JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
G 단백질 선택적 GPCR의 입체는 라이브 셀 서스펜션 형광 분석에서 FRET 센서를 사용하여 측정
요약
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
초록
Fӧrster 공명 에너지 전달 (FRET)을 연구 GPCR 시그널링 조사 점차 일반화되고있다 기반. 우리의 연구 그룹 Gα 서브 유닛과 아고 니스트 자극 다음 생균의 GPCR의 상호 작용을 검출하기위한 분자 내 FRET 센서를 개발했다. 여기서는 상세히 100 μM의 이소 염산염으로 처리시 β 2 아드레날린 수용체 및 Gαs C 말단 펩티드 사이의 FRET의 변화를 검출하기위한 프로토콜은 이전에 하나의 특징으로서. 우리의 FRET 센서는 전체 길이 GPCR하는 FRET 수용체 형광 (mCitrine)의 직렬로 구성된 하나의 폴리펩티드이며, 응급실 / K 경련 (체계적인 단백질 친 화성 강도 변조) 링커하는 FRET 기증자 형광 (mCerulean) 및 Gα C 말단 펩티드. 이 프로토콜 것이다 상세 세포 준비, 형질 전환 조건, 장비 설치, 분석 실행 및 데이터 분석. 이 실험 설계는 작은 채널을 검출FRET Anges의 단백질 - 단백질 상호 작용을 나타내는, 또한 리간드 GPCR-G 단백질 쌍들에 걸쳐 상호 작용의 세기를 비교하기 위해 사용될 수있다. 신호대 우리의 측정을 향상시키기 위해,이 프로토콜은 모든 단계에서 높아진 정확도를 요구하고, 재현성이 실행 가능하도록 여기에 제시된다.
서문
G 단백질 결합 수용체 (GPCR에)는 일곱 횡단 수용체이다. 인간 게놈 혼자 빛, 냄새 물질, 호르몬, 펩티드, 약물 및 다른 작은 분자를 포함하는 리간드의 다양한에 의해 활성화 된 GPCR, 코딩 약 800 유전자를 포함하고 있습니다. 시장 대상의 GPCR에 현재 모든 의약품의 약 30 %가 많은 질병 상태 2에서 큰 역할을하기 때문이다. 이 수용체 가족에서 수행 광범위한 작업의 수십 년에도 불구하고, 특히 GPCR 이펙터 상호 작용을 유도 분자 메커니즘에 관해서, 분야에서 상당한 뛰어난 질문이 남아있다. 지금까지 단 하나의 고해상도 결정 구조가 β 2 아드레날린 수용체 (β 2-AR)과 G 단백질 (3) 사이의 상호 작용에 대한 통찰력을 제공 간행되었다. 함께 지난 30 년의 광범위한 연구와 함께,이에 중요한 하나의 특정 구성 요소를 반복한다상호 다음 Gα 서브 유닛 C 말단. 이 구조는 GPCR 4 G 단백질 선택 5-6 모두에 의해 G 단백질의 활성화를 위해 중요하다. 따라서, Gα C 말단은 GPCR의 리간드 자극에 선택적 G 단백질의 활성화 사이의 중요한 링크를 제공합니다.
지난 10 년간 연구 된 GPCR은 GPCR의 입체의 하위 집합을 안정화 리간드가 결합하여, 광범위한 구조적인 풍경을 채우는 것이 좋습니다. 결정학, NMR 및 형광 분광법 및 질량 분석법을 포함한 여러 기술은 GPCR 구조적 프리를 조사 할 수 있지만, 이펙터 선택 7의 기능적 의미를 명료하게하기 위해 소수의 방법이있다. 여기서는 G 단백질의 입체 선택적 GPCR을 검출하기 Fӧrster 공명 에너지 전달 (FRET) - 기반 방식을 설명합니다. FRET는 방출 (기증자)이 겹치는 두 형광의 근접 평행 방향에 의존차 여기 (수용체) 스펙트럼 (8). 도너 및 억 셉터는 형광 단백질 구조적 변화 또는 단백질 - 단백질 상호 작용 중 하나의 결과로 서로 가까이 올 때, 그들 사이의 FRET은 증가하고, 방법 (8)의 범위를 이용하여 측정 할 수있다. FRET 기반의 바이오 센서는 GPCR 필드 9에서 널리 사용되어왔다. 이들은 세포 세번째 루프 GPCR C 말단에 도너와 억 셉터를 삽입하여 GPCR의 형태 변화를 조사하기 위해 사용되었다; 센서는 별도로 FRET 쌍 (10)과 GPCR 및 이펙터 (G 단백질 서브 유닛 / arrestins)를 라벨에 의해 GPCR 및 이펙터 상호 작용을 조사하기 위해 설계되었습니다; 일부 센서는 G 단백질 (11)의 구조적인 변화를 감지. 이 바이오 센서는 구조적인 GPCR의 변화와 이펙터, GPCR 이펙터 상호 작용 동력학 및 알로 스테 릭 리간드 (12)를 포함하여 뛰어난 질문의 군중을 요청하기 위해 필드를 사용할 수있다. 우리 그룹작용제 구동 조건에서 G 단백질 특정 GPCR의 입체를 검출 할 수있는 바이오 센서를 만드는 데 관심이 있었다. 이 바이오 센서 (체계적인 단백질 친 화성 강도 변조) (13) 경련라는 최근에 개발 된 기술을 사용합니다. 경련은 유효 농도를 제어하는 ER / K 링커를 사용하여 테 더링 작용하는 단백질 도메인을 포함한다. 형광의 FRET 쌍으로 링커 측면은 단백질 (12) 사이의 상호 작용의 상태를보고 할 수있는 도구를 만듭니다. 이전 1 경련 모듈은 GPCR에 Gα C 말단을 밧줄과 FRET의 형광 물질과의 상호 작용을 모니터링하는 데 사용되었다 mCitrine는 (은 일반적으로 알려진 변형, 노란색 형광 단백질 (YFP), 여기 / 발광 피크에 의해이 프로토콜에서 언급 , 여기 / 발광 피크 475분의 430 ㎚) (은 일반적으로 알려진 변형 시안 형광 단백질 (CFP에 의해이 프로토콜에서 언급) 525분의 490 ㎚) 및 mCerulean. N-에서 C- 말단에, t자신의 유전자 인코딩 된 하나의 폴리펩티드가 포함 전체 길이 GPCR은 수용체 (mCitrine / YFP)를 FRET, 10 나노 ER / K 링커, FRET 도너 (mCerulean / CFP) 및 Gα C 말단 펩티드. 본 연구에서는 센서는 GPCR-링커 길이 Gα 펩타이드로 축약된다. 모든 구성 요소는 각 도메인의 자유 회전을 가능하게하는 구조화 (의 Gly-빼앗아-의 Gly) 4 링커에 의해 분리된다. 이러한 센서의 상세한 특성화는 이전 두 개의 원형의 GPCR을 사용하여 수행 하였다 : 2-AR과 옵신 한 β.
이 센서는 일시적 HEK-293T 세포 존재 또는 리간드의 부재하에 초 (CPS) 당 카운트 임의 단위 FRET 쌍의 형광 계 생균 실험 측정 형광 스펙트럼으로 형질 감염된다. 이러한 측정은 형광 (YFP 최대 / CFP 최대) 사이의 FRET의 비율을 계산하는 데 사용된다. FRET (ΔFRET)의 변화 후 평균 FRET 비율을 감산하여 계산된다리간드 처리 된 샘플의 FRET 비율에서의 치료 샘플. ΔFRET는 (β 2-AR-10 nm의 Gαs 펩티드 2-AR-10 nm의 노 펩타이드를 β없는 대) 구조를 통해 비교할 수 있습니다. 여기서는 상세히 프로토콜은, 실시간 HEK-293T 세포에서 이들 센서를 표현 발현을 모니터링하고, 형광 기반 생균의 설정, 실행 및 분석은 약물 처리 된 조건 대 미처리의 측정을 안달. 이 프로토콜은 100 μM 이소 타르트 레이트로 처리 된 β-AR이 10 nm의 Gαs 펩티드 센서 특정이지만, 서로 다른 GPCR-Gα 쌍과 리간드에 대해 최적화 될 수있다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. DNA 준비
- 디자인 센서 모듈 클로닝 기법을 사용하여 구성한다. 이전 1 설명 된 β 2-AR 센서 설계를 참조하시기 바랍니다.
- 1.9, 260 / 2.0의 (230) - - 2.29, 260 / 1.7의 280 상업 미니 프렙 키트 프로토콜에 따라 DNA를 준비하고 농도 ≥에서, 2 mM 트리스 - 염산 용액의 pH 8에 750 NG / μl를 용출.
2. 세포 배양 준비
- 보충 된 4.5 g / L D- 글루코스를 함유하는 DMEM에서 배양 HEK-293T-FLP-N 세포를 10 % FBS (열 불 활성화) (V / V), 1 % L- 글루타민 보충하는 20 mM HEPES, pH가 7.5 37에서 5 % CO 2에서 가습 분위기에서 C를 °. 다음 단계에 대한 생물학적 안전 후드 세포를 처리합니다.
- 세포가 여섯 잘 요리에 계대 전에 합류 단층로 성장할 수 있습니다. 컨 플루을 달성하기 위해 시간은 초기 도금 밀도에 따라 달라집니다. 사용 플레이트 그(1) 내의 포화 상태에 올 -에 대한 도금 2 일 여섯 잘 도금. 합류 10cm 조직 배양 처리 된 접시는 약 4 × 106 세포 / ml의 세포 밀도를 갖는다. 세포 배양 성장의 이미지 그림 1을 참조하십시오.
- 10 ml의 PBS로 세포를 씻으, 0.25 %의 트립신를 Trypsinize (토론, 제 2 항 참조). 판 (8) × 10 5 세포 / 잘 조직에서 미디어 2 ㎖에 여섯 잘 요리 문화 처리 및 16을 준수 할 수 있도록 - 20 시간.
3. 형질 조건
- (- 36 시간 20 사이) 최적의 표현을 달성하기 위해 시간의 다른 금액을 요구할 수있다 구조에 대한 형질을 비틀. 통합 실험 시간에 대한 조건을 동기화합니다. 또한, 형질 감염되지 않은 대조구의 등가 셀 밀도 분석 중에 소음 및 산란 감산을 위해 사용되어야한다.
- 실온으로 형질 전환 시약을 가지고 : 감소 된 혈청 배지, DNA, 트랜 스펙 션 시약.
- 안에생물학적 안전 후드가 다음의 순서로 무균 마이크로 원심 튜브에 결합 시약을 100 μL의 혈청 감소 배지 2 μg의 DNA를 혼합한다. 혼합물의 표면 또는 튜브의 측면을 건드리지 않고 미디어 / DNA 믹스로 형질 전환 시약의 6 μl를 스파이크. 물론 당 하나의 형질 전환 반응을 설정합니다. 일관된 발현 수준을 달성하기 위해 (형질 감염 시약 6 μL - - 3, 4 μg의 DNA의 1) 형질 전환 조건은 최적화 될 수있다. 더 최적화 된 비율은 표 1을 참조하십시오.
- 30 분 - 15 생물학적 안전 후드에 실온에서 혼합물을 품어. 30 분 동안 배양 떠나는 경우에 반응을 사용하지 마십시오.
- 에 걸쳐 잘 드롭 현명한 방식으로 세포 반응을 추가하고 부드럽게 철저한 혼합을 보장하기 위해 여섯 잘 흔들어. 물론 당 하나의 반응을 추가합니다.
- 식 20 시간 후, 모니터 형광 조직 배양 형광 현미경을 사용. 40X에서 셀의 10 배 목표와 단백질 현지화와 인구 식을 평가합니다. OBS원형질막 (PM)에서의 단백질 발현에 정말 짜증나. 실질적인 내재화가 언급되는 경우 현저한 발현이 PM에 검출 될 때까지, 형질 감염을 모니터링한다.
4. 시약 및 장비 준비
- -80 ° C에서 100 mM의 약물 주식과 상점을 준비 : 이소 중주 석산 (100 밀리미터 300 밀리미터의 아스코르브 산을 포함 DH 2 O에서). 즉시 차가운 룸, 플래시 동결 / 얼음합니다. 분액했다 1 년까지 사용할 수있다.
- 셀 버퍼를 준비합니다 (~ 2 ㎖ / 조건) 37 ° C의 물을 욕조에 저장. 매일 신선한합니다. 셀 버퍼 구성 요소에 대한 참조 표 2.
- 약물 완충액 (10 ㎖)을 제조하고 실온에서 보관. 의약품 버퍼 구성 요소에 대한 참조 표 2.
- 산성은 진한 염산을 사용하여 큐벳을 씻는다. 약한베이스 (1 M KOH)으로 중화하고, 철저하게 DH 2 O와 큐벳을 세척
- 여러 가지로 형광 주위에 워크 스테이션을 준비합니다10, 200, 1,000 μL 피펫 팁, 초순수 H 2 O와 함께 10 분 카운트 다운, 큐벳 청소를위한 팁, 섬세한 작업 와이프와 접근 진공 라인 및 분출 병 설정 타이머의 상자
- 형광 및 열 블록에 37 ° C 외부 수조를 가열한다.
- 형광 분석기를 켜십시오; 430 nm의 대역 통과 8 나노 미터의 여기에 CFP 수집을 위해 형광 수집 프로그램을 설정; 방출 범위 450 nm의 - 600 nm의 대역 통과 4 nm의. 600 nm의 대역 통과 4 nm의 - 전용 센서 제어 등 YFP 수집을 위해 490 nm의 대역 통과 8 nm의, 방출 범위 500 세트 여기 (토론 참조). CFP 컬렉션 설정이 실험에서 FRET 스펙트럼을 얻기 위해 사용될 것이다.
- 아래의 그림 2와 같이 열 블록에 열두 1.5 ml의의 microcentrifuge 튜브를 놓습니다. 이 튜브는 셀 나누어지는 튜브를위한 홀더이다 (500 μL의 마이크로 원심 튜브.) 여기에 배치 큐벳을 완화하기 위해 홀더 1과 7에서 조직의 작은 조각을 놓습니다.
참고 : 처리되지 않은 상태 및 교차 오염을 방지하기 위해 약물 조건에 대해 별도의 큐벳을 사용합니다.

그림 2. microcentrifuge 관은 설정 및 치료 샘플에 대한 열 블록 큐벳에 위치 참조 위치 1에 있습니다.; 셀 나누어지는 튜브 2 위치에 있습니다 - 약물 치료 샘플 6. 큐벳 위치 7에; 셀 나누어지는 튜브 위치에있는 8 - 12 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 미니 37 ° C의 물을 욕조를 만드는 물 ~ 750 ㎕를 12 - 6, 8 - 홀더 2를 입력합니다.
- 미니 수조 (- 6, 8-12 홀더 2)에 세포 씩위한 열 500 μL의 microcentrifuge 튜브를 놓습니다. 각 튜브 (untreate 5 조건의 개별 반복 될 것입니다D, 처리 (5) 약물).
- 표현 세포 모니터 (단계 3.6 참조).
5. 실험 및 데이터 수집
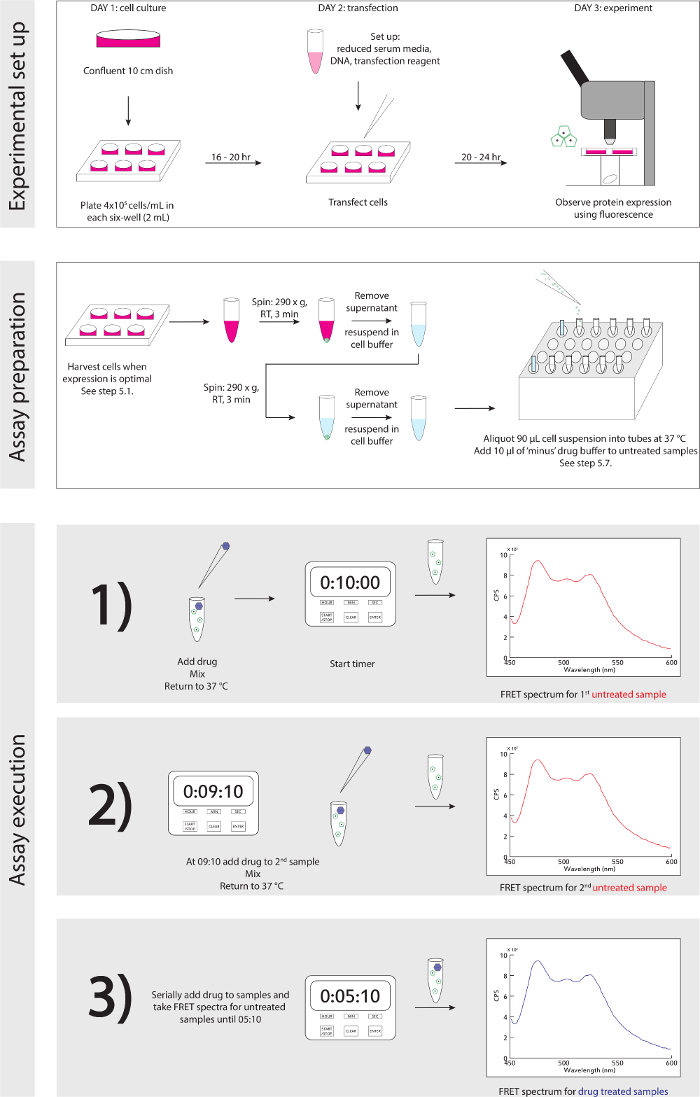
그림 3. 실험 회로도. 실험에 대한 상세한 단계별 가이드는 최대 및 실행 설정합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 실험 회로도에 대한 참조 그림 3. 세포가 형광 현미경으로 감지 단백질 발현에 따라, 수확 될 준비가되면 (토론, 제 4 항 참조) 생물 안전 후드, 부드럽게 P1,000과 그들의 문화에 ~ 1 미디어 ml의에 resuspend 세포를 제거하고 재 부유를 전송 1.5 ml의 microcentrifuge 관에.
참고 :이 N 말단을 소화하고있다으로 트립신을 사용하지 마십시오 /또는 GPCR 센서의 주머니를 결합. - 재 부유에 적절한 세포 밀도를 보장하기 위해 세포를 계산합니다. 4 × 106 세포 / mL로 재현 탁 대 음량을 최적화한다.
- 3 분 동안 실온에서 290 × g으로 스윙 버킷 원심 분리기에서 세포를 스핀. 원심 분리 후 상층 액을 제거합니다.
- 부드럽게 (37 ° C에서 보관) 1 ml의 세포 버퍼에 세포를 재현 탁 단계 5.3를 반복합니다. 두 번째 스핀 동안, -80 ° C에서 100 mM의 약물 재고 나누어지는를 수집합니다. 1 mM의 작업 주식에 대한 약물 버퍼 100 희석하고, 실온에서 보관 : 1을 확인합니다.
- 두 번째, 원심 분리 후에, 세포 완충액 (4 × 106 세포 / ㎖) 1 ㎖에 재현 탁 상등액 부드럽게 세포를 제거한다. 세포를 1 ml의 빈 셀로서 완충액 1 ㎖를 사용하여 분광 광도계의 측정 시료 OD 600. 일회용 플라스틱 큐벳에 세포를 분배하고 즉시 분광 광도법 따르는 microcentrifuge 관에 다시 전송합니다.
- 제어 형질 감염되지 않은 CEL의 경우리터 조건 스펙트럼, 부드럽게, P1,000 피펫 1 ML의 세포 버퍼에 형질 감염되지 않은 세포를 재현 탁 큐벳과 여기 430 nm에서 FRET 스펙트럼을 취득하는 세포의 90 μl를 추가, 대역 통과 8 nm의, 방출 450-600 nm의 대역 통과 4 nm의. 세포의 신선한 90 μl의 5 반복 스펙트럼 - 3를 수집합니다. 샘플 사이의 초순수 H 2 O와 큐벳을 사양 사이에 37 ° C에서 세포의 재고를 유지하는 각각의 샘플 나누어지는 사이에 P1,000 부드럽게 재현 탁하고, 린스.
- 6 - 8 - 열 블록 (12)에 실험 조건, 90 분취 홀더 (2)의 500 ㎕를 각 튜브로 형질 감염된 세포의 용 μL. 조심스럽게 각 나누어지는 사이 P1,000 피펫으로 세포의 주식을 재현 탁.
- 처리되지 않은 상태 샘플 6 - 세포를 분주 한 후, 2 튜브 의약품 버퍼의 10 μl를 추가합니다.
- 튜브 (8)에 1 mM의 약물 용액 10 μl를 추가하여 실험을 시작, 10 분에서 카운트 다운, 부드럽게 P200의 피펫과 튜브를 혼합하는 타이머를 시작합니다. 닫기 튜브 (37)에 반환C 열 블록 °.
- 즉시, (새로운 팁을 사용) P200으로 부드럽게 혼합 관 (2)을 받아 처리되지 않은 상태 큐벳에 세포 현탁액의 90 μl를 추가하고, 형광의 장소.
- 600 nm의 대역 통과 4 nm의 - 여기 430 nm의 대역 통과 8 nm의, 방출 (450)에서 FRET 스펙트럼을 획득.
- 9 분에서 - 10 초, 부드럽게, 1 mM의 약물 용액 10 μL와 튜브 (9) 스파이크 P200 (새 팁을 사용)과 혼합하고, 블록을 가열 튜브를 반환합니다.
- 튜브 (10)와 관 (3)과 5.12와 5.11 - 반복 5.10 단계를 반복합니다.
- 스펙트럼은 모든 처리되지 않은 상태의 샘플을 수집하고, 약물이 모든 약물 조건 샘플에 추가 될 때까지 1 분 간격 (8시 10분, 7시 10분 등)에서 5.13 - 반복 5.10 단계를 반복합니다. 교차 오염을 방지하기 위해 각 피펫의 단계에 대한 신선한 팁을 사용합니다.
- 5 분에서 - 10 초, 부드럽게 P200의 피펫과 튜브 8 (약 조건을) 혼합 시작 형광 분석기 약물 치료 샘플과 장소에 대해 별도의 큐벳에 세포 현탁액의 90 μl를 추가합니다.
- F 획득RET 스펙트럼 (설정에 대한 단계 5.11 참조).
- 나머지 약물 조건 샘플 (- 12 튜브 9) 1 분 간격 (4시 10분, 3시 10분 등)에서 5.16 - 반복 5.15 단계를 반복합니다.
- 실험 종료 후, 철저하게 초순수 H 2 O와 큐벳을 세척, 프로젝트 파일을 저장하고 다음 조건 튜브 주식 재. 세척 단계에서 교차 오염을 방지하기 위해주의하십시오. 가 H 2 O 병뿐만 아니라 세척 사이의 진공 라인에 팁을 변경합니다.
6. 데이터 분석
- 저장하고 SPC 수출 데이터 파일은 분석에 사용되는 포맷합니다. 분석 프로그램은 Sivaramakrishnan 연구소 간행물 웹 사이트에서 다운로드 할 수 있습니다.
- 분석 프로그램 (V9, V15), 형질 감염되지 않은 샘플 파일 (형질 감염되지 않은 세포 스펙트럼 수집 단계 5.6 참조) 데이터 입력, 출력 데이터 파일 및 쉼표로 구분 된 값 (CSV) 파일을 포함하는 분석 소프트웨어에 대한 경로 파일을 만듭니다.
- 다음 정보를 입력CSV 파일에 포함하여 각 샘플에 대한 사용 조건 (표 3의 샘플을 참조) 지정 :
파일 이름 - 개별 SPC 그래프 파일
수용체 -하는 GPCR 구조 지명자는 시험 하였다 (예를 들어, Β2)
바인더 - 지정되는 구조의 펩타이드 변형 시험 하였다 (예를 들면, S)
작용제 - (N)을 치료 지정 또는 약물 치료 (D) 조건
디렉토리 - SPC 파일은 일반적으로 저장 날짜별로 정리되는 경로 폴더
OD - 분광 광도계에서 시료의 기록 광학 밀도 - 샘플에서 버퍼와 산란 소음을 뺄 형질 감염되지 않은 샘플 (단계 5.6)에 대한 파일 이름을 입력합니다.
- 분석 프로그램에 조건을 입력합니다.
- 실행 프로그램은 개별 조건 (V9) 내에서 조건 (V15)에서 샘플을 분석합니다.
- 데이터 세트의 명백한 아웃 라이어있는 샘플 파일을 제외하거나 증가 또는 INDIVI의 OD 값을 감소시킴으로써 공제 조정이중 파일입니다.
- 액세스를위한 계산 된 출력 파일로 내보내기 데이터 비율 (525 나노 미터 / 475 nm의) FRET.
- 치료 (약물) 조건에 대한 개별 FRET 비율에서 처리되지 않은 상태의 평균 FRET 비율을 뺀 ΔFRET을 계산합니다.
Access restricted. Please log in or start a trial to view this content.
결과
실험의 일반화 된 도식 설정 및 실행은 그림 3에 자세히 설명되어 있습니다.
센서의 좁은 다이나믹 레인지의 FRET의 변화를 검출하기 위해, 부착되는 시스템의 뉘앙스에 부착하는 것이 중요하다. 셀 품질이 샘플링에서 단백질 발현뿐만 아니라 일관성에 필수적입니다. 최적 일관성 단층 (10X)에서 성장 배양 된 세포의 1 기능의 이미지를 그림
Access restricted. Please log in or start a trial to view this content.
토론
이 시스템 FRET 측정 타이트 동적 범위는이 프로토콜의 모든 단계에서 중요한 품질 관리의 필요성을 강화한다. 성공적인 FRET 실험을 보장하기 위해 가장 중요한 단계는 분석을 실행하는 동안 1) 세포 배양, 2) 형질 3) 단백 발현 및 4) 적시 정밀한 조정한다.
셀 건강 관리 / 도금 품질이 불가능 FRET 어떤 일관된 변화를 검출 할 수있는 실험 시스템 불량 셀 건강의 신호 - 대 - 잡음에...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 더 경쟁 관심이 없음을 선언합니다.
감사의 말
RUM은 미국 심장 협회 (American Heart Association) 전 박사 원정대 (14PRE18560010)에 의해 투자되었다. 연구는 미국 심장 협회 (American Heart Association) 과학자 개발 그랜트 (13SDG14270009) SS에 NIH (1DP2 CA186752-01 및 1-R01-GM-105646-01-A1)에 의해 투자되었다
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
참고문헌
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유