JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간의 전체 혈액 자연 살해 세포 용 균성 활동의 유세포 분석
요약
This work describes an advanced workflow for the accurate and fast determination of NK (Natural Killer) cell count and NK cell cytotoxicity in human blood samples.
초록
NK 세포는 NK 세포 독성 세포 기능에 대한 외부 간섭의 영향을 결정하기 위해 널리 사용되는 척도이다. 그러나,이 분석의 정확성 및 재현성 때문에 사용자의 오류로 인해 또는 실험 조작에 NK 세포의 감도 역시 불안정한 것으로 간주 될 수있다. 이러한 문제를 제거하기 위해 최소로 줄여 워크 플로우에 설립되었으며 여기에 표시됩니다. 우리는 선수에서, 다양한 시점에서 혈액 샘플을 얻어 설명하기 위해 (N = 4) 운동의 강렬한 한판 승부에 제출 된 그. 첫째, NK 세포를 동시에 확인하고 직접 전체 혈액에서와 같은 작은 하나 밀리리터에서, CD56 태그 및 자기 기반의 정렬을 통해입니다. 정렬 된 NK 세포는 시약 또는 상한 항체의 제거됩니다. 이들은 혈액 밀리리터 정확한 NK 세포 수를 설정하기 위해 계산 될 수있다. 둘째, 분류 NK 세포 (이펙터 세포 또는 E)를 3,3'- Diotade와 혼합 될 수있다각 이벤트의 시각화 및 위양성의 제거를 허용하는 촬상 유동 세포 계측기를 사용하여 E 비율 분석 : 5 T : cyloxacarbocyanine 과염소산 (DIO)은 분석 최적 1의 K562 세포 (표적 세포 또는 T)를 태그 또는 (예 : 이중선 또는 이펙터 세포와 같은) 위음성. 이 워크 플로는 약 4 시간에 완료, 심지어 인간의 샘플 작업을 매우 안정적인 결과를 허용 할 수 있습니다. 가능한 경우, 연구 팀은 인체에서 여러 가지 실험적인 개입을 테스트, 데이터의 무결성을 손상시키지 않고 여러 시점에 걸쳐 측정을 비교할 수 있습니다.
서문
자연 살해 세포는 선천성 면역계의 필수 요소이다. 그들은 매우 조절 동안, 인식하고 세포 간 접촉을 통해 사전 활성화 일없이 비정상 세포를 제거하는 기능을 갖는다. 따라서, 그들은 감염에 대한 방어의 빠른 라인을 형성한다. 특히 심한 운동은, 일시적으로 면역 시스템 2, 3, 4, 5를 누르는 것으로 나타났다. NK 세포가 효과적으로 질병 향상된 감도의 창을 생성이 효과 4, 6, 7, 특히 쉽다. 따라서, 개입의 연구는 전, 중 또는 NK 세포 기능에 미치는 영향을 줄이는 목적으로 강렬한 운동 후하는 운동 선수 후 대회의 복지에 대한 특별한 관심입니다.
그러나, 이러한 개입의 연구는 다양한 요인에 의해 복잡하게된다 : NK 세포는 백혈구 실의 약 1 %에서 8 드물다 1); 2) NK 세포 스트레스에 매우 민감하고 실험 기간 동안 생존하고 안정적으로 유지하는 생리 학적 조건에 노출에 의존하는 상수; 3) 표준 분석은 피콜 구배 9로, NK 세포의 세포 독성을 확인하고 분석 (10)를 해제, 신뢰할 수와 일치하지 않습니다. 인간 샘플의 고유 한 변화는 이들 이슈 인 화합물. 중재 동안에 수집 된 신선한 인간 샘플 적어도 동물 샘플 또는 불멸화 세포주에 비해, 수배 상당히 규제하고 어렵다. 이 실험을 반복하거나 통계적으로 유의 임계 값에 도달하기 위해 연구 코호트에 참가자를 추가 할 수있는 기회를 감소시킨다. 종합적으로, 이러한 문제는 fo를 간소화 할 수있는 프로토콜의 필요성을 지원R 모두 높은 처리량과 인간 시료에서 NK 세포 용균 활성의 높은 신뢰도 분석.
우리는 식별 외부 인자에 대한 노출을 최소화하면서 인간의 전혈로부터 분리하고 시험 NK 세포에 필요한 시간을 단축 워크 플로우를 구축. 감소 또는 NK 세포의 세포 독성의 증가를 검출 할 수 있도록 E 비율 : 상기 방법은 두 기기, 자기 기반의 셀 소터와 사이토 촬상 흐름 및 분석 특정 최적화 T의 사용을 최적화한다.
프로토콜
참고 : 모든 혈액 수집 절차는 애팔 래 치아 주립 대학 (ASU) 임상 시험 심사위원회 (IRB)에 의해 규정 된 지침에 따라 실시 하였다.
1. 전체 혈액 컬렉션
- 공인 phlebotomist는 세계 보건기구 (WHO)의 가이드 라인에 따라 혈액을 채취 있습니다.
- 디 에틸렌 디아민 산 칼륨을 함유 한 4 mL의 혈관 (K 2 EDTA)으로 혈액을 채취. 제조업체의 지시에 따라 혈관을 전환. 분리 될 때까지 벤치 탑 로커에 실온에서 혈관을 유지합니다.
DIO 표지 된 표적 세포의 제조 2
- K562 세포의 성장 완료 Iscove 개변 둘 베코 미디어 세포의 상태를 확인하기 위해 검정에 앞서 몇 주 동안 10 % 소 태아 혈청 (FBS) 및 1 % 페니실린 스트렙토 마이신이 보충 된 (IMDM). 정광을 조정3 × 105 세포로 세포의 이온 / ㎖ 매일 세포의 완료를 통해 카운트 세포 후속 통로. 매 2 ~ 3 일 전체 미디어의 변화를 수행합니다.
- 혈구 1 : 분석 당일 1을 이용하여 세포 수를 수행한다.
- K562 플라스크에서 10 μL를 제거하고 1.5 mL의 튜브에 배치합니다.
- (1)의 희석 요인에 대해 동일한 1.5 ML 튜브에 트리 판 블루 염료의 10 μL를 추가 : 1.
- 부드럽게 영화 튜브는 K562 세포를 혼합 파란색 염료를 트리 판입니다.
- K562 세포 트리 판 블루 염색은 실온에서 1 분 동안 품어하도록 허용합니다.
- 튜브에서 스테인드 K562 세포의 15 μL를 제거합니다.
- 세포 수에 대한 혈구 상에 피펫.
- 네 모서리의 사각형 셀뿐만 아니라 다섯 제곱의 총 중앙 광장을 계산합니다.
- 식을 이용하여 세포 수를 계산한다 :
총 세포 / ㎖ = 총 세포 계수 X (희석 계수 / 사각형의 수) X 10,000 / mL의
- 무 혈청 IMDM 배지에서 1 × 106 세포 / ml의 최종 농도로 재현 탁 K562 표적 세포.
- K562 염색 된 표적 세포를 들어, 10 × 106 K562 세포의 총 1 × 106 세포 / ㎖의 밀도로 한 15 ㎖의 튜브에 K562 표적 세포의 10 mL를 첨가. 사용할 준비가 될 때까지 5 % CO 2와 37 ° C를 인큐베이터에 놓습니다.
- K562 한 15 ㎖의 튜브에 세포를 표적 K562 DIO 염색 된 표적 세포의 경우, 10 × 106 K562 세포의 총 1 × 106 세포 / ㎖의 밀도로 10 mL를 첨가.
- DIO 염색 부드럽게 소용돌이에 지정된 15 ML 튜브에 세포 현탁액 1 ㎖ 당 1 μL DIO의 셀 라벨 솔루션을 추가합니다. 예를 들어, 1 × 106 세포 / ㎖를 10 × 106 K562 세포 / ml로 DIO 셀 라벨 용액 10 μL를 추가한다.
- 15 ML 튜브에서 5 % CO 2와 37 ° C에서 20 분 동안 품어 K562-DIO 솔루션입니다.
- 따르다배양을 보내고, 15ml의 튜브를 포함하는 K562-DIO 용액에 실온 인산 완충 용액 (PBS) 3 ㎖를 추가한다.
- 실온에서 135 XG에서 10 분 동안 원심 분리기.
- 조심스럽게 1,000 μL 볼륨 조절 피펫 세포 펠렛을 방해하지 않고 뜨는을 제거합니다.
- 세포 펠렛을 함유 15 ML의 튜브에 신선한 IMDM의 10 ML을 추가합니다.
- 부드럽게 와동 튜브 세포를 재현 탁한다.
- 반복 2.7 2.10에 두 번 더 반복합니다.
- 사용할 준비가 될 때까지 5 % CO 2와 37 ° C를 인큐베이터에 보관 세포.
주 : 세포를 최대 24 시간 동안 인큐베이터에 저장 될 수 있지만, 동일한 날에 이들을 사용하는 것이 바람직하다.
컨트롤 3. 준비
- 별도의 적절하게 표시 1.5 ml의 튜브에 다음 이동 :
- 신선한 IMDM 500 μL 1.5 mL의 관 표시된 "더블 긍정적"으로 K562 세포를 DIO 표지 재현 탁 함유 추가.
- 신선한 IMDM의 500 μL를 추가하면 "만 DIO"로 DIO 표지 K562 세포를 재현 탁 함유하는 1.5 ㎖의 튜브를 표시.
- 에 재현 탁 레이블이없는 K562 세포를 포함하는 신선한 IMDM의 500 μL를 추가 "프로피 디움 요오드 (PI)는 전용"1.5 mL의 튜브를 표시.
- 5 분 동안 55 ℃로 물을 욕조에 두 번 양성과 PI 전용 튜브를 놓습니다.
- 5 분 경과 후, 튜브를 제거하고 70 % 에탄올로 닦아.
- 더블 긍정적으로 PI와 PI 1.5 mL의 튜브 (10) L을 추가합니다.
- 30 분 동안 37 ° C의 배양기에서 세 K562 타겟 셀 제어 놓는다.
- 30 분 인큐베이션은 163 x g에서 2 분간 원심 분리 세 K562 타겟 셀 제어 지나면.
- 조심스럽게 세포 펠렛을 방해하지 않고 뜨는을 제거합니다.
- 신선한 IMDM 세포 배양액 20 μL 각 제어를 재현 탁하고, 적어도 5 % 이산화탄소로 37 ° C의 배양기에서 떠나최적의 DIO 신호에 대한 30 분.
참고 : 컨트롤 지금 사이토 이미징 흐름을 통해 실행 준비가 된 것입니다.
4. NK 세포 자동 분리
- 전지 세퍼레이터를 켜고 시동 사이클을 완료 할 수 있습니다.
- 모든 유체 병 조명이 녹색과 폐기물 병이 비어 있는지 확인합니다.
- 실내 온도 15 ML의 튜브 랙을 얻습니다.
참고 : 선택 샘플 볼륨에 근거한다. 예를 들어, 볼륨 미만 3 ㎖를 15 ㎖의 튜브 랙을 사용하여 볼륨 이상 3 ㎖를 50 ㎖의 튜브 랙을 사용한다. - 라벨 샘플 튜브를 따라 (샘플 / 참가자마다 반복) : 참가자 1 항목의 혈액 샘플; 참가자 1 음의 부분; 참가자 1 긍정적 인 부분.
- 조심스럽게 "전체 혈액 샘플"15 ㎖의 튜브에 단계 1.2에서 전체 혈액의 1.5 mL를 피펫.
- 단계 4.5에서 적절하게 레이블이 15 mL의 "전체 혈액 샘플"튜브를 삽입하고 15 mL의 "음의 분수"를 표시하고튜브 랙의 단계 4.4에서 "긍정적 인 분수"튜브. 행 (R1) A : : thefollowing 샘플 랙 설정을 사용하여 전체 혈액 샘플, 행 (R2) B : 음, 레이블이없는 부분, 행 (R4) C : 긍정적, 자기 표시된 부분을.
- autolabeling의 MiniSampler 상 분리 랙을 삽입합니다.
- 메뉴에서 "시약"를 선택하고 유리 병은 분리 랙에 위치 할 곳을 강조 표시합니다.
- 2 차원 코드 리더를 활성화하기 위해 "시약 읽기"를 선택합니다.
- 코드 판독기 덮개 0.5-2.5 cm 사이의 2D 코드 리더 앞의 적절한 시약 병을 놓습니다.
참고 : 예를 들면, NK 세포의 분리를 위해 필요한 시약 CD56이다. - 최적의 판독 용 2D 코드 리더 앞의 각도 시약 병을 잡으십시오.
- 적절한 분리 랙 위치로 시약 병을 놓습니다.
- 화면의 분리 탭에서 원하는 위치를 선택합니다.
- 라벨 하위 메뉴에서 노소를 할당tolabeling 프로그램입니다.
- 위치 1, 2, 3 및 4를 랙에 세포 분리 시약 CD56 마이크로 비드를 할당한다.
- 은 "posselwb"분리 프로그램을 선택합니다.
- 은 "린스"세척 프로그램을 선택합니다.
- 숫자 키패드를 사용하여 "볼륨"하위 메뉴에 1,500 μL의 샘플 볼륨을 삽입합니다.
- 키패드의 "입력"옵션을 선택합니다.
- 세포 분리를 시작합니다 "실행"을 선택합니다.
- 충분한 버퍼의 모든 샘플을 처리 할 수 있습니다 확인 "OK"를 선택합니다.
(5) NK 세포 수에 따라 세포 분리
- 즉시 세포 분리와 세포 분리에 따라 긍정적 인 부분을 검색 할 수 있습니다. 상온에서 둡니다. 이 부분은 원하는 순수 NK 세포 인구를 포함한다.
- 각 샘플의 경우, 단계 2.2에 따라 혈구를 사용하여 세포 수를 수행합니다.
- 계산 한 후, 세포 수를 기록한다.
6. 세포 독성 분석 샘플 준비
- 준비하고 그에 따라 각 샘플 / 참여자 1.5 mL의 튜브 레이블을 붙입니다.
- 피펫 각 튜브에 NK 세포와 DIO-labled K562 세포의 비율을 원하는.
참고 : 예를 들어, 표적 K562 세포 및 NK 효과기 세포의 바람직한 비율은 1 : 5이다. - 135 X g에서 5 분 동안 원심 분리기.
- 조심스럽게 세포 펠렛을 방해하지 않고 뜨는을 제거합니다.
- 재현 탁 NK-DIO는 인터루킨 -2 (IL-2) 및 2- 메르 캅토 에탄올 (2-ME) (불완전 NK 세포 배양 배지)없이 NK 세포 배지 500 μL의 K562 세포 혼합물 표지.
주 : 불완전 NK 세포 배양 배지가 L- 글루타민, 및 리보 데 옥시 리보 뉴 클레오 시드없이 중탄산 나트륨 필수적인 미디엄 이글 최소이다. - 각 튜브에 PI의 5 μL를 추가합니다.
- 163 x g에서 2 분간 원심 분리한다.
- 2 시간 동안 37 ℃에서 세포를 인큐베이션.
- 2 시간 배양 한 이후, centrifu163 x g에서 2 분간 GE.
- 조심스럽게 세포 펠렛을 방해하지 않고 뜨는을 제거합니다.
- 25 μL 불완전 NK 세포 배양 미디어를 Resuspend 세포.
자발적 7. 준비 ( "S") 샘플
- DIO 표지 K562 세포 피펫 500 μL 1.5 ㎖의 튜브에 (1 × 106 세포 / ㎖ 농도).
- 각 튜브에 PI의 10 μL를 추가합니다.
- 163 x g에서 2 분간 원심 분리 튜브.
- 2 시간 동안 37 ℃에서 세포를 인큐베이션.
- 2 시간 배양, 163 x g에서 2 분간 원심 분리를 다음과 같다.
- 조심스럽게 세포 펠렛을 방해하지 않고 뜨는을 제거합니다.
- 25 ㎕의 불완전 알파 - 최소 필수 매체 (α-MEM) 세포 배양 배지에 재현 탁 세포.
이미징 플로우 사이토 8. 데이터 수집
- 기기를 켭니다 사이토 흐름 이미징의 전면 도어 내부의 녹색 버튼을 누릅니다.
- 알 켭니다이미징과 관련된 리터 컴퓨터는 사이토의 흐름.
- 소프트웨어 사이토 이미징 흐름을 시작합니다.
- 시스템을 세척 및 샘플 라인을 준비하기 위해 "시작"버튼을 클릭합니다.
- "시작"이 완료되면, "교정"창을 닫습니다.
- 채널 할당 : 왼쪽 상단에이를 할당하기 위해서 각각의 채널을 클릭.
- Area_M06 대 원시 최대 픽셀 _MC_6, Area_M02 대 원시 최대 픽셀 _MC_2, AspectRatio_M01 대 Area_M05 및 FieldArea_M01 대 원시 최대 픽셀 _MC_5 : 오른쪽에서 4 산점도를 만들 수 산포도 버튼을 클릭합니다.
- 먼저 "더블 긍정적"컨트롤을 사용하여 샘플을 분석하기 시작합니다.
- 를 클릭 "로드."
- 샘플 로더에 3.9 단계 3.4에서 "두 번 긍정적"샘플 1.5 ML 튜브를 놓습니다.
- 은 "확대"탭에서 40X 목표를 선택합니다.
- 405 mW의 전원을 켜고642 mW의 레이저.
- 은 "브라이트"채널을 켭니다.
- 를 클릭 "을 선택 강도."
- 검출기가 과부하되지 않도록 "이중 양성"대조 샘플에 기초하여, 405 mW의 레이저의 원하는 강도를 결정한다.
참고 : 예를 들어, 본 실험을위한 최적의 강도가 11 mW에 설정되었다.
- 원하는 설정이 달성 된 후, 데이터를 수집.
- 은 "취득 파일"탭에서 사용자 지정 파일 이름 텍스트를 입력합니다. 데이터 파일을 저장할 폴더를 선택합니다.
- "수집"옆에 취득하는 세포의 수를 입력합니다. 일반적으로이 수는 1 만 1,000 사이 다릅니다.
- 를 클릭 "획득."
주의 : 원하는 셀 번호를 취득하면, 상기 데이터 파일은 자동으로 이전에 선택된 폴더에 저장된다.
- 인수가 완료되면, 다음 제어 샘플을로드 - DIO 만 제어합니다.
- 를 클릭 "로드."
- 샘플 로더에 "DIO 전용"샘플 1.5 ㎖의 튜브를 놓습니다.
- 선택한 "확대"탭에서 40X 목표를 둡니다.
- 405 mW의 레이저가 켜져 둡니다.
- 642 mW의 레이저와 "브라이트"채널을 끕니다.
주 : 이제 원하는 설정이 달성되었는지, 데이터를 취득 할 수있다. - 은 "취득 파일"탭에서 사용자 지정 파일 이름 텍스트 입력 및 데이터 파일을 저장할 폴더를 선택합니다. 옆에 취득하는 세포의 수를 입력합니다 "수집합니다.". 일반적으로이 번호는 1000입니다.
- 를 클릭 "획득."
주의 : 원하는 셀 번호를 취득하면, 데이터 파일은 자동으로 이전에 선택된 폴더에 저장된다.
- 은 "PI 전용"제어 샘플 단계를 반복 8.10. 실험 샘플은 현재 수집 할 준비가 된 것입니다.
- remaini를 처리은 "자발적인 'S'샘플 '다음을 포함하여, 실험 샘플을 NG :
- 선택한 "확대"탭에서 40X 목표를 둡니다.
- 405 mW의 642 mW의 레이저를 켭니다.
- 은 "브라이트"채널을 켭니다.
- 를 클릭 "설정 강도."
- 은 "취득 파일"탭에서 사용자 지정 파일 이름 텍스트 입력 및 데이터 파일을 저장할 폴더를 선택합니다. 사용자 정의 파일 이름 텍스트를 입력합니다.
- 옆에 취득하는 세포의 수를 입력합니다 "수집합니다."
- 은 "획득"버튼을 클릭합니다.
주의 : 원하는 셀 번호를 취득하면, 데이터 파일은 자동으로 이전에 선택된 폴더에 저장된다.
- 모든 실험 샘플 단계를 반복 8.12.
- 모든 실험 데이터와 파일을 수집 한 후, 시스템을 소독하기 위해 "종료"버튼을 클릭합니다.
9. Imaging 흐름 사이토 샘플 분석
- 분석 소프트웨어 애플리케이션 사이토 촬상 흐름을 연다.
- "파일"에서 실험 .RIF 파일을 엽니 다.
- 선택하여 단일 색상 .RIF 파일을 (DIO 전용 제어 단계 8.10 및 8.11 동안 생성 된 PI 전용 제어)를 사용하여 새로운 매트릭스를 구축 소프트웨어 사이토 이미징 흐름 보상 탭에서 "새 매트릭스 만들기"를 참조하십시오.
참고 : 소프트웨어는 단일 색상 파일의 선택을 묻는 메시지와 매트릭스 파일 (.ctm 파일 확장자)을 만들 병합 것, 즉 채널 보상을 적용하기 위해 선택하는 것입니다. - 소프트웨어의 "빌딩 블록"기능을 이용하여 도트 플롯을 만든다.
- 도트 플롯 게이트 (주파수 대 BrightFieldGradient_RMS) 포커스 세포를 만듭니다. 게이트 "초점"(그림 1A)를 호출합니다.
- "포커스 방식"게이트를 사용하면, g에 밝은 필드 화면 비율 대 밝은 필드 지역의 도트 플롯을 만들 중항 세포를 먹었다. 게이트 "싱글"(그림 1B)를 호출합니다.
- 은 "싱글"게이트를 사용 Intensity_MC_Ch5 대 Intensity_MC_Ch02의 도트 플롯을 만들 수 있습니다. 확인하고 게이트 DIO 양성에만 세포 (대상, 살아) 및 PI-DIO (죽은 대상) 더블 양성 세포 (그림 1C)이 플롯을 사용합니다.
주 : 모든 플롯 단계 9.4.1, 9.4.2에 기술 및 9.4.3은 소프트웨어 "빌딩 블록"함수를 이용하여 생성 될 수있다.
- 각 게이트의 세포 수에 액세스 할 수 도트 플롯의 통계 기능을 클릭합니다.
- 다음 식을 이용하여 자발 시료에서 죽은 대상 및 실험 시료의 비율을 계산한다 :
샘플 % 죽은 대상은 = (#dead 목표 × 100) / (#는 목표 + #dead 목표를 살) - 다음 식을 사용하여 세포 독성을 계산한다 :
%의 세포 독성 = [(실험 데드 자발적인 죽은) / (100 자발적 죽은)] × 100
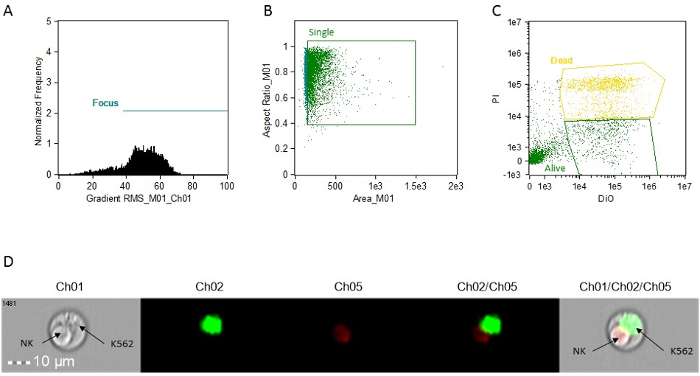
그림 1 : 세포 독성 활동 분석을위한 대표 히스토그램, 산점도 및 이미지. (A) 포커스 세포 분석. (B) 단일 세포 분석. (C) 표적 세포 염색 분석. 모든 결정은 각 이벤트에 첨부 된 이미지를 사용하여 제조된다. 이것은 단순히 그래프에서 이벤트를 클릭 분석 소프트웨어에 액세스 할 수있다. 사멸 NK 세포와 라이브 K562 대상을 보여주는 (D)는 이중 이벤트의 대표 이미지. CH01, 브라이트. CH02, DIO. CH05, PI. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
NK 세포 수의 결정
전혈에서 NK 세포 수 무거운 실행의 효과는도 2에 기재된 운동 프로토콜을 사용하여 측정 하였다. 혈액 샘플은 초기 채혈 후 최종적으로 24, 48 시간을 1.5 시간 운동 후, 즉시 운동 후, 운동 전에 그려진 하였다. 전혈 밀리리터 NK 세포의 농도는 각각의 러너 (도 3A)에 대한 각 타임 포인트에 대한 평균 (도 3b)상에서 ?...
토론
본 연구에 기재된 방법은 직접 (특히이 경우, 장시간 운동) 자극에 응답하여 개인의 NK 세포의 특이 적 활성을 측정한다. 일반적으로, NK 세포는 마커의 조합을 사용하여 분류 밀도 구배 또는 셀을 사용하여 하나의 혈액으로부터 분리된다. 그들은 시간이 걸리는 다수의 조작을 수반 한 사용자 심하게 의존하는 이러한 방법이 널리 사용되지만, 그들은 여러 단점을 가지고있다. 그 결과, 과도한 스트?...
공개
The authors have nothing to disclose.
감사의 말
This project was supported by Agriculture and Food Research Initiative Competitive Grant no. 2100-68003-30395 from the USDA National Institute of Food and Agriculture.
자료
| Name | Company | Catalog Number | Comments |
| K-562 lymphoblasts | ATCC | CCL-243 | |
| Iscove's Modified Dulbecco's Media | ATCC | 30-2005 | High glucose, with L-Glutamine, with HEPES, Sterile-filtered |
| Alpha Minimum Essential medium | ATCC | CRL-2407 | Without ribonucleosides and deoxyribonucleosides but with 2 mM L-glutamine and 1.5 g/L sodium bicarbonate |
| Trypan Blue Solution 0.4% | Amresco | K940-100ML | Tissue culture grade |
| Propridium Iodide Staining Solution | BD Pharmingen | 51-66211E | |
| Vybranto DiO cell-labeling solution | Vybranto | V-22886 | |
| autoMACS Pro Separator | Miltenyi Biotec | 130-092-545 | |
| autoMACS Running Buffer | Miltenyi Biotec | 130-091-221 | |
| autoMACS Washing Buffer | Miltenyi Biotec | 130-092-987 | |
| autoMACS Columns | Miltenyi Biotec | 130-021-101 | |
| Whole Blood CD56 MicroBeads, human | Miltenyi Biotec | 130-090-875 | |
| ImageStream X Mark II Imaging Flow Cytometer | EMD Millipore | ||
| Speedbeads | Amnis Corporation | 400030 | |
| 0.4-0.7% Hypochlorite (Sterilizer) | VWR | JT9416-1 | |
| Coulter Clenz | Beckman Coulter | 8546929 | |
| 70% Isopropanol (Debubbler) | EMD Millipore | 1.3704 | |
| D-PBS (Sheath fluid) | EMD Millipore | BSS-1006-B (1X) | No calcium or magnesium |
| INSPIRE Software | EMD Millipore | Version Mark II, September 2013 | |
| Ideas Application Software | EMD Millipore | Version 6.1, July 2014 |
참고문헌
- Cerwenka, A., Lanier, L. L. Natural killer cells, viruses and cancer. Nat Rev Immunol. 1 (1), 41-49 (2001).
- Nieman, D. C. Exercise, infection, and immunity. Int J Sports Med. 15, 131-141 (1994).
- Romeo, J., Warnberg, J., Pozo, T., Marcos, A. Physical activity, immunity and infection. Proc Nutr Soc. 69 (3), 390-399 (2010).
- Nieman, D. C. Marathon training and immune function. Sports Med. 37 (4-5), 412-415 (2007).
- Simpson, R. J., Kunz, H., Agha, N., Graff, R. Exercise and the Regulation of Immune Functions. Prog Mol Biol Transl Sci. 135, 355-380 (2015).
- Walsh, N. P., et al. Position statement. Part one: Immune function and exercise. Exerc Immunol Rev. 17, 6-63 (2011).
- Timmons, B. W., Cieslak, T. Human natural killer cell subsets and acute exercise: a brief review. Exerc Immunol Rev. 14, 8-23 (2008).
- Westermann, J., Pabst, R. Distribution of lymphocyte subsets and natural killer cells in the human body. Clin Investig. 70 (7), 539-544 (1992).
- Boyum, A. Isolation of leucocytes from human blood. Further observations. Methylcellulose, dextran, and ficoll as erythrocyteaggregating agents. Scand J Clin Lab Invest Suppl. 97, 31-50 (1968).
- McMillan, R., Scott, J. L. Leukocyte labeling with 51-Chromium. I. Technic and results in normal subjects. Blood. 32 (5), 738-754 (1968).
- Berk, L. S., et al. The effect of long endurance running on natural killer cells in marathoners. Med Sci Sports Exerc. 22 (2), 207-212 (1990).
- McAnulty, L. S., et al. Effect of blueberry ingestion on natural killer cell counts, oxidative stress, and inflammation prior to and after 2.5 h of running. Appl Physiol Nutr Metab. 36 (6), 976-984 (2011).
- Millard, A. L., et al. Brief Exercise Increases Peripheral Blood NK Cell Counts without Immediate Functional Changes, but Impairs their Responses to ex vivo Stimulation. Front Immunol. 4, 125 (2013).
- Janeway, C. A., Travers, P., Walport, M., Shlomchik, M. J. . Immunobiology: The Immune System in Health and Disease. 5th edn. , (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유