JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
자외선 VI와 라만 분광학 면역 플랫폼 제조
요약
Nanoparticle-based optical probes have been designed as a vehicle for detecting antigens using Raman and UV-Vis spectroscopy. Here we describe a protocol for preparing such probes for a UV-Vis/Raman spectroscopy immunoassay in such a way to incorporate future multiplexing capabilities.
초록
면역은 관련된 항체의 존재 여부에 따라 단백질을 검출하기 위해 사용된다. 때문에 연구와 임상에서의 광범위한 사용으로, 면역 기기 및 재료의 대형 인프라 찾을 수 있습니다. 예를 들어, 96 및 384 웰 폴리스티렌 플레이트를 상업적으로 사용할 수있는 다양한 제조업체의 자외선 - 가시 광선 (UV-비스) 분광 시스템을 수용하기 위해 표준 디자인을 가지고있다. 또, 효소 면역 분석법 (ELISA)과 같은 면역 맞춤 설계를위한 면역 글로불린을 검출 태그 및 차단제 다양한 가능하다.
기존 인프라에도 불구하고, 표준 ELISA 키트는 비용과 시간이 소모 될 수 개별적인 면역 개발을 요구하는 모든 연구의 요구를 충족하지 않는다. 그들은 일반적으로 형광 또는 COL에 의존하는 예를 들면, ELISA 키트 (한 번에 하나 이상의 분석 물을 검출) 기능이 낮은 다중화검출 orimetric 방법. 색도계 및 형광 기반의 분석은 광범위한 스펙트럼 피크에 의한 다중화 기능을 제한하고있다. 반면, 라만 분광법 기반의 방법 때문에 좁은 방출 피크에 다중화 훨씬 더 큰 능력을 가지고있다. 라만 분광기의 또 다른 장점은 라만 리포터 형광 태그 (1)에 비해 훨씬 적은 광표백을 경험한다는 것이다. 라만 기자는 형광과 색채 태그를 통해 가지고 있다는 장점에도 불구하고, 프로토콜은 라만 기반 면역이 제한된 제작합니다. 본 연구의 목적은 UV-비스 분석, 라만 분광법으로 분석 물을 직접 검출을위한 폴리스티렌 플레이트와 함께 사용하는 기능화 프로브를 제조하는 프로토콜을 제공하는 것이다. 이 프로토콜은 미리 설정된 인프라를 활용하면서 연구자가 미래 다 분석 검출 할 - 그것 - 자신의 접근 방식을 취할 수 있습니다.
서문
일반적인 샌드위치 면역 간접적 두 항체를 사용하여 항원의 존재를 검출한다. 포획 항체는 고체 표면에 결합 된 적절한 항원에 근접하여 항체 - 항원 복합체를 형성 할 때이다. 검출 항체는 도입 항원에 결합한다. 도 1a에 설명 된대로 세척 한 후, 항체 / 항원 / 항체 착물은 유지 및 표지 검출 항체에 의해 검출된다. 일반적인 검출 폭 넓은 스펙트럼 피크 2,3로 인해 10 분석에 다중화을 제한, 형광 또는 비색 검출기에 의해 수행된다. 반면에, 라만 기반 시스템은 최대 100 2,3- 분석 동시 검출을 주장 소스 향상 다중화 기능의 결과로 더 좁은 발광 피크를 가지고있다.
많은 문학 소스는 면역과 관련된 중요한 측면을 커버 할 수 있습니다 4-6 등 단계별로자세한 내용은 개인 ELISA 키트를 만들 수 있습니다. 불행하게도,이 프로토콜은 사용자 면역의 다중화 기능을 제한, 형광 또는 비색 검출을위한 것입니다. 이러한 필요를 해결하기 위해, 우리는도 1b에 도시 된 바와 같이 직접 면역을 위해 이전에 7 일 공개 된 UV-비스 / 라만 면역을 제조하는 구체적인 방법을 제시한다.
이 프로토콜은 기능화 된 금 나노 입자 기반 프로브의 제조,도 2에 도시를 포함한다. 금 나노 입자의 표면 (AuNPs)에 라만 기자 결합에 의해 시작 라만 / UV-마주 프로브를 확인하는 절차를. AuNPs 후, 폴리에틸렌 글리콜 (PEG)와 관련된 항체로 관능 화된다. AuNPs에 남은 결합 부위는 분석시 이후의 비 특이 적 결합 방지하기 위해 AuNPs에 메 톡시 폴리에틸렌 글리콜 티올 (MPEG-SH)를 결합에 의해 차단됩니다. 준비된 AuNP 프로브는 항원에 결합함으로써 테스트도 1b에 도시 된 바와 같이 폴리스티렌 플레이트의 웰에 고정시켰다. 관련 라만 기자는 라만 분광법 검출하는 동안 접시를 세척시, AuNP 프로브는 UV-마주 분광법을 사용하여 검출된다. UV-VI와 라만 스펙트럼 데이터를 결합하여이 면역의 기능을 향상 분석하는 두 가지 방법을 제공한다.
프로토콜
버퍼의 1. 준비
- 인산염 완충 식염수 (PBS)
- 배속 PBS 농도를 만들기 위해 450 ㎖의 HPLC 등급 물 10 배 PBS 50 mL로 희석. 살균 필터 0.22 μm의 필터 솔루션.
- 실온에서 보관 솔루션입니다.
- 트리스 완충 식염수 + 트윈 20 (TBST)의 제조
- 배속 농도를 만들기 위해 450 ㎖의 HPLC 등급 물 배 트리스 완충 식염수 (TBS)의 50 mL로 희석. 트윈-20의 0.05 % (v / v)의 위해 트윈-20의 250 μl를 추가합니다. 살균 필터 0.22 μm의 필터 솔루션.
- 실온에서 보관하십시오.
- 인간 혈청 알부민의 제조 (HSA) 차단 솔루션
- HSA 솔루션의 v / w는 3 %를 만들기 위해 멸균 여과 1X PBS 15 ml의에 HSA의 0.45 g을 달아. HSA까지 소용돌이 용액을 완전히 용해시킨다.
- 4 ℃에서 보관 HSA 솔루션입니다.
참고 : 소 혈청 알부민(BSA)도 차단 용액으로서 사용될 수있다.
- PEG 화 된 항체의 제조 (PEG-AB) 용액
참고 : 항체 솔루션을 결합 부위의 n 히드 록 (NHS)에 대한 경쟁에 의해 접합 반응을 방해하는 등의 BSA와 같은 캐리어 또는 안정화 단백질에서 무료로해야합니다. 항체는 트리스 나 글리신 완충액 온 경우, NHS 공액 반응 간섭 아민 또는 암모늄염을 방지하기 위해 버퍼 교환을 거쳐야한다. 항체는 동결 건조 된 형태 인 경우, 1 내지 10 ㎎ / ㎖의 농도로 제조자의 권고에 따라 재현 탁 될 수있다.- 트리스 나 글리신 완충액 항체, 탈염 컬럼을 사용하여 100 mM의 나트륨 바이 카보네이트로 버퍼 교환을 수행한다. 공액 반응 속도를 약 8.5로 pH를 높이기 위해 100 mM의 버퍼를 사용합니다.
- 100 밀리미터의와 수화물 오르 피리 딜 이황화-PEG-NHS (OPSS-PEG-NHS)1 ㎎ / ㎖ 이상의 농도로 한 용액의 부피로 비난의 중탄산.
참고 : OPSS-PEG-NHS는 신선한 만든 약 20 분 이내에 사용해야합니다. OPSS-NHS-PEG의 NHS 기의 pH 8.5의 수용액에서 약 20 분의 반감기를 갖는다. - 1 비율 (PEG : 항체) 2의 항체 용액 OPSS-PEG-NHS 추가 결합 비는 시험 샘플에 사용한다. 상기 제어를 위해 사용되는 접합 한 비율 : 마이크로 원심 분리 튜브에, 2의 항원 용액 OPSS-PEG-NHS를 추가한다.
주 : 2 : 1의 비율이 50 %의 결합 효율을 가정하고있다. 목적은 하나의 PEG 체인 각 항체 레이블을하는 것입니다. 이 단계에서, 과잉 표지 밑에 표시보다 낫다. OPSS-PEG-NHS 및 항체 용액의 적절한 양을 결정하기 위해 다음 식을 사용하여
V는 볼륨이고, C는 분자 또는 표현 농도는ml의 당 tibodies. 첨자 PEG와 순이는 각각 OPSS-PEG-NHS 항체이다. 최종 부피는 약 250 ㎕를해야한다. - 8 시간 또는 밤새 4 ° C에서 PEG-Ab의 솔루션을 품어. 동결 해동 사이클을 제한하고 낮은 바인딩 튜브를 사용할 수 있는지 확인하기 위해 -20 ° C에서 약 25 μL의 분취 작업에 보관 솔루션입니다.
2. 준비 UV-비스 / 라만 프로브
- 베어 AuNP 솔루션을 준비
- ml의 당 약 1 × 10 (11) 입자의 농도 AuNPs의 2 ml의 솔루션을 준비합니다.
- AuNPs가 집중해야하는 경우, 20 분 동안 또는 상등액가 선명해질 때까지 5,000 XG에서 2,000 재고 AuNP ㎕의 원심 분리기와 낮은 결합 원심 분리기 튜브를 입력합니다. AuNP 펠렛을 방해하지 않도록주의, 피펫으로 상층 액을 제거합니다.
- 하나의 튜브에 남아있는 AuNP 솔루션을 결합하고 집중하고 추정자외선 비스 측정을 획득하고,이 선형 관계로 알려진 농도의 값을 비교하여 기.
- ml의 당 약 1 × 10 (11) 입자의 농도 AuNPs의 2 ml의 솔루션을 준비합니다.
- 적절한 라만 리포터 표지 비율을 결정
- 메탄올 라만 기자의 작업 솔루션을 준비합니다. 이 농도는 사용 된 기자에 의존 할 것이다. 본 연구에서는 200 μM의 작동 용액에 3,3'- diethylthiatricarbocyanine오다 이드 (DTTC)를 준비합니다.
- 각 웰에 100 ㎕의 최종 부피를 가정하면, 라만 리포터 0.2 μM 내지 10 μM까지 농도의 범위이다되도록 96 웰 플레이트의 첫 번째 행의 각 웰에 작용 리포터 용액만큼 추가한다. 볼륨이 80 μl의 것을 각 웰 등 충분한 HPLC 등급 물을 추가합니다. 각 웰에 각각 100 μL의 최종 볼륨을 잘 만들기 위해 AuNP의 20 μl를 추가합니다. 일례가 표 1에 제공된다.
- 자외선 마주 스펙트럼을 400 내지를 측정판 읽기 UV - 마주 분광 광도계를 사용하여 700 nm의. 적절한 농도는 UV-비스 스펙트럼에 대한 정의 봉우리와 가장 높은 농도이다. AuNPs에 라만 기자의 높은 농도 비율까지 농도를 증가의 단계를 반복 2.2.2 발견된다.
참고 : 염료 및 AuNP 모양, 크기, 제조자는 적절한 농도에 영향을 미친다. 따라서 나와있는 단계는 사용되는 구성 요소에 따라 평가 변경해야합니다. 이 프로토콜은 양전하 염료의 사용을 포함했다. 이와 같이, AuNP 리포터 간의 바인딩 AuNPs 음전하를 이용하여 향상되었다. 이것은 시트르산 AuNPs 캡핑을 사용하여 수행 하였다. 자세한 내용은 토론 섹션을 참조하십시오.
- 라만 기자와 PEG-Ab의 바인딩 AuNP하기
- 라만 리포터 실온에서 30 분 동안 AuNPs에 결합 할 수 있도록 미리 결정된 농도 AuNP 라만 리포터 두 1.5ml의 배치를 준비한다.
- 입자에 항체 : 1 비율로 (200)를 만들 수있는 AuNP 및 라만 기자 솔루션 중 하나 배치에 PEG 화 항체 (PEG-순이)를 추가합니다. 이 용액을 시험 샘플에 대한 것이다. 컨트롤로서 사용되는 입자에 항체 : 1의 비율로 개별 마이크로 원심 튜브에, 200에서 AuNP 라만 리포터 용액의 다른 배치를 PEG 화 항원을 추가한다. 실온에서 30 분 동안 용액을 인큐베이션.
주 : 입자에 항체의 비율이 AuNPs 특정 사용하고 염료 및 각각의 경우에 대해 최적화되어야한다. AuNP 프로브 입자의 응집을 방지하면서 결합하기 위해 여기 목적은 항체의 가장 높은 비율을 가지고있다. 함께 추가 적절한 양을 결정하기 위해 다음 식을 사용하여
V는 볼륨이고, C는 ㎖의 당 입자 또는 항체로 표현 농도이다. 핀알 부피는 약 1.5 ml를해야한다.
- 블록은 MPEG-SH와 AuNP 표면에 사이트를 나머지.
- 물을 사용하여 200 μM 농도로 고체 메 톡시 폴리에틸렌 글리콜 티올을 용해시켜 MPEG-SH를 준비한다. MPEG-SH가 완전히 용해 될 때까지 용액을 소용돌이.
- 단계 2.3에서 만든 AuNP-PEG-Ab의 솔루션 : 1 비율로 40,000 MPEG-SH를 추가합니다. 금 나노 입자의 나머지 사이트 차단을 보장하기 위해 10 분 동안 실온에서 용액을 인큐베이션. 함께 추가 적절한 양을 결정하기 위해 다음 식을 사용하여
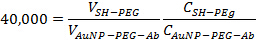
V는 볼륨이고, C는 ㎖의 당 입자 또는 항체로 표현 농도이다. 최종 부피는 약 1.5 ml를해야한다.
- 작용 라만 프로브를 복구 할 수 있습니다.
- 낮은 바인드 C에서 20 분 동안 5,000 XG에 원심 분리기 입자entrifuge 튜브 또는 상등액가 선명해질 때까지. AuNPs을 방해하지 않도록주의 피펫 팅하여 상층 액을 제거합니다.
- 이전되었다 1X PBS 용액 1 ㎖로 재현 탁 입자. 용액 (3 μL)의 소량의 UV-비스 측정을 취함으로써 AuNP 농도를 추정하고 공지 AuNP 농도에서 측정하여 결과를 비교. 최종 용액 ㎖의 당 적어도 1 × 10 (11) 입자가되도록 볼륨을 조절합니다.
- 4 ℃에서 저장 솔루션 이것은 면역 플레이트의 기능화를 위해 사용될 때까지. 1 주일 이내에 솔루션을 사용합니다.
| 볼륨은 각 구성 요소의 추가합니다 (㎖) | |||
| DTTC 최종 농도 (mM)을 | DTTC 작업 용액 (200 mM)을 | AuNP | 물 |
| 0.2 | 0.1 | (20) | 79.9 |
| 0.6 | 0.3 | (20) | 79.7 |
| 1 | 0.5 | (20) | 79.5 |
| 이 | 1.0 | (20) | 79 |
| (5) | 2.5 | (20) | 77.5 |
| (7) | 3.5 | (20) | 76.5 |
| (10) | 5.0 | (20) | (75) |
표 1. DTTC 희석 예. DTTC의 다양한 희석과 주식 DTTC, 금 나노 입자 용액, 물 관련 볼륨.
3. 면역 플레이트 준비
- 면역 측정법 판에 원하는 항원을 결합한다.
- 폴리스티렌 웰을 채울 정도로 희석 된 항원 (50 μg의 / ml)로 준비한다. 솔루션 와동바로 판 우물에 솔루션을 추가 할 수 있습니다. 항원을 실온에서 1 시간 동안 플레이트에 결합 할 수있다.
- 언 바운드 항원을 씻으십시오.
- 처분 용기에 솔루션을 덤핑 및 종이 수건이 덮여 탁상에 대해 판을 쳐서 여분의 항원 용액을 제거합니다.
- 전술 한 바와 같이 동일한 방식으로 세척 한 후 표면을 씻어 제거 웰에 추가 TBST. 이 단계를 두 번 더 반복합니다.
- 블록 비특이적 결합을 방지하기 위해 플레이트 상에 남아있는 결합 부위.
- 플레이트의 각 웰에 HSA 블로킹 용액 70 μl를 첨가하고 실온에서 30 분 동안 배양한다.
- 분리 단계 3.2에 규정 된 동일한 절차를 사용하여 플레이트를 헹군다. 더 사용할 준비가 될 때까지 4 ° C에서 플레이트 및 저장 건조를 커버.
- 면역 플레이트 기능화.
- t의 70 μl를 추가그는 96 웰 플레이트의 첫 번째 열에 섹션 2에서 제조 된 나노 입자 프로브 및 1 사용 이후의 열을 희석 : 2 시리얼 희석. 플레이트는 적어도 1 시간 동안 배양 할 수 있습니다. 면역 측정법 판을 제조하는 방법의 예는도 3에 주어진다.
- 적절하게 AuNPs 폐기해야하고, 단계 3.2에 설명 된대로 TBST로 5 회 접시를 씻으십시오. 최종 세척 한 후, 각 웰에 1X PBS의 70 μl를 추가하고 플레이트 씰 커버.
주 : 제어 샘플은 명확해야한다. 비특이적 결합이 발생한 경우, 대조 시료는 시험 시료와 유사한 색상을 가질 것이다.
- UV-VI와 라만 분광법에 의한 시험 분석 감도.
- 각 웰의 경우, UV-마주 스펙트럼 판 읽기 UV - 마주 분광 광도계를 사용하여 400에서 700 nm의 범위를 측정한다.
- 반전 라만 현미경을 사용하여 AuNP 프로브를 갖는 웰의 표면 상에 대물 초점. 산부인과웰의 라만 스펙트럼을 주석 박. 1,800cm -1 400cm 범위의 스펙트럼을 수집 -1. 모든 우물에 대해이 단계를 반복합니다.
- 스펙트럼 적절한 소프트웨어를 사용하여, UV-비스 스펙트럼에 대한 라만 스펙트럼에 대한 11 번째 오더 다항식 기준선 보정 및 3 차 차 다항식을 수행한다.
- 적절한 소프트웨어를 사용하여 스펙트럼, 라만 및 UV-비스 스펙트럼 정규화. (1) 최대 값을 설정하고 그에 따라 다른 값을 스케일링. 라만 스펙트럼을 정상화하기 위해 고유 한 폴리스티렌 피크를 선택하고 동일한 1로 설정하고 그에 따라 다른 값을 확장 할 수 있습니다.
- 스펙트럼 적절한 소프트웨어를 사용하여, 각각의 스펙트럼 피크의 적분을 수행한다. 라만 스펙트럼의 경우, 라만 리포터를 나타내는 피크는 폴리스티렌 피크의 존재 영역에 있어야한다. 피크 적분을 수행하기 위해, 원하는 피크 적분 경계를 지정하고 컨트롤을 포함하여 모든 샘플에 대해 원하는 피크 면적을 기록한다.
- 경기 수관련 표준 편차를 나타내는 각 포인트에 대한 오차 막대와 AuNP 농도의 로그 함수로서 관심의 평균 피크 면적 오티. 4 매개 변수 물류 곡선이 교정 점을 맞 춥니 다.
- 빈 샘플에 대한 관심의 피크의 면적의 평균을 블랭크의 평균값을 결정한다. 이 분야의 표준 편차를 결정하고; 이는 블랭크의 표준 편차이다.
- 이전 단계에서와 동일한 분석 피크 최저 농도에 대한 피크 면적의 표준 편차를 발견.
- 대표 결과 섹션에 명시된 검출 빈과 하한의 한계를 계산합니다. AuNP 농도의 관점에서 LLOD를 결정 4PL 교정 곡선이 값을 사용한다.
결과
본 연구에서는, 60 nm의 금 입자의 UV-비스 분광기를 사용 하였다. UV-비스 오픈 소스 스펙트럼 분석 소프트웨어 8을 사용하여 결정 하였다 AuNP 각 농도에 대한 400 내지 700 nm의 수거하고, 피크 면적으로부터 흡수 스펙트럼. 통합 피크 이전에 수집 된 스펙트럼은 3 점 다항식을 이용하여베이스 라인 보정을 시행 하였다. 피크 영역은도 4에서 설명한 바와 같이 대수 보정 곡선을 생성...
토론
자세한 프로토콜에서 해결하기 위해 몇 가지 중요한 포인트가 있습니다. 한 가지 문제는 라만 기자와 금 나노 입자의 선택입니다. 프로토콜은 개인 사용에 적합하도록 작성되었지만, 라만 리포터 DTTC 예로서 사용 하였다. DTTC는 양전하 기자 부정적인 같은 시트 레이트 출장 AuNPs로 표면을 충전하기 위해 결합한다. 이 프로토콜은 양의 표면 전하와 금 나노 입자를 사용하여 음으로 하전 기자 적응 ?...
공개
The authors declare that they have no competing financial interests.
감사의 말
This work was supported by a Research Catalyst Award from Utah State University. The authors would like to thank Annelise Dykes, Cameron Zabriskie, and Donald Wooley for their contributions.
자료
| Name | Company | Catalog Number | Comments |
| 60 nm Gold Nanoparticle | Ted Pella, Inc. | 15708-6 | These are citrate capped gold nanoparticles. Please see Discussion for relationship between Raman reporter and AuNP surface charge and its imporance to proper selection of AuNP and/or Raman reporter. |
| Sodium Bicarbonate | Fisher Scientific | S233-500 | |
| Methanol | Pharmco-Aaper | 339000000 | |
| Tris Buffered Saline (10x) pH 7.5 | Scy Tek | TBD999 | |
| Bottle Top Filtration Unit | VWR | 97066-202 | |
| Tween 20 (polysorbate 20) | Scy Tek | TWN500 | Used as an emulsifying agent for washing steps. |
| Phosphate Buffered Saline 10x Concentrate, pH 7.4 | Scy Tek | PBD999 | |
| Protein LoBind Tube 2.0 ml | Eppendorf Tubes | 22431102 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Protein LoBind Tube 0.5 ml | Eppendorf Tubes | 22431064 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Microplate Devices UniSeal | GE Healthcare | 7704-0001 | Used for sealing and storing functionalized plates. |
| Assay Plate, With Low Evaporation Lid, 96 Well Flat Bottom | Costar | 3370 | |
| HPLC grade water | Sigma Aldrich | 270733-4L | |
| 3,3′-Diethylthiatricarbocyanine iodide (DTTC) | Sigma Aldrich | 381306-250MG | Raman reporter |
| mPEG-Thiol, MW 5,000 - 1 gram | Laysan Bio, Inc. | MPEG-SH-5000-1g | |
| OPSS-PEG-SVA, MW 5,000 - 1 gram | Laysan Bio, Inc. | OPSS-PEG-SVA-5000-1g | OPSS-PEG-SVA has an NHS end. |
| Mouse IgG, Whole Molecule Control | Thermo Fisher Scientific | 31903 | Antigen |
| Goat anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody | Thermo Fisher Scientific | 31164 | Antibody |
| Human Serum Albumin Blocking Solution | Sigma Aldrich | A1887-1G | Bovine serum albumin can be used instead. |
| Mini Centrifuge | Fisher Schientific | 12-006-900 | |
| UV-Vis Spectrophotometer | Thermo Scientific | Nanodrop 2000c | |
| UV-Vis Spectrophotometer | BioTek | Synergy 2 | |
| Desalting Columns | Thermor Scientific | 87766 | |
| In-house built 785 nm inverted Raman microscope unit | N/A | N/A | An inverted Raman microscope is best for proper focusing onto surface of the well plate. Otherwise a very low magnification will be used due to height of the 96-well plate. An in-house built system was used as it was cheaper than buying from a vendor. However, any commercially available inverted Raman microscope system can be used. |
참고문헌
- Israelsen, N. D., Hanson, C., Vargis, E. Nanoparticle properties and synthesis effects on surface-enhanced Raman scattering enhancement factor: an introduction. Sci. World J. , e124582 (2015).
- Wang, Y., Schlücker, S. Rational design and synthesis of SERS labels. Analyst. 138 (8), 2224-2238 (2013).
- Wang, Y., Yan, B., Chen, L. SERS tags: novel optical nanoprobes for bioanalysis. Chem. Rev. 113 (3), 1391-1428 (2013).
- . . The Immunoassay Handbook: Theory and applications of ligand binding, ELISA and related techniques. , (2013).
- Cox, K. L., Devanarayan, V., Kriauciunas, A., Manetta, J., Montrose, C., Sittampalam, S. Immunoassay Methods. Assay Guid. Man. , (2004).
- . . ELISA development guide. , (2016).
- Israelsen, N. D., Wooley, D., Hanson, C., Vargis, E. Rational design of Raman-labeled nanoparticles for a dual-modality, light scattering immunoassay on a polystyrene substrate. J. Biol. Eng. 10, (2016).
- Menges, F. . Spekwin32 - optical spectroscopy software. Version 1.72.1. , (2016).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Yu, X. Quantifying the Antibody Binding on Protein Microarrays using Microarray Nonlinear Calibration. BioTechniques. 54, 257-264 (2013).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin. Biochem. Rev. 29 (Suppl 1), S49-S52 (2008).
- . . EP17-A2: Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures; Approved Guideline. 32. No 8, (2012).
- Leigh, S. Y., Som, M., Liu, J. T. C. Method for assessing the reliability of molecular diagnostics based on multiplexed SERS-coded nanoparticles. Plos One. 8 (4), e62084 (2013).
- Sinha, L. Quantification of the binding potential of cell-surface receptors in fresh excised specimens via dual-probe modeling of SERS nanoparticles. Sci. Rep. 5, 8582 (2015).
- Shi, W., Paproski, R. J., Moore, R., Zemp, R. Detection of circulating tumor cells using targeted surface-enhanced Raman scattering nanoparticles and magnetic enrichment. J. Biomed. Opt. 19, 056014 (2014).
- Xia, X., Li, W., Zhang, Y., Xia, Y. Silica-coated dimers of silver nanospheres as surface-enhanced Raman scattering tags for imaging cancer cells. Interface Focus. 3 (3), 20120092 (2013).
- McLintock, A., Cunha-Matos, C. A., Zagnoni, M., Millington, O. R., Wark, A. W. Universal surface-enhanced Raman tags: individual nanorods for measurements from the visible to the infrared (514-1064 nm). Acs Nano. 8 (8), 8600-8609 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유