JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
높은 처리량, 실시간, 세포 내 항균 활동의 이중 판독 테스트 및 진핵 세포의 세포 독성
요약
A high throughput, real-time assay was developed to simultaneously identify (1) eukaryotic cell-penetrant antimicrobials targeting an intracellular bacterial pathogen, and (2) assess eukaryotic cell cytotoxicity. A variation on the same technology was thereafter combined with digital dispensing technology to enable facile, high-resolution, dose-response, and two- and three-dimensional synergy studies.
초록
세포 내 항균 활성 및 진핵 세포의 세포 독성의 전통적인 조치는 엔드 포인트 분석에 의존하고 있습니다. 이러한 엔드 포인트 분석은 세포 용해, 집락 형성 단위 결정, 또는 시약을 추가로 판독을하기 전에 몇 가지 추가 실험 단계를 필요로한다. 예를 들어, 높은 처리량 스크리닝 분석법 중에 수천을 수행 할 때, 이러한 유형의 분석법에 필요한 하류 노력은 상당하다. 따라서, 높은 처리량 항균 검색을 용이하게하기 위해, 우리는 동시에 세포 내 세균 증식의 억제제를 식별하고, 진핵 세포의 세포 독성을 평가하기위한 실시간 분석을 개발 하였다. 특히, 실시간으로 세포 내 세균의 성장 검출은 세균 룩스 오페론 (1 차 세대 분석) 또는 형광 단백질 기자 (2 차 생성, 직교 분석) 중 하나와 세균 검사 균주를 표시하여 사용 하였다. 비 독성, 세포 막 impermeant 핵산 결합 염료또한 대 식세포의 초기 감염시 추가되었습니다. 이 염료는 가능한 세포에서 제외됩니다. 그러나, 비 - 실행 가능한 숙주 세포 엔트리 핵 DNA의 형광 표식 (디옥시리보 핵산)를 허용 막 완전성을 잃는다. 특히, DNA는 숙주 세포 사멸의 용액 기반의 판독을 제공하고, 형광 양자 수율이 크게 증가와 관련된 바인딩. 우리는 마이크로 플레이트 포맷에서 높은 처리량 스크린을 수행하고, 현미경으로 세포의 성장과 세포 독성을 평가하기 위해 결합 분석을 사용 하였다. 특히 항균제 함께 적용 둘 이상의 항균제의 결합 된 효과는 개별적으로 적용될 때보다 큰 시너지 효과를 입증 할 수있다. 다른 농도에서 항생제의 조합 순열을 평가해야하기 때문에 세포 내 병원균에 대한 시험 관내 시너지 효과를 테스트하는 것은 일반적으로 엄청난 작업입니다. 그러나, 우리는 우리의 실시간 분석이 자동화, 디지털 분배 기술 쪽과 함께 발견손쉬운 시너지 테스트 ermitted. 이러한 접근 방식을 사용하여, 우리는 체계적으로 세포 내 병원균, 레지오넬라 뉴모 필라에 혼자 항생제의 많은 수의 행동과 조합을 조사 할 수 있었다.
서문
세포 내 구획에 일시적으로 증가 또는 상주 병원균은 치료 근절하기 어렵다. 의무 또는 상대적으로 이러한 레지오넬라 뉴모 필라, Coxiella burnetii의, 브루셀라 종으로 세포 내 병원균을 의무. , Francisella의 야토 및 진균 종. 종종 달에 몇 년의 범위 일 수있다 치료를위한 항생제 치료의 과정을 연장 필요합니다. 또한, 세포 외 병원균은 일시적으로 세포 내 틈새 시장을 점유하고이 방법으로 항생제 치료의 일반적인 과정에 의해 허가를 탈출하고 나중에 악성 감염의 새로운 라운드를 시작합니다 나타날 수 있습니다. 황색 포도상 구균 (1) 및 uropathogenic 장내 세균 2,3 감염이 점점 인식 예입니다. 따라서, 근본적으로 신약 개발 목표는 세포 내 구획 침투 신규 항생제를 확인하는 것이다. 최적의 치료는 빨리 근절하기세포 생물 및 하위 억제 항균 노출을 통해 저항의 개발을 방지 특히 바람직하다.
이를 위해 모델 병원체, 레지오넬라 뉴모의 세포 성장을 표적 세포 - 침투제 항균제를 식별하기 위해 고 처리량 스크리닝 기술을 개발했다. 4 이전 임상 관찰은 표준 항생제 감수성 검사가 정확하게이 생물에 대한 생체 내 치료 효과에 예측하지 않았 음을 나타냅니다. 이러한 β - 락탐 및 아미노 글리코 사이드와 같은 항균제의 주요 클래스, axenically 성장 레지오넬라 균에 대해 매우 효과적이지만, 충분히 레지오넬라 균이있는 세포 내 구획에 침투하지 않기 때문에 5는 특히이이었다. 5,6 나중에 증거가 기술적으로 더 복잡한 세포 성장 분석을 효과적으로 임상 적 효능을 예측하는 것이 좋습니다. (7) 불행하게도, 이러한 분석은 집락 형성 단위 열거 위해 상이한 시간 점에서 용해 될 항균제로 처리 감염된 대 식세포를 요하는 매우 힘든 종점 분석법이었다. 이러한 분석은 대규모로 수행하는 것은 비실용적이고 높은 처리량 약물 발견에 부적합하다.
따라서, 우리는 세포 내 세균 성장의 실시간 측정을위한 기술을 개발했다. 6이 박테리아 염색체에 4 형광 단백질을 (이전에 기술, 1 세대 분석) 중 세균 루시퍼 라제 오페론 (8)의 통합을 통해 변형 된 박테리아 균주의 사용을 통해 구 기자 (여기 한 제 2 세대, 직교 분석 등)를 달성했다. 이러한 방식으로, 발광 또는 형광 신호 세균 수의 대용 실시간 판독을 제공한다.
그러나, 이러한 특성은 세포 내 infectio의 주요 교란 요인을 해결하지n 개의 분석, 숙주 세포에 오프 대상 효과. 구체적으로, 숙주 세포의 죽음은 본질적으로 세포의 성장을 제한하고, 항균 효과의 위양성 식별 리드. 심사 라이브러리의 많은 화합물은 진핵 세포 독성, 이러한 오탐 (false positive)이 후속, 해결을위한 엔드 포인트 세포 독성 분석의 큰 숫자를 필요로 사실 항균제를 압도 할 것입니다.
따라서, 동시에 진핵 세포 생존율 및 세포 성장을 평가 할 수 있도록 큰 관심이었다. 특히, 비 생존 진핵 세포의 특성은 세포막 무결성의 손실이다. 세포막의 투과성을 테스트 프로브 따라서 세포 생존 능력을 평가하기 위해 사용될 수있다. 우리는 이전에 액세스 사균의 핵 DNA를 염색하기 위해 추정되는 세포막 - impermeant, 형광 DNA 결합 염료의 일련의 기능을 특징으로한다. 4 핵 DNA 결합에,이 염료는 quantu에서 큰 증가를 표시배경 솔루션 형광 이상 증가 신호의 결과로 m 형광 수율. 따라서, 이러한 염료는 진핵 세포 사멸의 정량적 판독을 제공 하였다. (4) 특히, 우리는 여러 가지가 J774의 대 식세포와 연장 공동 배양하는 동안 자신 무독성 것으로 나타났다. 초기 감염 기간 동안 첨가하면, 그것들은 실시간 현미경 마이크로 플레이트 형광 계에 의해 측정 또는 관찰 할 수있는 진핵 세포 사멸의 형광 판독 값을 제공 하였다.
따라서, 세균 리포터 무독성, 막 impermeant 사용을 결합하여, DNA 결합 염료, 우리는 세균 부하 동시에 진핵 세포의 세포 독성을 동시에 측정 할 수있는 단순하고 비파괴 실시간 분석을 개발할 수 있었다. 이 분석은 우리의 세포 성장을 억제 할 수있는 능력을 위해 ~을 포함하여 기능적지지 않은 활동 (250) 항균제 및> 240,000 작은 분자를 384 웰 플레이트 형식으로 화면 ~ 10,000 알려진 생체 활성제 할 수있다레지오넬라 뉴모 동시에 각 화합물 진핵 세포 독성 데이터를 생성하는 동안. 레지오넬라 균의 세포 성장에 대한 알려진 항생제 (6) 우리의 분석은 지금까지이 유형의 가장 포괄적 인 탐사했다. 6
병용 할 때 우리의 분석 포맷의 효율에 기초하여, 우리는 다음에 공지 된 항균제의 잠재적 상승 효과를 탐구. 가장 일반적인 시너지 테스트 중 하나, 소위 바둑판 분석은 표준 적 둘 이상의 항균제의 2 배 희석액의 조합 효과를 평가함으로써 수행된다. 두개 이상의 항 미생물제를 별도로 적용 각각의 효과의 합보다 함께 적용될 때 이러한 분석에서 10 시너지는 큰 효과의 관찰에 의해 정의된다. 참고로, 지금까지 만 집중과 선택적 시너지 시험은 세포 내 레지오넬라 뉴모 필라에 대해 수행되었다 필요한 조합 순열을 곱한 기존의 엔드 포인트 분석에 포함 된 큰 노력 때문이다.
시너지 테스트를 용이하게하기 위해 디지털 자동 분배 기술 (6)과 조합하여 실시간 세포 성장 / 진핵 세포 독성 분석에 사용했다. 이 자동화는 DMSO 또는 수용액 단독 또는 384 웰 형식의 조합에 용해 화합물의 연속 희석을 분배하는 우리를 허용. (11) 또한, 이러한 강력한 액체 핸들링 기술은 용이하게 더 높은 해상도를 수행하라고 허가 제곱근 -의 두 (대신 표준보다 낮은 해상도, 두배) 우리 이차원 특이성 높은 수준을 달성하기 위해 희석 조합을 바둑판 시너지 분석. 이 배 희석 시리즈 12을 사용하는 경우이 해결 재현성에 대한 시너지 분야에서 문제를 해결에 특히 유용했다. 마지막으로, 우리의 분석은 정량적도 THER했다는 efore 억제의 그라데이션을 측정 하였다. 결과적으로, 분석은 성장 억제 비슷한 수준으로 조합 농도 isocontours 연결되는 isocontour isobolograms의 발현 억제 내용 전체를 캡처. 6이 묘화 전략은 조합 적 투여 량 - 반응 곡선을 가시화시켰다. 우리의 방법론을 설명하기 위해, 우리는 이러한 분석을 수행하기위한 우리의 프로토콜을 설명하고 대표적인 결과를 보여줍니다.
프로토콜
1. 실시간 세포 내 성장과 진핵 세포 세포 독성 분석
- 제조 된 숙주 세포 (J774A.1 세포)
- 9 %의 철 보충 혈청과 RPMI 1640에서 서스펜션 문화 J774A.1 뮤스의 musculus 대 식세포 유사 세포. 조직 배양 플라스크에 처음 통로. 세포 배지 15 ㎖에 75 ㎠로 조직 배양 플라스크에서 컨 플루 언트하게 한 후 15 ㎖의 조직 배양 플라스크로 복귀 50 ml를 전달하는 매체의 동일한 유형, 65 ml의 긁어 희석하여 분할 250 ml의 세균 진탕 플라스크에.
- 250 mL 및 / 또는 조직 배양 배지와 오분의 볼륨에 가득 1,000 ml의 세균 플라스크에 현탁액 스케일 업, 문화. 분당 약 120 회전 수로 회전 수를 설정하여 통기. 일관성있는 성장을 위해, 정확히 5 % CO 2, 37 ℃에서 배양한다.
- 그들은 범위 농도 도달 수확 세포 2.5 × 106 세포/ 5 × 106 세포 / ml의. 죽은 세포 독성 분석에서 배경 노이즈가 증가하는 바와 같이, 25 %를 초과하지 않는 (쉽게 트리 판 블루 염색에 의해 분석) 죽은 세포의 비율을 확인.
- 흰색 접시, 조직 384 웰 마이크로 플레이트 30 μl를 조직 배양 배지에서 5 × 10 4 J774A.1 세포에서 당은 물론, 문화 처리. 실험의 날에 90 %의 합류를 달성하기 위해 마이크로 밤새 품어.
- 준비 발광 또는 형광 레지오넬라 뉴모 필라
- 통로 L.의 뉴모 필라 (Lp02 :: flaA :: 럭스 8) 해당 매체에 박테리아, 즉, 버퍼 숯불 효모 추출물 (BCYE) 매체. 티미 딘 영양 요 구성 균주를 사용하는 경우, 100 μg의 / ㎖ 티미 딘와 매체를 보완. 합류를 얻기 위해 새로운 BCYE 판에 두껍게 생물을 확산하고 (냉동 재고에서 경우) (이전 판 통로에서 경우) 하루 배양 또는 2 ~ 3 일에 의해 실험 세균의 패치를 준비성장.
- 10g 효모 추출물 10 g의 N 용해 BCYE 플레이트를 준비 - HPO 4 (2- 아세트 아미도) -2- 아미노 에탄 술폰산 0.35 g의 K (2) 및 탈 이온수 950 ml를 1 g 일 염기성 칼륨 α - 케 토글 루타 레이트. 수산화 칼륨 (11.9 몰 용액 ≥2.5 ㎖)으로 pH 6.9로 조정한다.
- 15g의 한천 2g 활성탄을 추가; 1 L 최종 부피에 가져다. 자기 교반 막대 및 오토 클레이브를 추가합니다. 55 ° C로 냉각 매체 및 탈 이온수에 용해 된 0.4 g의 L 시스테인 및 0.42 g의 암모늄 철 (III) 시트 레이트를 포함하는 추가 필터 살균 솔루션을 제공합니다. 페트리 접시를 주입하기 전에 혼합 자석 교반 판을 사용합니다.
- 무균 성장 매체에 L.의 뉴모 필라 성장의 테스트를 위해 숯을 제외하고 BCYE에 사용되는 모든 화학 시약을 결합하여 ACES-효모 추출물 국물 (AYE)를 준비하고 한천. 필터 소독 즉시 사용하거나 나중에 실험 동결.
- 는 sa에 재현 탁 생물적절 100 μg의 / ㎖ 티미 딘 보충되어 J774A.1 세포에 사용 나 조직 배양 배지.
- 통로 L.의 뉴모 필라 (Lp02 :: flaA :: 럭스 8) 해당 매체에 박테리아, 즉, 버퍼 숯불 효모 추출물 (BCYE) 매체. 티미 딘 영양 요 구성 균주를 사용하는 경우, 100 μg의 / ㎖ 티미 딘와 매체를 보완. 합류를 얻기 위해 새로운 BCYE 판에 두껍게 생물을 확산하고 (냉동 재고에서 경우) (이전 판 통로에서 경우) 하루 배양 또는 2 ~ 3 일에 의해 실험 세균의 패치를 준비성장.
- 대 식세포 감염
- (박테리아 성장 억제 및 진핵 세포 용해 스크리닝 화합물 및 양성 및 음성 대조군) 관심 시험 화합물을 추가한다. 바람직하게는, 차량의 충분한 희석 있도록 DMSO (디메틸 설폭 사이드) 또는 수용액 ≥500x에 원액을 녹인다.
- 스톡 용액은 냉동 저장 될 수 있지만, 불안정한 화합물 항균제 동결 - 해동 사이클을 피한다.
- 조직 배양 배지에서 2.5 × 106 CFU (집락 형성 단위) / m 및 형광 기자 표지 세균 1.0 × 10 7 CFU / ㎖의 대상으로 적절한 비 독성, 막 impermeant, 핵산 산성을 추가하는 발광 박테리아를 희석 2.5 최종 분석 농도에서 염료 바인딩.
- 물론 각 J774A.1 문화에 혼합물의 20 μl를 추가, 최종 분석 볼륨50 μl의 최종 세균 농도 1 × 106 CFU / ㎖ (럭스 오페론 기자) 4 × 10 10 6 CFU / ㎖ (형광 단백질 기자).
- 100 % CO 2, 5 %를 1-3 일 동안 37 ° C에서 증발 가장자리 효과를 방지하기 위해 상대 습도 부화.
- (박테리아 성장 억제 및 진핵 세포 용해 스크리닝 화합물 및 양성 및 음성 대조군) 관심 시험 화합물을 추가한다. 바람직하게는, 차량의 충분한 희석 있도록 DMSO (디메틸 설폭 사이드) 또는 수용액 ≥500x에 원액을 녹인다.
- 분석 판독
- 기자에 맞게 마이크로 플레이트 루미 및 형광 계에 세균의 성장 및 진핵 세포 독성을 읽어 것이 사용된다.
- 열 (약 10 분 또는 뚜껑 생물 안전 캐비닛 오프에서) 약 20 분 동안 열려 뚜껑 실험실 벤치에 단일 층에 배치하여 사전 발광 독서에 마이크로 평형, 온도 관련 가장자리 효과를 방지 할 수 있습니다.
- 나중 시점에서 실시간 판독이 필요한 경우 인큐베이터 마이크로 플레이트 반환한다.
- 기자에 맞게 마이크로 플레이트 루미 및 형광 계에 세균의 성장 및 진핵 세포 독성을 읽어 것이 사용된다.
2. 데이터 분석
- 긍정과 부정 사기꾼에 데이터를 정규화trols는 진핵 세포에 대한 세포 내 세균의 성장과 %의 세포 독성에 대한 퍼센트 접이식 억제를 계산합니다.
- P는 +를 n을 μ μ | 3 (σ p를 + σ n)이 / - 분석 견고성을 평가하기 = 1 'Z 분석 Z-계수 (Z)를'사용하여 박테리아 성장 억제 및 세포 독성 모두 긍정적이고 부정적인 컨트롤 사이의 통계적 거리를 계산 |. 이 식에서, P는 σ 및 σ n은 각각 양성 및 음성 대조군 웰에 대한 표준 편차이다; μ p와 μ N은 각각 양성 및 음성 대조군 웰에 대한 평균 값이다.
- 높은 처리량 스크리닝 분석법을 위해, 관심있는 시험 화합물의 효과를 평가하기 위해, Z 표준 점수 (또는 다른 대안으로서, 정량적 통계 방법)을 계산한다. 또한, 간단한 배 감소를 계산하거나 관련성이 잠재적으로 생리 학적으로 감소 배를 기록 기하학적으로 복제 세균에 대한 효과 크기의 측정.
3. 단일 및 다중 차원 (즉, 시너지) 용량 - 반응 시험 및 자료 해석
- 프로토콜 섹션 1에 설명 된 대 식세포와 박테리아를 준비합니다.
- 직전 감염이나 무균 배양에 (즉, 최소 억제 농도 또는 MIC) 및 낮은에 하이 엔드에 스패닝의 목표로 희석 시리즈를 두 배로, 직렬 완전히 성장을 제거하는 농도를 실험적인 관심의 항균제를 추가 명백한 활동을 보여줍니다 농도를 종료합니다.
- 제조사의 프로토콜에 따라 항균 희석 직접 자동 추가를 통해 단일 용량 - 반응 및 조합 시너지 테스트 셋업을 용이하게하기 위해 자동화 된 액체 핸들링 시스템을 사용한다.
- 예를 들어, 서브 배로 희석하여 사용을 고려841 / 54841eq1.jpg "/> - 희석 시리즈를 접은 분석은 데이터의 정확성과 재현성을 높이기 위해 복제합니다.
- 대식 세포를 감염, 발광 박테리아를 조직 배양 배지에서 2.5 × 106 CFU (콜로니 형성 단위) / ml로 희석 타겟팅. 물론 각 J774A.1 문화, 최종 분석 볼륨 50 μL, 최종 세균 농도 1 × 106 CFU / ㎖로 혼합물의 20 μl를 추가; 100 % 상대 습도 5 %에서 37 ° C에서 CO 2를 배양한다.
- 무균 성장 시험을 위해, AYE 배지에서 1 × 106 CFU / ㎖의 최종 농도 발광 박테리아 희석 384- 웰 플레이트의 각 웰에 50 μl를 추가 5 % CO 2에서 37 ° C에서 부화 100 % 상대 습도.
- 박테리아의 성장을 억제하는 항균 조합 분수 억제제 농도를 지수를 계산한다. 세균 g을 완전히 또는> 99 % 억제를 초래 조합의 각 약물 (A, B,.. N) 미국rowth (FIC A, B를, N...) 각 부분 억제 농도 계산을 다음과 같이 FIC A = 화합물의 농도는 "A"의 최소 억제 농도로 나눈 값을 "A"자체. . 그러면 FIC 조합 인덱스를 계산하거나 등 FIC B를 계산 같은 수식을 사용하여
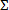 FIC는 FIC의 A + FIC B 형 +를 =. . 각 저해 조합에 대한 .FIC 없음.
FIC는 FIC의 A + FIC B 형 +를 =. . 각 저해 조합에 대한 .FIC 없음. - 시너지 효과를 평가하기 위해 1.0에서 가장 멀리 벗어난 조합 인덱스를 사용합니다. 보수적 인 상승 효과의 표시 및 ≥4, 길항제의 효과로 ≤0.5의 차단을 고려하십시오. (12)
- 플롯은 isobolograms isocontour isobolograms 및 / 또는있는 isosurface는 조합의 효과 (6) 같은 대체 그래픽 표현을 isobolograms.
결과
마이크로 세포 성장 분석
도 1은 분석 단계도이다. 도시 자동화 단계가 수동으로 수행 될 수있다. 그러나, 처리량이 큰 액체 핸들링 시스템을 이용하여 용이하게된다.
도 2는 384- 웰 마이크로 플레이트, 듀얼 판독 실시간 세포 성장 및 (Lp02)은 중 어느 하나...
토론
우리는 세포 내 박테리아의 성장 및 숙주 세포 독성의 동시 검출을위한 실시간 분석을 설명한다. 프로토콜에서 몇 가지 중요한 단계가 있습니다. 첫째, 강력한 분석 성능, 세균 및 세포 독성 판독 사이에 충분한 스펙트럼 분리가 있어야합니다. 이러한 분리는 루시 페라 제 오페론 기자와 형광 DNA 결합 염료의 조합에 대한 고유이다. 그러나, 우리의 경험 (표 1-3,도 2),<...
공개
The authors have nothing to disclose.
감사의 말
이 논문에보고 된 연구 내용은 전적으로 저자의 책임이며 JEK하는 보너스 번호 R01AI099122에서 알레르기 및 국립 보건원 (National Institutes of Health)의 감염증의 국립 연구소에 의해 지원되었다 반드시 국립 연구소의의 공식 견해를 대변하지 않습니다 건강. 우리는 ICCB - 롱 우드의 검사 시설 및 / 또는 국가 검사 실험실을위한에서 제니퍼 스미스, 데이비드 Wrobel, 스와 치앙마이, 더그 홍수, 숀 존스턴, 제니퍼 Nale, 스튜어트 Rudnicki, 폴 연의, 리처드 시우, 레이첼 소장에게 감사의 말씀을 우수의 뉴 잉글랜드 지역 센터 디펜스의 개발과 높은 처리량 심사 분석의 성능을 자신의 도움 (U54AI057159에서 지원) 감염증을 신흥. 우리는 또한 원고에 도움이 의견 케네스 P. 스미스에게 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| J774A.1 cells | American Type Culture Collection | TIB-67 | Host cell |
| ACES | Sigma-Aldrich | A9758 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Yeast extract, ultrafiltered | Becton-Dickinson/Difco | 210929 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; lower grades may cause impaired growth and/or alter sensitivity of Legionella to growth inhibitors |
| Alpha-ketoglutaric acid, monopotassium salt | Sigma-Aldrich | K2000 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Sodium pyruvate | Sigma-Aldrich | P5280 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Potassium phosphate, dibasic | Thermo Fisher Scientific | P288-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| L-cysteine | Sigma-Aldrich | C-7755 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Ammonium iron(III) citrate | Sigma-Aldrich | F5879 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; ferric pyrophosphate may be used instead but is more difficult to weigh accurately |
| Potassium hydroxide solution, concentrated | Thermo Fisher Scientific | SP236-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Deonized water | N/A | N/A | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Thymidine (tissue culture grade) | Sigma-Aldrich | T1895 | For supplementing both RPMI 1640 and buffered yeast extract agar/medium — lower grade thymidine may be used for the latter, but may cause impaired cell growth and/or cell death in RPMI 1640 |
| RPMI 1640, standard formulation | Corning via Thermo Fisher Scientific | 10-040-CV | For growing J774A.1 cells prior to plating; includes 2 mM L-glutamine |
| RPMI 1640 lacking phenol red | Corning via Thermo Fisher Scientific | 17-105-CV | For plating J774A.1 cells in 384 well dishes (not suitable for growth prior to plating); also lacks L-glutamine — supplement to 2 mM before use |
| L-glutamine, 200 mM in 0.85% NaCl (tissue culture grade) | HyClone via Thermo Fisher Scientific | SH30034.02 | For supplementing RPMI 1640 lacking L-glutamine, to 2 mM final concentration |
| Iron-supplemented calf serum | Gemini Bioproducts | 100-510 | For supplementing RPMI 1640, to 9.1% final concentration |
| Trypan Blue solution | Sigma-Aldrich | T8154 | For staining for J774A.1 cell death determination while counting cell density |
| SYTOX Green, 5 mM solution in DMSO | Thermo Fisher Scientific | S7020 | For staining for J774A.1 cell death determination by fluorescence reading or epifluorescence microscopy (in conjunction with orange-red or far red fluorescent bacteria). Use at 125 nM final concentration. |
| Cell culture incubator | Thermo Fisher Scientific | 13-255-26 | For incubation of J774A.1 cells (both before and after infection); can also be used for incubation of bacteria, or a standard atmosphere incubator can be used instead) |
| Orbital shaker | BellCo Glass | 7744-01010 | For shaking incubation of J774A.1 cells before infection; fits inside cell culture incubator; includes shaker base 7744-01000 and tray 7740-01010 (these are also available separately) |
| Shaker flasks (250 ml) | ChemGlass Life Sciences | CLS-2038-04 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (250 ml) | BellCo Glass | 7744-16250 | For shaking incubation of J774A.1 cells before infection |
| Shaker flasks (1,000 ml) | ChemGlass Life Sciences | CLS-2038-07 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (1,000 ml) | BellCo Glass | 7744-16100 | For shaking incubation of J774A.1 cells before infection |
| Sponge foam caps for flasks (250 ml-1,000 ml) | ChemGlass Life Sciences | CLS-1490-038 | For shaking incubation of J774A.1 cells before infection; reduces risk of contamination relative to standard metal caps |
| MultiDrop Combi programmable multichannel peristaltic pump | Thermo Fisher Scientific | 5840300 | For dispensing J774A.1 cells, medium, and bacterial suspension containing fluorophores to large numbers of 384 well dishes |
| Combi standard bore manifold | Thermo Fisher Scientific | 24072670 | Default predispense volume of 20 μl is insufficient to compensate for settling — increase to 80 μl |
| White 384 well dishes treated for tissue culture | Corning | 3570 | For reading luminescence and fluorescence; Greiner catalog # 781080 also tested successfully |
| DMSO (tissue culture grade, in sealed ampoules) | Sigma-Aldrich | D2650 | For dissolving positive control and test compounds |
| Azithromycin | Sigma-Aldrich | PHR1088 | Antibiotic positive control |
| Saponin (from Quillaja bark) | Sigma-Aldrich | S-4521 | Cytoxicity positive control |
| Multichannel pipettor | Thermo Fisher Scientific | Finnpipette | For transfer of fixed amounts of positive control compounds; pipettor must have digital dispensing with detents to enable repetitive fixed volume dispensing |
| Epson pin transfer robot | Epson/ICCB-L | (Custom equipment) | For transfer of fixed amounts of test compounds from library arrays |
| D300 digital dispensing system | Hewlett-Packard via Tecan | D300 | For transfer of variable amounts of test compounds ranging from 11 picoliters to 10 µl |
| T8+ cartridges for D300 digital dispensing system | Hewlett-Packard via Tecan | T8+ | For dispensing test compounds |
| Epifluorescence microscope with computer-connected digital camera | Nikon | Ti | For live cell imaging; any standard fluorescent microscope can substitute, with phase contrast or DIC optics, capable of imaging green (fluorescein), orange-red to red (Texas Red), and far-red (Cy5) fluorescence, with 100X oil objective for highest resolution |
| Glass-bottom tissue culture dishes | MatTek Corporation | P35G-1.5-20-C | For live cell imaging. Dishes such as the MatTek allow microscopic visualization at 600X or 1,000X magnification through use of an inverted epifluorescent or confocal microscope. These specific dishes are 3.5 cm nominal diameter, 3.3 cm inside diameter, with 20 mm diameter #1.5 thickness cover slips inserted into the bottoms. |
| Photoshop CS6 | Adobe | Adobe photoshop or similar programs can be used to pseudocolor and merge light microscopic and fluorescent images. | |
| Mathematica 10 | Wolfam | For generation of two-dimensioonal isocontour isobolograms and three-dimensional surface isobolograms. |
참고문헌
- Garzoni, C., Kelley, W. L. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 17 (2), 59-65 (2009).
- Rosen, D. A., et al. Utilization of an intracellular bacterial community pathway in Klebsiella pneumoniae urinary tract infection and the effects of FimK on type 1 pilus expression. Infect Immun. 76 (7), 3337-3345 (2008).
- Blango, M. G., Mulvey, M. A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics. Antimicrob Agents Chemother. 54 (5), 1855-1863 (2010).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay Drug Dev Technol. 12 (4), 219-228 (2014).
- Edelstein, P. H. Antimicrobial chemotherapy for legionnaires' disease: a review. Clin Infect Dis. 21 Suppl 3, S265-S276 (1995).
- Chiaraviglio, L., Kirby, J. E. High-Throughput Intracellular Antimicrobial Susceptibility Testing of Legionella pneumophila. Antimicrob Agents Chemother. 59 (12), 7517-7529 (2015).
- Pedro-Botet, L., Yu, V. L. Legionella: macrolides or quinolones?. Clin Microbiol Infect. 12 Suppl 3, 25-30 (2006).
- Coers, J., Vance, R. E., Fontana, M. F., Dietrich, W. F. Restriction of Legionella pneumophila growth in macrophages requires the concerted action of cytokine and Naip5/Ipaf signalling pathways. Cell Microbiol. 9 (10), 2344-2357 (2007).
- Chu, J., et al. Non-invasive intravital imaging of cellular differentiation with a bright red-excitable fluorescent protein. Nat Methods. 11 (5), 572-578 (2014).
- Eliopoulos, G. M., Moellering, R. C., Lorian, V. Ch. 9. Antimicrobial combinations. In: Antibiotics in Laboratory Medicin. , 330-396 (1996).
- Jones, R. E., Zheng, W., McKew, J. C., Chen, C. Z. An alternative direct compound dispensing method using the HP D300 digital dispenser. J Lab Autom. 18 (5), 367-374 (2013).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. J Antimicrob Chemother. 52 (1), (2003).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9 (10), 1005-1012 (2012).
- Berger, K. H., Merriam, J. J., Isberg, R. R. Altered intracellular targeting properties associated with mutations in the Legionella pneumophila dotA gene. Mol Microbiol. 14 (4), 809-822 (1994).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol Microbiol. 7 (1), 7-19 (1993).
- Vogel, J. P., Isberg, R. R. Cell biology of Legionella pneumophila. Curr Opin Microbiol. 2 (1), 30-34 (1999).
- Kirby, J. E., Isberg, R. R. Legionnaires' disease: the pore macrophage and the legion of terror within. Trends Microbiol. 6 (7), 256-258 (1998).
- Kirby, J. E., Vogel, J. P., Andrews, H. L., Isberg, R. R. Evidence for pore-forming ability by Legionella pneumophila. Mol Microbiol. 27 (2), 323-336 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279 (5352), 873-876 (1998).
- Song, H., Fares, M., Maguire, K. R., Sidén, A., Potácová, Z. Cytotoxic Effects of Tetracycline Analogues (Doxycycline, Minocycline and COL-3) in Acute Myeloid Leukemia HL-60 Cells. PLoS ONE. 9 (12), e114457 (2014).
- Isberg, R. R., Falkow, S. A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12. Nature. 317 (6034), 262-264 (1985).
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opin Drug Discov. 3 (6), 655-669 (2008).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr Chem Genomics. 3, 33-41 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr Opin Pharmacol. 9 (5), 580-588 (2009).
- Dunlap, P., Thouand, G., Marks, R. Biochemistry and genetics of bacterial bioluminescence. Bioluminescence: Fundamentals and Applications in Biotechnology - Volume 1. 1, 37-64 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유