Method Article
칼슘 염료를 개구부 신경 절편에 삽입하기 : 신경 개구부를 통해 개구리 신경 근육 계통에서 칼슘 과도 등록
요약
여기에서는 칼슘에 민감한 염료를 개구리 신경 그루터기를 통해 신경 종말로 삽입하는 방법을 설명합니다. 우리는 또한 말초 신경 말단에서 빠른 칼슘 과도 현상의 기록과 분석을위한 프로토콜을 제시합니다.
초록
시냅스 전 신경 말단에서 시냅스 전 칼슘 농도를 측정하는 가장 실현 가능한 방법 중 하나는 광학 기록입니다. 이것은 세포 내 자유 칼슘 농도에 따라 방출 강도 또는 파장을 변화시키는 칼슘 - 민감성 형광 염료를 사용하는 것을 기본으로합니다. 칼슘 염료로 세포를 얼룩지게하는 데 사용되는 몇 가지 방법이 있습니다. 가장 일반적으로 마이크로 피펫을 통해 염료를 로딩하거나 염료의 아세 톡시 메틸 에스테르 형태로 사전 배양하는 과정이 일반적입니다. 그러나 이러한 방법은 발생하는 방법 론적 문제로 인해 신경근 접합부 (NMU)에 적용 할 수 없습니다. 이 기사에서는 칼로리 감수성 염료를 개구리 신경의 개구리 신경 그루터기를 통해 신경 종말로 삽입하는 방법을 제시합니다. 신경 말단에 외부 칼슘이 들어가고 칼슘 염료에 결합하는 것이 밀리 초 단위로 발생하기 때문에 빠른 상호 작용 시스템을 사용하여 이러한 상호 작용을 기록 할 필요가 있습니다ns. 여기에서는 빠른 CCD 카메라로 칼슘 과도 현상을 기록하기위한 프로토콜에 대해 설명합니다.
서문
칼슘 이온 (Ca 2+ )은 중개자 방출 1 , 2 , 3 , 4 , 5 의 개시, 유지 및 가소성을 포함하여 많은 연결 신호 과정에 참여합니다. 활동 전위가 도달하면, 세포 외 칼슘 2+ 는 신경 말단에 들어가고 신경 전달 물질 방출을 시작합니다. 일부 시냅스에서 칼슘 전류는 전기 생리 학적 방법으로 직접 측정 할 수 있습니다 6 , 7 , 8 . 신경근 접합부 (NMJ)의 경우 신경 말단의 미세한 크기 때문에 직접 패치 클램프와 2 전극 전압 클램프 기술을 사용할 수 없습니다.
NMJ의 신경 말단에서 내부 칼슘 2+ 전류의 기록은 간접 전기iological 방법 9 , 10 . 그러나, 이러한 방법은 나트륨 및 칼륨 이온 채널 차단제에 의한 시냅스의 전처리가 필요합니다. 광학적 방법은 신경 말단의 이온 전류를 약리학 적으로 분리 할 필요가 없으며, 활동 전위에 의해 유발 된 칼슘 이온 + 유입의 기록을 허용하고, 칼슘 이온 (axoplasm) 11 , 12 , 13 , 14 의 칼슘 이온의 상승을 허용한다. 이 방법은 자유 Ca 2+ 이온 15 , 16 , 17 , 18 , 19 의 결합시 특정 Ca 2+ 감응 염료의 형광 변화를 기록한 것입니다.
칼슘 2 + 지시약을 C에 넣을 수 있습니다.실험의 목적에 따라 다양한 방법으로 나타납니다. 연구원은 멤브레인 투과성 염료 형태 20 , 21 , 패치 피펫 22 또는 마이크로 인젝션 23 , 24 , 25 를 통해로드하는 욕조 응용을 사용합니다. 그러나 이러한 모든 방법들은 시냅스 건축가의 특이성 때문에 NMJ의 경우 약간의 제한이있다. NMJ의 경우, 가장 편리하고 성공적인 방법은 염색제를 신경 그루터기에 넣는 것, 전방 채움 방법 26 , 27 , 28 , 29 입니다. 이 기술은 말초 신경 종말에 다양한 형광 염료를로드하는 데 사용할 수 있습니다. 이 방법은 Drosophila 신경 말단 28 , 도마뱀 운동 신경28 ) 및 개구리 모터 신경 터미널 ( 17 , 26 , 27 , 30)을 포함한다 . 연구 대상에 따라 체계적인 세부 사항이 다를 수 있습니다. 유리 마이크로 피펫은 애벌레 28의 작은 신경에 사용할 수 있습니다. 몇몇 연구자들은 근육을 신경 주입하는 신경 끝이 염료로 미리 채워진 우물에 잠겨있는 방법 27 , 28 을 기술했다. 염료를 담그기 위해 몇 시간 동안 방치한다. 염료는 축색 돌기에 흡수되어 신경 말단으로 옮겨집니다. 이 논문에서는 개구리 모터 신경 말단에 형광 표시기를 삽입하는 방법을 설명한다. 우리의 프로토콜은 염료와 조직의 부화를 위해 플라스틱 피펫 팁을 사용합니다. 우리는 또한 칼슘 2 + 형광 트랩을 수집하고 분석하는 방법을 설명합니다nsients.
프로토콜
실험은 Rana ridibunda 개구리의 근육 피부 피질 의 고립 된 신경 근육 조제에 수행되었다. 두 성별 동물의 크기는 약 5-9 cm이었다. 실험 절차는 카자흐 연방 대학교 (Kazan Federal University) 및 카잔 의대 (Kazan Medical University) 실험실 동물의 사용 및 관리에 관한 NIH 지침에 따라 수행되었습니다. 실험 프로토콜은 유럽 공동체위원회 지침 86 / 609 / EEC의 요구 사항을 충족했으며 카잔 의과 대학 윤리위원회의 승인을 받았습니다.
1. 솔루션 준비
- 링거 용액 준비.
- 링거 용액을 준비하십시오 : 113.0 MM NaCl, 2.5 MM KCl, 3.0 MM NaHCO 3 및 1.8 MM CaCl 2 . pH를 7.2-7.4로 조정하십시오.
- 낮은 Ca 2+를 가지고 링거 용액을 준비한다. + 함량 : 113.0 mM NaCl, 2.5 mM KCl, 3.0 mM NaHCO3, 6.0 mM MgCl2, 0.9 mM CaCl2. pH를 7.2-7.4로 조정하십시오.
- 염료 - 로딩 용액의 제조.
- HEPES-Na가 함유 된 수성 용액을 10 mM (pH 7.2-7.4)로 준비한다.
- 염료 30 와 유리 병에 HEPES 솔루션 14 μL를 추가합니다.
참고 : Ca 2+ 지시약 염료는 분말 500 μg이 들어있는 500 μL 바이알에 들어 있습니다. - 소용돌이 치고 완전히 스핀 다운 믹스.
- 용액을 희석하여 Ca 2 + 지시약의 최종 농도를 30 mM로 낮추십시오. 빛에 노출시키지 않고 -20 ° C에서 보관하십시오.
2. 염색 로딩 절차
- pectoralis proprius 신경 조각으로 피부 pectoris 근육을 해부.
참고 : 해부 절차를 사용할 수 있습니다.Blioch 등 이 무료로 다운로드 할 수 있습니다. , 1968 31 .- 해부 절차 들어, 두 개의 미세한 집게와 각막 가위를 사용합니다 ( 재료 표 참조). 해산 된 조직을 실리콘 엘라스토머로 코팅 된 페트리 접시에 옮기고 링거 용액으로 채우고 미세한 스테인레스 스틸 핀으로 티슈를 고쳐서 접시에 약간 펴십시오.
- 페트리 접시를 링거 용액의 신선한 분액으로 다시 채우십시오. 결합 조직을 제거하십시오. 신경을 손상시키지 마십시오.
- 충전 용 피펫을 준비하십시오 : 면도날을 사용하여 표준 플라스틱 10 μL 피펫 팁의 원뿔 부분의 ~ 2 mm 길이 조각을 잘라냅니다.
- 페트리 접시에 채우는 피펫을 마운트하는 모델링 점토의 조각을 준비합니다.
- 피펫 팁으로 만든 실리콘 튜빙과 플라스틱 연결 어댑터를 통해 플라스틱 주사기에 채우기 피펫의 뒷면을 연결하십시오.
- 전에너희 절차를로드, 플라스틱 피펫을 사용하여 페트리 접시에서 링거의 솔루션을 제거합니다. 미세 주사기를 사용하여 근육 - 신경 준비를 건조; 이것은 채우는 피펫의 후속 적재시 Ca 2+ 염료의 희석을 방지합니다.
- 냉동실에서 Ca 2+ 지시약 병을 꺼내 어두운 곳에서 실온에서 해동 시키십시오.
- 저배율 (10 배)의 입체 현미경 제어하에 근육과 신경 사이의 교차점을 감지합니다. 미세 핀셋과 가위로 근육 표면 가까이에 가슴 지느러미 신경을 자릅니다 (2.1 단계 참조). 약 2mm 길이의 신경 그루터기를 남겨주세요.
- 모델링 점토를 사용하여 페트리 접시에 튜빙과 주사기에 첨부 된 채우는 피펫을 수정.
- 피펫의 끝을 신경 그루터기 가까이에 놓습니다.
- 그것을 꼬집지 않고 부드럽게 피펫의 끝 부분에 신경 그루터기를 대기음.
- 블런 (blun)에서 흡입 튜빙을 제거하십시오.필링 피펫의 끝.
- 긴 바늘이있는 주사기를 사용하여 주입 피펫에서 과잉 용액을 조심스럽게 제거하십시오 ( 재료 표 참조). 신경 그루터기를 끼지 마십시오.
- 수직으로 팁에 흡인 된 신경 그루터기를 유지하면서 약간 채우는 피펫의 팁을 올리십시오.
- 석유 젤리를 사용하여 채우기 피펫 팁의 외부에서 신경 그 루터 기의 흡입 부분을 보온하십시오.
- 필요하면 필링 피펫에서 단열 된 신경 그루터기를 말라. 긴 바늘이있는 주사기를 사용하여 필링 피펫에서 과량의 용액을 부드럽게 뽑아냅니다.
- 긴 피펫 팁이있는 피펫을 사용하여 염료 로딩 용액 (0.5 단계)을 그립니다 (1 단계 참조).
- 부드럽게 충전 피펫으로 로딩 솔루션과 피펫 팁을 삽입합니다. 혼합물을 신경 그루터기로 직접 꺼내십시오.
- 석유 젤리로 채우는 피펫의 열린 끝 부분을 봉인하십시오.
- 링거 스의 작은 분량을 더한다.준비가 젖은 유지 페트리 접시에 olution.
- 어두운 온도와 습도 조건에서 실온에서 5 시간 동안 준비물을 품는다.
- 로딩 용액으로 채우는 피펫을 제거하고, 링거 용액으로 조제 물을 헹구고 8 ° C에서 밤새 냉장고에 보관하십시오.
3. 현미경 검사를위한 조직 준비
- 준비를 실리콘 엘라스토머로 코팅 된 챔버에 넣고 스틸 마이크로 바늘로 고정시켜 약간 늘어지게합니다.
- 신선한 링거 용액의 분액과 함께 조직을 씻어.
- 흡입 전극을 사용하여 신경을 자극하십시오. 전극의 구조는 Kazakov 등 이 논문을 무료로 다운로드하면 얻을 수 있다. , 2015 32 . 전극 팁을 신경의 절단 끝과 가깝게 위치시키고 전극 구멍으로 신경 그루터기를 대기음하십시오.
- 현미경 스테이지에 준비 챔버를 장착하십시오. Place 온도 프로브 및 챔버의 입구 및 출구 발화.
- Peltier 요소에 전원 코드를 연결하십시오.
- 준비를 씻어 내려면 간단한 중력 중심 시스템을 사용하십시오. 초과 용액을 제거하려면 관류 흡입 펌프를 켜십시오.
- 온도 컨트롤러 유닛을 켭니다.
- 온도 조절기를 20 ° C로 설정하십시오.
- 자외선 차단 장치를 설치하십시오.
- 전기 자극기에 자극 와이어 전극을 연결하고 4X 객관적인 렌즈와 현미경으로 근육 수축을 관찰.
- 낮은 Ca 2+ 및 높은 Mg 2+ 함량의 링거 용액으로 관류 시스템을 채우십시오.
참고 :이 솔루션은 근육 수축을 방지하는 데 사용됩니다. 외부 칼슘 농도의 감소와 외부 마그네슘의 상승은 칼슘 이온 과도 변화의 진폭 감소를 초래한다. 그러나, 이전의 경험에 기초하여 0.9 mM CaCl 2 및 6 mM MgCl 2 는 여전히 Ca 2+ 과도 현상의 진폭을 안정적으로 해결하기에 충분합니다. 예를 들어 니코틴 성 아세틸 콜린 수용체의 특정 차단제 인 d-tubocurarine 또는 alpha-bungarotoxin을 사용하면 근육의 경련을 완전히 또는 부분적으로 차단할 수 있습니다 그러나, 이러한 독소의 첨가는 또한 시냅스 전의 칼슘 섭취에 영향을 줄 수 있습니다 33 . 이를 피하기 위해 μ-conotoxin GIIIA를 사용할 수 있습니다 27 . - 펌프를 켜고 저 Ca 2+ 및 고 Mg 2+ 가 포함 된 Ringer 용액으로 조제약의과 주입을 시작하십시오.
- 현미경으로 40x 대물 렌즈로 전환하십시오.
- 스위치 켜기 그는 단색화 자입니다 ( 재료 표 참조).
- 모노 크로 메터 제어 소프트웨어에서 방출 파장 488 nm와 연속 조명 모드를 선택하십시오.
- 형광 모드에서 높은 배율에서, 신경 터미널은 염료와 함께로드되었는지 확인하십시오.
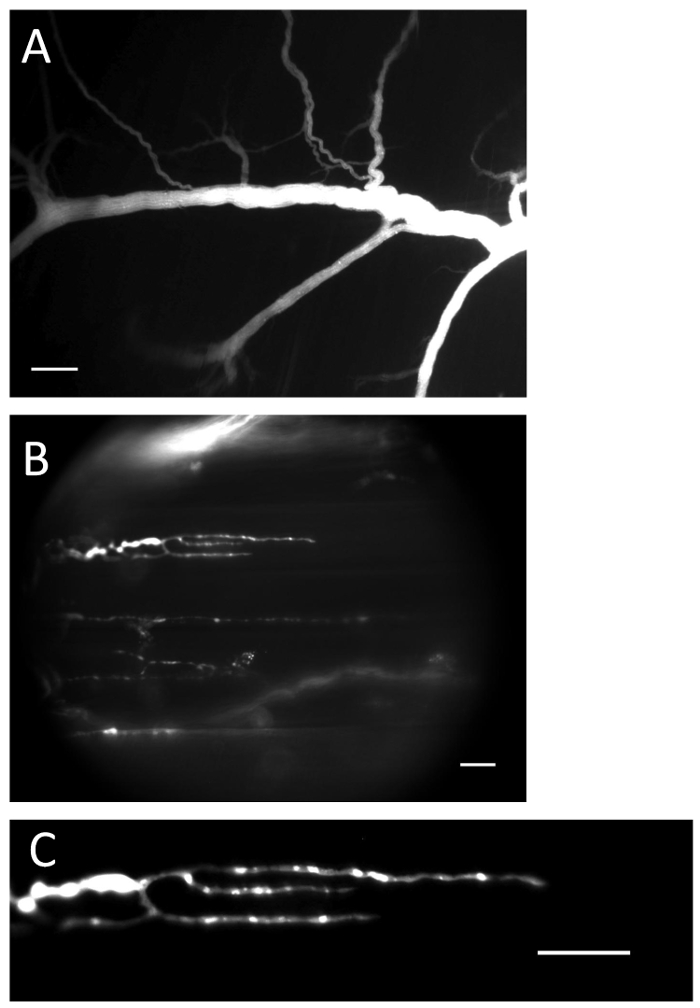
그림 1 :로드 된 칼슘 2 + 표시기가있는 신경과 말단. ( A )로드 절차 후 Ca 2+ 지시약으로 채워진 신경. 스케일 바 = 200 μm. ( B ) 칼 2 + 표시기로 가득한 신경 엔딩. 스케일 바 = 20 μm. ( C ) Ca 2+ - 지시자 형광은 신경 종결에서 분명하게 보인다. 스케일 바 = 20 μm._blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
- Ca 2+ 및 Mg 2+ 가 낮은 용액에서 30 분 이상 평형을 유지하도록한다.
4. 디지털 CCD 카메라로 영상 캡쳐
참고 : 형광 신호 캡처에 대한 자세한 내용은 각 현미경 및 카메라 유형에 따라 다르지만 핵심 고려 사항은 이미지 캡처 속도입니다.
- NMJ에서 단일 칼슘 2+ 과도 전류의 기록을위한 최소 포착 주파수로 1 kHz를 사용하십시오.
참고 : 빠른 디지털 CCD 카메라는 형광 이미징에 필요합니다 ( 재료 표 참조). 데이터 수집 시스템과 소프트웨어 ( Table of Materials 참조)는 카메라, 모노 크로 미터 및 자극 장치의 동기화에 사용되었습니다. 요컨대,이 프로토콜은 데이터의 디지털 출력에 동기화 펄스를 생성 할 수있게합니다획득 시스템을 사용하여 셔터를 열고, 비디오 신호를 캡처하고, 자극을 시작합니다. 모든 시간 파라미터는 프로토콜 및 / 또는 장치에서 설정 될 수있다. 일반적인 프로토콜은 1 kHz (80 x 80 픽셀)에서 수집 된 일련의 500 프레임입니다. 여기 광으로 조명하면 Ca 2+ 지시약이 표백되고 세포 조직이 광 손상 될 수 있습니다. 따라서, 여기 광에 장시간 노출되는 것을 피하십시오. 이 프로토콜에서 셔터는 비디오 캡처에 필요한 시간 동안 만 열립니다. 특정 신경 말단 당 20 개의 시리즈를 획득하십시오. 여기에서 목표는 대조군과 약물 전달 후 동일한 부위를 모니터링하는 것입니다. - 현미경의 4X 대물 렌즈 아래에서 밝은 영역 정권을 사용하여 근육과 신경 가지를 시각화합니다.
- 40X 객관적인 렌즈로 전환하고, epifluorescence 정권과 488 nm의 여기 파장을 사용하여, 염료로드 신경 끝을 검색합니다. 관심의 신경 끝 부분을 확인하십시오.
- 삼안경에현미경, 빛 경로 교환 레벨을 선택하십시오 : 카메라에 100 % 빛.
- CCD 카메라의 수집 소프트웨어를 시작하십시오.
- "라이브"모드에서 ROI를 찾고 초점을 조정하십시오.
- "변경"메뉴를 선택하십시오.
- "기본 구성"은 초당 1,000 프레임 (fps), 해상도는 80 x 80입니다.
- 입력 프레임 수를 500으로 설정하십시오.
- 실험의 이름을 입력하십시오.
- "외부 트리거"를 선택하십시오.
- 사전 트리거 시간을 10ms로 설정하십시오.
- 반복 횟수를 20으로 설정하십시오.
- 모노 크로 메타 컨트롤 소프트웨어에서 488 nm의 방출 파장과 "외부 트리거 조명"모드를 선택하십시오.
- 데이터 수집 소프트웨어를 실행하십시오.
- 자극 프로토콜을로드하십시오.
- 비디오를 레코딩하기 전에 비디오 수집 소프트웨어를 사용하여 어두운 프레임을 캡처하십시오.
- 자극 프로토콜을 실행합니다.
- ROI 및 chec 선택k 녹음 된 신호.
5. 데이터 분석
참고 : 데이터 분석을 위해 CCD 카메라 소프트웨어와 ImageJ를 사용하십시오. 데이터는 스프레드 시트 프로그램에서 곡선으로 표시됩니다. CCD 카메라 소프트웨어에서 평균 20 회 반복하여 결과를 ImageJ 지원 파일로 내 보냅니다. ImageJ에서 ROI와 배경을 선택하십시오. ROI에서 배경을 뺍니다. 비율 (ΔF / F 0 -1) x 100 %로 데이터를 표시하십시오. 여기서 ΔF는 자극 중 형광 강도이고 F 0 는 휴지시 형광 강도입니다.
- CCD 카메라 수집 소프트웨어에서 파일> 평균 파일을 클릭하십시오. 파일을 선택하고 평균을냅니다.
- "평균으로 저장"을 클릭하여 평균 파일을 .fit 파일로 저장하십시오.
- ImageJ 소프트웨어를 실행하십시오. 다음 단계를 수행하십시오.
- 이미지> 조정> 밝기 / 대비를 클릭하십시오.
- 이미지> 스택> 도구>; 스택 분류기.
- 분석> 도구> ROI 관리자를 클릭하십시오.
- 평균화 된 .fit 파일을 ImageJ 창으로 끌어 놓습니다.
- 더 나은보기를 위해 창을 확대하십시오.
- 커서를 움직여 마지막 프레임을 선택하고 삭제합니다 (이것은 어두운 프레임 임).
- 배경으로 여겨지는 영역의 직사각형 ROI를 선택하십시오. ROI 관리자에 추가하십시오.
- 추가> 다중 측정을 클릭하여 배경을 측정하십시오. 평균에 유의하십시오. 데이터를 복사하여 스프레드 시트 프로그램으로 내 보낸 다음 비율에 대한 임계 값의 평균값을 계산합니다.
- Process> Main> Subtract를 클릭하여 스택에서 임계 값을 뺍니다. 임계 값의 평균값을 입력하십시오.
- 신경 터미널 주변의 직사각형 ROI를 선택하십시오. ROI 관리자에 추가하십시오.
- More> Multi Measure를 클릭하여 측정하십시오. 평균에 유의하십시오. 스프레드 시트 프로그램으로 복사하여 내 보냅니다.
- 신호의 평균 오프셋.
참고 :자극없이 기본 염료 형광을 시연하는 처음 수십 포인트; 이것은 휴식 상태의 형광입니다. - 신호를 나머지 형광으로 나눕니다.
- "1"을 빼고 100 %를 곱하십시오.
- 신호를 플롯하고 Ca 2+ 과도 현상의 진폭을 계산하십시오.
결과
염료 로딩과 운동 신경 자극 후 형광 신호 (Ca 2+ 과도 현상)의 진폭이 신경 말단에서 감지 될 수 있습니다 ( 그림 2 참조). Ca 2+ 과도 현상의 매개 변수가 표 1 에 나와 있습니다. 정량적으로, 본 연구에서 측정 된 Ca 2+ 과도 현상의 매개 변수는 냉혈 동물의 시냅스에서 다른 과학자들이 얻은 데이터에 가깝다. Ca 2+ 과도 현상의 매개 변수는 Ca 2+ 와 염료의 결합 속도와 그 후의 해리에 달려있다. Ca 2+ 가 신경 종결에 들어가는 속도, 염료와의 상호 작용 및 세포질 내 확산은 모두 Ca 2+ 과도 현상의 상승 시간에 영향을 미친다. 형광 신호의 감쇠 시간은 염료의 친 화성,세포 내 완충액과의 Ca 2+ 상호 작용 및 이온 펌프에 의한 제거 35 . Ca 2+ 과도 현상의 진폭 분석은 신경 전달 물질 방출에 참여하는 칼슘 입구에 다양한 물질의 영향을 연구하는 데 사용될 수 있습니다 33 .

그림 2 : 평균 Ca 2+ 과도는 개구리 NMJ에서 측정. 칼슘 2+ 과도 현상은 13 마리의 개구리 NMJ 신호의 평균을 기준으로 계산되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 피크ΔF / F (%) | 상승 시간 20 % -80 % (ms) | τ (ms) |
| 12.6 ± 1,1 (n = 13) | 4.6 ± 0.5 (n = 13) | 115.3 ± 8.3 (n = 13) |
표 1 : Ca 2+ 과도 현상 의 평균 매개 변수 . 데이터는 평균 ± SE로 표시됩니다. n은 별개의 NMJ에서 측정 한 횟수입니다. 피크 ΔF / F는 ΔF / F의 평균 진폭입니다.
토론
이 논문에서 우리는 신경 단단을 통해 개구리 신경 종말에 칼슘 2 + 감응 염료 로딩을 수행하는 방법을 제시했다. 적재 절차가 끝날 때까지 신경 근위 부분의 모든 말단에는 상당한 형광 수준이 있습니다. 프로브의 내부 - 말단 농도는 40 ~ 150 μM 사이 인 것으로 추측됩니다.
배양 과정은 두 단계로 진행됩니다 : 실온에서, 그리고 냉장고에서 더 낮은 온도에서. 상온에서 염료로 조직 배양 시간을 조절하는 것이 중요합니다. 신경 그루터기의 실제 길이, 특정 염료 및 온도에 따라 잠복기 시간이 다를 수 있습니다. 과다 노출되면, 신경 그루터기에 가까운 근위부의 터미널에 과부하가 걸릴 수 있습니다. 그러나 신경의 중간 부분에서, 만족스럽게로드 된 터미널을 찾을 수 있습니다. 동안냉장고에 장기간 배양하면 염료가 신경 종말에 고르게 분포합니다.
우리 자신의 관찰 33 , 35 및 다른 연구자 30 의 데이터는 postsynaptic response의 진폭이나 소형 end-plate 전위의 빈도에 대한 적재 절차의 감지 할 수없는 영향력이 없음을 증명합니다. 좋은 장수는 적재 된 준비에 문서화되었습니다. 우리가 주목하고 싶은 몇 가지 중요한 점이 있습니다. 염료가 절단 된 신경의 축삭으로 들어갈 수 있도록 절개 한 후 몇 분 안에 염료 로딩 용액에 신경 그루터기를 놓는 것이 매우 중요합니다. 지연은 아마도 신경 axons의 resealing로 인해, 효과가로드를 일으킬 수 있습니다 27 , 36 . 일부 연구자들은 100 mM EDTA (Ca 2+ - 및 Mg 2+ - 쉐이핑 제)에 신경 그루터기를 담그고) 절단 axons가 resealing에서 방지하기 위해 신경 excision 직후. 완충제는 1-2 분 후에 제거되고 염료 로딩 용액으로 교체된다. 적재 절차를 위해 플라스틱 튜빙 대신에 석유 젤리를 사용하면 더 짧은 신경 덩어리를 사용할 수 있습니다. 이 접근법을 사용하는 동안, 그것은 염료와 HEPES 솔루션에 잠겨있는 후 절단하고 axons은 염료 솔루션 27,28 에서 2가 이온의 부족 때문에 reseal하지 않습니다.
우리 연구에서 우리는 덱스 트란 대신 Ca 2+ 지시약의 수용성 소금 형태를 사용했다. 덱스 트란 접합체는 염 형태보다 축삭에서 더 천천히 퍼진다. 그러나, 덱스 트란 접합체의 사용은 신경 및 NMJ에 의한 염료 구획화 및 취급을 감소시킨다. 칼슘 녹색 1-3,000 MW 덱스 트란 접합체는 우수한 확산 속도를 가지며 감소 된 구획화를 보여줍니다 up class = "xref"> 38.
장기간의 형광등 조명을 피하는 것은 건강과 생존에 영향을주기 때문에 매우 중요합니다. 우리는 신경 터미널을 검색하기 위해 가시 광선 채널에서 노말 스키 광학을 사용합니다. 녹음하는 동안 우리는 조리개를 사용하여 조명 된 필드를 제한합니다.
이 로딩 방법은 오랫동안 잠복기를 견딜 수있는 준비에만 적합하다는 것이 주목됩니다. 연구가 더 연약한 조직 ( 예 : 온혈 동물의 시냅스)에서 수행 될 때 염료 로딩 시간을 줄이려면 신경 그루터기 길이를 줄이고 적재를 위해 마이크로 피펫을 사용해야합니다.
이 로딩 기술은 단일 신경 자극 및 리듬 시냅스 활동 모두에서 형광 표시기가있는 세포질 Ca 2+의 변화를 영상화하는 데 적합합니다ef "> 17 , 27 , 35. Ca 2+ 과도 현상 진폭 분석은 신경 전달 물질 방출에 관여하는 칼슘 유입에 대한 다양한 물질의 영향을 연구하는데 사용될 수있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 카자흐 연방 대학교의 경쟁력있는 성장을위한 러시아 정부의 프로그램과 러시아 연구 기초 연구 (16-04-01051; 16-34-00817; 15-04-02983)에서 수행되었습니다. 원고 초안 초안에 도움이되는 의견을 제공 한 4 명의 익명 심사 위원에게 감사드립니다. 음성 녹음을 위해 Yuliya Aratskaya에게 감사의 말을 전합니다. 빅토르 일린 (Victor Ilyin) 박사에게 많은 도움이되는 의견과 필사본 편집에 대한 도움을 주신 데 대해 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
참고문헌
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release?. Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P., Gregory, J. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. , 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G., Yuste, R., Konnerth, A. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. , 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유