Method Article
세포 외 기질의 Glycoproteomics : 질량 분석을 사용하여 본래 글리코 펩타이드 분석을위한 방법
요약
이 논문은 ECM 단백질 조성물 (1) 분석, 글리코 실화 부위 (2)의 식별 및 당쇄 형태 (3)의 조성 특성을 허용 MS 분석 심혈관 조직 샘플을 제조하는 방법을 설명한다. 이 방법은 다른 조직의 ECM의 연구에, 약간의 수정으로 적용 할 수 있습니다.
초록
섬유증 많은 심혈관 질환의 특징이고, 세포 외 기질 (ECM)의 악화 된 분비 및 증착과 관련된다. 사용 단백질 체학, 우리는 이전에 150 개 이상의 ECM을 확인하고 심장 혈관 조직에서 단백질을 ECM은 관련. 특히, 많은 ECM 단백질은 당화된다. 이러한 번역 후 변형은 단백질 폴딩, 용해도, 결합 및 분해에 영향을 미친다. 우리는 이후 액체 크로마토 그래피 탠덤 질량 분석법 본래의 글리코 펩타이드 (LC-MS / MS) 분석과 호환 ECM 단백질에 대한 연속 추출 및 농축 방법을 개발 하였다. 전략은 ECM 단백질의 가용화 용 티슈 탈세 포화 및 염산 구아니딘 염화나트륨, SDS 순차적 배양에 기초한다. LC-MS / MS에서의 최근 발전은 있도록 높은 에너지 충돌 해리의 조합 (HCD)와 전자 전달 해리 (ETD)로서 분할 방법을 포함ECM 단백질의 글리코 펩타이드의 직접 조성 분석. 본 논문은 조직 샘플로부터의 ECM을 제조하는 방법을 설명한다. 이 방법은 단백질 프로파일뿐만 아니라 MS 분석에 의한 평가와 글리코 실화의 특성화를 허용 아닙니다.
서문
섬유증은 많은 질병의 특징입니다. 섬유 아세포 증식 및 세포 외 기질 (ECM) (1)의 악화 된 분비 및 증착과 관련된 높은 합성 표현형으로 분화. 과도한 ECM 증착 기능 손상으로 이어지는 초기 손상이 저감 후에도 계속할 수 있습니다. 사용 단백질 체학, 우리는 이전에 150 개 이상의 ECM을 확인하고 심장 조직 2, 3에서 단백질을 ECM은 관련. 그들은하지 연속 리모델링과 마음의 동적 적응에 기여하는 유일한 구조 단백질뿐만 아니라는 matricellular 단백질, 단백질 분해 효소이다. 특히, 많은 ECM 단백질은 4 당화된다. 이러한 번역 후 변형 (PTM)이 특정 아미노산 위치에 당 잔기의 첨가를 포함하고, 바인딩, 단백질 접힘, 용해도에 영향을 열화 5 까지.
포유 동물에서 발생하는 두 가지 글리코 실화 종류가 있습니다. (1) N 글리코 실화가의 Xaa는 프롤린을 제외한 임의의 아미노산이다 컨센서스 서열의 Xaa-ASN-의 Thr / 빼앗아 내의 아스파라긴 잔기 아스파라긴 (Asn)의 복스 질소에서 발생한다. (2) O-당화에서, 당 잔기가 하이드 록시 프롤린 및 히드 록시 리신을, 훨씬 적은 정도 세린과 트레오닌 잔류 물 (SER, THR) 또는 첨부. O - 글리코 실화 단백질의 다양한 그룹에서 발생할 수 있지만, N 글리코 실화는 분비 단백질이나 막 단백질의 세포 외 도메인 (5)에 한정된다. 전자 재료를 연구 할 때 N-당화에게 매력적인 공격 대상이됩니다.
단백질 체학은 질병 단백질 변화의 분석을위한 새로운 표준을 설정합니다. 지금까지 대부분의 프로테오믹스 연구는 세포 내 단백질 (6)에 집중되어있다. 이는 다음과 같은 이유에 주로 기인한다. 첫째, 풍부한 세포 내 단백질은 확인 시험을 방해부족한 ECM 구성 요소의 문법을 없애는. 이것은 미토콘드리아 및 myofilament 단백질의 단백질 함량 (7)의 큰 비율을 차지 된 심장 조직에서 특히 중요하다. 둘째, 통합 ECM 단백질은 크게 교차 연결 및 용해하기 어렵다. 마지막으로 풍부한 PTMS (즉, 당화)의 존재는 분리, 액체 크로마토 그래피 탠덤 질량 분석법 (LC-MS / MS)에 의해 식별 모두에 영향을 미치는 분자 질량, 전하, 및 펩티드의 전기 특성을 변화시킨다. 최근 몇 년 동안, 우리는 개발 이후 질량 분석기 (MS) 분석과 호환되는 ECM 단백질의 연속 추출 및 농축 방법을 개선했다. 전략은 연속 배양을 기반으로합니다.
첫 번째 단계는 염화나트륨 상기 ECM 관련 느슨하게 결합 된 ECM 단백질 추출뿐만 아니라, 새로이 합성 된 ECM 단백질을 용이하게하는 이온 성 완충액으로 수행된다. 그것은 내가상기 생화학 적 분석법 8 세포막 비방, 의무 및 세제의 자유 비 변성. 이어서, 탈세 포화가 소듐 도데 실 설페이트 (SDS)로 이루어진다. 이 단계에서, 낮은 SDS 농도는 멤브레인 불안정화 및 더욱 용해성 비정 ECM 성분의 파괴를 방지하는 반면, 세포 내 단백질의 방출을 보장한다. 마지막으로, ECM 단백질은 구아니딘 히드로 클로라이드 완충액 (GuHCl)로 추출한다. GuHCl는 9 힘줄, 연골 10, 11 척, 12, 13, 중심부 (2, 3)과 같은 조직에서 주로 가교 결합 단백질 및 프로테오글리칸 추출 효과적이다. 우리는 심혈관 질환 2 ECM 리모델링을 탐구 LC-MS / MS와 함께,이 생화학 적 분류를 적용 , 3, 11, 12, 13, 14. MS에서의 최근 발전은 본래 글리코 3 (15)의 직접적인 분석을 허용 높은 충돌 에너지 해리 (HCD)와 전자 전달 해리 (ETD)의 조합과 같은 새로운 분할 방법을 포함한다.
여기에는 단백질 조성물, 글리코 실화 부위의 확인 및 당쇄 형태의 특성의 분석을 허용 MS 분석 ECM을 제조하는 방법을 설명한다. ECM (16)의 글리코 실화 분석 이전에 비해,이 방법은 MS를 사용하여 부위 특이 적 방식으로 당화 프로파일의 조성 변화의 직접적인 평가를 허용한다. 우리는 심장 혈관 조직에이 방법을 적용했습니다. 그러나, 수 등그래서 다른 조직 표본에서 ECM의 연구에, 약간의 수정으로 적용 할 수 및 ECM 생물학에 전례없는 통찰력을 제공 할 수 있습니다.
프로토콜
연구는 원즈 워드 지역 연구 윤리위원회에 의해 승인되었다 (참조 번호 : 06 / Q0803 / 37) 및 연구 개발 사무실에서받은 기관의 승인. 모든 환자는 동의서를 작성했다.
세포 외 기질 단백질의 1 추출
참고 :이 실험에 사용 된 인간의 심방 조직은 단지 마음의 심정지 체포 후, 체외 순환시 심방 부속기에서 얻었다. 모든 샘플은 세인트 조지 병원, 런던, 영국에서 수집되었다. 모든 조직 샘플은 -80 ° C에서 냉동해야합니다. 이러한 파라 포름 알데히드 등의 휘발과 보존 샘플을 사용 가교 단백질이하지 마십시오.
- 추출 단계 사이의 시간을 최소화하기 위해, 표 1에 따라, 실험에 앞서 모든 추출 버퍼를 준비한다. 온도가 조절 된 환경에서, 실온 (RT)에서 배양 모두를 수행(즉, ~ 20 ° C는) 추출 간의 일관성을 보장합니다.
- 조직 20-50 mg의 무게. 여러 샘플을 추출 잘라 하나씩 무게 될 경우 조직의 전체 해동을 방지 할 수 있습니다. 메스를 사용하여 3-4 작은 조각 (예 2-3 ㎜)로 조직을 주사위 1.5 ㎖의 튜브에 이들을 함께 배치했다.
- (PBS; 표 1 및 재료의 도표 참조)를 빙냉 인산염 완충 식염수 500 μL를 첨가하고 혈액 오염을 최소화하기 위해 다섯 개 세척을 수행한다.
- 추출 단계 1 : 염화나트륨 완충액 포란
- PBS로 세정 한 후, 스크류 캡과 1.5 ㎖의 튜브에 시료를 배치했다. 염화나트륨 버퍼를 추가 티슈 중량 : 10 배 (w V)로 (표 1 참조). 소용돌이 최저 속도 (즉, 600 RPM)에서 1 시간 동안 RT에서 튜브.
참고 : 낮은 소용돌이 속도가이 단계에서 조직의 기계적 중단을 방지하는 것이 중요합니다.추출 동안 모든 튜브를 배치 할 폼 어댑터를 사용하십시오. - 39 ° C에서 10 분 동안 16,000 XG에 새로운 원심 분리 튜브로 이동 추출물. 사용할 때까지 -20 ° C에서 추출물을 저장합니다. 간단히 말해서, 신선한 염화나트륨 완충액 나머지 조직 펠렛을 세척 하였다. 버퍼의 동일한 유형을 사용하여 (즉, 염화나트륨 완충액 100 μL) 세척 다른 용해도 (염화나트륨으로 추출하지 예, 단백질)과 다른 단백질의 추출을 방지 할 수있다.
- 세정 후, 후속 추출 단계와 단백질 함량의 중첩을 최소화하기 위해 버퍼의 완전한 제거를 보장한다. 세척에 사용 된 염화나트륨 완충액 버린다.
주 : 상기 버퍼 볼륨 조직 중량의 비율은 재현 추출 중요하다. 10 : 1의 비율 (V는 : W) 및 염화나트륨 SDS 추출 및 5 : 1 GuHCl 단계에 대한 버퍼 포화없이 단백질의 충분한 양을 제공한다. 단백질 농도는 약 내선 후 1 ~ 2 ㎍ / μL이다raction.
- PBS로 세정 한 후, 스크류 캡과 1.5 ㎖의 튜브에 시료를 배치했다. 염화나트륨 버퍼를 추가 티슈 중량 : 10 배 (w V)로 (표 1 참조). 소용돌이 최저 속도 (즉, 600 RPM)에서 1 시간 동안 RT에서 튜브.
- 추출 단계 2 : SDS 버퍼와 탈세 포화
- 열 번 (V : w)에서 SDS 완충액 (표 1)를 추가 티슈 중량; SDS 낮은 농도 (즉, 0.1 %)를 사용 탈세 포화시 ECM 단백질의 손실을 방지하는 것이 중요하다. 소용돌이 최저 속도 (즉, 600 RPM)에서 16 시간 동안 실온에서 튜브.
참고 : 낮은 소용돌이 속도가 ECM의 기계적 중단을 최소화 할 수 있습니다. - 새로운 튜브에 추출물을 전송합니다. 39 ° C에서 10 분 동안 16,000 XG 원심 분리기; 사용할 때까지 -20 ° C에 저장합니다. 간단히 SDS를 제거 DD의 H 2 O로 나머지 조직 펠렛을 세척 하였다. 세척 후 액체의 완전한 제거를 확인합니다.
- 열 번 (V : w)에서 SDS 완충액 (표 1)를 추가 티슈 중량; SDS 낮은 농도 (즉, 0.1 %)를 사용 탈세 포화시 ECM 단백질의 손실을 방지하는 것이 중요하다. 소용돌이 최저 속도 (즉, 600 RPM)에서 16 시간 동안 실온에서 튜브.
- 추출 단계 3 : GuHCl 버퍼와 배양
- (: w V) 티슈 중량 다섯 시간 GuHCl 완충액 (표 1)을 추가한다. 소용돌이 즉 최대 속도로 72 시간 (실온에서 튜브 3,200 RPM); 격렬한 소용돌이로 교반은 ECM의 기계적 중단을 용이하게합니다.
- 새로운 튜브에 추출물을 전송합니다. 사용할 때까지 -20 ℃에서 10 ℃에서 4 분, 점포 16,000 × g에서 원심 분리기.
2. 단백질 정량 및 강수량
참고 세제의 존재로 인해 상기 SDS 완충액은 280 nm에서 흡광도 측정에 기초하여 직접 단백질 정량과 호환된다. 재현 정량을 보장하기 위해 모든 단백질 추출물 (17)에 대한 비색 분석을 사용합니다.
- 부량.
- 직렬 적절한 추출 완충액 (예, 염화나트륨, SDS, 또는 GuHCl) (17)에 희석 된 소 혈청 알부민 (BSA)을 사용하여 검량선 표준을 준비한다. 이 기간 동안, 샘플 추출을 해동.
- 내 농도를 수득하는 추출 완충액에 희석 시료흡광도의 선형 범위; 1:10 희석 (V는, V) 만족스러운 결과를 산출한다. 비색 분석법> 4 M GuHCl 농도와 호환되지 같이 DDH 2 정량 O 동일한 양으로 GuHCl 샘플을 희석한다.
- bicinchoninic 산 (BCA)를 사용하여 96- 웰 플레이트에서 분석을위한 제조사의 지침에 따라 색채 분석 (17) (재료의 도표 참조) 계; 적어도 중복 측정을 수행하는 것이 좋습니다.
- 30 분 동안 배양 한 후, BSA 표준 검량선 (17)를 사용하여 단백질 농도를 계산하기 위해 570 nm 파장에서의 흡광도 측정을 수행.
- 단백질 침전
- 해동 GuHCl 실온에서 추출합니다. 나누어지는 새로운 튜브에 각 샘플의 단백질 10 μg의. 직접 글리코 펩티드 분석을 위해 분취를 50㎍. 에탄올과 인큐의 10 배 볼륨 추가BATE 밤새 -20 ℃에서.
참고 : GuHCl 더 효소 반응과 대부분의 전기 응용 프로그램과 호환되지 않습니다. GuHCl의 제거는 탈 글리코 실화 트립신 소화하기 전에 필요합니다. 에탄올과 GuHCl의 용해도는 반대로, 단백질의 낮은 용해도는 약 18 단백질의 98 % 회수를 산출하면서 GuHCl의 효과적인 제거를 허용한다. - 39 ° C에서 30 분 동안 16,000 × g에서 원심 분리하고 상등액을 흡인. 침전 된 펠렛을 방해하지 않도록주의하십시오. RT에서 진공 농축기 (물질의 표를 참조)를 사용하여 15 분 동안 펠렛을 건조.
참고 :이 프로토콜은 여기 중지 할 수 있으며, 건조 된 펠렛 사용할 때까지 -20 ° C에 저장됩니다. - 선택적으로, (보조 방법을 참조 QC) 품질 관리 등의 겔 전기 영동으로 실행.
- 해동 GuHCl 실온에서 추출합니다. 나누어지는 새로운 튜브에 각 샘플의 단백질 10 μg의. 직접 글리코 펩티드 분석을 위해 분취를 50㎍. 에탄올과 인큐의 10 배 볼륨 추가BATE 밤새 -20 ℃에서.
3. 연속 탈 글리코 실화N-당화 부위 점유율의 평가
- 샘플 건조하여 (단계 2.2.2 참조) 동안, 표 1에서와 같이, 탈 글리코 실화 효소를 함유하는 탈 글리코 실화 debranching 버퍼를 준비한다. 제품의 자세한 내용은 자료의 표를 참조하십시오.
- 각 샘플에 대한 탈 글리코 실화 효소를 함유하는 완충액 10 μL를 추가한다. 빠른 소용돌이 및 샘플의 스핀 다운을 수행하여 적절한 펠렛 재 부유를 확인합니다.
참고 : debranching 효소를 사용하여 설탕 단량체의 제거는 O 연결된 복합 당류의 후속 완전한 제거를 위해 필수적이며, MALDI 스펙트럼은 PNGase-F에 의한 N- 연결 당의 나중에 분해를 촉진한다. - 37 ° C의 온도에 의한 헤파 II.Increase 헤파 란 황산의 제거를 허용하고 교반과 함께 36 시간 동안 배양 25 ° C에서 2 시간 동안 인큐베이션.
참고 : 낮은 반응 볼륨과 장기 배양 시간, 사용 인큐베이터 뜨는을 감안할 때 단단히 복수의 1.5 ML의 욕조 팩약 45 ° 기울고 인큐베이터 안에 50ml의 원뿔형 튜브 내부 ES. - 36 시간 후, 16,000 XG에서 1 분 동안 원심 분리 그리고 증발 약 45 분 동안 실온에서 진공 농축기를 사용하여 샘플에서 H 2 O.
- 50 U / ㎖의 MALDI 스펙트럼은 PNGase-F를 포함하는 H 2 O 18 10 μL로 건조 된 샘플을 절단하는 재현 탁 탈 아미드 화 반응의 모든 아스파라긴 결합 형 글리 칸.
참고 : 생성 아스파라긴산은 MS 분석에서 N 글리코 실화의 존재를 나타내는 2.98 다 과량의 물질을 운반한다. - 인큐베이터 통 일정 교반하에 37 ℃에서 36 시간 동안 배양.
4. 트립신 용액 인 소화
주의 :이 단계는 (모두 비 탈글 라이코 실화 된 (즉, 글리코 펩티드 직접 분석에 사용되는) 및 탈글 라이코 실화 된 샘플들에 대해 수행되어야한다, 즉, 당쇄 OC의 평가에 사용cupancy).
- N-글리코 실화 부위 점유율의 평가 (이전 단계에서 표시)에 대한 총 단백질의 10 μg의를 사용합니다. 글리코 직접 분석 대상 시료를 들어, 개시 량으로 50 μg의 단백질을 사용한다.
참고 : 다음 단계는 단백질 10 μg의 설명된다. 필요에 따라 일 evolumes (즉, 5 시간 50 μg의 위해를)까지 확장 할 수 있습니다. - 각각 6 M 우레아, 2 M 티오 우레아, 최종 농도 9 M 우레아, 3 M 티오 우레아를 사용하여 각 샘플의 분취 량의 단백질을 변성 (10 μL의 시료에 대하여, 예를 들면, 우레아 / 티오 20 μL).
- 100 밀리미터 dithiotreitol (10 mM의 DTT, 3.33 μL, 최종 농도)을 첨가하여 단백질을 줄인다. 240 rpm으로 교반하면서 1 시간 동안 37 ℃에서 인큐베이션.
- (50 mM의 최종 농도 3.7 μL) 0.5 M 요오도 아세트 아미드를 첨가하여 알킬화를 수행하기 전에 샘플을 실온으로 식혀. 1 시간 동안 어두운 데에서 인큐베이션.
- -20 (사전 냉장 사용° C) 아세톤 (샘플의 6 배 부피)을 -20 ℃에서 밤새 배양 샘플. 4 ℃에서 25 분 동안 14,000 XG에서 원심 분리하여 침전물.
- 뜨는을 대기음. 침전 된 펠렛을 방해하지 않도록주의하십시오. RT에서 30 분 동안 진공 농축기를 이용하여 단백질 펠렛을 건조.
- 0.1 M 트리 에틸 암모늄 바이 카보네이트 (TEAB) 완충액, pH가 8.2 20 μL에 재현 탁 함유 트립신 (0.01 ㎍ / μL) 및 37 ° C에서 240 rpm으로 밤새 다이제스트.
- (1 % TFA의 최종 농도 TFA, 2 μL) 10 % 트리 플루오로 아세트산과 샘플을 산성화하여 소화를 중지.
C18 열을 사용하여 5. 펩타이드 정리
주 : 분해 후에 펩티드 혼합물로부터 오염물의 제거를 방해 이온 진압을 줄이고 신호 - 대 - 잡음 비율 및 연속 커버리지를 개선한다. 이 단계는 모두 비 탈글 라이코 실화 및 탈글 라이코 실화 사를 위해 수행되어야한다mples.
- 1 분 동안 1,000 XG에서 원심 웰 당 200 μL의 메탄올을 사용하여 C18 스핀 플레이트 수지 (재료의 도표 참조) 활성화.
- 1 분 동안 1,000 XG에서 H 2 O. 원심 분리기에서 80 % 아세토 니트릴 (ACN), 0.1 % TFA의 웰 당 200 μL를 첨가하여 세척 하였다.
- 1 분 동안 1,000 XG에서 H 2 O. 원심 1 % ACN 0.1 % TFA의 웰 당 200 μL를 첨가하여 평형. 이 단계를 두 번 더 반복합니다.
- 1 분 동안 1,500 XG에 수지 원심 분리기를 포함하는 웰에 4 단계 샘플 (전체 부피)을로드. 흐름 -을 통해 두 번 다시 넣고 원심 분리를 반복합니다.
- 1 분 동안 1,500 XG에서 H 2 O. 원심 1 % ACN 0.1 % TFA의 웰 당 200 μL를 첨가하여 세척 하였다. 이 단계를 두 번 더 반복합니다.
- 1 분 동안 1,500 XG에서 H 2 O. 원심 분리기에서 50 % ACN 0.1 % TFA의 웰 당 170 μL로 샘플을 용출. 이전 단계를 반복그리고 수집 된 용출액을 결합한다.
- RT에서 2 시간 동안 진공 농축기를 사용하여 용출을 건조. 그것이 바로 사용하지 않을 경우, 사용할 때까지 -80 ° C에서 건조 된 샘플을 유지한다.
참고 : 단백질 식별을위한 탈글 라이코 실화 샘플은이 단계 이후 LC-MS / MS에 사용할 준비가 된 것입니다. 6 단계와 7은 이러한 샘플 필요하지 않습니다. - 해동 0.5 ㎍ / μL의 최종 단백질 농도로 H 2 O 2 % ACN 및 0.05 % TFA의 탈글 라이코 실화 된 샘플을 재현 탁. 비 탈글 라이코 실화 된 샘플들의 직접 글리코 분석 단계 6으로 진행.
- 선택적으로, 종래의 탠덤 질량 태그 (TMT)로 라벨링 펩티드 필터; 펩티드 fitration위한 보조 방법 참조.
TMT 6. 라벨 (직접 글리코 펩타이드 분석을위한 전용)
- 해동 및 1 개 ㎍ / μL의 농도를 얻기 위해 50 mM의 TEAB 50 μL에 건조 된 펠렛을 재현 탁.
- ResusPED TMT 제로의 0.8 mg을 바이알 ACN 41 μL에 시약 (TMT 0, 재료의 도표 참조). 부유 제조업체의 recommendantions을 따르십시오.
- (TMT 0 20.5 μL로 펩티드 즉, 50 μL), 0.4 mg의 TMT 0 ~ 50 개 μg의 펩티드의 비율 펩티드 샘플 라벨. 실온에서 1 시간 동안 인큐베이션.
- 비율 6에서 5 %의 히드 록실 아민을 첨가하여 라벨링 반응을 켄 칭하고, 100 (5 % 히드 록실 아민, 즉 4.23 μL). 실온에서 15 분 동안 인큐베이션.
- 진공 농축기를 이용하여 실온에서 1 시간에 대해 0 TMT -labelled 펩티드 시료를 건조. DDH 2 O. 10 μL에 재현 탁
참고 : 인해 글리 칸 잔류에, 글리코 펩타이드를 비 당화 펩티드보다 높은 분자량을 표시합니다. TMT 0 글리코 펩티드의 충전 상태를 증가시킨다. 이것은 (m / z)의 비율을 충전하는 상대적인 질량을 줄이고 ETD 조각을 용이하게한다.
(7). 글리코 펩타이드 농축
- 키트 (물질의 표를 참조)에 제공되는 반응 완충제를 사용한다.
- 단계 6.5에서 각각 10 μL 샘플을 결합 완충액 50 μL를 추가한다. 이 균질해질 때까지 glycocapture 수지 용액을 소용돌이. (15)을 캡처 기반의 양쪽이 온성 친수성 상호 작용 액체 크로마토 그래피 (ZIC-HILIC)을 사용합니다.
- 새로운 1.5 ㎖의 튜브에 수지 현탁액의 분취 액 50 μL. 2,500 XG에서 1 분 동안 스핀 상층 액을 제거한다. 시료 60 μL를 추가 (즉, 결합 완충액으로 샘플) 수지 펠렛을 함유하는 튜브. 피펫을 사용하여 혼합하고 1200 rpm에서 교반하면서 20 분 동안 RT에서 배양한다.
- 2,000 XG에서 2 분 동안 원심 분리하고 새로운 튜브로 상청액을 이전. 튜브를 유지합니다. 수지 튜브에 세척 완충액 150 μL를 추가한다. 피펫을 사용하여 혼합하고 1200 rpm에서 교반하면서 10 분 동안 RT에서 배양한다.
- 2,500 × g으로 2 분 동안 스핀. 이전(단계 7.4)에서 동일한 튜브에 상청. 세척이 두 번 단계를 반복합니다.
- 용출 버퍼의 75 μL를 추가하고 피펫을 사용하여 섞는다. RT에서 5 분 동안 1,200 rpm으로 교반 한 후 2,500 × g으로 2 분 동안 튜브를 원심 분리. 새로운 1.5 ㎖의 튜브에 상청을 전송. 세정 단계를 반복하고 동일한 튜브에 용출 상등액 옮긴다.
- g X 2500에서 2 분 동안 용출 (즉, 글리코 펩티드)을 함유하는 튜브를 원심 분리기. 이전 단계로부터의 임의의 잔류 수지 제거를 위해 새로운 튜브에 상청을 전송.
- RT에서 약 2 시간 동안 진공 농축기를 이용하여 용출 총 150 μL를 건조. DDH 2 O.에서 2 % ACN 15 μL 0.05 % TFA의 건조 다운 글리코 펩티드를 재현 탁
- 글리코 특성화 HCD와 ETD 단편화를 이용하여 ECM 단백질 조성물을 분석 HCD 단편화를 이용하여 LC-MS / MS를 수행하도록 진행하고, LC-MS / MS. 섹션 8을 참조하십시오.
8. 질량 분광법 분석
- 전자 재료 조성물의 단백질을 분석 HCD 단편화를 이용하여 LC-MS / MS를 수행; 자세한 내용은 보충 방법을 참조하십시오.
- (자세한 보충 방법 참조) 글리코 특성화 HCD와 ETD 단편화를 이용하여 LC-MS / MS를 수행; 농축 된 샘플을 비 - 농후 입력 재료 (15)와 비교한다.
주 : 간접 분석 글리코 펩타이드, 글리코 펩타이드 직접 분석 및 데이터베이스 검색 용 LC-MS / MS 법의 상세한 설명은 보충하는 방법에 제공된다. 질량 분석기를 사용하여 ECM 단백질과 글리 칸 성분의 특성에 관심이 연구팀은 이전의 출판물 3, 11, 15를 참조하는 것이 좋습니다.
결과
프로토콜의 개략적 흐름이도 1에 제공된다.
ECM 추출 프로토콜
추출의 효율성은 분취 비스 - 트리스 아크릴 아마이드 겔에서 각 추출물을 형성 실행 시각화 실버 염색을 이용하여 모니터링 할 수있다. 도 2a는 염화나트륨, SDS의 상보성을 도시 GuHCl 순차 추출 후 추출한다. 이 QC는 과도한 단백질 분해 등의 샘플 품질 잠재적 인 문제를 식별 할 수 있습니다. 추출 후 ECM 당 단백질은 GuHCl 추출물 (도 2B)이 풍부하다.
탈 글리코 실화
탈 글리코 실화의 효율성을 평가하기 위해, 비 탈글 라이코 실화 제어 PA에서 실행되어야합니다rallel. 탈 글리코 실화 시간은도 3a에 예시 된 바와 같이, 당 잔기의 완전하고 균일 한 제거를 달성하기에 적합해야한다. 도 3b는 작은 효율적 O 및 N- 결합 된 올리고당 류를 대상 GAG 제거 및 탈 글리코 실화 효소의 효소의 첨가에 의해 탈글 라이코 실화 된 샘플의 대표 예를 나타낸다.
Glycoproteomics
NXT / S의 sequons의 점유의 평가를위한 프로토콜은 MS (도 3c) 후 ECM 당 단백질에 대한 단백질 서열 커버리지를 개선하고, 당 단백질의 존재의 초기 스크리닝을 허용한다. 데이터베이스가 이전에 확인 된 당 단백질을 포함하도록 사용자 정의 할 수 있습니다 이것은, 글리코 펩티드에 대한 검색 시간을 줄일 수 있습니다. HCD-ETD 단편화는 ECM의 g에 연결된 올리고당의 조성 및 특성 확인에 사용 lycoproteins. 도 4a는 탈 글리코 실화 (글리코 간접 분석) 한 후 18 O 표지 펩티드 얻은 대표적인 스펙트럼을 표시한다. 도 4b는 ECM으로부터 추출 본래 글리코 (직접 분석 글리코 펩타이드) 분석 후의 스펙트럼의 대표 예이다.
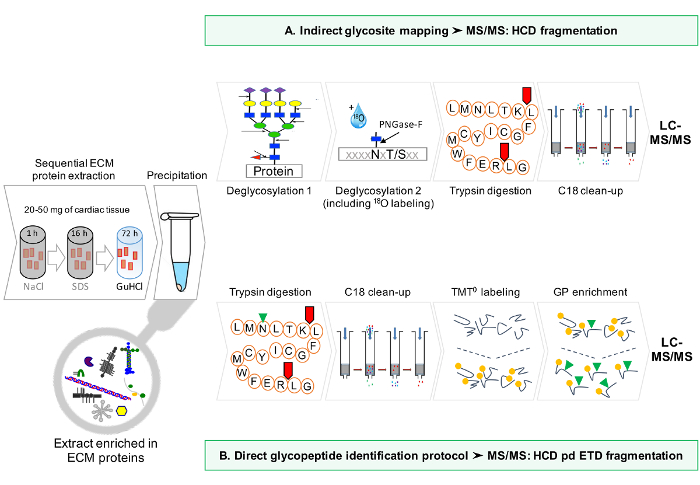
그림 1 : 방법 개요. (A) ECM 단백질 순차 농축 한 후, LC-MS / MS 분석은 탈글 라이코 실화 된 추출물에 대해 수행된다. (B)은 대안 적으로, 비 탈글 라이코 실화 된 ECM 추출물은 상기 글리코 펩타이드에 대해 충실. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2 "SRC ="/ 파일 / ftp_upload / 55674 / 55674fig2.jpg "/>
그림 2 : ECM 단백질의 추출. (A) 연속 추출 과정 ( "영어 퀵")에서 3 가지 추출물이 자신의 단백질 함량에 보완. SDS 추출물은 세포 내 단백질에 충실하면서, GuHCl 추출물은 ECM 단백질의 대부분을 포함하고있다. 성공적인 분류는 다른 실버 염색 패턴으로 시각화된다. (B) ECM 단백질은 작은 류신 - 풍부 프로테오글리칸의 관련성이 밝혀 져야만, biglycan의 mimecan과 같이 주로 SDS 및 염화나트륨 추출물 거의 존재 더불어 GuHCl 추출물에서 검출된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
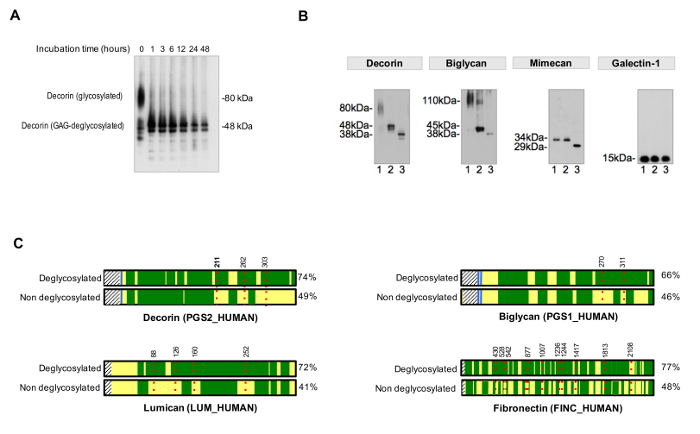
그림 3. Glyc 분석osylation. (A) 적절한 배양 시간은 완전한 탈 글리코 실화 필요합니다. 예는 당 단백질 관련성이 밝혀 져야만에서 글리코 사 미노 글리 칸 사슬 제거하는 동안 배양 시간의 효과를 나타낸다. (B) 당 단백질 ECM 대형 글리코 반복 체인 짧은 다양한 N- 및 O- 결합 올리고 사카 라이드로 장식된다. 면역 블롯의 각 레인 1은 치료 심장 추출물을 나타냅니다. 레인 2는 글리코 사 미노 글리 칸을 소화 효소로 처리 추출물이 포함되어 있습니다. 레인 3의 샘플은 추가로, N- 및 O- 결합 oligossacharides 제거하기위한 효소 함유한다. Galectin-1 따라서 단백질의 크기에는 변화가없고, 글리코 실화되지 않는다. 린치 M, 등 각색. H 2 O (18)의 존재 MALDI 스펙트럼은 PNGase F로 처리-4 (C)에서, LC-MS / MS 분석 샘플 비 탈글 라이코 실화 된 샘플과 비교 (우측 %)보다 시퀀스 커버리지를 달성한다. 디아크 녹지는 LC-MS / MS에 의해 시퀀스의 범위를 나타낸다. 빨간 점선은 아미노산의 위치를 나타내는 숫자로, glycosites을 나타냅니다. 위치 관련성이 밝혀 져야만의 글리코 실화 검출 ASN (211) (N, 굵게 하이라이트)가도 4에 예로서 상세하게 도시되어 이 도면의 확대를 보려면 여기를 클릭하세요.
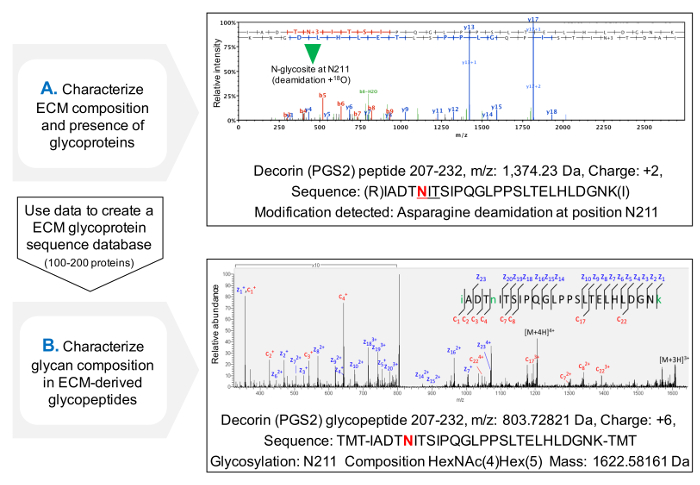
그림 4. MS에 의해 글리코 펩타이드 분석. (A) ECM 농축 추출에 샷건 프로테오믹스 방법을 사용하여, 글리코 펩티드를 NXT / S의 sequons 내의 탈 아미드 아스파라긴의 존재에 의해 식별 18 O.로 표지 될 수있는 예는 함유 관련성이 밝혀 져야만하는 펩티드위한 HCD MS / MS 스펙트럼을 나타낸다 이전에서 Asn (211) 당화. 얻은 데이터를 사용할 수있다ECM 당 단백질의 사용자 정의 데이터베이스를 만들 수 있습니다. (B) HCD-ETD 단편화는 글리코 ECM 농축 추출물을 분석하는데 사용된다. ETD MS / MS 스펙트럼은 당쇄 조성물의 특성을 허용한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| A. 주식 솔루션 | |
| DTT (Dithiotreitol, C 4 H 10 O 2 S 2) | DDH 2 100mm의 DTT O. 1 |
| EDTA (에틸렌 디아민 테트라 아세트산, C 10 H 16 N 2 O 8) | 250 DDH 2 O, pH를 8.0 mM의 EDTA. |
| GuHCl (구아니딘 염산염, 6 CLN CH 3) | 8 M GuHClDDH 2 O. |
| IAA (요오도 아세트 아미드, C 2 H 4 INO) | DDH 2 O. -1,2- 500 mM의 IAA |
| 나트륨 아세테이트 (아세트산 나트륨, C 2 H 2 NAO 3) | DDH 2 O, pH가 5.8에서 1 개 M 나트륨 아세테이트. |
| 염화나트륨 (염화나트륨, 염화나트륨) | DDH 2 O. 1 M 염화나트륨 |
| 인산 나트륨 (인산이 나트륨, 나트륨 2 H 2 PO 4) | DD의 H 2 O, pH가 6.8에서 1 M 나트륨 포스페이트 이염. |
| SDS (나트륨 도데 실 설페이트, NAC 12 H 25 SO 4) | DDH 2 O 3을 1 % SDS (35 mM)을 |
| TFA (트리 플루오로 아세트산, C 2 O 3 HF 2) | 10 % DDH 2 O.에서 TFA (1.2 M) |
| TEAB (트리 에틸 암모늄 바이 카보네이트, C 7 H 17 NO 3) | ddH2O, pH를 8.5에서 1M의 TEAB |
| 티오 우레아 (티오, CH 4 N 2 S) | DDH 2 O 3 M 티오 |
| 트리스 -HCl (트리스 - 염산 (NH 4 11 O C 3의 HCl]) | 100 DDH 2 O, pH를 7.5 mM의 트리스 -HCl. |
| 우레아 (요소, CH 4 N 2 O) | DDH 2 O. 9 M 우레아 |
| B. 반응 버퍼 | |
| C18 청소의 평형 버퍼 | 1 % ACN 0.1 % TFA DDH 2 O에 |
| C18 정화 컬럼 세척 완충액 | H 2 O 80 % ACN 0.1 % TFA |
| C18 청소 용출 버퍼 | DDH 2 O 중 50 % 아세토 니트릴, 0.1 % TFA |
| 탈 글리코 실화 버퍼 (4 배) | 600 mM의 염화나트륨 및 DDH 2 O, pH가 6.8에서 200 mM의 나트륨 포스페이트. |
| GuHCl 버퍼 (4) | 4 M 염산 구아니딘, 50 mM의 나트륨 아세테이트 및 DDH 2 O, pH를 5.8 mM의 EDTA 25. 100 (V : V) 추가 1 단백질 분해 효소 억제제의 칵테일 사용하기 전에. |
| 염화나트륨 버퍼 (4) | 0.5 M의 NaCl, 10 mM의 트리스 -HCl 및 DDH 2 O 25 mM의 EDTA, pH가 7.5. 100 (V : V) 추가 1 단백질 분해 효소 억제제의 칵테일 사용하기 전에. |
| PBS (1X) | 1.7 mM의 KH 2 PO 4, 5 mM의 나트륨 2 HPO 4, 150 mM의 염화나트륨, pH가 7.4. 25 mM의 EDTA 및 추가 1 : 100 (V를, V) 단백질 분해 효소 억제제 칵테일의 사용 전에. |
| 샘플 버퍼 (4X) | 100 개 mM 트리스, 2 % SDS, DDH 2 O, pH가 6.8에서 40 % 글리세롤, 0.02 % 브로 모 페놀 블루. 사용하기 전에 10 % ß-머 캅토 에탄올을 추가합니다. |
| SDS 버퍼 (4) | 100 : 0.1 % SDS 및 2 DDH 25 mM의 EDTA O. 1 추가 (절 : v)로 프로 티나 제 억제제의 칵테일 BEF광석 사용. |
| C. 효소 | |
| Chondroitinase의 ABC (5) | 0.5 U 탈 글리코 실화 버퍼 / ㎖ (1X) |
| Keratanase 5 | 0.1 U 탈 글리코 실화 버퍼 / ㎖ (1X) |
| 헤파 II (5) | 0.1 U 탈 글리코 실화 버퍼 / ㎖ (1X) |
| α2-3,6,8,9 - 뉴 라미니다 제 (시알 리다 아제) 5 | U 0.025 탈 글리코 실화 버퍼 / ㎖ (1X) |
| β1,4 갈 락토시다 제 (5) | U 0.015 탈 글리코 실화 버퍼 / ㎖ (1X) |
| β-N 아세틸 글루코사민 5 | 0.25 U 탈 글리코 실화 버퍼 / ㎖ (1X) |
| 엔도 α-N-acetylgalactosaminidase (O 글리코시다 제) 5 | U 0.013 탈 글리코 실화 버퍼 / ㎖ (1X) |
| MALDI 스펙트럼은 PNGase-F (N 글리코시다-F) (6) | 5H 0 U / ㎖ 2 O 18 |
| 트립신 | TEAB 버퍼 0.01 ㎍ / μL |
| 표 참고. | |
| (1) -20 ° C에서 냉동 원액을 유지합니다. | |
| 2 IAA는 빛으로부터 보호 유지되어야한다. | |
| 3 SDS 용이 <20 ℃에서 결정화된다. 1 % SDS (원액)의 용해를 용이하게하기 위해, 뜨거운 수돗물 버퍼 가온. | |
| 4 개 추출 버퍼는 RT에 저장 될 수있다. 사용하기 전에 표시된 단백질 분해 효소 억제제의 광범위한 스펙트럼 칵테일을 추가합니다. | |
| 이 효소 5는 제 탈 글리코 실화 단계에서 첨가한다. | |
| MALDI 스펙트럼은 PNGase F-6은 제 탈 글리코 실화 단계에서 첨가한다. | |
표 1 : 주식 솔루션, 반응 버퍼와 효소. 이 테이블은 MS 분석 전에 심장 ECM 단백질의 추출 (효소 digestions 포함) 이후의 처리에 필요한 각 스톡 용액 및 반응 완충액의 조성이 나열.
토론
이 프로테오믹스 (proteomics) 프로토콜은 우리의 실험실에서 지난 몇 년 동안 최적화되었습니다. 여기, 우리는 심장 조직을 사용하지만 약간의 조정은 다른 조직에의 응용을 위해 요구 될 수있다. 예를 들어, 추출 프로토콜은 고려 사항으로 조직의 세포 수를 취할 필요가있다. 심장 조직은 혈관 조직에 비해 높은 세포입니다. 혈관 조직을 사용하는 경우, SDS 농도가 낮은 (즉, 0.08 %) 일 수 있고 탈세 포화 시간이 짧은 (즉, 4 시간) 11, 12, 13이다. 탈 글리코 실화 효소의 사용은 ECM 조성물의 LC-MS / MS 분석을 위해 중요하다. 그러나, 배양 시간은 다른 조직 유형에 따라 조정해야합니다. (예, 아 그린, perlecan) (데이터는 도시하지 않음) 기저막 단백질이 풍부한 피부와 같은 샘플을 이용하여 예를 들어, 25 ° C에서 II 필요한 연장 배양 시간을 헤파. 직접 분석 글리코 펩타이드가 배양 15 세포 조정 배지에서 행할 수있다. 농축 공정이 단순화 subproteome의 분석을 위해 요구 될 수 없다. GuHCl 추출물과 유사하게, 염화나트륨 추출물은 또한 약간의 수정과 glycoproteomics 분석을위한 의무입니다. ECM 단백질 농축 기타 추출 프로토콜 ECM의 글리코 19, 20을 특성화하도록 구성 될 수있다.
당화는 가장 복잡한 PTM 5입니다. 글리코 펩타이드의 간접 식별은 NXT / S의 sequon에 혼입 18 O와 탈 아미드가 Asn 검출함으로써 달성된다. 다른 위치에서 탈 아미드가 Asn은 잘못된 반응을 나타낼 수있다. 마찬가지로, N-당화 단백질 온톨로지의 맥락에서 고려되어야하십시오 NXT / S의 sequon를 함유하는 세포 내 단백질의 글리코 실화되지 않지만 위양성을 야기 할 수도있다. 현재 공학자로H 알고리즘은 미리 결정된 시퀀스 만 (NXT / S의 예에서 Asn)에서 PTMS의 선별을 허용하지 않는 데이터를 수동으로 필터링해야한다. 이 위치에서 당화의 존재 / 부재의 식별 질병 및 제어 샘플 사이에 비교할 수 있습니다. (세린 또는 트레오닌의 질량 변화를 도입하는 예) O-MALDI 스펙트럼은 PNGase F에 대한 탈 글리코 실화에는 효소 당량 없다. 따라서, O 글리코 실화의 식별 직접 분석 글리코 펩타이드로 제한된다. 직접 분석 글리코 펩타이드가 단백질에 부착 당의 조성 정보를 취득하는 데 사용하지만, 당쇄의 구조적인 정보를 제공하지 않는다. 또한, 조성물은 글리 칸 글리 칸 합성 분비 후 처리의 결과이다.
ECM 단백질에 대한 우리의 3 단계 추출법 ( "영어 퀵") 6 심혈관 다양한 조직에서 ECM 특성화 수있다. 조직의 분별다른 6 바와 같이 여러 가지로 추출 간략화 ECM 프로테옴을 얻을 필요가있다. 세포 내 단백질은 달리 덜 풍부한 ECM 단백질의 식별을 방해하는 것 추출물에서 단백질의 과도한 존재비 동적 범위에 기여하는 것이다. 또한, 세포 내 단백질의 글리코 ECM 농축 이후 MS 분석을 어렵게 할 O-5 글리코 실화를 수행한다. 다른 저자는 그러나 그들이 당화의 분석을 추구하지 않았다, 예를 들어 폐 (21)와 연골 조직 10의 특성을 유사 추출 방법을 적용했다. 이전의 글리코 실화 분석 만 glycosites 식별 집중 코어 단백질의 글리 칸의 제거를 요구하고, O 글리코 실화 22, 23을 평가할 수 없다. 렉틴 배열과 화학 농축는 글리 칸 일반의 평가에 사용할 수있는생체 시료에 ES는 결합 특이성을 기반으로하지만, 이러한 기술은 특정 단백질 (24) 글리 칸 유형을 지정할 수 없습니다도 아니다 당화 사이트를 평가할 수 있습니다.
먼저, 우리는 이전 ECM 단백질의 LC-MS / MS로 스겔 전기 영동을 사용했다. 겔 분리를 LC-MS / MS 분석을 단순화 의무 단백질 분획을 얻는 데 유용하지만, 최신 장비가 빠른 스캔 속도를 제공한다. 따라서, 전기 영동 분리 단계는 생략 할 수있다. 겔 상단에 유지되는 대형 ECM 단백질은,보다 효율적으로 분석되고 이는 추가적인 이점을 제공한다. 그러나, 그대로 단백질의 Mw가에 대한 정보가 손실됩니다. MALDI 스펙트럼은 PNGase F 탈 글리코 실화 전의 증착 공정 위음성을 최소화하기 일반 H 2 O의 완전한 제거를 보장한다. 당 잔기 (즉 변수 당쇄 대중) LC에 의한 분리를 방해 및 MS / MS에 의해 후속 펩티드 식별을 손상. 는 PAN-탈 글리코 실화 프로토콜은 또한 당화에 집중하지 ECM 단백질의 단백질 체학 분석을 권장합니다.
프로테오믹스는 ECM에 전례없는 통찰력을 제공 할 수 있습니다. 구조적지지 초과하면 ECM에 연결된 글리 칸은 호스트 병원체 상호 작용, 세포 간 통신 및 면역 반응 25, 장기 이식 후의 동종 이식 거부, 즉 필수적이다. Glycoproteomics는 glycobiology에 필수적인 도구가 될 것입니다.
공개
없음.
감사의 말
JBB은 왕의 영국 심장 재단 센터에서 경력 설립 위원이다. MM은 영국 심장 재단의 선임 연구원이다 (FS / 2분의 13 / 29,892). 이 연구는 우수 이니셔티브에 의해 지원되었다 (역량 센터 우수한 기술을위한 - COMET) 오스트리아 연구 진흥원 FFG의 "혈관의 우수 연구 센터는 노화 - 티롤, VASCage"(K-프로젝트 번호 843536)와 NIHR 생물 의학 연구를 킹스 칼리지 병원과 협력 가이의 세인트 토마스 '국민 건강 재단 신뢰와 킹스 칼리지 런던에 기반 센터.
자료
| Name | Company | Catalog Number | Comments |
| A. Chemicals | |||
| Acetonitrile, MS-grade (ACN, C2H3N) | Thermo Scientific | 51101 | 5.2-5.8, 6.2, 7.11, Supp 2, 3, 4 |
| Cocktail of proteinase inhibitors | Sigma-Aldrich | P8340 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Disodium phosphate (Na2H2PO4) | Sigma-Aldrich | S7907 | 3.1 |
| Dithiotreitol (DTT, C4H10O2S2) | Sigma-Aldrich | D0632 | 4.3 |
| Ethylenediaminetetraacetic acid (EDTA, C10H16N2O8) | Sigma-Aldrich | E9884 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Ethanol (C2H6O) | VWR | 437433T | 2.2.1 |
| Guanidine hydrochloride (GuHCl, CH6ClN3) | Sigma-Aldrich | G3272 | 1.6.1 |
| Glycerol (C3H8O3) | Acros organics | 158920025 | Suppl 1.1 |
| H2O LC-MS Cromasolv | Sigma-Aldrich | 39253-1L-R | Throughout the protocol |
| H218O | Taiyo Nippon Sanso | FO3-0027 | 3.5 |
| Hydroxylamine (HA, H3NO) | Sigma-Aldrich | 467804 | 6.4 |
| Iodoacetamide (IAA, C2H4INO) | Sigma-Aldrich | A3221 | 4.4 |
| Phosphate-buffered Saline (PBS), 10x | Lonza | 51226 | 1.3 |
| Sodium acetate (C2H3NaO2) | Sigma-Aldrich | S7545 | 1.6.1 |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | 1.4.1, 3.2 |
| Sodium dodecyl sulfate (SDS, NaC12H25SO4) | Sigma-Aldrich | 466143 | 1.5.1 |
| Triethylammonium bicarbonate (TEAB, C7H17NO3) | Sigma-Aldrich | 11268 | 4.7, 6.1 |
| Trifluoroacetic acid (TFA, C2HF3O2) | Sigma-Aldrich | T62200 | 4.8, 5.2-5.8, 7.11, Supp 2, 3 |
| Thiourea (CH4N2S) | Sigma-Aldrich | T8656 | 4.2 |
| Tris-hydrochloride (Tris-HCl, NH11C4O3[HCl]) | Sigma-Aldrich | T3253 | 1.4.1, Suppl 1. |
| Urea (CH4N2O) | Sigma-Aldrich | U1250 | 4.2 |
| Name | Company | Catalog Number | Comments |
| B. Enzymes | |||
| α2-3,6,8,9-Neuraminidase (Sialidase) | EDM Millipore | 362280 (KP0012) | 3.1 |
| β1,4-Galactosidase | EDM Millipore | 362280 (KP0004) | 3.1 |
| β-N-Acetylglucosaminidase | EDM Millipore | 362280 (KP0013) | 3.1 |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | 3.1 |
| Endo-α-N-acetylgalactosaminidase (O-glycosidase) | EDM Millipore | 362280 (KP0011) | 3.1 |
| Heparinase II | Sigma-Aldrich | H6512 | 3.1 |
| Keratanase | Sigma-Aldrich | G6920 | 3.1 |
| PNGase-F (N-Glycosidase F) | EDM Millipore | 362280 (KP0001) | 3.5 |
| Trypsin | Thermo Scientific | 90057 | 4.7 |
| Name | Company | Catalog Number | Comments |
| C. Reagent kits | |||
| 30 kDa MWCO spin filters | Amicon, Millipore | 10256744 | 5.9, Suppl 2 |
| Macro SpinColumn C-18, 96-Well Plate | Harvard Apparatus | 74-5657 | 5.1 |
| NuPAGE Novex BisTris Acrylamide Gels | Thermo-Scientific | NP0322PK2 | Suppl 1 |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | 2.1.3 |
| ProteoExtract Glycopeptide Enrichment Kit | Merk Millipore | 72103 | 7 |
| Tandem mass tag 0 (TMT0) | Thermo Scientific | 900067 | 6.2, 6.3 |
| Name | Company | Catalog Number | Comments |
| D. Equipment and software | |||
| Acclaim PepMap100 C18 Trap, 5 mm x 300 µm, 5 µm, 100 Å | Thermo Scientific | 160454 | Suppl 3, 4 |
| Acclaim PepMap100 C18, 50 cm x 75 µm, 3 µm, 100 Å | Thermo Scientific | 164570 | Suppl 3 |
| Byonic Search Engine | Protein Metrics | Version 2.9.30 | Suppl 5 |
| Dionex UltiMate 3000 RSLCnano | Thermo Scientific | n/a | Suppl 3, 4 |
| EASY-Spray Ion Source | Thermo Scientific | ES081 | Suppl 4 |
| EASY-Spray PepMap RSLC C18, 50 cm x 75 µm, 2 μm, 100 Å | Thermo Scientific | ES803 | Suppl 4 |
| Mascot Search Engine | Matrix Science | Version 2.3.01 | Suppl 3 |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFADBMBHQ | Suppl 4 |
| Proteome Discoverer Software | Thermo Scientific | Version 2.1.1.21 | Suppl 3, 5 |
| Picoview Nanospray Source | New Objective | 550 | Suppl 3 |
| Q Exactive HF Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFALGMBFZ | Suppl 3 |
| Savant SpeedVac Concentrator | Thermo Scientific | SPD131DDA | 2.2.2, 3.4, 4.6, 5.7, 6.5, 7.11 |
| Scaffold Software | Proteome Software | Version 4.3.2 | Suppl 3 |
참고문헌
- Porter, K. E., Turner, N. A. Cardiac fibroblasts: at the heart of myocardial remodeling. Pharmacol. Ther. 123 (2), 255-278 (2009).
- Barallobre-Barreiro, J., et al. Proteomics analysis of cardiac extracellular matrix remodeling in a porcine model of ischemia/reperfusion injury. Circulation. 125 (6), 789-802 (2012).
- Barallobre-Barreiro, J., et al. Glycoproteomics reveals decorin peptides with anti-myostatin activity in human atrial fibrillation. Circulation. 134 (11), 817-832 (2016).
- Lynch, M., Barallobre-Barreiro, J., Jahangiri, M., Mayr, M. Vascular proteomics in metabolic and cardiovascular diseases. J. Intern. Med. 280 (4), 325-338 (2016).
- Varki, A., Lowe, J. B., Varki, A. Biological Roles of Glycans. Essentials of glycobiology. 2nd ed. , (2009).
- Barallobre-Barreiro, J., Lynch, M., Yin, X., Mayr, M. Systems biology - opportunities and challenges: The application of proteomics to study the cardiovascular extracellular matrix. Cardiovasc. Res. , (2016).
- Agnetti, G., Husberg, C., Van Eyk, J. E. Divide and conquer: the application of organelle proteomics to heart failure. Circ. Res. 108 (4), 512-526 (2011).
- Mason, R. M., Mayes, R. W. Extraction of cartilage protein-polysaccharides with inorganic salt solutions. Biochem. J. 131 (13), 535-540 (1973).
- Vogel, K. G., Peters, J. A. Isolation of proteoglycans from tendon. Methods. Mol. Biol. 171, 9-17 (2001).
- Wilson, R., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell. Proteomics. 9 (6), 1296-1313 (2010).
- Barallobre-Barreiro, J., et al. Extracellular matrix remodeling in response to venous hypertension: proteomics of human varicose veins. Cardiovasc. Res. 110 (3), 419-430 (2016).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell. Proteomics. 9 (9), 2048-2062 (2010).
- Didangelos, A., et al. Extracellular matrix composition and remodeling in human abdominal aortic aneurysms: a proteomics approach. Mol. Cell. Proteomics. 10 (8), (2011).
- Grandoch, M., et al. Loss of biglycan enhances thrombin generation in apolipoprotein E-deficient mice: Implications for inflammation and atherosclerosis. Arterioscler Thromb. Vasc. Biol. 36 (5), e41-e50 (2016).
- Yin, X., Bern, M., Xing, Q., Ho, J., Viner, R., Mayr, M. Glycoproteomic analysis of the secretome of human endothelial cells. Mol. Cell. Proteomics. 12 (4), 956-978 (2013).
- Parker, B. L., et al. Quantitative N-linked glycoproteomics of myocardial ischemia and reperfusion injury reveals early remodeling in the extracellular environment. Mol. Cell. Proteomics. 10 (8), (2011).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal. Biochem. 150 (1), 76-85 (1985).
- Pepinsky, R. B. Selective precipitation of proteins from guanidine hydrochloride-containing solutions with ethanol. Anal. Biochem. 195 (1), 177-181 (1991).
- de Castro-Brás, L. E., et al. Texas 3-step decellularization protocol: looking at the cardiac extracellular matrix. J. Proteomics. 86, 43-52 (2013).
- Naba, A., Clauser, K. R., Hynes, R. O. Enrichment of extracellular matrix proteins from tissues and digestion into peptides for mass spectrometry analysis. J Vis Exp. (101), e53057 (2015).
- Decaris, M. L., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell. Proteomics. 13 (7), 1741-1752 (2014).
- Zhang, H., Li, X. J., Martin, D. B., Aebersold, R. Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry. Nat. Biotechnol. 21 (6), 660-666 (2003).
- Parker, B. L., et al. Site-specific glycan-peptide analysis for determination of N-glycoproteome heterogeneity. J. Proteome Res. 12 (12), 5791-5800 (2013).
- Li, Y., et al. Simultaneous analysis of glycosylated and sialylated prostate-specific antigen revealing differential distribution of glycosylated prostate-specific antigen isoforms in prostate cancer tissues. Anal. Chem. 83 (1), 240-245 (2011).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix: an ever-changing and diverse entity. Circ. Res. 114 (5), 872-888 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유