JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
형광 유전자 인코딩 ph 지시자 초파리 melanogaster 말 관 Epithelia에 광학 정량화의 세포내 pH
요약
세포 이온 수송 종종 세포내 pH를 모니터링 하 여 평가 될 수 있다 (pH나). 유전자 Encoded pH-지표 (GEpHIs) 그대로 셀에 세포내 pH의 부 광 량을 제공합니다. 이 프로토콜 내용을 통해 셀룰러 ex vivo 라이브 이미징 pHerry와 초파리 melanogaster 의 말 tubules의 세포내 pH의 정량화, 의사 비율 유전자 인코딩 pH 지시자.
초록
상피 이온 수송 체계 이온 항상성 뿐만 아니라 필수적인 세포 전기 화학 기온 변화도의 유지 보수에 필수적입니다. 세포내 pH (pH나)은 많은 이온 운송업 자에 의해 영향을 하 고 따라서 pH나 모니터링은 운송업 자 활동을 평가 하기 위한 유용한 도구. 현대 유전자 인코딩 pH-지표 (GEpHIs) 세포 및 subcellular 규모 pH나 그대로 셀에의 부 광 량을 제공합니다. 이 프로토콜 설명 세포질 pH나 규제의 초파리 melanogaster 의 말 Tubules (MTs)에서 ex vivo 라이브 이미징 통해 pHerry, pK의사 비율 GEpHI의 실시간 정량화를 는 cytosol에서 pH 변화 추적에 적합. 추출 된 성인 비행 MTs 단일 셀 레이어 epithelia의 형태학 상으로 그리고 기능상 다른 섹션으로 구성 되며 상피 전송의 조사를 위해 접근 가능 하 고 유전자 세공 모델으로 사용할 수 있습니다. GEpHIs 기존 pH에 민감한 형광 염료와 이온 선택적 전극 위에 여러 가지 이점을 제공합니다. 적절 한 모터 요소 사용할 수 있습니다 제공 GEpHIs 뚜렷한 세포 인구 레이블을 수 있습니다. 이 라벨은 전 비보 vivo에서, 그리고 제자리에 , 준비는 본질적으로 다른 유형의에 특히 유용 합니다. GEpHIs 또한 반복된 염료 치료 또는 조직의 외부화에 대 한 필요 없이 시간이 지남에 그대로 조직에 pHi 의 정량화를 허용합니다. 현재 GEpHIs의 주요 단점은 경향을 cytosolic 포함 조직 손상에 대 한 응답에서에서 집계-표현식을 구성 합니다. 이러한 단점, 그들의 솔루션 및 GEpHIs의 고유의 장점은 추출 된 MTs의 기능적으로 명료한 원금과 방사상 세포의 basolateral 양성자 (H+) 교통의 평가 통해이 프로토콜에서 설명 했다. 기술과 분석 설명 다양 한 척추 동물 및 무척 추 동물 준비에 쉽게 적응할 수 있다, 분석 결과의 세련 특정 전송기를 통해 이온 플럭스의 복잡 한 결정을 연구소 교육에서 조절 될 수 있습니다.
서문
이 프로토콜의 목표는 정량화의 세포내 pH (pHi)는 유전자 인코딩 pH-표시기 (GEpHI)를 사용 하 여 설명 하 고 어떻게 모델 곤충 (디의에서 basolateral H+ 교통을 평가 하기 위해이 메서드를 사용할 수 있습니다 설명 melanogaster) 신장 구조, 말 관 (MT). MTs 과일 파리의 배설 기관으로 봉사 하 고 몇 가지 주요 측면1포유류 nephron 기능적으로 비슷합니다. MTs는 흉부와 복 부의 tubules (앞쪽에 및 사후)의 2 쌍으로 정렬 됩니다. 각 산의 단일 셀 상피 튜브 metabolically 활성 주 셀의 독특한 꼭대기 구성 (luminal)과 basolateral (hemocoel) 극성으로 삽입된 방사상 세포. 형태학 상으로, 기능적으로, 앞쪽 MTs 3의 구성 그리고 발달 별개 세그먼트, 특히 초기 크기 세그먼트, 전환 세그먼트, 및2ureter 조인 분 비 주요 세그먼트. 셀룰러 규모 루멘으로 트랜스 상피 이온 수송 basolateral 나+-K+뿐만 아니라 꼭대기 원형질 막 V ATPase3 와 알칼리-금속/H+ 교환기에 의해 수행 됩니다-ATPase4, 내부 정류기 K+ 채널5, 나+-구동 Cl−/HCO3− 교환기 (NDAE1)6및 Na+-K+-2 Cl− cotransporter (NKCC; Ncc69)7, 방사상 세포 중재 Cl- 물8,9전송 하는 동안. 이 복잡 하지만 액세스할 수 physiologic 시스템 초파리의 유전 및 행동 다양 한 도구와 함께 내 생 이온 전송 메커니즘의 조사를 위한 우수한 기회를 제공 합니다.
이 프로토콜에 대 한 근거는 행동과 다른 모델 시스템 도구의 수출을 셀에서 통합에 대 한 잠재력을 가진 상피 이온 수송을 공부에 대 한 유전자가 단 시스템을 설명 했다. PHerry10의 표현, 녹색 pH에 민감한 슈퍼 황도 pHluorin11,12 (SEpH) 및 빨간색 pH을 구분 하지 않는 mCherry13, MTs의 융합에서 파생 된 GEpHI 허용에 H+ 전송의 정량화 높은 K+/nigericin 교정 기술14를 통해 단일 산 세포. 마찬가지로 많은 이온 운송업 자 H+ 해당 이동, 세포내 pH나 의 정량화 전송기의 다양 한 통해 이온 이동의 기능적 표현으로 제공 합니다. 또한 조직의 특정 transgene15 에 RNA 간섭 (RNAi)16 식 세포 이미징 및 전체-기관 분석17 와 결합 될 수 있는 강력한 유전자 도구를 제공 하는 초파리 MT 모델 시스템 , 18 , 19 관 기능 동작에 분자에서 수직 통합 된 강력한 도구 집합을 만들 수의. 이 스탠드 반면 다른 많은 프로토콜으로 역사적으로 그러한 측정 의존 해야 복잡 한 상피 생물학을 평가 하 고 마이크로 해 부, 정교한 이온 선택적인 전극20,21, 발굴 그리고 비싼 pH에 민감한 염료22 제한적인 로드 요구와 다른 유형의 조직에 가난한 세포 특이성. GEpHIs는 광범위 하 게 pH나 다양 한 세포 유형23을 측정 하기 위해 사용 되어 왔습니다. 초기 작품 고유의 pH 감도의 녹색 형광 단백질 (GFP) pH나 배양된 상피 세포24 을 모니터링 하는 데 악용 하지만 지난 2 년간 본 균27 뉴런25명과26, 사용 GEpHIs , 그리고 식물 세포28. 세포질 GAL4/UAS 식 시스템15 와 초파리 MT의 생리 적인 접근을 통해 유전 구성의 대상에 대 한 잠재력의 조합을이 pH의 조사에 대 한 이상적인 준비 하 게 나 레 귤 레이 션 및 상피 이온 수송.
pH나 규제 수십 년 동안 공부 되었습니다 하 고 생활에 필수적 이다. MT 준비는 강력한 모델 pH나 규제의 생리학을가 르 치지만 또한 수행을 정교한의 pH나 레 귤 레이 션 ex vivo에서 비보조사를 제공 합니다. 이 프로토콜 초파리 NH4Cl 펄스 산 기술21, 로드를 사용 하 여 산의 상피 세포의 basolateral 막에 걸쳐 H+ 움직임의 정량화를 설명 하지만 pH 지시자로 유전자 인코딩, 의무가 transgenesis 및 라이브 이미징 모든 준비를 이러한 메서드 및 그들의 이론적인 틀을 적용할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 프로토콜의 모든 단계는 메이 요 클리닉 (로체스터, 미네소타) 동물 사용 지침을 준수합니다.
1. 비행 축산
- 인상 파리와 세트 표준 축산29에 따라 십자가.
참고: 형광 기자 식 GAL4/UAS 시스템 온도에 비례 하 고 따라서 양육 온도 식 수준 변경 조정 될 수 있다. 높은 식 수준 동안 종종 더 나은 신호 대 잡음 비율에이 상태는 또한 증가 cytosolic와 organellar 집계와 관련 pHerry10, 같은 구문을 GFP 레드 형광 단백질 (RFP) 퓨전을 사용 하 여 때 30,31. 수행 하 여 정량화는 여전히 가능한 집계를 피할 수 없는 경우는 pH나 7.0에 해당 하는 1.0의 형광 비율 교정 각 실험 및 정규화 데이터 포인트 (단계 7.4 참조 교정 아래에 참고). - 설정 homozygous capaR GAL432 남성 십자가 homozygous UAS-pHerry10 처녀 암컷과 homozygous c724 GAL4이미징 수 있도록 homozygous UAS-pHerry 처녀 암컷에 수 컷2 산도나 주 셀에는 MT의 방사상 세포의 각각. 음식과 28 ° c.에 친구를 두고 신선한 튜브로 3 GAL4 남성과 장소 6 UAS-pHerry 여성
참고: 애벌레 4 d 이내 분명 해야한다 고 성인 eclose 10 일 주위에 시작 됩니다. - 일수로 시 여성 파리를 수집 하 고 10 d 28 ° c.에 대 한 나이를 따로합니다
참고: 어떤 제한적인 행동 분석 실험 (램지 분 비 분석 결과17,19) 같은 세포내 라이브 pH 이미징에 상관 될 것입니다 그에 해당 하는 실험의 타이밍을 조정할 수 있습니다. 남성 파리 사용할 수 있지만 여성에서 tubules는 더 크고 더 강력한.
2. 폴 리-L-리 신 슬라이드 준비 합니다.
- 표준 75 x 25 mm 슬라이드의 상단 주위 소수 PAP 펜 40 x 20 m m 테두리를 그리고 슬라이드 광학 이미징와 호환 되지 않는 경우 실시간 사용 큰 coverslips에 15 분 동안 건조 따로 설정 합니다.
- 각 슬라이드에 재고 0.01% 폴 리-L-리 신 (PLL) 솔루션의 2 개 mL를 전송 하 고 실시간에 1 시간을 위해 따로
- 피 펫과 초과 PLL을 제거 합니다. 나중을 위해 50 mL 원뿔 유리병에서 솔루션을 저장 합니다. 4 ° c.에 게
- 진공 라인으로 모든 나머지 솔루션 발음 슬라이드에 없습니다 솔루션 되도록 전체 슬라이드 표면 진공 라인을 실행 합니다.
- 사용 하기 전에 RT에서 옆으로 1 추가 시간에 대 한 슬라이드를 설정 합니다. 표준 슬라이드 책에 최대 1 달 동안 건조 RT에 슬라이드를 저장 합니다.
3. 해 부 접시 및 유리 막대의 준비
- 4.5 mL 탄성 깊이의 5. 믹스 일회용 피 펫 팁을 생산 하는 RT에 페 트리 접시 35 x 10 m m 폴리스 티 렌에 기본의 고무 경화제 0.5 mL를 추가 합니다. O/N 실시간에 치료 하는 탄성을 허용
참고: 탄성 중합체는 명확 하 고 거품의 무료 되어야 합니다. 거품의 붓는 후 10-15 분 동안 진공 항아리에 탄성 번호판을 유지 하 여 촉진 수 있습니다. - 손 사이 5mm 유리 막대를 개최 하 고 떨어져 끝을 당기면 조명된 분 젠 버너에 막대의 센터를 녹여. 유리로 녹아 당겨 더 신속 하 게 얇고 (0.1 m m) 및 테이퍼 샤프트 (그림 1).
참고: 칼에서 45 ° 각도 종종 tubules를 처리 하는 데 도움이. 이 ( 그림 1참조) 칼을 뽑아로 서 한 손으로 낮추는 방법으로 얻을 수 있습니다. - 단일 모서리 탄소 강철 면도날의 무딘 쪽과 중간에 얇은 샤프트를 휴식. 휴식 깨끗 한 되도록 해 범위에서 막대의 얇은 끝을 검사 합니다.
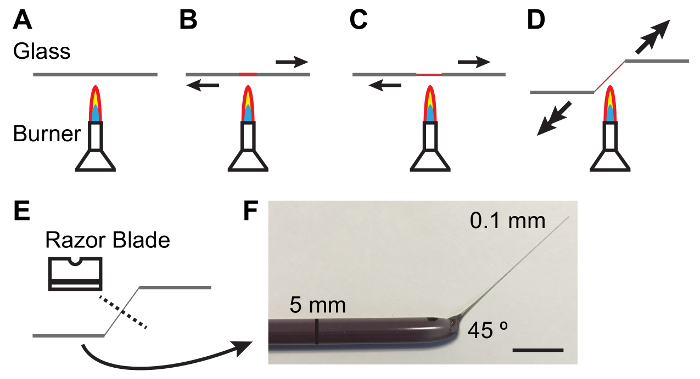
그림 1: 말 Tubules를 처리 하기 위한 유리 막대를 조작.
A-E입니다. 난방 및 MTs. 화살표를 처리 하기 위한 적합 한 테이퍼를 생산 하 고 각도를 유리 막대를 당기의 과정 방향 및 적용 되는 힘의 크기를 나타냅니다. F. 적절 하 게 조작된 유리 도구 사진. 눈금 막대 = 10 m m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
4입니다. 솔루션 및 관류 시스템 준비
참고: 관류 시스템 제조 업체에 의해 다릅니다. 이 프로토콜 기반으로 합니다 중력 먹인 8 채널 오픈 저수지는 입력된 흐름 속도 레 귤 레이 터와 진공 기반 유출 하지만 MTs 여기에 설명 된 대로 적용할 수 있습니다 어떤 관류 시스템과 작동 하도록 설치 하는 방법.
-
다음과 같은 솔루션을 준비:
- Aliquot 슈나이더의 매체 (40 mL 50 mL 원뿔 튜브로)와 4 ° c.에 게
- 솔루션을 준비 (예: 곤충 Phosphate-Buffered 염 분 (iPBS)와 NH4Cl iPBS) RT 표 1에 따라 필요한 경우에). 실험의 날에 사용 하기 전에 RT 따뜻한 솔루션.
참고: iPBS 40 mM NH4Cl iPBS 수 대용량 (1 리터 이상) 준비와 4 ° c.에 저장 - 8 교정 솔루션 500ml 볼륨 pH에서 준비 = 5.0, 6.0, 6.5, 7.0, 7.3, 7.6, 8.0과 9.0 표 1 및 4 ° c.에 저장소에 표시 된 대로 N-메 틸-D-glucamine (NMDG)와 HCl로 적정 하 여 각 솔루션의 pH를 조정 합니다.
- 실험 당일 rt 교정 솔루션의 5 mL aliquots 따뜻한 고 10 µ M의 최종 농도 생산 재고 nigericin 솔루션 (디 메 틸 sulfoxide (DMSO)에 20 m m)를 추가 합니다.
주의: 장갑 nigericin을 처리 합니다. 일회용으로 nigericin를 접촉할 모든 장비 취급. Nigericin 유리 및 플라스틱에 남아 있고 생물학 준비 장비를 다시 사용 하는 경우 손상 됩니다.
-
관류 시스템:
- 관류 시스템 모든 저수지 ddH2O (그림 2)를 작성 하 여 프라임. 모든 라인을 채우기 위해 흐름 속도 레 귤 레이 터에 인접 수 있도록 한 번에 하나의 채널을 엽니다.
참고: 그것은 실속 된 채널을 열고 저수지에서 드라이브 흐름에 플런저를 사용 하 여 라인에 공기를 필요할 수 있습니다. - 2 채널을 열고 ddH2O 배수를 허용 합니다. 일단 저수지는 거의 비어, iPBS와 NH4Cl 펄스 iPBS 두 번째 저수지 첫 번째 저수지를 작성. 설정 유량 최대 흐름 속도 레 귤 레이 터 원심 라인을 채우기 위해 1 분을 각 솔루션을 허용 다음 흐름 (그림 2)를 중지 합니다.
- 위치 2 영상 현미경 스테이지의 "손 돕기" 클램프를 납땜의 세트. 이미징 플랫폼의 각 측면에 하나의 클램프를 배치 합니다.
- 조심 스럽게 열 모 세관 유리의 조각의 원심 0.5 인치 (내부 직경 1.5 m m, 외경 0.86 m m, 길이 100 m m)는 분 젠 버너에. 중력에 의해 구 부 선단부를 수 있도록 원하는 각도 달성 되 면 불꽃에서 유리를 제거 하 여 45 ° 굴곡을 만듭니다. 유리 모 세관의 두 번째 작품으로이 과정을 반복 합니다.
- 구부러진된 유리 모 세관 흐름에 선 및 유출 진공 연결 라인에 각각 넣고 손에 "도움" 탑재 (그림 3) 현미경의 이미징 단계와 함께 그들을 정렬.
- 관류 시스템 모든 저수지 ddH2O (그림 2)를 작성 하 여 프라임. 모든 라인을 채우기 위해 흐름 속도 레 귤 레이 터에 인접 수 있도록 한 번에 하나의 채널을 엽니다.

그림 2: 관류 시스템 및 이미징 구성입니다.
MT basolateral 전송 기능의 동시를 통해 생리 적 평가에 필요한 구성 요소 형광 이미징 및 빠른 솔루션 교환 라이브. 가스 라인 표시 사항이 고 HCO3- 전송의 평가 실험의 확장을 허용. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
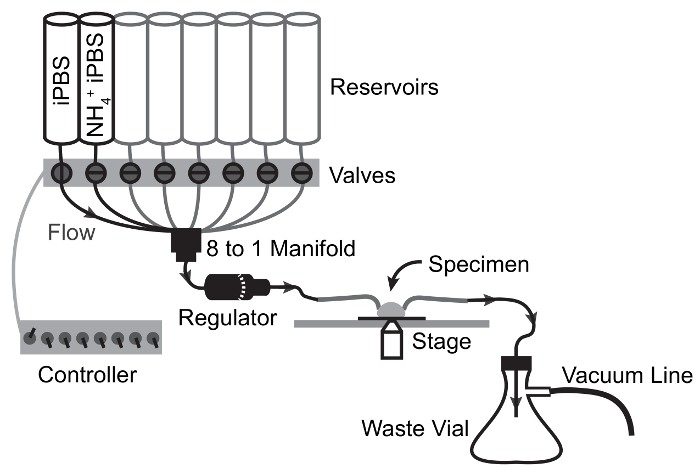
그림 3: 관류 장치 NH4Cl 펄스의 흐름 회로도 실험.
화살표는 흐름 경로 포인트 전환 밸브를 묘사. 솔루션 중력 흐름에 의해 견본에 저수지에서 이동 하 고 진공 흡입에 의해 폐 플라스 크를에 견본 약 실에서 그려집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
5. 성인 초파리 앞쪽 말 Tubules의 해 부.
- 해 부 접시를 수집 섹션 3에서에서 유리 막대, 단면도 2에서 PLL-코팅 슬라이드, 접착 관류 잘 분배기, 진공 그리스, 4 x 2"스트립 영화 씰링의 뽑아, # 5의 2 쌍 좋은 집게, 그리고 차가운 슈나이더의 매체와 RT iPBS의 40 mL aliquots.
- 씰링 테이프에 진공 기름 확산 하 고 윤활제와 하단 코트 테이프에 접착 관류 잘 분배기를 누릅니다. 접착제 관류 잘 분배기를 벗기십시오 고 그리스-사이드-다운 PLL 코팅된 슬라이드 위에 놓습니다. 두고 개별 견본 소수 성 기름에 추적 하는 웰 스 관류 잘 분배기를 제거 합니다.
- 그리스 둘러싸고에 RT iPBS의 장소 200 µ L PLL 코팅된 슬라이드에 잘 하 고는 stereoscope 아래 슬라이드를 이동 합니다.
- 장소는 빈 비행에 UAS-pHerry/capaR-GAL4 파리 유리병 그리고 10 분 동안 얼음에 그들을 anesthetize.
참고:이 방법은 마 취, CO2, 달리의 파리 탈수 하지 않습니다 보장 합니다. - 해 접시에 얼음 처럼 차가운 슈나이더의 매체를 부 어 그리고 좋은 집게를 사용 하 여 하나의 마 취 여성 비행 해 stereoscope 아래 접시에 전송.
- 집게의 세트로 흉부에 의해 비행을 누른 다른을 사용 하 여 부드럽게 복 부의 후부 그립. 즉,는 집게를 사용 하 여 비행 신중한 움직임의 후부 오픈 당겨. 여 hindgut 표시 되 면 선단부를 반복, 짧은 잡아당김을 통해 신체에서 hindgut 당겨서 기본 tracheoles에서 용기와 MTs를 무료.
참고: 앞쪽 및 후부 MTs 표시 됩니다 midgut 강과 hindgut ureter 통해 만나는. 자유의 지 가능성이 되도록 MTs의 첫 번째 쌍 수 후부 tubules는 hindgut를 둘러싸십시오. 이들은 일 수 있다 (그림 4A) 무시 됩니다. - 꼬집어 ureter에서 앞쪽 MTs 미세 집게로 일단 MTs의 두 번째 집합은 복 부의 무료. 이 앞쪽 MTs 용기에서 분리 되며 ureter을 닫습니다.
- 하는 tubules가 양쪽을 ureter 아래 막대를 밀어서 당겨 유리 막대와 무료 앞쪽 MTs를 선택 합니다. 솔루션에서 위로 MTs를 들어 냅니다.
- MTs와 ureter 막대의 아래쪽을 준수 하 고 내려 ureter 바로 슬라이드에 유리 막대를 설정 합니다. Ureter을 부착 하 고 유리 슬라이드 (그림 4B)에 다운 ureter을 눌러는 MTs의 원심 끝 인감. MTs 조작할 필요 이상 더 이상 하지 않습니다. MTs ureter 슬라이드에 고정 된 솔루션에서 최대 부동 한다.
- 유리 막대의 정밀한 끝을 사용 하 여 슬라이드 표면에 걸쳐 부드럽게 각 관을 청소. 중괄호는 관을 분쇄 피하기 위해 PLL-코팅 슬라이드 (그림 4C)의 표면에 각 관의 전체 길이 연결할 인접 하 원심 이동 관의 정상에 막대를 슬라이드를 슬라이드에 대 한 막대.
- 탑재 된 관 이상의 유체 가득한 작은 형성을 슬라이드에 다시 접착 관류 잘 분배기를 놓습니다.
- 표본을 현미경 스테이지에 배치 합니다. 유입을 놓고 각각 입구와 콘센트 열기, 관류의 모 세관 유출.
참고: 잘 분배기 오픈 관류 챔버를 바란다면 남아 있을 수 있습니다. 이 경우 유입 및 유출 모세 혈관 잘 한 이미징의 반대편에 정렬 수 있습니다.
6. 프로토콜 및 관 건강 이미징의 유효성 검사
참고:이 프로토콜에 수행 GFP (SEpH)와 RFP (mCherry) 필터 세트 거꾸로 넓은 필드 epifluorescent 현미경 ((예) 470/40 nm 여기, 515 nm longpass 방출 (em), 전 500 nm dichroic 및 546/10 nm, 590 nm longpass em, 565 nm dichroic), 10 X / 0.45 공기 목표, 라이브 이미지 캡처 및 이미징 소프트웨어에 대 한 단색 카메라. 프로토콜 모든 직 립에 대 한 적응 시킬 수 있다 또는 최적의 노출 시간과 빛의 강도, 범주화 매개 변수 달라 지기는 하지만 GFP와 RFP 광학 및 이미지 수집 소프트웨어, 사이 전환 하는 자동된 필터와 현미경을 거꾸로. 배경 빼기와 ROI를 사용 하 여 각 채널에 포함 아무 형광 신호 ROI에 인접 한 후 모든 분석, 형광 강도 (ROI)의 지역에서 평균 픽셀 강도으로 분석 합니다.
- 현미경, 광원, 및 이미징 시스템을 켭니다.
- 오픈 관련된 이미징 소프트웨어입니다.
- 접 안 렌즈를 통해 모양과 MT의 루멘 전송된 빛에서 명확 하 게 표시 될 때까지 수동으로 초점을 조정.
- 이미지 분석 소프트웨어에서 "인수" 탭을 클릭 하 고 "획득 모드" 섹션에서 "범주화" 풀 다운 메뉴에서 "2 x 2"를 선택 합니다.
- 조명 빛을 photobleaching 최소화 가벼운 경로에 5% 중립 밀도 필터를 삽입 합니다.
- GFP (SEpH) 채널 "채널" 메뉴에서 클릭 "라이브" 카메라를 통해 형광 신호를 관찰 합니다.
- 강도 히스토그램의 밝은 픽셀 값이 최대 값의 약 40%는 노출 시간을 설정 하려면 "시간" 슬라이더를 조정 다음 "" 조명 중지 하려면 중지를 클릭 합니다.
- Cytosolic mCherry의 부재 (조직 손상이 나 overexpression의 표시) 집계 단계 6.6 6.7 RFP (mCherry) 채널 및 앞쪽 산의 동 공이 확장 되어 초기 세그먼트의 존재를 확인 반복 (그림 4D).
참고: 확대 세그먼트는 관의 가장 인접 세그먼트 이며이 세그먼트의 내부 루멘의 직경은 인접 한 전환 세그먼트의 보다 큰 ~ 20 µ m로 명확 하 게 명백한 해야 합니다. 2 x 2 픽셀 binning 자주 충분 하지만 필요한 조명 농도를 더 증가 시킬 수 있다. 전형적인 노출 시간은 150 & 800 ms/채널 사이입니다. Photobleaching를 최소화 하기 위해 최대한 작은 빛으로 사용 합니다. Photobleaching를 최소화 두 fluorophores 수 표 백제 하지 독립적으로, 따라서 어떤 비율 보정을 무효화 하는으로 pHerry 같은 듀얼 fluorophore 지표의 사용에 필수적입니다. - "시계열" 확인란을 클릭 하 여 시간 경과 영상 프로토콜을 사용 합니다.
- 조정 "기간" 10 분 "간격" 슬라이더를 "시계열" 섹션에서 풀 다운 메뉴에서 0 최대 이미지 수집 속도와 총 캡처 시간을 설정 합니다. 0.2 Hz의 총 획득 율은 종종 충분 합니다.
- GFP (SEpH) 및 "채널" 섹션에서 RFP (mCherry) 상자를 확인 하십시오.
- 적절 한 밸브 컨트롤러를 활성화 하 여 살포 시스템의 iPBS 라인을 열고 "시작 실험."를 클릭 하 여 이미징 프로토콜을 시작 1 분 후 전환 NH4Cl 펄스 솔루션 20 여 적절 한 밸브를 개폐 iPBS 라인 s 다음 NH4Cl 라인을 폐쇄 하 고 iPBS 밸브를 재개 하 여 iPBS에 반환. 관류 시스템을 중지 하기 전에 완료 하려면 전체 이미징 프로토콜을 허용 합니다.
참고: 시간 경과 분석 안정적인 mCherry 신호 및 NH4Cl의 증가, 유실, 따라 냉각 하 고 점차적으로 복구 SEpH 신호 계시 해야 한다. - 2-포인트 캘리브레이션을 수행 합니다.
- 기본 슬라이드에서 필 링으로 잘 분배기를 제거 하 고 잘 영상에서 모세 혈관 관류 및 클램프를 제거.
- 200 µ L 교정 iPBS (pH 7.4, 10 µ M nigericin) 200 µ L 피 펫와 영상에 적용 됩니다. 피 펫와 영상에서 솔루션 다음 보정 솔루션의 또 다른 200 µ L를 바꿉니다. 4 번 완벽 한 솔루션 교류를 보장 하기 위해이 프로세스를 반복 합니다.
- 이미징 하기 전에 30 분 동안 교정 솔루션에서 준비 품 어. 반복 단계 6.6-6.11에서 동일한 매개 변수를 사용 하 여 이미징 프로토콜, 캡처 이미지의 불과 1 분의 수정.
참고: 관류 시스템 및 모세 혈관이이 단계에서 필요 하지 않습니다과 영상에 첨부할 수 없습니다 nigericin 모세 혈관을 노출 하지 않으려면 잘. - 200 µ L 피 펫으로 잘 이미징에 200 µ L 교정 iPBS (pH 9.0, 10 µ M nigericin)를 추가 합니다. 피 펫와 영상에서 솔루션 다음 보정 솔루션의 또 다른 200 µ L를 바꿉니다. 4 번 완벽 한 솔루션 교류를 보장 하기 위해이 프로세스를 반복 합니다.
- 10 분 전에 이미징에 대 한 두 번째 교정 솔루션에서 준비 품 어. 반복 단계 6.13.3는 이미징 프로토콜.
- 어느 채널에서 아무 픽셀 "의미 투자 수익"를 클릭 하 여 스크롤 하지만 강도 막대 그래프에 값이 없는 보고 관찰 하는 동안 "프레임" 슬라이더 이미지 스택 포화는 것인지 이미지 분석 소프트웨어에서 캡처한 이미지 스택을 검토합니다 최대 감지 값에 도달 합니다. 어떤 프레임 픽셀 최대 키 강도 도달 하는 경우, 노출 시간 또는 조명 강도 및 반복 섹션 6 줄일.
참고: 일단 각 준비에 사용 되는 포인트 교정 하지 않는 한 실험 또는 교정 사이 이미지 매개 변수를 변경 하지 마십시오 설립 (8.3 단계 참조).
- 이미지 스택 시간의 기능으로 형광의 강도와 형광 비율 (SEpH/mCherry)를 분석 합니다.
- "말은 투자 수익"를 클릭 하 고 자유 변형 도구 선택 합니다. 산의 ~ 50 µ m 길이 추적 하는 마우스를 잡으십시오 ROI, 그리기 완료 클릭 마우스 오른쪽 다음 배경 ROI (그림 5A)를 정의 하는 산에 인접 한 지역에 반복.
- "측정"에서 "평균 강도"를 클릭 클릭 하 여 강도 값의 테이블을 만들 "내보내기 > 데이터 테이블 > 만들기."
- 구성 톱니 아이콘을 클릭 하 고 "시간"와 "강도 뜻"를 제외한 모든 매개 변수를 선택 취소 새로 만든된 데이터 테이블에 대 한 탭을 마우스 오른쪽 단추로 클릭 하 고 "다른 이름으로 저장" 선택한.csv 파일로 데이터를 내보냅니다.
참고: 유사한 측정 할 수 있다 또한 ImageJ 같은 무료 소프트웨어를 사용 하 여. - 스프레드시트 테이블을 열고 "텍스트"에서 "데이터" 탭을 선택 하 여 데이터 테이블을 가져올 합니다.
- 스프레드시트에 함수를 사용 하 여 각 시간 점에서 SEpH 신호 강도에서 SEpH 배경 강도를. MCherry 신호에 대 한이 프로세스를 반복 합니다.
- 시간 및 배경 수정 강도 데이터와 클릭을 포함 하는 열을 선택 하 여 시간의 기능으로 각 채널 강도 플롯 "삽입 > 분산형 (차트) > 직선으로 분산형" (그림 5B).
- 스프레드시트 함수를 사용 하 여 각 시간 점에서 SEpH/mCherry 형광 비율을 계산.
- 시간 및 비율 데이터와 클릭을 포함 하는 열을 선택 하 여 시간의 기능으로 음모 형광 비율 "삽입 > 분산형 (차트) > 직선으로 분산형" (그림 5C).
7. 전체 말 Tubules Ex Vivo에서 pHerry의 구경 측정.
- 해 부 고 섹션 5에에서 설명 된 대로 이전 MTs의 신선한 세트를 탑재.
- 6.13.2 단계에서 설명한 대로 교정 iPBS (pH 7.4, 10 µ M nigericin)에 대 한 iPBS를 교환 합니다. 30 분 동안 품 어.
- MTs 찾아서 단계 6.1-6.11에에서 설명 된 대로 SEpH/mCherry 이미지의 쌍을 수집 합니다. IPBS 6.13.4, 단계에서 설명한 대로 10 분 기다려야 및 다시 이미지 교정의 다른 재고 솔루션을 교체 합니다. 이 프로세스를 반복 하 여 SEpH/mCherry 비율 모든 솔루션에 몇 군데 되었습니다. 구하는 pH 9.0 이미지는 견본 거의 높은 pH에서 복구 마지막.
- 플롯 SEpH의 형광 비율 mCherry에 교정 8 표본에서에서 부과 pH나 의 함수로 단계 6.14.9에에서 설명 된 대로. 공식 1 (그림 5D)에 따르면 전체 보정 기능을 볼츠만 곡선으로 캘리브레이션 데이터에 맞게. 데이터 일치 하지 않는 경우 교정 세트 1.0의 형광 비율 pHi 7.0에 해당 되도록 정규화 각 표본에서 플롯 하 고 다시 분석 (그림 5E).
참고: 후자의 과정은 필요한 경우 개별 실험 필요 합니다 그들의 자신의 내부 포인트 교정33 (정량화 아래 절차 (단계 8.3) 참조). -
공식 1
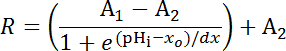
여기서 R = SEpH/mCherry 비율 및1,2, xo, 그리고 dx 는 커브 피팅 매개 변수를 나타내는 최소 형광 비율, 최대 형광 비율, pK는, 함수의 폭 각각. xo 명백한 pK는 7.1와 7.4 셀 유형 및 정확한 교정 상태에 따라 다를 수 있습니다 pHerry의 =.
8. 전 비보 말 관 Epithelia에서 Basolateral 산 압출의 정량화.
- 이미지 pHerry 표현 방사상 세포와 pHerry 표현 교장 동시에 세포.
- 섹션 5에에서 설명 된 대로 이전 MTs UAS-pHerry/capaR-GAL4 즉석에서 해 부 하지만 잘 이미징에 해 슈나이더의 중간에서 MTs 전송 하지 마십시오.
- 섹션 5에에서 설명 된 절차를 사용 하 여 같은 해 접시에 UAS-pHerry/c724-GAL4 비행에서 앞쪽 MTs를 해 부.
- 같은 이미징 단계 5.8-5.11에에서 설명 된 대로 잘으로 MTs의 2 세트를 전송 합니다.
참고: 슬라이드 아래로 MTs의 팔을 강타 하는 때 배치 UAS-pHerry/c724-GAL4 와 서로 가까이 UAS-pHerry/capaR-GAL4 tubules의 MTs pHerry 표현 원금과 방사상 세포 동일한 필드 (구상 될 수 있다 그림 6A)입니다.
- NH4Cl prepulse 6.12 단계에 설명 된 대로 적용 됩니다.
참고: 경우에 일관 된 보정 (그림 4B) 달성 될 수 없었다, 접착제 후 보정 iPBS (pH 7.0, 10 µ M nigericin, 30 분 부 화)와 각 실험의 끝에 7.0 pHi 를 설정 하 여 포인트 교정 수행 관류 잘 구분선과 관류 장비 제거 되었습니다. - 방정식 2 다른 산 세그먼트 (를 사용 하 여 절대 또는 표준화 된 비율 적절)의 방사상과 교장 세포에서 추적을 보정 하 고 NH4Cl 철수 후 복구 단계를 사용 하 여 지 수 감퇴 기능을 적용 하 여 분석 통계 분석 소프트웨어와 붕괴 상수 (τ) (그림 6B) 지적.
공식 2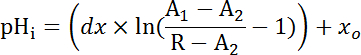
어디 R = SEpH/mCherry 비율 및1,2, xo, 그리고 dx 는 커브 피팅 매개 변수 보정 단계 7.4 (공식 1)에 의해 결정 됩니다.- PH나 pH나 고 산 준비34사이 로드 휴식에서 유사 하의 기능으로 (JH +, 방정식 3참조) 산 압출 속도 계산 합니다. 단계 8.3에서에서 파생 하는 지 수 함수를 사용 하 여 pH나 시간 각 시간 간격에서의 파생을 계산.
식 3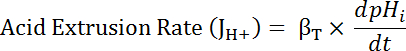
- 계산 하는 기본 버퍼링 용량 (βi; 방정식 4) 나 단계 8.3.1에서에서 각 간격의 시작에서 이전 문학에 따라 pH에 cytosol의 ( 식 4참조).
참고: 초파리에 βi 의 가장 철저 한 특성화 애벌레 모터 신경 맨끝35 와 이러한 데이터 산 셀 다른 사용 가능한 데이터의 부재에 대 한 개최 추측 될 수 있다.
방정식 4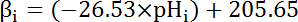
- JH + (식 3) 확인 βT (8.3.2 단계)에서 난/dt dpH (8.3.1 단계)에서 제품을 계산 합니다.
참고:이 프로토콜에서 설명 된 같은 명목상 중 탄산염-무료 솔루션, 중 탄산염-파생 된 용량을 버퍼링 (βb) 것으로 간주 됩니다 ~ 0mm. 총 용량 (βT) 버퍼링 β나 βb, 그리고 따라서 β의 합계는나 = βT HCO3-/CO236의 부재. - 플롯 JH + 는 pH나 의 함수로 단계 6.14.9에에서 설명 된 대로 각 시간 간격의 시작 부분에.
- 지 수 감퇴 기능 pH나 통계 분석 소프트웨어를 사용 하 여 겹치는 모든 집합의 부분에 적용 됩니다. 셀과 MT 세그먼트 (그림 6 c) 간의 산 압출 속도 비교 결과 기능 변화의 속도 비교 합니다.
참고: 커브 피팅 사용 하는 가장 적절 한 함수 항상 수 없습니다 단일 지 수 없습니다. 없습니다 그들은 적합의 미 덕을 개선 하는 경우 다른 함수를 교체하실 수 있습니다. - 계산 하는 산 성 pH나 셀 크기와 모양에서 유사 하의 기능으로 ( 방정식 5참조)를 유출.
방정식 5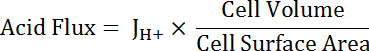
참고: 셀 크기 수 수 이미지에 직접 측정 하거나 근사 합니다. 주 셀 다음 크기와 빈 관의 반쪽으로 대표 될 수 있다: 내경 24 µ m; 외경 48 µ m; 높이 50 µ m. 과도 방사상 세포 변수 이지만 약 50 µ m의 높이와 직경 10 μ m의 원통형으로 대표 될 수 있다. 아래의 대표 결과 의 마지막 단락을 참조 하십시오. - 지 수 감퇴 기능 pH나 통계 분석 소프트웨어를 사용 하 여 겹치는 모든 데이터 집합의 부분에 적용 됩니다. 산 용 셀과 MT 세그먼트 (그림 6D) 간의 비교 결과 기능 변화의 속도 비교 합니다.
- PH나 pH나 고 산 준비34사이 로드 휴식에서 유사 하의 기능으로 (JH +, 방정식 3참조) 산 압출 속도 계산 합니다. 단계 8.3에서에서 파생 하는 지 수 함수를 사용 하 여 pH나 시간 각 시간 간격에서의 파생을 계산.
Access restricted. Please log in or start a trial to view this content.
결과
건강 한 조직 및 앞쪽 MTs의 적절 한 식별이이 프로토콜의 성공에 생명 이다. 해 부, 동안 주의 해야 직접 터치 하는 MTs와만 핸들을 그들은 MTs를 직접 잡지로 ureter 파손 (그림 4A- B)로 이어질 것입니다. MTs는 플랫 슬라이드에 휩 쓸, tubules는 가능한 조금만 진 해야 합니다 고이 피할 초과 모션 단일 셀 상피 층 (그...
Access restricted. Please log in or start a trial to view this content.
토론
Drosophila MTs에 pH나 의 정량화의 성공을 전적으로 추출 된 MTs와 장착 및 해 부그림 A - ( C)의 품질의 상태에 따라 달라 집니다. 따라서, 조직으로의 주의 깊은 취급 설명은 필수적입니다. PLL에 갓 코팅 슬라이드 실질적으로 솔루션 이전 노출 슬라이드 원조 마운트 장착 그들 보다 훨씬 더 많은 접착제 경향이. 주의 설치 또한 뚜렷한 산 세그먼트 (
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 없다.
감사의 말
이 작품은 NIH DK092408에 의해 지원 되었다 그리고 MFR. AJR에 DK100227 T32-DK007013에 의해 지원 되었다. 저자 CapaR GAL4와 c724 GAL4 박사 줄리안 A.T. 다우 감사 하고자 초파리 주식. 우리는 또한 실험적인 비행 십자가 유지 하는 지원에 대 한 야 곱 B. 앤더슨을 감사 합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Poly-L-Lysine (PLL) Solution | Sigma-Aldrich | P4832 | Store at 4 °C, can be reused. |
| Nigericin Sodium Salt | Sigma-Aldrich | N7143 | CAUTION: Handle with gloves. Store as aliquots of 20 mM stock solution in DMSO at 4 °C. |
| Adhesive Perfusion Chamber Covers, adhesive size 1 mm, chamber diameter × thickness 9 mm × 0.9 mm, ports diameter 1.5 mm | Sigma-Aldrich | GBL622105 | Can be substituted as needed to match perfusion system. |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Available from multiple vendors. |
| Helping Hands Soldering Stands | Harbor Freight Tools | 60501 | Available from multiple vendors. |
| Open Gravity-fed Perfusion System with Valve Controller, 8 to 1 Manifold and Reserviors | Bioscience Tools | PS-8S | Any comparable perfusion system can be used. |
| Flow Regulator | Warner Instruments | 64-0221 | Can be substituted as needed to match perfusion system. |
| Schneider's Medium | Fisher Scientific | 21720024 | Store at 4 °C in sterile aliquots. |
| #5 Inox Steel Forceps | Fine Science Tools | 11252-20 | Can be substituted based on experimenter comfort. |
| 35 x 10 mm polystyrene Petri dish | Corning Life Sciences | Fisher Scientific 08-757-100A | Exact brand and size are unimportant. |
| 75 x 25 mm Microscope Slides | Corning Life Sciences | 2949-75X25 | Exact brand and size can vary as long as perfusion wells are compatible. |
| Filimented Borosilicate Capillary Glass, ID 1.5 mm, OD 0.86 mm, thickness 0.32 mm | Warner Instruments | 64-0796 | Filiment not necessary, glass can be substituted to match perfusion tubing and perfusion wells. |
| Tygon Tubing, ID 1/16", OD 1/8", thickness 1/32" | Fisher Scientific | 14-171-129 | Available from multiple vendors, can be substituted to match perfusion system. |
| Vacuum Silicone Grease | Sigma-Aldrich | Z273554 | Available from multiple vendors. |
| Plastic Flow Control Clamp | Fisher Scientific | 05-869 | Available from multiple vendors, sterility not required |
| Glass rods, 5 mm diameter | delphiglass.com | 9198 | Exact size is personal preference, multiple vendors available |
| PAP Hydrophobic Pen | Sigma-Aldrich | Z377821 | Available from multiple vendors. |
| Sealing Film | Sigma-Aldrich | P7668 | Available from multiple vendors. |
| 15 mL Falcon tube | BD Falcon | 352096 | Available from multiple vendors. |
| 50 mL Falcon tube | BD Falcon | 352070 | Available from multiple vendors. |
| HEPES; 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Sigma-Aldrich | H3375 | Available from multiple vendors. |
| MES; 4-Morpholineethanesulfonic acid monohydrate | Sigma-Aldrich | 69892 | Available from multiple vendors. |
| TAPS; N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid | Sigma-Aldrich | T5130 | Available from multiple vendors. |
| 10X/0.45 Air Objective | Zeiss | 000000-1063-139 | Comparable objectives can be substituted. 40X objectives can be used for single cell imaging. |
| Dissecting Stereoscope | Zeiss | Discovery.V8 | Any dissecting stereoscope can be used. |
| UAS-pHerry transgenic Drosophila melagnogaster | Available from Romero Lab | First published: Citation 10 | |
| capaR-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 32 | |
| c724-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 2 | |
| Monochromatic High Sensitivity Digital Camera | Zeiss | Axiocam 506 mono | Exact brand and model can vary, can be replaced with any monochromatic high-sensitivity camera suited to live cellular imaging. |
| GFP/FITC filter set, 470/40 nm ex., 515 nm longpass em., 500 nm dichroic | Chroma | CZ909 | Any GFP/FITC filer set can be substituted. |
| RFP/TRITC filter set, 546/10 nm ex., 590 nm longpass em., 565 nm dichroic | Chroma | CZ915 | Any GFP/FITC filer set can be substituted. |
| Inverted Epifluoescent Microscope | Zeiss | Axio Observer Z.1 | Any comparable microscope with motorized filter switching can be used. Upright microscopes can be used with open perfusion baths and water-immersion objectives. |
| Statistical Analysis Software | Microcal | Origin 6.0 | Any software with comparable functionality can be substituted |
| Image Analysis Software | National Institutes of Health | ImageJ 1.50i | Any software with comparable functionality can be substituted |
| Image Acquisition Software | Zeiss | Zen 1.1.2.0 | Any software with comparable functionality can be substituted |
| Single-edged Carbon Steel Razor Blade | Electron Microscopy Sciences | 71960 | Available from multiple vendors. |
| Microscopy Slide Folder | Fisher Scientific | 16-04 | Available from multiple vendors. |
| Bunsen Burner | Fisher Scientific | 50-110-1231 | Available from multiple vendors. |
| Polystrene Drosophila Rearing Vials with Flugs | Genesee Scientific | 32-109BF | Comparable items can be substituted. |
| 2.5 L Laboratory Ice Bucket | Fisher Scientific | 07-210-129 | Available from multiple vendors. |
| NMDG; N-Methyl-D-glucamine | Sigma-Aldrich | M2004 | Available from multiple vendors. |
| 200 uL barrier pipette tips | MidSci | AV200 | Available from multiple vendors. |
| 200 μL variable volume pipette | Gilson Incorporated | PIPETMAN P200 | Available from multiple vendors. |
참고문헌
- Dow, J. A. T., Romero, M. F. Drosophila provides rapid modeling of renal development, function, and disease. Am J Physiol Renal Physiol. 299 (6), F1237-F1244 (2010).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. P Natl Acad Sci USA. 94 (10), 5207-5212 (1997).
- Davies, S. A., et al. Analysis and inactivation of vha55, the gene encoding the vacuolar ATPase B-subunit in Drosophila melanogaster reveals a larval lethal phenotype. J Biol Chem. 271 (48), 30677-30684 (1996).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. P Natl Acad Sci USA. 101 (37), 13689-13693 (2004).
- Evans, J. M., Allan, A. K., Davies, S. A., Dow, J. A. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function. J Exp Biol. 208 (Pt 19), 3771-3783 (2005).
- Sciortino, C. M., Shrode, L. D., Fletcher, B. R., Harte, P. J., Romero, M. F. Localization of endogenous and recombinant Na(+)-driven anion exchanger protein NDAE1 from Drosophila melanogaster. Am J Physiol Cell Physiol. 281 (2), C449-C463 (2001).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207 (Pt 15), 2599-2609 (2004).
- O'Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274 (4 Pt 2), R1039-R1049 (1998).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. P Natl Acad Sci USA. 111 (39), 14301-14306 (2014).
- Rossano, A. J., Kato, A., Minard, K. I., Romero, M. F., Macleod, G. T. Na+ /H+ -exchange via the Drosophila vesicular glutamate transporter (DVGLUT) mediates activity-induced acid efflux from presynaptic terminals. J Physiol. 595 (3), 805-824 (2017).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys J. 79 (4), 2199-2208 (2000).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat biotechnol. 22 (12), 1567-1572 (2004).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151(2007).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Hirata, T., et al. In vivo Drosophilia genetic model for calcium oxalate nephrolithiasis. Am J Physiol Renal Physiol. 303 (11), F1555-F1562 (2012).
- Schellinger, J. N., Rodan, A. R. Use of the Ramsay Assay to Measure Fluid Secretion and Ion Flux Rates in the Drosophila melanogaster Malpighian Tubule. J Vis Exp. (105), (2015).
- Caldwell, P. C. An investigation of the intracellular pH of crab muscle fibres by means of micro-glass and micro-tungsten electrodes. J Physiol. 126 (1), 169-180 (1954).
- Boron, W. F., De Weer, P. Intracellular pH transients in squid giant axons caused by CO2, NH3, and metabolic inhibitors. J Gen Physiol. 67 (1), 91-112 (1976).
- Rink, T. J., Tsien, R. Y., Pozzan, T. Cytoplasmic pH and free Mg2+ in lymphocytes. J Cell Biol. 95 (1), 189-196 (1982).
- Bizzarri, R., Serresi, M., Luin, S., Beltram, F. Green fluorescent protein based pH indicators for in vivo use: a review. Anal Bioanal Chem. 393 (4), 1107-1122 (2009).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys J. 74 (3), 1591-1599 (1998).
- Raimondo, J. V., Irkle, A., Wefelmeyer, W., Newey, S. E., Akerman, C. J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons. Front Mol Neurosci. 5, 68(2012).
- Raimondo, J. V., et al. Tight Coupling of Astrocyte pH Dynamics to Epileptiform Activity Revealed by Genetically Encoded pH Sensors. J Neurosci. 36 (26), 7002-7013 (2016).
- Bagar, T., Altenbach, K., Read, N. D., Bencina, M. Live-Cell imaging and measurement of intracellular pH in filamentous fungi using a genetically encoded ratiometric probe. Eukaryot Cell. 8 (5), 703-712 (2009).
- Gjetting, K. S., Ytting, C. K., Schulz, A., Fuglsang, A. T. Live imaging of intra- and extracellular pH in plants using pHusion, a novel genetically encoded biosensor. J Exp Bot. 63 (8), 3207-3218 (2012).
- Greenspan, R. J. Fly pushing: the theory and practice of Drosophila genetics. , 2nd ed, Cold Spring Harbor Laboratory Press. (2004).
- Raimondo, J. V., et al. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front Cell Neurosci. 7, 202(2013).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. J Cell Biol. 188 (4), 547-563 (2010).
- Terhzaz, S., et al. Mechanism and function of Drosophila capa GPCR: a desiccation stress-responsive receptor with functional homology to human neuromedinU receptor. PloS one. 7 (1), e29897(2012).
- Boyarsky, G., Ganz, M. B., Sterzel, R. B., Boron, W. F. pH regulation in single glomerular mesangial cells. I. Acid extrusion in absence and presence of HCO3. Am J Physiol. 255 (6 Pt 1), C844-C856 (1988).
- Chesler, M. The regulation and modulation of pH in the nervous system. Prog Neurobiol. 34 (5), 401-427 (1990).
- Rossano, A. J., Chouhan, A. K., Macleod, G. T. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
- Roos, A., Boron, W. F. Intracellular pH. Physiol Rev. 61 (2), 296-434 (1981).
- Vaughan-Jones, R. D., Wu, M. L. pH dependence of intrinsic H+ buffering power in the sheep cardiac Purkinje fibre. J Physiol. 425, 429-448 (1990).
- Buckler, K. J., Vaughan-Jones, R. D., Peers, C., Nye, P. C. Intracellular pH and its regulation in isolated type I carotid body cells of the neonatal rat. J Physiol. 436, 107-129 (1991).
- Bevensee, M. O., Schwiening, C. J., Boron, W. F. Use of BCECF and propidium iodide to assess membrane integrity of acutely isolated CA1 neurons from rat hippocampus. J Neurosci Methods. 58 (1-2), 61-75 (1995).
- Arosio, D., et al. Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nat Methods. 7 (7), 516-518 (2010).
- Wu, Y., Baum, M., Huang, C. L., Rodan, A. R. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function. Am J Physiol Regul Integr Comp Physiol. 309 (7), R747-R756 (2015).
- Schulte, A., Lorenzen, I., Bottcher, M., Plieth, C. A novel fluorescent pH probe for expression in plants. Plant Methods. 2, 7(2006).
- Shen, Y., Rosendale, M., Campbell, R. E., Perrais, D. pHuji, a pH-sensitive red fluorescent protein for imaging of exo- and endocytosis. J Cell Biol. 207 (3), 419-432 (2014).
- Johnson, D. E., et al. Red fluorescent protein pH biosensor to detect concentrative nucleoside transport. J Biol Chem. 284 (31), 20499-20511 (2009).
- Mahon, M. J. pHluorin2: an enhanced, ratiometric, pH-sensitive green florescent protein. Adv Biosci Biotechnol. 2 (3), 132-137 (2011).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Tantama, M., Hung, Y. P., Yellen, G. Imaging intracellular pH in live cells with a genetically encoded red fluorescent protein sensor. J Am Chem Soc. 133 (26), 10034-10037 (2011).
- Matlashov, M. E., et al. Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochimica et biophysica acta. 1850 (11), 2318-2328 (2015).
- Kogure, T., et al. A fluorescent variant of a protein from the stony coral Montipora facilitates dual-color single-laser fluorescence cross-correlation spectroscopy. Nat biotechnol. 24 (5), 577-581 (2006).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. P Natl Acad Sci USA. 95 (12), 6803-6808 (1998).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Stornaiuolo, M., et al. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Mol Biol Cell. 14 (3), 889-902 (2003).
- Makkerh, J. P., Dingwall, C., Laskey, R. A. Comparative mutagenesis of nuclear localization signals reveals the importance of neutral and acidic amino acids. Curr Biol. 6 (8), 1025-1027 (1996).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- McGuire, R. M., Silberg, J. J., Pereira, F. A., Raphael, R. M. Selective cell-surface labeling of the molecular motor protein prestin. Biochem Biophys Res Comm. 410 (1), 134-139 (2011).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유