JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세균성 성장의 정확한, 높은 처리량 분석
요약
세균성 성장의 양적 평가 시스템 수준 현상으로 미생물 생리학을 이해 하는 데 필수적입니다. 실험적인 조작 및 분석 접근 프로토콜, 세균성 성장, 시스템 생물학의 핵심 주제는의 정확한, 높은 처리량 분석에 대 한 허용 소개.
초록
세균성 성장 시스템 수준에서 세포 역학 조사에서 뿐만 아니라 현대 미생물 생리학의 발달에 중앙 개념 이다. 최근 연구는 세균성 성장 및 게놈 감소와 transcriptome 개편 같은 게놈 넓은 이벤트 사이의 상관 관계를 보고 했다. 올바르게 박테리아의 성장을 분석 유전자 기능 및 세포 구성 성분의 성장-종속 조정 이해 결정적 이다. 따라서, 높은 처리량으로 세균 성장의 정확한 정량적 인 평가 필요 합니다. 신흥 기술 개발 공부 하는 박테리아의 성장을 위해 사용 하는 방법의 업데이트를 허용 하는 새로운 실험 도구를 제공 합니다. 여기 소개 하는 프로토콜 세균성 성장의 재현 하 고 정확한 평가 위해 고도로 최적화 된 실험적인 절차 microplate 리더를 사용 합니다. 이 프로토콜의 성장을 평가 하는 데 사용 되었다 대장균 변종 설명한. 프로토콜의 주요 단계는 다음과 같습니다: 재현할 결과와 높은 처리량 성장 평가 96 잘 접시를 사용 하 여, 두 가지 주요의 수동 계산 반복된 테스트에 대 한 작은 튜브에서 셀 주식의 많은 수의 준비 매개 변수 (즉, 최대 성장 속도 인구 밀도) 성장 역학을 나타내는. 전통적인 식민지 형성 단위 (CFU) 분석 결과, 한 천 배지에서 시간이 지남에 따라 유리 튜브에 교양 있는 셀을 계산, 비교 현재의 방법 보다 효율적 고 성장 변화, 자세한 시간 레코드를 제공 합니다 하지만 엄격한 낮은 인구 밀도에 검색 제한입니다. 요약, 설명된 방법 개념적 결론 또는 이론적 관찰 하도록 이용 될 수 있는 세균 성장의 정확 하 고 재현성 높은 처리량 분석을 위해 유리 하다.
서문
미생물 연구는 종종 세균 세포의 문화, 그리고 세균 생리학1,2,3의 기본적인 현상을 대표 하는 세균성 성장 곡선의 평가로 시작 합니다. 세균성 문화는 근본적인 방법론 때문에 기본적인 문화 원리 교과서 출판된 연구 문학에 널리 사용할 수 있습니다. 벤치 수준에서 상당한 관심은 전통적으로에 초점을 맞춘 성장 미디어 최적화와 배양 조건, 하지만 성장 속도 제어는 미생물 생리학의 더 큰 이해를 제공할 것입니다 가능성이 되지 않았습니다. 광범위 하 게 공부4. 기 하 급수적으로 성장 하는 박테리아, 세포의 주요 매개 변수는 성장률, 게놈, transcriptome와 프로테옴5,6,7,8 조정 될 것으로 보고 되었습니다. . 따라서, 세균성 성장의 양적 평가 미생물 생리학을 이해 결정적 이다.
세균성 성장 평가, 바이오 매스를 추정 하는 데 사용 하는 실험 방법 잘 설립된9,10 있으며 광 탁 등, 물리적, 생화학 또는 생물 학적 매개 변수의 탐지에 기반. 또한, 성장 변경의 동적 속성을 캡처하는 데 사용 하는 분석 방법 설립된 비선형 모델11,,1213, 예를 들어 로지스틱 방정식에 일반적으로 근거한 다. 성장 역학 광 탁도 측정 하거나 콜로 니 형성 단위 (CFU) 분석 실험을 수행 하 여 셀 성장 문화에서의 시간된 샘플링에 의해 일반적으로 획득 됩니다. 이러한 배양 및 검출 방법의 한계는 데이터 요소는 없습니다 인구 역학의 진정한 반사 측정 간격 시간에 종종 있기 때문에 때문에 문화 조건 (예를 들어, 온도 변경 및 통 기 통풍) 샘플링 시간에 교란 된다. 문화 및 분석 기술은 최근 개발 기술 및 이해를 사용 하 여 업데이트 해야 합니다. Microplate 리더의 최근 발전 세균 성장의 실시간 관찰을 허용 하 고 노동 비용을 크게 감소. 이러한 고급 장치를 사용 하 여, 세균성 성장에 대 한 최신 연구는 높은 처리량 측정14,15에 대 한 분석 방법 보고.
이 프로토콜의 목적은 궁극적으로 어떻게 성장 율 결정 되 고 어떤 요인에 영향을 미치는 성장 율의 질문 하는 양적 연구에 대 한 가치가 있을 것입니다 높은 처리 방식으로 정확한 성장 역학을 평가 하는 것입니다. 프로토콜 세균 성장의 반복 가능 하 고 정확한 정량에 대 한 계정으로 이동 해야 하는 모든 요소를 해결 합니다. 실험 방법 및 분석 주요 텍스트에서 자세히 설명 합니다. 이 메서드는 높은 처리량 방법에서 세균 성장의 정확 하 고 재현성 분석을 허용합니다. 미생물학은 그들의 실험적인 증거 추가 양적 결과 파생이 프로토콜을 사용할 수 있습니다. 이 프로토콜은 또한 개념적 결론 또는 성장에 대 한 이론적 개요를 달성 하기 위해 시도 하는 시스템 생물학에서 연구를 위해 사용할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 성장 매체를 준비
참고: 최소한의 중간 M63의 화학 조성은 다음과 같습니다: 62 m K m 2 HPO 4, 39mm KH 2 포 4, 15 밀리미터 (NH 4) 2 등 4, 1.8 µ M FeSO 4, 15 µ M 티 아민-HCl, 0.2 m m MgSO 4 및 22 m m 포도 당. M63 3 재고 솔루션을 혼합 하 여 이루어집니다: 5 X 솔루션, 20% 포도 당 및 MgSO 4 티 아민 솔루션. 4 모든 솔루션을 저장 ° C.
- FeSO 4 솔루션을 준비 하는 5 X 솔루션
- 준비를 사용 하 여 전기 피 펫, 일회용 혈 청 학적인 피 펫 ddH 2 O 50 mL 원심 분리기 튜브를 추가. P-200 0.06 mL HCl 0.01 M HCl. 추가 36 mg FeSO 4-7 H 2 O를 섞어 잘 추가를 사용 하 여.
- 160 mL ddH 2 O 측정 실린더에 측정 하 고 500 mL 비 커에 추가. 이 순서 대로 다음을 추가: 10.72 g K 2 HPO 4, 5.24 g KH 2 포 4, 2.0 g (NH 4) 2 등 4, 그리고 0.5 mL FeSO 4 솔루션 (단계 1.1.1에서에서 준비).
- 2 분 코를 추가 하 여 7.0에 pH를 조정 하는 정밀 pH 미터를 사용 하 여. 측정 실린더에 솔루션을 붓는 다 고 200 mL의 총 볼륨 ddH 2 O를 추가 합니다. 250 mL 여과 장치 (PVDF, 0.22 μ M)를 사용 하 여 솔루션을 소독.
- 준비 20% 포도 당 솔루션
- 200 mL ddH 2 O 측정 실린더에 측정 하 고는 500 mL 비이 커에 부 어. 자력 교 반기를 사용 하 여 혼합 하는 동안 포도 당 50g을 추가 합니다. 250 mL의 총 볼륨 측정 실린더에 솔루션을 희석. 1.1.3 단계에 설명 된 대로 솔루션을 소독.
- MgSO 4 티 아민 솔루션 준비
- 500 mL 비 커에 150 mL ddH 2 O를 추가. 자력으로 혼합 될 때 200 mL의 총 볼륨 측정 실린더에 있는 티 아민-HCl와 MgSO 4-7 H 2 o. Dilute 솔루션의 10 g 1.0 g을 추가 합니다. 1.1.3 단계에 설명 된 대로 솔루션을 소독.
- 최소 중간 M63 준비
- 5 X 솔루션, 20% 포도 당 솔루션, MgSO 4 티 아민 솔루션, 전자 피 펫, P-200 피 펫 및 깨끗 한 벤치에 200 µ L 피 펫 팁.
- 155.8 mL ddH 2 O 측정 실린더에 측정 하 고 500 mL 비 커에 부 어.
- 전자 피 펫, 일회용 혈 청 학적인 피 펫을 사용 하 여 추가 5 X 솔루션 및 4 mL 20% 포도 당 용액 40 mL 측정된 ddH 2 o. 그런 다음, 추가 0.2 mL는 P-200 MgSO 4 티 아민 솔루션. 1.1.3 단계에 설명 된 대로 솔루션을 소독.
2. 글리세롤 재고 준비
- 셀 문화
참고: (예를 들어, W3110 및 그것의 감소 된 게놈) 세균성 긴장 스트레인 은행 조직에서 사용할 수 있습니다. 긴장 한 천 배지에서 식민지의 형태로 일반적으로 얻을 수 있습니다.- 장소 5 소독된 유리 튜브와 실리콘 고무 마 개, 전자 피 펫, P-1,000, 1000 µ L 피 펫 팁, P-200, 200 µ L 피 펫 팁, 클린 벤치에 대상 긴장 (접시에 식민지).
- 는 실리콘 고무 마 개를 열기 전에 분 젠 버너 유리 튜브의 입 노출. 튜브 열 후 불꽃에 실리콘 고무 마 개를 노출 하 고 가볍게 유리 튜브에 다시 뚜껑을 배치.
- 전자 피 펫, 일회용 혈 청 학적인 피 펫을 사용 하 여 유리 튜브와 4.5 mL M63 다른 4 개의 튜브 중 하나에 5 mL M63 추가.
- P-200 팁을 사용 하 여 식민지를 선택 5 mL M63 포함 된 유리 튜브에 접종을.
- 소용돌이 관 정지 수 있도록입니다. 그런 다음 솔루션을 10 배 희석 4.5 mL M63 포함 된 4 개의 튜브 중 하나에이 솔루션의 0.5 mL를 옮겨서.
- 는 2.1.5 나머지 튜브에 대 한 단계에서 설명 하는 프로세스를 반복 합니다. 5 다른 농도로 희석 시리즈 (1, 10, 100, 1000, 희석 및 10000) 이제.
- 소독 유리 튜브 및 실리콘 고무 stoppers 2.1.2 단계에 설명 된 대로 입. 모자는 stoppers 튜브. 하지 주름 실리콘 고무 마 개에 의해 오염 방지.
- 37 ° C에 미리 데워 진된 떨고 인큐베이터에서 5 개의 튜브를 배치 하 고 200 rpm에서 흔들어. 하룻밤 또는 10 ~ 30 헤에 대 한 문화를 품 어
- 글리세롤 주식에 대 한 문화의 선택
- 깨끗 한 벤치에 미리 따뜻하게 실내 온도 M63 매체, P-1,000, 1000 µ L 피 펫 팁, 그리고 일회용 cuvette 장소.
- 추가 1000 µ L P-1, 000와 일회용 cuvette에 M63. 분 광 광도 계에 일회용 cuvette, 600의 고정된 파장에서 프로그램을 시작, 및 측정 빈.
- 떨고 인큐베이터에서 클린 벤치 5 유리 튜브를 이동.
- 삭제 M63 일회용 cuvette에서 1000 µ L 문화 P-1, 000와 같은 일회용 cuvette에 추가. 2.2.2 단계에서 설명한 대로 세포 배양 (OD 600)의 광 탁도 측정.
참고: 모든 오염을 방지 하 고 정확한 측정을 달성 하기 위해 노출 유리 튜브와 같이 불꽃을 소용돌이 샘플링 하기 전에 문화 stoppers. 신뢰할 수 있는 결과 보장 하기 위해, 반복된 측정은 것이 좋습니다, 특히 때 셀 밀도. - 다섯 셀 문화, 초기 지 수 성장 단계에 있는 하나를 선택 (OD 600 = 0.01-0.05) 글리세롤 주식.
참고: 여러 문화 최적의 범위 내에서 밀도, 가장 가까운 0.05에 일반적으로 선택 됩니다.
- 반복된 테스트에 대 한 글리세롤 주식 확인.
참고: 10 주식을 준비 하기 위한이 설명 합니다. 실험 요구 사항에 따라 더 크게 또는 더 작은 금액을 만들 수 있습니다.- 소독된 60% 글리세롤 용액 10 1.5 mL microtubes, P-1,000 소독 놓고 P-200, 1000 그리고 200 µ L 피 펫 팁, 그리고는 microtube 깨끗 한 벤치에 서 서.
- 추가 250 µ L pipetting에 의해 60% 글리세롤 솔루션 및 1.5 mL microtube 믹스를 선택한 세포 배양의 750 µ L 소독.
참고: 스톡 볼륨 변수 이지만 항상 셀 문화; 60% 글리세롤의 1:3 비율을 유지 이 결과 15% 글리세롤의 최종 농도. - 는 Microtube 서에서 나머지 9 microtubes 놓고 준비 단계 2.3.2 각 관에서에서 혼합물의 100 µ L를 분배 합니다. 지금 미래 사용을 위해 10 동일한 글리세롤 주식 있다.
- 주식-80에서 깊은 냉동 실에 저장 ° c.
3. 성장 곡선 인수
- microplate 리더 설정.
참고: (재료의 표 참조) 플레이트 리더에 사용 하는 특정 말 씨는 여기에 사용 된 인용 부호 표시에 표시 된 조건. - 오픈 소프트웨어
- 입니다. 오픈 " 프로토콜 "에 " 작업 관리자 " 선택 " 새로 만들기 ". 선택 " 표준 프로토콜 ".
- 오픈 " 프로시저 ", 설정을 조정 하 고. 오픈 " 설정 온도 ", 선택 하 고 " 인큐베이터에 ". 설정 " 온도 " 37 ° C에 그리고 " 그라데이션 "을 0 ° C. 확인 " 예 열 " 다음 단계를 계속 하기 전에. 오픈 " 운동 시작 ", set " 실행 시간 " 24시: 00 또는 48:00:00, 및 " 간격 " 00시 30분: 00 또는 01시: 00.
참고: 전체 96 잘 접시 읽을 약 1 분 걸립니다. - 오픈 " 흔들어 " 설정 " 흔들 모드 "으로 " 선형 ". 체크 " Constitution 쉐이크 " 설정 " 주파수 " 567 cpm에서. 오픈 " 읽기 ", 확인 " 흡 광도 ", " 끝점/운동 ", 및 " Monochromators. " 설정 " 파장 " 600.
- 클릭 " 유효성 검사 " 절차 올바른지 확인 합니다. 클릭 " 저장 " 미래 사용을 위한 새로운 프로그램으로 그것을 저장 하.
- 오픈 " 프로시저 ", 설정을 조정 하 고. 오픈 " 설정 온도 ", 선택 하 고 " 인큐베이터에 ". 설정 " 온도 " 37 ° C에 그리고 " 그라데이션 "을 0 ° C. 확인 " 예 열 " 다음 단계를 계속 하기 전에. 오픈 " 운동 시작 ", set " 실행 시간 " 24시: 00 또는 48:00:00, 및 " 간격 " 00시 30분: 00 또는 01시: 00.
- 성장의 기록 실시간
- 96 잘 접시에 접종된 문화 샘플의 위치를 나타내기 위해 96 잘 접시 그림 (8 × 12 테이블)를 그립니다. 테이블을 출력 하 고 실험에 대 한 참조로 사용.
참고: 웰 스는 미 판의 가장자리에 있는 포함 빈 매체 증발 때문. - 장소 소독된 96 잘 평면 바닥 microplate와 뚜껑, P-1000, 1000 µ L 피 펫 팁, P-200, 200 µ L 피 펫 팁, 여러 1.5 mL microtubes, 8-멀티 채널 피 펫, 멸 균된 시 저수지, 실내 온도 M63, 글 리세 린 주식 (2.3 단계에서 준비) 깨끗 한 벤치에.
- 시 저수지에 M63 약 25 mL를 추가합니다. 이 저수지 주식에 대 한 모든 다음 단계 사용 하 여.
- 추가 900 µ L 직렬 희석을 만들기 위한 준비에 microtubes에 M63.
- 는 글리세롤 재고 실 온에서 해 동. 900 µ L을 추가 해 동된 글리세롤 주식과 소용돌이에 M63. 그러면 원래 글리세롤 주식의 10 희석.
- 다른 microtube M63 및 소용돌이의 900 µ L을 포함 하 게 10 희석의 전송 100 µ L. 그러면 100 희석.
- 3.2.6 희석의 원하는 숫자를 얻을 때까지 반복 단계.
- 채우기 200 µ L M63 사용 microplate의 가장자리에서 웰 스는 8 개 채널 피 펫 (P-200).
참고:이 웰 스는 빈으로 사용할 수 있습니다. - 부하 200 µ L 각 샘플 준비 단계-3.2.4 3.2.7 참조 테이블 (단계 3.2.1)에 따르면 미 판 우물을 희석. 소용돌이 희석된 샘플 전에 로드 및 로드 같은 샘플에 여러 우물에 다양 한 접시에 위치.
- 플레이트 리더에 96-잘 미 판 배치.
- 오픈 " 읽기 지금 "에 " 작업 관리자 " (3.1 단원) 프로그램을 선택 하십시오. 클릭 " 확인 "를 측정 시작. 데이터 분석 (제 4)에 대 한 새로운 실험 파일로 녹음을 저장.
- 96 잘 접시에 접종된 문화 샘플의 위치를 나타내기 위해 96 잘 접시 그림 (8 × 12 테이블)를 그립니다. 테이블을 출력 하 고 실험에 대 한 참조로 사용.
4. 데이터 분석
- 수출 USB 메모리를 실시간 성장 율 데이터 (3.2 단원)의 결과 텍스트 파일로 스틱.
참고: 96-잘 포맷 된 결과 (곡선) 실시간으로 플레이트 리더에 표시 됩니다. 시간별 레코드 (OD 값); 테이블로 내보낼 수 있습니다. 행과 열 대표 잘 번호 (예를 들어, A1, B1)과 측정 시간 (예: 00시: 59), 각각. - 스프레드시트 소프트웨어와 함께 텍스트 파일을 엽니다.
- 96 잘 microplate의 시간별 OD 600 읽기 추가 분석에 대 한 새 워크시트에 복사.
- 빼기 배경에서 읽는 시간 각 샘플의 시간별 읽기에서 제로 잘.
참고: 편의 위해, 빈의 평균값이 우물 포함 하 M63 (단계 3.2.8) 배경 값으로 사용할 수 있습니다. - 최대 인구 밀도 추정을 5 연속 세 600 읽기의 평균을 계산.
참고: 5 연속 세 600 읽기의 가장 큰 평균 값 해당 성장 곡선의 최대 OD 600으로 정의 됩니다. - OD 600의 모든 연속적인 값 쌍에 대 한 다음 방정식을 적용 하 여 성장 율, μ (h -1), 계산:
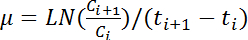
참고:이 수식에서는 C 나 및 C i + 1 어떤 두 연속 시간 포인트 (t i t i + 1의 OD 600 값을 나타냅니다 각각). LN 자연 로그값을 나타냅니다. - 계산 시간별 OD 600을 기반으로 시간이 지남에 성장 속도 변화 단계 4.6 따라 읽습니다. 평균 및 최대 성장 율 추정 5 연속 성장률의 표준 편차를 계산.
참고: 작은 표준 편차와 함께 가장 큰 의미는 해당 성장 곡선의 극대 성장 율으로 정의 됩니다.
5. 96-잘 읽기 (선택 사항)의 글로벌 바이어스 확인
참고: 두 접시 리더 및 소모품 96 잘 접시 한쪽으로 치우친된 측정을 발생할 수 있습니다. 매우 정확 하 고 재현 가능한 양적 결과 얻기 위해 96 잘 접시의 글로벌 바이어스를 확인 것이 좋습니다.
- 3.2.2 섹션에서 설명한 대로 96 잘 접시 및 플레이트 리더 바이어스 테스트에 대 한 준비.
- 추가 20 mL M63 소독된 50 mL 원심 분리기 튜브. 같은 원심 분리기 튜브와 소용돌이에 글리세롤 주식을 추가 합니다. 멸 균된 시 저수지에 정지 솔루션 전송.
- 8 채널 피 펫을 사용 하 여 일시 중단 된 솔루션의 200 µ L 96 잘 접시에 전송.
- 플레이트 리더에 96 잘 접시를 놓고 측정 시작.
- 기록 시간별 OD 600 읽어들이고 분석 섹션 4에서에서 설명한 대로. 96-잘 읽기의 locational 바이어스를 결정 하기 위해 각 잘 계산 된 최대 성장 속도 인구 밀도 비교.
Access restricted. Please log in or start a trial to view this content.
결과
설명된 방법 96-잘 형식 리더는 여러 광학 밀도 측정 (일 분)에서 다양 한 시간 간격을 이용 하 여 동적 세균성 성장을 지속, 높은 처리량으로에서 잡으려고 수단을 제공 합니다. 다양 한 유전자를 표현 하는 E. 콜라이 긴장의 구색의 성장 곡선 단일 실험 (그림 1A)에서 정확 하 게 취득 될 수 있다. 설명된 방법에 비해 전통적인 방법 (CFU 분석 결과)...
Access restricted. Please log in or start a trial to view this content.
토론
프로토콜에 중요 한 단계는 기 하 급수적으로 성장 하는 세포와 같은 샘플은 microplate에 다양 한 위치에서 여러 우물에서의 복제의 보통주 준비 포함 됩니다. 이전, 미생물학 하룻밤 사전 문화에서 문화를 시작 했다. 이 방법은 세균 성장의 지연 시간을 줄일 수 있습니다, 하는 동안 재현할 수 성장 곡선을 달성 하기 어렵다. 그림 2에서 같이 거의 동일한 성장 곡선, 재현할 수 ?...
Access restricted. Please log in or start a trial to view this content.
공개
고헤이 츠치야는 CFU 분석 결과 예제를 제공 하는 감사 합니다. 이 작품 부분적으로 재정적으로 지원 했다는 선진적인 26506003 과학 연구 (C) 호에 대 한 (BWY)에 교육, 문화, 스포츠, 과학 및 기술, 일본에서.
감사의 말
저자는 공개 없다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| K2HPO4 | Wako | 164-04295 | |
| KH2PO4 | Wako | 166-04255 | |
| (NH4)2SO4 | Wako | 019-03435 | |
| MgSO4-7H2O | Wako | 138-00415 | |
| Thiamine-HCl | Wako | 201-00852 | |
| glucose | Wako | 049-31165 | |
| HCl | Wako | 080-01066 | |
| Iron (II) sulfate heptahydrate (FeSO4-7H2O) | Wako | 094-01082 | |
| KOH | Wako | 168-21815 | |
| Glycerol | Wako | 075-00611 | |
| Centrifuge tube (50 mL, sterilized) | WATSON | 1342-050S | |
| Pipette Tips, 200 µL | WATSON | 110-705Y | |
| Pipette Tips, 1,000 µL | WATSON | 110-8040 | |
| Microtube (1.5 mL) | WATSON | 131-715C | |
| 8 multichannel-pipette | WATSON | NT-8200 | |
| PASORINA STIRRER | AS ONE | 2-4990-02 | |
| Glass cylinder (200 mL) | AS ONE | 1-8562-07 | |
| Precision pH mater | AS ONE | AS800 / 1-054-01 | |
| Pipetman P-200 | GILSON | 1-6855-05 | |
| Pipetman P-1000 | GILSON | 1-6855-06 | |
| Disposable Serolocical Pipettes (10 mL) | SANPLATEC | SAN27014 | |
| Disposable Serolocical Pipettes (25 mL) | SANPLATEC | SAN27015 | |
| Microtube stand | BM Bio | 801-02Y | |
| Vortex | BM Bio | BM-V1 | |
| Corning Costar 96-well microplate with lid (Flat bottom, Clear) | Sigma-Aldrich | Corning, 3370 | |
| Corning Costar reagent reservoir (50 mL) | Sigma-Aldrich | Corning, 4870 | |
| Stericup GV PVDF (250 mL, 0.22 µM) | Merck Millipore | SCGVU02RE | |
| Pipet-Aid XP | DRUMMOND | 4-000-101 | |
| Bioshaker (BR-23UM MR) | TAITEC | 0053778-000 | |
| Disposal cell (1.5 mL) | Kartell | 1938 / 2-478-02 | |
| DU 730 Life Science UV/Vis Spectrophotometer | Beckman Coulter | A23616 | |
| EPOCH2 | BioTek | 2014-EP2-002 / EPOCH2T | |
| Beaker (500 mL) | IWAKI | 82-0008 | |
| BIO clean bench | Panasonic | MCV-B131F | |
| Glass tubes | NICHIDEN RIKA GLASS | P-10M~P-30 /101019 | |
| Silicone rubber stoppers | ShinEtsu Polymer | T-19 | |
| Bacterial strains | Strain bank organization; National Bio Resource Project (NBRP) in Japan |
참고문헌
- Kovarova-Kovar, K., Egli, T. Growth kinetics of suspended microbial cells: from single-substrate-controlled growth to mixed-substrate kinetics. Microbiol Mol Biol Rev. 62 (3), 646-666 (1998).
- Soupene, E., et al. Physiological studies of Escherichia coli strain MG1655: growth defects and apparent cross-regulation of gene expression. J Bacteriol. 185 (18), 5611-5626 (2003).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Egli, T. Microbial growth and physiology: a call for better craftsmanship. Front Microbiol. 6, 287(2015).
- Kurokawa, M., Seno, S., Matsuda, H., Ying, B. W. Correlation between genome reduction and bacterial growth. DNA Res. 23 (6), 517-525 (2016).
- Matsumoto, Y., Murakami, Y., Tsuru, S., Ying, B. W., Yomo, T. Growth rate-coordinated transcriptome reorganization in bacteria. BMC Genomics. 14, 808(2013).
- Nahku, R., et al. Specific growth rate dependent transcriptome profiling of Escherichia coli K12 MG1655 in accelerostat cultures. J Biotechnol. 145 (1), 60-65 (2010).
- Dai, X., et al. Reduction of translating ribosomes enables Escherichia coli to maintain elongation rates during slow growth. Nat Microbiol. 2, 16231(2016).
- Madrid, R. E., Felice, C. J. Microbial biomass estimation. Crit Rev Biotechnol. 25 (3), 97-112 (2005).
- Harris, C. M., Kell, D. B. The estimation of microbial biomass. Biosensors. 1 (1), 17-84 (1985).
- Yates, G. T., Smotzer, T. On the lag phase and initial decline of microbial growth curves. J Theor Biol. 244 (3), 511-517 (2007).
- Kargi, F. Re-interpretation of the logistic equation for batch microbial growth in relation to Monod kinetics. Lett Appl Microbiol. 48 (4), 398-401 (2009).
- Peleg, M., Corradini, M. G. Microbial growth curves: what the models tell us and what they cannot. Crit Rev Food Sci Nutr. 51 (10), 917-945 (2011).
- Sprouffske, K., Wagner, A. Growthcurver: an R package for obtaining interpretable metrics from microbial growth curves. BMC Bioinformatics. 17, 172(2016).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Mol Biol Evol. 31 (1), 232-238 (2014).
- Hermsen, R., Okano, H., You, C., Werner, N., Hwa, T. A growth-rate composition formula for the growth of E.coli on co-utilized carbon substrates. Mol Syst Biol. 11 (4), 801(2015).
- Engen, S., Saether, B. E. r- and K-selection in fluctuating populations is determined by the evolutionary trade-off between two fitness measures: Growth rate and lifetime reproductive success. Evolution. 71 (1), 167-173 (2017).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유