Method Article
쥐에 있는 부분 시 신경 Transection: 망막 신경 절 세포의 2 차 변성을 평가 하기 위해 새로운 수술 방식으로 설립 모델
요약
망막 신경 절 세포 (RGCs)의 2 차 변성 녹 내장에서 일반적으로 발생합니다. 이 연구 부분 시 신경 transection 위한 혁신적인 수술 접근 방법을 설명합니다. 이 공간 절약 요원 접근의 사용 모델의 응용 범위를 확장 하며 보조 부상 메커니즘의 탐사 RGCs에 새로운 방식으로
초록
이전 연구에 망막 신경 절 세포 (RGCs)의 2 차 변성 녹 내장에서 일반적으로 발생 하는 것으로 나타났습니다. 부분 시 신경 transection 유용 하 고 재현할 수 모델을 간주 됩니다. 2 차 변성, 예를 들면 완전 한 시 신경 transection와 시 신경 호감 모델 평가 대 한 일반적으로 사용 되 다른 시 신경 상해 모델에 비해, 부분 시 신경 transection 모델은 우수한 기본 구분 제자리에서 2 차 변성. 따라서, 그것은 2 차 변성을 평가 하기 위한 훌륭한 도구 역할을 합니다. 이 연구는 직접 안구의 궤도 측면 벽을 통해 retrobulbar 시 신경의 영역에 액세스 하 여 부분 시 신경 transection의 소설 작용 접근법을 설명 합니다. 또한, 선물이 transection 지원 하기 위해 새롭게 설계 된, 저렴 한 비용 수술 악기. 기본 및 보조 부상 분야의 경계를 구별에 대표적인 결과 같이, 새로운 접근 및 악기 하면 높은 효율과 안정성 모델의 외과 수술에 대 한 충분 한 공간을 제공 하 여. 이 차례로 쉽게 transection 전에 시 신경에서 meningeal 칼 집 및 안과 혈관을 분리 있습니다. 추가적인 혜택은 공간 절약형 요원 이렇게 뒤에 메커니즘의 탐사를 허용 하는 부분적으로 transected 시 신경의 그 루터 기에 약물, 운반대, 또는 선택적 RGC 추적기를 관리 하는 수 사관의 능력을 향상 새로운 방식에서, RGCs에 보조 부상.
서문
2 차 변성 외상 성 부상, 그리고 다음 급성과 만성 신경 퇴행 성 질환 후에 중앙 신경 조직 (CNS)에 일반적으로 발생합니다. 1 , 2 , 3 , 4 , 5 주 병 적인 이벤트의 초기 결과 신경 그리고 glial 세포의 죽음은 불린다 기본 변성, 신경 및 또는 부분적 으로만 영향을 받지 않습니다 기본 glial 세포의 죽음에는 2 차 변성 손상입니다. RGCs의 2 차 변성 녹 내장에서 발생을 또한 믿어진다. 6 Yoles 외. 7 2 차 부상 RGCs의 시 신경 손상 모델에서 발생 하는 것을 확인 했다. 그들은 뉴런 누구의 axons 급성 피해는 결국 퇴행 성 환경으로 인해 타락 한 후 부상 되지 않았습니다 이러한 axons을 둘러싼 부상으로 생산 했다. 이 이차 변성 가해진 손상의 심각도 관련 된 진보적인 패션에 신경을 영향을 줍니다. 지금까지 녹 내장에서 RGC 손상 기본 메커니즘 불분명, 특히 부족 한 임상 치료에서 보조 부상에 관련 된 유지. 8 , 9 , 10 그러므로 필요는 녹 내장의 개발 하는 동안 RGCs의 보조 변성의 기본 메커니즘을 탐구입니다. 11 의 크기, 분포, 및 메커니즘 RGCs의 보조 변성의 양적 평가 수 보조 부상의 동물 모델 설립 과학자 공부 RGCs의 보조 부상 증가 주목을 끌고 있습니다.
이 문제를 명확 하 게 쥐 퐁 모델 Levkovitch-Verbin 그 외 여러분 에 의해 설립 되었다 12 axonal 상해 평가를 유도 변성 고 RGCs의 죽음. 이 모델 2 차 변성의 메커니즘을 탐구 하 고 잠재적인 신경 에이전트를 식별에 대 한 좋은 도구를 구성 하는 것 여겨진다. 보조 부상의이 모델을 생성 하는 데 사용 하는 악기는 완료 시 신경의 양적 transection 다이얼 노브를 통해 절단의 깊이 설정 하 여 양적 transect를 규모와 다이아몬드 칼입니다. 수술 경로 안구 위쪽 또는 일시적인 결 막에서 접근합니다. 수술 과정에서 망막 및 시 신경 수도 영향을 받을 차례로 주 부상을 일으킬 수 있습니다 집게의 힘에 의해. 더 중요 한 것은, 노출된 시 신경의 제한 된 공간 때문에 그것은 절 개 전에 meningeal 덮개 분리 어렵다. 따라서, 그것은 부분 시 신경 transection, 망막 허 혈 및 모델의 실패 귀착되는 동안 안과 혈관을 손상 수 있습니다. 또한, 다이아몬드 칼은 비용이 많이 드는, 그리고 각 사용 감소 팁 선명도. 이 영향을 미칠 수 깊이. 을 모델링의 효과
이 연구에서 설명 RGCs의 보조 변성의 모델 안구의 측면 궤도 벽에서 새로운 요원 접근 방식을 통해 얻은 것입니다. 소설 요원 이렇게 궤도 근육 콘, 아래쪽 또는 안구의 비 강 측면 사이드 쪽으로 당길 때 안구 및 시 신경 주 상해를 피하에 의해 둘러 쌓여 retrobulbar 시 신경에 직접 액세스 합니다. 이 또한 모델 설립, 동안 외과 수술의 공간을 증가 하 고 부분적으로 시 신경 transecting 전에 meningeal 칼 집 격리 수 있습니다. 그것은 실수로 참여와 안과 혈관의 부상 이어질 수 있는 모델의 실패를 통지 해야 합니다. 또한, 모델 transfected 세포, 마약과 transected 부분적으로 시 신경의 그 루터 기에 시 약의 후속 평가 수 있습니다. 자체 디자인된 수술 악기 저렴 하 고 사용된 여러 번 모델링의 비용을 줄일 수 있습니다. 이 방법에 의해 설립 RGCs의 보조 부상 모델 좋은 재현성 및 안정성을 보였다.
프로토콜
관련 된 동물 주제 기관 동물에 의해 승인 절차 관심과 사용 위원회 (IACUC) 수도 의과대학의. 모든 수술 기구 및 솔루션 미생물 감염을 제한 하는 수술 전에 소독 했다.
참고: 수술 프로토콜 포함 5 개 부품, 즉 마 취, 수술 방법, 시 신경 평가, 마지막으로, 및 복구. 시 신경의 부분 양적 transection 지원, 새로운, 저렴 한 비용 수술 악기 설계 되었다. 모든 절차는 윤리적인 규칙 및 수술 방법에 따라 실시 했다.
1. 수술 기법
- 무 균 기술을 사용 하 여 실험을 실시, 동물 사용에 대 한 프로토콜 특정 기관 이어야 합니다.
- Sterilize 악기 및 자료 (솔루션, 시험 물질, 추적기, 바늘, 등) 감염 및 동물 복지에 불리 한 영향 뿐만 아니라 연구에 잠재적인 부정적인 영향을 방지 하기 위해 생활 조직에 접촉으로 오는 .
2. 마 취
- 수의학 isoflurane 기화 기 시스템을 사용 하 여 Anesthetize SD 쥐. 1 L/min의 속도로 의학 급료 산소를 사용 하 여 증발 isoflurane 가스. 연결 된 마 취 상자에 동물 하 고 느린 호흡과 동물 진정까지 4.5%의 농도에서 isoflurane 실행.
- 가스 마스크 첨부 파일에 가스 흐름을 전환 하 고 작업 테이블에는 동물을 놓습니다. 2%와 모니터 마 취 isoflurane 농도를 낮춥니다. 큰 동물 (> 300 g) isoflurane의 높은 농도 필요할 수 있습니다. 적절 하 게 조정 isoflurane 복용량과, 수술 중 마 취를 모니터링 합니다. 끊임없이 깊이 호흡의 속도 평가 하 고 깊은 고통의 부재를 보장 하기 위해 발가락 핀치 평가 5 분 마다 수행.
- 수술 완료는 isoflurane 끄고 작업 테이블에서 제거 하기 전에 몇 분 동안 호흡 산소는 동물 허용. 수술 담요로 동물을 취재 하거나 수술 하는 동안 규제 난방 담요를 사용 하 여 체온을 유지.
3. 수술 보조 악기 (SSAI)를 자체 설계
- 는 SSAI 만든 스테인리스 스틸 및 주로 사용은 휴대용 극 (100 m m, 길이, 직경, 9 m m)와 홈된 헤드 ( 그림 1). 홈 붙이 머리의 홈이 있는 표면을 각각 수직 깊이, 폭, 및 200 µ m, 500 µ m 및 1000 µ m의 길이와 반원형 이다. 두 부분 사이 50 m m의 길이와 공동 섹션이입니다. 홈 붙이 머리 ' s 가장자리는 넓은 300 µ m.
참고: 홈된 표면 transection 복 부 시 신경을 안정화 수 있습니다. 지 시 신경 시 신경의 복 부 측; 내 낳는 때 홈의 외부에 노출 되 한편, 홈된 가장자리에 노출 등 시 신경 수직 절단을 수행 하면 transected 될 수 있습니다. 홈 붙이 표면에서 누워 복 부 시 신경 홈이 있는 머리에 의해 보호 됩니다 ' s 지. - RGCs 해당 양적 transected 시 신경 축 삭 (등 쪽), 하 주 상해를 구현 하는 보조 하면서 부상 RGCs 해당 직접 손상 없이 untransected 시 신경 축 삭 (복 부 측) 하에서 수행 것.
4. 외과 접근
- 장소 머리는 외과 의사를 직면 하 고 있는 수술 테이블에 위쪽으로 쥐의 오른쪽. 수술 시야의 중심에 바로 궤도 조정 합니다. 다음, 여러 번 측면 법 75% 에탄올에 0.5% 액체 적용 오른쪽 궤도 피부의 외부 음향 구멍을 따라 절 개 지역 청소. 아이리스가 위를 사용 하 여 외부 음향 구멍을 측면 법 사이 모피 제거.
- 는 0.5 1 cm의 길이 가진 외부 음향 구멍을 측면 법 따라 아이리스가 위를 사용 하 여 피부 절 개를 확인 합니다. 다음, 근 막과 위쪽 삼각형 쐐기를 만들려고 이빨된 집게를 0.12 m m 풀을 꼬집어. 절 개 영역으로 욕실이 봄이 위 낮은 블레이드를 삽입 하 고 같은 전단 방향으로 근 막 오픈 컷.
- 욕실이 함께 근 막 컷이 위 봄 하 고 궤도 정 맥 노출. 사용 날카로운 톱니 집게 클램프 궤도 정 맥의 측면 및 둔 절 개의 양쪽 열. 후속 작업을 촉진 하기 위하여 배치 되는 궤도 근육 표면의 수술 방향 궤도 정 맥 놓고 수술을 피하기 위해 궤도 정 맥 출혈 관련.
- 아이리스가 위로 잘라 오른쪽 측면 법 동안 궤도 근육의 무딘 해 부에 대 한 시야를 완전히 노출 하 절 개 라인 따라 떨어져 따라 습을 사용 하 여
- 클램프 subfascial 궤도 근육의 폴더와 무딘 계속 피부와 근 막 절 개의 방향에 수직으로 구분 합니다. 점차 궤도 지방이 많은 직물의 외관까지 궤도 깊이 도달 하는 측면에 따라 별도.
- 궤도 지방 조직에의 노출, 외과 의사의 오른쪽 측면에 세로로 직면에서 쥐 머리 방향 변경. 한편, 지역 지속적으로 촉촉한를 사용 하 여 수술 또는 면봉 포함 하는 메 마른 PBS 유지. 이 이렇게 촉 촉 하 고 부드러운 조직을 유지 하면서 수술 분야의 명확한 비전을 보장.
5. 시 신경에 액세스
- 궤도 adipose 조직 궤도 구멍에서 시 신경 주위 궤도 근육 콘 취재를 잘라. 이렇게 하면 적절 한 수술 방법의 더 나은 노출. 피하기 위해 제한 된 지방 조직의 유지 절제는 출혈 지속.
- 지방 조직, 측면 곧바로 노출 컷. 바깥쪽, 측면 곧바로 클램프 그리고 욕실이 봄이 위로 잘라. 지방 조직 측면 곧바로 아래 경우, 0.12 m m를 사용 하 여 시 신경 overlying 지방 올려 이빨 집게와 욕실이 봄이 위로 잘라.
참고:이 시간에, 광학 신경 주위 조직 칼 집 표시 되어야 합니다. - 계속 분리 시 신경의 총 노출까지 궤도 깊이에 시 신경의 방향 따라 조직 칼 집. 깨끗 한 조직 제거에서 발생 하는 깨끗 한 적은 양의 혈액을 수술 면봉을 사용 하 여 영역을 유지.
참고: 이제, 시 신경 표시 되어야 합니다. - 액세스, 안과 동맥 손상 없이 신경을 둘러싸는 meningeal 칼 집을 제거 합니다. 부드럽게 운영 현미경 고배율에서 경질의 혈관 패턴 검사를 칼 집 회전.
- 혈관, 없는 영역을 식별 하 고 경질에 경도 컷 수행. 13 찢 어 칼 집 26 G 바늘 팁 또는 사파이어 외과 프로브 knifepoint 시 신경의 방향에 평행한 신중 하 게, 측면 인하와 함께 맥 관 구조에 손상을 피하.
참고: 신경을 다루는 유일한 남은 거미 집 모양의 membra 해야 합니다.네브라스카, 매우 얇고 투명.
- 혈관, 없는 영역을 식별 하 고 경질에 경도 컷 수행. 13 찢 어 칼 집 26 G 바늘 팁 또는 사파이어 외과 프로브 knifepoint 시 신경의 방향에 평행한 신중 하 게, 측면 인하와 함께 맥 관 구조에 손상을 피하.
- 5.2 단계, 시 신경의 방향에 평행한 부드럽게 26 G 바늘 팁 또는 사파이어 외과 프로브의 knifepoint와 거미 집 모양의 막 버리고 비슷합니다. 13
- 결과 홈된 머리 가장자리 보다 약간 높은 되 고 지 시 신경에 부드럽게 하 고 신중 하 게,에 악기 홈 안에 시 신경을 하다. 이 시점에서 26 G 바늘 팁 홈된 머리 플랫폼의 가장자리 또는 knifepoint 사파이어 외과 프로브 부분 시 신경 transection 완료를 위에 지 시 신경 transect.
6. 닫는 및 복구
후자를 시 신경의- 이동 악기는 수직으로 좀 더 깊이 방향. 그런 다음, 부드럽게 악기의 홈이 있는 머리를 제거 합니다. 눈 근육 이나 다른 조직 추가 손상을 방지 하려면 스크래치 하지 마세요. 부분 시 신경 transection의 그 루터 기를 관찰할 수 있다.
- 측면 곧바로, 근 막 및 그들의 원래 위치로 눈의 다른 주변 조직 교체합니다. 그런 다음 순서로 근육 및 궤도의 피부 층 봉합. 출혈이 지속 되 면, 부드럽게 의료 면봉으로 상처를 닫기 전에 시간 동안 이것을 유지. 감염을 방지 하기 위해 상처에 항생제 연 고를 적용.
- 차례 isoflurane 소스 끄고 몇 분 동안 호흡 산소를 동물 허용. 쥐 소생 과정 온수 매트와 열 절연 제를 준비 하거나 건조 패딩 케이지 표면을 커버 합니다. 복구 프로세스 동안 쥐 기도 patency 되도록 담요와 동물 커버.
- 수술 후 개별적으로 집 동물입니다. 제도 동물 보호 기관에 의해 제공 된 지침에 따라 수술 후 진통제를 관리 합니다. 수술 후 동물을 주의 깊게 모니터링.
결과
SSAI (그림 2A)를사용 하 여 새로운 수술 방식으로 보조 부상 모델의 설립에 관한 성공 확인, RGCs 했다 retrogradely 모델 설립 후 즉시 표시 됩니다. 이 절차의 목적은 신경 추적 염료 (3 %fluorophore (예, Fluorogold) 멸 균 인산 염 버퍼 식 염 수에) 우량한 colliculus (그림 2B)에 주입 하 여 retrogradely 레이블 RGCs 것 이었다. 이 접근의 약간 변이 가진 가능한 RGCs 재현할 수 라벨 생성 합니다. 14 , 15 , 16 , 17 , 18 염료 RGCs 망막에 의해 retrogradely 촬영 될 것 이다 하 고와 오른쪽 눈에 안 transected 축 삭 라이브 RGCs에 대 한 마커를 창설 한다. 한편, RGCs는 오른쪽 눈에 축 삭 하지 추적 염료 (그림 2C)로 분류 될 수 transected 부분적으로 시 신경에 해당 하는. 제어 눈으로 작업, 망막의 시 신경을 따라 RGCs 없이 왼쪽된 눈은 모두 표시 형광 골드 염료와 우량한 colliculus (그림 2D)에서 역행으로.
7 일 부분 시 신경 transection RGCs, 역행 라벨링 한 후는 망막 수확, 고정, 평평 하 게 되었고 탑재. 레이블이 RGCs 망막의 정의 된 영역에서 형광 현미경 아래 몇 군데 있었다. 형광 표시 RGCs 부분 시 신경 transection 없이의 결과 그림 3에 표시 됩니다. 광학 신경의 untransected 부분에 해당 하는 오른쪽 망막 RGCs 형광 금, 표시 했다 레이블 및 레이블 RGCs의 명확한 경계 수만 (그림 3A, 그림 3B), 시각 시연 시 신경의 부분 트랜잭션. 제어 눈, 왼쪽된 눈 망막을 보여주었다 형광 (그림 3C, 그림 3D)의 모든 RGCs로.
평가 여부 시 신경 머리와는 entoretina에 혈액을 공급 하는 안과 동맥 맥 관 구조 손상 되었고 오른쪽 눈 안구 내부 작업 중에 영향을 했다 몇 군데 수술 전후. 이미지 고 전에 오른쪽 눈 (눈 수술) 수술 후 1 시간에 혈액 공급을 보여주었다. 동맥에 있는 혈액은 적절 한. 정 맥의 아무 방해 관찰 되었다. 이러한 연구 결과 표시 (그림 4A, 그림 4B)작업 중 혈액 공급 시스템에 아무 손상도 없었다. 따라서, 2 차 변성 모델 RGCs의 성공적으로 설립 되었다.
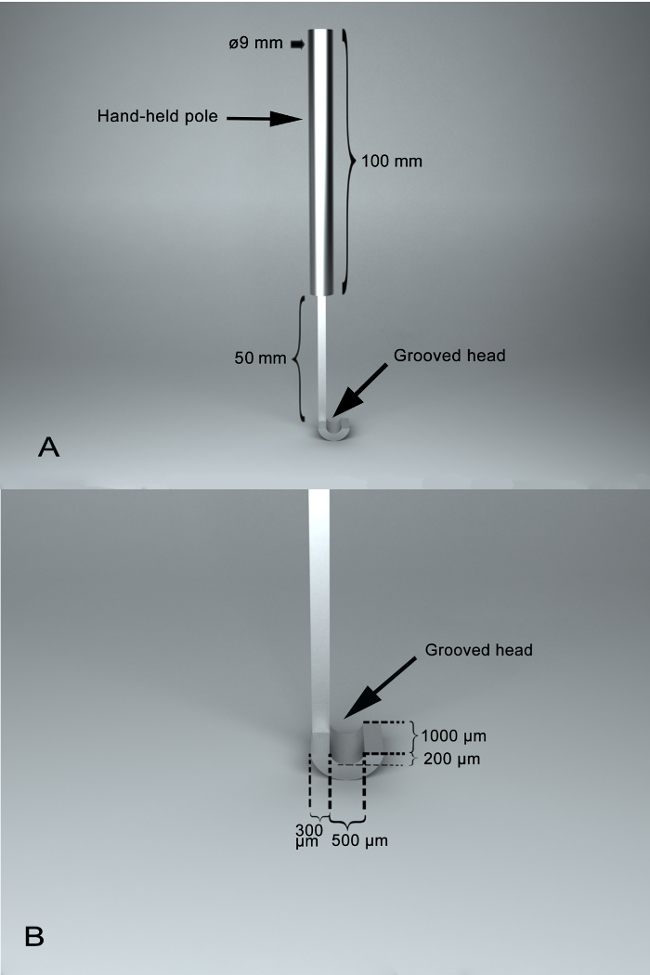
그림 1 : 자체 디자인된 외과 조수로 악기, SSAI의 사진. (A) 휴대용 극 및 홈이 있는 머리를 포함 하 여 2 개 주요 부품으로 외과 악기의 파노라마 전망. 그들 사이 50 m m의 길이와 공동 섹션이입니다. 휴대용 극의 길이 100 m m, 그리고 휴대용 극의 직경은 9 mm. SSAI 홈의 (B) A 기능. 홈 붙이 머리의 홈이 있는 표면을 transection 위해 안정 되 고, 누워 시 신경 수 세미 원형 이다. 홈이 있는 표면 200 µ m의 수직 깊이 500 µ m의 너비와 1000 µ m의 길이 이다. 홈 붙이 머리의 가장자리의 폭은 300 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
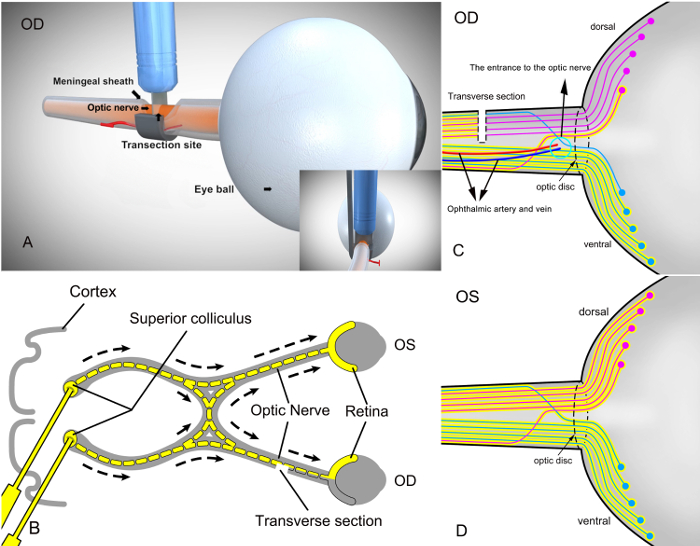
그림 2 : 자체 디자인된 외과 조수로 악기 (SSAI)와 함께 오른쪽 시 신경의 partial transection 후 망막에 라벨 및 retrogradely는 fluorophore와 우량한 colliculus 라벨 RGC의 회로도. (A) 부분 오른쪽 시 신경이 transection 자체 디자인된 수술 보조 장비 (SSAI) 쥐에서의 수술 보기. (B) 모델링, 후 RGCs 했다 표시 retrogradely 뇌의 우량한 colliculus 신경 추적 염료 (노란색, 멸 균 인산 염 버퍼 식 염 수에 3 %fluorophore) 주입 하 여. RGCs axons 우량한 colliculus에 거주, 이후 추적 염료 RGCs에 의해 retrogradely 촬영은 하 고 라이브 셀에 대 한 마커를 창설 한다. 그림에서 가로 섹션 시 신경의 단면을 나타냅니다. OD, 운영된 눈; 운영 체제, 작업 없이 제어 눈입니다. (C), 시 신경의 untransected 부분에 해당만 RGCs fluorophore와 분류 했다. 구분 되지 않은 복 부 시 신경 및 망막;에 해당 RGCs 블루 대표 레드는 부분적으로 transected 지 시 신경 및 망막에 해당 RGCs 반영합니다. (D)는 망막 수술 없이 왼쪽된 눈 (제어 눈)의 RGCs 했다 모든 분류 염료에 의해. 등 쪽과 복 부 시 신경 모두 뿐만 아니라 염료에 의해 표시 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
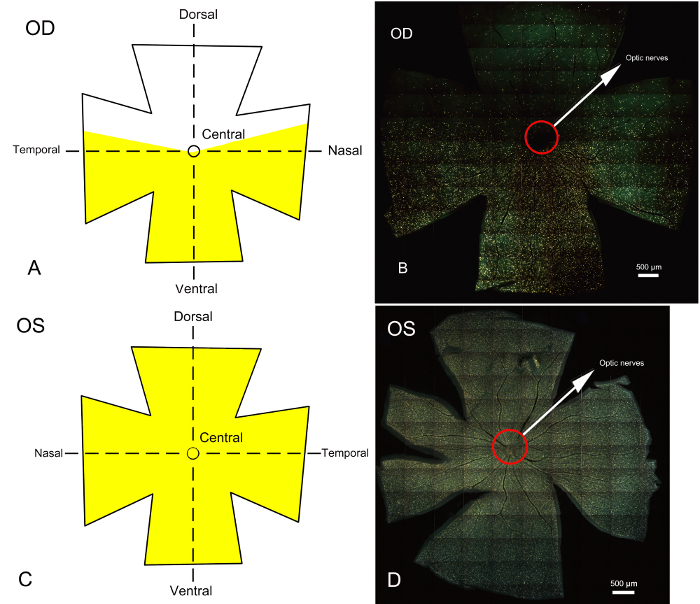
그림 3 : 전체 망막 epifluorescence 현미경 fluorophore 표시 RGCs 부분 시 신경 transection 설정한 후 7 일의 모델 및 우량한 colliculus의 라벨 역행. 망막에 RGC 영역 스테인드 Fluorogold의 해당 도식은 또한 제공 됩니다. (A) (C) fluorophore와 각각 라벨링 후 RGCs 오른쪽 (요원)의 망막에 왼쪽 (제어) 눈의 도식 다이어그램을 나타냅니다. 노란색 형광 골드 염료와 함께 표시 하는 영역을 나타냅니다. 망막 등, 복 부 및 중앙 부분으로 나누어져 있습니다. (B) 와 (D) 형광 현미경; 얻은 전체 망막 epifluorescence 현미경 대표 노란은 RGCs fluorophore 표시 영역을 나타냅니다. B에 나와 수술 눈 (오른쪽 눈) 레이블이 없는 지역 RGCs에 해당 하는 망막의 등 쪽에 주로 transected 부분적으로 시 신경의 영역을 나타냅니다. 형광 골드 염료에 의해 표시 된 지역 RGCs transected 하지 이며 주로 망막의 중앙과 복 부 측면에 집중 되어 시 신경에 해당 지역입니다. boundary 레이블 및 레이블 RGCs 영역 사이 분명 하다. RGC 시체의 기본 변성 등 망막에 제한 됩니다 그리고 중앙과 복 부 망막에 RGC 시체의 모든 손실 보조 변성에 기 인할 수 있습니다. (D) 전체 망막 RGCs fluorophore와 라벨링 후 왼쪽된 눈의 photomicrograph. 수술 없이 왼쪽된 컨트롤 눈의 RGCs fluorophore에 의해 얼룩이 완전히 했다. 스케일 바 = 500 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
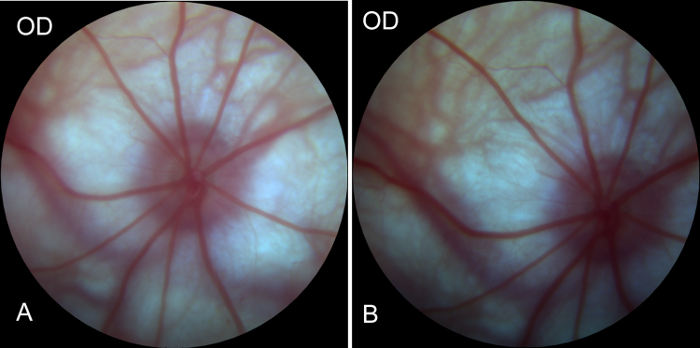
그림 4 : 수술 전 및 수술 후 이미지 오른쪽 눈의 저의 저 카메라에 의해 획득. (A) 쥐, 오른쪽 눈 수술 전에 저의 이미지는 저, 동맥 작성, 그리고 정 맥 반환 또는 방해의 좋은 혈액 공급을 보여주는 좋은 망막 혈액 공급 시스템을 나타냅니다. (B) 이미지의 오른쪽 눈 수술 후 1 시간의 저. 저의 수술 전 이미지와 비교 하면, 상당한 변경 망막 혈액 공급, 안구의 혈액 공급 시스템 모델링의 과정에서 영향을 받지 했다 나타내는에서 관찰 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
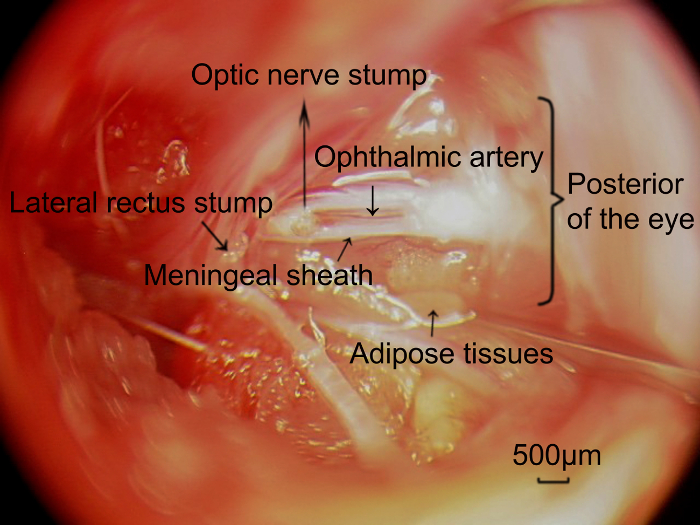
그림 5 : 사진 retrobulbar 시 신경 그리고 안과 동맥의 외과 접근 방식을 통해 캡처한 meningeal 칼 집에 있는. 시 신경의 표적으로 길이 완전히 제거 후 안과 동맥 (화살촉) 시 신경의 meningeal 칼 집과 부수적인 되었고 노출, 시 신경에 병렬. 스케일 바 = 500 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
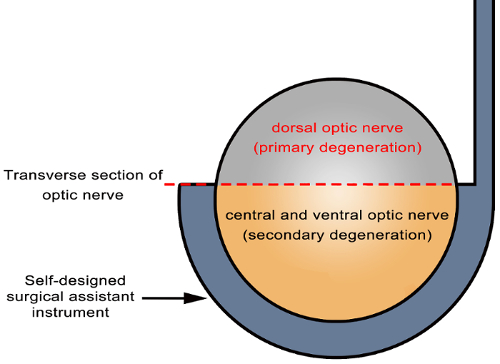
그림 6 : 시 신경에 기본 및 보조 변성 위치의 회로도. 시 신경의 부분 절 개 자체 디자인된 외과 조수로 악기 (화살표)를 사용 하 여 달성 되었다. 직접 손상 된 사이트 (회색에서 가로 섹션에서 시 신경의 지 느 러 미 절단 사이트)에서 축 삭 받아야 간접적으로 손상 된 사이트 (노란색에서 가로 섹션에서 시 신경의 중앙과 복 부 지역)에 그 기본 변성 2 차 변성을 받 다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
운영 절차
모델 건설 과정 고 시의 가치 있는 몇 가지 포인트가 있다. 4.2 단계에서 수술 운동 subfascial 근육 위에 맥 관 구조를 손상 되지 않도록 신중 하 게 수행 되어야 한다. 특히 때 피하 근 막 외부 측면 법에서 절단, 날카로운 톱니 집게 사용 해야 합니다을 위쪽으로 피하 근 막 근 막 표면에 수직으로; 근 막 욕실이 함께 모델 실패 과도 한 출혈이 발생할 수 있습니다 외부 법에서 궤도 혈관 손상을 방지 하려면 봄이 위 잘라 되어야 합니다. 4.3 단계는 잠재적으로 직접 혈관에서 제거 출혈 방지의 이점이 있다. 분리 단계 4.5, 따기 날카로운 톱니 모양의 겸 하지만 욕실이 없는 이유에서 궤도 근육에서 봄이 위 지속적인 출혈과 출혈을 방지 하는. 근육 피부 근 막 절 개;을 수직 방향으로 양쪽에 퉁 명 스럽게 분리 한편, 바깥쪽과 주변 궤도의 깊은 근육이 뻗어 있다. 이 절차는 큰 수술 창을 제공 하 고 오버레이 시 신경 조직에 대 한 한 시 빨리 벗어나게 액세스 허용 궤도 구멍의 깊은 부분을 발표할 예정 이다. 위의 절차에서 출혈이 발생 하는 경우 압력 적용 해야 살 균을 사용 하 여 수술 또는 면봉. 작은 출혈이 절차에 의해 몇 초 후 중지 됩니다. 4.6 단계의 목적은 쉽게 궤도 깊이에 시 신경의 방향 따라 시 신경이 노출 궤도 근육 콘에 뚱 뚱 하 고 별도 일부 근육을 제거 하는 후속 작업을 촉진 하기 위하여.
현재 프로토콜의 가장 중요 한 부품은 단계 5.1-5.6입니다. 그것은 시 신경 머리 주위 맥 관 구조를 손상 하지 해야 합니다. 시 신경이 부분적으로 눈의 1 mm 이내 신경 관통 하 고 내부 망막에 혈액을 공급 하는 안과 동맥에 손상을 피하기 위해 눈의 뒷면에서 최소 1.5-2.0 mm로 transected 한다. 측면 곧바로 절단의 목적 측면 곧바로 넓은 고 시 신경의 보기를 분명히 차단 시 신경의 더 나은 노출을 달성 하는 것입니다. 한편, 안과 동맥 meningeal 칼 집 (그림 5)와 관련 된 제거를 피하기 위해, 그것은 분리 하 고 시 신경 주위 dura 해리 meningeal 칼 집의 혈관 패턴을 검사 하는 데 필요한 집게를 사용 하 여 부드럽게 회전 하는 칼 집. 또한, 혈관이 없는 영역 식별 되어야 합니다, meningeal 칼 집에 경도 컷을 수 있도록. 그것은 또한 안과 동맥에 밀접 하 게 연관 된 경질의 부분을 피하기 위해 눈의 뒷면에서 작은 작업 거리를 유지 하는 데 필요한. 망막은 일반적으로 투명 하 고 혈관을 명확 하 게 구분 될 수 있습니다. 손상 된 망막 혈액 공급의 경우 망막 퇴 화, 유백색 백색의 부드러운 모습을 선도. 시간이 지남에 따라 눈과 렌즈의 유리 챔버를 뿐만 아니라, 줄된 눈 크기와 흐린 일반적으로 될 수 있습니다. 본이 연구에서는 수술 전 및 수술 후 이미지는 저 위의 단계를 적용 한 후 모델에 저 혈액 공급 손상 확인.
또한,이 모델의 몇 가지 단계에서 특별 한 주의가 필요 합니다. 노출 시 신경 날카로운 곡선-톱니 모양의 포 셉 또는 다른 수술 도구를 사용 하 여 때 외과 의사 피해 야 한다 과도 한 힘으로 시 신경, 안구 또는 안과 동맥 손상 될 수 있습니다 기본 상해 및 망막 국 소 빈 혈 결과. 또한, 눈 주변 혈관 해야 하지 손상 될, 지속적인 출혈을 방지 하는 모델링의 실패에 발생할 수 있습니다. 이 실험에 사용 된 SSAI 섬세 한 사용을 필요 합니다. 시 신경 악기 그루브 내 놓으면 시 신경 및 홈이 있는 표면을 단단히 좋은 일관성 및 각 동물 모델의 반복성을 보장 하기 위해 장착 해야 합니다. 초기 항목 인하 후 연습, 전체 수술 눈, 당 15-20 분 이내 완료 수 있습니다.
왕 외. 19 시 신경 양적 절단기를 사용 하 여 부분 시 신경 transection의 유사한 동물 모델을 발표 했다. 수술 절차 포함: 1) 절단 떨어져 외부 법, 중단 하 고 고정 종을 우수한; 2) 시 신경 탐험과 절단기;를 사용 하 여 시 신경의 우량한 부분을 transecting 그리고 3) 결 막과 피부를 봉합. 수술은 비교적 간단, 작업 중 다음과 같은 문제가 발생 했다. 비록 측면 법 절 개는 작업에 대 한 특정 공간 노출 수, 끊임없이 retrobulbar 시 신경 칼 집, 특히 때 외과 의사 이상 retrobulbar 노출 노출 하려면 안구 스트레칭 하는 피할 필요가 있었다 시 신경 칼 집 칼 집 격리; 더 촉진 하기 위하여 안구 스트레칭 위한 힘이 이었다, 안구 및 시 신경의 직접 견인 부상을 일으킬 것입니다. 시 신경 칼 집와 함께 잘라 수 있습니다 혈관에 특별 한 주의 지불 했다 그리고 혈관에 손상을 실패 모델 설립으로 이어질 가능성이 높습니다. 이 문서에서 설명 하는 보조 부상 모델의 주요 절차는: 새로운 요원 접근 안구의 측면 궤도 벽에서 직접 액세스 궤도 근육 콘으로 둘러싸인 retrobulbar 시 신경 주 상해를 피하는 안구, 시 신경, 아래쪽 또는 안구의 비 강 측면 사이드 쪽으로 당길 때 이 새로운 수술 방법을 모델링, 동안 외과 수술의 공간을 증가 하 고 밀접 하 게 관련 된 시 신경의 partial transection 전에 안과 동맥 meningeal 칼 집의 쉽게 격리 수 있습니다. 부분 시 신경 transection 자체 디자인된 한 외과 악기가 고, 비용 효과적이 고 재사용, 모델링의 전반적인 비용 감소와 함께 수행 되었다. 쥐의 궤도 구조는 법 및 아무 뼈 구조에 가장 가까운 궤도와 다른 포유동물의 다른 이지만 근육으로 덮여. 외과 접근은 궤도 뼈와과 파괴의 필요 없이 안구의 후부 부분을 도달할 수 있습니다. 통해 엄격한 수술 소독 하 고 수술 후 항생제 예방 치료, 감염, 염증 및 부 종 크게 감소 되었다.
자체 디자인된 외과 보조 기구
부분 시 신경 transection의 쥐 모델 자체 디자인된 외과 조수로 악기, 누구의 주요 특징은 다음과 같습니다를 사용 하 여 설립 되었다. 그것은 또한 다른 동물 사이에서 transection 일관성을 보장 하는 홈된 가장자리에 노출 시 신경의 부분 양적 transection에 지원할 수 있습니다. 우리는 테스트 하 고 SSAI 모델 설립의 반복성을 확인. 변이의 최대 계수는 1.85%, 평균 0.67% ±0. 44%. 20 이러한 결과 나타냅니다 만족 재현성 및 유엔 부분 시 신경 transection 모델을 설정 하는 SSAI를 사용할 수 있습니다.iformity입니다.
홈된 표면의 너비와 홈의 내부 표면의 세미 원의 디자인 수 시 신경에 영향을 더 고정 홈된 화면을 확인 하 고 시 신경 또한 감소 하는 실험적인 오류 및 불리 한 반응 더 긴밀 하 게 연결. 홈된 지 커터의 선명도에 홈에 시 신경 손상 하지 것입니다 작업 중 홈에 시 신경의 더 나은 보호를 허용 한다. 홈된 가장자리의 또 다른 장점은 시 신경 transection 동안 호감 부상 방지입니다.
그것은 깊고 좁은 공간에서 작동 하는 데 적합 합니다. 비록 새로운 요원 접근 확장 되었습니다 통로가 남아 깊은, 그리고 휴대용 극 및 공동 섹션 후속 작업을 수행 시 신경 칼 집에서 쉽게 홈된 머리를 사용할 수 있습니다. 작업에 대 한 악기를 사용 하는 경우 다양 한 커터 transection, 예: 26 G 바늘 팁에 대 한 사용할 수 있습니다. 사파이어 외과 프로브 칼도 타 박상을 방지 하 고가 위로 인 한 부상 호감을 선택할 수 있습니다. 그루브 표면 완료 시 신경 절단의 다양 한 각도에 다른 수직 깊이에 만들 수 있습니다.
왕의 절단기에 비해 외 는 SSAI 더 간단한 구조를 하고있다. 또한, 가공 단계 및 동물 모델의 반복성이 향상 된 일관성, SSAI를 사용 하 여 더 편리 하다. 마지막으로, 도구는 SSAI와 절단에 대 한 적용의 범위 넓은 이기도합니다. 끝으로, SSAI 신경의 양적 하 고 균일 한 절 개를 시키는 쥐 시 신경 transection를 평가 하기 위한 모델을 설정 하기 위한 효과적인 악기 역할을 수 있습니다.
쥐 부분 시 신경 Transection 모델의 특징
부분 시 신경 transection 모델 RGCs에 2 차 변성을 평가 하기 위해 유용 합니다. 이 모델의 잠재적인 장점 기본 2 차 변성에서 정확 하 게 분리 하는 기능은 제자리에, 모두는 시 신경 및 망막에서. 중앙과 복 부 시 신경 등 시 신경 (그림 6)의 partial transection (약 1/3 ~ 1/2) 후 보조 부상에 더 취약 했다. 망막에서 RGCs의 기본 및 보조 상해의 지역 위치에 해당 하는 망막 RGCs partial transection 후 시 신경의 지형에 근거 한다. 쥐의 전체 망막 등 (등)와 복 부 (열 등 한) 부분으로 나누어져 있습니다, 보조 및 기본 상해 있다면 두 부분에 존재. 그러나, RGCs 망막 및 시 신경 축 삭의 관계에 따라, 복 부 망막에 RGC 죽음 한다 주로 인할 보조 부상 (그림 3). 12 , 22 , 23 이 모델 포함의 장점: 간단 하 고 조작이 쉬운 악기 표준 절차; 눈에 영향을 주지 않습니다 좋은 재현성 및 안정성 이 기술은 짧은 방해 RNAs (siRNAs), 플라스 미드, 적용 하 여이 공간 절약형 요원 접근에서 RGCs transfect에 사용 될 수 및 부분 시 신경에 바이러스 성 벡터는 그 루터 기. 또한, 시 약 선택적 치료 또는 RGCs의 라벨에 대 한 부분 시 신경 등 걸에 배치 될 수 있습니다.
RGCs의 전체, 기본 및 보조 부상 후 망막 두 부상 종류 사이에서 명확한 경계와이 동물 모델에 부분 시 신경 transection 공존. 시 신경 축 삭 망막에 RGC 위치 협회 더 정확한 구별을 위해 추가 조사를 요구, 비록 공간 절약형 요원 이렇게 모델의 응용 프로그램 범위를 확장 하 고 탐구 하는 연구자 수는 새로운 방식으로 RGCs에 보조 부상의 메커니즘.
공개
모든 저자 들은 관심의 모든 갈등을 선언 합니다.
감사의 말
이 작품은 베이징 자연 과학 재단 (7152038), 중앙 남쪽 대학 (2016zzts162)의 중앙 대학 및 과학 연구 재단의 Aier 눈 병원 그룹 (부여 번호에 대 한 근본적인 연구 자금에 의해 지원 되었다 AF156D11)입니다. 마지막으로, 년 동안 귀중 한 지원 판 연 Yiping 쑤 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Animal Aneathesia Ventilator System | MIDMARK | Matrx VMR | |
| Isoflurane | RWD Life Science Co. | R510-22 | |
| Surgical Microscope | Leica AG, Heerbrugg, Switzerland | M620 F20 | |
| Tobramycin Eye ointment | Alcon | H20110312 | |
| Fluorogold | Biotium | 80014 | |
| Iris scissors | 66vision Co. | 54026 | |
| Vannas spring scissor | 66vision Co. | 54137B | |
| Sharp-serrated forceps/0.12mm toothed forceps | 66vision Co. | 53329A | |
| Sharp-curved forceps | 66vision Co. | 53324A | |
| Sapphire surgical probe | 66vision Co. | 50205TA | |
| 26G needle tip | Shandong Weigao Group Medical Polymer Co. | 3151474 | |
| 10 μl Hamilton Syringe | Hamilton Co. | 80030 | |
| 5-0 non-absorbable suture | Johnson & Johnson International Co. | W580 | |
| Chlorhexidine | Sigma-Aldrich | 282227 | |
| Stereotaxie apparatus | RWD Life Science Co. | 68026 | |
| Retinal Imaging System | OptoProbe Ltd. | OPTO-RIS | |
| RetCamII wide field imaging system | Clarity Medical Systems,Inc. | RetCamII | |
| Fluorescence microscope | Leica Microsystems Inc. | DM6000 |
참고문헌
- Stoica, B. A., Faden, A. I. Cell death mechanisms and modulation in traumatic brain injury. Neurotherapeutics. 7 (1), 3-12 (2010).
- Hausmann, O. N. Post-traumatic inflammation following spinal cord injury. Spinal Cord. 41 (7), 369-378 (2003).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guimaraes, J. S., et al. Mechanisms of secondary degeneration in the central nervous system during acute neural disorders and white matter damage. Rev Neurol. 48 (6), 304-310 (2009).
- Stewart, S. S., Appel, S. H. Trophic factors in neurologic disease. Annu Rev Med. 39, 193-201 (1988).
- Brubaker, R. F. Delayed functional loss in glaucoma. LII Edward Jackson Memorial Lecture. Am J Ophthalmol. 121 (5), 473-483 (1996).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Nickells, R. W. From ocular hypertension to ganglion cell death: a theoretical sequence of events leading to glaucoma. Can J Ophthalmol. 42 (2), 278-287 (2007).
- Doucette, L. P., Rasnitsyn, A., Seifi, M., Walter, M. A. The interactions of genes, age, and environment in glaucoma pathogenesis. Surv Ophthalmol. 60 (4), 310-326 (2015).
- Osborne, N. N., Melena, J., Chidlow, G., Wood, J. P. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. Br J Ophthalmol. 85 (10), 1252-1259 (2001).
- Rokicki, W., Dorecka, M., Romaniuk, W. Retinal ganglion cells death in glaucoma--mechanism and potential treatment. Part II. Klin Oczna. 109 (7-9), 353-355 (2007).
- Levkovitch-Verbin, H., et al. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Magharious, M. M., D'Onofrio, P. M., Koeberle, P. D. Optic nerve transection: a model of adult neuron apoptosis in the central nervous system. J Vis Exp. (51), (2011).
- Yoles, E., et al. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Invest Ophthalmol Vis Sci. 33 (13), 3586-3591 (1992).
- Fisher, J., et al. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21 (1), 136-142 (2001).
- Levkovitch-Verbin, H., et al. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Invest Ophthalmol Vis Sci. 41 (13), 4169-4174 (2000).
- Li, Y., et al. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. J Clin Invest. 118 (3), 913-923 (2008).
- Tang, Z., et al. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. J Exp Med. 207 (4), 867-880 (2010).
- Wang, X., Li, Y., He, Y., Liang, H. S., Liu, E. Z. A novel animal model of partial optic nerve transection established using an optic nerve quantitative amputator. PLoS One. 7 (9), e44360 (2012).
- Yan, F. C., Li, S. N., Liu, K. G., Lu, Q. J., Wang, N. L. The establishment of a rat partial optic nerve transection model and assessment of its reproducibility. Ophthalmology in China. 22 (1), 34-37 (2013).
- Fitzgerald, M., et al. Secondary degeneration of the optic nerve following partial transection: the benefits of lomerizine. Exp Neurol. 216 (1), 219-230 (2009).
- Fitzgerald, M., et al. Near infrared light reduces oxidative stress and preserves function in CNS tissue vulnerable to secondary degeneration following partial transection of the optic nerve. J Neurotrauma. 27 (11), 2107-2119 (2010).
- Li, H., et al. Lycium barbarum (wolfberry) reduces secondary degeneration and oxidative stress, and inhibits JNK pathway in retina after partial optic nerve transection. PLoS One. 8 (7), 68881 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유