JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Vivo에서 PH, pO2, 산화 환 원 상태, 고 농도의 인산 염 및 종양 Microenvironment에 티의 EPR 평가
요약
낮은 분야 (L-밴드, 1.2 g h z) 전자 상자성 공명 녹는 nitroxyl 및 trityl 프로브를 사용 하 여 유방암의 마우스 모델에서 종양 microenvironment에 생리 적으로 중요 한 매개 변수 평가 대 한 시연입니다.
초록
이 프로토콜 낮은 필드 전자 상자성 공명 (EPR)의 기능을 보여줍니다-화학 종양 microenvironment (TME)에 정량적 인 정보를 제공 하는 기능 상자성 프로브 조합에서 기법을 기반으로 포함 p O2, pH, 산화 환 원 상태, 간 질 성 무기 인산 (Pi), 그리고 세포내 티 (GSH)의 농도. 특히, 최근에 개발 된 수용 성 다기능 trityl 프로브 응용 프로그램 탁월한 기회를 제공 한다 vivo에서 pH, pO2 와 P의 동시 측정 e에서 나 xtracellular 공간 (희망 조사)입니다. 세 개의 매개 변수는 단일 프로브를 사용 하 여 측정 프로브 배포 및 시간 측정의 그들의 상관 분석에 대 한 수 있습니다.
서문
암 진행 및 치료에서 TME의 주요 역할은 점점 더 감사1. 단단한 종양, 조직 hypoxia2, 증3,4, 높은 감소 용량5, 세포내 GSH6,7, 높은 농도에서 TME의 중요 한 생리 적인 매개 변수 중 그리고 중간 Pi8 잘 문서화 되어있다. 비 침 투 적인 vivo에서 pO2, pH, Pi, GSH, 및 산화 환 원 평가 TME에서 생물 학적 과정에 대 한 독특한 통찰력을 제공 하 고 도와 항 암 약물과 치료 전략 TME 대상의 전 임상 심사에 대 한 사전 도구. 자기 공명 영상 (MRI) 및 낮은 필드 EPR 기반 기술에 의해 조직에 합리적인 알코올 관통은 그들이 이러한 TME 매개 변수의 비 침범 성 평가 대 한 가장 적절 한 접근 합니다. MRI 이미징 물 양성자에 크게 의존 하 고 해부학 해상도 제공 하기 위해 임상 설정에서 널리 이용 된다 하지만 기능 해상도 부족. Extracellular Pi 농도 pH 생 인산에서 신호에 따라 인-31 핵 자기 공명 (31P NMR) 측정 TME 특성화에 대 한 잠재적으로 매력 있지만 일반적으로 여러 번으로가 면 높은 세포내 Pi 농도9,10. 이, 달리 EPR 측정 분광학에 의존 하 고 특별히의 이미징 설계 상자성 프로브 기능 해상도 제공 하. 참고 exogenous EPR 프로브 외 인 한 이점을 NMR 프로브 EPR의 훨씬 더 높은 본질적인 감도와 내 생 적인 배경 EPR 신호의 부재 합니다. 듀얼 기능 pH 및 redox nitroxyl의 최근 개발11 프로브 및 다기능 trityl 프로브12 비보에 대 한 탁월한 기회 여러 TME 매개 변수의 동시 측정을 제공 하 고 그들의 상관 관계 분석 조사 배포 및 측정의 시간에 독립. 우리의 지식에 없는 다른 방법을 동시에 생체 내에서 생리 적으로 중요 한 화학 TME 매개 변수 pO2, pHe, Pi, redox, GSH 등 생활 주제에 평가를 사용할 수 있다.
에 대 한 조사 Vivo에서 기능 측정:
그림 1 상자성 프로브 TME 매개 변수, 미 립 자 및 녹는 프로브를 포함 하는 액세스 하는 데 사용의 화학 구조를 보여 줍니다. 고감도 기능, 조직 생활, 그리고 최소한의 독성 안정성 미 립 자 프로브 EPR 프로브가 비보에 대 한 수용 성 조사를 통해 선호 하는 몇 가지 이점이 있습니다. 예를 들어 입자 프로브는 몇 주 동안 조직 pO2 의 경도 측정에 대 한 허용 하는 녹는 프로브에 비해 조직 이식의 사이트에서 보존 배 증가 했습니다. 다른 한편으로, 녹는 프로브 EPR 기반 이미징 기법으로 수 있도록 여러 기능에서 부수적인 분석을 사용 하 여 해결 공간 측정을 제공 하 여 미 립 자 프로브를 능가할 (pO2, pH, Pi, 산화 환 원, 그리고 GSH)입니다.

그림 1. TME 평가 분석 결과 조립 상자성 프로브의 화학 구조. 이 미 립 자 pO2 프로브, 링컨-BuO 포함 (R =-O (CH2)3채널3), 그리고 수용 성 조사: 듀얼 기능 pH 및 redox 프로브, NR; GSH-민감한 프로브, RSSR; 다기능 pO2와 pH, 그리고 extracellular microenvironment, 희망 조사. 의 Pi 프로브 이러한 프로브 합성 제공된 참조 11,12에서 설명 하고있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
프로토콜
모든 동물 작업 승인 WVU IACUC 프로토콜에 따라 수행 되었다.
1. 프로브 보정 및 합성
- 미 립 자 pO2-민감한 링컨 BuO 프로브
참고: 링컨-BuO microcrystals 합성 되며 참조13에 설명 된 대로 준비. 그들은 매우 안정 하 고 년 동안 실 온에서 보관 하실 수 있습니다. 링컨-BuO 미 립 자 조사의 EPR 선 폭은 pO2-민감한 매개 변수. 링컨-BuO microcrystals pO2 부분 압력13, 값이 없을 경우에 본질적인 선 폭의 760 mmHg까지 무산 소 조건에서 산소 농도 범위에서에서 선 폭의 이상적인 선형 의존을 설명 산소와 산소 의존도 (mG/mmHg에서 측정 되는) 약간의 기울기의 microcrystal 준비의 다른 일괄 처리에 대 한 다양 한. 따라서, 교정은 모든 특정 배치에 필요한.- 링컨-BuO microcrystals의 60 밀리 그램의 무게.
- 산소 감도 교정에 대 한 Dulbecco의 수정이 글 미디어 (DMEM) 중간 (20 mg/mL의 농도)의 3 ml microcrystals를 일시 중단 하 고 5 mL 유리 라운드-하단 튜브에서 7 파워를 사용 하 여 20 kHz에서 프로브 sonicator와 얼음에 5 분 동안 sonicate.
- 유리에서 sonicated microcrystals의 장소 1 mL L-밴드 (1.2 g h z) EPR 계의 표면 코일 공에 관 하 고 37 ° C와 산소 농도 0, 1, 2, 4, 8의 생리 적인 온도에서 연속 파 (CW) EPR 스펙트럼을 취득 20.9%. 가스 혼합 가스 컨트롤러에서 전달 솔루션을 버블링 하 여 산소 농도 유지 하 고 온도 조절기에 연결 된 물 목욕을 사용 하 여 온도 유지 합니다. 다음 EPR 분석기 수집 매개 변수를 사용 하 여: 진폭 변조, 100 밀리 그램; 변조 주파수, 100 kHz; 청소 폭, 5 G; 청소 시간, 60 s.
- 를 달성 하기 위해 더 나은 신호 대 잡음 비율 (SNR)는 선 폭의 60%의 변조 진폭 값 사용 하 여 (예를 들어, 변조 진폭 0.6 G을 사용 하 여 1 G의 선 폭에 대 한).
- 대체 교정 절차 간소화: 공기 부풀어 및 무산 소14EPR 스펙트럼을 기록. 후자의 경우 anoxia 샘플에서 10 mM 포도 당 및 참조14에 따라 1 mL 프로브 솔루션 100 U/mL 포도 당 산화 효소의 추가 의해 유지.
- EPR 스펙트럼 선 폭, LW 찾을 Lorentzian 기능에 맞게. 즉 (LW공기−LWanoxia)의 값으로 pO2, LW의 의존의 경사로 microcrystals pO2 의 감도 평가 /pO2air, 어디 LW공기 그리고 LWanoxia 공기와 anoxia 조건에서 스펙트럼 선 폭 각각; p O2air = 152 mmHg.
- 듀얼 기능 pH 및 redox 프로브, NR
참고: NR 프로브 참조11에 설명 된 대로 합성 됩니다. 그것은 실내 온도에 안정 모두를 솔리드로 수성 해결책 에서입니다. 합성된 NR 프로브 4 ° c.에 유지 됩니다. 질소 hyperfine 분할N및 신호 진폭 부패 속도 pH에 민감한 NR 프로브의 스펙트럼 매개 변수 (pK는는 조사 = 37 ° C, pH 감도 5.6에서 7.6의 범위에서 6.6)와 프로브 감소 용량 microenvironment, 각각.- NR 냉장고에서 제거 하 고 따뜻한 실내 온도 (10-15 분) 컨테이너를 허용. 염 분 해결책의 1 mL에 용 해 및 HCl 이나 NaOH를 pH 미터를 사용 하 여 작은 aliquots와 7.2에 pH를 조정, NR의 6.34 mg 밖으로 무게. 재고 솔루션으로 준비 NR 솔루션 (10 mM)을 사용 합니다.
- 수행 NR 프로브의 pH 교정 다음과 같습니다 (참조11참조). 먼저, 2mm 나 인산 염 버퍼, 150 mM NaCl 0.9 ml NR 재고 솔루션의 0.1 mL를 추가 합니다. PH 미터를 사용 하 여 필요한 pH에 HCl 이나 NaOH의 aliquots로 얻은 1 mM NR 솔루션 적정 온도 조절기에 연결 된 물 목욕을 사용 하 여 온도 제어 합니다.
- L-밴드 EPR 분석기를 사용 하 여 microcentrifuge 1.5 mL 튜브에 샘플의 EPR 스펙트럼을 기록 합니다. 다음 EPR 분석기 수집 매개 변수를 사용 하 여: 진폭 변조, 2.5 G; 변조 주파수, 100 kHz; 청소 폭, 60 G; 청소 시간, 20 s.
- EPR 스펙트럼의 낮은-높은 필드 구성 요소 사이의 거리의 절반으로 분할 일정 (N) hyperfine를 측정 하 고 pH, L-밴드 EPR pH의 측정에 대 한 교정 곡선을 제공 하기 위해 대 플롯.
- GSH-민감한 RSSR 프로브
참고: RSSR 프로브 참조15에 설명 된 대로 합성 됩니다. 4 ° c.에 합성된 NR 프로브를 저장 닥터지 RSSR 이황화 biradical 복합 쉽게 세포내 GSH 반응 GSH에서 비보에 EPR16,17를 사용 하 여 결정 하기 위한 신뢰할 수 있는 접근을 제공 하는 세포 막에 걸쳐 확산. 이 메서드는 RSSR 프로브 GSH thiols의 주된 세포내 수영장의 높은 반응 속도 기반으로 합니다. GSH 분할의 이황화 결합 ( 계획 1참조)와 RSSR biradical의 반응의 2 개의 과격 한 파편 biradical 스펙트럼 구성 요소의 감소에서 명시와 사이의 해당 스핀 교환 취소 결과 monoradical 부품의 증가입니다. Biradical RSSR 프로브에 대 한 monoradical 컴포넌트의 진폭의 증가의 속도 GSH 농도에 비례 이며 편리한 GSH-민감한 EPR 스펙트럼 매개 변수입니다. Vivo에서 EPR 측정에서 GSH 농도 평가 하려면 해당 온도 pH에 GSH와 RSSR 반응의 속도의 이전 교정 다음과 같이 수행할 수 있다.- 된 RSSR 냉장고에서 제거 하 고 따뜻한 실내 온도 (10-15 분) 컨테이너를 허용. 그리고는 NR의 4.05 mg 밖으로 무게 DMSO 솔루션의 1 mL에 용 해. 준비 된 RSSR 솔루션 (10 mM)를 사용 하 여 재고 솔루션으로.
- 속도 상수, kobs, RSSR GSH 바람직한 온도와 pH와의 반응의 값을 다음과 같이 확인 합니다.
- 첫째, 1 mM 나 인산 염 버퍼의 0.98 ml RSSR 재고 솔루션 (10 mM)의 20 µ L, pH 7.2, 150 mM NaCl, 0.2 m m RSSR를 프로브 솔루션.
- 0.1 m M 나 인산 버퍼 pH 7.2 GSH의 1, 2, 및 5 mM 농도의 솔루션을 준비 합니다. Vivo에서 측정에서 대상 기관의 세포에서 GSH 농도 정확 하 게 평가 하려면 생체 외에서 교정의 세포내 pH 값에 가까운 pH에서 수행할 수 있다.
- 0.2 m m RSSR 솔루션 및 단계 1.3.4에서에서 준비 GSH 솔루션 중 하나의 동일한 볼륨을 믹스. 최종 농도 0.1 m m 프로브와 GSH의 0.5, 1, 또는 2.5 m m에 대 한.
- RSSR GSH 솔루션 혼합, 직후 EPR 공명에 샘플을 놓고 10 분 동안 12 초 마다 EPR 스펙트럼을 기록 합니다. 그런 다음 monoradical 스펙트럼 진폭의 증가의 속도 계산 합니다. 다음 EPR 분석기 수집 매개 변수를 사용 하 여: 진폭 변조, 1 G; 변조 주파수, 100 kHz; 청소 폭, 60 G; 청소 시간, 10-60 s입니다.
- 측정 된 EPR 활동은 monoexponents에 맞게 하 고 지 수 활동, τ의 시간 상수를 계산. 선형 회귀 (1/τ = kobs × [GSH]) GSH RSSR 사이 반응의 관찰 된 속도 상수 값을 제공 합니다 (예를 들어, 34 ° C와 pH 7.2, kobs = 2.8 ± 0.2 M-1의-1)11.
- PO2와 pH, Pi 평가 대 한 다기능 희망 조사
참고: 희망 조사에 설명 된 대로 합성 monophosphonated trityl12 를 참조 하 고 4 ° c.에 유지 됩니다. PH << pK는 (한-산 성 형태)와 pH >> pK는 (B-기본 형태)에서 희망의 CW EPR 스펙트럼 분할P인 hyperfine 때문에 남자에 의해 표시 됩니다. 일반적인 악기 설정은 다음과 같습니다: 진폭 변조, 37.5 mG; 변조 주파수, 100 kHz; 청소 폭, 0.9 G; 청소 시간, 20-60 s입니다. 중간 pH에서 (5 < pH < 8) 희망 조사의 EPR 스펙트럼 4 중 주에 의해 특징입니다 때 두 A와 B 상태 있는지. 희망의 개별 EPR 선 폭은 pO2 마커 (정확도, ≈ 1 mmHg; p O2 범위, 1-100 mmHg). Protonated 희망 (양식)의 일부분은 8.0 (정확도, ± 0.05)에서 6 범위에서 pH 마커입니다. 양성자 환율 (mG에서 표현) 스펙트럼 시뮬레이션에 의해 추출 하는 Pi와의 값은 Pi 마커 (정확도, ± 0.1 m m, 범위, 0.1-20 m m)입니다. 교정 과정은 생리 적인 온도 (37 ° C), 솔루션 이온 강도 (NaCl, 150 m m), 및 희망 프로브 농도 0.2 m m, 이전 참조12,18에서 설명 하 고 아래에 자세히 수행 됩니다.- 냉동 실에서 희망 프로브를 제거 하 고 따뜻한 실내 온도 (10-15 분) 컨테이너를 허용.
- 염 분 해결책의 1 mL에 용 해 및 pH 7.4에 조정, 희망 조사의 10.7 m g으로 무게. 추가 20 µ L 0.2 m m 희망을 얻기 위해 염 분 해결책의 0.98 ml (10 mM) 희망의 준비 재고 솔루션의 프로브 솔루션.
- PH의 프로브 교정, 샘플 1% 미만의 마지막 희석 된 HCl, NaOH의 작은 볼륨의 추가 의해 희망 프로브 솔루션의 0.2 m m를 적정. 37 ° C에 의해 국립 국 표준 (미국)의 권장 참조 솔루션에 대 한 pH 값을 사용 하 여 보정 한 pH 전극으로 pH를 측정 합니다. circulator에 연결 된 외피 반응 비 커를 사용 하 여 신중 하 게 pH 측정 동안 참조 및 적정 한 솔루션의 온도 유지 하기 위해. 10 m m 포도의 추가 의해 무산 소 조건 및 프로브 솔루션 100 U/mL 포도 당 산화 효소를 유지 합니다.
- 인산 염의 부재에서 무산 소 조건에서 각각, pH ≤ 5와 pH ≥ 8, A와 B 형태의 EPR 스펙트럼을 취득.
- 본질적인 스펙트럼 매개 변수를 해당 스펙트럼을 사용 합니다. 즉, 희망 조사의 해결 되지 않은 슈퍼 hyperfine 구조에 근접 하는 가우스 함수 Lorentzian 함수의 컨볼루션으로 스펙트럼 라인을 시뮬레이션 합니다. 실험적인 스펙트럼을 계산된 EPR 스펙트럼의 피팅 생성 값P 및 Lorentzian 선 길이 (pp), 폭 가로 휴식 속도, 1/T2 에 의해 결정 (여기서 1/T2 (√3/2) Lpp = CW EPR에 RF 흡수 선의 측정된 파생에 대 한), 그리고 가우스 분포, G.의 선 폭
참고: 다음은 단계 1.4.2에에서 지정 된 조건에서 측정 된 스펙트럼에서 가져오는 매개 변수:P(A) = 3.63 G,P(B) = 3.37 G; 1/T2(A) = 23.6 mG; 1/T2(B) = 9 밀리 그램; G(A) = 40 mG; G(B) = 45 mG (참조8참조). - 희망의 EPR 스펙트럼을 취득 중간 pH에서 (5 < pH < 8). 앞에서 설명한18로 참조19 에서 적응 하는 비 결합 또는 느슨하게 결합 된 시스템에 여러 사이트 간의 exchange의 이론을 사용 하 여 인수 EPR 스펙트럼의 높은 출원 구성 요소를 시뮬레이션 합니다. 기본 매개 변수 A에 대 한 얻은 사용 했으며 B (단계 1.4.5 참조) 변수의 수를 줄일. 분수는 (pA)의 값을 실험 하는 사람에 게 계산 된 스펙트럼에 맞게 하 고 pH pA 값의 의존도 플롯. 추가 연구에서 pH에 의존의 pA 를 사용 하 여 pH 보정 곡선으로.
참고: 분리 상수, pK는는 (희망)의 값을 제공 합니다 pA 표준 적정 곡선의 pH 의존 피팅 = 6.98. Vivo에서 학문, 희망 조사의 전체 EPR 스펙트럼을 취득 하지 않습니다 실용적인 EPR 스펙트럼에 분할 인 hyperfine의 낮은-높은 필드 구성 요소 사이의 간격을 확보 하는 데 필요한 추가 시간 때문에. 따라서, 추가 exemplified 연구에만 높은 출원 EPR 스펙트럼의 구성 되어 측정과 분석. - PO2의 프로브 교정에 대 한 다양 한 산소 농도에서 희망 조사의 EPR 스펙트럼을 취득.
- 가스 혼합물으로 버블링 하 여 솔루션의 제어 pO2 값 가스 컨트롤러에서 전달. 제어 온도 조절기에 연결 된 물 목욕을 사용 하 여 솔루션 온도 (37 ° C).
- EPR 스펙트럼을 시뮬레이션 하 고 산소 유발 이완 속도의 값을 결정 하는 1.4.6 단계에 설명 된 대로 그들을 실험 하는 사람에 게 맞는.
참고: 산소 유발 이완 속도의 값 0.49 mG/mmHg 모두 a 그리고 B 형태의 희망 조사 37 ° C8에서 측정 되. - 프로브 교정 [Pi]의에 대 한 다양 한 인산 염 농도에서 희망 조사의 EPR 스펙트럼을 취득. PK는는 근처 pH 값으로 희망 급진적인 솔루션을 사용 하 여 (pK는는 37 ° C에서 6.9 =)18 다양 한 인산 염 농도를 적정 하 고. 위의 단계에서 설명한 대로 온도 가스 성분을 유지 합니다.
- EPR 스펙트럼을 시뮬레이션 하 고 단계 1.4.6 Pi 유도 환율 값을 확인 하려면에 설명 된 대로 그들을 실험 하는 사람에 게 맞는.
참고: [파이] 파이 유도 환율의 의존도 추가 연구에서 교정으로 사용 됩니다.
2. 마우스 모델 유방암의
- MMTV PyMT 자연 종양 모델
- 4-8 주를 사용 하 여-오래 된 여자 친구 바이러스 B 형 민감성/NIH (FVB/N) 마우스 유 방 종양 바이러스 발기인 (MMTV) polyoma 중간-T 항 원 (PyMT +) 마우스 EPR 연구 vivo에서 자발적으로 형성 된 유 방 종양.
- 정상적인 유 방 땀 샘과 종양의 조직 microenvironments의 비교를 위해 나이 일치 littermate 여성 PyMT oncogene (PyMT−, "강포한 유형")20에 부족을 사용 합니다.
- L-밴드 EPR 분광학 isoflurane 마 취 동안 4 주 동안 일주일에 한 번씩 쥐 대상 (프로브 배달 아래 참조).
- 공기 isoflurane 혼합물 (3 %isoflurane)를 사용 하 여 마우스를 anesthetize 하 고 표면 코일 공 진 기에 가까운 종양 (유 방 땀 샘)와 함께 오른쪽, 측면 위치에 조정 테이블에 마우스를 놓습니다.
- 마우스 배치 후 프로브 intratissual (i.t.) 주입에 의해 관리, EPR 분석기를 조정 하 고 5-10 분에 대 한 EPR 스펙트럼을 취득.
- 2-3 유 방 종양을 측정 (MMTV에서-PyMT + 마우스) 또는 비 종양 같은 EPR 세션 (PyMT− 쥐)에서 유 방 동맥을 베어링.
- Orthotopic 메트로-1 종양 모델
- 37 ° C, 5% CO2, 그리고 10% 태아 둔감 한 혈 청 (FBS), 10 µ g/mL 인슐린, 5 ng/mL rhEGF, 및 1% 포함 된 DMEM에 95% 상대 습도에서 FVB/N 배경 메트로 1 murine 유 방 암 세포 성장에 PSA (페니실린 G 나트륨, 황산 염 스, 암포 B) ~ T175 플라스 크에서 80% 합류입니다.
- 미디어를 발음 하 고 10 mL PBS와 부착 셀 린스 (1.54 m m KH2포4, 155 mM NaCl, 그리고 2.71 m m 나2HPO4-7 H2O 없이 염화 칼슘 또는 마그네슘 염화 물, pH = 7.4).
- 0.25% Trypsin EDTA 용액 5 mL를 추가 하 고 플라스 크를 흔들어 세포를 분리 합니다. 세포를 분리 하는 경우 추가 10 mL 10% 포함 된 DMEM FBS 플라스 크에 세포를 수집.
- 132 x g 4 ° c.에서 10 분 동안에 세포 현 탁 액을 원심 hemocytometer를 사용 하 여 셀을 계산 하 고 100 µ L 당 1 x 106 셀 resuspend 최소 DMEM.
- 8 주 오래 된 여성 FVB/N 야생 타입 마우스의 4 번 유 방 지방 패드에 종양 세포 현 탁 액의 100 µ L를 주사 천천히 using 인슐린 주사기 (바늘 29G 1/2).
- 촉진 하 여 종양 개시를 모니터링 (약 2-3 주 후 표시), 성장 (시각), 및 마우스 히스 (visual) 매일.
- 한 번 / 주 캘리퍼스를 사용 하 여 종양 크기를 측정 하 고 방정식을 사용 하 여 종양 볼륨 확인:
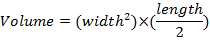
3. Vivo에서 기능 측정을 위한 배달 프로브
- 사용 미 립 자 링컨 BuO 프로브 (의정서 I) 내 면된 링컨-BuO와 종양 세포를 이식 하 여 orthotopic 종양 모델에서 포2 측정을 위한 microcrystals 이전14,21 설명과 아래에 자세히.
- 메트로-1 셀에 링컨 BuO microcrystals의 국제화에 대 한 메트로 1 종양 모델의 경우 20 mg/mL의 농도에서 DMEM에 링컨 BuO microcrystals를 일시 중단 하 고 5 mL 유리 라운드-하단 튜브에서 7 파워를 사용 하 여 20 kHz에서 프로브 sonicator와 sonicate 얼음에 5 분에 대 한
- 포함 하는 메트로-1 셀 (약 30% 합칠) 10 mL 문화 미디어 T75 플라스 크를 정지 100 µ L (링컨 BuO의 2 밀리 그램)를 추가 합니다. 모든 절차는 biosafety 내각에서 고 미디어 페니실린 및 잠재적인 감염을 최소화 하기 위해 스 포함.
- 37 ° c에 도달할 때까지 또는 72 h에 대 한 셀을 품 어 ~ 80 %confluency.
- 미디어 발음 5 번 10 mL PBS로 세포 세척. 5 mL 트립 신-EDTA와 셀을 분리 합니다. 셀을 수집 합니다. 원심 분리기 단계 2.2.4에서에서 위에서 설명한 대로 세포 생존 능력 및 수량 결정 제외 염료와 세포의 샘플을 얼룩.
- 1 x 106 당 100 µ L의 농도에서 세포를 중단 최소화 DMEM.
- 2.2.5 단계에 설명 된 대로 8 주 오래 된 여성 FVB/N 강포한 유형 쥐의 4 번 유 방 지방 패드에 내 면된 링컨 BuO microcrystals를 포함 하는 세포 현 탁 액의 100 µ L를 주사 천천히 인슐린 주사기를 사용 하 여.
- 2.2.6와 2.2.7 단계에 설명 된 대로 종양 개시와 성장을 모니터링 합니다.
- 중 사용 미 립 자 링컨 BuO 프로브 (프로토콜 II) 자연 또는 orthotopic 모델. 정상적인 유 방 땀 샘 이나 유 방 종양, 인슐린 주사기를 사용 하 여 관심, 예를 들어, 사이트에서 링컨 OBu microcrystals를 주사.
- 수용 성 조사
- 쥐 어 isoflurane 혼합물 (1.0 L/min 배달 및 isoflurane의 2-3%)의 흡입에 의해 anesthetize는 마 취를 사용 하 여 기계 및 EPR 분석기의 간격으로 그들을 배치.
- 악기, 조정 다음 NR (10-30 µ L, 10 m m), 희망 프로브를 주입 (10−30 µ L, 0.5-2 m m) 염 분, pH 7.2, 또는 DMSO (10 µ L, 10 m m) 솔루션 (i.t.) RSSR 프로브.
4. Vivo에서 기능 측정
- EPR 분 광 측정을 위해 마 취 기계 3.3.1 단계에 설명 된 대로 사용 하 여 공기 isoflurane 혼합물의 흡입에 의해 쥐를 anesthetize.
- L-밴드 (1.2 g h z) EPR 분석기를 사용 하 여 다음과 같이 기능적인 측정을 수행 합니다.
- 일반 유선 또는 유 방 종양에 표면 코일 공 놓고는 분석기를 조정 합니다.
- 이식 후 몇 주 동안 5−10 분 이식된 미 립 자 조사에서 EPR 스펙트럼을 취득. 수용 성 조사, 경우 5-10 분에 대 한 프로브 주사 후 즉시 EPR 스펙트럼을 취득.
- 분할N및 신호 진폭, I(t) hyperfine 찾을 수 NR 프로브의 EPR 스펙트럼을 분석 합니다. 1.2.4 단계에서 얻은 보정 곡선을 사용 하 여 pH 값에N 값을 변환 합니다. 상대적으로 초기 진폭에서 I(t) 신호 진폭의 부패의 속도 분석 I(t = 0), 초당 (s-1) 임의의 단위에서 계산.
- GSH-민감한 RSSR 프로브 GSH 농도 계산 하려면 지 수 활동의 시간 상수를 monoexponents로의 EPR 스펙트럼의 monoradical 성분의 증가 맞게.
- PH, pO2 와 Pi의 값을 생성 (단계 1.4.5)에 설명 된 대로 실험 것 다기능 희망 조사 높은 필드의 EPR 스펙트럼에 맞게.
5. 통계 분석
- 데이터 처리 및 통계 분석을 수행 합니다. (일반적으로 분산된 데이터 집합)에 대 한 피어슨의 r 상관 관계 테스트 및 (데이터 배포의 거부 정상으로 데이터 집합)에 대 한 Spearman의 순위 순서 상관 관계를 사용 하 여 상관 관계 분석.
결과
조직 p O 2 평가 링컨-BuO를 사용 하 여 조사:
우리는 갓된 링컨 BuO microcrystals 서 스 펜 션의 교정 수행 단계 1.1 아래 설명 된 절차를 사용 하 여. 그림 2 는 일반적인 산소 의존 링컨 BuO 프로브 여성 C57Bl/6 마우스의 세포를 주입 하 ...
토론
제시 메서드는 중요 한 매개 변수 화학 TME의 즉 pO2, pH, 산화 환 원 상태 및 중간 Pi와 세포내 GSH의 농도의 비 침범 성 비보에 평가 대 한 수 있습니다. 낮은 분야 EPR, MRI와 자기 공명 기법, 비 침 투 적인 vivo에서 TME 매개 변수 프로 파일링에 대 한 선택의 방법이 있습니다. MRI는 해부학 적 구조를 시각화 하지만 기능 감도 부족. MRI, 달리 EPR 기술 기능 스핀 프로브와 함께 사?...
공개
저자는 공개 없다.
감사의 말
이 작품은 NIH에 의해 부분적으로 지원 된다 CA194013, CA192064 및 U54GM104942를 부여. WVCTSI VVK, AB, TDE를 시작에 대 한 인정 이다. 저자는 설명 실험 지원에 대 한 박사 M. Gencheva, K. 작성을 감사합니다. 내용은 전적으로 저자의 책임 이며 반드시 NIH의 공식 의견을 대표 하지 않는다.
자료
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
참고문헌
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유