Method Article
효율적인된 3D 소 뇌 분화 프로토콜 옵션 2D 수정
요약
우리 간단한 3D 차별화를 사용 하 여 hPSCs에 대 한 프로토콜 정의 매체를 설명 하 고 초기 neuroepithelial 구조와 셀 집계를 생성할 수와 소 뇌 관련 표식으로 옵션에 대 한 긍정적인 성장 요인 감소 기능적 뉴런을 생성 하는 단층으로 셀을 차별화 하는 데 2D 수정.
초록
복잡성과 분화 프로토콜의 비용을 감소 하는 것이 연구자에 대 한 중요 합니다. 이 관심이 모방 하는 외부 요인 인간 만능 줄기 세포 (hPSC)로 두뇌 개발 또는 이상, 질병 표현 형을 마스킹 등의 모델 소개 수 있습니다 가능한 의도 하지 않은 효과 대 한 우려와 맞는. 여기, 우리 hPSCs, 소재 요구 사항 이전 프로토콜 보다 덜 간단한 시작 방법, 적은 패턴 요소와 설계에 대 한 두 개의 소 뇌 분화 프로토콜을 제시. 최근, 우리 문화 절차, 형태학 등 하위/심 실 영역-두뇌 개발 모델링 관련 및 마름모꼴을 포함 한 다른 뇌 "organoid" 프로토콜 일치 부동성 3 차원 (3D) 제품을 생성 하는 개발 입술 모양의 구조입니다. 두 번째 제품 소 뇌 관련 된 표식에 대 한 긍정적인 고 신경 같은 칼슘 유입 전시 기능 소 뇌 신경 세포를 생성할 수 표시 되는 완전 한 차별화를 부착, 2 차원 단층 프로시저를 사용 합니다. 함께, 이러한 프로토콜 테스트 유선형된 신경 차별점의 기본 모델 뿐 아니라 다른 연구 목적에 적합 한 옵션 선택 과학자를 제공 합니다.
서문
처음 소 뇌 혈통으로 hPSCs를 차별화 하는 데 체 외에서 프로토콜 vivo에서 소 뇌 개발1,2,,34를 흉내 낸의 원리에 운영 한다. 이와 같이, 그들은 프로-소 뇌 패턴 및 성숙에 특정 시간에 도입 요인의 승계 요구. 이러한 가운데 최고 morphogenetic 단백질 (BMPs), 그리고 섬유 아 세포 성장 인자 (FGFs) 중간 hindbrain 개발 및 isthmic 주최자5,,67의 형성에서 알려진된 역할 뼈 WNT, 했다. 물론, 각 추가 단계 및 요소는 연구원에 대 한 노동 집약적인 조작 및 큰 비용의 증가 의미 하 고 그래서 동등한 결과 달성 가능한 간단한 프로토콜 개발 관심입니다. 그들의 개발 시험관같은, 외부 제어를 필요로 하는 셀 든이 실제적인 문제 가상 질문으로 멋지게 dovetails.
소 뇌 차별화, 2015 년에 출판 하는 프로토콜 목적8패턴화 FGF2, FGF19, 및 stromal 세포 파생 요소 1 (SDF1)만 사용 하 여 성장 요인의 광범위 한 번호를 사용 하 여의 필요성을 해결. 이 연구는 또한 자유 롭 뜨 3D 문화 시스템을 사용 하 여 이전 소 뇌 프로토콜에서 달랐다. 소 뇌 표식에 대 한 긍정적인 세포를 생산, 이외에 두뇌 "organoids" 그들의 기술에 의해 생성 된 관련 형태학, 마름모꼴 입술 모양의 구조와 같은 전통적인 2D 단층 문화에서 사용할 수 없는 전시를 표시 했다. 비록 덜 복잡 하 고 비용이 많이 드는 성장 요인, 유니폼 embryoid 몸 (EBs)와 96 잘 접시 (96WPs), 문화 형성 등의 기능에 관하여 했다 절차 복잡 한 초기 단계. 또 다른 3D 프로토콜 같은 해 출판, 일반적이 고 저렴 한 셀 문화 기술9를 사용 하 여 신경 계보에 성공적인 차별화를 보고. 비록이 그룹 소 뇌 차별화 보다 대뇌 피 질의 조사, 소 뇌 차별화에 대 한 그들의 개념의 응용 프로그램 할인 하지 수 없습니다.
우리는 최근 보고 패턴화 요인의 감소 된 수를 사용 하 여 3D 소 뇌 분화 프로토콜 (즉, FGF2, 4, 및 8), 중간 요구 사항10을 최소화 하기 위해 전체 6 잘 플레이트 (6WPs)에서 세포를 유지 하 여 간소화 된 설치 뿐만 아니라. 과 립 세포의 생산을 돕기 위해, 흐려져 주 작동 근 (SAG) 최종 성숙 단계 동안 사용 되었다. SAG 소닉 고슴도치 (쉬), 이전 소 뇌 프로토콜과 립 세포 선구자 (GCPs) vivo에서1,2, 의 성장을 촉진 하는 역할 때문에 사용 했다 보다 적게 비싼 화학 대안입니다 11,,1213. 차별화 제품 형태학 상으로 관련 구조8,9소 뇌 관련 마커의 존재를 포함 하 여 다른 3D 프로토콜에서 그와 일치 했다. 이러한 결과 강화 흉내 상세한 이전 메시지는 vivo에서 의 환경 복잡 한 3 차원 체 외에서 분화 프로토콜에 필요한 않을 수 있습니다.
3D 프로토콜 외에도이 보고서에 설명 합니다 같은 빠른 설치, 기본 재료, 설계 2D 프로토콜 및 성장 요인의 수를 감소. 표식에 대 한 긍정적인 조기와 관련 된, 그것은 인간 배아 줄기 세포 (hESCs)에서 셀 수 또는 유도 만능 줄기 세포 (hiPSCs), 소 뇌, 신경 및과 립 세포 id. 또한, 칼슘 이미징 기능 인간의 뉴런의 존재를 나타냅니다. 프로토콜 중에서 선택할 수 중 하나에 관심이 연구원에 대 한 유연성의 수준을 추가: (1) 생성 특정 세포 유형, 모델링 (2) 인간의 두뇌 개발 및 구조, (3) 분석 단층에서 최적화 된 관련 설정 (예를 들어, 패치 클램프 기록), 또는 혼합 신경 문화에서 (4) 세포 세포 상호 작용. 그들의 간단 하 고 저가 자연 적합 그들 액세스할 수 연구자의 hPSC 필드에 새로 또는 기본 hPSC 절차에서 더 차별화 옵션 필요 합니다.
프로토콜
1입니다. 준비
참고: 모든 단계에 대 한 특정 항목에 대 한 테이블의 자료 를 참조.
-
HPSC 문화에 대 한 정의 500 mL hPSC 문화 매체를 준비
참고: 단계 2.1 2.6에 대 한 매체를 사용 합니다.- HPSC 중간 보충 하룻밤 (o/n) 4 ° c.에 녹여 HPSC 기본 매체의 12.5 mL 중간 병에서 다음 10 mL 2.5 mL (만들기 100 U/L)와 보충의 추가 병 페니실린/스 (펜/Strep).
- 4 ° C에서 저장 하 고 2 주 이내 사용.
참고: hPSC 매체는 10 µ M 바위 억제제 (RI) 및 10 %DMSO 추가 하 여 셀 아래로 고정을 사용할 수 있습니다.
-
1 L 신경 유지 보수 매체 (NMM) 차별화 문화에 대 한 준비
참고: 단계 3.1-4.4 매체를 사용 합니다.- 믹스 글루타민 강화 DMEM/F12 및 신경 기본 매체 (1:1 비율) 1 리터 병, (1x) n 2 보충과 다음 보충, (1x) B27 보충, 5 µ g/mL 인슐린, 1.5 m m L-글루타민, 100 µ M 비 본질적인 아미노산 (NEAA), 100 U/L 펜/Strep, 및 10 µ M 베타-mercaptoethanol입니다.
- 4 ° C에서 매체를 저장 하 고 3 주 이내에 사용 합니다.
참고: 혼합된 기저 중간에 보충 교재를 추가 하기 전에 필요한 양의 재고 농도에 따라 추가 구성 요소에 대 한 조정에 적절 한 볼륨을 제거 합니다.
-
HPSCs를 뿌리고 500ml 0.5 m m EDTA 작업 솔루션의 준비
참고: 단계 2.4 및 2.5에 대 한 매체를 사용 합니다.- 흐름 후드 아래 전송 49 mL의 인산 염 버퍼 식 염 수 (PBS) 메 마른 500 mL PBS 병에서 50 mL 튜브. 50 mL 튜브를 0.5 M EDTA의 0.5 mL 및 0.9 g NaCl 추가 합니다. 해산을 부드럽게 섞는다.
- 메 마른 500 mL PBS 병 0.22 μ m 필터 및 전송 사용 하 여 필터를 소독 솔루션. 실내 온도 (RT)에 저장 합니다.
-
HPSC 문화에 대 한 hPSC 문화 접시를 준비
참고: 단계 2.1 2.6에 대 한 번호판을 사용 합니다.- HPSC 적절 한 부착 코팅 (PAAC)의 작업 솔루션 x 50 확인: PAAC o/n 4 ° c.에 유리병을 녹여 1.5 mL 튜브에 400 µ L aliquots로 1:1 비율로 DMEM/F12 및 전송 PAAC 희석. 50 x 작업 솔루션 PAAC-80 ° c.에 저장
참고: (중요) PAAC 굳은 RT에 신속 하 게, 따라서 그것은 필요한 모든 구성 요소 (DMEM, 튜브 등) 얼음에 (4 ° C에서) 지켜진다. - 4 ° C에서 작동 솔루션 PAAC x 50의 튜브를 녹여 다음 차가운 DMEM/F12 50 x 희석. 6WP 750 µ L/잘 희석된 PAAC의 추가. 37 ° c.에 적어도 1 시간에 대해 품 어
참고: PAAC 접시 저장할 수 있습니다 4 ° C에서 1 주 동안 1 시간 잠복기 후 접시 여. 사용 하기 전에 37 ° C에 따뜻한 접시.
- HPSC 적절 한 부착 코팅 (PAAC)의 작업 솔루션 x 50 확인: PAAC o/n 4 ° c.에 유리병을 녹여 1.5 mL 튜브에 400 µ L aliquots로 1:1 비율로 DMEM/F12 및 전송 PAAC 희석. 50 x 작업 솔루션 PAAC-80 ° c.에 저장
-
감 별 법 문화에 대 한 방지 접착제 (AA) 접시를 준비
참고: 단계 3.1-4.1에 대 한 번호판을 사용 합니다.- 5 mg/mL를 만들어 많은 (2 hydroxyethyl 메타 크리 레이트) 95%에서 (폴 리-헤 마) 솔루션 에탄올. 명확한 솔루션을 얻을 때까지 o/n 37 ° C에서 흔들어. 실시간에 저장소
참고: 0.22 μ m 필터를 통해 필터링 소화 폴 리-HEMA를 제거할 수 있습니다. - 하단의 각 잘 덮 이도록 문화 접시에 많은 HEMA를 추가 합니다. 2 일 동안 37 ° C에서 접시를 품 어 하 고 우물의 액체/유니폼 코팅의 완전 증발 되도록 판 검사. AA 접시 포장 수 있으며 실시간 저장
- 5 mg/mL를 만들어 많은 (2 hydroxyethyl 메타 크리 레이트) 95%에서 (폴 리-헤 마) 솔루션 에탄올. 명확한 솔루션을 얻을 때까지 o/n 37 ° C에서 흔들어. 실시간에 저장소
-
감 별 법 문화에 대 한 폴 리-L-Ornithine/Laminin (PLO/램) 접시를 준비
참고: 단계 4.2-4.4 플레이트를 사용 합니다.- 코트의 웰 스, 살 균 PBS에 녹아 20 µ g/mL PLO를 사용 하 여 노출 영역. 플레이트 o/n 37 ° c.에 품 어 PLO를 발음 하 고 PBS로 3 회 씻어.
참고: (선택 사항) Incubated 플레이트 PLO와 포장 고 필요할 때까지 4 ° C에서 저장 될 수 있습니다. - 코트 PLO 코팅 우물의 표면 영역, 살 균 PBS에 녹아 10 µ g/mL 램을 사용 하 여. 37 ° C에서 2 시간 이상 또는 o/n 4 ° c.에 품 어 램을 제거 및 세척 우물 PBS 가진 2-3 배, 적절 한 매체 및 셀 즉시 추가.
참고: (선택 사항) 램 제거 솔루션 4 ° C에서 저장 고 다시 최대 2 배까지 사용 될 수 있습니다. (중요) 램 코팅 표면 건조;를 허용 하지 않습니다 이 즉시 추가 PBS 또는 적절 한 매체.
- 코트의 웰 스, 살 균 PBS에 녹아 20 µ g/mL PLO를 사용 하 여 노출 영역. 플레이트 o/n 37 ° c.에 품 어 PLO를 발음 하 고 PBS로 3 회 씻어.
2. 프로토콜 1: 피더 무료 hPSC 문화
참고: hESCs 비 상업적인 조직에서 가져온 (h01-라인, 재료의 표참조). 3 hiPSC 제어 라인 (hvs51, 60, 및 88) 섬유 아 세포 (fibroblasts 했다 익명, 비 식별 기증자 로부터 파생 및 따라서 IRB 승인 면제) 3 건강 한 인간 환자에서 프로그래밍에 의해 생성 된10, 17.
- 급지대 무료 문화에서 hPSCs를 유지
- 녹고 후 hPSCs hPSC 매체에 PAAC 접시에 도금 (단계 2.2 참조), 5% CO2와 37 ° C에서 hPSCs를 유지. HPSC 매체 매일 (단계 2.3 참조), 하루를 제외 하 고 녹고 나 뿌리고, 후 고 현미경 세포 검사 (목표: 2.5x/0.06, 5 x / 0.12 Ph0, 10 x / 0.25 Ph1) 관찰 성장 속도 차별화 (그림 3의 영역을 식별 하 , 상단 왼쪽된 패널 차별화의 예를 보여 줍니다).
- 통로 hPSCs 모든 3-4 일, 또는 때에 문화 > 80% 합류. 만약 셀 전시 차별화, 메서드를 뿌리고 사용 정상 hPSC의 5% 미만 (단계 참조 2.4), 그렇지 않으면 부드러운 메서드를 사용 하 여 (단계 2.5 참조). 문화에서 더 이상 필요, hPSCs 장기 저장용 고정 될 수 없습니다 (단계 2.6 참조).
- 해 동 hPSCs hPSC 매체에
- 녹고 과정 (9 mL/저온 관)에 대 한 살 균 튜브 및 해 동된 세포를 받을 준비 PAAC 플레이트 hPSC 매체의 필요한 볼륨을 전송. 10 µ M 리와 함께 두 튜브에서 매체를 보충 한다.
- LN2 스토리지 및 장소에서 직접 물 욕조 (37 ° C)에 cryotube를 검색 합니다. 때만 작은 얼음 크리스탈 남아, 물 목욕에서 제거 및 해빙 과정에 대 한 튜브를 극저온 튜브의 내용을 전송 (전체 용량 10 mL). 290 x g 실시간에 5 분 동안에 관을 원심
- 혈 청 학적인 피 펫을 사용 하 여 제거는 PAAC PAAC 격판덮개의 우물에서 솔루션 셀, 수신 및 10 µ M RI와 hPSC 매체를 추가 하기 위한 (단계 1.4 참조).
참고: (중요) 않습니다 하지 aspirate PAAC 솔루션 흡입 바늘, 또는 그것은 고형화 하 고 진공 펌프에 라인을 방해할 수 있습니다. - 상쾌한 튜브에서 제거 하 고 resuspend 10 µ M RI와 hPSC 매체에 셀. 1 저온 관/잘 6WP의 비율로 대상 플레이트에 셀을 배포 합니다. 5% CO2, 37 ° C에서 품 어 그리고 1 일 매체 새로 고치지 마십시오.
참고: 5% O2 에 셀을 시작 셀 생존을 증가할 수 있습니다.
- HPSC 매체를 새로 고침
- 따뜻한 물 목욕; 또는 RT에서 무 균 튜브에 hPSC 매체의 필요한 볼륨 2 mL/잘 6WP의 제안 했다.
참고: (선택 사항): hPSC 매체의 추가 금액을 추가 하 여 hPSCs;를 새로 고치지 않고 여분의 하루를 남아 있을 수 있습니다 그러나, 허용 하지 않습니다이 일주일에 한 번 이상. - HPSCs를 포함 하는 우물에서 매체를 발음 하 고 신선한 hPSC 매체를 추가 합니다.
- 37 ° C, 5% CO2배양 기에서 hPSCs 문화.
- 따뜻한 물 목욕; 또는 RT에서 무 균 튜브에 hPSC 매체의 필요한 볼륨 2 mL/잘 6WP의 제안 했다.
- HPSC 매체에 통과 hPSCs
- 무 균 튜브, 뿌리고 프로세스 및 passaged 세포를 받을 PAAC 접시의 준비에 대 한 hPSC 매체의 필요한 볼륨을 전송 합니다. 10 µ M RI와 대상 플레이트에 대 한 매체를 보충 한다. 중간 튜브 RT 또는 물 욕조에 따뜻한.
참고: 준비 및 처리는 다 재료의 테이블에에서 나열 된 하나 이상의 대체 코팅 소재를 사용 하는 경우. - 혈 청 학적인 피 펫을 사용 하 여 제거는 PAAC PAAC 격판덮개의 우물에서 솔루션 셀, 수신 및 10 µ M RI와 hPSC 매체를 추가 하기 위한 (단계 1.4 참조).
참고: (중요) 않습니다 하지 aspirate는 흡입 PAAC 솔루션 바늘, 고형화 하 고 진공 펌프에 라인을 방해할 수 있습니다. - HPSCs와 우물에서 매체를 passaged 수, 씻어 0.5 m EDTA, m로 두 번 셀 다음 추가 0.5 m EDTA m 37 ° c.에 2-5 분 동안 품 어 발음
참고: 1 mL/잘 6WP의 세척 및 보육에 대 한 EDTA의 충분 한 볼륨입니다. - 현미경 아래 우물을 확인 (목표: 2.5x/0.06, 5 x / 0.12 Ph0, 10 x / 0.25 Ph1). 만약 셀 분리 하기 시작, EDTA 솔루션 및 플러시 셀 hPSC 매체를 사용 하 여 무료 발음.
참고: (중요) 돌 때 EDTA 발음 전체 hPSC 식민지를 제거를 하지 (기다리지 말고 전체 식민지는 분리 될 때까지). 할 플러시되지 셀 이상 5 번 hPSCs를 해 고 pluripotency에 영향을 미칠 수 있습니다. 또한, 서 리와 hPSC 매체에 우물에서 세포를 플러시 전에 그들은 다시 접시를 준수 수 있습니다 셀 게 하지 마십시오. - HPSCs 전송 경험적 결정 (일반적으로 합류, 식민지, 및 성장 율의 크기에 관련 된)을 바탕으로, 분할의 비율은 1:4-1를 사용 하 여 대상 격판덮개의 우물: 16 (즉, 대상의 4 우물을 원래 접시에서 1 잘 플레이트)입니다. 5% CO2, 37 ° C에서 품 어 그리고 1 일 매체 새로 고치지 마십시오.
참고: 비율 1시 16분-1시 20분은 크롤 링 방지 식민지의 모양을 개선 하 고 분할.
- 무 균 튜브, 뿌리고 프로세스 및 passaged 세포를 받을 PAAC 접시의 준비에 대 한 hPSC 매체의 필요한 볼륨을 전송 합니다. 10 µ M RI와 대상 플레이트에 대 한 매체를 보충 한다. 중간 튜브 RT 또는 물 욕조에 따뜻한.
- 부드러운 방법 (G-방법)를 사용 하 여 통과 hPSCs
- 무 균 튜브, passaging 프로세스 및 passaged 세포를 받을 PAAC 접시의 준비에 대 한 hPSC 매체의 필요한 볼륨을 전송 합니다. 10 µ M 리 대상 플레이트에 대 한 매체를 보충 한다. RT, 또는 37 ° c.에 물 욕조에 따뜻한 중간 관
- PAAC 격판덮개의 우물에서 제거 PAAC 솔루션을 사용 하 여 혈 청 학적인 피 펫 셀, 수신 및 10 µ M RI와 hPSC 매체를 추가 하기 위한 (단계 1.4 참조).
참고: (중요) 않습니다 하지 aspirate PAAC 흡입 바늘, 또는 그것은 고형화 하 고 진공 펌프에 라인을 방해할 수 있습니다. - Passaged 수를 hPSCs와 우물에서 매체를 발음 하 고 0.5 m EDTA를 사용 하 여 두 번 셀을 씻어. 두 번째 세척, EDTA, 발음 하기 전에 대기 30 s 다음 PBS의 1 mL을 추가 4-9 분 37 ° c.에 품 어 기다리는 동안, PBS의 4 mL를 무 균 튜브 준비.
참고: 6WP의 1 mL/우물에 EDTA의 충분 한 볼륨입니다. - 현미경 아래 우물을 확인 (목표: 2.5x/0.06, 5 x / 0.12 Ph0, 10 x / 0.25 Ph1). 셀을 분리를 시작 하는 경우 신중 하 게 무료로 식민지 수 있도록 접시의 측면을 누릅니다. 때 > 식민지의 50%는 무료 부동, 5 mL 혈 청 학적인 피 펫을 사용 하 여 4 mL PBS 포함 된 튜브에 1 mL PBS에에서 식민지를 전송 (triturate 하지 않습니다).
참고: (중요) hPSC 문화를 정리 하는 목적 이므로, 셀 남아 분화 여부를 확인 하는 검사는 접시에 첨부. 또한, 잘 사용 하 여이 프로세스에 연결 된 남아 있는 식민지는 뒤에 남아 있을 수 있습니다 그래서 모든 식민지 통로 필요는 없습니다. - 튜브에 정착 하는 셀에 대 한 RT에서 5-10 분을 기다려 (원심 하지 마십시오). 튜브, 정착된 hPSCs를 제거 하지 않도록 주의 복용에서 PBS를 발음. 신중 하 게 hPSC 매체에 셀 resuspend (할 하지 triturate), 셀 분할의 비율은 1:4-1를 사용 하 여 대상 격판덮개 전송: 16. 5% CO2, 37 ° C에서 품 어 그리고 1 일 매체 새로 고치지 마십시오.
- HPSCs 아래로 고정
- 합류, 따라 문화, (최대) 2-3 일에 hPSCs의 1을 사용 하 여 스토리지 LN2에 대 한 1-2 cryopreservation 튜브를 채우기 위해.
- 2.5 뿌리고 (단계)의 끝에, 500 µ L를 사용 하 여 또는 전송 hPSC 매체의 1 mL 세포 6WP의 1에서 1 개 또는 2 cryopreservation 튜브를 각각 (500 µ L/유리병). 각 튜브를 중간 포함 hPSC 매체, 20 µ M RI, 및 20 %DMSO 동결 x 2의 500 µ L를 추가 합니다.
참고: (선택 사항) 세포 동결 매체 1 mL/유리병에서 x 1에 직접 전송할 수 있습니다. - 4 ° C, 그리고-80 ° c.에 즉시 저장소를 미리 냉각 극저온 용기 (소 프로 파 놀 포함)에 저온 관 배치
- 다음 날에는 LN2 탱크 장기 저장을 위한 극저온 튜브를 전송 합니다.
3. 프로토콜 2: 3D "Organoid" 차별화
-
수정 된 G-hPSCs의 뿌리고의 방법으로 차별화의 설치
- 무 균 튜브에 대상 우물의 수에 대 한 NMM의 필요한 볼륨을 전송. Ng/mL FGF2 및 10 µ M RI 4 보충. 중간 튜브 RT, 또는 37 ° c.에 물 욕조에 따뜻한
참고: 개시 웰 스의 합류에 따라 hPSCs는 집중 대상 접시는 2:1 또는 3: 1을 배포 하는 동안 비율 (즉, 대상 접시의 1로 원래 접시에서 2 우물), 2.5 mL/잘 끝 볼륨 6WP의. - 있을 경우에, hPSCs를 포함 하는 우물에서 매체를 발음 하 고 0.5 m EDTA를 사용 하 여 두 번 셀을 씻어. 두 번째 세척, EDTA, 발음 하기 전에 대기 30 s 다음 PBS의 1 mL을 추가 4-9 분 37 ° c.에 품 어 기다리는 동안, PBS의 4 mL를 무 균 튜브 준비.
참고: 6WP의 1 mL/우물에 EDTA의 충분 한 볼륨입니다. (중요) 녹고 후 마지막 통로, 그리고 적어도 1-2 구절 후 문화에 3 일 이상 했다 hPSCs를 사용 하는 것이 바람직합니다. - 웰 스는 현미경 검사 (목표: 2.5x/0.06, 5 x / 0.12 Ph0, 10 x / 0.25 Ph1). 셀을 분리를 시작 하는 경우는 접시의 측면에 부드러운 드려서 셀 무료. 튜브 5 mL 피 펫과 4 mL PBS를 포함 하는 셀 전송.
참고: (중요) 빛 홍 조 및 trituration 식민지를 분할 하 고 느슨한 세포를 수집 하지만 준수는 접시에 남아 있는 세포를 무시 허용 됩니다. - 튜브 중력 분리에 대 한 실시간, 10 분 동안 앉아서 수 있습니다. 필요에 따라 셀을 가볍게 원심 (200 x g RT에 5 분 보다 더 큰) 필요한 경우.
- 정착된 hPSCs, 제거 하지 않도록 주의 복용 튜브에서 PBS aspirate resuspend 4 ng/mL NMM에 셀 FGF2 및 10 µ M 리, 고 후 2:1 또는 3:1 비율로 AA 코팅 접시에 배포. 5% CO2, 37 ° C에서 품 어 그리고 요구 되지 않는 한 일 동안 매체를 새로 하지 않습니다 (단계 3.2.1 참조).
참고: (선택 사항) 셀 전송의 편의 위해 유통, 이전 대상 격판덮개의 우물을 문화 매체의 일부를 추가 하 고 작은 볼륨에서 셀 resuspend. 또한, hPSCs 스테인드 하 고 정확한 시작 셀 밀도 정의 하려면 계산 될 수 있습니다. 그러나, 대상 접시에 최종 볼륨 6WP의 2.5 mL/잘 되어야 한다.
- 무 균 튜브에 대상 우물의 수에 대 한 NMM의 필요한 볼륨을 전송. Ng/mL FGF2 및 10 µ M RI 4 보충. 중간 튜브 RT, 또는 37 ° c.에 물 욕조에 따뜻한
-
37 ° c (5% CO2) 부동성 차별화 문화 유지
- 변화 중간 색깔, 죽은 세포, 응집, 그리고 바닥을 잘 준수의 축적에 대 한 매일 플레이트를 확인 하십시오.
- 선택 사항: 중간 변경 일정에 새로 고침 (를 포함 하 여 상쾌의 첫 3 일) 매체 설정는 경우 노란색, 그리고 중간 변경/새로 고침 (단계 3.3)에 대 한 지침을 따르십시오. 셀의 대부분 죽은 경우, 새로 고침 변경/중간 중력 분리 (3.4 단계)에 대 한 지침을 따르십시오.
참고: EBs의 형성과 성장에 큰 셀 집계 예상 된다, 하지만 셀 및 셀 집계 수 있습니다 덩어리 같이 큰 질량 개별 성장/확산 때문에. 이 관찰 되는 경우 대 중 헤어 라이트 분쇄 허용 됩니다. 셀 AA-플레이트 표면에 시작, 웰 스의 내용을 떠 남은 수 있습니다 새로운 우물에 직접 전송 또는 중간 변경/새로 고침 프로세스 동안 전송. 접시에 준수 해야 하는 셀을 전송 하지 마십시오.
- 선택 사항: 중간 변경 일정에 새로 고침 (를 포함 하 여 상쾌의 첫 3 일) 매체 설정는 경우 노란색, 그리고 중간 변경/새로 고침 (단계 3.3)에 대 한 지침을 따르십시오. 셀의 대부분 죽은 경우, 새로 고침 변경/중간 중력 분리 (3.4 단계)에 대 한 지침을 따르십시오.
- 3 일에 변경 매체 NMM 4 ng/mL FGF2와 함께 합니다. 매일 매체를 새로 고칩니다.
- 7 일에 매체를 변경 NMM 1 µ M와 Retinoic 산 (RA), 100 ng/mL FGF8B, 및 4 ng/mL FGF2. 매일 매체를 새로 고칩니다.
참고: (중요) RA는 빛에 민감한. 빛에서 RA 문화 샘플을 보호 합니다. - 14 일에 100 ng/mL FGF8B, 100 ng/mL, FGF4 및 20 ng/mL FGF2 매체 NMM를 변경 합니다. 매일 매체를 새로 고칩니다.
- 17 일에 변경 매체 NMM 100 ng/mL FGF8B와 함께. 매일 매체를 새로 고칩니다.
- 21 일에 매체 100 ng/mL 두뇌 파생 된 Neurotrophic 요인 (BDNF)와 NMM과 10 ng/mL Glial 파생 된 Neurotrophic 요인 (GDNF)으로 변경 합니다. 매일 매체를 새로 고칩니다.
- 28 일에 변경 매체 NMM 100 ng/mL BDNF와 10 ng/mL GDNF, 3 ng/mL SAG, 100 ng/mL Neurotrophic 요인 3 (NT3), 및 25 m m KCl. 재생 매체 매일 합니다.
- 35 일에 분석을 위한 3D organoids를 수집 합니다.
- 변화 중간 색깔, 죽은 세포, 응집, 그리고 바닥을 잘 준수의 축적에 대 한 매일 플레이트를 확인 하십시오.
-
3 차원 문화에 대 한 변경/새로 고침 차별화 매체
- 무 균 튜브에 적절 한 구성 요소 (구성 요소 일정 단계 3.2.2-3.2.7 참조)와 NMM의 필요한 볼륨을 전송. 37 ° c.에 물 욕조에 따뜻한
- 접시를 팁 고 셀 우물의 아래쪽 가장자리에 정착 될 때까지 부드럽게 흔들어. 조심 스럽게 2 mL는 세포의 제거를 피하고 혈 청 학적인 피 펫을 사용 하 여 오래 된 매체의 다음 신선한 매체의 2 개 mL를 추가. 5% CO2와 37 ° C에서 품 어.
참고: (중요) 마지막 볼륨 6WP의 2.5 mL/잘 해야 합니다. 증발이 발생 하는 경우 2 mL의 오래 된이 매체는 더 셀 문화; 건조를 제거 하지 마십시오 대신, 여분의 매체를 추가 합니다.
-
변경/새로 고침 차별화 중간 중력 분리
- 무 균 튜브에 적절 한 구성 요소와 NMM의 필요한 볼륨을 전송. 37 ° c.에 물 욕조에 따뜻한
- 무 균 튜브에 우물의 내용을 전송 하 고 중력 분리에 대 한 실시간에서 10 분 동안 앉아 튜브를 허용 합니다.
- 튜브에서 오래 된 매체를 제거 하는 피 펫을 사용 하 여, 제거 하지 복용 주의 셀, 적절 한 구성 요소와 NMM에 resuspend 정착 다음 새로운 AA 코팅 웰 스에 배포. 5% CO2와 37 ° C에서 품 어.
참고: (옵션) 편의 문화 매체의 일부 대상에 추가할 수 있습니다 위한 우물 낮은 볼륨에서 resuspended 세포 분화와 함께 배포 하기 전에. 최종 볼륨 6WP의 2.5 mL/잘 해야 합니다.
4. 프로토콜 3: 대체 2D 차별화 문화
-
시작 하 고 12 일을 통해 3D 프로토콜 섹션 3에 따라 단계를 사용 하 여 문화를 유지
- 3.1 3.2.3 스텝과 3.3 및 3.4 단계에 따라 변경/재생 매체에 따라.
-
전환 하 고 2D 단층 문화 유지
- 차별화의 13 날에 중력 분리 (3.4 단계) 변경/재생 매체에 대 한 지침을 따르십시오만 셀/집계 PLO/램 코팅 접시를 배포 (단계 1.6 참조) 2.5 mL/6WP의 최종 볼륨.
참고: 매체 수 보완 될 10 µ M RI와 준수 및 세포의 생존을 위해 초기 도금 하는 동안. (중요) 웰 스, 낮은 밀도 또는 격판덮개에 크롤 링을 방지 하 고 (단계 4.4 참조)을 필요에 따라 통로에 셀 균등 하 게 전파 하는 것이 바람직합니다. PLO/램 코팅 접시 (즉, 6WP, 12WP, 등)의 기본 크기 결정 되어야 합니다 경험, 셀 라인에 대 한 확산 속도 및 제품에 대 한 목적에 따라. 명령과 6WP에 대 한 볼륨을 줄 것 이다 잘 번호 (즉, 2 mL/잘 6WP, 1 mL/잘 12WP, 등)의 2 배 각에 대 한 등분으로 변환 될 수 있습니다. - 14 일에 100 ng/mL FGF8B, 100 ng/mL, FGF4 및 20 ng/mL FGF2 매체 NMM를 변경 합니다. 4.3 단계에 설명 된 대로 매일 매체를 새로 고칩니다.
- 17 일에 변경 매체 NMM 100 ng/mL FGF8B와 함께. 4.3 단계에 설명 된 대로 매일 매체를 새로 고칩니다.
- 21 일에 100 ng/mL BDNF와 함께 NMM에 매체 그리고 10 ng/mL GDNF 변경 합니다. 4.3 단계에 설명 된 대로 매일 매체를 새로 고칩니다.
- 28 일에 변경 매체 NMM 100 ng/mL BDNF 10 ng/mL GDNF, 3 ng/mL SAG, 100 ng/mL NT3, 및 25 mM KCl. 재생 매체 4.3 단계에 설명 된 대로 매일.
- 35 일에서 분석, 대 한 세포를 수집 하거나 단계 4.2.5 확장된 문화 (테스트 하지 잠재적인 제한)으로 동일한 매체에 유지.
- 차별화의 13 날에 중력 분리 (3.4 단계) 변경/재생 매체에 대 한 지침을 따르십시오만 셀/집계 PLO/램 코팅 접시를 배포 (단계 1.6 참조) 2.5 mL/6WP의 최종 볼륨.
-
2D 문화에 대 한 변경/새로 고침 차별화 매체
- 무 균 튜브에 적절 한 구성 요소 (구성 요소 일정 단계 4.2.2-4.2.5 참조)와 NMM의 필요한 볼륨을 전송. 37 ° c.에 물 욕조에 따뜻한
- 우물에서 중간 발음 다음 2 mL 새로운 매체를 추가 합니다. 5% CO2와 37 ° C에서 품 어.
참고: (선택 사항) 마지막 볼륨 2.5 mL/6WP, 오래 된 매체의 2 mL을 제거 하는 피 펫을 사용 하 고 신선한 매체의 2 개 mL를 추가의 잘 보관할 수 있습니다. 일부를 예약 우물, 그리고 공기 접촉에서 방지 셀에 중간 변경 단계 동안 셀에 충격을 줄일 수 있습니다.
-
통로 2D 차별화 문화
- 뿌리고 프로세스에 대 한 무 균 튜브에 적절 한 구성 요소 (구성 요소 일정 단계 4.2.2-4.2.5 참조)와 NMM의 필요한 볼륨을 전송 하 고, 별도로, passaged 셀을 받기 위한 플레이트 코팅 PLO/램을 준비 하. 10 µ M RI와 대상 플레이트의 매체를 보충 한다. 중간 튜브 RT, 또는 37 ° c.에 물 욕조에 따뜻한 구성 요소를 저장 하려면 passaging 과정에서 세포를 세척 NMM 혼자 사용 가능 하다.
참고: (중요) 제품 칼슘 이미징에 사용 하는 경우 실험, 통로 세포 분화의 끝 전에 2-6 일 사이 확인. - Passaged 수를 우물에서 매체 발음 300 µ L/잘 분리 trypsin 기반 에이전트의 추가 (참조 테이블의 자료), 소용돌이 플레이트 웰 스, 커버를 분리 에이전트를 즉시 제거.
- RT에서 2 분 동안 앉아 접시 허용 다음 접시의 측면에 두 드려서 셀을 풉니다. 600 µ L/잘 정의 된 트립 신 억제제 (DTI)을 추가 하 고 5 mL NMM 무 균 튜브에 DTI에 셀을 전송.
- 원심 실시간 Aspirate 매체에서 15 분 동안 290 x g에서 튜브와 튜브 다른 5 mL NMM 추가.
- 실시간 Aspirate 매체에서 15 분 동안 290 x g에서 튜브 원심 고 셀 리를 포함 하는 적절 한 매체에 resuspend.
- 분할의 비율은 1:1-1을 사용 하 여 PLO/램 플레이트에 셀 배포: 초기 합류, 확산 속도, 대상 플레이트에 차동 크기에 따라 12, 5% CO2와 37 ° C에서 유지 하 고.
- 뿌리고 프로세스에 대 한 무 균 튜브에 적절 한 구성 요소 (구성 요소 일정 단계 4.2.2-4.2.5 참조)와 NMM의 필요한 볼륨을 전송 하 고, 별도로, passaged 셀을 받기 위한 플레이트 코팅 PLO/램을 준비 하. 10 µ M RI와 대상 플레이트의 매체를 보충 한다. 중간 튜브 RT, 또는 37 ° c.에 물 욕조에 따뜻한 구성 요소를 저장 하려면 passaging 과정에서 세포를 세척 NMM 혼자 사용 가능 하다.
결과
감소 된 성장에 대 한 시각적 개요는 2D 및 3D 소 뇌 분화 프로토콜 요소
그림 1 에서는 2D 및 3D 소 뇌 분화 프로토콜에 대 한 전체 일정 외적 요소와 도금의 시간. HPSCs 3D 소 뇌 차별화 진행에 대 한 일반적인 진행 그림 2에 표시: hESC 라인 h01-식민지로 시작 하는 피더 무료 문화에 0에서 (그림의 왼쪽 위); 하루 2 (위 가운데); EB 형성을 겪고 다음 주 14 (오른쪽 위);에서 RA와 FGF8 신경 유도 명백한 루멘과 더 큰 셀 집계로 성장 다양 한 크기와 모양 하루 28 (왼쪽 아래);의 집계를 형성 하루 28 (아래 가운데);에 표시 단일 집계의 다른 구조와 복잡성에 개발 고와 (오른쪽 아래) 하루 35에서 동일한 구조를 형태학 상 변화를 계속 했다. 2D 소 뇌 차별화를 진행 하는 hPSCs에 대 한 일반적인 진행은 그림 3에서 묘사: hESC와 피더 무료 문화 날 0 (hESC 식민지 가운데 차별화 된 셀의 영역을 나타내는 동그라미 그림의 왼쪽 위)에 식민지로 h01-라인 ; 하루 2 (위 가운데); EB 형성을 겪고 다음 날 13 (오른쪽 위);에서 RA와 FGF8 신경 유도 명백한 루멘과 더 큰 셀 집계로 성장 (왼쪽 아래); 주 14에서 도금 후 부착 세포로 확산 그리고 하루 35 낮은 (더 낮은 중간) 및 고배율 (오른쪽 아래)에 더 많은 복잡 한/성숙한 형태를 가진 세포의 단층으로 다음.
3D 제품 전시 마커 및 초기 Neuroepithelium의 구조
그림 2 (아래 왼쪽된 이미지) 그림 4 확률적 병합 뿐 아니라 성장 및 성숙 속도, 변화 또는 집계의 떨어져 깨고 경작을 통해 본 3D 집계 형태가 고. 이에 불구 하 고 각 차별화 immunocytochemistry (ICC) 그림 5에 얼룩으로 소 뇌과 립 마커 ZIC1을 포함 한 초기 신경 및 신경 마커를 전시 하는 집계를 생성 합니다. 더 중요 한 것은, 그림 5 와 그림 6 간단한 3D 문화, 감소 성장 요인, 초기 neuroepithelium 마름모꼴 입술 등 두뇌 개발에 관련 된 복잡 한 구조와 집계를 생성할 수는 건의 한다.
2D 제품 전시 소 뇌 마커 및 기능 신경 활동
2D 문화는 복잡 한 3 차원 구조를 재현할 수 없는, 그들은 ICC 얼룩 그림7에서에 표시 된 대로 소 뇌과 립 세포 마커 ZIC1을 포함 한 초기 신경 및 신경 마커를 전시 하는 세포를 생성할 수 있습니다. RT-PCR을 통해 유전자 표정 분석 그림 8에서 보듯이 비록 초기과 립 세포 마커 ATOH1 의 존재는 변수를 실험과 라인 사이의 ICC 얼룩 결과 지원 합니다. 칼슘 이미징 2D 문화에 더 쉽게 처리 됩니다. 그림 9, 보충 비디오 1및 추가 비디오 2에서 보듯이 전기적 자극된을 세포 신경 발사 패턴, 기능적 뉴런의 생성 제안의 전형적인 칼슘 유입 보여줍니다.
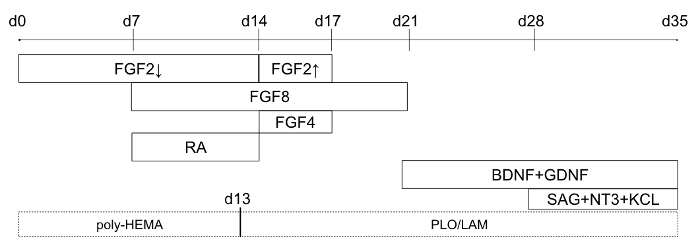
그림 1: 차별화 프로토콜 (차별화의 하루 0에서 시작)의 타임 라인. 실선 상자는 특정 요소 문화 매체에 추가 하 고 점선 상자 표시 판-코팅 옵션 2D 수정에 대 한 나타냅니다. FGF2, 아래쪽 화살표는 낮은 농도 (4 ng/mL), 참조 및 위쪽 화살표는 높은 농도 (20 ng/mL)를 말합니다. 이 그림은 홈즈와 하이 네10에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
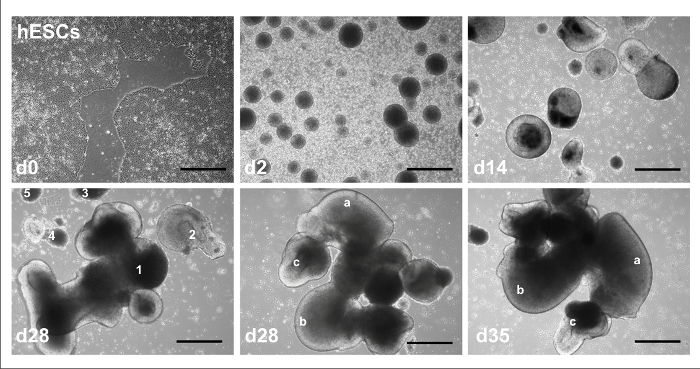
그림 2: 3D 프로토콜의 대표 명시 이미지. d0, d2에서 EBs에서 hESC 식민지 유도 d14, 다양 한 크기와 형태 (번호 1-5) d28, d28에 독특한, 식별 기능 (문자는 는-c로 표시)와 단일 집계의 집계에 따라 집계 및 d35에 동일한 기능에서 볼 수 변경 됩니다. 눈금 막대 = 100 µ m. 이 그림은 홈즈와 하이 네10에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3: 2D 프로토콜의 대표 명시 이미지. hESC 식민지 d0, d2에서 EBs 20 x 확대 및 확대, x 5에서 보듯이 d35에서 성숙 후 d14에서 집계를 도금 후 d13에서 유도 후 집계 합니다. 상단 왼쪽된 패널에서 백색 원형 hESC 식민지 가운데 차별화 된 셀의 영역을 표시합니다. 눈금 막대 = 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
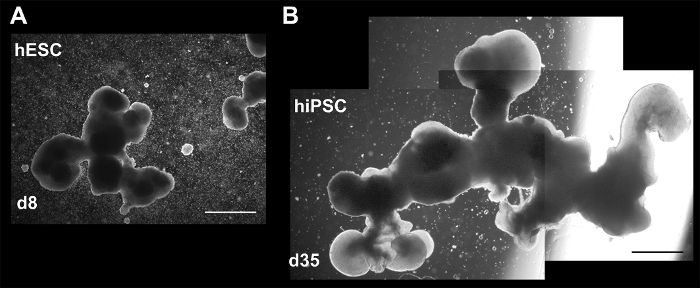
그림 4: 3 차원 문화에 다양 한 크기와 복잡성을 보여주는 명시 이미지. (A) 주 8에서 집계 (hESCs), 및 (B) d35 (hiPSCs). 후자의 이미지 전체 집계 표시 하려면 세 가지 별도 이미지 구성 됩니다. 두 집계 작은 집계 또는 (속보) 구조의 손실의 병합에 의해 영향을 받은 수 있습니다. 눈금 막대 = 200 µ m. 이 그림은 홈즈와 하이 네10에서 재 공포. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
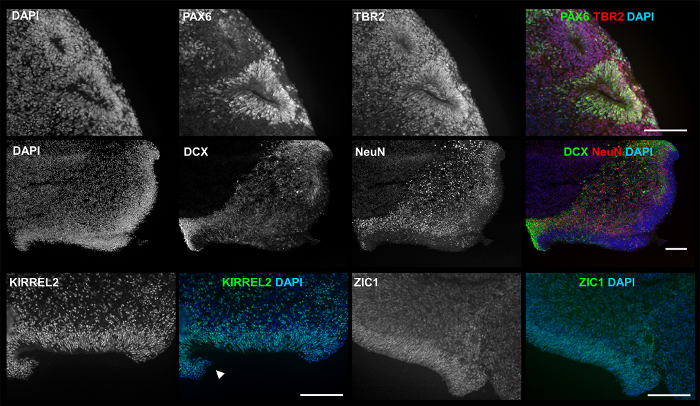
그림 5: 3D 제품의 ICC 이미지 표시 관련 마커 및 구조. 문화 d35에 3D 제품 전시: PAX6 (녹색) 및 신경 장미 같은 대형의 루멘으로 (빨강) TBR2 (첫 번째 행); DCX (녹색) 및 외부 가장자리 심 실 영역 (VZ)에서 확산 NeuN (레드)-같은 구조 (두 번째 행); KIRREL2, neuroepithelium 소 뇌와 관련 된 마커 (3 행, 왼쪽); 그리고 ZIC1는 마커 관련 된 소 뇌과 립 세포 (오른쪽 세 번째 행). 여러 번 사용 하 여 4 개의 다른 hPSC 라인 실험 실시: hESC 라인 h01-(n = 5), 및 iPSC 라인 hvs88 (n = 4), hvs60 (n = 3), 및 hvs51 (n = 1). 화살표 마름모꼴 입술 (RL)을 가리킨-구조와 같은. 눈금 막대 = 100 µ m. 이 그림은 홈즈와 하이 네10에서 재 공포. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 6: 3D 제품에서 대규모 심 실 영역 같은 구조. 문화 d35에서 hESC 파생 집계 PAX6 (녹색) 및 TBR2 (적색) 일반적으로 관련 된 심 실 영역 (VZs) 및 subventricular 영역 (SVZs) 에서 vivo에서 발견 하는 초기 뉴런에 대 한 긍정적 이다. (맨 위) 별표 (*) 표시 VZ 같은 지역 괄호 VZ의 깊이/부서를 나타내는 집계의 가장자리를 따라 실행의 꼭대기 쪽 / SVZs. (중간) 결합 된 신호 표시 PAX6 흩어져 섹션 + TBR2-셀 상단 오른쪽 끝으로 크기에서 증가 하 고 VZ. (아래) 중간 패널에 사각형으로 표시 된 섹션의 높은 확대 이미지. 눈금 막대 = 100 µ m. 이 그림은 홈즈와 하이 네10에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
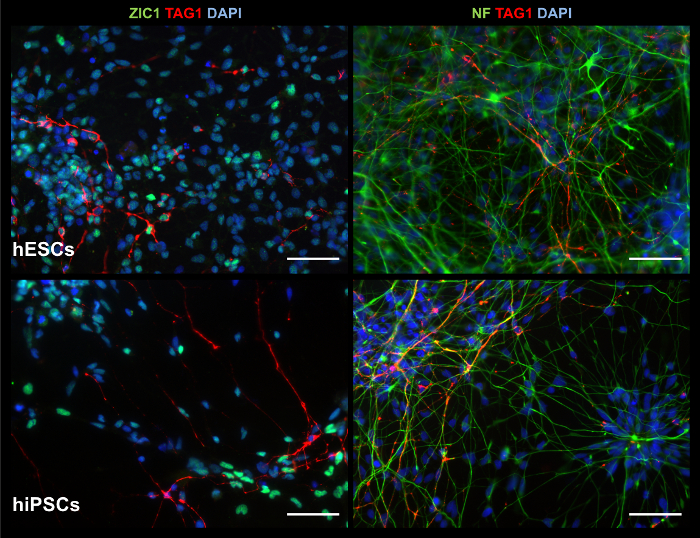
그림 7: 2D 제품의 ICC 이미지 표시 관련 마커. 문화 d35에서 2D 제품 전시, hESCs (위쪽 행)와 hiPSCs (아래쪽 행), 셀에 대 한 긍정적인:과 립 세포 마커 ZIC1 및 철새 소 뇌 신경 마커 TAG1 (왼쪽 열); 그리고 신경 마커 neurofilament (NF)와 TAG1 (오른쪽 열). 눈금 막대 = 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
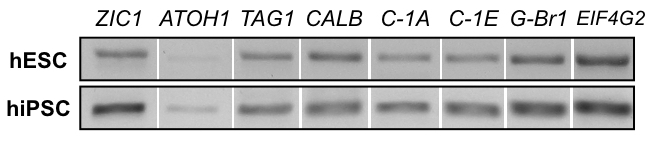
그림 8: 2D 제품의 RT-PCR. h01-hESC 선의 mRNA 표정 분석 (위쪽 행)와 hiPSC 라인 hvs60 (아래쪽 행)는 2D의 끝에 프로토콜 제품에 젤 전기 이동 법을 보여줍니다:과 립 세포 마커 ZIC1과 립 세포 마커 ATOH1, 철새 소 뇌 신경 마커 TAG1, Purkinje 셀 표식 Calbindin (CALB), 전압 종속 칼슘 채널 CACNA1A (C-1A), CACNA1E (C-1E), 감마-aminobutyric 산 (GABA) B 수용 체 1 (G-Br1), 및 내부 관리 유전자 EIF4G2).
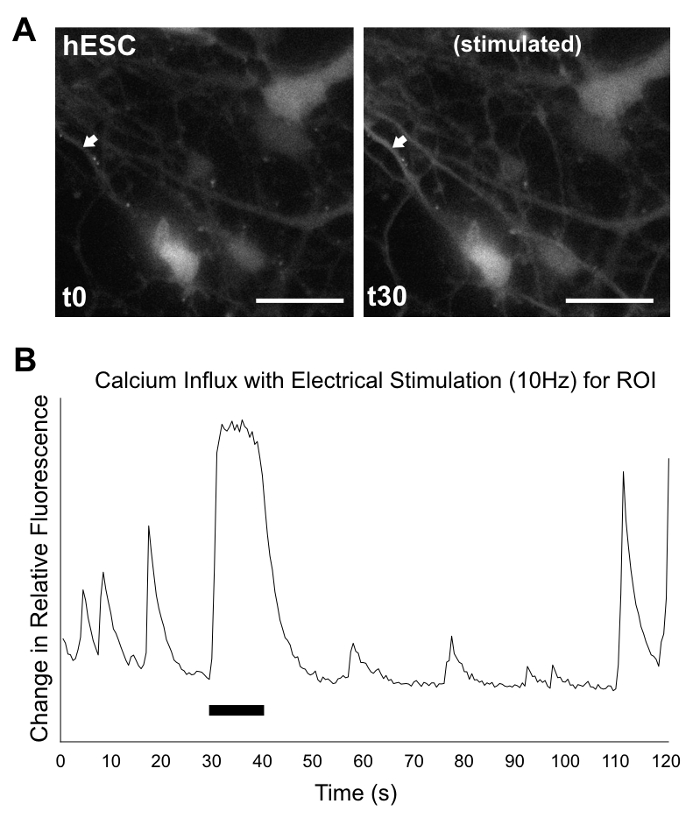
그림 9: 칼슘 이미징/2D 제품의 분석. 문화 d35에 hPSC 차별화 제품 fluor5 염료를 가진 외피 후 현미경, 2 분 동안 기록 되었다. 30 s, 셀 10 전기 자극 했다 s에서 10 Hz. (A) 스틸 이미지 보기 hESCs 0에서 s (왼쪽)와 30에서 전기 자극의 시작 후 s (오른쪽). 화살표 (ROI) 칼슘 유입의 분석에 대 한 관심의 영역을 나타냅니다. 투자 수익에 대 한 시간 대 상대 형광에 (B) 그래픽 분석 표시 변경 (형광 변화 = (F F0) /F0, 어디 F0 = (∑F1-n) / n), 신경 같은 급격 한 발생 하기 전에, 도중, 그리고 후 자극입니다. 검정색 막대는 전기 자극의 길이 나타냅니다. (화이트) 바 규모 50 µ m. 전체 기록에 대 한 hESC (로 여기에 본) 하 고 (표시 되지 않음)는 hiPSC 라인 보충 비디오 1 , 비디오 2 보충, 각각 =. 녹음 4 배속에서 AVI 형식으로 되어있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
보충 비디오 1: 칼슘 hESC 선에서 h01-2D 제품의 비디오 이미징. 문화 d35에 h01-현미경, 아래 2 분 fluor5 가진 외피 후 기록 하는 hESC 선에서 차별화 제품 염료. 30 s, 셀 10 전기 자극 했다 10 Hz. 녹음에 s 2 프레임/s에서 되었고 ~ 7 프레임/s, ~ 30 지속 비디오에서 AVI 비디오로 처리 ~ 4 배속에서 s. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보충 비디오 2: 칼슘 hiPSC 라인 hvs51에서 2D 제품의 비디오 이미징. 문화 d35에 hiPSC 라인 hvs51에서 차별화 제품 fluor5 염료를 가진 외피 후 현미경, 2 분 동안 기록 되었다. 30 s, 셀 10 전기 자극 했다 10 Hz. 녹음에 s 2 프레임/s에서 되었고 ~ 7 프레임/s, ~ 30 지속 비디오에서 AVI 비디오로 처리 ~ 4 배속에서 s. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
복잡성 및 비용 요인이 관련 줄기 세포 연구자 선택 또는 분화 프로토콜을 개발 하는 경우입니다. 그것은 얼마나 많은 외부 컨트롤 원하는 세포 유형, 생성 하는 데 필요한의 미결 문제 이것은 특히 사실 이다 또는-다르게 포즈-얼마나 유능한 hPSCs 생산 하는 그들의 자신의 개발 환경에 두고 자신에 게 충분 한 경우 영양소입니다. 체 외에 외적 요인의 소개 아주 잘 원하는 셀 제품을 생산할 수 있습니다 하지만 그들은 또한 방해 수 내장 발달 용량 세포 vivo에서전시는 것 이다. 그런 고려는 목표는 질병 모델링 환자 파생 Ipsc의 사용 하는 경우에 특히 중요 하다. 패턴화 성장 요인의 광범위 한 사용 질병 고기 마스크 수 있습니다. 이 보고서에 대 한 자세한 프로토콜 복잡성, 비용, 또는 모방 하는 외부 요인8,9의 사용을 줄이기 위해 이전 연구의 추세에 따라.
그것은 이전 연구 다 vivo에서 조건 재현 공동된 노력 없이 소 뇌 운명 향해 차별화를 달성 하는 것은 나타납니다 보고 Muguruma 그 외 여러분, 그리고 우리 자신의 최근 연구 결과 바탕으로, 1 , 2 , 3 , 4 , 8 , 10. 흥미로운 점은 두 연구 모두 사용 FGF2 어느 설정 필요, 했다 제안 성장 요인의 다른 세트를 사용. 우리 도망 추가 테스트, 어디 FGFs 선택적으로 프로토콜을에서 제외 되었고 셀 외부 FGFs10없이 동일한 제품을 생성할 수 있는 것으로 나타났다. 우리의 연구 간의 차이 사실 우리가 다른 hPSC 라인과 문화 방법을 사용, RA, 신경 감 별 법을 유도 하 고과 립 세포 생존과 성숙 (BDNF GDNF, SAG, KCL)을 지 원하는 구성 요소를 포함 하 여 한정 했다11 -14. 또한, Muguruma 그 외 여러분에 비해 덜 복잡 한 시작 방법 채택 되었다. 그들의 프로토콜 96WPs, 그들에 게 서로 다른 물리적 및 화학적 절연에 균일 한 EBs를 생성 하 여 시작 했다. 여기에 프로토콜 모든 PSCs 상대적으로 EB 형성, 자유롭게 상호 작용 하도록 허용 하는 동안 6WPs에서 함께 혼잡 했다. 어떻게이 수 있습니다. 차동 영향을 EBs와 나중에 organoids (를 포함 하 여 신호 화합물의 본질적인 생산)의 물리적, 화학적 환경 알, 그리고 탐험 될 수 있습니다. 또한, 우리의 식을 표시 하는 동안 유전자 연관-그래서의 암시-형태학 상으로 비슷한 구조 내에 있는 소 뇌 근원 보고 Muguruma 그 외 여러분, 우리 제외할 수 없습니다 같은 신경의 구조는 소 뇌 비 정체성의 있습니다. 미래 연구, Muguruma 그 외 여러분 보고 그 같은 항 체의 대형 패널을 사용 하 여 (즉, ATOH1, CALB, 등) 같은 할당 및 비교 더 결정적인 두 프로토콜의 제품을 만들 것입니다.
3D 프로토콜 내에서 중요 한 시작 이며 셀 문화 분석에 대 한 최종 제품의 충분 한 숫자를 보장 하기에 충분 한 수를 유지 합니다. EBs/잘 문화 (그림 1)에서 첫 3 일 동안 500 이상 부터는 감안할 때 상당한 죽는 일찍 프로토콜, 좋습니다. 이 hPSCs 지류 무료 문화에 대 한 주어진된 식민지 크기를 달성 하기 어려울 수 없습니다 하지만 여전히 급지대 종속 방법을 사용 하 여 그에 대 한 쉽지 않을 수도 있습니다. 셀의 많은 수를 감안할 때, 매체 (pH 변화를 나타내는), 그리고 죽은 세포의 축적에서 색상 변경에 대 한 감시에 중요 하다. 두 문화권의 붕괴를 방지 하기 위해 수정 해야 합니다. 도 있을 수 있습니다 셀 및 집계의 응집으로 대규모 구조. 비록 아직도 분석 될 수 있다 집계 될 수도, 제품 수량 줄어들 것입니다 크게, 그래서 부드러운 분쇄와 작은 집계에 그들을 깨는 유용할 수 있습니다. 그러나, 방해 일반 집계를 피하기는 스스로 성장할 수 있는 큰 크기 (그림 4). 집계 될 경우 너무 스파스, 집계는 완전히 격리 된 있도록 웰 스를 결합 하는 것이 좋습니다. 제품 다양성 (숫자, 크기 및 형태)은 3 차원 세포 배양, 덜 복잡 한 시작 프로시저 (예: 여기에 설명 된 프로토콜 절연, 균일 한 EB 형성 단계, 제안 하는 시작 하는 이러한 프로토콜에 대 한 포함 한 잘 알려진 문제 ) 더 실용적인8,15수. 이 연구자 명심, 특히 분석, 중 필요가 뭔가 보고 프로토콜 제품 다른 3D 프로토콜8,,915에서 발견 된 일치를 생성. 크기와 형태에 따라, 그들은을 신경 근 엽의 범위 안에 대뇌 organoid Kelava 및 랭 커스터15, 회전 타원 체의 분류를 피팅 하는 가장 최근의 리뷰에 설명 된 대로. 특히 주목할 만한 3D 구조의 존재를 루멘, (하위) 심 실 영역와 마름모꼴-입술 기능 같은 신경 근 엽의 암시는 (그림 5 와 그림 6) 구분으로 다른 그룹8 , 15 , 16 , 17. 모든 실험에서 이상 생산 이후 putative VZ/SVZs와 소 뇌 관련 마커 (ZIC1, KIRREL2), 집계 그는 RL 같은 우리의 프로토콜을 사용 하 여 3D 차별화의 성공 결정을 위한 유용한 기준 추가 지원을 제공 하는 기능. 과거 35 일 문화의 길이 연장 하지 테스트, 하지만, 복잡성, 성장과 성숙이이 기술에 의해 허용의 최대 범위를 결정 하 추진 수 있습니다.
2D 프로토콜 3D 프로토콜로 같은 비 부착 EB 형성 및 신경 유도 과정을 사용 하 고 그래서 위의 코멘트에도 적용. 도금, 일단 고려의 다른 세트는 고려 되어야 한다. EBs는 접시에 바깥쪽에 셀에 대 한 신속 하 게 준수 해야 합니다. 준수, RI (해당 되는 경우 이미 사용)의 추가 문제가 매체의 볼륨 감소 또는 PLO/램 농도 실험 변경 적용 될 수 있습니다 경우. 세포 성장에서 너무 조밀한 또는 스파스 (20-80 %confluency 사이 성장 선호)로 유지 하는 것이 중요 하다 우물; 일일 모니터링 및 적시 뿌리고 오버-confluency 또는 부동 셀을 피하기 위해 중요 하다. 3D 프로토콜 달리 거기 해서는 안됩니다 상당한 죽는 문화 중의 가난한 성장, 지역 또는 확산 속도 둔화 될 수 있습니다. 뿌리고 (예: 셀 프로세스와 셀 사이의 개발된 네트워크 제거) 세포의 성숙 상태에 영향을 하 고 포인트 셀을 수집 것 이다 또는 어떤 방식으로 분석 접근 하는 때 염두에 보관 해야 합니다. 예를 들어 칼슘에 대 한 그것을 이미징 분석 2-6 일전 사이 통로 세포에 매우 중요 하다. 너무 가까이 뿌리고 분석 셀에 연결 하는 시간이 없 또는 성숙, 그리고 너무 멀리 셀과 밀, 이미징 어렵게 될 수 있습니다 의미할 수 있습니다. 실험 사이 변이 있을 수 있지만 결과 그 초기 2D 소 뇌 프로토콜1,2보고와 일치. ICC 얼룩 및 유전자 표정 분석 또한 식별 하는 표식 (그림 7 , 그림 8) 다른 신경 및 소 뇌 id와 관련 된과 립 세포 마커 ZIC1에 대 한 긍정적인 세포의 존재를 확증. 칼슘 이미징, 세포 fluor5 염료와 incubated의 전기 자극을 포함, 기능 신경 활동 (그림 9, 보충 그림 1, 그림 2 보충), 표시는 확인 되지 않고 있지만 이러한 과 립 세포를 했다. 그것은 arguable 함으로써 세포 더 많은 시간 과거 35 일 문화의 길이 확장 하 여 성숙, 기능 신경 활동의 양을 증가 한다. 이 잠재적인 나중에 탐험 수 있습니다.
위에 제안 하는 연구의 라인 이외 것 제품 id (수량 및 품질) 차이 결정 하는 관심의 2D 및 3D 프로토콜 사이. 외부 FGFs의 중요성은 2D 프로토콜에서 테스트 하지 및 알고 도움이 될 것 이라고 후 도금, 3 차원 구조의 부족 그리고 그래서 관련된 신호 경로 만들 것 이다 2D 문화 다소 일찍 화합물을 패턴화에 의존. 축소 된 기본 프로토콜 (예, RA, BDNF SAG)은 동등 하 게 그럴듯한 추가 조사에 대 한 됩니다. 마지막으로, 미래의 연구는 새로운 연구 및 도구를 더 나은 특성 (발전 효율의 평가)에서 유익할 수 있습니다 특정 인간 소 뇌 신경 하위.
마음에 주어진된 주의 둘 다 보고 프로토콜 소 뇌 차별점, 다른 목적에 적합 한 제품으로 사용 될 수 있습니다. 그들은 셀 라인 같은 차별점 또는 타겟된 신경 감 별 법의 다른 유형에 대 한 기본 모델의 생존 능력을 테스트, 파일럿 연구를 수행 연구원에 대 한 실질적인 출발점으로 봉사 할지도 모른다.
공개
저자는 공개 없다.
감사의 말
우리는 Gerbren 제이콥스와 Jurjen Broeke Prisca 리사 Gasparotto 생성 및 두 개의 제어 iPSC 라인의 특성을 보여주는 우리의 절차에 대 한 기여에 대 한 Leferink를 그들의 전문 기술 지원에 대 한 감사.
자료
| Name | Company | Catalog Number | Comments |
| DMEM/F12+Glutamax | Gibco | 31331-028 | glutamine fortified DMEM/F12 |
| Neurobasal medium | Gibco | 21103-049 | neural basic medium |
| N2 supplement | Gibco | 17502-048 | |
| B27 supplement | Gibco | 17504001 | |
| Insulin | Imgen | PT468-B | |
| L-glutamine | Gibco | 25030-024 | |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-035 | |
| beta-mercaptoethanol | Gibco | 21985-023 | |
| Poly-L-Ornithine | Sigma | P3655 | |
| Poly (2-hydroxyethyl methacrylate) | Sigma | P3932 | aka Poly-Hema |
| Laminin | Sigma | L2020 | |
| E8 medium and supplement | Gibco | A1517001 | hPSC medium and supplement |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Sodium Chloride | Sigma | S-5886 | |
| y-27632 (ROCK inhibitor) | SelleckChem | S1049-10mg | |
| DMSO | Sigma | D-2650 | |
| Geltrex | Gibco | A1413302 | hPSC-appropriate adherent coating (PAAC) |
| 0,5M EDTA | Gibco | 15575-020 | |
| 0.2 um filter | VWR | 28145-77 | |
| 1.5 mL Eppendorf tube | VWR | 525-0130 | |
| DMEM/F12 | Gibco | 21331-020 | |
| Ethanol | VWR | 83804360 | |
| Parafilm | Sigma | PM996 | wrap for culture plates |
| cryotubes | ThermoFisher | 368632 | |
| TrypLE | Gibco | 12563-029 | trypsin-based dissociation agent |
| Defined Trypsin Inhibitor (DTI) | Gibco | R-007-100 | |
| FGF-2 | Peprotech | 100-18B | |
| FGF-4 | R&D Systems | 100-31 | |
| FGF-8B | Peprotech | 100-25 | |
| Retinoic Acid | Sigma | R2625 | |
| Brain Derived Neurotrophic Factor | Peprotech | 450-02 | |
| Glial Derived Neurotrophic Factor | Peprotech | 450-10 | |
| Potassium Chloride | Sigma | P5405 | |
| Neurotrophic Factor 3 | Peprotech | 450-03 | |
| Smoothened Agonist (SAG) | Cayman | 11914 | CAS 912545-86-9 |
| Axiovert 40C microscope | Zeiss | Brightfield imaging microscope | |
| Axiocam | Zeiss | Brightfield imaging - image aquisition | |
| Eppendorf Centrifuge 5810 | Eppendorf | 521-0996 | centrifuge for cell culture |
| PBS (gebufferde natrium oplossing) | Braun Medical | 3623140 | |
| 5 ml Serological pipets | VWR | 612-4950 | |
| 10 ml Serological pipets | VWR | 612-4951 | |
| 6-wells culture plates | VWR | 734-2323 | |
| 12-wells culture plates | VWR | 734-2324 | |
| hESCs | WiCELL | line H01 |
참고문헌
- Erceg, S., et al. Efficient differentiation of human embryonic stem cells into functional cerebellar-like cells. Stem Cells Dev. 19, 1745-1756 (2010).
- Erceg, S., Lukovic, D., Moreno-Manzano, V., Stojkovic, M., Bhattacharya, S. S. Derivation of cerebellar neurons from human pluripotent stem cells. Curr Protoc Stem Cell Biol. , (2012).
- Su, H. L., Muguruma, K., Matsuo-Takasaki, M., Kengaku, M., Watanabe, K., Sasai, Y. Generation of cerebellar neuron precursors from embryonic stem cells. Dev Biol. 290, 287-296 (2006).
- Salero, E., Hatten, M. E. Differentiation of ES cells into cerebellar neurons. Proc Natl Acad Sci U S A. 104, 2997-3002 (2007).
- Joyner, A. L. Engrailed, Wnt and Pax genes regulate midbrain--hindbrain development. Trends Genet. 12, 15-20 (1996).
- Joyner, A. L., Liu, A., Millet, S. Otx2, Gbx2 and Fgf8 interact to position and maintain a mid-hindbrain organizer. Curr Opin Cell Biol. 12, 736-741 (2000).
- Tam, E. W. Y., Benders, M. J. N. L., Heine, V. M. Cerebellar Development-The Impact of Preterm Birth and Comorbidities. Fetal and Neonatal Physiology. , (2017).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Rep. 10, 537-550 (2015).
- Pasca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12, 671-678 (2015).
- Holmes, D. B., Heine, V. M. Simplified 3D protocol capable of generating early cortical neuroepithelium. Biology Open. 6, 402-406 (2017).
- Chen, J. K., Taipale, J., Cooper, M. K., Beachy, P. A. Inhibition of Hedgehog signaling by direct binding of cyclopamine to Smoothened. Genes Dev. 16, 2743-2748 (2002).
- Chen, J. K., Taipale, J., Young, K. E., Maiti, T., Beachy, P. A. Small molecule modulation of Smoothened activity. Proc Natl Acad Sci U S A. 99, 14071-14076 (2002).
- Dahmane, N., Ruiz-i-Altaba, A. Sonic hedgehog regulates the growth and patterning of the cerebellum. Development. 126, 3089-3100 (1999).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129, 1435-1442 (2002).
- Kelava, I., Lancaster, M. A. Stem Cell Models of Human Brain Development. Cell Stem Cell. 18, 736-748 (2016).
- Kadoshima, T., et al. Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell-derived neocortex. Proc Natl Acad Sci U S A. 110, 20284-20289 (2013).
- Englund, C., et al. Pax6, Tbr2, and Tbr1 are expressed sequentially by radial glia, intermediate progenitor cells, and postmitotic neurons in developing neocortex. J Neurosci. 25, 247-251 (2005).
- Warlich, E., et al. Lentiviral vector design and imaging approaches to visualize the early stages of cellular reprogramming. Mol Ther. 19, 782-789 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유