Method Article
고해상도 볼륨 이미징의 뉴런 형광의 사용 제외 방법에 의해 및 미세 장치 전용
요약
볼륨은 세포의 생리 및 병리학 적 특성에 관한 중요 한 매개 변수입니다. Neurites 및 신경 성장에 동적 구조 분석에 필요한 하위 미세 축 분해능으로 생체 외에서 신경 볼륨의 전체 필드 측정을 허용 하는 형광 제외 방법을 설명 합니다.
초록
볼륨은 다른 시간의 척도에 신경 세포의 생리 및 병리학 특성에 관한 중요 한 매개 변수입니다. 신경은 그들의 확장된 없는 형태학에 관한 매우 독특한 셀 고 따라서 볼륨 측정에 대 한 여러 방법론 도전을 모집. 신경 성장 체 외에서 의 특별 한 경우 선택한 방법론 하위 미세 축 해상도 전체 필드 관찰 시간 또는 일 분에서 시간의 척도에 함께 포함 되어야 합니다. 셀 모양 재건 confocal 영상, 전기 기반 측정 또는 원자 힘 현미경을 사용 하 여 같은 다른 방법과 달리 최근에 개발 된 형광 제외 방법 (FXm) 이러한 과제를 수행 하기 위해 잠재력이 있다. 그러나, 그것의 원리에서 간단한 되 고, 있지만 신경에 대 한 고해상도 FXm 구현의 여러 조정 및 전용된 방법론 필요 합니다. 선물이 여기 형광 제외, 낮은 거칠기 다중 구획 미세 장치, 그리고 마지막으로 로컬 신경 볼륨의 생체 외에서 측정을 달성 하기 위해 micropatterning의 조합에 따라 하는 방법. 장치에서 제공 하는 높은 해상도 사용 하 여 신경 프로세스 (neurites)의 로컬 볼륨 및 볼륨 성장 콘 (Gc) 같은 신경 성장에 관련 된 몇 가지 특정 구조의 측정 수 있었습니다.
서문
세포질 볼륨의 정확한 지식은 셀 크기 항상성 단 세포 미생물 1 그리고 더 일반적으로 mitotic 세포 2의 문제에 의해 구동 지난 몇 년 동안에서 증가 주목을 받고 있다. 그러나, 셀 볼륨의 질문은 또한 포스트 mitotic 세포는 뉴런 전형적인 예제 구성에 대 한 관련.
볼륨은 참으로 다양 한 스케일과 시간 지점에서 생리 및 병리학 사건의 중요 한 서명 전기 활동 (밀리초 단위) 3 에 돌이킬 수 없는 관련 된 과도 axonal 변형에서 신경 삶에 신경 붓기가 발생 하는 신경 퇴행 성 질병 (인간에서 년간) 4의 무 증상 단계. 그러나, 가장 큰 볼륨의 변화 신경 성장 동안 (고려 유기 체)에 따라 주 또는 일의 중간 시간 규모에서 발생합니다. 뉴런의 확장 하 고 복잡 한 형태는 배수 문제를 제기 셀 크기의 규칙. Axonal 길이 직경 실제로 단단히 규제 vivo에서, 각 신경 유형 5,6값 특정 있습니다.
이러한 문제 vivo에서, 해결 하기 위해 복잡 한 또한 단순화 된 방법으로 해결할 수 있습니다 생체 외에서. 그 목표에 빨리 볼륨 측정 전용 메서드 충분히 성장 역학 (즉 분의 시간 규모에서) 및 호환 관찰 시간 또는 일이 필요 합니다. 여러 가지 방법은 세포 볼륨 시험관에 직접 또는 간접적으로 액세스할 수 년 동안 개발 되었습니다. Confocal 영상에서 셀 재건, 그들 중 하나 이지만이 방법은 약 500 nm 7의 제한 된 축 해상도 표시 하는 동안 빛에 라벨 부착 및 반복 노출 의미. Note 격자 빛 시트 현미경 8라는 더 정교 하 고 최근 방법으로 부분적으로이 두 마지막 단점을 극복할 수 있다는. 원자 힘 현미경 검사 법 사용된 9 되었지만이 검색 방법은 느리고 지루한 본질에 의해. 또한, 육체적 인 접촉을 셀 필요 고려 신경 10의 극단적인 부드러움 측정 방해할 수 있습니다. 다른 세포 유형 11, 하지만 대 한 부적 절 한 확장 뉴런 처럼 접착제 셀 임피던스 또는 공명을 사용 하 여 간접 방법 고용 있다.
가장 유망한 방법 중 하나는 형광 염료로 가득 가까운 챔버에 세포의 제외 된 볼륨의 측정을 기반으로 합니다. 형광 제외 방법 (FXm) 라벨, 필요로 그것의 원리에서 간단 하 고 빠르고, 긴 기간 세포 인구 잠재적으로 하위 광학 축 해상도 광학 이미징 적합 하다. 더 정확 하 게, z에서 해상도 있지만이 궁극적인 해결책을 제한 하는 잡음의 여러 소스 (즉, 세포가 없는 지역에서), 카메라의 동적 범위를 나눈 문화 챔버에 최대 형광 강도에 따라 다릅니다. 이 방법은 매우 강력한 마이그레이션 부착 셀 12 의 볼륨에 따라 또는 철저 하 게 13에 설명 된 대로 포유류 세포의 유사 분열 동안 볼륨 변화 연구 되었습니다. 그러나, 뉴런 FXm 하위 미세 프로세스에 광범위 한 그들의 분파를 고려에 대 한 방법론 문제를 구성 합니다.
선물이 여기 신경 가지와 동적 구조 성장 콘 같은 신경 성장에 관여의 높이와 고정밀 볼륨 액세스를 부드러운 FXm 챔버의 제조를 선도 하는 방법.
실 축 해상도 최적화 하기 위해 측정 하는 개체 보다 비슷한 높이 있어야 합니다. 따라서, 우리는 세 가지 서로 다른 높이의 중앙 측정 챔버 특징 다른 FXm 장치 설계. Neurite 측정에 전념 하는 가장 얇은 (3 µ m 높이):이 낮은 높이 제외 소마는 근처 15 µ m 높은 중간 챔버에 남아. 두꺼운 중앙 챔버 (10과 12 µ m) 전체 세포 성장에 따라 충분히 높다. 장치는 또한 중앙 챔버의 양쪽에 위치한 두 개의 저수지를 포함 한다. 4 개의 주입 구멍 (IH)은 이렇게 구현 하 고 다음과 같이 지정 된다: 입구와 출구 역할 칩, 휴대폰 정지를 반면 다른 두 저수지를 피드.
우리는 알려진된 기하학의 포토 레지스트 구조를 사용 하 여 높이 측정에 대 한 첫 번째 조립된 교정 coverslips가 있다. 우리는 다음 몇 군데 무료 성장 신경, 하지만 또한 형태학 상으로 제한 된 뉴런 접착의 micropatterns에.
프로토콜
연구 관리 및 실험 동물의 사용에 유럽 공동체 지침에 따라 실시 되었다: 86/609/EEC. 연구 목적 및 프로토콜 윤리적인 별관의 ERCadg 프로젝트 승인 하 고는 ERCEA에 의해 정기적으로 검토, 첼로에 설명 되어 있습니다. 동물 시설 받은 인 퀴리 라이센스 #C75-05-18, 24/04/2012 년, 위원회 회의 d'Ethique en matière d를 보고 ' expérimentation animale 파리 센터 외 수 드 (국가 등록 번호: #59).
1입니다. 금형의 제작
참고: 금형 중앙 및 중간 챔버에 연결 입구와 출구, 플러스 두 저수지 (후미) 중앙 챔버의 양쪽에 있는 포함 되어 있습니다.
- 평평한 핀셋을 사용 하 여 51 m m 직경 실리콘 웨이퍼를 조작 하 고 다른 한 장소에서 그들을 전송.
- 중앙 약 실 실리콘 몰드
- 2 mL 플라스틱 피 펫을 긍정적인 감광 채우십시오. 피펫으로 51 m m 직경의 실리콘 웨이퍼의 중심에 위치 하 고 취재는 포토 레지스트와 웨이퍼 표면의 약 75%까지 그것의 저수지에 누릅니다. 30에 대 한 3000 rpm 스핀 코트 s.
- Spin coater에서 열판, 50, 100 ° C의 표면 온도와 웨이퍼를 전송 s.
- 마스크 aligner의 기판 홀더 (척)에 열판에서 웨이퍼를 전송할. "DRIE 마스크"를 통해 노출 (보조 파일 "masks_neuron_volume_chips.tiff" 및 "masks_neuron_volume_chips.dxf" 참조).
- 웨이퍼는 척에서 다음 100 mL 유리 crystallizing 개발자 (이온을 제거 된 물에 희석 1:4)를 포함 하는 접시에에서 다이빙. 웨이퍼를 놓고 지속적으로 하 고 부드럽게 감동 crystallizing 요리 하는 동안 1 분 동안 그것을 유지.
참고: 시 약 하기에 최대 높이에 1 cm crystallizing 접시 작성. - 개발자에서 웨이퍼를 철회 하 고 약 10 s.Then 장소는 흡수 성 종이에 웨이퍼에 대 한 이온을 제거 된 물으로 채워진 100 mL crystallizing 그릇에 잠수함 가압 질소 공기 타격 총을 사용 하 여 그것을 건조.
- 50 대 한 웨이퍼 배치 115 ° C의 표면 온도와 열판에 s
- 다음 매개 변수 (DRIE 기법에 대 한 자세한 정보는 참조 14 와 15에서 찾을 수 있습니다); 깊은 반응성 이온 에칭 (DRIE) 수행 패 시 베이 션 단계: 50 sccm C4F8, 그 지지의 흐름 10 sccm, CP 10 승, 유도 결합 플라즈마 (ICP) 1500 W, 총 24 mbar, 온도 18 ° C; 에칭 단계: SF6, 백업 그의 100 sccm 흐름 10 sccm, CP 11 승, ICP 1500 W, 총 24 mbar, 온도 18 ° C; 보호막 처리 시간: 4 s; 에칭 시간: 7 s; 총 과정 기간: 일반적으로 5 분 약 10 µ m에 대 한 에칭 깊이.
- 감광 기판으로 다이빙 crystallizing 접시 가득 아세톤으로 분해.
- 피 라 솔루션에서 웨이퍼를 잠수함 (H2O2 (30%)의 2/3과 1/3 H2의 등4 (95 %)) 5 분.
주의: 항상 먼저 H2O2 를 추가 하 고 H24 와 린스 적어도 3 시간에서 그래서 저온 청소 후.
- 1.2.1 1.2.11 테이블 1-3에 나열 된 매개 변수를 다음 단계를 수행 하 여 중간 챔버에 해당 하는 금형을 조작.
참고: 각 테이블 중앙 관찰 챔버의 특정 높이 특징 주어진된 장치에 해당 합니다.
참고: 증가 감광도 (각 장치에 대 한 3 마스크 1 참조 보조 파일 "masks_neuron_volume_chips.tiff" 및 "masks_neuron_volume_chips.dxf")를 사용 하 여 전체 프로세스를 수행 합니다.- Spin coater 기판 홀더에 에칭된 실리콘 웨이퍼를 놓습니다.
- Spin coater 기판의 열망은 효과적인 (기판 회전 한다 명목상 회전 속도 동안 장소에 머물) 확인 하 여 제대로 작동 하는지 확인 하십시오.
- 수-8의 점도 대상된 두께 범위의 높이 함께 증가합니다. 항상 20-30 mL 병을 사용 하 여 저장할 수-8 감광을 스핀 코팅 전에 웨이퍼에 붓는 다 (수-8 너무 플라스틱 피 펫으로 조작할 수 점성 수 있습니다).
- 실리콘 웨이퍼의 약 75%를 덮고까지 부정적인 에폭시 형 감광 기판의 중심에 수-8를 붓고 스핀 코트 매개 변수를 사용 하 여 "Spincoating" 테이블의 행에 표시 합니다.
- 장소 기간 및 온도 대 한 열판에 코팅 된 웨이퍼 행 "부드러운 빵"에 표시 된.
- 마스크 aligner에 에칭된 웨이퍼와 적절 한 "수-8 마스크"를 탑재.
- 전용된 맞춤 십자가 사용 하 여 마스크 에칭된 웨이퍼 정렬 (이러한 십자가의 전형적인 크기: 50 µ m × 150 µ m) 각 마스크에 설계 되었습니다.
참고: 장치의 각 측면에 두 개의 십자가 충분 한 (하단 왼쪽에 하나)를 오른쪽 상단에 하나. - 노출 행 "노출 에너지"에 표시 된 대로 적절 한 UV 복용량 내가-라인 마스크 aligner (파장 365 nm)를 사용 하 여.
참고: 노출에 UV 램프의 효과적인 힘에 의해 각 포토 레지스트에 대 한 노출 에너지 E 특정 나누어 계산, 마스크의 흡수에 의해 변조: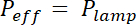 x (1- 흡수마스크). 흡수는 약 20% 유연한 마스크와 크롬 하드 마스크에 대 한 무시할 수 있습니다.
x (1- 흡수마스크). 흡수는 약 20% 유연한 마스크와 크롬 하드 마스크에 대 한 무시할 수 있습니다. - 기간 및 온도 행 "게시물 빵"에 대 한 열판에 코팅 된 웨이퍼를 놓습니다.
- 2 100 mL 유리 crystallizing 요리, 개발자, 다른 빈을 포함 한 준비. 다이빙 하는 동안 개발자에 웨이퍼 행 "개발"에 표시 된. 부드럽게 개발 따라 crystallizing 접시 선동
- 약 5 빈 crystallizing 접시 위에 소 프로 파 놀과 웨이퍼를 뿌려 s. 마지막으로, 웨이퍼는 흡수 성 종이에 놓고 가압 질소 공기 타격 총을 사용 하 여 그것을 건조 합니다.
- 기간 및 온도 대 한 열판에 코팅 된 웨이퍼 행 "하드 빵"에 표시 된 장소 (선택 사항).
참고:이 단계는 감광 제에 균열을 방지 하 고 다음 단계에 대 한 균질 평평한 표면 제공에 유용 합니다. - 표 1-3에 나열 된 프로세스를 완료 하려면 1.3.10 1.3.1-단계를 반복 합니다.
- 포토 리소 그래피의 마지막 단계 후 silanize 최종 마스터 구성 된 금형 2을 파견 하 여 부정적인 감광의 3 층의 100 mm 페 트리 접시에 마스터의 각 측에 Trichloro(1H,1H,2H,2H-perfluoro-octyl) silane의 100 µ L 방울. 페 트리 디스크 파라핀 플라스틱 필름으로 밀봉 하 고 상 온 (RT)에서 20 분을 품 어.
참고: 마스터 금형 준비 이며 여러 번 사용할 수 있습니다.
- Spin coater 기판 홀더에 에칭된 실리콘 웨이퍼를 놓습니다.
2입니다. PDMS 칩의 제조
- 실리콘 기반 유기 폴리머의 90 g을 부 어 (입니다: PDMS) 100 mL 플라스틱 컵에. 경화제 (무게에서 1:10) 10 g를 추가 합니다. 플라스틱 피 펫을 사용 하 여 2-3 분을 위한 혼합물을 저 어.
참고: PDMS의 90 g 10 g 6 칩의 제조에 대 한 경화제의 혼합. - 기포를 제거 하는 진공 desiccator와 약 30 분 동안 펌프 내에서 섞어 배치는 PDMS에 갇혀.
- P100 페 트리 접시에 마스터 몰드를 놓고 혼합물의 15 mL 주사기를 사용 하 여 몰드에 부 어.
참고: 15 mL 전체 칩 높이 1.5 m m의 이끌어 낸다. - 아니 더 많은 기포는 PDMS의 표면에 파열 될 때까지 펌프를 진공 desiccator 내 PDMS 몰드 구조를 놓습니다.
참고:이 단계는 약 30 분 걸립니다. - 웨이퍼는 웨이퍼 아래 죽은 PDMS 볼륨을 피하기 위해 콘 팁을 사용 하 여 배양 접시의 하단에 눌러. 적어도 2 시간을 위한 70 ° C에서 오븐에서 PDMS 몰드 장치를 놓습니다.
- 스테인리스 플랫 주걱을 사용 하 여 화학 후드와 칩에 따르는 소 프로 파 놀 PDMS 블록 demold 후드의 스테인리스 벤치에 놓습니다.
- 실리콘 웨이퍼 주위 잘라내어 PDMS 복제 메스를 사용 하 여 demold.
- (휴가 2 m m 여백) 주위 메스 또는 면도칼 블레이드를 사용 하 여 칩을 잘라.
- 1.5 m m 직경 구멍을 뚫는 단단히 눌러 후미를 펀치 하 고 그것 삭감 하 고 입구의 구멍을 개척 작용. 액체 주입 되는 칩의 4 개의 전용된 지역에 같은 마십시오.
- 고집과 microstructured 측면에 접착 테이프를 박 리 하 여 칩을 청소. 양쪽에 소 프로 파 놀을 뿌린 다. 다음에 공기 타격 총을 사용 하 여 가압 질소 칩 건조.
3. 꽃무늬 coverslips (24 × 24 m m2) 제조
참고: 곡선된 핀셋으로 coverslips를 조작 합니다.
- 폴 리-ornithine (PLO) 패턴
- 유리 coverslips에 플라즈마를 청소 하는 O2 를 적용 합니다. 플라즈마 매개 변수: 압력 아래로 양수: 0.25 mbar; O2 공급 기간: 3 분; 가스 흐름: 10 sccm; 최대 편차: ± 5 sccm; 플라즈마 지속 시간: 3 분; 압력 설정: 0.36 mbar; 최대 편차: ±0.10 mbar; 전원 설정: 50 W; 최대 편차: 5%; 빠져나가 고 기간: 45 s.
- 초 산의 혼합 484 µ L 3-methacryloxypropyl-trimethoxysilane의 56 µ L 15 mL의 총 볼륨을 절대 에탄올 완료.
- 각 coverslip에이 솔루션의 500 µ L의 방울을 넣어 1 mL 팁 콘을 사용 하 여, 2-3 분 클린 마이크로 파이버와이 퍼를 사용 하 여 건조를 기다려.
참고: Silanized 유리 coverslips 저장할 수 있습니다 파라핀 플라스틱 필름으로 밀봉 된 플라스틱 상자 내에서 실 온에서 1 달. - 클린 룸 환경에 위치한 스핀 coater에 각 coverslip를 놓습니다. 긍정적인 감광 coverslip (약 500 µ L)와 30에 대 한 4000 rpm 스핀 코트의 약 75%를 덮고의 방울 넣어 0.45 μ m의 최종 두께 도달 하는 s.
- 1 분 동안 coverslips 115 ° C의 표면 온도와 열판에 배치
- 435의 파장에서 각 coverslip 노출 마스크 동기 기를 사용 하 여 fabricant 매개 변수에 따라 전용된 마스크를 통해 (G 선) nm (UV 복용량에 대 한 50-60 mJ.cm-1)
- 개발자 (희석), 이온된 수에 포함 된 다른 항목을 포함 한 2 유리 crystallizing 요리를 준비 합니다.
- 지속적으로 하 고 부드럽게 crystallizing 접시를 교 반 하면서 하나 하나에 1 분 동안 개발자 각 coverslip 잠수. 흡수 성 종이에 약 5 미 장소는 웨이퍼에 이온된 수에 웨이퍼를 잠수함 그리고 가압 질소 공기 타격 총을 사용 하 여 그것을 건조 합니다.
- 활성화 O2 플라즈마 3.1.1 같이 동일한 매개 변수를 적용 합니다.
- 후드, 증언 4 170 µ L P100 페 트리 접시 당 100 µ g/mL PLO 솔루션의 상품. 각 이러한 상품에는 coverslips의 패턴된 얼굴을 넣어. 건조를 피하기 위해 플라스틱 파라핀 영화와 페 트리 접시를 봉인. 실시간에서 밤새 품 어
참고: PLO 솔루션 주입구 여는 coverslips에 연결 된 유지 되어야 합니다. - 4 받는 사람 (일반적으로 P60 접시) 준비, PBS 그리고 이온된 수 4 한 그들 중의 3을 채우기. 순수 에탄올의 두 유리 crystallizing 요리를 준비 합니다.
- 배양 접시에서 각 coverslip 밖으로, 10-15에 대 한 첫 번째 PBS 목욕에서 잠수함, 피난은 액체 흡수 조직 측면에 세로로 coverslip 여, 에탄올 탕 내부 패턴된 얼굴 등 으로 삽입.
참고:는 감광 해산 완료 되 면 어려워진 다는 coverslip의 무늬 쪽을 찾을. 따라서, 그것의 위치를 추적 하는이 단계에서 중요 하다. - 장소는 초음파 목욕 sonicator 내 접시 crystallizing 에탄올 (120 W / 35 kHz) 감광 제 3 분 해산 하 고.
참고: 모든 4 coverslips는 감광의 해산을 손상 시킬 수 있는 PBS에 의해 희석을 제한 하려면 에탄올 목욕을 변경 합니다. - 다음 두 번째 PBS 목욕에 그것에 뛰어들어 여러 번 에탄올 목욕에서 coverslip 밖으로 가져가 라. 에탄올의 나머지 액체 필름에서 결과 사라집니다 기름기 같은 표면까지 표면 부분을 반복적으로 확인 합니다.
- 잠수함 5-10 s는 coverslip 세 번째 PBS 목욕으로. 다음 즉시 이온된 물 목욕에 그것을 전송. 흡수 성 종이에 coverslip 놓고 가압 질소 공기 타격 총을 사용 하 여 그것을 건조 합니다.
참고: 이온된 수에 마지막 린스 건조 단계에서 PBS 결정의 형성을 피하기 위해 사용 됩니다.
- 포토 레지스트 구조 높이 보정에 대 한
- 3.1.4 단계만 수행 합니다. 3.1.8 하. 전용된 마스크 (마스크 "감광 줄무늬", 참조 보조 파일 "Mask_Photoresist stripes.dxf")를 사용 하 여.
4. 칩 조립 및 최종 구현
- 유리 하단 요리에 조립 칩
- 표면 활성화를 위한 플라즈마 챔버에 넣고 PDMS 칩과 유리 접시에 그것은 접착 될 것입니다. 매개 변수: 펌핑 압력 아래: 0.25 mbar; O2 공급 기간: 3 분; 가스 흐름: 10 sccm; 최대 편차: ± 5 sccm; 플라즈마 지속 시간: 30 s; 압력 설정: 0.40 mbar; 최대 편차: ±0.10 mbar; 전원 설정: 50 W; 최대 편차: 5%; 빠져나가 고 기간: 45 s.
- 부드럽게 유리 coverslip 접촉 활성화 된 PDMS 칩을 넣어 하 고 섬세 하 게 본드는 coverslip로 칩 칩의 가장자리에 압력을 적용 합니다. 접합 강도 높이려면 5 ~ 10 분 동안 70 ° C에서 오븐에 장치를 놓습니다.
참고: 기둥을 포함 하는 부품에 누르지 마십시오, 그들은 너무 많은 압력 하에서 붕괴 수도 있습니다. - (즉 RT에서) 후드 접합 후 30 분 이내에 IHs, 100 µ g/mL PLO 솔루션으로 가득 10 µ L 팁 콘 장소 그리고 액체를 주입. 각 IHs의 상단에 한 방울을 형성 하기 위하여 볼륨을 조정 합니다. 그런 다음, 칩 주위의 모든 페 트리 접시에 PBS 추가 1 mL 팁 콘을 사용 하 여.
- 2 시간 보육 시간의 최소 RT에서 칩 하자. 야간 보육에 대 한 플라스틱 파라핀 필름을 사용 하 여 건조 하지 않도록 하는 페 트리 접시를 봉인.
참고: 액체는 칩을 무시 해야 합니다 그렇지 않으면 칩 외부 누출 되지 해야 합니다. - 10 µ L 팁 콘 가볍게 각 IH에 누르고 초과 액체를 빨 아. 다음 완전히 콘센트 내부 팁 콘 스틱 하 고 남은 액체를 그립니다.
- 4.1.5 (비우는) 및 4.1.3 (충전) 단계에서 주어진 지침 laminin 다음으로 PLO를 교체 합니다. 1 시간에 대 한 RT에서 품 어.
- 4.1.5 (비우는) 및 4.1.3 (충전) 단계에서 주어진 지침 문화 매체 다음 laminin를 교체 합니다. 문화 매체의 구성: MEM 81.8%; 나트륨 Pyruvate 100 m m 1%; Glutamax 200 m m 1%; 말 혈 청 5%; B27 보충 2%, N2 보충 1%, Gentamicin 0.2%; 220 nm 필터를 사용 하 여 솔루션을 필터링 합니다. 1 mL 팁 콘을 사용 하 여, 또한이 매체는 칩을 둘러싼 PBS 교체 합니다.
- 적어도 5 h (또는 숙박) 신경 전에 시드 37 ° C, 5% CO2 에서 규제 하는 인큐베이터에 칩을 넣어.
- Coverslips 꽃무늬 칩 사용 하 여 조립
참고: 패턴화 coverslips 긍정적인 감광 참조 개체 포함, 단계 4.2.1 4.2.9 수행 합니다. 그렇지 않으면만 단계 4.2.3, 스틱 무늬 PLO coverslip에 PDMS 장치 4.1.2, 같이 넣어 내부 문화 매체를 수행 하 고 칩 주변 4.2.10 단계로 이동 합니다.- 사각형 두꺼운 현미경 유리 슬라이드에 한 방울의 물을 예금 하 고 주입구 (비 꽃무늬 면 유리 슬라이드)에 의해 유리 슬라이드에는 coverslip 스틱. 현미경, 펠트 펜을 사용 하 여 유리 슬라이드의 뒤쪽에 감광 줄무늬의 위치를 표시 합니다.
- 무늬 유리 coverslip을 마스크 aligner의 마스크 소유자에 놓습니다. 포토 레지스트 참조 개체 가운데에 펠트 펜으로 만든 마크에 의존 합니다.
- 4.1.1에서 PDMS 칩에 설명 된 대로 플라즈마 단계를 수행 합니다.
- PDMS 칩을 마스크 aligner의 모바일 기판 홀더 (척)에 놓습니다.
참고: 광섬유 대비 증가, PDMS 칩 아래 실리콘 웨이퍼를 놓습니다. 실리콘 웨이퍼 정렬 과정 (물림 쇠에 붙어 투명 테이프 사용)는 척에 단단히 붙어 있어야 합니다. - 물림 쇠는 coverslip에 있는 감광 줄무늬의 배열 가진 칩에 맞게 기계적 접촉의 한계에서 들어올립니다.
- 해제는 척까지는 PDMS의 표면 기둥 터치 유리 coverslip 마무리 하 여 칩과는 coverslip 사이의 기계적 접촉을 얻을 수 있습니다.
- 낮은 물림 쇠. 이제 마스크 홀더에서 칩에 접착 하는 coverslip을 제거 합니다. 다음 장치는 35 mm 페 트리 접시에 놓고 오븐에 모든 것을 전송 (온도: 70 ° C) 결합 강도 높이기 위해 5 ~ 10 분.
- 4.1.3 단계에서 수행 합니다.
참고: PLO를 사용 하 여 coverslips 패턴, 단계 단계 4.2.9 4.2.7에서 직접 이동 합니다. - 4.1.5 (비우는) 및 4.1.3 (작성) 단계에서 설명 하는 절차는 도금 중간 다음 PLO를 교체 합니다. 1 mL 팁 콘을 사용 하 여, 또한이 매체는 칩을 둘러싼 PBS 교체 합니다.
- 37 ° C, 5% CO2 에 5 h 보육 시간의 최소 신경 시드까지 규제 하는 인큐베이터에 칩을 넣어.
5. 신경 문화
- HBSS 10의 10 mL를 혼합 하 여 절 개 매체 (HH 매체) 100 mL를 준비 x, Hepes 1 M의 2 mL 및 88 mL 200 mL 플라스틱 플라스 크에 살 균 물의.
참고: HH 매체 문화 전날 준비 될 수 있습니다. - E18 생쥐 배아 자 궁 경부 전위 (찰스 강에서 C57BL/6J 쥐)에 의해 안락사 어머니 로부터 추출에서 해 마를 해 부. 해 부의 단계 예 16에 자세히 설명 되어 있습니다.
- 화학 분리를 시작 위하여 트립 신 (0.3 mL의 트립 신 2.5 %HH 매체의 2.7 mL를 EDTA 없이) 37 ° C에서 10 분을 포함 하는 플라스틱 튜브에 마를 배치 합니다.
- 거의 모든 액체를 무시 하 고 일회용 플라스틱 펫을 사용 하 여 HH의 5 ~ 10 mL와 함께 그것을 대체. 3 번 마십시오. 마지막 채우기 HH 대신 중간 도금의 1 mL 사용 하 여.
- 기계적으로 주목 하 고 꺼내기 전체 볼륨 여러 번, 거품을 만들고 더 이상 15-20 구절을 사용 하 여 피하 여 1 mL 팁 콘을 사용 하 여 조직 분리.
- 별도 500 µ L 받는 사람에서 세포 현 탁 액 45 µ L의 PBS에 희석의 5 µ L를 사용 하 여 솔루션을 준비 합니다. 10 µ L 피 펫을 사용 하 여이 솔루션의 1 µ L 고 Malassez 셀 카운터에 희석된 정지를 삽입. 17 에서 제공 하는 표시를 사용 하 여 셀의 수를 견적 하기 위하여.
참고: 단일 마 일반적으로 뉴런의 약 0.5 백만 제공 한다. - 실시간에서 6 분 x 100g에서 원심 분리기
- 삭제는 상쾌한 고 도금 매체 10 백만 셀/mL의 농도 달성 하는 데 필요한의 볼륨으로 바꿉니다. Resuspend 세포에 의해 연속적으로 갈망 하 고 1 mL 팁 콘 세포 현 탁 액을 추출.
- 세우는 칩에 도금 매체 (4.1.5 단계로 참조). 10 µ L 피 펫을 사용 하 여 갓 resuspended 솔루션의 2-3 µ L를 수집 하 고 입구에 주사 (4.1.3 단계에서 설명 하는 주입 절차 참조). 즉시 콘센트에서 동일한 작업을 반복 합니다.
- 각 저수지에 도금 매체의 동일한 볼륨에 대 한 주사 (4.1.3 단계로 참조).
참고: 빠르게 셀의 밀도 확인 하려면 현미경 칩을 관찰 합니다. 최적의 셀 밀도의 크기 순서에 대해 해당 4 기둥으로 구분 된 사각형 표면에서 5-10 셀 (0.3 m m2, 즉 에 대 한에 대 한 15-20 m m2당 세포). - 결국 반복 단계 5.10 0.5-1을 대신 사용 하 여 대상된 셀 밀도 도달 세포 현 탁 액의 µ L.
- 37 ° C 5% CO2규제 인큐베이터에 시드 칩을 놓습니다.
6. 형광 제외 관찰
- 영상 매체에 의해 문화 매체의 교체입니다.
- 4.1.7로 영상 매체를 준비 하지만 페 놀 레드 없는 대신 가상 메모리를 사용 하 고 형광 dextran을 추가 합니다. 그 목표에 희석 dextran (분자량 10000 g/mol, PBS에 10 mg/mL에서 집중 재고 솔루션) 0.5-1의 최종 농도 달성 하기 위해 mg/mL 영상 매체에.
참고: 사용 Dextran 496/524 또는 650/668 흡수/방출 맥시 마와 함께 변화. 0.45 (빨간 대역폭에 그들의 자동 형광의 제거)에 µ m 높은 긍정적인 감광 구조와 이미지 신경 (독성)이 두 번째 이미지를 먼저를 선호 합니다. - 10 µ L 피 펫을 사용 하 여 모든 후미를 다시 채워 그들 완전히 영상 매체 (4.1.3, 4.1.5 중간 교체의 정확한 방법론에 대 한 단계를 참조).
- 4.1.7로 영상 매체를 준비 하지만 페 놀 레드 없는 대신 가상 메모리를 사용 하 고 형광 dextran을 추가 합니다. 그 목표에 희석 dextran (분자량 10000 g/mol, PBS에 10 mg/mL에서 집중 재고 솔루션) 0.5-1의 최종 농도 달성 하기 위해 mg/mL 영상 매체에.
- 이미징
- 37 ° C에서 5% CO2의 규제 환경 챔버를 갖춘 epifluorescence 현미경 아래에 칩을 놓습니다. 40 X, 수 가늠 구멍 (NA) 0.8 건조를 사용 하 여 전체 전력의 목표, 30% (전체 전력: 3 승)와 노출 시간 30 밀리초. (에서 시간 경과 실험의 경우 여러 개의 연속적인 이미지를 단일) 초점에 셀의 이미지를 취득 합니다.
- 이미지 분석
- 균질 배경을 전용된 소프트웨어에 구현 된 배경 감소 루틴을 사용 하 여 이미지를 정상화. 13 이 소프트웨어에 포함 된 단계를 처리 하는 이미지의 세부 정보를 참조 하십시오. 출력 이미지를. 매트 형식입니다.
- 변환 합니다. 로 매트 파일입니다. 루틴을 사용 하 여 8 비트 이미지를 TIFF 보충 자료 (conversion_mattotiff.m, importfilevol.m에 대 한 호출)에 넣어.
- 가져오기를 수행 > 이미지 시퀀스에서 비디오를 만들려고 ImageJ에는. TIFF 이미지입니다.
- 기둥 (reference 개체) 평균 B의 강도와 셀 (배경, 즉 높이 0) 없는 챔버의 사각형 영역 중앙에 사각형 영역의 평균 강도 P를 계산 합니다. 18 이미지 처리의 상세한 방법론의 예를 참조 하십시오.
참고: 사각형 영역을 강도 참조 해야 사용의 측면 차원 기둥 가장자리에서 빛 공해를 피하고 있는 동안 충분 한 픽셀 수를 기둥 직경의 절반 정도. - P 및 B 값을 사용 하 여 높이 h에서 강도 나 선형 변환 법을 확립.
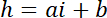
hc 는 챔버의 알려진된 높이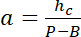 및
및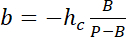
참고: PDMS 없음 감지 autofluorescence 표시 됩니다. - 관심의 영역 주위의 영역 선택, 강도 ImageJ를 사용 하 여 통합 ( 19 대 한 자세한 내용은 참조) 셀 구획의 볼륨을 측정 하기 위해 6.3.5에 변환 법 적용.
참고: 관심의 영역 수에 따라 선택 되어야 하위 세포 요소의 형광 같은 걸, 예를 들면,의 성장 선택에 대 한 콘 선택 GFP LifeAct 뉴런에 GFP 방출 채널이 컨투어 저장에 대 한 관심의 영역 영역 (빨간색)에서 dextran의 방출 채널의 같은 영역 내에서 투자 수익 관리자 도구를 다음 측정 셀 볼륨 포함을 사용 하 여.
결과
섹션 1과 2에에서 설명 된 제조 과정의 결과 그림 1A의 이미지에 의해 설명 된다-1B 및 그림 1C의 곡선. 그림 1D 의 PDMS 칩, 즉 중앙에서과 20 µ m 높은 다음 중간 챔버의 2 개의 다른 대표 지역의 거칠기 값을 표시합니다. 약 7 배 거칠기 감소 수-8 포토 레지스트 대신 에칭된 Si 웨이퍼를 사용 하 여 얻은 되었습니다. 다음, FXm 10 µ m 높은 챔버 내에서 알려진된 형상 (그림 2A)의 감광 스트라이프에 적용 처음 했다. 이미지 처리 및 강도 높이 변환 후 ( 그림 2B의 그래프 참조),이 스트라이프 (그림 2C) 따라 횡단면에 FXm 프로필 원하는 높이 프로필 (그림 2D) 제공. 그림 2D 기계 profilometry 및 FXm 메서드를 사용 하 여 얻은 프로필 간의 비교를 보여 줍니다. 가장자리와 고원 값을 포함 하 여 이러한 프로필은 매우 유사 하 고, 메서드를 유효성 검사. FXm 데이터의 분산 더 그림 3 및 그림 4, 평가 방법의 궁극적인 해상도의 대표는 하지만 결과 낮은 강도에서 매우 약한의 가능한 효과 피하기 위해 고용 자동-감광 GFP 채널에서의 형광.
그런 다음, 3 µ m에 10 µ m 높은 챔버 (그림 3) neurites를 관찰합니다. 배경 잡음의 표준 편차는 약 18 nm 강도 높이 변환 및 배경 개정 후. 이 값은 실제 실리콘 표면에 casted PDMS 표면 거칠기 보다 약간 더 높은 (12 nm, 그림 1D의 표 참조) 수 8 금형에서 얻은 PDMS에 측정 하는 거칠기 보다 훨씬 낮은 하지만. 이러한 결과 기둥을 쓰-8 포토 레지스트로 구멍을 열고 보다는 실리콘 웨이퍼에 우물을 시추의 부가 가치를 강조 표시 합니다. 이러한 낮은 값 그림 3A에 표시 된 것 같은 볼륨에서 높은 신호를 잡음 비율과 매우 명확한 이미지를 수 있습니다. 그러한 이미지에서 검색할 수 있는 데이터의 예를 들어, 우리는 1.6 µ m (즉, 10 픽셀) 넓은 neurite 볼륨 계산 슬라이스 ( 그림 3B의 그래프 참조). 약 400의 평균 neurite 높이 가치를 제공를 사용 하 여 첫 번째 근사에서 이러한 데이터의 선형 적합 nm, 비교 예 10 일 신체 callosum 5내의 오래 된 새끼 있는 500 nm axonal 직경. 우리 또한 함께 FXm 접착 직렬 abutted 2 µ m와 6 µ m 길이에서 30 µ m의 넓은 줄무늬의 구성의 micropatterns. 우리의 목표는 3D 모양에 neurite 폭의 영향을 연구 했다. 그림 3C 3D 표현 10 µ m 높은 상공에서 얻은 이미지를 전체 신경의 잘못 된 색상 표시 합니다. Soma는 큰 줄무늬의 말단에 위치 하 고 있습니다 반면 Neurites 2 µ m와 6 µ m 넓은 줄무늬에 퍼지고 있다. 높이 프로 파일은 세 가지 다른 횡단면에 당겨 졌다. 그림 3A에 표시 하는 그래프와 일관성, 표면 (그림 3D) neurite 폭 횡단면 증가 이상의 통합.
우리는 또한 성장 콘 (GC) 3D 구조에 집중 했다. 그림 4 A B 두 가지 GC 프로필 3 µ m 높은 상공에는 그들의 분기 하위 구조를 강조 표시 합니다. 또한, 우리는 12 µ m 높은 상공에서 Gc의 볼륨의 역학에 따라 시간 경과 실험을 수행. 그림 4C 축소의 주기 및 몇 분의 시간 규모에서 주어진된 GC의 재 활성화를 표시합니다. GFP lifeact 마우스를 사용 하 여, 덕분에 성장 콘 GFP 방출 파장에 현지 했다 (510 nm) 그들의 높은 걸 집중에서. 파장에서 식별 하는 표면 647에서 dextran 방출 파장에 통합 하는 데 사용 되었다 GC 볼륨을 계산 하는 nm. 그림 4D 마침내 약 6 µ m3의 값을 중심으로 3 개의 다른 뉴런에 다른 시간 지점 및 위치에서 GC 볼륨의 분포가 표시 됩니다.
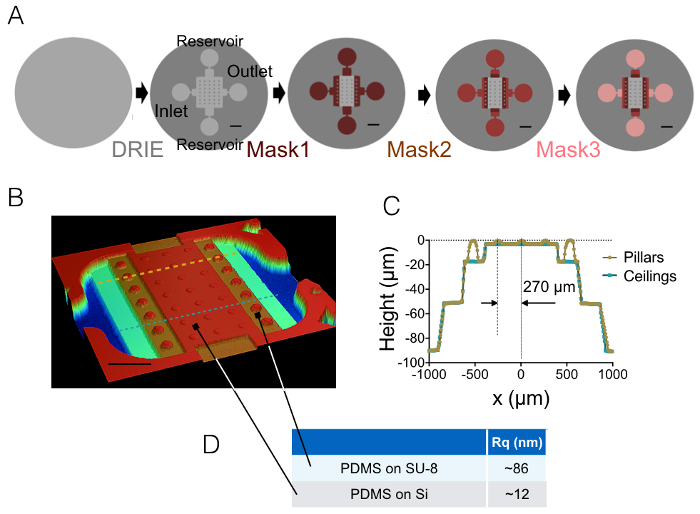
그림 1: FXm PDMS 챔버. (A)는 4 개의 다른 단계 최종 금형에 지도 제작의의 음모. 입구, 출구 및 저수지의 위치 표시 됩니다. 스케일 바: 1 mm. (B) 광 profilometer를 사용 하 여 얻은 PDMS FXm 챔버의 이미지. 이 이미지는 10 µ m 높은 기둥의 3 행과 20, 50, 90 µ m 높이 중간 챔버를 포함 하는 중앙 챔버를 보여줍니다. 눈금 막대: 500 µ m. (C) (B)에 그려진 두 개의 점선 따라 칩의 횡단면 뷰. 옐로우/골드: 기둥, 블루 따라 횡단면: 기둥 사이의 횡단면. (D) PDMS 거칠기의 값 측정 50 × 50 µ m2 지역에 실리콘 성형 20 µ m 높은 수-8 중간 챔버에 의미 (이 분야의 위치에 대 한 화살표 참조). 평균 값은 세 가지 영역 측정에서 얻은 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
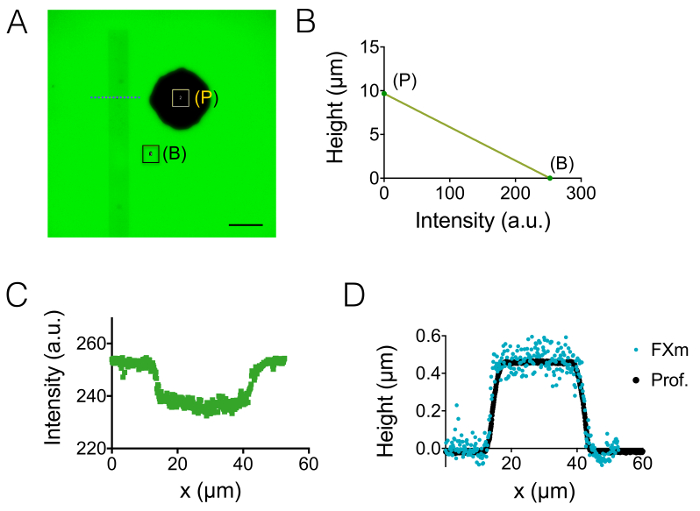
그림 2: 감광 제 스트라이프를 사용 하 여 관심의 대상으로 FXm 방법의 교정. (A)는 10 µ m 높은 상공에서 찍은 GFP 형광 이미지 가득한 10000 MW dextran 488에서 흡수 1 mg/mL에서 nm. (B: 배경, p: 기둥)입니다. 건조 40 X 나 0.8 목표 관찰. 눈금 막대: 50 µ m. (B) 선형 보정 법칙은 두 색된 사각형 (A)에 표시 된 파란색 파선의 수준에서 얻은 대답 (C) 형광 강도 프로필에 표시는 포토 레지스트 교차의 평균 강도에서 얻은 스트라이프 (0.45 μ m 높은 긍정적인 감광 제)입니다. (D) (B) (파란색 점)의 데이터의 높이 변환 강도 후 기계 profilometer (검은 점) 및 FXm에서 얻어진 프로 파일의 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
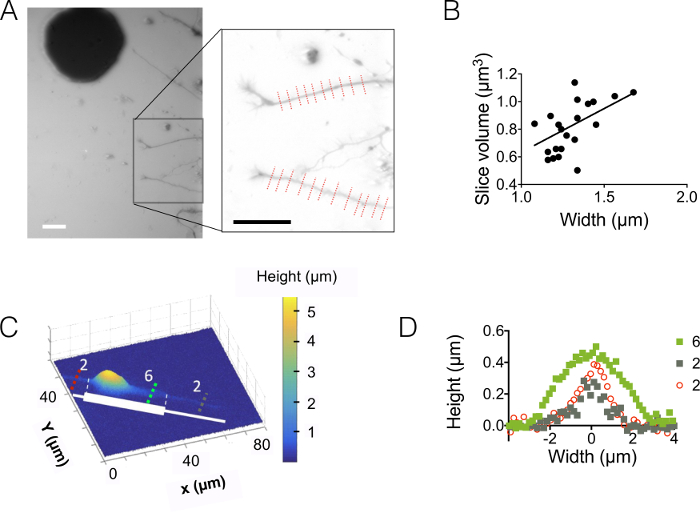
그림 3: Neurite 볼륨 이미징. (A) Neurite 다음 15 µ m 중간 챔버에 위치한 소마에서 중앙 3 µ m 높은 챔버로 확장. 488에서 10000 MW dextran 흡수를 사용 하 여 수행 하는 이미징 및 40 X, 나 0.8 건조 목표. 인세트 두 neurites와 오른쪽에 그래프를 선택한 배경 감소 일상적인 하이라이트의 사용 후 얻은. 스케일 바: 30 µ m. (B) Neurite 슬라이스 볼륨 neurite 폭의 기능으로 (A)에 표시 된 22 프로필 (평균 10 픽셀, 즉 1.6 µ m "neurite 조각"에)에서 얻은. 실선은 슬로프 0.4 µ m 원점 통과의 선형 적합을 나타냅니다. (C) 접착 부분에 꽃무늬 신경의 거짓 컬러 이미지 연속 2 µ m와 6 µ m 넓은 젊고 아름 다운 여자 (흰색에서 표현) 했다. 647에서 흡수 10000 MW dextran 가득 10 µ m 높은 상공에서 측정 되었다 및 40 x 나를 사용 하 여 0.8 건조 목표. ((D)) 높이 프로 파일에 해당 하는 색된 점선된 라인 (C)에 표시 된 동일한 색상 코드를 유지. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
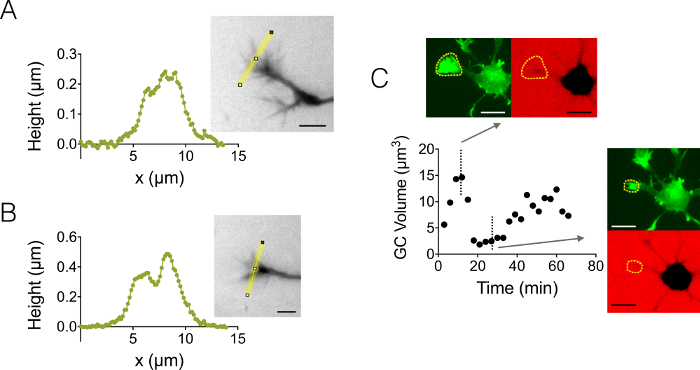
그림 4: 정적 및 동적 성장 콘 영상. (A-B) 성장 원뿔 높이 프로 파일 관련된 이미지에 표시 된 노란색 라인을 따라 높이 변환 강도 후 3 µ m 높은 상공에서 얻은. 10000 MW dextran 488에서 흡수와 채우기를 사용 하 여 수행 하는 관측 및 40 X, 나 0.8 건조 목표. (C) 전체 신경 영상 12 µ m 높은 상공에 가득 10000 MW dextran 647에서 흡수 nm. 관찰 두 가지 형광 채널 변경: 성장 콘 지역화 (노란 점선), 및 형광 제외에서 GC 볼륨 계산 CY5 GFP. 파선 노란색으로 포함 하는 표면 GC 볼륨을 계산 하기 위해 사용 되었다. 그래프는 두 대표 다른 시간 지점에서 GFP와 CY5 채널에 시간, 및 관련 된 형태학 GC 볼륨의 변화를 보여줍니다. 모든 데이터는 40 x 나를 사용 하 여 인수 했다 0.8 건조 목적은 모든 3 분 스케일 바: 10 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 단계 | 1:8 µ m 레이어 마스크 | 마스크 2시 30분 µ m 층 | 마스크 3시 40분 µ m 층 |
| 수-8 종류 | 2007 | 2025 | 2050 |
| Spincoating | 30 s @ 2000 rpm | 30 s 3050 rpm @ | 30 s 3250 rpm @ |
| 부드러운 빵 | 95 ° C @ 3 분 | 65 ° C + 6 분 95 ° C @ @ 2 분 | 65 ° C + 7 분 95 ° C @ @ 3 분 |
| 노출 에너지 | 110 mJ/cm2 | 155 mJ/cm2 | 170 mJ/cm2 |
| 사후 노출 빵 | 95 ° C @ 4 분 | 1 분 65 ° C + 6 분 95 ° C @ @ | 65 ° C + 7 분 95 ° C @ @ 2 분 |
| 개발 | 2 분 30 초 | 5 분 | 6 분 |
| 하드 빵 (옵션) | 200 ° C @ 3-5 분 | 200 ° C @ 3-5 분 | 200 ° C @ 3-5 분 |
표 1: 사진 평판 단계 12 μ m 높이 중앙 챔버를 포함 하는 장치를 만들려고 수행. 중간 챔버의 높이: 20, 50, 90 µ m.
| 단계 | 마스크 1시 10분 µ m 층 | 마스크 2시 30분 µ m 층 | 마스크 3시 40분 µ m 층 |
| 수-8 종류 | 2007 | 2025 | 2050 |
| Spincoating | 30 s 1500 rpm @ | 30 s 3050 rpm @ | 30 s 3250 rpm @ |
| 부드러운 빵 | 95 ° C @ 3 분 | 65 ° C + 6 분 95 ° C @ @ 2 분 | 65 ° C + 7 분 95 ° C @ @ 3 분 |
| 노출 에너지 | 125 mJ/cm2 | 155 mJ/cm2 | 170 mJ/cm2 |
| 사후 노출 빵 | 95 ° C @ 4 분 | 1 분 65 ° C + 6 분 95 ° C @ @ | 65 ° C + 7 분 95 ° C @ @ 2 분 |
| 개발 | 2 분 30 초 | 5 분 | 6 분 |
| 하드 빵 (옵션) | 200 ° C @ 3-5 분 | 200 ° C @ 3-5 분 | 200 ° C @ 3-5 분 |
표 2: 사진 평판 단계 높이에서 10 μ m의 중앙 챔버를 포함 하는 장치를 만들려고 수행. 중간 챔버의 높이: 20, 50, 90 µ m.
| 단계 | 마스크 1시 12분 µ m 층 | 마스크 2시 32분 µ m 층 | 마스크 3시 40분 µ m 층 |
| 수-8 종류 | 2015 | 2025 | 2050 |
| Spincoating | 30 s 3250 rpm @ | 30 s 2500 rpm @ | 30 s 3250 rpm @ |
| 부드러운 빵 | 95 ° C @ 3 분 | 65 ° C + 5 분 95 ° C @ @ 2 분 | 65 ° C + 7 분 95 ° C @ @ 3 분 |
| 노출 시간 | 140 mJ/cm2 | 157 mJ/cm2 | 170 mJ/cm2 |
| 사후 노출 빵 | 95 ° C @ 4 분 | 1 분 65 ° C + 5 분 95 ° C @ @ | 65 ° C + 7 분 95 ° C @ @ 2 분 |
| 개발 | 3 분 | 5 분 | 6 분 |
| 하드 빵 (옵션) | 200 ° C @ 3-5 분 | 200 ° C @ 3-5 분 | 200 ° C @ 3-5 분 |
표 3: 사진 평판 단계 높이에서 3 μ m의 중앙 챔버를 포함 하는 장치를 만들려고 수행. 중간 챔버의 높이: 18, 50, 90 µ m.
추가 데이터 1: masks_neuron_volume_chips.tiff. PDMS 장치 (DRIE 마스크와 마스크 1-3)를 조작 하는 데 사용 하는 마스크의 개요 보기. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보조 데이터 2: 파일 "masks_neuron_volume_chips.dxf". 전자 파일 조작 DRIE 마스크와 마스크 1-3 하 수 있도록 합니다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보조 데이터 3: "Mask_Photoresist stripes.dxf". 전자 파일 레지스트 줄무늬의 포토 리소 그래피에 사용 되는 마스크를 조작 수 있도록 합니다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보조 데이터 4: 파일: conversion_mattotiff.m 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보조 데이터 5: 파일: importfilevol.m 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
뉴런의 볼륨 이미지 구성 때문에이 세포의 길고 얇은 확장 FXm 기술에 대 한 도전. 이 프로토콜 신경 영상 전용 미세 장치의 동일한 종류의 변종을 설명 합니다.
미세 디자인의 측면, 옆에 목표의 형광 제외 이미징에 대 한 기본 이며 절충 한 측면 해상도 이미지 선명도 의미 합니다. 그것은에 게재 되었습니다 13 챔버 높이 보다 작은 초점의 깊이를 선도 높은 NA 없음을 볼륨 측정의 정밀도 대 한 해로운 영상 초점에서 수행한 및 충분 한 마진의 개체의 윤곽선 사이 남아 있는 경우 nterest 그리고 통합의 경계입니다. 그러나, 초점의 깊이 보다 훨씬 더 높은 상공의 사용 때문에 광자 확산는 부드럽게 이미지 선명도 관심사의 목표의 가장자리를 손상 한다. 3 µ m 높은 챔버의 제조 측면 흐리게이 감소 하 고 매우 잘 정의 된 형광 제외 이미지도 높은 NA를 사용 하 여 제공 (0.8) 40 X 목표 측면 고해상도 신경 분 지를 시각화.
3 µ m 높은 챔버의 경우 칩 조립은 중요 한 단계, 특히 하지만 주의 조작 4.1.2에 설명 된 대로 방지 지붕 붕괴. 이러한 얇은 실에 관련 된 볼륨 비율 높은 표면 또한 시간이 지남에 Dextran 농도의 안정성의 문제를 제기. 우리 보육의 1 박 후는 Dextran의 표면 흡수 했다 무시할 수 확인: PBS에서 Dextran을 교체 후 기둥와 배경 사이의 강도 차이 사이 초기 강도 대비 1000 당 약 1 Dextran의 면 전에 서이 두 영역입니다. 참고 아래쪽 coverslip에 및 PDMS 지붕에 신경 준수 수 있습니다. 이 효과 코팅으로 꽃무늬 coverslips (즉, 우리가 하지 PDMS 챔버 내 접착 분자를 품 어 할 때)를 사용 하 여 따라서 엄격 하 게 지역화 챔버의 바닥에 때 사라집니다.
그렇다 하 고 그들의 도전적인 형태 뉴런 FXm 오히려 적합 한 방법, 즉 dextran endocytosis의 주요 한계 중 하나는 매우 제한 된는 사실 때문에이 셀. 우리 선택 10 kDa 정립에에서 억제 범위 (시간) 어떤 보이는 endocytosis 현상.
결론적으로에 FXm의 개념적 단순 일련의 실험적인 문제는 현재 프로토콜, nanometric PDMS 거칠기 및 미세 챔버 높이, 또는 배경 교정의 흘 수에 대 한 수정에 의해 해결 되었습니다에 의해 균형 PDMS 기둥 사이의 천장입니다. 그러나, 형광 매체 제한에 가까운 미세 챔버를 사용 하 여 효과적인 표면 세포 접착, 또는 중앙에서 소마를 제외 하는 필요성을 절감 하 지원 기둥의 필요성 같은 몇 가지 특정 제약 조건 생성 높은 해상도 관측에 액세스할 수 있는 셀의 영역을 제한 하는 높은 선명도와 신경 확장 관찰 하 약 실. 이 방법의 한 가지 가능한 진화 한 광학 교체 물리적 감 금이를 제거 하는 것입니다. 빛 시트 현미경의 새로운 개발 있습니다 결합 될 advantageously FXm 미래에.
공개
저자는 충돌의 관심을 선언합니다.
감사의 말
저자는 프로세스 개발 및 장치 제작에 그들의 귀중 한 지원을 위해 하는 ChiLab, 재료 및 마이크로 실험실-Politecnico 디 토리노-교수 C F Pirri, 닥터 M Cocuzza와 박사 S L Marasso의에서 DISAT 인정 하... 우리는 토론 및 이미지 처리에서 지원에 대 한 Quantacell에서 빅터 라신 감사합니다. 우리는 GFP LifeAct 마우스를 제공에 대 한 마우스에 대 한 그들의 지원에 대 한 인 퀴리와 파블로 바 가스와 아나 마리아 레논 (인 퀴리)의 동물 시설에서 이자벨 Grandjean를 마 농 샤 감사. 우리는 형광 배제 방법의 이해에 그들의 도움 인 Langevin 및 Clotilde Cadart, 라 리사 Venkova, Matthieu Piel 인 퀴리-UMR 144에서에서 올리비에 Thouvenin에 감사. 마지막으로, 우리 소에 그들의 지원 위한 인 피에르-질 드 Gennes (CNRS UMS 3750)의 기술 플랫폼을 감사합니다. 이 작품은 유럽 연구 위원회 고급 부여 번호 321107 "첼로,"에 의해 부분적으로 지원 되었다 PSL 대학교 (SwithNeuroTrails 프로젝트), ANR Investissement d'Avenir, IPGG Labex 및 Equipex.
자료
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Plasmalab System 100 | Oxford Instruments | To perform DRIE | |
| MJB4 mask aligner | SUSS MicroTec | SU-8 photolithography | |
| NXQ 4006 Mask aligner | Neutronix Quintel | Photolithography associated to DRIE | |
| Plasma cleaner | Diener Electronic | Pico PCCE | |
| Cell culture hood | ADS Laminaire | Optimale 12 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Multifuge X1R | |
| Incubator 37 °C 5% CO2 | Panasonic | MCO-170AICUVH-PE IncuSafe CO2 Incubator | |
| Epifluorescence microscope | Leica | DMi8 | |
| PDMS Oven between 65 and 80 °C | Memmert | ||
| Mechanical profilometer | Veeco | Dektak 6M Stylus Profiler | |
| Optical profilometer | Veeco | Wyko NT9100 | |
| Vacuum desiccator | Verrerie Villeurbanaise (Kartel Labware) | 230KAR | Diameter 200 mm |
| Ultrasonic bath sonicator | Labo Moderne | SHE1000 | Volume of the bath: 0.8 liter |
| Hotplate | Stuart SD162 | SD162 | |
| Masks | |||
| DRIE | Supplementary data | ||
| Su8 Mask 1 | Supplementary data | ||
| Su8 Mask 2 | Supplementary data | ||
| Su8 Mask 3 | Supplementary data | ||
| S1805 calibration stripes | Supplementary data | ||
| Small laboratory equipment | |||
| 1.5 mm hole puncher | Sigma-Aldrich | 29002519 (US reference) | |
| Scalpel or razor blade | |||
| 9" Stainless Steel Flat Spatula with Spoon | VWR International | 82027-532 | To demold PDMS |
| Top Lip Wafer Handling | VWR International | 63042-096 | |
| Curved tweezer | FST | Dumont #7 Forceps - Standard / Dumoxel | To manipulate glass coverslips |
| Substrates | |||
| Silicon wafer | Prolog Semicor Ltd | ||
| 24x24 mm glass coverslips | VWR | 631-0127 | |
| Photoresists and developpers | |||
| AZ 1518 positive photoresist | Microchemicals GmbH | Before DRIE process, thicknes 1.8 µm | |
| AZ 351B developer | Microchemicals GmbH | To develop positive AZ 1518 photoresist | |
| SU-8 2007 | MicroChem | ||
| SU-8 2025 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| PGMA developer | Technic | To develop SU-8 negative photoresist | |
| Microposit S1805 resist | Chimie Tech Services | Positive photoresist used to obtain 0.5µm high structures | |
| MF 26A developer | Chimie Tech Services | To develop positive S1805 photoresist | |
| Laboratory consumables | |||
| Disposable plastic pipette 3 mL | LifeTechnologies - ThermoFisher | ||
| P100 Petri dishes | TPP | 93100 | |
| 20 mL syringe | Terumo | SS+20ES1 | |
| Transparent scotch tape | |||
| Square wipes | VWR | 115-2148 | |
| Parafilm | DUTSCHER | 90260 | Plastic paraffin film |
| Chemicals | |||
| (3-Methacryloxypropyl)trichlorosilane | abcr | AB 109004 | |
| PDMS and curing agent Sylgard 184 | Sigma-Aldrich | 761036 | |
| isopropanol | W292907 | ||
| poly-ornithine | Sigma-Aldrich | P4957 - 50 mL | |
| Ethanol absolute | Sigma-aldrich | 02865 | 99.8% |
| 3-methacryloxypropyl-trimethoxysilane | Sigma-aldrich | M6514-25ML | (C4H5O2)-(CH2)3- Si(OCH3)3 |
| acetic acid | Sigma-aldrich | 71251-5ML-F | |
| Dextran 10kW conjugated with Alexa488 | LifeTechnologies - ThermoFisher | D22910 | Absoprtion at 488 nm |
| Dextran 10kW conjugated with Alexa647 | LifeTechnologies - ThermoFisher | D22914 | Absoprtion at 647 nm |
| Culture medium | |||
| MEM | LifeTechnologies - ThermoFisher | 21090-022 | |
| Horse Serum | LifeTechnologies - ThermoFisher | 26050088 | |
| B27 | LifeTechnologies - ThermoFisher | 12587-010 | |
| Glutamax 200 mM | LifeTechnologies - ThermoFisher | 35050-061 | |
| Sodium Pyruvate GIBCO 100 mM | LifeTechnologies - ThermoFisher | 11360-070 | |
| Gentamicin | LifeTechnologies - ThermoFisher | 15710-049 | |
| PBS | Sigma-Aldrich | D8537-500ML | |
| HBSS 10x | LifeTechnologies - ThermoFisher | 14180-046 | |
| Hepes 1M | LifeTechnologies - ThermoFisher | 15630-056 | |
| trypsin-EDTA | Sigma-Aldrich | 59418C-100ML | |
| Neurobasal | LifeTechnologies - ThermoFisher | 21103-049 | |
| Neurobasal without phenol red | LifeTechnologies - ThermoFisher | 12348-017 | |
| Softwares | |||
| Routine in Matlab for background normalization | Quantacell | Contact Victor Racine: victor.racine@quantacell.com | |
| ImageJ | To select specific ROI for image analysis | ||
| Routine | ImageJ | Supplementary data | |
| Routine | Matlab | Supplementary data |
참고문헌
- Jun, S., Taheri-Araghi, S. Cell-size maintenance: universal strategy revealed. Trends Microbiol. 23 (1), 4-6 (2015).
- Zlotek-Zlotkiewicz, E., Monnier, S., Cappello, G., Le Berre, M., Piel, M. Optical volume and mass measurements show that mammalian cells swell during mitosis. J. Cell Biol. 211 (4), 765-774 (2015).
- Kim, G. H., Kosterin, P., Obaid, A. L., Salzberg, B. M. A mechanical spike accompanies the action potential in Mammalian nerve terminals. Biophys J. 92 (9), 3122-3129 (2007).
- Iacono, D., et al. Neuronal Hypertrophy in Asymptomatic Alzheimer Disease. J Neuropathol Exp Neurol. 67 (6), 578-589 (2008).
- Cheli, V. T., et al. Conditional Deletion of the L-Type Calcium Channel Cav1. 2 in Oligodendrocyte Progenitor Cells Affects Postnatal Myelination in Mice. J Neurosci. 36 (42), 10853-10869 (2016).
- Kneynsberg, A., Collier, T. J., Manfredsson, F. P., Kanaan, N. M. Quantitative and semi-quantitative measurements of axonal degeneration in tissue and primary neuron cultures. J Neurosci Methods. 266, 32-41 (2016).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PloS one. 10 (3), (2015).
- Aguet, F., et al. Membrane dynamics of dividing cells imaged by lattice light-sheet microscopy. Mol Biol Cell. 27 (22), 3418-3435 (2016).
- Roland, A. B., et al. Cannabinoid-induced actomyosin contractility shapes neuronal morphology and growth. eLife. 3, (2014).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci USA. 103 (47), 17759-17764 (2006).
- Chen, J., Xue, C., Zhao, Y., Chen, D., Wu, M. H., Wang, J. Microfluidic impedance flow cytometry enabling high-throughput single-cell electrical property characterization. Int J Mol Sci. 16 (5), 9804-9830 (2015).
- Bottier, C., et al. Dynamic measurement of the height and volume of migrating cells by a novel fluorescence microscopy technique. Lab Chip. 11, 3855-3863 (2011).
- Cadart, C., et al. Fluorescence eXclusion Measurement of volume in live cells. Methods Cell Biol. 139, 103-120 (2017).
- Marasso, S. L., et al. A novel graphene based nanocomposite for application in 3D flexible micro-supercapacitors. Materials Research Express. 3 (6), 065001(2016).
- Welch, C. C., Goodyear, A. L., Wahlbrink, T., Lemme, M. C., Mollenhauer, T. Silicon etch process options for micro-and nanotechnology using inductively coupled plasmas. Microelectronic Engineering. 83 (4), 1170-1173 (2006).
- Fath, T., Ke, Y. D., Gunning, P., Götz, J., Ittner, L. M. Primary support cultures of hippocampal and substantia nigra neurons. Nat. Protoc. 4 (1), 78-85 (2008).
- abcam. Counting cells using a hemocytometer. , Available from: http://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2017).
- ImageJ. Getting intensity values from single ROI. Image Intensity Processing. , Available from: https://imagej.net/Image_Intensity_Processing (2017).
- ImageJ. 19. Tools. ImageJ User Guide. , Available from: https://imagej.nih.gov/ij/docs/guide/146-19.html (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유