Method Article
혈액 기반 ROS1의 검출을 위한 테스트 및 RET Ribonucleic 산 디지털 연쇄 반응을 사용 하 여 순환에서 퓨전 성적표
요약
순환 혈액에서 ribonucleic 산 (cRNA)의 임상 진단에 unmet 필요 이다. 여기 우리가 과민 하 고 특정 디지털 연쇄 반응을 사용 하 여 비 작은 세포 폐 암 환자에서 cRNA를 특성화 하는 방법을 설명 합니다. 테스트 72 시간 이내 퓨전 변종 감지 하 디자인 요구 사항을 충족.
초록
분리와 종양에서 파생 된 순환 ribonucleic 산 (cRNA) 액체 생 혈액-기반에 대 한 특성에 대 한 새로운 방법을 개발 했습니다. 강력한 탐지 cRNA 혈액에서 복구의 임상 진단에 중요 한 unmet 필요를 솔루션을 나타냅니다. 테스트는 cRNA 안정화는 방부 제를 포함 하는 혈액 컬렉션 튜브로 전체 혈액의 수집으로 시작 합니다. 셀-무료, exosomal, 및 혈소판 관련 된 RNA는 테스트 시스템에 플라즈마 격리 됩니다. cRNA 이며 역방향 보완 DNA (cDNA)에 복사할 디지털 연쇄 반응 (dPCR)를 사용 하 여 증폭. 샘플 제어 유전자와 대상 바이오 마커 모두에 대 한 평가. 테스트 유효성 검사 포함 검색, 정확도, 및 견고성 연구 분석 샘플의 제한. Reproducibly 이러한 연구 개발 된 방법 ROS1에 대 한 여러 퓨전 변종 감지 (C-선생님 proto-oncogene 1; 8 변종)과 RET (transfection proto-oncogene; 동안 재배열 8 이체). 샘플 처리 워크플로 테스트 결과 샘플 영수증의 72 시간 지속적으로 생성할 수 있도록 최적화 되었습니다.
서문
최대 비 작은 세포 폐암 (NSCLC)의 25% 환자 없을 수 충분 한 조직 진단의 시간에 테스트를 위해 사용할 수 있는. 조직 수 경우에도 그것은 수 있습니다 권장 되지 않을 충분 한 수량 또는 수행 하는 품질의 분자 테스트1,2. 경우에서 분자 프로 파일링에 대 한 생 검에서 충분 한 직물은, 환자 몇 주 또는 더 이상 결과 기다리거나 분자 결과3,4없이 치료를 시작 해야 할 수도 있습니다. 그러나, 그것은 유익한 분자 진단 수 사용할 수 있는 진단 NSCLC 환자에 대 한 여러 타겟된 치료 옵션의 출현 주어진 중요 한. 순환 셀 무료 DNA (cfDNA) 액체 생 검에서의 테스트4,,56을 테스트 하는 전통적인 조직 문제에 해결책 이다. NSCLC 신속한 결과 생성을 위한 cfDNA와 유사한 dPCR 기반 워크플로 사용 하 여 실용적인 돌연변이 대 한 현재 테스트 옵션 포함 표 피 성장 인자 수용 체 (EGFR) sensitizing 돌연변이 ΔE746-A750 및 L858R, EGFR 저항 돌연변이 T790M KRA Proto-Oncogene (KRA) 이체, 및 B-영국 공군 Proto-Oncogene (BRAF) 변형 V600E. 비록로 광범위 하 게 채택 되지 필드, 순환 종양에서 파생 된 메신저 RNA (mRNA) 액체 생 검에서 고립 된 중요 한 임상 정보7,,89제공할 수도 있습니다. 우리는 이전 개발과 극피동물 Microtubule 관련 단백질 같은 4 Anaplastic 림프 종 수용 체 티로신 키 니 아 제 (EML4가) 퓨전 변형 혈장10에서 다중화 탐지의 방법에 보고. 이 연구에서 우리는 ROS1 및 RET, 8 퓨전 변종 각 분석 결과 내에서 취재에 대 한 더 높은 순서 다중화 RNA 목표를 포함 하도록 이러한 메서드를 확장. 목적은 이전 진단 NSCLC 환자의 혈장에서이 퓨전 이체의 탐지를 위한 빠른, 민감한, 특정, 고 재현 기법을 개발 했다.
테스트 프로세스는 RNA 혈액 컬렉션 튜브11안정화를 사용 하 여 의사의 사무실에서 시작 됩니다. 이러한 튜브 셀 RNase 억제제 뿐만 아니라 방부 제 포함. 샘플은 중앙된 병리학 모자 미국 대학 인가/임상 실험실 개선 개정 (CLIA)에 하룻밤 배송된 우선 순위-유능한 직원에 의해 처리에 대 한 인증된 실험실 (임상 실험). 일단 임상 실험에 의해 접수, 처리의 각 단계에서 승인 된 표준 운영 절차 (SOP) 실시 됩니다. 전체 혈액 순환도 RNA를 분리 하는 데 사용 되는 플라즈마를 복구 하 centrifuged 혈액 또는 exosomes 및 혈소판7,,89등 moieties 캡슐화 내 무료. 이러한 구획에서 RNA를 분리, 우리는 여러 추출 방법의 비교에 따라 RNA 복구 시스템 선택. 격리 된 RNA 집중 이며 역방향 cDNA를 복사할 수 있습니다. 여러 역전사 효소와 유전자 특정 뇌관 cDNA 합성 메서드 ROS1 및 RET 대상 성적 변환10극대화를 최적화 하는 동안 평가 했다. 이것은 낮은 풍부 순환 종양에서 파생 된 퓨전 변종 등 성적에 대 한 중요입니다. 마지막으로, 우리는 dPCR 뇌관 및 프로브 농도 RET 또는 ROS1 퓨전 변형 제어 유전자, glucuronidase-β (GUSB)의 다중화 검출 수 있도록 최적화. 우리 다음이 보고서에 설명 된 분석 검증 연구를 수행 하기 전에 마지막 잠긴된 프로토콜에 각각 최적화 연구에서 최상의 조건을 결합. 이 프로토콜 및 이러한 결과 순환에 드문 퓨전 이체의 일상적인 검출을 위한 신속 하 고 민감한 워크플로에 대 한 기초를 제공합니다.
프로토콜
달리 설명 하지 않는 한 제조자의 지시는 아래에 나열 된 시 약에 대 한 따 랐 다. PCR 분석 실험 ROS1 및 RET 융해를 감지 하도록 설계 된 상용 제품은.입니다.
1. RNA 역방향 전송 (RT)에 대 한 준비 작업-dPCR: 실험실 모범 사례
- RNA를 작업할 때 RNase 없는 환경을 만듭니다.
- 오염 RNases를 비활성화 하도록 상업적으로 사용할 수 있는 스프레이 사용 합니다.
- 사용 인증 RNase 무료 시 약, 팁, 그리고 튜브. Pipettors에 대 한 장벽을 팁 RNases의 소개 또는 샘플의 교차 오염을 방지 하기 위해 사용 합니다.
- 항상 샘플으로 의류에서 떨어지는에서 입자를 방지 하기 위해 실험실 코트를 착용. 실험실 코트 특정 RNA 처리와 함께 사용 하도록 지정 합니다.
- 피부에서 RNases에서 샘플 오염을 방지 하기 위해 장갑을 착용 한다. 글러브를 자주 변경 합니다.
참고: RNase와 실험실 표면 오염 때문에 환경에 노출 되는 가정 합니다. 피부, 머리, 문 손잡이, 냉장고 손잡이, 펜/마커, 등 문의 장갑 이상 RNase 자유를 간주 됩니다. - 사용 하기 RNase 비활성화 스프레이 전에와 pipettors, benchtops, 원심 분리기, 및 다른 작업 면을 오염을.
- 만약에 가능 하다 면, RNA와 전용 장비 세트를 유지 관리 합니다.
- 샘플으로 떨어지는 또는 오염 작업 영역에서 입자를 방지 하기 위해 RNA 샘플을 작업할 때 실험실 지역에서 공기 흐름의 중단을 최소화 합니다.
- 스토어-80 ˚C에서 RNA를 정화.
- 이 저하 될 수 있다 RNA 샘플의 여러 동결 해빙 하지 마십시오.
2. 긍정적인 컨트롤에 대 한 분석 RNA 자료의 생성
- 디자인 합성 DNA를 사용 하 여 관심10의 퓨전 변종에 대 한 mRNA 시퀀스 출판.
- 주어진된 퓨전 변형 퓨전 사이트 플러스 PCR amplicon 커버 각 측에 측면에 서는 충분 한 길이 포함 하는 mRNA 퓨전 시퀀스를 선택 합니다.
- 순환 하는 혈소판 농축 혈장을 사용 하 여 점령 하는 RNA의 크기를 모방 하기 위해 50-250 nt 사이 뉴클레오티드 시퀀스를 선택 합니다.
- T7 발기인 순서 추가 (5'-CAGAGATGCATAATACGACTCACTATAGGGAGA-3') 대상 시퀀스의 5' 끝에.
- 두 배 좌초 deoxyribonucleic 산 (DNA) 조각으로 합성 시퀀스를 주문.
- 10 ng / µ L의 최종 농도에 트리 스-EDTA (테) 버퍼에 합성 DNA reconstitute
- 60 기 합성 DNA RNA 녹음 방송 생체 외에서 를 사용 하 여 변환.
- 정화 RNA 사본 페 놀/guanidine 기반 시 약12를 사용 하 여.
- 포함 DNase I, RNase 잔여 서식 파일 DNA를 제거 무료.
- 순화 된 생체 외에서 RNA 특정 염료와 표준 상용 fluorometer를 사용 하 여 RNA의 농도 측정 합니다. 선택한 표준에 대 한 허용 범위 내에서 RNA가 확인 합니다. 희석 수 있습니다.
- 젤 전기 이동 법 2 %agarose 젤 높은 범위 50-250 nt 크기 범위를 포함 한 RNA 사다리와 RNA 젤 얼룩을 사용 하 여 성공적인 전사를 확인 합니다.
- 각 시험관에 RNA 젤에의 부하 500 ng.
- 5 V/cm에서 젤을 실행 합니다.
- 조명를 사용 하 여 단일 밴드를 시각화 하 고 결과 문서화 합니다.
- (2.1.2 단계에서 디자인에 따라) 퓨전 이체의 각각에 대 한 예상된 성적 크기를 확인 합니다.
- 각 시험관에 RNA RT-dPCR 일치 변종 특정 PCR 분석 결과 사용 하 여 검출 확인 (참조가이 프로토콜의 5-8 단계).
- 옵션: 각 융합 변형 및 제어 유전자 GUSB 포함 된 생체 외에서 RNA의 아데닌 혼합물 준비.
- 단계 2.9 수행 하는 경우: dPCR 변종 특정 PCR 분석 실험 (이 프로토콜의 단계 5-8 참조)를 사용 하 여 제어 혼합물에 포함 된 퓨전 이체의 각각의 탐지를 확인.
- 2.5 fg100.25에서 배열 하는 농도 테스트 하 여 원하는 입력된 농도 분석 긍정적인 컨트롤을 결정 합니다. 원하는 복사 번호 출력에 따라 농도 선택 합니다.
- 확인, 다음 10 µ L 단일 사용 aliquots 분석 RNA의 긍정적인 컨트롤 (단계 4.4)-80 ˚C에 스토어에 사용 하기 위해 준비.
3. 기증 표본
- 10 mL 인간의 전체 혈액 표본 10 mL 혈액 컬렉션 튜브 (BCT)에 포함 하는 셀 무료 RNA 방부를 수집 합니다.
참고: 모든 인간의 기증자 사용 연구에 동의 한다 고 기증자 특정 식별 정보를 수집 하거나 테스트 중에 사용 한다. - BCT 제조자에 의해 지정 된 기간 내에서 전 혈 샘플을 처리 합니다.
- 풀링된 정상적인 인간 플라스마 분석 긍정적인 컨트롤 내에서 사용 하기 위해 상용 소스에서 구입하실 수 있습니다. 긍정적인 통제 (4.4 단계)와 함께 사용 하기 위해 단일 사용, 풀링된 정상적인 인간 플라스마와-80 ˚C에 스토어의 1 mL aliquots를 준비 합니다.
4입니다. 플라즈마에서 RNA를 순환의 회복
참고:이 절차 동안 신속 하 게 작업에 중요 하다.
- 전체 혈액 튜브 20 분 200 x g에서 원심
- 혈 청 학적인 피 펫을 사용 하 여 centrifuged 혈액 컬렉션 튜브에서 플라즈마의 최대 4 mL를 수집 합니다. 방해 또는 버 피 코트 레이어 발음 주의 해야 합니다.
- Exosomes, 혈소판 및 플라즈마에서 RNA 세포 무료로 캡처할 수 있는 상용 키트를 사용 하 여 순환 RNA 격리 합니다. 각 일괄 처리와 함께 긍정적인 컨트롤 샘플에서 RNA를 분리.
-
임상 샘플의 각 일괄 처리에 대 한 긍정적인 통제를 다음과 같이 준비:
- 1 mL 풀링된 정상적인 인간 플라스마 aliquot (단계 3.3) 녹여
- 10 µ L 분석 RNA 약 수 (단계 2.12) 녹여
- 에탄올 lysate 플라즈마에 추가 된 후 정상적인 인간 플라스마 샘플으로 10 µ L 분석 RNA를 추가 하 여 긍정적인 통제를 준비 합니다.
- 100 µ L nuclease 무료 물 샘플 elute 즉시 RNA 청소 진행 및 농도.
- 샘플 젖은 얼음에 저장 하 고 적용, 최대 1 시간 동안 수 있습니다.
- 열 기반 메서드를 사용 하 여 RNA를 집중 하 고 RNase 무료 물 9 µ L에 elute.
- 5 단계로 바로 진행 하거나 젖은 얼음에 샘플까지 1 시간 동안 유지 합니다.
5. cDNA RNA의 반전 녹음 방송
- 무작위 뇌관 (구성 요소는 표 1 참조)를 포함 하 여 상업적으로 이용 가능한 반전 녹음 방송 반응 키트를 사용 하 여 cDNA를 집중된 순환 RNA 샘플을 변환 합니다.
참고: 유전자 특정 뇌관 사항이 고 테스트 변종에 대 한 디자인 될 수 있다. 프라이 머는 대상 RNA 순서에 따라 설계 되었습니다. 2.1 단계에서에서 융합 변형 시퀀스를 사용 합니다.- 아무 역전사 컨트롤 샘플 등 아무 RNA 컨트롤 샘플 ( 표 1참조).
- 상업적으로 사용 가능한 DNA 집중 스핀 열을 사용 하 여 반전 녹음 방송 반응에서 cDNA를 격리 합니다.
참고: 이 단계는 효소, 뇌관, 및 무료 deoxynucleotide 된 (dNTPs)의 제거를 촉진 한다. - PCR 반응에서 cDNA를 즉시 사용 하거나-80 ˚C에 저장 합니다.
6. 디지털 PCR
참고:이 PCR는 물방울 디지털 PCR (참조 테이블의 자료).
-
PCR 혼합 주의.
- 일회용 랩 코트와 니트 릴 장갑을 착용 한다.
- PCR를 사용 하 여 혼합 전용된 시 약 준비 지역에서 시 약. 시 약만 준비 지역에서 cDNA를 처리 하지 않습니다.
- 빛에서 그들을 보호 하기 위해 노력 하는 동안 프로브 커버. 과도 한 빛 사진 수는 프로브에 부착 된 형광 염료 표 백제.
- 믹스, 덮여 수송 그리고 cDNA 전에 별도 사전 증폭 영역에 추가 하는 빛 으로부터 보호.
- 추가 테스트를 cDNA PCR 깨끗 한 후드에 PCR 혼합에 사전 증폭 지역에 위치.
- 표 2에 따라 20 µ L의 최종 반응 볼륨에 대 한 PCR 믹스를 준비 합니다.
- PCR 믹스 + PCR 번호판 cDNA를 배포 합니다.
참고: 플레이트 레이아웃의 사용 가이드는 것이 좋습니다. - 커버 플레이트 이동식 플레이트 마감재를 사용 하 여.
- 잠시 우물의 아래에 샘플을 수집 하는 격판덮개 원심
- 10에 대 한 낮은 조정에 판 통에 믹스 s.
- 잠시 우물의 아래에 샘플을 수집 하는 격판덮개 원심
- 플레이트 마감재를 제거 합니다. 수동 또는 자동 물방울 생성 시스템으로 PCR cDNA 혼합에 대 한 작은 물방울 생성을 수행 합니다.
- 수동 물방울 생성에 대 한 전송 20 µ L PCR 혼합 샘플 웰 스 물방울 생성 카트리지에. 드롭릿 세대 기름의 70 µ L를 추가 합니다. 고무 가스 켓 및 전송 카트리지 물방울 생성을 시작 하려면 수동 물방울 발생기를 커버. 드롭릿 세대, 다음 제조업체에서 권장 하는 팁을 사용 하 여 신선한 PCR 접시에 방울을 전송 합니다. 발음 및 6 5 동안 작은 물방울을 천천히, 분배 s 방울 카트리지 또는 접시에 팁의 개통을 건드리지 않고, 각각.
- 자동된 물방울 생성에 대 한 일 씰과 방울 생성기에 접시를 봉인. 모든 팁, 카트리지, 확인 그리고 번호판 자리에 작은 물방울 생성을 시작 하기 전에.
- 다음 물방울 생성 및 전송 작은 물방울의 신선한 PCR 접시에 호 일 접시 마감재와 표 3의 설정을 사용 하 여 열 사이클 번호판 봉인.
- 열 cycler 후 실행은 완료 방울 리더를 사용 하 여 접시를 읽고. 컨트롤, 샘플, 등의 위치를 식별 하는 리더 소프트웨어에 대 한 접시 레이아웃 만들기 및 읽기 시작 하는 소프트웨어에 부하.
7. 데이터 분석 및 검토, 및 결과의 발생
- 상용 소프트웨어를 사용 하 여 결과 읽기 플레이트 분석.
- 분석 메뉴를 2 차원 (2D) 진폭 플롯을 볼로 이동 합니다.
- 드롭릿 데이터를 검사 하 여 데이터의 전반적인 품질을 평가 합니다.
- 이벤트 메뉴를 사용 하 여 총 허용된 이벤트 수에 대 한 데이터를 평가 합니다. 잘 당 미만 10, 000 건의 경우 신중 하 게 추가 문제에 대 한 데이터를 평가 합니다.
- 탈 선 형광 진폭에 대 한 데이터를 확인 합니다. 상당한 진폭 차이 복제 샘플 농도 차이 가난한 처리 또는 샘플의 혼합을 나타냅니다.
- 품질이 물방울 이나 문제가 있는 샘플을 나타내는 45도 축에 스프레이 패턴 방울 클러스터의 메모를 확인 합니다.
- 먼저 긍정적인 제어, 아니 역전사 (없음 RT), 및 아니오 RNA 제어 (NRC) 데이터를 검사 합니다. 모든 제어 샘플을 선택 하 고 2D 플롯에 의해 클러스터 품질 검사. 적절 한 임계 처리, 물방울 클러스터 간의 구분이 분명 명백한 해야 합니다.
- 각 분석 결과 변형 제어 우물에 따라 임계값을 설정 합니다.
- 만약 제어 유전자 인구 (5'-hexachloro-fluorescein-CE phosphoramidite 프로브도 표시), y 축, 그리고 변형 유전자 인구에서 이중 부정 드롭릿 인구를 분리 하기 십자선 도구를 사용 하 여 2D 플롯에 설정된 임계값 (제시 으로 표시 fluorescein amidite OR 6-carboxyfluorescein 프로브), x 축.
- 합계 한 샘플에 대 한 각 복제 우물에서 복사합니다.
- 테스트 결과 variant 복사본 검색 수로 표현 한다.
참고: 정상적인 실행 포지티브 또는 네거티브 샘플 호출에 대 한 분석 컷오프 값을 확인 하려면 건강 한 기증자 샘플 최종된 과정을 통해 (적어도 10 개별 샘플)를 설정 하 고 위에 변이 대 한 어떤 감지 배경 신호 구분 설정 관심입니다. 또한, 긍정적 이거나 부정적인 결과 호출 하는 데 필요한 제어 유전자 사본의 수를 설정 합니다. 이 제어 유전자 컷오프 내부 품질 관리 (QC) 수량 및 처리 되는 각 RNA 샘플의 품질을 평가 하기 위해 역할을 합니다.
8. 셀 라인 (옵션)를 사용 하 여 실시간 dPCR 반응 조건의 확인
- 퓨전 이체의 탐지를 확인 하려면 상용 셀 라인에 ROS1 또는 RET 퓨전 표현 관심의 mRNA. 다음과 같이 하십시오.
- 냉동된 상태에서 직접 세포 guanidinium 기반 솔루션에 플래시-냉동 세포 균질 균질 전에 간단한 녹고 RNA 저하와 손실 될 수 있습니다.
- 실리 카 막 스핀 열 RNA에 대 한 설계를 사용 하 여 RNA를 분리.
- fluorometer을 사용 하 여 RNA 관련 시 약 및 표준 RNA 샘플의 농도 측정 합니다.
- 플라즈마 또는 다른 상업적인 소스에서 야생-타입 RNA의 배경으로 고립 된 RNA를 희석.
- CDNA, 디지털 PCR 및 데이터 분석 및 검토, RNA의 전사 역에서 단계를 수행 하 고 생성의 결과 원하는 이체의 탐지를 확인 하려면이 프로토콜에 나열 된.
결과
이 프로토콜 NSCLC 환자 (그림 1A)의 플라스마 내에서 드라이버 변이의 측정에 사용 하기 위해 RNA 퓨전 이체의 탐지를 위해 개발 된 테스트 시스템을 설명 합니다. 퓨전 mRNA NSCLC 인구에서 가장 일반적인 RET 및 ROS1 재배열의 표현에서 제품 식별13,,1415,,1617. 멀티플렉스 PCR 분석 실험 다음 단일 반응 내에서 각 대상에 대 한 8 가장 일반적인 성적 변형 NSCLC에서 감지 하도록 설계 되었습니다. ROS1 소재 시에서 가장 일반적인 translocations CD74, SDC4, SLC34A2, EZR 또는 TPM3 유전자 (그림 1B)의 5' 부분으로 연결을 생성합니다. RET 로커 스에서 가장 일반적인 translocations 이어질 KIF5B과 나란히 있는 분석 결과 6 명의 exon 접합 커버. 적용 되는 추가 RET 파트너 CCDC6 와 TRIM33 (그림 1C) 포함 됩니다. 총,는 분석 실험 약 88%를 커버 ROS1 및 RET 변경 NSCLC 환자 인구17에 알려진의 99%의.
특이성 시험 부품의 처음 ROS1 또는 RET에 의해 융합 성적표 다중화 분석 실험에 대 한 mRNA 순서를 포함 하는 8 개의 개별 생체 외에서 RNAs를 사용 하 여 평가 되었습니다. 각 RNA 종 다중화 버전을 구성 하는 각 개별 변형 분석 결과 대 한 테스트를 했다. 이 분석 실험의 아무 분, 따라서 100%를 보여주는 내는 설계 분석 특이성 다중화 분석 (데이터 표시 되지 않음). 테스트 프로토콜의 탐지의 하한값을 확인 하려면 셀 라인 퓨전 변형 분석 결과에 포함 된 표현에서 파생 된 총 RNA는 0.04%, 0.2%, 1%, 5% 농도에 정상적인 RNA의 배경으로 혼합 했다. 다중화 된 RET 및 ROS1 변형 PCR 분석 실험 0.2% 퓨전 변종 (그림 2A-B)으로 작은 발견. 또한, 5%의 준비에서-대상 셀 라인 파생된 RNA (EML4가 퓨전 성적 표현) 검색 되지 않습니다 다중화 ROS1 및 RET 분석 실험으로 더 특이성 (그림 2A-B)를 시연.
RT dPCR 프로세스의 정밀 테스트 모두 ROS1에 대 한 수행 되었다 및 RET. 분석 제어 소재 아데닌 생체 외에서 RNAs의 구성 되었다 반전 녹음 방송 및 3 dPCR를 통해 3 농도 (높음, 보통 및 낮음)에서 처리 같은 날 (-하루), 3 일 연속 (간 일), 그리고 두 명의 연산자 (간 연산자) 내에서 서로 다른 경우 정밀 테스트 결과 모두 관심의 퓨전 사본 뿐만 아니라 GUSB, 내부 품질 관리 통계 (그림 2C-D)으로 포함 되어, 제어 유전자의 정확한 탐지를 시연 했다.
GUSB 내부 제어 뿐만 아니라 임상 샘플의 각 배치는 배치 컨트롤 집합으로 실행 되었습니다. 긍정적인 통제 개발 분석 체 외 의 혼합물에서 RT-dPCR에서 테스트 퓨전 이체의 각각을 대표 하는 RNA 뿐만 아니라 분석 생체 외에서 RNA GUSB. 이 RNA RNA 추출 하는 동안 lysate 정상적인 인간 플라스마로 아군은 고 프로토콜에 걸쳐 임상 샘플 함께 처리 했다. 역전사 (없음 RT) 통제할 부정적인 컨트롤의 RNA 추출 워크플로 오염 물질의 부재를 확인 하 고 RNA에 대 한 뇌관의 특이성을 설명 했다. 아니 실시간 제어 긍정적인 컨트롤로 동일한 물자를 사용 하 여 생성 된 하지만 cDNA 합성 반응에서 효소를 포함 하지 않습니다. RNA 제어 (NRC)는 오염 반전 녹음 방송 반응 구성 요소에서 기록의 부재를 확인 부정적인 컨트롤이입니다. 이 컨트롤 cDNA 합성 단계에서 워크플로로 소개 되 고 물 RNA 서식 파일 대신 반응에 추가 되었습니다. 아니 RT 및 NRC 컨트롤 정확한 결과 전달 하는 경우 두 채널에 부정적인 되어야 합니다. 표 1 각 컨트롤에 대 한 반전 녹음 방송 반응 구성 요소를 나열합니다. 이러한 컨트롤의 각에 대 한 2D 플롯의 예는 ROS1에 대 한 표시 됩니다 (그림 3 A-C) 및 RET (그림 3 E-G) 다중 분석 실험. 퓨전 변종 fluorescein amidite (FAM) 프로브를 사용 하 여 검색 된 및 제어 유전자, GUSB, 5'-hexachloro-fluorescein-CE phosphoramidite (16 진수) 프로브를 사용 하 여 검색 하는 동안는 y 축을 따라 표시 되 고 x 축에는. 이러한 배치 컨트롤 분석 결과 견고성을 확인 하기 위해 21 일에 걸쳐 평가 됐다. 퓨전 긍정적인 방울 및 GUSB 제어 유전자 방울 ROS1 및 RET에 대 한 연구 (그림 3D, H)의 과정을 통해 실행 하는 모든 21 실행에서 관찰 되었다. 모든 부정적인 컨트롤 (없음 RT 및 NRC) 전체 21 일간 (데이터 표시 되지 않음)에 걸쳐 부정적인 결과 굴복.
문제를 해결 하는 능력 임상 실험실 설정에서 실행 되도록 테스트 프로토콜의 중요 한 구성 요소입니다. 여기, 우리는 RT dPCR 프로토콜을 사용 하 여 최적의 결과의 실제 예제를 제공 합니다. 첫 번째는 역전사 제어(그림 4)의 중요성을 보여주는 예제 2D 플롯 이다. 이 예제에서는 돌연변이 긍정적인 방울 효소의 부족으로 인해 cDNA 변환 하더라도 참석 했다. 이 결과 dPCR 뇌관을 표적 게놈 DNA를 증폭으로 인해 했다. 이 경우에, 디자인 intron에 걸친 분석 결과의 게놈 DNA의 증폭이 되지 것입니다. 또는, RNase 무료 DNase 효소 오염 DNA를 제거 하는 데 사용할 수 있습니다 하지만 이것은 권장 하지 않습니다 드문 대상의 검출에 대 한 일부 RNA 분해 효소와 부 화 하는 동안 발생할 수 있습니다. 다음 예제에서는 2 차원 플롯은 두 채널 (그림 4B)에 긍정적인 방울와 NRC. 이 표시 RT-dPCR 설치 프로그램에서 어떤 시점에서 오염. 이 경우에, 권장 테스트에서 사용 된 어떤 잠재적으로 오염 된 시 약을 버리고, 철저 하 게 모든 장비를 오염을 제거 하 고 다시 신선한 반응 구성 요소와 테스트입니다. 세 번째 예에서는 2D 플롯 45 ° 선 (그림 4C) 따라 물방울의 살포로. 이것은 종종 전단 및 물방울의 병합에 의해 발생 합니다. 주의 방울 전에 열 순환 처리, 필수적 이다 작은 물방울은 손상 하는 경향이. 좋습니다 자동된 물방울 세대의 사용 가능한 경우. 경우 수동으로 전송 작은 물방울 생성, 수 권장된 넓은 구멍 팁을 선택 하 고 조심 pipetting 기술을 채용. 작은 물방울 전송 필요 느린 포부와 분배, 각 장소 5-6 초 동안, 그리고 피 펫 팁 오프닝 드롭릿 카트리지를 터치 하거나 잘 하지 않는 필수. 분배 때 액체 수준에서 피 펫 팁을 유지 하 고 천천히 방울 분사 (보기 데모 비디오)로 인상. 마지막 2D 플롯 예제는 긍정적이 고 부정적인 드롭릿 인구 (그림 4D) 사이 별거의 부족을 보여 줍니다. 이 여러 원인이 있을 수 있습니다. 세포의 용 해 버퍼에 매우 저하 된 DNA의 초과 사용 하는 세제 같은 강력한 PCR 억제제 분리의 손실을 발생할 수 있습니다. 이 경우에 cDNA 합성 및 dPCR (와 같은이 프로토콜의 단계 5에서 설명한) 사이 정리 단계를 추가 하십시오. 마지막으로, 분리의 부족, 최적의 증폭 사정 수도 있습니다 그리고 최적화 PCR 단계의 또한 고려 되어야 한다.
그림 5 대표 984 실제 환자 내의 데이터 설정-주위 시간 샘플을 급속 한 성격의이 테스트 워크플로 보여 줍니다. 결과 48 시간 이내 (의 경우 79%) 샘플 영수증의과의 경우, 95 %72 시간 내로 일찍 치료 의사에 보고 되었다. 끝으로의 사용 급속 한 시험 시스템을 제공할 수 있다 RNA 혈액 컬렉션 튜브, 혈액, 그리고 RT-dPCR는 최적화 된 프로토콜 적절 한 내부 및 배치 컨트롤, 실행에서 최적화 된 RNA 추출 절차를 순환 안정 퓨전 RNA 이체 NSCLC에 관련의 정확한 탐지.
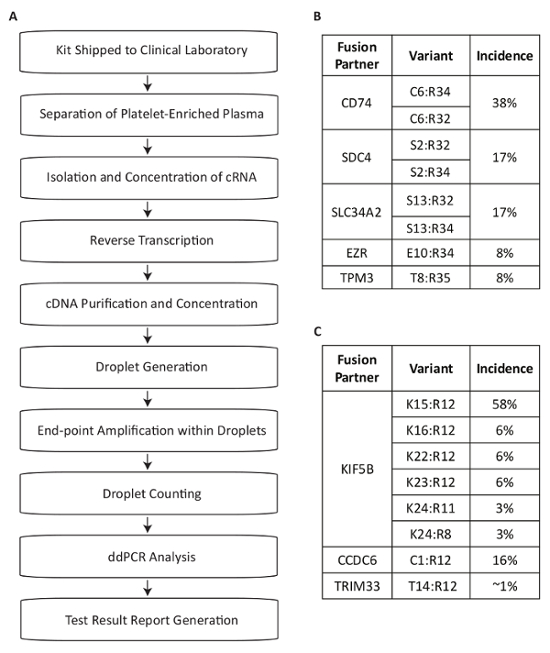
그림 1 : 혈액 샘플 처리 단계 퓨전 변형 탐지를 사용 하 여 분석 실험 관련 가장 널리 RET 및 ROS1 변종 NSCLC의 개요. (A) 전체 혈액 그려지고는 BCT는 임상 실험실으로 표본 수집 키트 내에서 제공 하는 경우 시작 샘플 테스트. 반대로 유전자 특정 뇌관으로 변하게 하 고 dPCR에 사용 하기 위해 정화 RNA 순환 혈소판 농축 혈장 내의 여러 소스 로부터 복구 됩니다. 드롭릿 세대 (유제), 구성 된 상업적으로 사용 가능한 시스템을 사용 하 여 샘플 처리 확대, 그리고 물방울 계산. 데이터는 상업적으로 사용 가능한 소프트웨어를 사용 하 여 분석 된다. 그리고 나 서 테스트 결과 문서화 테스트 요청 의사를 다시 보고. 과정은 결과 출시 샘플 영수증에서 72 시간의 기간 내에서 작동 하도록 설계 되었습니다. (B) ROS1 및 (C) RET 8 변종 다중화 분석 내에서 적용 됩니다. 권한이 있는 Biodesix 웹사이트에서 적응. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
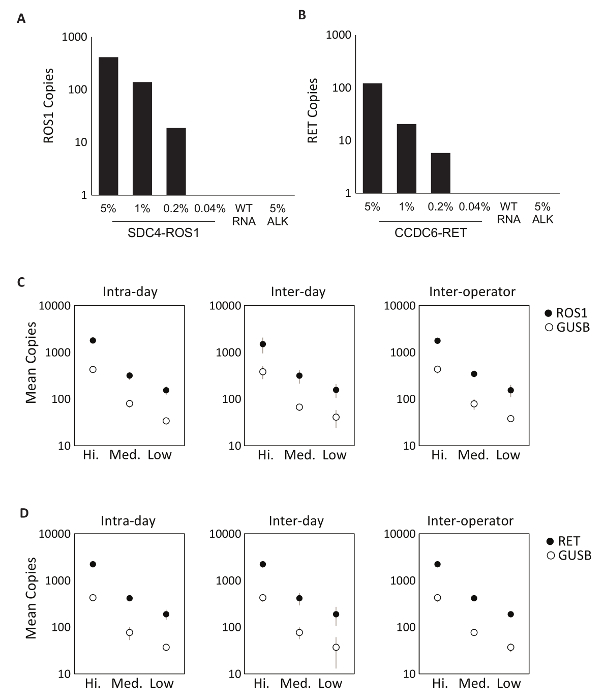
그림 2 : 분석 유효성 검사. 셀 라인 표현 (A) SDC4 ROS1 퓨전과 퓨전 (B) CCDC6 RET 총 인간 야생-타입 RNA (WT RNA)의 배경에서 희석 했다. 각 퓨전 변종 탐지의 한계는 각 변형 분석 결과 대 한 미리 정의 된 기준을 사용 하 여 0.2% 변형 주파수에서 설립 되었다. 이 임계값 위의 모든 샘플은 또한 제어 유전자의 적어도 21 복사본을 포함합니다. 야생-타입 RNA의 배경에서 5 %EML4 (가) 표준 부정적인 결과 의해 확인 되었다 분석 결과 특이성을 설명 하기 위해 테스트를 했다. 분석 다중화 RNA 표준 높은, 중간에서 측정 및 (C) ROS1 (D) RET. 정밀에 대 한 낮은 농도 3에서 실행 되는 같은 날 (-하루), 3 연속 일 (간), 그리고 3 개의 실행을 통해 평가 되었다 두 명의 독립적인 연산자 (간 연산자)입니다. 복사본 수와 표준 편차의 의미 표시 됩니다. 권한이 있는 Biodesix 웹사이트에서 적응. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
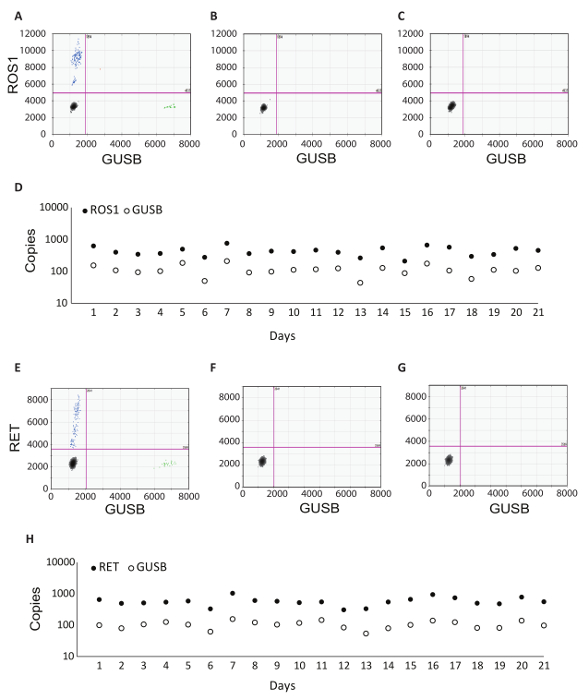
그림 3 : 일괄 처리 제어 예제 및 견고성 데이터. 다중화 ROS1 분석 결과 dPCR의 2D 플롯 결과 (A) 긍정적인 통제, (B)에 대 한 아무 역전사 제어, 및 (C) RNA 템플릿 제어. (D) 컨트롤은 21 일 (주말 및 공휴일 제외)에 실행 했다. 긍정적인 통제 했다 141 + 439 ROS1에 대 한 표준 편차 + 복사본 수를 의미 합니다. 아니 역전사 효소 및 없습니다 템플릿 컨트롤 또한 매일에 실행 하 고 모든 이들은 부정적인 (데이터 표시 되지 않음). RET 다중화 분석 결과 dPCR의 2D 플롯 결과 (E) 긍정적인 통제, (F)에 대 한 아무 역전사 제어 및 (G) RNA 템플릿 제어. (H) 컨트롤은 21 일 (주말 및 공휴일 제외)에 실행 했다. 긍정적인 통제 했다 182 + 586 RET에 대 한 표준 편차 + 복사본을 의미 합니다. 표시 되지 않습니다 있으며 없음 역전사 없습니다 템플릿 컨트롤을 또한 매일에 실행 하 고 모두 부정 했다. 권한이 있는 Biodesix 웹사이트에서 적응. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
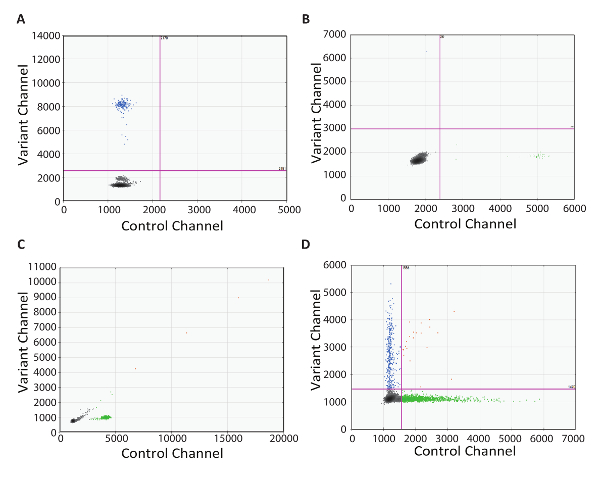
그림 4 : 문제 해결 RT-dPCR. 2D 플롯 대표 최적의 dPCR 결과 때 아무 반전 transcriptase 컨트롤, 컨트롤 내에 없는 RNA (C) (B) 오염 오염 (A) 전단 및 방울, 그리고 (D의 병합 ) 제대로 최적화 된 PCR 조건 또는 PCR 저해. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
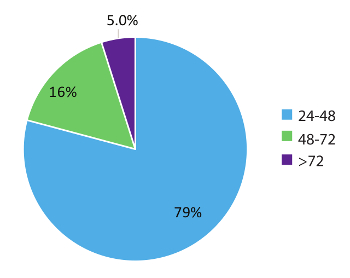
그림 5 : 처리 시간 (TAT). 문신 (시간)에 RNA 이체를 요청 하는 테스트에 대 한 컴파일된 (n = 984). 주말, 휴일, 및 개최 샘플 데이터 제외 > 실험실 테스트 요청 양식에서 불완전 한 임상 정보로 인해 24 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
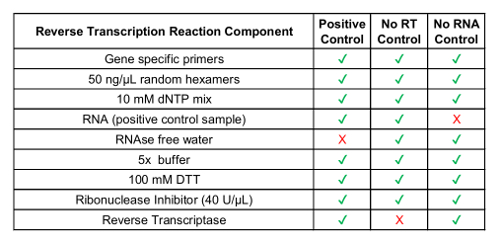
표 1: 공정 제어에 대 한 반전 녹음 방송 시 약의 준비.
| 구성 요소 | 볼륨 |
| 프로브에 대 한 dPCR supermix x 2 (아무 2'-deoxyuridine 5'-3 인산 염) | 10 Μ L |
| 20 x 변형 대상 프라이 머/프로브 세트 (450 nmol/L 뇌관, 250 nmol/L 팸 프로브) | 1 Μ L |
| 제어 대상 프라이 머/프로브 세트 x 20 (450 nmol/L 뇌관, 250 nmol/L 16 진수 프로브) | 1 Μ L |
| nuclease 무료 물 | 1 Μ L |
| cDNA | 7 Μ L |
표 2: dPCR에 대 한 마스터 믹스의 준비.
| 자전거 단계 | 온도 | 시간 | # 사이클 | 진입 속도 |
| 효소 활성화 | 95 ° C | 10 분 | 1 | ~ 2 oC/s |
| 변성 | 94 ° C | 30 s | 40 | |
| 어 닐 링/확장 | 55 ° C | 1 분 | ||
| 효소 비활성화 | 98 ° C | 10 분 | 1 | |
| (선택 사항) 개최 | 4 ° C | 무한 한 | 1 | ~ 1 oC/s |
표 3: 열 순환 조건입니다.
토론
RET 및 ROS1 재배열 함께 NSCLC 인구18내 드라이버 돌연변이의 3%를 차지 한다. 비록 드문, 이러한 유전 변경의 검출은 필수적 이다. 이러한 변경 NSCLC 환자 특별히 onco-단백질13에서 결과 탈 키 니 아 제 활동을 억제 하는 표적된 치료제에서 혜택을 받을 수 있습니다. 같은 치료는 다른 RET에 대 한 효능 임상 시험19에서 수 입증 되었습니다 동안에 이미 ROS1 긍정적인 NSCLC에 사용 하기 위해 FDA에 의해 승인 됩니다.
디지털 PCR 기술은 액체 생 응용 프로그램20은 감도를 제공 한다. 이 기술 사용 하기 위해 상당한 채택 되었습니다 순환 NSCLC4,6,21,,2223 환자에서 종양 돌연변이의 측정에 대 한 DNA 세포-무료와 함께 . CfDNA, 뿐만 아니라 우리는 종양 RNA (그림 1A)10순환에서 NSCLC 환자에서 가장 널리 퍼진 퓨전 이체의 강력한 측정을 위한 프로토콜을 개발 했다.
우리의 설립된 프로토콜 분석 0.2% (그림 2) 아래로 탐지 한계에 대 한 수 있습니다. RT dPCR 매우 구체적이 고 민감한 반면는 분석 실험 알려진된 퓨전 변종 선택 하 고 검색 PCR 분석 결과에 대 한 다중화의 패널에 제한 됩니다. 따라서, 다중화 분석에 포함 되어야 하는 융해 NSCLC 환자의 인구 내의 적절 한 범위를 보장 하기 위해 신중 하 게 선택 되어야 합니다. 우리가 성공적으로 RET 및 ROS1를 동시에 8 퓨전 이체 결과에서 RET 또는 ROS1 loci의 재배열을 검색 하 고 각각 99%와 RET 및 ROS1 긍정적인 인구의 88%를 커버에 대 한 분석 실험 설계 (그림 1B-C )17.
이 연구에 설명 된 대로 최종 테스트 워크플로 포함 배치 컨트롤 결과의 일관성을 보장 합니다. 이러한 컨트롤에는 모두 긍정적인 분석 표준 컨트롤 뿐 아니라 두 부정적인, 함께 확인 거기 아무 오염 또는 PCR 저해 (그림 3 참조) 일괄 처리 내에서 발생 하는 포함 됩니다. 분석 결과의 안정성을 보장 하기 위해, 연구는 (그림 3D, H) 21 일 동안 배치 컨트롤을 사용 하 여 수행 되었다. 이러한 데이터는이 프로토콜 내에서 설정 된 RNA 과정의 일관성을 보여 줍니다.
좋은 연구실 관행 및 적절 한 RNA 처리는 강력 하 고 정확한 결과 보장의 핵심 구성 요소. 실험실 공간 및 전용된 장비 사용 RNA, 각 사용 후 장비 청소, RNase 무료 시 약 및 소모품를 사용 하 여 및 모든 오염 RNases를 줄이는 데 도움이 작업 공간에는 RNase 비활성화 스프레이 적용. 전용된 연구실 코트를 포함 한 기술자에 의해 RNA 샘플의 병역 처리 장갑 변경, RNA 추출 절차를 통해 신속 하 게 작업을 자주 되며 얼음에 유지 샘플 샘플 무결성을 보존 하기 위해 매우 중요 합니다. 일단 RNA cDNA를 복사할 반대 하고있다, 덜 저하 하는 경향이 더 안정적인 형태로 샘플이입니다. RNA 무결성을 지 원하는 사례 이외에도 PCR 구성 요소와 샘플 거짓 긍정적인 결과 이어질 수 있는 교차 오염을 방지 하기 위해 분리 된 지역에서 유지 되어야 합니다. 재고 PCR 시 약 및 PCR 마스터 믹스의 준비 PCR에서 별도 유지 한다 그리고 큰 주의 해야 증폭된 템플릿 (게시물-PCR) 분리 시 약, RNA, cDNA 샘플 등 모든 미리 증폭 소재로. 마지막으로, 적절 한 생성 및 증폭 하기 전에 PCR 혼합 유화 처리 드롭릿 무결성 및 최적의 dPCR 조건을 유지 하기 위해 중앙입니다. 이와 같은 조치는 일관 되 고 정확한 결과 얻기 위해이 프로토콜의 실행 중 중요 합니다. 모든 데이터 시험 되어야 한다 결과의 릴리스 전에 숙련 된 직원에 의해 확실 하 게 모든 QC 통계 나왔다. 차선의 결과 (그림 4)의 경우 일괄 처리 기술 직원과 실험실 감독에 의해 검토 되어야 하 고 다시 처리 해야 할 수도 있습니다.
RT dPCR 결과 샘플 접수 및 시험이이 연구에서 사용 된 설정 내에서 샘플 결과의 95%에서 24 시간으로 일찍 일어날 수 있다 (n = 984) 영수증 (그림 5)의 시간에서 72 시간 이내에 주문 의사를 보고 했다. 많은 의사를 제공 하는이 차례-주위에 시간이 필요한 적절 한 치료의 개시를 허용 하는 시간 프레임에 분자 정보. 이러한 결과 일반적으로 기존의 조직 생 검을 사용 하 여 얻은 그 보다 이전. NSCLC 및 다른 암에 대 한 추가 생체와 유사한 순환 RNA 기반 방법을 사용 하 여 개발 될 수 있습니다 그리고 같은 빠른 시간-에-결과에서 도움이 될 것 이라고. 예를 들어 RT-dPCR를 사용 하 여 프로그래밍 죽음 Ligand 1 (PD-L1) mRNA 사본의 측정 immunotherapy 옵션에 대 한 의사를 알려 수 있습니다. 또한 액체 생의 유틸리티에 성장 관심사 및 치료 효능에 대 한 모니터링에 dPCR입니다. 게놈 특정 변종에 대 한 테스트를 사용 하 여 종양의 부활의 이전 표시 전에 환자는 표준24이미징 등 관리 대책의 증상 치료 regimens를 조정 하는 의사 수 있습니다. 이 연구에서 보고 하는 것과 같은 프로토콜 그들의 비 침해, 감도, 빠른 설정-주위 시간 및 비용 효율성 모니터링에 이상적입니다. 여기서 설명 하는 분석 결과 신속한 치료 결정을 용이 하 게 하 고 조직 기반 테스트4에 익숙한 몇 가지 제한 사항이 있으므로 피할 최소한의 허위-긍정 검색 속도, 샘플 영수증에서 72 시간 이내에 결과를 제공 합니다.
우리의 프로토콜 및 데이터 식별 낮은 풍부 RNA 이체 뿐만 아니라 혈액 기반 돌연변이 임상 연습에서의 테스트에 대 한 가능성에 대 한 강력한 테스트 시스템을 보여 줍니다. 실용적인 드라이버를 하지 않은 그 환자에 대 한 빠른 대상된 액체 생 검에 의해 확인 된 돌연변이 접근 같은이 하나, 더 광범위 한 게놈 및 프로테옴 조직과 혈액에서 테스트의 추가 광범위 한 임상 정보를 제공할 수 있습니다. 치료 계획을 지원 합니다.
공개
흠, 엘 제, 이다, 격차가의 직원 및 주식 보유 Biodesix, Inc.의 HM, 엘 제와 격차가 있다 Biodesix, 순환 비 작은 세포에 있는 유전 이체의 탐지에 대 한 진단 테스트 시스템에서 특허 출원에 공동 발명가 폐 암입니다.
감사의 말
우리는 우리의 공동 감사, 스티븐 존스, Nia Charrington, 박사 Dianna 만났으며, 및 그들의 분석 결과 디자인에 대 한 디지털 생물학 센터 (생물 라 드 주식 회사 캘리포니아)에서 사만 다 쿠퍼 박사 지원; Nezar Rghei와 박사 Moemen 프리미엄 (Norgen Biotek, 캐나다) 중요 한 조언을 최적화 RNA 추출 프로토콜; 그리고 섀 넌 캠벨, Scott Thurston, 제프 Fensterer, 섀 넌 Martello 및 지원에 대 한 Joellyn 노스 테스트 요구 사항 및 상업 모니터링.
자료
| Name | Company | Catalog Number | Comments |
| Ultrapure Distilled Water (DNAse, RNAse Free) (500 mL) | Life Technologies | 10977-015 | 1604071 |
| Ultrapure Distilled Water (DNAse, RNAse Free) (500 mL) | Life Technologies | 10977-015 | 1809353 |
| Nuclease-free water (molecular grade) | Ambion | AM9938 | 1604071 |
| Nuclease-free water (molecular grade) | Ambion | AM9938 | 1606077 |
| Phosphate Buffered Saline 1X, Sterile | Amresco | K812-500mL | 1446C189 |
| Phosphate Buffered Saline 1X, Sterile – 500 mL | Invitrogen | 10010023 | 1916C092 |
| RNase Zap (Life Tech) (250 mL) | Ambion | AM9780 | 353952 |
| Beta-Mercaptoethanol (BME) (250 mL) | CalbioChem | 6050 | W105B |
| OmniPur Ethyl Alcohol | CalbioChem | 4455-4L | 56054611 |
| OmniPur Ethyl Alcohol | CalbioChem | 4455-4L | 56238638 |
| Isopropyl Alcohol | VWR | 0918-4L | 2116C416 |
| TranscriptAid T7 High Yield Transcription Kit | Thermo Scientific | K0441 | 403648 |
| TranscriptAid T7 High Yield Transcription Kit | Thermo Scientific | K0441 | 288461 |
| DNase I | Thermo | K0441 | 371299 |
| QIAzol Lysis Reagent | Qiagen | 79306 | 54809699 |
| 20x TE buffer pH 8.0 | Alfa Aesar | J62388 | R13C548 |
| UltraPure Agarose | Invitrogen | 16500-100 | 552730 |
| 10x TBE buffer | Invitrogen | AM9863 | 353065 |
| Cell-Free RNA BCT | Streck | 218976 | 60110327 |
| Cell-Free RNA BCT | Streck | 218976 | 61900327 |
| Cell-Free RNA BCT | Streck | 218976 | 61480327 |
| Cell-Free RNA BCT | Streck | 218976 | 62320327 |
| Plasma/Serum Circulating and Exosomal RNA Purification Kit (Slurry Format) 50 preps | Norgen | 42800 | 585849 |
| Plasma/Serum Circulating and Exosomal RNA Purification Kit (Slurry Format) 50 preps | Norgen | 42800 | 588308 |
| Lysis Buffer | Norgen | 21205 | A5F61E |
| RNA Cleanup and Concentration Micro-Elute Kit (Norgen) 50 preps | Norgen | 61000 | 585848 |
| RNA Cleanup and Concentration Micro-Elute Kit (Norgen) 50 preps | Norgen | 61000 | 588309 |
| DNA Clean and ConcentratorTM- 5 200 preps (samples) | Zymo | D4014 | ZRC186976 |
| DNA Clean and ConcentratorTM- 5 200 preps (samples) | Zymo | D4014 | ZRC188077 |
| DNA Clean and ConcentratorTM- 5 200 preps (samples) | Zymo | D4014 | ZRC188413 |
| Collection Tubes 500 pack | Zymo | C1001-500 | N/A |
| SuperScript IV First Strand Synthesis System 200 rxn (samples) | Life Technologies | 18091200 | 391657 |
| SuperScript IV First Strand Synthesis System 200 rxn (samples) | Life Technologies | 18091200 | 392504 |
| SuperScript IV First Strand Synthesis System 200 rxn (samples) | Life Technologies | 18091200 | 448001 |
| SuperScript IV Reverse Transcriptase | Life Technologies | 18090200 | 451702 |
| Qubit HS RNA Assay Kit (500) | Life Technologies | Q32854 | 1745264 |
| Qubit assay tubes (500) | Life Technologies | Q32856 | 13416Q311 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64031651 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64063941 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64065740 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64065741 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64079083 |
| ddPCR Buffer Control for Probes | Bio-Rad | 1863052 | 64025320 |
| ddPCR Buffer Control for Probes | Bio-Rad | 1863052 | 64052358 |
| gBlock KIF5B-RET K15:R12 | IDT | 151004172 | 4-Oct-16 |
| gBlock KIF5B-RET K16:R12 | IDT | 151004173 | 4-Oct-16 |
| gBlock KIF5B-RET K22:R12 | IDT | 151004174 | 4-Oct-16 |
| gBlock KIF5B-RET K23:R12 | IDT | 151004175 | 4-Oct-16 |
| gBlock KIF5B-RET K24:R11 | IDT | 151004176 | 4-Oct-16 |
| gBlock KIF5B-RET K24:R8 | IDT | 151004177 | 4-Oct-16 |
| gBlock CCDC6-RET C1:R12 | IDT | 151004178 | 4-Oct-16 |
| gBlock TRIM33-RET T14:R12 | IDT | 151004179 | 4-Oct-16 |
| RET exon 8 RT Gene Specific Primer | IDT | 150554385 | 28-Sep-16 |
| 5’-CTCCACTCACACCTG-3’ | IDT | 150554385 | 28-Sep-16 |
| RET exon 11 RT Gene Specific Primer | IDT | 150554384 | 28-Sep-16 |
| 5’-GCAAACTTGTGGTAGCAG-3’ | IDT | 150554384 | 28-Sep-16 |
| RET exon 12 RT Gene Specific Primer | IDT | 150554383 | 28-Sep-16 |
| 5’-CTGCCTTTCAGATGGAAG-3’ | IDT | 150554383 | 28-Sep-16 |
| gBlock CD74-ROS1 C6:R34 | IDT | 152324366 | 15-Nov-16 |
| gBlock CD74-ROS1 C6:R32 | IDT | 152324367 | 15-Nov-16 |
| gBlock SDC4-ROS1 S2:R32 | IDT | 152324368 | 15-Nov-16 |
| gBlock SDC4-ROS1 S2:R34 | IDT | 152324369 | 15-Nov-16 |
| gBlock S13del2046-ROS1 S13del2046:R32 | IDT | 152324370 | 15-Nov-16 |
| gBlock S13del2046-ROS1 S13del2046:R34 | IDT | 152324371 | 15-Nov-16 |
| gBlock EZR-ROS1 E10:R34 | IDT | 152324372 | 15-Nov-16 |
| gBlock TPM3-ROS1 T8:R35 | IDT | 152324373 | 15-Nov-16 |
| ROS1 exon 34 RT Gene Specific Primer | IDT | 152704983 | 21-Nov-16 |
| 5’-CCTTCCTTGGCACTTT-3’ | IDT | 152704983 | 21-Nov-16 |
| ROS1 exon 35 RT Gene Specific Primer | IDT | 152704985 | 21-Nov-16 |
| 5’-CTCTTGGGTTGGAAGAGTATG-3’ | IDT | 152704985 | 21-Nov-16 |
| ALK Gene Specific Primer | IDT | 140035422 | 26-Aug-16 |
| 5’-CAGTAGTTGGGGTTGTAGTCG-3’ | IDT | 140035422 | 26-Aug-16 |
| EML4-ALK Cell line pellet | Horizon Discovery | N/A | 11-Jun-15 |
| SLC34A2-ROS1 Cell line pellet | Horizon Discovery | N/A | 11-Jun-15 |
| CCDC6-RET Cell line pellet | Horizon Discovery | N/A | 11-Jun-15 |
| Human Brain Total RNA | Ambion | AM7962 | 1703548 |
| PrimePCR ddPCR Expert Design Assay: K15:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K16:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K22:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K23:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K24:R11 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K24:R8 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: C1:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: T14:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: C6:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: C6:R32 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S2:R32 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S2:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S13del2046:R32 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S13del2046:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: E10:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: T8:R35 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| (version 2) | Bio-Rad | 12003909 | 213939881 |
| PrimePCR ddPCR Expert Design Assay: ROS1 Multiplex (version 3.2) | Bio-Rad | N/A | 13-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: ROS1 Multiplex (version 3.2) | Bio-Rad | N/A | 20170112v3.2 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 212851151 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 207383915 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 195995635 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 212851152 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 213949301 |
| PrimePCR ddPCR Expert Design Assay: EML4-ALK | Bio-Rad | 12003909 | 20160914 |
| PrimePCR ddPCR Expert Design Assay: EML4-ALK | Bio-Rad | 12003909 | 211383227 |
| Droplet Generation Oil for Probes | Bio-Rad | 186-3005 | 1065C220 |
| Droplet Generation Oil for Probes | Bio-Rad | 186-3005 | 64052953 |
| Droplet Generation Oil for Probes | Bio-Rad | 186-3005 | 64052358 |
| Automated Droplet Generation Oil for Probes (20x96) | Bio-Rad | 186-4110 | 1065C320 |
| Automated Droplet Generation Oil for Probes (20x96) | Bio-Rad | 186-4110 | 64052952 |
| Automated Droplet Generation Oil for Probes (20x96) | Bio-Rad | 186-4110 | 64064127 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000065883 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000084276 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000079928 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000084395 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000084634 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20160627 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20161107 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20161206 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20161216 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20170125 |
| Pipet Tips for Automated Droplet Generator | Bio-Rad | 1864120 | PR125340 |
| DG32 Cartridge for Automated Droplet Generator (10-96 well plates) | Bio-Rad | 186-4108 | 206894 |
| DG32 Cartridge for Automated Droplet Generator (10-96 well plates) | Bio-Rad | 186-4108 | 206893 |
| Pierceable Foil Heat Seal | Bio-Rad | 1814040 | 1409850 |
| Pierceable Foil Heat Seal | Bio-Rad | 1814040 | 100402 |
| Pierceable Foil Heat Seal | Bio-Rad | 1814040 | 145851 |
| Microseal 'B' seals | Bio-Rad | MSB1001 | BR00428490 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64039089 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64049253 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64049255 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64081870 |
| DNA Lo Bind Tube 0.5 mL | Eppendorf | 22431005 | E1629620 |
| DNA Lo Bind Tube 1.5 mL | Eppendorf | 22431021 | F16698K |
| DNA Lo Bind Tube 2 mL | Eppendorf | 22431048 | E160610I |
| 50 mL Conicals, Polypropylene (25) | Thermo | 339652 | G5ZF5W8118 |
| TempAssure PCR 8-Strips, Optical Caps, Natural, polypropylene (120) | USA Scientific | 1402-4700 | 16202 |
| For Rainin LTS Pipettors 0.5-20 µL tips | Pipette.com | LF-20 | 40155-642C4-642C |
| For Rainin LTS Pipettors 5-200 µL tips | Pipette.com | LF-250 | 40154-642C4-642B |
| Tips LTS 200 ul Filter 960/10 RT-L200F (10 boxes) | Rainin | 17002927 | 1635 |
| Pipet Tips, 10 ul TipOne RPT ultra low retention filter tip refill cassette, sterile | USA Scientific | 1181-3710 | F1175551-1108 |
| Pipet Tips, 10 ul TipOne RPT ultra low retention filter tip refill cassette, sterile | USA Scientific | 1181-3710 | F118054L-1720 |
| Pipet Tips, 100 ul TipOne RPT ultra low retention filter tip refill cassette, sterile (10x96) | USA Scientific | 1180-1740 | 0014961Q-2501 |
| Pipet Tips, 200 ul TipOne RPT ultra low retention filter tip refill cassette, sterile | USA Scientific | 1180-8710 | E116684P-1540 |
| Pipet Tips, 1000 ul XL TipOne RPT ultra low retention filter tip refill cassette, sterile (10x96) | USA Scientific | 1182-1730 | F118815P |
| 5 mL Standard Racked Gilson-fit Reference Tips | Scientific Specialties | 4411-00 | 14312 |
| Combitips advanced, 0.1 mL Biopur | Eppendorf | 003 008 9618 | F165414H |
| Combitips advanced, 0.2 mL Biopur | Eppendorf | 0030 089.626 | F166689J |
| Combitips advanced, 5 mL Biopur | Eppendorf | 0030.089 669 | F166054J |
| Combitips advanced, 50 mL Biopur | Eppendorf | 003.008.9693 | F166055I |
| Reagent Reservoir | VWR | 89094-680 | 141500 |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | E163697P |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | F165029I |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | F165028G |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | E163697P |
| Twin tec PCR Plate 96, semi-skirted, Green | Eppendorf | 951020346 | F166183K |
| Equipment Type | Equipment ID | ||
| Analytical Balance | EQP0125 | ||
| Cryogenic Freezer 1, -80oC | EQP0095 | ||
| Refrigerator 6.1 cu ft GP06W1AREF | EQP0139 | ||
| -20oC Freezer | EQP0140 | ||
| Beckman Coulter Microfuge 22R | EQP0025 | ||
| Beckman Coulter Microfuge 22R | EQP0124 | ||
| Thermo Scientific Hereaus Megafuge 8 | EQP0104 | ||
| Mini Centrifuge | EQP0131 | ||
| Mini Centrifuge | EQP0136 | ||
| Mini Centrifuge | EQP0134 | ||
| Mini Centrifuge | EQP0235 | ||
| Mini Centrifuge | EQP0216 | ||
| Thermo Scientific HeraTherm Incubator | EQP0105 | ||
| Pipette 0.1 - 2.5 μL | EQP0182 | ||
| Pipette 0.1 - 2.5 μL | EQP0072 | ||
| Pipette 0.1 - 2.5 μL | EQP0070 | ||
| Pipette 0.5-10 μL | EQP0218 | ||
| Pipette 0.5-10 μL | EQP0075 | ||
| Pipette 0.5-10 μL | EQP0169 | ||
| Pipette 0.5-10 μL | EQP0074 | ||
| Pipette 0.5-10 μL | EQP0147 | ||
| Pipette 2 - 20 μL | EQP0128 | ||
| Pipette 2 - 20 μL | EQP0160 | ||
| Pipette 2 - 20 μL | EQP0018 | ||
| Pipette 2 - 20 μL | EQP0146 | ||
| Pipette 10 - 100 μL | EQP0079 | ||
| Pipette 10 - 100 μL | EQP0181 | ||
| Pipette 10 - 100 μL | EQP0085 | ||
| Pipette 10 - 100 μL | EQP0077 | ||
| Pipette 20 - 200 μL | EQP0088 | ||
| Pipette 20 - 200 μL | EQP0087 | ||
| Pipette 20 - 200 μL | EQP0231 | ||
| Pipette 100 - 1000 μL | EQP0050 | ||
| Pipette 100 - 1000 μL | EQP0158 | ||
| Pipette 100 - 1000 μL | EQP0217 | ||
| Pipette 100 - 1000 μL | EQP0082 | ||
| Pipette 100 - 1000 μL | EQP0183 | ||
| Pipette 100 - 1000 μL | EQP0083 | ||
| Pipette 5 mL | EQP0153 | ||
| Timer | S/N 140623950 | ||
| Hamilton SafeAire VAV Fume Hood | EQP0206 | ||
| Biosafety Cabinet | EQP0205 | ||
| Biosafety Cabinet | EQP0204 | ||
| Qubit 3.0 | EQP0102 | ||
| Benchmark Digital Heat Block | EQP0108 | ||
| Benchmark Digital Heat Block | EQP0231 | ||
| Polaroid Z2300 Instant Print Digital Gel Camera with WiFi and 16GB SDHC memory card | EQP0111 | ||
| Electrophoresis Power Unit | EQP0113 | ||
| Electrophoresis Small Gel Box | EQP0116 | ||
| Maestro Transilluminator | EQP0118 | ||
| Microwave | EQP0215 | ||
| Multichannel 8-well Pipette 2 - 20 μL | EQP0207 | ||
| Multichannel 8-well Pipette 10 - 100 μL | EQP0090 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0094 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0161 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0162 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0163 | ||
| Vortex Genie 2 | EQP0052 | ||
| Vortex Genie 2 | EQP0007 | ||
| Vortex Genie 2 | EQP0132 | ||
| Vortex Genie 2 | EQP0137 | ||
| Vortex Genie 2 | EQP0135 | ||
| Air Clean PCR Workstation | EQP0203 | ||
| Air Clean PCR Workstation | EQP0096 | ||
| Air Clean PCR Workstation | EQP0148 | ||
| Air Clean PCR Workstation | EQP0097 | ||
| QX200 Droplet Generator | EQP0202 | ||
| QX200 Droplet Generator | EQP0121 | ||
| Automated Droplet Generator | EQP0179 | ||
| PX1 PCR Plate Sealer | EQP0123 | ||
| PX1 PCR Plate Sealer | EQP0186 | ||
| C1000 Touch Cycler w/96W FS RM | EQP0120 | ||
| S1000 Cycler w/96W FS RM | EQP0174 | ||
| S1000 Cycler w/96W FS RM | EQP0173 | ||
| T100 Thermal Cycler | EQP0180 | ||
| T100 Thermal Cycler | EQP0175 | ||
| QX200 Droplet Reader | EQP0194 | ||
| QX200 Droplet Reader | EQP0122 |
참고문헌
- Ignatiadis, M., Lee, M., Jeffrey, S. S. Circulating Tumor Cells and Circulating Tumor DNA: Challenges and Opportunities on the Path to Clinical Utility. Clin Cancer Res. 21 (21), 4786-4800 (2015).
- Alix-Panabieres, C., Pantel, K. Clinical Applications of Circulating Tumor Cells and Circulating Tumor DNA as Liquid Biopsy. Cancer Discov. , (2016).
- Paxton, A. Is Molecular AP testing in sync with guidelines. CAP Today. , (2014).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA Oncol. , (2016).
- Sozzi, G., et al. Quantification of free circulating DNA as a diagnostic marker in lung cancer. J Clin Oncol. 21 (21), 3902-3908 (2003).
- Oxnard, G. R., et al. Noninvasive detection of response and resistance in EGFR-mutant lung cancer using quantitative next-generation genotyping of cell-free plasma DNA. Clin Cancer Res. 20 (6), 1698-1705 (2014).
- Best, M. G., et al. RNA-Seq of Tumor-Educated Platelets Enables Blood-Based Pan-Cancer, Multiclass, and Molecular Pathway Cancer Diagnostics. Cancer Cell. 28 (5), 666-676 (2015).
- Rodriguez, M., et al. Different exosome cargo from plasma/bronchoalveolar lavage in non-small-cell lung cancer. Genes Chromosomes Cancer. 53 (9), 713-724 (2014).
- Kalluri, R. The biology and function of exosomes in cancer. J Clin Invest. 126 (4), 1208-1215 (2016).
- Mellert, H., et al. Development and Clinical Utility of a Blood-Based Test Service for the Rapid Identification of Actionable Mutations in Non-Small Cell Lung Carcinoma. J Mol Diagn. 19 (3), 404-416 (2017).
- Qin, J., Williams, T. L., Fernando, M. R. A novel blood collection device stabilizes cell-free RNA in blood during sample shipping and storage. BMC Res Notes. 6, 380 (2013).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biotechniques. 15 (3), 532-537 (1993).
- Kohno, T., et al. Beyond ALK-RET, ROS1 and other oncogene fusions in lung cancer. Transl Lung Cancer Res. 4 (2), 156-164 (2015).
- Takeuchi, K., et al. ROS1 and ALK fusions in lung cancer. Nat Med. 18 (3), 378-381 (2012).
- Rimkunas, V. M., et al. Analysis of receptor tyrosine kinase ROS1-positive tumors in non-small cell lung cancer: identification of a FIG-ROS1 fusion. Clin Cancer Res. 18 (16), 4449-4457 (2012).
- Tsuta, K., et al. RET-rearranged non-small-cell lung carcinoma: a clinicopathological and molecular analysis. Br J Cancer. 110 (6), 1571-1578 (2014).
- Forbes, S. A., et al. COSMIC: somatic cancer genetics at high-resolution. Nucleic Acids Res. 45 (1), 777-783 (2017).
- Salgia, R. Diagnostic challenges in non-small-cell lung cancer: an integrated medicine approach. Future Oncol. 11 (3), 489-500 (2015).
- Cagle, P. T., Raparia, K., Portier, B. P. Emerging Biomarkers in Personalized Therapy of Lung Cancer. Adv Exp Med Biol. 890, 25-36 (2016).
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proc Natl Acad Sci U S A. 96 (16), 9236-9241 (1999).
- Oxnard, G. R., et al. Association Between Plasma Genotyping and Outcomes of Treatment With Osimertinib (AZD9291) in Advanced Non-Small-Cell Lung Cancer. J Clin Oncol. 34 (28), 3375-3382 (2016).
- Reckamp, K. L., et al. A Highly Sensitive and Quantitative Test Platform for Detection of NSCLC EGFR Mutations in Urine and Plasma. J Thorac Oncol. 11 (10), 1690-1700 (2016).
- Yanagita, M., et al. A prospective evaluation of circulating tumor cells and cell-free DNA in EGFR mutant non-small cell lung cancer patients treated with erlotinib on a phase II trial. Clin Cancer Res. , (2016).
- Abbosh, C., et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 545 (7655), 446-451 (2017).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-534 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유