JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
영양 탄소 전송 및 무척 추 동물 소비자의 지질 대사에 대 한 통찰력을 제공 합니다 지방산 13C Isotopologue 프로 파일링
요약
지방산 영양 마커 접근, 즉, 전체 분자와 소비자 조직으로 전송으로 지방산의 동화 없이 또는 사소한 수정, 작은 토양 무척 추 동물의 지방 산 성 대사에 지식 격차에 의해 방해 된다. Isotopologue 프로 파일링 풀 영양 상호 작용 하는 귀중 한 도구로 제공 됩니다.
초록
지방산 (FAs) 식품 웹 생태에 유용한 biomarkers는 그들은 일반적으로 완전 한 분자로 동화 하 고 미성년자 또는 다른 영양 수준 사이 식이 라우팅 수 있도록 수정, 소비자 조직으로 전송 때문에. 그러나, FA 영양 마커 접근 토양 동물의 지질 대사에 한정 된 지식에 의해 아직도 방해 된다. 이 연구는 지방산 물질 대사 경로 두 개의 광범위 한 토양 Collembola, Protaphorura fimata , Heteromurus nitidus에 추적 프로그램으로 완전히 이라는 팔 미트 산 (13C16:0, 99 원자 %)를 사용합니다. 운명과이 전조의 대사 수정, 조사 하기 위하여 isotopologue 프로 파일링 하는 방법 제시, 단일 이온 모니터링을 사용 하는 질량 분석에 의해 수행. 또한, 업스트림 실험실 실험 먹이 추출 및 지배적인 지질 분수 (중립 지질, 인지질) 및 관련된 수식 계산의 메 틸 화 설명 되어 있습니다. Isotopologue 프로 파일링 하지만 수익률 13C 전조를 분류에서 파생 된 지방산에서 전체 13C 농축 않지만 isotopologues 부모 이온 (즉, FA 분자 이온의 질량 초과의 패턴 생성 M+) 각각의 표시 된 하나 이상의 질량 단위 (M+ 1, M2, M+ 3, 등)에 의해 FA. 이 지식을 de novo 생 합성에 비해 완전히 소비 FA의 식이 라우팅의 비율에 결론을 수 있습니다. Isotopologue 프로 파일링은 풀 영양 상호 작용을 토양 동물에서 지방산 대사의 평가 위해 유용한 도구로 서 좋습니다.
서문
토양 등 암호 서식 지, 영양 관계 주소로 어려운 고 추가 동물군의 작은 크기에 의해 제한 됩니다. 지난 10 년간 필드 조건1,2,3토양 동물의 먹이 전략을 정의 하기 위한 생체로 지방산의 사용에 특히 생화학 생태학, 발전을 보이고 있다. 이것은 리소스에서 지방산은 전체 분자 소비자 조직에 통합 될 수 있다는 사실에 기반, 프로세스 식이 라우팅4되 나. 지방산의 양도 3 영양 단계, 즉, 곰 팡이에서 Collembola5선 충을 통해 보고 되었습니다. 최근, 육 식 동물6,7 여겨졌다 고 토양 음식 웹에서 영양 마커로 지방산에 대 한 첫 리뷰 게시8,9되었습니다.
영양 상호 작용에 대 한 더 자세한 정보는 지방산 안정 동위 원소 (FA-SIP) 조사에 의해 달성 했다. 13C의 결정 /12C 비율 지방산 다이어트와 소비자에에서 돌리다 이진 링크를 관련된 탄소 흐름을 예측 하 고 지상파에 고용 되어 신선한 물, 그리고 해양 식품 거미줄10,11 ,,1213. 기본 가정은 식이 라우트된 지방산 효소 프로세스; 적용 되지 않습니다. 따라서, 그들의 13C 신호, 즉, 13C /12C 소비자에서 지방산의 비율은 다이어트1에 비슷합니다. 그러나, 먹이 사슬의 13C 서명의 점진적인 고갈 영양 연구14,,1516에 FA SIP의 광범위 한 응용 프로그램을 방해 함으로써 수 중 시스템에서 보고 되었습니다. 또한, 지상파 식품 웹에서 대부분 무척 추 동물의 지질 대사에 대 한 지식을 여전히 제한 됩니다.
소비자에서 지질 물질 대사 경로의 이해 영양 마커 지방산 식품 웹 생태에 양적 탄소 흐름의 결정에 대 한 의미의 사용을 위해 필수적 이다. 이 고려해, 13C-isotopologue 프로 파일링, 유망한 방법은 어떤 생물 학적 시스템17, 탄소 물질 대사의 조사에 대 한 어떤에 원리를 적용할 수 있습니다. 13탄소 C 표시 기판, 13C에서 대사 네트워크의 배포의 도입에 따라 하는 것은 소비자 쇼 특정 isotopologue 배포에서에서 생성 된 대사 제품부터 추적. 이 양적 핵 대사 공명 분광학18,19 또는 질량 분석20,21그것의 더 높은 때문에 낮은 바이오 매스와 후자에 선호 생물 학적 샘플에 의해 평가 될 수 있다 감도입니다.
Isotopologue 프로 파일링 성공적으로 아미노산에 적용 되었으며 vivo에서 탄소 물질 대사 세균성 병원 체17,,2223, 지방산에서 구현에 대 한 통찰력을 제공 하지만 산 뒤에 느껴 지 있다. 안정 동위 원소 표시 전조 지방산, 식이 라우팅 또는 β-산화, 토양 무척 추 동물 소비자에 통해 저하의 운명에 첫번째 상세한 분석 최근 수행한 Menzel 외. 24. 여기, 13C 지방산 이어서 자주 토양 무척 추 동물, Collembola, 키 하위의 isotopologue 분석 분류 관 실험 방법론 기본 제공 됩니다. 이 microarthropods는 좋은 모델 그들은 중요 한 구성 요소는 잘 그들의 영양 마커 지방산8,25에 대 한 조사를 하 고 토양 먹이 그물의 형성.
소비자에서 지질 물질 대사 경로의 이해 영양 마커 지방산 식품 웹 생태에 양적 탄소 흐름의 결정에 대 한 의미의 사용을 위해 필수적 이다. 현재 프로토콜 먹이 실험, 그리고 추출 및 지배적인 지질 분수 (중립 지질, 인지질)의 메 틸 화에 대 한 생 화 확 적인 절차 Collembola에서 실험실을 위한 설계 및 설정 제공 합니다. 그것은 isotopologue 구성 지방산의 질량 분석에 의해 분석 되는 방법을 보여 줍니다 고 관련된 수식 및 계산에 설명 합니다. 이 절차에서 결과: isotopologues 초과 하나 이상 (즉, 지방산 분자 이온 M+) 부모 이온의 질량의 비율 (i) 질량 단위 (M+ 1, M2, M+ 3, 등) 및 (ii) 전체 13 C 농축 지방산에서 13C 이라는 전조에서 파생. 이 방법은 일반적으로 이들은 성공적인 레이블 통풍 관을 위해 제어 된 조건 하에서 충분 한 수량에 culturable 및 후속 전제에 다른 어떤 약탈자 먹이 상호 작용에 적용할 수 있습니다 Collembola 사용, 비록 확인입니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
설명된 프로토콜 동물 윤리의 경쟁력에서 떨어지지 않습니다. 그러나 때 사람들이 더 높은 동물 설명된 프로토콜 적응, 주의 기관 동물 윤리 위원회 동물 처리에 대 한 프로토콜을 승인 했다.
1입니다. 동물의 경작
참고: 모든 확고 프로토콜26,,2728를 기반으로하는 실험 단계 설명 했다. Biotests 실험실에서 쉽게 culturable 생물의 지속적인 공급을 해야합니다. 여기, Collembola 종 Protaphorura fimata (Gisin, 1952)와 Hetermurus nitidus (템플턴, 1835) 사용 되었습니다. 두 종의 하 생산적인 실험실 문화 베이커의 효 모와 먹이로 유지 하기 위해 수 있습니다.
- 꽉 끼는 뚜껑 플라스틱 microcosms에 (지름 7 c m, 높이 4.5 c m), 활성 탄, 석고의 혼합물을 추가 하 고 매우 습 한 사육 기판 (그림 1A) 제공을 증류수.
- 때 충분 한 기질, 예를 들어, 10 microcosms 일괄 처리에 대 한 microcosms 믹스를 준비. 석고 (225 g)의 혼합 9 부분과 건조 활성 탄 (25 g) 함께 석고 냄비에 1 일부 증류수 (250 mL)의 신중 하 게 약 10 개 부분을 추가 하 고 실 온에서 교 반 없이 5 분 동안 앉아 있게.
- 시계 방향으로 두꺼운 짙은 일관성 달성 될 때까지 공기 방울을 피하기 위해 적당 한 속도로 실험실 스푼으로 저 어. 즉시 microcosms 약 1 ㎝의 높이에 붓으십시오.
- 벤치에 두 드려서 부드럽고 소용돌이 여 석고를 부드럽게. 참고 구멍 (기포의 무작위 제품) 및 고 랑 (적극적으로 메 마른 주걱으로 추가) 산란 거기 비옥한 Collembola을 장려 수 있습니다. 이 연구는 구멍과 같은 재현할 조건 데 찬성 랑 피 했다. 그러나, 시연을 위해 그림 1B 는 일부 구멍을 선물 한다.
- 실내 온도;에 약 1-2 일 건조 허용 60 ° C에 외피는 1-2 h 그 시간을 줄일 수 있습니다.
- 기판은 약간 젖은 때까지 피 펫을 수돗물을 추가 하 여 사용 하기 전에 microcosms 축. 소 우주 Collembola 부드러운 표 피 있고 건조 쉽습니다 정기적으로 증류수를 추가 하 여 촉촉한 유지.
- 쉽게 간단한 흡입 관, 즉, 약 25 cm 긴 실리콘 튜브를 사용 하 여 석고 베이스 Collembola 전송 튜브에 동물의 흡입을 방지 하기 위해 작은 메쉬 장착 피 펫 팁으로 오래. 또는, 작은 브러쉬 bristles에 준수 하도록 함으로써 동물을 전송.
- (단계 1.2 참조) 전송 30 갓 Collembola 새로운 microcosms로 부 화 하 고과 립된 건조 베이커의 효 모 (칼 끝)에 대 한 음식 제공 (그림 1B); 일주일에 두 번 이상 갱신. 계획 3 독립적인 샘플링 하루; 복제 두 일 0-7과 14. 어둠 속에서 15 ° C에서 품 어. 일정 한 온도 필수 유지, 지방산으로는 변경 막 유동성에 대 한 요구 사항에 맞게 동물 물질 대사에 의하여.
- 균질 13C를 노출 실험을 시작 하기 전에 4 주 동안 Collembola 베이커의 효 모와 피드 /12C 신호 및 지방산에서 패턴. 흡입 튜브 또는 브러쉬를 사용 하 여 모든 계란 (그림 1C), 찌 끼 펠 릿을 제거 하 고 exuviae 정기적으로 동물 수에 대 한 피드 그들 그로 인하여 그들의 지질 프로 파일을 변경.

그림 1: Collembola의. (A) 소 사육 기판, 석고, 활성 탄 및 증류수의 말린된 혼합 가득. (B)와 (C) Protaphorura fimata 문화;의 대표적인 표본 참고 건조 베이커의 효 모 사용 음식 근원으로 또한 번 식 기판 (검은색 화살표)에 구멍으로 작은 너 겟 (B) 두 계란 (흰색 화살표) 뿐만 아니라 (C). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
2. 라벨 다이어트, 수확, 그리고 샘플 처리
- 라벨
- Collembola 문화를 설정한 후 4 주는 30 명의 새로운 microcosms 놓고 어둠 속에서 15 ° C에서 품 어.
- 베이커의 효 모는 전적으로 13C 라는 팔 미트 산 (13C16:0, 99 원자 %)는 비율 0.5:1, 예를 들어, 5 g에 주걱으로 13C 라는 팔 미트 산 베이커의 효 모와 혼합 하 여 포함 된 그들을 먹이로 펄스 레이블 소개 13 C16:0와 10 g 베이커의 효 모 건조. 각 축소판에 칼 팁에 대 한 놓습니다.
- 6 h 후 완전히 레이블이 베이커의 누 룩과 식품 표시이 대체 합니다.
-
더 재배
- 실험의 과정에서 효 모 다이어트 3 일 마다 갱신 그리고 Collembola 그 기간 내에 소비 무엇 보다 높은 금액을 추가. 가장 중요 한 것은, Collembolan 계란, 찌 끼 펠 릿 및 exuviae 제공 된 음식에 동물에 의해 독점 공급을 보장 하기 위해 정기적으로 제거 하는 흡입 관 또는 브러시 사용 합니다.
- 수확
- 7 일까지 매일 안전 microcosms 샘플 14 일에 각 샘플링 시간;에 3 개의 독립적인 복제를 수집 다른 샘플링 시간 수 있습니다.
- 테 플 론 코팅 나사 모자, 각 샘플에 대 한 하나를 갖춘 10 mL 유리 튜브를 준비 합니다. 미리 유리 세탁기에이 관을 청소 하 고 이후에 이온된 수로 두 번 씻어. 마지막으로, 소수 성의 모든 흔적을 제거 하려면 오염 물질 세척 두 번 클로 프롬 (HPLC 학년)의 2 개 mL를 추가 하 여 소용돌이 약 및 용 매를 삭제.
- 컨트롤 샘플 (0 일) 하루 0 샘플으로 사전 문화에서 3 30 비공개 Collembola 걸릴.
- 노출 된 샘플에 대 한 (1 일 및 이후), 걸릴 각 사례 3 30에에서 매일 샘플 문화에서 판매인 Collembola을 노출 13C 라는 팔 미트 산 베이커의 누 룩의 믹스와 함께 먹이.
- 울트라-중량에 의해 Collembola 신선한 체중을 기록 합니다. 동물 배기 또는 적절 한 규모-팬을 브러시를 사용 하 여 전송 합니다. 에 무게의 규모-팬, 충격-멋진 동물 (2 h-80 ° C) 전에 동안 Collembola의 쉬운 취급을 보장 합니다. 또는, 10 분 CO2 스트림 수 있습니다 안전 하 게 동물을 기 절.
- 직접 후 무게 넣어 동물 규모 팬에서 신중 하 게 10 mL 유리 시험관에. 관을 분석까지 메탄올 (HPLC 등급) 및 저장소-20 ° C에서의 1 mL에 채우십시오.
참고:이 단계 이후부터 피하기 위해 유기 용 매 관련; 플라스틱 장비와 샘플 처리 대신 디스펜서와 유리 용기로 용 매에 대 한 적합 한 펫을 사용 합니다.
3. 동물 조직 및 Methanolysis 지질 추출
- 3 유리 테스트-튜브 (테 플 론 코팅 스크류 캡 장착) 빈 값으로 메탄올의만 1 mL를 포함 하는 일괄 처리 당을 준비 합니다. 중요 한 것은, 또는 추가 유리 펫 이나 씻어 서 클로 프롬/메탄올 용 매 저항 분배기에 의해서만이 프로토콜에 사용 된 용 매를 전송 합니다.
- 지질 추출 과정의 시작 부분에 저장 (또는 블랭킹) 증발;에 의해 적용 된 메탄올 감소 소형 벤치탑 회전 진공 집중 장치 (RVC) 진공 펌프와 콜드 트랩을 갖춘 것이 좋습니다. 오픈 튜브는 RVC에 전송 하 고 20 분 200 hPa의 50 ° C와 진공 압력에 드라이까지 증발.
- 각 샘플 (공백 포함)를 단상 추출 용 매 (chloroform/methanol/0.05 M 인산 염 버퍼 1:2:0.8, pH 7.4)의 5 mL을 추가 하 고 흔들어 하룻밤 실 온에서 Collembolan 지질을 추출 (~ 200 rpm).
- 새로운 튜브에 용 매를 전송 하 고 다시는 추가 2.5 mL 추출 용 매를 가진 3 h 동안 흔들어 하 여 샘플을 추출. 그 후, 두 단계; 추출 물 결합 유리 펫 파스퇴르를 사용 하 여 것이 좋습니다. 0.8 mL와 증류수, 0.8 mL 클로 프롬의 추가 다음 믹스 하 고 5 분 동안 20 ° C에서 2000 g에서 원심. 마지막으로, 수성의 분리에 대 일 분 동안 서 서 클로 프롬을 샘플을 수 있도록 단계.
- 지방산 패턴 분석에 대 한 중립 지질, glycolipid, 그리고 인지질 분수 Collembola의 총 세포 지질을 나눕니다.
- 각 샘플에 대 한 준비는 실리 카 산 열 (0.5 g silicic 산, 메쉬 상업 열 100-200 µ m 크기, 테이블의 자료를 참조)의 클로 프롬 (늘어진) 1 mL를 추가 하 여. 이 과정을 속도를, 일반적으로 고체 상 추출 크로마토그래피에서 사용 하는 진공 블록에 열을 탑재 합니다. 나일론 바늘;를 사용 하지 마십시오 튜브 위에 스테인레스 스틸을 사용 합니다.
- 클로 프롬 늘어진 사용 후는 통과 열 전송 완전 한 낮은 클로 프롬 단계 각 샘플의 개별 열에. 이 절차를 단순화 하기 위해 위 수성 단계를 미리 제거할 수 있습니다. 그러나 유리의 파스퇴르 펫을 사용 하 여, 열 밖으로 건조 하지 마십시오 주의.
- 연속적으로 지질 분수 (포함 중립 지질 지방산, NLFAs), 클로 프롬의 5 mL와 10 mL의 아세톤 (glycolipids-이 프로젝트에서 분석 되지)와 메탄올 (를 포함 하 여 인지질 지방산, PLFAs)의 5 mL elute. 개별 유리 용기에 각 분수를 수집 합니다.
- 추출의 끝에, 클로 프롬 (NLFAs)과 RVC에 증발을 통해 메탄올 (PLFAs)을 줄일 수 있습니다. 오픈 튜브는 RVC 전송과 증발, 건조까지 ~ 60 ° C 및 24 hPa의 진공에서 90 분.
- 지질 (NLFA 및 PLFA 분수) 웰 치 (1991)29 (수산화 나트륨의 45 g, 메탄올, 150 mL와 증류수 150ml) 수산화 나트륨-메탄올 솔루션의 1 mL의 추가에서 프로토콜을 다음의 비 누화를 시작 하 고 100에 품 어 물 욕조에 30 분 동안 ° C. 2 분 동안 얼음 물에 샘플을 냉각 다음 샘플 다시 벤치에 넣고 실 온에서 작업을 계속.
- 공란을 포함 하 여 각 샘플에는 내부 표준을 추가 합니다. 지방 산 성 실험 생물; 없는 일반적인 선택 또한 포화 지방산을 사용 하 여 분열 하 여 손실을 최소화 하 고 중간 체인 길이와 분자를 선택. 다양 한 용도로, 홀수 nonadecanoic 산 (19:0) 작품 잘. 그래서, isooctane에서 0.74 m m 솔루션의 30 µ L를 추가 합니다. 정확한 수량은 매우 중요 한-는 중량으로 피 펫의 정밀도 사전에 확인 해야 합니다.
- 2 분 동안 얼음에 급속 하 게 물 욕조에 멋진 10 분 동안 80 ° C에서 품 어, 염 산-메탄올 (메탄올의 275 mL와 6.0 N 염 산의 325 mL 혼합)의 2 개 mL를 추가 합니다. 이 단계는 시간과 온도 민감한; 함께 사용 하 여 80 ± 1 ° C와 10 ± 1 분 확인 얼마나 많은 샘플 수 물 목욕으로가 서 한 번에 80 ° c.를 유지
참고:이 절차는 지방산 메 틸 에스테 르 (FAMEs), 증발 가스 크로마토그래피에 대 한 안정 즉, 지방산 analytes에에서 발생 합니다. - 마지막으로, 1.25 mL의 헥 산/메 틸 제 3 부 틸 에테르 (1:1)를 추가 하 고 부드럽게 10 분 후 5 분에 대 한 2000 g에서 원심 분리기에 대 한 바위 아래 단계 및 계속 최고 단계 FAMEs;의 구성 제거 유리 펫 파스퇴르를 사용 합니다. 세척 단계에 대 한 수성 수산화 나트륨 (NaOH 900 mL의 증류수에 용 해의 10.8 g)의 3 mL를 추가 합니다.
- 록 하 고 다시 원심 분리기입니다.
- 받아 완전 한 위 포함 하는 지질 단계 유리 파스퇴르 피 펫 및 전송 테 플 론 심장 장착 된 가스 크로마토그래피 샘플 유리병을 사용 하 여. 이 GC 측정에 문제가 발생할 것입니다 수성 단계의 작은 금액을 포함 하지 마십시오. 유리병을 캡슐화 하 고 분석까지-20 ° C에서 저장.
4. GC-FID, 지방산의 정량화
- 가스 착 색 인쇄기를 사용 하 여 식별 하 고 지질 Collembola (동물)의 NFLA 및 PLFA 분수에 FAMEs 계량. 가스 크로마 토 그래프 (GC) 불꽃 이온화 검출기 (FID)를 갖추고 설립 및 검증 된 장비30입니다.
- FAMEs의 식별을 위해 명성 표준에 그 샘플에 봉우리의 보존 기간을 비교 합니다. 이들은 키 FAMEs 식품과 생물의 다양 한 취재의 질적 또는 양적 표준 혼합입니다.
- 조사 유기 체 그룹 및 실험적인 다이어트에 대 한 대표 FAs 구성 된 명성 표준 혼합물을 사용 합니다. Collembola에서 이들은 진핵생물, 예를 들면, 아라키 돈 산 (20:4ω6) 같은 긴 사슬 불포화 지방산 지방산 특성. 다이어트로 누 룩을 사용 하는 경우 이들은 linoleic 산 (18:2ω6) 등 곰 팡이 마커입니다. 좋은 선택 37 다른 지방산 자주 동물, 곰 팡이에 구성 된 소위 명성 혼합 이며 식물 소재, 그리고 세균 산 메 틸 에스테 르 (BAME) 혼합 ( 재료의 표참조).
- GC-FID에는 샘플을 실행 하려면 해당 소프트웨어 악기의 순서를 설정 합니다. 자세한 내용은 제조업체의 설명서를 참조 하십시오. 시퀀스는 외부 표준 혼합물 (예: 명성 및 BAME 믹스), 뒤에 샘플으로 시작 합니다. Note는 보존 시간 변화, 즉, 약간의 지연이 GC 열 샘플을 실행 하는 동안 각각의 실행에서에서 지방산의 차입 시간에! 또한 모든 10번째 샘플 시퀀스에서 실행 하거나 팔 미트 산 (16:0)에 대 한 잠금 보유 시간을 사용 하 여 표준 포함.
- GC 설정 악기에 적응. 다음 프로그램은 고성능 (HP) 모 세관 칼럼에 대 한 제안 (25 m x 0.2 m m 아이디, 두께 0.33 µ m. 설정된 주입 양 splitless 모드에서 1 µ L 필름 및 캐리어 가스로 수소를 사용. (1 분 동안 개최) 50 ° C에서 온도 프로그램 시작 및 25 ° C min-1 230 ° C (5.7 분 개최) 3 ° C min-1 다음 175 ° C 증가 사용 합니다.
- 다음 수식을 사용 하 여 각 지방산에 대 한 알려진된 금액 적용 각 명성 FID에 의해 얻은 응답을 사용 하 여 생물의 그램 신선한 (건조) 중 당 nmol 지방산 계산.
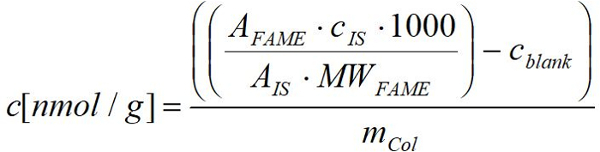
명성: 샘플에 각각 명성의 피크 면적
MWFM: µ g/µ에 해당 명성의 분자량
C: µ g에 내부 표준의 농도
IS: 내부 표준의 피크 면적
m열: 신선한 (건조) 중량 g에서 각각 Collembola 샘플의
1000: nmol µ에서 변환 요소
cBW: nmol에 해당 하는 빈 값의 평균에 각각 명성의 농도
5. Isotopologue 프로 파일링 하 여 13C 분석
- GC 시스템을 결합 하는 대량 선택적인 검출기 (MS) isotopologue 결정에 대 한 전자 이온화 (EI) 소스와 함께 제공 된 사용 합니다.
- 극 지 모 세관 칼럼 (예를 들어, DB 23, CP 실 88)를 사용 하 여이 추가 이중 결합의 동일한 번호와 함께 불포화 지방산의 분리 수 있습니다. GC 열의 선택이 결정 하는 지방산 분자 이온의 좋은 표현으로 결과 대 한 중요 합니다.
- DB 23 열 (60 m x 0.25 m m 아이디, 필름 두께 0.15 µ m), 130 ° C에 오븐 온도 시작 하 고 170 ° c 6.5 ° C/min으로 증가 203 ° C에 3 ° C/min의 증가 함께 따르고 1.9 분 230 ° C에 40 ° C/min의 증가 함께 따라 누르고 8.3 분 설정된 전송 선 온도 280 ° c.에 대 한 개최 다시, GC 메서드는 악기를 조정 합니다.
- 구성 된 알려진된 양의 FAMEs 모든 지방산에 대 한 양적 기준 13C 법인에 대 한 조사를 사용 합니다. 시작 및 실행 하는 각 샘플 시퀀스의 끝에 이러한 표준을 넣어. 이러한 기준에서 지방산의 정체 시간을 가져가 라.
- 항상 레이블이 없는 샘플 이라는 프로브로 시작 하는 그 후 실험에서 샘플을 측정 합니다. 샘플 농도, 예를 들면 1:12.5.If 악기에 대 한 사용할 수 있는 적절 한 분할 비율을 적용, 나머지 analytes에서 열을 삭제 하려면 실행 하는 각 샘플 뒤 헬륨으로 backflush를 적용 합니다.
- SIM 수집 이동에서 고통을 하지 않습니다 고 재현성 분석 보존 시간 되도록 GC-MS 메서드를 잠금 하는 보존 기간을 적용 합니다.
- GC/EI-MS 선택 된 이온 감시 (SIM) 악기의 모드를 사용 하 여 지방산의 분자 이온에서 13C 설립을 결정 합니다. 시뮬레이션 모드에서 동작 전체 스캔 모드 기준으로 감도 증가와 특정 analytes를 감지 수 있습니다.
- 처음 이란 존재를 초기 스캔을 실행 하 고 적절 한 이온에 SIM를 실행 합니다. 각 지방산의 크로마 피크 시간 포괄 m/z 스캔 창 (SIM 그룹)을 선택 하 여 관심의 분자 질량에서 데이터를 취득. 일반적으로, 분석 및 시간 창 당 2 ~ 4 이온을 모니터링 합니다.
- 감도 증가 하기 위하여 대량 스캔 속도 조정 하 고 (시간 각 질량 보고) 시간 머물러. 최고의 품질 데이터 최저 가능한 속도로 얻을 수 있습니다 및 일반적으로 SIM에 규칙 끝났습니다 8 ~ 12 스캔 분석 피크. 악기 설정에 대 한 프록시는 9 ms의 질량 당는 평균 유지 시간 6의 주기 시간 s와 175 ms cyle-1의 검색 시간.
- 각 지방산 (M+ 1M+ 2 , 등등)의 모든 isotopologues의 분자 이온 (+M)를 감지 합니다. 예 대표 결과 참조 하십시오.
- 각 이온 조각 (isotopologue)의 풍부를 기록 합니다. 정량화의 품질과 풍부한 분자 이온과 그 isotopologues은 상대적으로 낮은 크게 MS 시스템의 성능에 따라 다릅니다. 큰 샘플 시퀀스 (실험)를 시작 하기 전에 노래를 실행 하 고 필요한 경우 이온 소스를 청소.
참고: 첫째, 이러한 데이터를 얻을 전체 13소비 전조 (여기 16:0)에 의해 각 지방산의 C 풍부. - 그들의 잠복된 대응 이라는 지방산의 동위 원소 구성의 비율을 사용 하 여 영양 탄소 플럭스를 할당. 6.1 단계에서 원자 % 수식을 사용 하 여 각 지방산에서 이라는 탄소 (원자 %, 원자 %)의 비율을 계산. 13C 레이블이 없는 동물 (0 일) 이라는 (하루 1 이상) 사이 Collembola의 지방산의 비율을 비교 하 여 소비자에 13C 다이어트에서의 흐름에 대 한 상대적인 표시로.
- 지방산 사슬에 13C 법인의 위치를 지정 합니다. 분포에 따라는 isotopologues 풀 전체 표시 추적 지방산 (여기 16:0)의 식이 라우팅 체인 신장에서 지질 물질 대사에 의하여. M+ 15, M16, 13C의 사용에 의해 체인 신장과 C2 표시 전체 마커 분자의 동화 isotopologues 부모 이온 (+M), 예를 들면에 가장 풍부 하 게 증가 하는 동안 조각 (13C 아 세 틸 coa) 분자 이온 가까이 isotopologues 좀 더 자주.
6. 13C 농축의 계산
- isotopologues의 분포에 따라 다음 관계를 사용 하 여 각 지방산에서 이라는 탄소 (원자 %)에서 전반적인 백분율 계산: 원자 % (비율 13C isotopologue 통합) = (주파수 x 각각 isotopologue)
Kuppardt 외. 후 계산 됩니다. 31 로: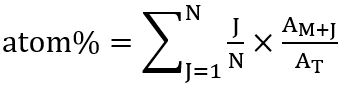
여기서 N 은 지방산, 탄소 원자의 수 J 13C 동위의 수, M + J 는 각각 isotopologue 및 T 모든 isotopologues 총 풍부한 풍부. - 계산, 합계 피크 지역 값 각각 FA 및 모든 isotopologues (M+ 1, M+ 2및 등)의 분자 이온 (+M)의 SIM-MS 분석, 감지 하 고 관계 되는 풍부 100%로 설정. 각 검색 된 isotopologue의 부분은 쉽게 3의 규칙에 따라 계산 합니다.
- 비 셔 서 하루 0 컨트롤 값을 (자연 13C 배경) 수행 외부 13C 라벨만 다시 추적 하는 최종 데이터를 얻기 위해 실험 값에서 뺍니다.
Access restricted. Please log in or start a trial to view this content.
결과
Collembola의 신선한 무게와 지질 콘텐츠
설명된 실험 과정에서 NLFAs 및 PLFAs의 내용을 변화 하지 않았다 크게 시간이 지남에, 표본의 신선한 무게 하지 크게24하지만 약간 증가 하는 반면. 두 매개 변수 Collembola 표본의 체력의 좋은 수준을 나타냅니다. 지방산 및 동위 원소 분석을 위한 샘플링 일에 해당 하는 실험을 통해 Collembola의 신선한 무게...
Access restricted. Please log in or start a trial to view this content.
토론
Isotopologue 프로 파일링
FAs에 13C 유통에서 양적 측면의 상세한 분석 탄소 음식 거미줄에 분할 할당을 최첨단 기술이 필요로 한다. 현재 작업 고용 13C를 평가 하기 위해 프로 파일링 isotopologue / 트로픽 상호 작용에 대 한 일반적인 FA biomarkers에12C 비율. 이 방법은 액체 크로마토그래피 (LC-MS)에 의해 아미노산 분석을 위해 잘 설립 이며, 병원 성 ...
Access restricted. Please log in or start a trial to view this content.
감사의 말
R. Menzel과 도이치 가운데 (RU RU780/11-1)에 의해 L. Ruess의 재정 지원은 기꺼이 인정 했다. R. Nehring RU 780/10-1에 의해 투자 되었다. 마지막으로, 우리는 매우 감사 박사 헤이젤 Ruvimbo Maboreke에 우리의 원고 교정을 위해입니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| neoLab-Round jars | neoLab | 2-1506 | 69 x 40 mm, 10 pacs/pack |
| Charcoal activated | Carl Roth | X865.1 | p.a., powder, CAS No. 7440-44-0 |
| Alabaster Dental | RÖHRICH-GIPSE | --- | http://www.roehrich-gipse.de/dentalgipse.php |
| Chloroform | Carl Roth | 7331.1 | HPLC ≥ 99,9 % |
| Methanol | Carl Roth | P717.1 | HPLC ≥ 99,9 % |
| Hexan | Carl Roth | 7339.1 | HPLC ≥ 98 % |
| tert-Butyl methyl ether (MTBE) | Carl Roth | T175.1 | HPLC ≥ 99,5 % |
| Aceton | Carl Roth | 7328.2 | HPLC ≥ 99,9 % |
| NaOH | Carl Roth | 6771.1 | p.a. ≥99 %, in pellets |
| di-Natriumhydrogenphosphat | Carl Roth | P030.1 | p.a. ≥99 % , water free |
| Na-dihydrogenphosphat Dihydrat | Carl Roth | T879.1 | p.a. ≥99 % |
| Hypochloric acid (6 N) | VWR International | 26,115,000 | AVS TITRINORM vol. solution |
| Bond Elut (Columns) | Agilent Tech. | 14102037 | HF Bond Elut-SI, 500 mg, 3 mL, 50/PK |
| Präparatengläser Duran | Glasgerätebau Ochs | 135215 | Ø 16 x 100 mm, plus screw cap with handy knurl and integrated PTFE/silicone gasket |
| Supelco 37 Component FAME Mix | Sigma-Aldrich | 47885-U Supelco | 10 mg/mL in methylene chloride, analytical standard |
| FlowMesh | Carl Roth | 2796.1 | Polypropylene mesh, approximately 0.3 mm thick, with 1 mm strand spacing |
| Bacterial Acid Methyl Ester (BAME) Mix | Sigma-Aldrich | 47080-U Supelco | 10 mg/mL in methyl caproate, analytical standard |
| Methyl nonadecanoate | Sigma-Aldrich | 74208 | analytical standard ≥ 98.0 % |
| Hexadecanoic acid-1-13C (Palmitic) | Larodan Fine Chemicals | 78-1600 | GC ≥ 98.0 % (13C: 99.0 %) |
| RVC 2-25 CDplus | Martin Christ Gefrier-trocknungsanlagen | Compact benchtop midi concentrator | |
| Alpha 2-4 LDplus | Martin Christ Gefrier-trocknungsanlagen | Drying manifold | |
| MZ 2C NT | Vacuubrand GMBH | Vacuum pump | |
| Roto-Shake Genie | Scientific Industries | Combined rocking and rotating device | |
| XP64 Micro Comparator | Mettler Toledo | Super high precision balance | |
| GC-System 7890A | Agilent Tech. | Gas chromatograph | |
| 7000 GC/MS Triple Quad | Agilent Tech. | Triple Quad mass spectrometer | |
| 7683B Series Injector | Agilent Tech. | Sample injector | |
| Heraeus Multifuge 3SR+ | Thermo Scientific | Centrifuge with 10 ml tube rotor |
참고문헌
- Ruess, L., et al. Application of lipid analysis to understand trophic interactions in soil. Ecology. 86 (8), 2075-2082 (2005).
- Ruess, L., et al. Lipid composition of Collembola and their food resources in deciduous forest stands - Implications for feeding strategies. Soil Biology and Biochemistry. 39 (8), 1990-2000 (1990).
- Chamberlain, P. M., Bull, I. D., Black, H. I. J., Ineson, P., Evershed, R. P. Fatty acid composition and change in Collembola fed differing diets: identification of trophic biomarkers. Soil Biology and Biochemistry. 37 (9), 1608-1624 (2005).
- Stott, A. W., Davies, E., Evershed, R. P., Tuross, N. Monitoring the routing of dietary and biosynthesised lipids through compound-specific stable isotope (delta C-13) measurements at natural abundance. Naturwissenschaften. 84 (2), 82-86 (1997).
- Ruess, L., Haggblom, M. M., Langel, R., Scheu, S. Nitrogen isotope ratios and fatty acid composition as indicators of animal diets in belowground systems. Oecologia. 139 (3), 336-346 (2004).
- Pollierer, M. M., Scheu, S., Haubert, D. Taking it to the next level: Trophic transfer of marker fatty acids from basal resource to predators. Soil Biology and Biochemistry. 42 (6), 919-925 (2010).
- Ferlian, O., Scheu, S., Pollierer, M. M. Trophic interactions in centipedes (Chilopoda, Myriapoda) as indicated by fatty acid patterns: Variations with life stage, forest age and season. Soil Biology and Biochemistry. 52, 33-42 (2012).
- Ruess, L., Chamberlain, P. M. The fat that matters: Soil food web analysis using fatty acids and their carbon stable isotope signature. Soil Biology and Biochemistry. 42 (11), 1898-1910 (2010).
- Traugott, M., Kamenova, S., Ruess, L., Seeber, J., Plantegenest, M. Empirically characterising trophic networks: What emerging DNA-based methods, stable isotope and fatty acid analyses can offer. Adv Ecol Res. 49, 177-224 (2013).
- Hammer, B. T., Fogel, M. L., Hoering, T. C. Stable carbon isotope ratios of fatty acids in seagrass and redhead ducks. Chemical Geology. 152 (1-2), 29-41 (1998).
- Budge, S. M., Iverson, S. J., Koopman, H. N. Studying trophic ecology in marine ecosystems using fatty acids: A primer on analysis and interpretation. Marine Mammal Science. 22 (4), 759-801 (2006).
- Haubert, D., et al. Trophic structure and major trophic links in conventional versus organic farming systems as indicated by carbon stable isotope ratios of fatty acids. Oikos. 118 (10), 1579-1589 (2009).
- Ngosong, C., Raupp, J., Richnow, H. H., Ruess, L. Tracking Collembola feeding strategies by the natural 13C signal of fatty acids in an arable soil with different fertilizer regimes. Pedobiologia. 54 (4), 225-233 (2011).
- Bec, A., et al. Assessing the reliability of fatty acid-specific stable isotope analysis for trophic studies. Methods in Ecology and Evolution. 2 (6), 651-659 (2011).
- Gladyshev, M. I., Makhutova, O. N., Kravchuk, E. S., Anishchenko, O. V., Sushchik, N. N. Stable isotope fractionation of fatty acids of Daphnia fed laboratory cultures of microalgae. Limnologica. 56 (Supplement C. 56 (Supplement C), 23-29 (2016).
- Gladyshev, M. I., Sushchik, N. N., Kalachova, G. S., Makhutova, O. N. Stable isotope composition of fatty acids in organisms of different trophic levels in the Yenisei river. PLoS One. 7 (3), e34059(2012).
- Eisenreich, W., Dandekar, T., Heesemann, J., Goebel, W. Carbon metabolism of intracellular bacterial pathogens and possible links to virulence. Nature Reviews Microbiology. 8 (6), 401-412 (2010).
- Eylert, E., Bacher, A., Eisenreich, W. NMR-based isotopologue profiling of microbial carotenoids. Methods Mol Biol. 892, 315-333 (2012).
- Garton, N. J., O'Hare, H. M. Tuberculosis: feeding the enemy. Chemical Biology. 20 (8), 971-972 (2013).
- Rosenblatt, J., Chinkes, D., Wolfe, M., Wolfe, R. R. Stable isotope tracer analysis by GC-MS, including quantification of isotopomer effects. Am J Physiol. 263 (3), E584-E596 (1992).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. J Mass Spectrom. 31 (3), 255-262 (1996).
- Heuner, K., Eisenreich, W. The intracellular metabolism of legionella by isotopologue profiling. Methods Mol Biol. 954, 163-181 (2013).
- Willenborg, J., et al. Characterization of the pivotal carbon metabolism of Streptococcus suis serotype 2 under ex vivo and chemically defined in vitro conditions by isotopologue profiling. J Biol Chem. 290 (9), 5840-5854 (2015).
- Menzel, R., Ngosong, C., Ruess, L. Isotopologue profiling enables insights into dietary routing and metabolism of trophic biomarker fatty acids. Chemoecology. 27 (3), 101-114 (2017).
- Buse, T., Ruess, L., Filser, J. New trophic biomarkers for Collembola reared on algal diets. Pedobiologia. 56 (3), 153-159 (2013).
- Hutson, B. R. Effects of variations of the plaster-charcoal culture method on a Collembolan, Folsomia candida. Pedobiologia. 18, 138-144 (1978).
- Fountain, M. T., Hopkin, S. P. Folsomia candida (Collembola): a "standard" soil arthropod. Annu Rev Entomol. 50, 201-222 (2005).
- ISO, I. O. fS. Soil Quality-Inhibition of reproduction of Collembola (Folsomia candida) by soil pollutants. , ISO 11267:1999 (1999).
- Welch, D. F. Applications of cellular fatty acid analysis. Clin Microbiol Rev. 4 (4), 422-438 (1991).
- Dodds, E. D., McCoy, M. R., Rea, L. D., Kennish, J. M. Gas chromatographic quantification of fatty acid methyl esters: flame ionization detection vs. electron impact mass spectrometry. Lipids. 40 (4), 419-428 (2005).
- Kuppardt, S., Chatzinotas, A., Kastner, M. Development of a fatty acid and RNA stable isotope probing-based method for tracking protist grazing on bacteria in wastewater. Appl Environ Microbiol. 76 (24), 8222-8230 (2010).
- Zhang, X., He, H., Amelung, W. A GC/MS method for the assessment of 15N and 13C incorporation into soil amino acid enantiomers. Soil Biology and Biochemistry. 39 (11), 2785-2796 (2007).
- Vetter, W., Thurnhofer, S. Analysis of fatty acids by mass spectrometry in the selected ion monitoring mode. Lipid Technol. 19 (8), 184-186 (2007).
- Thurnhofer, S., Vetter, W. A gas chromatography/electron ionization-mass spectrometry-selected ion monitoring method for determining the fatty acid pattern in food after formation of fatty acid methyl esters. J Agric Food Chem. 53 (23), 8896-8903 (2005).
- Haubert, D., Haggblom, M. M., Scheu, S., Ruess, L. Effects of fungal food quality and starvation on the fatty acid composition of Protaphorura fimata (Collembola). Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology. 138 (1), 41-52 (2004).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유