JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
주문, 녹 농 균 스트레인 PA14 Transposon 삽입 돌연변이의 비중복 라이브러리의 복제
* 이 저자들은 동등하게 기여했습니다
요약
녹 농 균 감염에 취약 한 호스트 중요 한 병 적 상태를 발생합니다. P. 농 균 스트레인 PA14NR 설정으로 지정 하는 PA14의 비중복 transposon 삽입 돌연변이 라이브러리 수많은 프로세스에서 유전자 기능 분석을 촉진 한다. 여기에 제시 된 높은 품질 PA14NR 설정 돌연변이 라이브러리의 복사본을 생성 하는 프로토콜이입니다.
초록
녹 농 균 phenotypically 및 genotypically 다양 하 고 융통성 있는 그람 음성 박테리아 인간의 환경에서 유비 쿼터 스입니다. P. 녹 농 균 은 biofilms 형성, 항생제 내성, 독성 요인, 생산 및 만성 감염 동안 빠르게 진화 수 있습니다. 따라서 피 녹 농 균 하면 둘 다 급성과 만성, 감염, 치료 하기 어려운 특정 환자 인구에 있는 중요 한 병 적 결과. P. 농 균 스트레인 PA14 다양 한 포유류 및 nonvertebrate 호스트 만들기 PA14이 병원이 체를 공부에 대 한 매력적인 스트레인 감염 보존된 게놈 구조와 인간의 임상 분리 이다. 2006 년에, 4,596 예측된 PA14 유전자에 해당 하는 5,459 돌연변이 포함 하는 비중복 transposon 삽입 돌연변이 라이브러리 생성 되었습니다. 그 이후, PA14 라이브러리의 연구 커뮤니티 개별 유전자의 기능 및 복잡 한 경로 P. 녹 농 균의 더 나은 이해를 허용 했다. 복제 프로세스를 통해 도서관 무결성의 유지 관리는 적절 한 처리 및 정확한 기술을 필요합니다. 이 위해,이 원고 도서관 복제, 라이브러리 품질 관리 및 개별 돌연변이의 적절 한 저장소에 단계가 자세히 설명 하는 프로토콜을 제공 합니다.
서문
녹 농 균 phenotypically 및 genotypically 다양 하 고 융통성 있는 그람 음성 박테리아 피부 microflora 뿐만 아니라 토양, 물, 그리고 가장 인간의 환경에 이다. 많은 세균성 종에 비해, P. 농 균 는 5.5-7 Mbp 콘텐츠 높은 G + c (65-67%)의 비교적 큰 게놈. 또한, 그것의 유전자의 상당한 비율이 변화 적응성에 참여 하 고 환경 스트레스1에 응답에 큰 유연성을 허용 하는 규제 네트워크의 부분 이다. P. 녹 농 균 독성 요인의 과다를 표현, 양식 biofilms proclivity를 전시, 통해 경로 감지 하는 여러 개의 쿼럼 응답을 조정 하는 능력을 보유 하 고 및 항생제 저항을 개발 하는 주목할 만한 용량을 표시 그리고 허용 오차2,3,,45,6,7,8. 이러한 특성 P. 녹 농 균에 한 감염 치료에 대 한 상당한 도전을 제시.
만성 피. 녹 농 균 감염 수많은 질병 상태에서 발생할 수 있습니다. 낭 성 섬유 증 (CF), 낭 성 섬유 증 막 횡단 전도성 레 귤 레이 터 (CFTR) 유전자의 돌연변이 의해 발생 하는 유전 질환 inspissated, 감염 된 분 비는 기도 내에서 결과 진보적인 기관지 확장 증 및 궁극적으로, 죽음 호흡기 장애9에서. 성인,으로 CF와 환자의 대다수는 피 녹 농 균, 병 적 상태와 사망률이 질병10와 관련 된 중요 한 역할을 만성 감염. 또한, 심한 화상 부상11, tracheostomies12, 공동 교체13또는 내재 카 테 터14 환자 양식 하는 박테리아의 기능에 관련 된 피 녹 농 균 감염에 대 한 위험에 노출 되어 biofilms 및 탈출 선 동적인 응답15호스트. 또한, 식민 경쟁 없이 선택한 후 발생 합니다 다중 항생제 내성 또는 내성 인구는 넓, 순차 항균 치료12,,1617 를 통해 , 18. 수많은 질병 상태에 대 한 중요 한 의미를 해야한다 더 나은 피 녹 농 균 의 병 인을 이해.
PAO1 PA103, PA14, 박세리, 종자를 포함 한 여러 피 농 균 임상 격리, 있다 P. 농 균 병의 다양 한 기능을 조사 하기 위해 광범위 하 게 연구 되었습니다. 긴장 PA1420 가장 일반적인 클론 그룹 전세계19,중 하나에 속해 하 고 실험실에서 광범위 하 게 passaged 하지은 임상 분리 이다. PA14is 매우 주목할 만한 내과 감염의 척추 모델에 악성 프로21, pili 구조22, pathogenicity 제도23, 유형 III 분 비 체계 (TTSS), 포유류 쪽으로 세포 독성 세포24 과 항생제 저항과 지 속성25프로 파일. 또한, PA14 또한 매우 다양 한 호스트 병원 체 모델 시스템에서 악성, 식물 잎 등 침투 모델26,27,꼬마 선 충 감염 모델28, 29, 곤충30,31, 모델 뿐 아니라 마우스 폐 렴 모델32,33 및 피부 화상 모델34.
게놈 넓은 돌연변이 라이브러리는 게놈 규모의 유전자 기능 분석을 함으로써 유 기체의 생물학을 이해 하는 매우 강력한 도구를 구성 하는 불필요 한 유전자에 있는 isogenic 돌연변이의 컬렉션입니다. 2 채도 근처 transposon 삽입 돌연변이 라이브러리 P. 녹 농 균 에 배포에 대 한 현재 사용할 수 있습니다. transposons의 삽입 사이트 두 라이브러리에 대 한 결정 되었습니다. 이러한 소위 비중복 라이브러리는 시간을 상당히 줄여 세균성 긴장의 게놈 넓은 연구를 촉진 하 고 비용에 관련 된 심사 새롭거나 임의의 transposon 돌연변이. P. 농 균 PAO1 transposon 돌연변이 라이브러리는 MPAO1에 스트레인 PAO1 transposons IS를 사용 하 여phoA/ 하 분리 이며lacZ/하35, Manoil 연구소, 워싱턴 대학으로 큐레이터 이다. 시퀀스 확인 컬렉션 9,437 transposon 돌연변이의 게놈 넓은 범위를 제공 하 고 대부분 유전자36두 돌연변이 포함 하는 도서관에 의하여 이루어져 있다. P. 농 균 PAO1 transposon 돌연변이 라이브러리에 대 한 정보 공개, 인터넷에서 액세스할 수 있는 Manoil 연구소 웹사이트 http://www.gs.washington.edu/labs/manoil/libraryindex.htm에서 제공 됩니다. P. 농 균 스트레인 비중복 transposon 삽입 돌연변이 라이브러리 (PA14NR 설정) 스트레인 PA14 transposons MAR2xT7 및 테네시phoA를 사용 하 여37 에 현재 소아과의 부에 의해 배포 됩니다 PA14 매사 추세 츠 종합 병원. PA14NR 설정 불필요 한 유전자37에 단일 transposon 삽입과 이상의 5800 돌연변이의 컬렉션으로 구성 됩니다. PA14NR 설정의 건설에 대 한 내용은 온라인 검색 도구는 PA14NR의 사용을 촉진 하는 다양 한 포함 공공, 인터넷에서 액세스할 수 있는 사이트 http://pa14.mgh.harvard.edu/cgi-bin/pa14/home.cgi?section=NR_LIB에 설명 되어 있습니다. 설정 합니다.
원래 PA14NR 설정 5,459 돌연변이, 약 34000 임의의 transposon 삽입 돌연변이, 모든 예측된 PA14 유전자37의 77%를 대표 하는 4,596 예측된 PA14 유전자에 해당 하는 포괄적인 라이브러리에서 선택한 구성. 2006 년에 도서관의 건설 이후 새로운 돌연변이 추가 되었습니다, 그리고 현재 약 4600 PA14 유전자를 나타내는 이상 5800 뮤턴트38 포함 PA14NR 설정. PA14 transposon 돌연변이의 대다수는 야생 타입 배경37에서 생성 되었다. 유전적 배경를 포함 하 여 돌연변이 도서관의 각 구성원에 관한 자세한 사항은 온라인 데이터베이스 검색을 통해 또는 비중복 라이브러리 스프레드시트 (http:// PA14 웹 사이트에서 사용할 수 있는 두 기능을 다운로드 하 여 사용할 수 pa14.mgh.harvard.edu/cgi-bin/pa14/home.cgi)입니다. 돌연변이의 대다수는 MAR2xT7를 사용 하 여 만들어진 TnPhoA (phoA) transposon37을 사용 하 여 만든 작은 세트 (MrT7) transposon. 각 transposon gentamicin (MrT7) 또는 대 (phoA)를 사용 하 여 돌연변이 선택할 수 있는 항생제 저항 카세트를, 있다. 돌연변이의 PA14NR 세트 63 96 잘 접시에 저장 되어 있는 야생 타입 PA14 이루어져 있는 접시, 주사 하는 두 개의 추가 96-잘 제어를 포함 하 고 사전 설정 된 패턴에 삽입 된 uninoculated 우물. 온라인 검색 도구와 크게 결합 96 잘 접시 형식 심사 분석 사용자가 돌연변이 고기와 관련 된 유전자를 쉽게 식별할 수 있도록 사용자 지정 개발을 촉진 한다. 온라인 검색 도구는 또한 검색 및 추가 연구에 필요한 추가 관련 돌연변이의 선택을 용이 하 게.
PA14 및 PAO1 transposon 돌연변이 라이브러리는 사회 과학에 대 한 매우 중요 한 전역 리소스 그리고 그들은 알 수 없는 유전자의 기능과이 세균성 병원 체의 경로 유효성 검사에서 서로 보완. 공교롭게도, PAO1 및 PA14 transposon 돌연변이 라이브러리의 건설 이후 많은 피 농 균 분리의 전체 게놈 DNA 시퀀싱 분석이 나타났습니다 PAO1와 PA14 피 녹 농 균의 다른 주요 subclades에 속한다 계통7,39,,4041. 임상 P. 농 균 분리 하기 때문에 발견 계통, PAO1 및 PA14 다른 피 녹 농 균 에 속하는 사실 전역 배포 하위 비교에 대 한 두 개의 transposon 돌연변이 라이브러리의 가치를 향상 시킵니다. 연구입니다.
간행물 건축을 설명 하 고 세균성 돌연변이 라이브러리, P. 농 균 라이브러리35,등의 상영37,42, 문학에서 쉽게 사용할 수 있습니다. 그러나, 우리의 지식 최선을 아니 게시 프로토콜 설명 하는 자세한 절차와 기술을 복제, 사용 유지 보수 및 세균성 돌연변이 라이브러리의 유효성 검사 사용할 수 있습니다.
이 책에서 설명 하는 방법론 사용을 촉진 하는 세 가지 프로토콜의 집합 및 PA14NR 설정의 유지 관리에 설명 합니다. PA14NR 설정의 받는 사람에 게 권장 하는 대로 첫 번째 프로토콜 라이브러리의 복제를 설명 합니다. 두 번째 프로토콜 질주, 성장, 및 PA14NR 설정 사용 하 여 식별 하는 개별 돌연변이 저장에 대 한 지침을 포함 합니다. 세 번째 프로토콜 transposon 돌연변이에서 파편의 PCR 증폭 등 돌연변이 정체성을 확인 하는 후속 시퀀싱 품질 관리 기법을 설명 합니다. 프로토콜의이 세트는 복제 및 기타 세균성 돌연변이 라이브러리 또는 컬렉션의 유지 보수에 대 한 적응 하지 수도 있습니다. 세균성 돌연변이 라이브러리 또는 컬렉션의 복제 "마스터 복사"의 무결성을 유지 하기 위해 매우 좋습니다 (원래 사본을 받았다). 일상적인 실험실 사용을 위해 설정 하는 PA14NR의 여러 복사본의 복제 마스터 복사본의 interwell 오염의 가능성을 최소화합니다.
프로토콜
주의: 피 녹 농 균, 인간 병원 체를 취급 하는 때 표준 BSL-2 안전 조치를 사용 합니다. 만약 당신이 immunocompromised 개인 또는 세균성 감염 민감성을 증가 시키는 어떤 건강 상태, 주의 특별 한 피 를 작업할 때 녹 농 균입니다. 해당 교육 기관에 biosafety 사무실을 상담 하 고 사용 하기 전에 의사 로부터 승인을 PA14 NR 설정 또는 세균성 병원 체의 돌연변이 라이브러리.

그림 1: 개요는 PA14NR의 프로토콜 i: 복제 설정. 제 1 일: "마스터 복사" PA14NR 설정의 파운드 한 천 매체에서 냉동된 돌연변이 문화 및 성장 37 ° c.에 하룻밤 돌연변이 주 2: 깊은 잘 블록 파운드 액체 국물 포함 된 돌연변이 성장 파운드 한 미디어에서 전송, 하룻밤 950 rpm에서 떨고와 37 ° C에서. 제 3 일: 글리세롤, 하룻밤 파운드 문화 혼합 후 장기 저장을 위한 대상 96 잘 접시를 전송. -80 ° C 냉동 고에 편평한 장소 96 잘 접시. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
그림 2: 설정 권장. 불 임 및 매끄러운 워크플로 적절 한 예방 조치를 사용 하 여 유지 되어야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
1. 프로토콜 i: 복제는 PA14NR의 설정
참고: 라이브러리의 복제는 16 개의 플레이트의 각 연속 4 주에 처리 될 수 있는 4 개의 하위 집합에 PA14NR 설정 나누어 얻을 수 있습니다. 1 ~ 6 부의 세대 동안 6 개 이상의 복사본의 생성 다음 표 2에 설명 된 주간 워크플로 표 1에 설명 된 주간 워크플로을 준수 합니다. PA14NR 설정의 12 복사본을 생성 하려면 주 2 액체 LB 미디어에 동일한 PA14NR 하위 집합을 예방 하 고 다시 (같은 집합에서 1 일에 복제 하는 한 천 배지), 3 일 및 이전에 하룻밤 돌연변이 문화 하루 3, 4 일에 복사 판으로 각각.
| 하루 0 | 주 1 | 주 2 | 3 일 |
| 하루를 준비 | PA14NR 설정 돌연변이 파운드 한 미디어의 성장 | PA14NR 설정 돌연변이 액체 LB 미디어에서의 성장 | 대상 번호판 PA14NR 설정 돌연변이 문화의 전송 |
표 1: 1-6 PA14NR 설정의 복사본의 복제에 대 한 일정. 사본의 작은 번호의 복제 주간 워크플로를 준수 수 있습니다.
| 하루 0 | 주 1 | 주 2 | 3 일 | 4 일 |
| 하루를 준비 | 한 천 파운드에 PA14NR 설정 돌연변이의 성장 | PA14NR 설정 돌연변이 액체 LB 미디어에서의 성장 | PA14NR 설정의 6 복사본의 1 세트를 생성 하기 위해 하루 3 돌연변이 문화의 전송 | PA14NR 설정의 6 복사본의 2 세트 생성 하 하루 4 돌연변이 문화의 전송 |
| PA14NR 설정 돌연변이 액체 LB 미디어에서의 성장 |
표 2: PA14NR 설정의 최대 12 복사본의 복제에 대 한 일정. 사본의 많은 수의 복제 주간 워크플로 내에서 레이어 링이 필요 합니다.
- 주 1: 성장 파운드 한 천 배지에서 PA14NR 설정 마스터 복사본의
- 장갑, 랩 코트와 PA14NR 설정 처리 하기 위해 마스크를 착용 하십시오.
- 벤치 하 고 70% 에탄올으로 표면 닦아.
- LB agar 미디어43 를 준비 하 고 오토 클레이 브에서 소독 물에 55 ° C에 25 분 멋진 미디어 목욕 하 고 어느 15 µ g/mL gentamicin 테네시를 포함 하는 돌연변이 대 한 MAR2xT7 transposon 삽입, 또는 200 µ g/mL 대를 포함 하는 돌연변이 대 한 추가 phoA 삽입.
- 접시 당 미디어의 약 60 mL를 사용 하 여 직사각형 접시에 녹은 파운드 agar를 붓는 다. 약 1 시간 전에 대 한 살 균 후드 건조 접시를 사용합니다. 한은 천의 표면에 물 응축 없음 있는지 확인 합니다. 필요한 경우 4 ° C에서 접시를 저장 합니다.
- 에탄올 닦아 벤치 위에 분 젠 버너와 불 임 분야를 만들고 컨테이너 복제기 핀 살 균에 대 한 적절 한 솔루션을 설정 (단계 1.1.9을 참조). 사용 열 플라스틱 용기 (5.25"L x 4.25" x 1.75 "H 대략적인 크기 W) 복제기 핀 살 균에 대 한. 압력솥 사용 하기 전에 플라스틱 용기입니다.
참고: 분 젠 버너 불꽃의 열 대류 현재, 불꽃 위에 공간을가 열 하 고 리프트 어떤 미 립 자 및 밑에, 차가운 공기에서 공기 살 균 작업 영역을 유지 만듭니다. - ()을 피하기 위해 불필요 한 녹고-80 ° C 냉동 고에서 최대 4 개의 PA14NR 설정 마스터 플레이트를 제거 하 고 4 L 얼음 팬에 드라이 아이스에 넣어.
- 단지 시간이 걸릴 것입니다 드라이 아이스에서 복제 하 짧은 해빙 수 있도록 벤치에 96-잘 마스터 플레이트 (단계 1.1.8 참조) 복제기 핀 (약 3-4 분)의 살 균에 필요한 가져가 라. 스탬프 전에 한 접시에 A1 좌표 위치를 표시 합니다. 마스터 플레이트와 왼쪽된 상단에 있는 두 접시의 A1 좌표와 한 천 배지를 맞춥니다.
- 아래에 설명 된 단계에 따라 "핀" 복제기를 소독. 과잉 액체를 제거 하려면 각 단계 후 약간 복제기를 누릅니다.
- 0.3-0.5의 250 mL에 핀을 담가 % 염소 (10% 가구 표 백제) 30 초 동안. 로 핀의 손상으로 이어질 수 있습니다 염소 솔루션와 접촉을 최소화 합니다. 250 mL 살 균 ddH2O에서에서 핀을 담가 또는 불 임 초순 10 초, 30 초 동안 250 mL 70% 에탄올에 다음 2 분에 대 한 95% 에탄올의 250 ml에서.
- 화 염 분 젠 버너 불꽃을 복제기를 수직으로 들고, 천천히 접근 하는 불꽃 에탄올 재가동 될 때까지 다음 즉시 화 염에서 철수 하 여 복제기 핀을 소독. 화 염에서 일단 모든 에탄올 화상 소화 됩니다. 유지는 뚜껑 또는 이와 유사한 용기 레코딩 에탄올, 질 식 하 여 가까운 필요한 경우.
참고: 에탄올 불꽃 근처에서 작업할 때 극단적인 주의 사용 합니다. 화 염에 직접 복제기를 보유 하지 않습니다. - 30 초 동안 천 파운드 미디어를 포함 하는 사용 하지 않는 무 균 사각형 접시에 고정으로 멋진 핀
- 짧게 따뜻한 알루미늄 봉인 PA14NR 설정 마스터에서 손으로 판 박 리 하기 전에. 복제기 핀을 냉각 하는 동안 이렇게 합니다. 알루미늄 인감 인감 접시를 수정 하지 않도록 하려면 신중 하 게 제거 합니다. 족집게를 사용 하 여 알루미늄 인감의 잔해를 벗기다.
- 부드럽게 밀고 마스터 플레이트와 핀을 보장 하기 위해 모든 4 개의 방향에서 스윙 복제기 복제기 핀 삽입 96-웰 스의 각 냉동된 세균성 문화 접촉. 고정된 문화권에 대 한 복제기 핀 접시의 가장자리에 있는 우물에 밀어 접시의 바깥 가장자리에 위치한 우물 외 주의.
- 부드럽게 복제기 핀 한 천 격판덮개의 표면에 놓습니다. 약간의 원형 모션 폼 미니-각 돌연변이 스트레인에 대 한 약 4-5 m m의 잔디밭에 복제기를 이동 합니다. 교차 오염을 방지 하는 미니-잔디 겹칠 수 있습니다 가능성을 하지 마십시오.
- PA14NR 설정 마스터 플레이트 새로운 살 균 알루미늄 인감과 인감. 오염을 피하기 위하여 언제 든 지 알루미늄 인감의 접착 면을 만지지 마십시오. 접시의 가장자리와 각 잘 접시 롤러를 사용 하 여 봉인 완전히 다는 것을 확인 하십시오. 드라이 아이스를 반환 96 잘 접시입니다.
- 각 마스터 플레이트에 대 한 절차를 반복 합니다.
- PA14NR 설정 처리 후 70% 에탄올과 모든 작업 표면의 아래 닦으십시오.
- 37 ° C 배양 기를 복제 한 천 배지를 전송 하 고 밤새 품 어.
- 주 2: 성장 파운드 액체 국물에 PA14NR 설정 마스터 복사본의
- LB 액체 국물43 중 15 µ g/mL gentamicin 테네시phoA 삽입을 포함 하는 돌연변이 대 한 MAR2xT7 transposon 삽입, 또는 200 µ g/mL 대를 포함 하는 돌연변이 대 한 포함 된 준비.
- 불필요 한 장비의 층 류 두건 하 고 작업을 시작 하기 전에 10 분의 최소 후드 송풍기를 설정. 후드 표면 및 70% 에탄올을 사용 하 여 후드에 배치 하는 어떤 품목 든 지 아래로 닦으십시오.
- 층 류 두건은 50-1200 µ L 12 채널 전자 피 펫을 사용 하 여 적절 한 항생제를 포함 하는 파운드 액체 국물의 525 µ L에 2 mL 깊은 잘 블록 채우십시오. 그런 다음, 에탄올 닦아 벤치 탑 미디어 가득 깊은 잘 블록 전송. 멸 균 상태 유지로 팁을 다시 사용 합니다.
- 장갑, 실험실 외 투, 및 PA14NR 설정 처리 하기 위해 마스크를 착용 하십시오.
- 벤치 하 고 70% 에탄올으로 표면 닦아.
- 벤치 탑을 하룻밤 성장된 돌연변이 체 긴장 된 한 천 배지를가지고.
- 에탄올 닦아 벤치 위에 분 젠 버너와 불 임 분야를 만들고 컨테이너 복제기 핀 살 균에 대 한 적절 한 솔루션을 설정 (다음 단계 참조).
- 복제기 "핀" 아래에 설명 된 단계를 소독. 과잉 액체를 제거 하려면 각 침수 후 약간 복제기를 누릅니다.
- 0.3-0.5의 250 mL에 핀을 담가 30 초 동안 % 나트륨도 발견 됐 죠. 그것은 핀의 손상으로 이어질 수 있습니다으로 염소 솔루션을 복제기 핀 접촉을 최소화 합니다. 다음, 250 mL 살 균 ddH2O에서에서 핀을 담가 또는 초순 10 초, 30 초 동안 70% 에탄올의 250 mL에 다음 2 분에 대 한 95% 에탄올의 250 ml에서에 다음.
- 불꽃 천 파운드 미디어를 포함 하는 30 초 동안 사용 되지 않는 사각형 접시에 고정으로 복제기 핀 다음 멋진 핀 소독.
참고: 사용 극단주의 에탄올 불꽃 근처에서 작업할 때 (1.1.8 참조).
- 부드럽게 장소 돌연변이 성장과 핀 한 접시에 모든 96 돌연변이 접촉은 확인을 포함 하는 한 접시에 복제기 핀 다음 파운드 액체 국물을 포함 하는 깊은 우물에 핀 잠수함. 핀과 함께 우물의 측을 만지지 마십시오.
- 메 마른 숨 봉인 막으로 깊은 우물 블록 인감. 각각 잘은 제대로 밀봉 되도록 접시 롤러를 사용 합니다.
- 각 한 천 판에 대 한 절차를 반복 합니다.
- PA14NR 설정 처리 후 70% 에탄올과 모든 작업 표면의 아래 닦으십시오.
- 사용 가능한 경우 고속 통을 사용 하 여 950 rpm에서 37 ° C에서 15-16 h에 대 한 접종된 액체 문화를 성장.
참고: 고속 통 사용할 수 없는 경우, 250-300 rpm에서 뿌리 깊은 우물 블록의 보육은 가능 합니다. 그러나, 작은 식민지 변종 (SCVs)25 낮은 산소 조건에서 신흥의 큰 기회가 있다. 따라서, 그것은 매우 낮은 통 속도에서 깊은 우물 블록에서 문화를 성장 하는 때 외피 아래 15-16 h 시간을 유지 하는 것이 좋습니다. SCVs 돌연변이 웰 스에서의 확산을 원치 않는 유전 화면 수행 하는 라이브러리를 사용 하 여 때 돌연변이 고기를 변경할 수 있습니다.
PA14NR 설정에서 특정 우물 또는 느린-성장/비-성장 돌연변이, 클론, 누락을 포함 uninoculated 미디어를 포함. 이 우물의 위치 기록 되 고이 간행물으로 포함 된 웰 스 정보 설정 추가 PA14NR 파일에서 찾을 수 있습니다.
- 대상 접시에 PA14NR 설정 하룻밤 문화의 제 3 일: 전송
- 층 류 두건 하 고 작업을 시작 하기 전에 10 분의 최소 후드 송풍기를 설정. 후드 표면 및 70% 에탄올을 사용 하 여 후드에 배치 하는 어떤 품목 든 지 아래로 닦으십시오.
- 방수 접착제 레이블 인쇄 (서식 파일에 대 한 보충 PA14NR 설정 레이블 파일 참조). 플라스틱에서 제거 96 잘 접시 층 류 두건 내부 포장. 플레이트 껍질-오프 라벨 및 대상 접시의 H1 우물에 a 1을 가장 가까운 접시의 가장자리를 따라 배치. 약간 대상 접시의 뚜껑을 해제 하 고 접시 뚜껑으로 덮여 때 라벨을 표시 하려면 아래쪽 가장자리에 라벨을 놓습니다.
- 60% 글리세롤 (v/v)의 3.5 L를 준비 하 고 소독 압력솥에서 20 분.
- 장갑, 실험실 외 투, 및 PA14NR 설정 처리 하기 위해 마스크를 착용 하십시오. 고속 통 또는 일반 통에서 깊은 우물 블록을 제거 합니다.
- 살 균 층 류 두건에 깊은 잘 블록을 전송 하 고 신중 하 게 숨 봉인 막 제거. 알루미늄 인감을 바꿉니다. 스핀-다운 결로 수집에 매우 낮은 속도로 깊은 잘 블록 (50-150 x g 30 초 다음 감속 quicky에 원심 브레이크를 함으로써).
- 살 균 후드와는 50-1200 µ L 12 채널 전자 피 펫을 사용 하 여 다시 깊은 잘 블록 전송 하 고 살 균 필터링된 팁 각 잘 하 525 µ L의 글리세롤/파운드 액체 수프 믹스 (등분 파운드 액체 국물과 60% 글리세롤 솔루션)를 추가 합니다. 부드럽게 pipetting 300 µ L를 위아래로 3 번 전자 피 펫과에 의해 혼합. 물방울을 방지 하기 위해 팁을 꺼내기 전에 잘의 팁을 터치 합니다. 팁을 추출 하 고 행 전체 깊은 우물 블록 할 때까지 계속 합니다.
- Aliquoting 중 interwell 오염을 방지 하기 위해 12 채널 전자 반복적인 피 펫 및 필터링 된 팁을 사용, 돌연변이 문화의 900 µ L를 올려 고 라이브러리 판의 6 복사본을 생성 하려면 각 대상 96 잘 접시에 150 µ L를 분배. 대상 번호판으로 문화의 전송 시작 하기 전에 팁 우물의 벽으로 drips을 방지 합니다. 없는 반복 피 펫을 사용할 수 있는 경우 멀티 채널 피 펫을 사용 하 여 각 떨어지는 방지 하기 위해 위에서 설명한 기술을 사용 하 여 6 96 잘 접시로 150 µ L를 분배 하.
- 살 균 알루미늄 물개를 사용 하 여 번호판을 커버 하 고 완전히 인감 플레이트 가장자리와 모든 우물을 판 롤러를 사용 하 여. 레이블 식별자 알루미늄 인감을 커버 있는지 확인. 접시, 우물의 측에 또는 알루미늄 도장에 문화 시작 수 있습니다으로 동요 할.
- 평면,-80 ° C 냉동 실에도 표면에 후드와 장소 접시에서 봉인된 플레이트를 제거 합니다.
- 라이브러리를 처리 후 70% 에탄올과 모든 작업 표면의 아래 닦으십시오.
- 그리고 유전 스크린 (프로토콜 III 참조)를 수행 하는 라이브러리를 사용 하 여 라이브러리 복제 후 품질 관리 검사를 수행 합니다.
2. 프로토콜 II: 취급 및 PA14NR 집합에서 개별 돌연변이의 저장
-
제 1 일: 행진 돌연변이 관심의
- PA14NR 설정 링크 http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS 통해 관심의 돌연변이의 위치를 확인 하거나 링크 http://에서 다운로드 비중복 Library.xls 파일을 사용 하 여 pa14.mgh.harvard.edu/cgi-bin/pa14/downloads.cgi)입니다. 모든 특정 돌연변이 gentamicin (대)를 선택 하는 데 필요한 항생제의 기록을 합니다.
- 파운드 한 미디어를 준비 하 고 20-25 분, 오토 클레이 브에서 소독 한 물 목욕에서 55 ° C에 냉각. 15 µ g/mL gentamicin 테네시phoA transposon 삽입을 포함 하는 돌연변이 대 한 MAR2xT7 transposon 삽입, 및 200 µ g/mL 대를 포함 하는 돌연변이 대 한 추가 합니다. 접시 (원형 또는 직사각형 플레이트는 적절 한)에 파운드 한 미디어를 붓는 다. 1 시간 전에 약 30 분 살 균 후드에서 건조 플레이트를 사용합니다.
- 오토 클레이 브 모든 plasticware 및 비 살 균 용품 사용 하기 전에.
- 장갑, 실험실 외 투, 및 PA14NR 설정 처리 하기 위해 마스크를 착용 하십시오. 벤치 하 고 PA14NR 설정으로 작업 하기 전에 70% 에탄올으로 표면 닦아.
- 분 젠 버너와 불 임 필드를 만듭니다.
- -80 ° C 냉장고에서 관심의 돌연변이와 PA14NR 설정 96 잘 접시를 제거 하 고 드라이 아이스에 배치, 벤치, 드라이 아이스 컨테이너 걸릴 짧게 (약 1-2 분) 녹고 약간 있도록 벤치 위에 96 잘 접시를 장소.
참고: 라이브러리 번호판에 대 한 더 많은 액세스 interwell 오염에 대 한 더 큰 위험을 연관으로 모든 PA14NR 설정 96 잘 접시 행진 개별 돌연변이, 액세스의 기록을 유지. - 박 리, 인감 접시를 수정 하지 못하도록 주의 전에 손으로 따뜻한 알루미늄 인감. 족집게를 사용 하 여 알루미늄 인감의 잔해를 벗기다.
- 96 잘 접시에 관심의 돌연변이 찾습니다. 메 마른 나무 막대기 또는 살 균 피 펫 팁 중 하나를 사용 하 여 잘 관심의 돌연변이 포함 하는 개별에서 냉동된 문화의 작은 금액을 선택.
- 다음과 같이 단일 돌연변이 식민지에 대 한 천 배지에서 문화를 동결 행진: 부드럽게 확산 행진 1, 신선 하 고, 메 마른 나무 지팡이 또는 피 펫 팁를 사용 하 여 만드는 접시의 섹션을 통해 박테리아 행진 1 통해 끌어서 박테리아의 두 번째 섹션에 걸쳐 플레이트, 행진 2를 만들려고입니다. 3 메 마른 나무 지팡이 또는 피 펫 팁을 사용 하 여, 행진 2 통해 끌어서 만들 행진 3 판의 마지막 부분에 걸쳐 박테리아.
- 새로운 살 균 알루미늄 도장 소스 접시를 봉인. 오염을 피하기 위하여 언제 든 지 알루미늄 인감의 접착 면을 만지지 마십시오. 각 우물 및 격판덮개의 가장자리 접시 롤러를 사용 하 여 봉인 완전히 다는 것을 확인 하십시오. 드라이 아이스 그리고-80 ° C 냉장고 반환 96 잘 접시.
- 37 ° C 배양 기에서 한 천 배지를 밤새 품 어.
- 라이브러리를 처리 후 70% 에탄올과 모든 작업 표면의 아래 닦으십시오.
-
제 2 일: 성장의 파운드 액체 국물의 돌연변이
- 15 µ g/mL gentamicin 또는 transposon 삽입 당 200 µ g/mL 대를 포함 하는 액체 LB 국물을 준비 합니다.
- 장갑, 실험실 외 투, 및 피 녹 농 균을 처리 하기 위해 마스크를 착용.
- 벤치 하 고 70% 에탄올으로 표면 닦아. 분 젠 버너와 불 임 필드를 만듭니다.
- 모자와 메 마른 문화 관으로 적절 한 항생제와 파운드 국물의 3-5 mL를 전송 합니다.
- 메 마른 주걱 또는 살 균 피 펫 팁 사용 하, 돌연변이 스트레인의 단일 식민지를 선택 하 고 파운드 미디어에 접종.
- 225-250 rpm에서 통에 37 ° C에서 파운드 액체 문화를 밤새 품 어.
- P. 농 균처리 후 70% 에탄올과 모든 작업 표면의 아래 닦으십시오.
-
제 3 일:-80 ° C 냉장고의 돌연변이 저장
- 돌연변이 이름, 항생제와 레이블 cryovial 파운드 국물과 스토리지의 날짜에 추가.
- 50%의 500 mL를 준비 글리세롤 (v/v) 오토 클레이 브에서 소독.
- 장갑, 실험실 외 투, 및 피 녹 농 균을 처리 하기 위해 마스크를 착용.
- 벤치 및 층 류 홍수 후드 하 고 70% 에탄올으로 표면 닦아.
- 셰이 커에서 돌연변이 문화를 포함 하는 튜브를 제거 합니다.
- 드라이 아이스와 함께 작은 컨테이너를 준비 합니다.
- 층 류 후드를 사용 하거나 분 젠 버너와 에탄올 닦아 벤치 위에 살 균 필드를 만듭니다.
- 무 균 조건를 사용 하 여 레이블이 지정 된 cryovial에 세균성 문화 및 50% 글리세롤의 동일 금액을 추가 하 고 부드럽게 피 펫과 혼합 (최종 볼륨 1-2 mL/유리병 사용 cryovials의 크기에 따라). 코기를 드라이 아이스에 cryovial를 배치 합니다.
- Cryovial-80 ° C 냉장고에서 레이블이 지정 된 상자에 배치 합니다.
- 70% 에탄올과 모든 작업 표면 처리 후 닦아 P. 농 균.
3. 프로토콜 III: PA14NR 세트의 품질 관리
- 새로 복제 된 판 (30-40 돌연변이 권장 테스트) 가능한 interwell 오염 감지 하에서 돌연변이의 무작위 세트를 선택 합니다.
참고: 경우에는 어디는 되 고 사용 되는 특정 유전자의 돌연변이의 id를 확인 하는 데 필요한, 것이 좋습니다 포함 된 유전자의 알려진된 순서에 대 한 설계 유전자 특정 뇌관을 사용 하 여 PCR 확대를 수행 하는 transposon의 삽입 하지만 도전, 임의의 사용의 이점은 더 많은 유전자 특정 PCR 뇌관 amplyfing DNA는 transposon 돌연변이에서 조각 하는 경우 보다는 PCR 뇌관 포함 대규모 돌연변이 확인 및 잠재력의 존재를 감지 하는 능력의 용이성 오염 물질입니다. 품질 관리 목적을 위해 그것 아니다 모든 무작위로 slected 돌연변이 대 한 고품질 PCR 시퀀싱 데이터를 얻을 필요가 돌연변이의 충분 한 수 에러율을 평가 하는 검사는. - "프로토콜 II" 행진 하 고 돌연변이 체 긴장 성장에 따라.
- 오토 클레이 브 모든 plasticware 및 비 살 균 용품 사용 하기 전에.
- 선호 하는 방법에 의해 게놈 DNA를 격리 합니다. 이 작품에서 설명 하는 분석에 대 한 게놈 DNA 분리 키트 제조 업체의 프로토콜에 따라 이용 되었다. 여러 돌연변이 체 긴장은 동시에 분석할 수 있습니다.
- Microvolume 분 광 광도 계를 사용 하 여 게놈 DNA 농도 측정 합니다. 약 100 ng / µ L을 genomic DNA 농도 조정 합니다.
- 템플릿으로 게놈 DNA를 사용 하 여 단계 1의 표 3, Arb1 PCR 파편 (그림 3) 생성에 설명 된 대로 "PCR1 반응"을 실행. 이 단계에 대 한 프라이 머는 표 4에 나와 있습니다.
- 5 µ L PCR1 반응의 버퍼 로드 x 10의 0.5 µ L을 추가 하 고 1.5-2 %agarose 젤으로 로드 80-150 V에 젤을 실행.
참고: 특정 조각 길이 또는 특정 조각 범위는 기대 하지 않습니다, 그리고으로 임의의 뇌관 여러 위치에 바인딩할 수 있습니다 하나 이상의 밴드 존재할 수 있습니다. - 템플릿으로 PCR1 반응에서 DNA를 사용 하 여 단계 2의 표 3, Arb2 PCR 파편 (그림 3) 생성에 설명 된 대로 "PCR2 반응"을 실행. 이 단계에 대 한 프라이 머는 표 4에 나와 있습니다.
- PCR2 반응의 5 µ L 버퍼 로드 x 10의 0.5 µ L을 추가 하 고 1.5-2 %agarose 젤으로 로드 80-150 V에 젤을 실행.
참고: 특정 조각 길이 또는 특정 조각 범위는 기대 하지 않습니다, 그리고으로 임의의 뇌관 여러 위치에 바인딩할 수 있습니다 하나 이상의 밴드 존재할 수 있습니다. - 시퀀싱에 대 한 적절 한 transposon 특정 뇌관 함께 PCR2 반응을 보냅니다.
- 그들 폭발 링크를 사용 하 여 완전 한 PA14 게놈에 대 한 제공 하는 PA14NR 도서관 홈페이지 (http://pa14.mgh.harvard.edu/cgi-bin/pa14/blast.cgi) 또는 직접의 특정 유전자 시퀀스에 대 한 그들을 발 파 하 여 시퀀싱 결과 byBLASTing analize 관심의 돌연변이입니다.
참고: 선택 된 돌연변이 대 한 정보는 PA14NR 설정 웹 사이트 (검색 http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS 또는 다운로드 비중복 Library.xls 링크 http:/에서 파일을 검색 하 여 찾을 수 있습니다. / pa14.mgh.harvard.edu/cgi-bin/pa14/downloads.cgi).
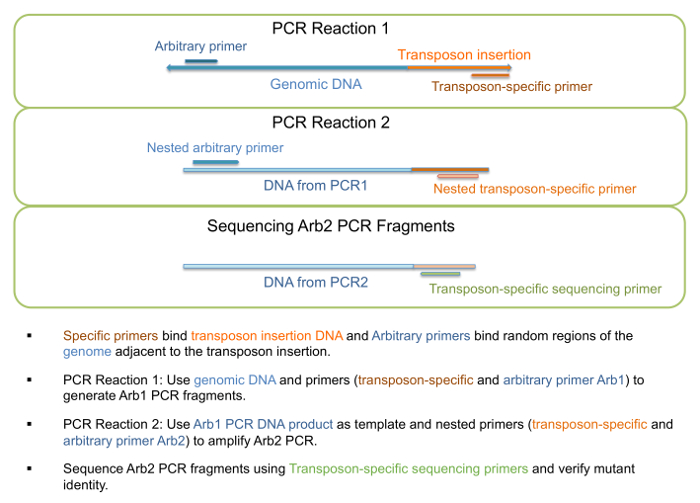
그림 3: PCR 증폭 및 시퀀싱 transposon 삽입 돌연변이의. PCR 증폭에 관여 하 고 돌연변이 정체성의 확인에 대 한 시퀀싱 단계 구조도 볼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| PCR 반응 설정 | |
| 1 단계 | 2 단계 |
| PCR1 반응: | PCR2 반응: |
| 23.25 µ L 물 (분자 생물학 등급) | 19.15 µ L 물 (분자 생물학 등급) |
| 3µL 10 x Taq 중 합 효소 버퍼 | Taq 중 합 효소 버퍼 x 5 µ L 10 |
| 0.5µL Taq 중 합 효소 | 0.6 µ L Taq 중 합 효소 |
| 0.625 µ L 20 µ M 뇌관 Arb1D (표 4) | 0.625 µ L 20 µ M 뇌관 Arb2A (표 4) |
| 0.625 µ L 20 µ M transposon 특정 뇌관 (PMFLGM. GB 3a 또는 Tn5Ext) (표 4) | 0.625 mL 20 µ M Transposon 특정 뇌관 (PMFLGM. GB 2a 또는 Tn5Int2) (표 4) |
| 1 µ L 10 mM dNTPs | 1 µ L 10 mM dNTPs |
| 1 µ L genomic DNA, 100 ng | 5 µ L PCR1 반응 |
| 30 µ L 최종 반응 볼륨 | 30 µ L 최종 반응 볼륨 |
| PCR 반응 설정 | |
| PCR1 Thermocycler 조건: | PCR2 Thermocycler 조건:: |
| 95 ° C-2 분 | 95 ° C-2 분 |
| 5 주기를 반복 합니다. | 30 주기를 반복 합니다. |
| 95 ° C-30 s | 95 ° C-30 s |
| 30 ° C-1 분 | 54 ° C-30 s |
| 72 ° C-1 분 | 72 ° C-1.5 분 |
| 30 주기를 반복 합니다. | 72 ° C-10 분 |
| 95 ° C-30 s | 4 ° C-보류 |
| 45 ° C-30 s | |
| 72 ° C-1 분 | |
| 72 ° C-10 분 | |
| 4 ° C-보류 |
표 3: PCR 반응 및 thermocycler 사용 조건 임의 PCR를 위해. 임의 PCR 반응을 순차적으로 수행 되 고 조각 PCR1 반응 중에 생성 된 PCR2 반응에서 서식 파일로 사용 됩니다. 반응의 각 집합에 대해 특정 thermocycler 설정이 사용 됩니다.
| 뇌관 이름 | 뇌관 순서 |
| MAR2xT7 Transposon 특정 뇌관 | |
| PMFLGM입니다. GB 3a | TACAGTTTACGAACCGAACAGGC |
| PMFLGM입니다. GB-2a | TGTCAACTGGGTTCGTGCCTTCATCCG |
| MAR2xT7 Transposon 시퀀싱 뇌관 | |
| PMFLGM입니다. GB 4a | GACCGAGATAGGGTTGAGTG |
| 테네시phoA Transposon 전용 프라이 머 | |
| Tn5Ext | GAACGTTACCATGTTAGGAGGTC |
| Tn5Int2 | GGAGGTCACATGGAAGTCAGATCCTGG |
| 테네시phoA Transposon 시퀀싱 뇌관 | |
| Tn5Int | CGGGAAAGGTTCCGTTCAGGACGC |
| 임의 뇌관 | |
| ARB1D | GGCCAGGCCTGCAGATGATGNNNNNNNNNNGTAT |
| ARB2A | GGCCAGGCCTGCAGATGATG |
표 4: 품질 관리에 사용 되는 뇌관의 목록 실험. 프라이 머 사용 PCR 증폭 및 transposon 삽입 돌연변이 돌연변이 정체성 확인의 시퀀싱에 대 한.
결과
PA14NR 설정의 12 개의 새로운 복사본, 그리고 생성 하는 새 복사본의 품질 관리 평가 프로토콜 III를 사용 하 여 실시 하는 프로토콜을 사용 하 여 복제 했다.
PA14NR 설정 컨트롤 플레이트, 야생 형식 PA14로 구성 된 함께 돌연변이 판 주사 및 미리 설정 된 패턴 (그림 4A)에 삽입 된 웰 스 uninoculated, 복제 된 metholo...
토론
P. 녹 농 균 PA14NR 설정 하는 것은 과학계에 대 한 귀중 한 자원 이다. Clarivate 분석의 중요 과학 지표 데이터베이스, Liberati 그 외 여러분 에서 3 월 2017 데이터 집합에 따라 (2006 년) 37, PA14NR 설정의 건설을 설명 하는 미생물학 간행물의 최고 1%에서 평가 된다. Google 학술 검색 보고 Liberati 그 외 여러분 의 600 인용 (2006 년) 8 월 2017로 원래 원고. 라이브러리는 e...
공개
저자는 금융 충돌의 관심을 보고. 엘리 아나 Drenkard와 프레드릭 Ausubel PA14 비중복 transposon 돌연변이 라이브러리 생성에 참가. 브라이언 헐리 Lael Yonker 현재 집와 매사 추세 츠 종합 병원에서 소아과의 부의 일환으로 돌연변이 라이브러리를 배포.
감사의 말
우리 데이터베이스 검색에 그녀의 지도 대 한 MGH 트레드웰 가상 라이브러리의 리사 Philpotts를 감사 하 고 싶습니다. 이 작품은 낭 성 섬유 증 기초 (YONKER16G0 및 HURLEY16G0) 및 NIH NIAID에 의해 지원 되었다 (BPH와 에이드: R01 A1095338).
자료
| Name | Company | Catalog Number | Comments |
| Materials for Library Replication | |||
| Sterile 96-well Tissue-culture treated, case of 50 | Corning Life Sciences | 353072 | via Fisher Scientific |
| Sterile 96 Well Clear V-Bottom 2000μL Deep Well Plates, case of 25 | Corning Life Sciences | 3960 | via Fisher Scientific |
| Nunc OmniTray (rectangular plates), case of 60 | Thermo Scientific Rochester | 242811 | via Fisher Scientific |
| Rectangular Ice Pan, Midi (4L) | Corning Life Sciences | 432104 | via Fisher Scientific |
| Secure-Gard Cone Mask, case of 300 | Cardinal Health | AT7509 | via Fisher Scientific |
| AluminaSeal, pack of 100 | Diversified Biotech | ALUM-100 | via Fisher Scientific |
| Breathe-Easy membrane, pack of 100 | Diversified Biotech | BEM-1 | via Sigma-Aldrich |
| Sterile, individually wrapped, 50mL Solution Trough/Reagent Reservoir, case of 100 | Sorenson | S50100 | via Westnet Incorporated |
| Plate roller | VWR | 60941-118 | via VWR |
| Cryo Laser Labels - CRYOLAZRTAG 2.64" x 0.277", pack of 16 sheets | GA International | RCL-11T1-WH | via Labtag.com (template for printing also available from Labtag.com) |
| 96-well replicator | V & P Scientific, Inc. | Custom 407C, 3.18mm pin diameter, 57mm long | via V & P Scientific, Inc. |
| Multitron Pro, 3mm Shaking incubator | Infors HT | l10003P | via Infors HT |
| Picus 12 Channel 50-1200μL Electronic Pipette | Sartorius | 735491PR | via Sartorius |
| Filter Tips 50-1200μL, pack of 960 | Biohit | 14-559-512 | via Fisher Scientific; use electronic multichannel-compatible tips |
| Dry Ice | User-specific vendor | ||
| Materials for Individual Mutant Storage | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Materials for Quality Control PCR | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| NanoDrop | Thermo Scientific | ND-2000 | via ThermoFisher |
| PCR Thermocycler | |||
| Omnistrips PCR Tubes with domed lids | Thermo Scientific | AB0404 | via Fisher Scientific |
| ART Barrier low-retention pipette tips (10 uL, 100 uL, 1000 uL) | Molecular BioProducts, Inc. | Z676543 (10 uL), Z676713 (100 uL), Z676802 (1000 uL) | via Sigma-Aldrich |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| MasterPure DNA Purification Kit | Epicentre | MCD85201 | via Epicentre Technologies Corp |
| GeneRuler 1 kb Plus DNA Ladder, ready-to-use | Thermo Scientific | SM1333 | via ThermoFisher |
| RediLoad Loading Buffer | Invitrogen | 750026 | via ThermoFisher |
| Chemicals | |||
| Chemicals for Library and Individual Mutant Storage | |||
| Glycerol MB Grade, 1L | Sigma Aldrich | G5516 | via Sigma-Aldrich |
| LB Broth | Per 1L dH2O: 10g tryptone, 5g yeast extract, 5g NaCl, 1ml 1N NaOH (Current Protocols in Molecular Biology. Wiley, 1994.) | ||
| Tryptone | Sigma Aldrich | T7293 | via Sigma-Aldrich |
| Yeast Extract | Sigma Aldrich | Y1625 | via Sigma-Aldrich |
| Sodium Chloride | Sigma Aldrich | S7653 | via Sigma-Aldrich |
| Sodium Hydroxide | Sigma Aldrich | S8045 | via Sigma-Aldrich |
| LB agar | See preparation above, add 15g Bacto Agar | ||
| Bacto Agar | Sigma Aldrich | A5306 | via Sigma-Aldrich |
| Gentamicin sulfate, 10g | BioReagent | 1405-41-0 | via Sigma-Aldrich |
| Kanamycin sulfate | Gibco | 11815024 | via ThermoFisher |
| Ethanol, 190 proof | Decon | 04-355-221 | via Fisher Scientific |
| Chemicals for Quality Control PCR | |||
| Primers | User-preferred vendor | See primers listed in Table 3 | |
| Corning cellgro Molecular Biology Grade Water | Corning | 46000CV | via Fisher Scientific |
| Taq Polymerase Buffer | Invitrogen | 10342020 | via ThermoFisher |
| Taq DNA Polymerase, recombinant | Invitrogen | 10342020 | via ThermoFisher |
| dNTPs | Invitrogen | 10297018 | via ThermoFisher |
| Agarose | Sigma | A9539 | via Sigma-Aldrich |
참고문헌
- Moradali, M. F., Ghods, S., Rehm, B. H. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Front Cell Infect Microbiol. 7, 39 (2017).
- Bleves, S., et al. Protein secretion systems in Pseudomonas aeruginosa: A wealth of pathogenic weapons. Int J Med Microbiol. 300 (8), 534-543 (2010).
- Breidenstein, E. B., de la Fuente-Nunez, C., Hancock, R. E. Pseudomonas aeruginosa: all roads lead to resistance. Trends Microbiol. 19 (8), 419-426 (2011).
- Flynn, K. M., et al. Evolution of ecological diversity in biofilms of Pseudomonas aeruginosa by altered cyclic diguanylate signaling. J Bacteriol. 198 (19), 2608-2618 (2016).
- Hazan, R., Maura, D., Que, Y. A., Rahme, L. G. Assessing Pseudomonas aeruginosa persister/antibiotic tolerant cells. Methods Mol Biol. 1149, 699-707 (2014).
- Klockgether, J., et al. Genome diversity of Pseudomonas aeruginosa PAO1 laboratory strains. J Bacteriol. 192 (4), 1113-1121 (2010).
- Mathee, K., et al. Dynamics of Pseudomonas aeruginosa genome evolution. Proc Natl Acad Sci U S A. 105 (8), 3100-3105 (2008).
- Taylor, P. K., Yeung, A. T., Hancock, R. E. Antibiotic resistance in Pseudomonas aeruginosa biofilms: towards the development of novel anti-biofilm therapies. J Biotechnol. 191, 121-130 (2014).
- Flume, P. A., Van Devanter, D. R. State of progress in treating cystic fibrosis respiratory disease. BMC Med. 10, 88 (2012).
- . Cystic Fibrosis Foundation Patient Registry 2015 Annual Data Report Available from: https://www.cff.org/Our-Research/CF-Patient-Registry/2015-Patient-Registry-Annual-Data-Report.pdf (2016)
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clin Microbiol Rev. 19 (2), 403-434 (2006).
- Sadikot, R. T., Blackwell, T. S., Christman, J., Prince, A. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia. Am J Respir Crit Care Med. 171 (11), 1209-1223 (2005).
- Song, Z., et al. Prosthesis infections after orthopedic joint replacement: the possible role of bacterial biofilms. Orthop Rev (Pavia). 5 (2), 65-71 (2013).
- National Nosocomial Infections Surveillance, S. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 32 (8), 470-485 (2004).
- Cohen, T. S., Parker, D., Prince, A. . Pseudomonas aeruginosa Host Immune Evasion. 7, 3-23 (2014).
- Fernandes, A., Dias, M. The microbiological profiles of infected prosthetic implants with an emphasis on the organisms which form biofilms. J Clin Diagn Res. 7 (2), 219-223 (2013).
- Khosravi, A. D., Ahmadi, F., Salmanzadeh, S., Dashtbozorg, A., Montazeri, E. A. Study of Bacteria Isolated from Orthopedic Implant Infections and their Antimicrobial Susceptibility Pattern. Res J of Microbiol. 4 (4), 6 (2009).
- Roemhild, R., Barbosa, C., Beardmore, R. E., Jansen, G., Schulenburg, H. Temporal variation in antibiotic environments slows down resistance evolution in pathogenic Pseudomonas aeruginosa. Evol Appl. 8 (10), 945-955 (2015).
- Fischer, S., et al. Intraclonal genome diversity of the major Pseudomonas aeruginosa clones C and PA14. Environ Microbiol Rep. 8 (2), 227-234 (2016).
- Wiehlmann, L., et al. Population structure of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 104 (19), 8101-8106 (2007).
- Lam, J. S., Taylor, V. L., Islam, S. T., Hao, Y., Kocincova, D. Genetic and functional diversity of Pseudomonas aeruginosa lipopolysaccharide. Front Microbiol. 2, 118 (2011).
- Choi, J. Y., et al. Identification of virulence genes in a pathogenic strain of Pseudomonas aeruginosa by representational difference analysis. J Bacteriol. 184 (4), 952-961 (2002).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proc Natl Acad Sci U S A. 101 (8), 2530-2535 (2004).
- Mikkelsen, H., McMullan, R., Filloux, A. The Pseudomonas aeruginosa reference strain PA14 displays increased virulence due to a mutation in ladS. PLoS One. 6 (12), e29113 (2011).
- Drenkard, E., Ausubel, F. M. Pseudomonas biofilm formation and antibiotic resistance are linked to phenotypic variation. Nature. 416 (6882), 740-743 (2002).
- Rahme, L. G., et al. Common virulence factors for bacterial pathogenicity in plants and animals. Science. 268 (5219), 1899-1902 (1995).
- Rahme, L. G., et al. Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors. Proc Natl Acad Sci U S A. 94 (24), 13245-13250 (1997).
- Kirienko, N. V., Cezairliyan, B. O., Ausubel, F. M., Powell, J. R. Pseudomonas aeruginosa PA14 pathogenesis in Caenorhabditis elegans. Methods Mol Biol. 1149, 653-669 (2014).
- Mahajan-Miklos, S., Tan, M. W., Rahme, L. G., Ausubel, F. M. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model. Cell. 96 (1), 47-56 (1999).
- Limmer, S., et al. Pseudomonas aeruginosa RhlR is required to neutralize the cellular immune response in a Drosophila melanogaster oral infection model. Proc Natl Acad Sci U S A. 108 (42), 17378-17383 (2011).
- Miyata, S., Casey, M., Frank, D. W., Ausubel, F. M., Drenkard, E. Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis. Infect Immun. 71 (5), 2404-2413 (2003).
- Coleman, F. T., et al. Hypersusceptibility of cystic fibrosis mice to chronic Pseudomonas aeruginosa oropharyngeal colonization and lung infection. Proc Natl Acad Sci U S A. 100 (4), 1949-1954 (2003).
- Pazos, M. A., et al. Pseudomonas aeruginosa ExoU augments neutrophil transepithelial migration. PLoS Pathog. 13 (8), e1006548 (2017).
- Maura, D., Hazan, R., Kitao, T., Ballok, A. E., Rahme, L. G. Evidence for direct control of virulence and defense gene circuits by the Pseudomonas aeruginosa quorum sensing regulator, MvfR. Sci Rep. 6, 34083 (2016).
- Jacobs, M. A., et al. Comprehensive transposon mutant library of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 100 (24), 14339-14344 (2003).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomonas aeruginosa PAO1. J Bacteriol. 194 (23), 6387-6389 (2012).
- Liberati, N. T., et al. An ordered, nonredundant library of Pseudomonas aeruginosa strain PA14 transposon insertion mutants. Proc Natl Acad Sci U S A. 103 (8), 2833-2838 (2006).
- Feinbaum, R. L., et al. Genome-wide identification of Pseudomonas aeruginosa virulence-related genes using a Caenorhabditis elegans infection model. PLoS Pathog. 8 (7), e1002813 (2012).
- Stewart, L., et al. Draft genomes of 12 host-adapted and environmental isolates of Pseudomonas aeruginosa and their positions in the core genome phylogeny. Pathog Dis. 71 (1), 20-25 (2014).
- Thrane, S. W., et al. The widespread multidrug-resistant serotype O12 Pseudomonas aeruginosa clone emerged through concomitant horizontal transfer of serotype antigen and antibiotic resistance gene clusters. MBio. 6 (5), e01396-e01315 (2015).
- van Belkum, A., et al. Phylogenetic Distribution of CRISPR-Cas Systems in Antibiotic-Resistant Pseudomonas aeruginosa. MBio. 6 (6), e01796-e01715 (2015).
- Lewenza, S., et al. Construction of a mini-Tn5-luxCDABE mutant library in Pseudomonas aeruginosa PAO1: a tool for identifying differentially regulated genes. Genome Res. 15 (4), 583-589 (2005).
- . . Current Protocols in Molecular Biology. , (1994).
- Breidenstein, E. B., Khaira, B. K., Wiegand, I., Overhage, J., Hancock, R. E. Complex ciprofloxacin resistome revealed by screening a Pseudomonas aeruginosa mutant library for altered susceptibility. Antimicrob Agents Chemother. 52 (12), 4486-4491 (2008).
- Musken, M., Di Fiore, S., Dotsch, A., Fischer, R., Haussler, S. Genetic determinants of Pseudomonas aeruginosa biofilm establishment. Microbiology. 156 (Pt 2), 431-441 (2010).
- Schurek, K. N., et al. Novel genetic determinants of low-level aminoglycoside resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother. 52 (12), 4213-4219 (2008).
- Oumeraci, T., et al. Comprehensive MALDI-TOF biotyping of the non-redundant Harvard Pseudomonas aeruginosa PA14 transposon insertion mutant library. PLoS One. 10 (2), e0117144 (2015).
- Yeung, A. T., et al. Swarming of Pseudomonas aeruginosa is controlled by a broad spectrum of transcriptional regulators, including MetR. J Bacteriol. 191 (18), 5592-5602 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유