Method Article
오래 비 코딩 RNA의 RNA 표적 식별에 RNA 풀 다운 절차
요약
이 RNA 풀 다운 메서드 오래 비 코딩 RNA (lncRNA)의 RNA 목표를 식별 수 있습니다. 집에서 만든, 설계 방지 감각 DNA oligonucleotide 프로브는 적절 하 게 고정 된 조직 또는 세포 라인에이 lncRNA에 교 잡에 따라, 효율적으로 수 있습니다는 lncRNA의 모든 RNA 대상의 캡처를.
초록
오래 비 코딩 RNA (lncRNA), 정의 된 독서 프레임 없이 200 뉴클레오티드의 순서는 규정 비 코딩 RNA의 가족에 속한다. 그들의 생물학 기능 크게 불명 하 게 남아 있지만 이러한 lncRNAs의 수는 꾸준히 증가 하 고 그것은 지금 인간 같은 10000 이상 성적 증명서를 할 수 있습니다 추정. 이들 중 일부는 RNA 공동-그리고 post-transcriptional 성숙의 다른 단계에서 뿐만 아니라 transcriptional 수준에서 일어나는 유전자 발현의 중요 한 규정 경로에 포함 될 알려져 있습니다. 후자의 경우에는 lncRNA에 의해 타겟으로하는 RNAs를 식별할 수 있다. 왜 유용 직접 관련 된 RNAs의 또는 간접적으로 관심의 lncRNA id를 사용 하는 방법을 개발 하는 이유입니다.
그 관련된 chromatin 시퀀스 함께 lncRNA의 격리 수 있도록 이전에 게시 프로토콜에 의해 영감을 했다,이 프로토콜 관련된 RNAs의 격리를 허용 하도록 적응 시켰다. 우리는 두 단계는이 프로토콜의 효율성에 대 한 중요 한 결정. 첫 번째는 특정 안티 감각 DNA oligonucleotide 프로브 관심의 lncRNA에 교배 할 수 디자인입니다. 이 위해, lncRNA 이차 구조 생물 정보학에 의해 예언 되었다 하 고 반대로 감각 oligonucleotide 프로브 내부 기본 페어링의 낮은 확률을 표시 하는 영역에 대 한 강한 친 화력으로 설계 되었습니다. 절차의 두 번째 중요 한 단계는 조직 또는 모든 분자 파트너 사이의 네트워크를 보존 하는 경작된 한 세포의 통 조건에 의존 합니다. 높은 처리량 RNA 시퀀싱와 결합,이 RNA 풀 다운 프로토콜의 lncRNA의 전체 RNA 위하여를 제공할 수 있습니다.
서문
여기에 설명 된 방법의 전반적인 목표는 긴 noncoding RNA (lncRNA)의 RNA 분자 파트너입니다. LncRNA 정의 독서 프레임 없이 200 뉴클레오티드의 순서에 해당 합니다. 그들 중 일부 유전자 표현 규제 transcriptional 수준 뿐만 아니라 RNA 공동-그리고 post-transcriptional 성숙의 다른 단계에 참여 해야 표시 되었습니다. 후자의 경우에는 lncRNA의 분자 파트너는 RNAs를 식별할 수 있습니다. 직접 관련 된 RNAs의 또는 간접적으로 관심의 lncRNA id를 사용 하는 방법 다음 개발에 필수적인 것입니다.
이전 게시 방법, 같은 RNA 정화 (짹짹)1,2 및 캡처 교 잡 분석의 RNA 대상 (차트)3,4, Chromatin 격리 허용의 높은 처리량 검색 RNA-바인딩 단백질 그리고 특정 lncRNA의 게놈 바인딩 사이트. 이러한 두 가지 방법에서 관심의 lncRNA은 처음 때 교배 biotinylated 보완 oligonucleotides 하 고 복잡 한 다음 streptavidin 비즈를 사용 하 여 절연. 이 두 기술 사이의 주요 차이점은 대상으로 lncRNAs 프로브 디자인 관련이 있습니다. 짹짹, RNA 물고기, 짧은 보완 DNA oligonucleotide 조사는 lncRNA의 전체 길이 타일을 풀 디자인의 구성에 의해 영감 을된 전략 대조적으로, 차트, 저자 교 잡에 사용할 수 있는 사이트를 조사 하는 lncRNAs에 RNase H 매핑 분석 결과 적응.
여기 디자인 안티 감각 DNA biotinylated oligonucleotide 프로브를 사용 하 여 내부의 낮은 확률을 표시 하는 영역에 대 한 강한 선호도 조사 생물 정보학을 선택 lncRNA 이차 구조5 모델링 제안 절차 페어링 자료. 이 절차는 기와 oligonucleotide 조사2 의 풀에 따라 그 보다 덜 비싸고 RNAse H 감도4에 따라 그 보다 적은 시간이 소요 되 고의 이점이 있다.
LncRNAs6post-transcriptional 유전자 규칙에 대 한 증거의 성장 시체로는 lncRNA의 목표는 RNAs의 캡처를 사용 하는 접근 방식을 개발에 매우 유용 하다. 또한, 대부분의 응용 프로그램에 대 한 사용할 수, 접근 경작된 한 세포와 조직 추출에서 최적화 되었다.
프로토콜
모든 절차 관리 및 라이선스 (86/609/EEC 및 2010/63/UE) 실험 동물의 사용에 대 한 유럽 경제 공동체 따라 부여 D. Becquet (현 데 부 슈-뒤-론, 인증 번호 13-002)을 수행 했다.
1. 조사 설계
-
관심의 lncRNA의 기본 시퀀스를 사용 하 여 "RNAstructure 웹 서버"5에 그것의 이차 구조를 생성 합니다.
참고:이 사이트에 다른 알고리즘을 사용할 수 있습니다. 3 예측 도구를 프로브 디자인에 대 한 최상의 결과 줄: "" (낮은 자유 에너지 구조) 배, "MaxExpect" (매우 가능성이 기본적인 쌍), 및 "Probnot" (가능성이 기본 쌍 pseudoknots 포함). 이러한 세 가지 분석 수행 하 고 비교할 수 있습니다. 비엔나 RNA websuite7등 다른 웹 서버도 사용할 수 있습니다.- 내부 기본 페어링의 낮은 확률을 표시 하 고이 지역에 대 한 강한 친화 력 가진 25 기초의 반대로 감각 oligonucleotide 프로브 디자인 영역을 선택 합니다.
참고: 이러한 프로브 GC 내용 40와 60% 사이 구성 한다. 사용 하 여 맞춤 검색 도구 (폭발), 확인 선택 된 반대로 감각 oligonucleotide 조사 선택한 셀 시스템에 표현 하는 다른 RNA에 있는 뉴클레오티드 순서를 인식 하지 못합니다.
- 내부 기본 페어링의 낮은 확률을 표시 하 고이 지역에 대 한 강한 친화 력 가진 25 기초의 반대로 감각 oligonucleotide 프로브 디자인 영역을 선택 합니다.
- 디자인 또한 일반적인 DNA oligonucleotide 조사 25 기지의도 선호도 다른 RNA 시퀀스에 대 한 관심의 lncRNA에 대 한 관심의 게놈에 표시.
- 3'-끝에 biotin과 프로브를 주문.
참고: 입체 방해를 줄이기 위해 triethyleneglycerol 스페이서와 함께 증가 하는 oligonucleotide Biotin 사이의 거리. 최적의 결과 위해 풀 다운의 결과의 특이성을 평가할 수 있을 것, 것이 좋습니다 디자인 3 다른 반대로 감각 oligonucleotide 조사 그리고 실험적으로 그들의 효율을 비교.
2. 교차 연결
-
경작된 세포 cross-linking
- 문화는 GH4C1 sommatolactotroph 햄의 F10 매체 15% 말 혈 청 및 2% 태아 종 아리 혈 청 보충 뇌 세포. 78.5 cm2 문화 접시에 합류까지 세포 성장. 이 약 1 × 107 셀에 해당합니다.
- 1 인산 염의 중간 볼륨 x 린스 식 염 수 (PBS)를 버퍼링 합칠 GH4C1 78.5 cm2 문화 판에서에서 세포 배양 매체를 제거
- PBS (78.5 cm2 요리 10 mL);에서 1 %paraformaldehyde 솔루션 셀 수정 이 솔루션은 4 %paraformaldehyde 재고 솔루션에서 갓 준비 되어야 한다. 실 온 (RT)에서 10 분 동안 동요에서 상호 링크.
주의: Paraformaldehyde (PFA)은 독성, 그리고 신중 하 게 처리 되어야 합니다. - 글리신 1.25 M (paraformaldehyde 솔루션의 10 mL 당 1 mL);의 1/10 볼륨을 추가 하 여 paraformaldehyde 액션을 끄다 실시간 5 분 교 반
- PBS의 중간 볼륨 X 1 (5 분) 시간 포부와 두 린스 하 여 미디어를 삭제 합니다.
- 1 해당 PBS의 볼륨 추가/미디어, 세포 스 크레이 퍼, 그리고 원심 분리기 튜브 다음 전송 수집 셀의 볼륨의 10.
- 5 분 동안 4 ° C에서 510 g에서 회전 합니다.
- 가능한 만큼 상쾌한을 제거 합니다.
- 알 약-80 ° c.에 필요에 따라 무기한 저장
-
조직 Cross-linking
- 1% paraformaldehyde PBS (약 10x 조직의 볼륨)에 희석의 솔루션에 갓 획득된 마우스 뇌 조직 5 mg, 실시간에서 10 분 동안 교 반
- 1.25 M 글리신 솔루션 (paraformaldehyde 솔루션의 10 mL 당 1 mL)을 추가 하 여 paraformaldehyde 행동 끄다 및 실시간 5 분 교 반
- 열망 하 여 미디어를 삭제 하 고 PBS (약 10x 조직의 볼륨) 두 번 린스. 가능한 만큼 상쾌한을 제거 합니다.
- 교차 연결 된 조직-80 ° c.에 무기한 저장
3. 세포 또는 조직 세포
- 세포의 용 해 버퍼 (50 mM Tris HCl pH 7.0, 10 mM EDTA, RNAse 억제제 솔루션의 200 U/mL와 프로 테아 제 억제제 5 µ L/mL의 칵테일 보충 1 %SDS)를 준비 합니다.
- 사전 해빙 없이 lysed 샘플을 얻기 위해 다시 셀 펠 릿 또는 교차 연결 된 조직이이 버퍼 (셀 펠 릿 또는 조직의 100 밀리 그램 당 약 1 mL)를 일시 중단 합니다. 1 x 107 세포에서 얻은 셀 펠 릿 lysed 샘플을 포함 하는 단백질의 대략 20 밀리 그램을 일으키 다.
참고: 사용 하는 조직에 따라 기계적 장애의 단계 추가 되어야 합니다. 이 경우에,이 추가 단계는 샘플의 난방을 피하기 위해 중요 하다.
4입니다. 쥡니다
-
쥡니다 조건의 최적화
- 30 s에서 2 ~ 5 시리즈 sonicator 30 프로그램에서 s.
- 테스트 희석된 lysed 샘플 (희석 계수 ½ ¼ 단백질의 약 10 또는 5 밀리 그램에 해당)에 쥡니다 조건 최적화를 수행 합니다. 장소에서 4 ° C 물 목욕 lysed 샘플을 희석 하 고 쥡니다 시리즈를 시작 합니다.
- RNA 정화 키트 또는 RNA 격리 시 (예, Trizol) RNAs를 정화.
- TBE 버퍼에 1 %agarose 젤 전기 이동 법에 순화 된 RNA의 총합을 로드, RNA 파편의 길이 확인 합니다. 이 길이 200, 800 bp 사이 배열 해야 한다.
참고: RNA 조각 크기에 따라 반대로 감각 oligonucleotide 조사 효율 달라질 수 있습니다. 그것은 다음 쥡니다의 다른 조건 하에서 시험의 효율성을 확인 하는 것이 좋습니다.
-
Lysed 샘플 쥡니다
- 4 ° C에 (단계 3.2 후 얻은) 단백질의 20 밀리 그램에 해당 하는 장소 lysed 샘플 목욕 물 하 고 단계 4.1에에서 최적화 된 쥡니다 시리즈를 시작 합니다.
- 직후 쥡니다, 4 ° c.에 12000 g에서 5 분 동안 원심 분리기 새로운 원심 분리기 튜브에서 supernatants 전송.
참고: 동질성 되도록 복제 supernatants 풀링되 고이 단계에서 재배포.
5. RNA 풀-다운
-
제 1 일 – 교 잡 단계
- 교 잡 버퍼 (50 mM Tris HCl pH 7.0, 750 mM NaCl, 1 mM EDTA, 1 %SDS, Formamide 임기 추가 15%)의 2 개를 추가 supernatants 쥡니다 단계 후 수집 하. 와 동입니다.
- 원심 분리기 튜브 (입력된 샘플)에 각 샘플의 20 µ L를 전송 하 고-20 ° c.에 저장
- 각 샘플에 100 pmol biotinylated oligonucleotide 프로브 (또는 비-; 표 1참조)를 추가 합니다. 실시간에서 튜브 회전에 적당 한 동요에 따라 4 ~ 6 h을 품 어
- 마그네틱 streptavidin 구슬의 50 µ L RNAse 억제제 솔루션의 200 U/mL와 프로 테아 제 억제제 5 µ L/mL의 칵테일 보충 추가 합니다.
- 실시간에서 튜브 회전에 적당 한 동요에서 밤새 품 어
-
제 2 일 – RNA 격리 단계
- 마그네틱 지원을 사용 하 여 구슬 세포 lysate에서 분리, 상쾌한, 폐기 및 세척 세척 버퍼의 900 µ L와 구슬 (SDS 0.5%, SSC 2 x). 반복 5 번 interspersed 실시간에 회전에 5 분 교 반
- 마지막 세척 후 마지막으로 한 번 가만히 따르다와 95 µ L Proteinease K 버퍼 (10 mM Tris HCl pH 7.0, 100 m m NaCl, 1 mM EDTA, 0.5 %SDS)의 추가 및 가수분해-K (20 mg/mL) 샘플의 5 µ L.
- 얼음에 입력된 샘플 (20 μ)을 해 동 하 고 Proteinease K 버퍼의 75 µ L 및 가수분해-K (20 mg/mL)의 5 µ L를 추가 합니다.
- 50 ° c에서 95 ° c.에 다음 10 분 45 분 K 성분 가진 모든 샘플을 품 어
- 마그네틱 지원 구슬 RNAs에서 분리 하기 전에 3 분 동안 얼음에 샘플을 진정. 상쾌한을 유지 하 고 구슬 삭제.
- RNA 정화 키트, DNA 소화 단계를 포함 해야 하는 RNAs를 정화. -80 ° c.에 RNAs를 저장
- 반전 녹음 방송 정량 (RT-정량) 뒤에 특정 뇌관 (표 1)를 사용 하 여 정량 실시간 키트를 사용 하 여 수행 합니다.
- 특정 Neat1 프로브 (표 1)의 각으로 얻은 두 개의 RNA 풀에 해당 하는 두 개의 DNA 라이브러리를 생성 합니다. 차세대 시퀀싱 시스템에서 시퀀싱을 수행 합니다.
결과
몇몇 최근 연구 lncRNAs 거의 모든 중요 한 생물 학적 과정에 필수적인 역할을 플레이 하 고이 역할 모두는 transcriptional 및 post-transcriptional 수준에서 발생 하는 유전자 발현의 통제를 통해 이루어집니다. 이 후자의 경우에서 보여주는 RNAs lncRNAs6의 대상이 될 수 있습니다.
LncRNA 핵 농축된 풍부한 사본 1 (Neat1) frontotemporal 치 매, 루 경화 증, 또는 간 질8,,910, 다른 neuropathologies에 연루 되 고 또한 misregulated 다른 암11,12.
이 lncRNA는 몸의 특정 핵, paraspeckles, 구조적 구성 요소 유전자 식13의 post-transcriptional circadian 규제에 참여 하 고 알려져 있습니다. 모든 세포의 핵에서 발견 되 고 뿐만 아니라 Neat1, 필요한 여러 RNA 의무적인 단백질 (RBP)14, 주위 뿐만 아니라 그들의 형성에 대 한 주위에 형성 하는 Paraspeckles15 핵 내의 RNA 대상 유지 수 실제로 알려져 있습니다. . Paraspeckles의 대형 다양 한 구성 요소의 협회를 통해 이루어집니다. 이 형성은 운전 RNA 대상13의 리듬 핵 보유 circadian 리듬 패턴을 표시 하려면 표시 했다. Paraspeckles에 의해 RNA 대상의 핵 보유는 RBP 바인딩을 통해 또는 RNA/RNA 협회를 통해 직접 발생할 수 있지만 paraspeckles에 의해 표적으로 하는 RNAs의 범위 결정 했다. 직접 대상으로 RNA를 식별 하기 위해 또는 직접 Neat1에 의해 RNA 풀 다운 프로토콜 설계 되었습니다 하지 고립과 조직 샘플 (참조 그림 1 그래픽에서 잘 경작된 한 세포에 모든 Neat1 RNA 대상의 id를 허용 하 프리젠테이션 기술)입니다.
프로토콜의 다른 lncRNA 전이 관련 된 폐 선 암 사본 1 (Malat1)의 RNA 대상 식별 또한 성공적으로 적용 했다. Malat1 요소를 접합 하는 여러 RNA와 핵 얼룩에 매우 보존 하 고 표현 lncRNA 이다. Malat1 여러 초기 사전 mRNA16,17의 접합의 규칙에 관련 된으로 알려져 있다.
(SO) 및 비 특정 oligonucleotide (통계청) 프로브는 여기 설명 된 프로브 디자인 전략을 사용 하 여 생성 되었습니다. 이 전략은 lncRNA의 이차 구조에 의해 예측 페어링 내부 자료의 낮은 확률을 표시 하는 영역의 선택에 및이 지역에 대 한 강한 친화 력 가진 특정 프로브 디자인에 의존 합니다. 이러한 생물 정보학 예측, Neat1의 일련의 예측 된 이차 구조의 그림의 대표적인 결과 (1480 2000 뉴클레오티드) 프로브 그림 2에 주어진 설계 두의 위치와 함께.
설계 된 프로브 GH4C1 배양 세포 및 마우스 뇌 조직 추출 물 (표 1)에 대 한 Neat1 Neat1 또는 Malat1 쥐를 이동 했다. Neat1 또는 Malat1 상대 농축 입력된 샘플을 기준으로 일반적인 및 특정 프로브에 대 한 계산 됩니다. 그림 3 풀 다운 Neat1 GH4C1 하 셀 라인 (그림 3A) 쥐에 게 특정 검색의 효율성을 표시 하 고 마우스 뇌 조직 추출 (그림 3B). 프로브 디자인 프로토콜을 사용 하 여 (그래서) 프로브 Malat1 감독 특정 oligonucleotide를 생성, 효율적인 프로브 다른 충분히 효율적 고 했다 하는 동안 얻은 하나 삭제 (그림 4A).
RNA 후 풀 다운 절차 실시간 정량 Pcr 실험, 어떤 RNAs 특정 뇌관 (표 1)으로 평가 하 여 다음 Neat1 또는 Malat1 GH4C1 추출 물에 관련 된 것으로 표시 했다. GH4C1 셀 추출 물에서 Neat1와 관련 된 RNAs 또한 뇌 조직 추출 물에서 Neat1와 관련 된 것으로 표시 했다. 실제로, Neat1 RNA 풀-다운, 후 Malat1 GH4C1 셀 라인와 마우스 뇌 조직 추출 물 (그림 5A)에 Neat1에 의해 타겟이 될 발견 되었습니다. 상호로, Neat1 Malat1 RNA 풀 다운 GH4C1 셀 (그림 4B)에서 특정 조사 수행 후 농축 크게 했다. 두 개의 lncRNAs 사이의 긴밀 한 관계를 강조 함으로써 이러한 결과 Neat1 및 Neat1 RNA 식18, 에 유사 콘텐츠를 표시 하는 Malat1 녹아웃 쥐에 의해 제안 Malat1의 잠재적인 co-regulatory 역할 19. GH4C1 세포와 뇌 하 수 체 특정 프로브 Neat1 RNA 풀 다운 다음 두 가지 주요 뇌 하 수 체 호르몬, 성장 호르몬 (Gh) (그림 5B)와 prolactin (Prl) (그림 5C)의 성적표 농축 크게 했다 추출, Neat1에 의해 두 가지 호르몬의 가능한 규칙을 제안 합니다. 비교할 때 사용 하는 두 가지 특정 프로브, 그것은 그들의 효율성 RNA 대상으로 간주 됩니다 (그림 5B 및 그림 5C)에 따라 다 수 등장. 이러한 결과 RNA 대상의 농축에 풀 다운 lncRNA의 농축에 최고의 효율성 뿐만 아니라 최고의 효율을 표시 선택 하려면 몇 가지 특정 프로브 디자인의 필요성을 강조 표시 합니다.
RNA 풀 다운 방법 또한 RNA 높 처리량 연속 관심13의 lncRNA의 RNA 목표의 포괄적인 목록을 얻으려면 다음 수 있습니다. GH4C1 뇌 세포 Neat1 RNA 풀 다운 위에서 설명한 두 가지 특정 프로브를 사용 하 여 수행한 후에 RNA-seq 분석. 그것은 지적 되어야는 통계청을 사용 하 여 부정적인 제어를 RNA-seq 분석에 복종 될 또한 RNA의 수준 복구 후 통계청과 RNA 풀 다운은 라이브러리의 건설을 허용 하기에 충분. 이것은 하지 경우 이전 경험13. 라이브러리 특정 프로브 사용 Tophat/커 프 스 단추를 사용 하 여 분석 된 후 생성 된 파이프라인20 과 당 kilobase 당 조각의 값만 녹취 록 1 계정으로 찍은 것 보다 더 높은 매핑된 읽기 (FPKM)의 백만. Neat1로 이동 하는 두 특정 프로브 목록을 얻은 (표 1) 평가 결과의 특이성을 교차 했다. 4,268 유전자 paraspeckles, GH4C1 셀13에 표현 된 성적 증명서의 28%와 관련 된 발견 되었다. 정량 분석 (그림 5A-C)를 사용 하 여 얻은 결과와 일치, Gh, Prl, 및 Malat1 녹취 록 Neat1와 관련 된 것으로 발견 됐다. RNA 풀 다운 방법은 따라서 lncRNAs와 그들의 RNA 목표 간의 상호 작용을 탐구 하는 효율적인 도구가 될 것으로 입증 되었다.
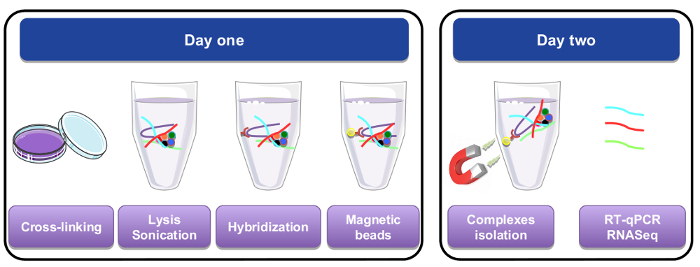
그림 1: RNA의 그래픽 표현을 풀 절차 다운. 첫 날, 세포 또는 조직 paraformaldehyde로 했더라도, lysed, 되었고 biotinylated 특정 프로브를 추가 하 여 수행 되었다 교 잡 단계 전에 sonicated. 마그네틱 streptavidin 구슬 다음 세포 lysate의 나머지에서 특정 자료를 별도 추가 되었습니다. 두 번째 날, 구슬 자석에 의해 분리 되었고 여러 번 씻어. 드-가교 단계 정화 되었고 실시간 정량 또는 RNA-seq 분석에 사용 되는 RNAs의 복구를 허용. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
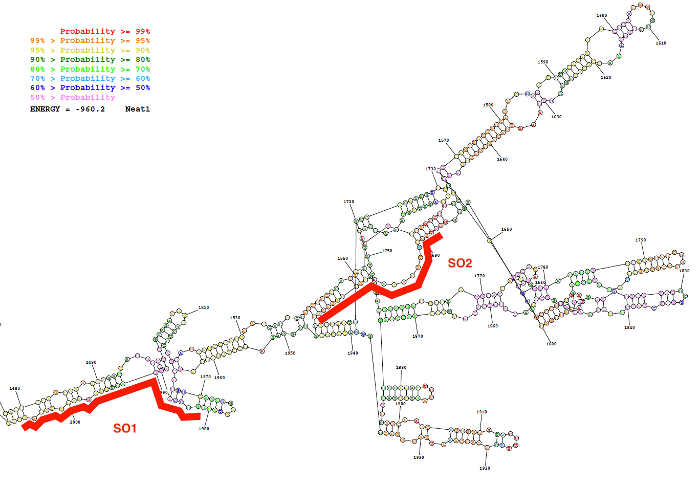
그림 2: 생물 정보학 리소스 (RNAstructure 웹 서버, 낮은 에너지 구조)에 의해 예측 Neat1 시퀀스 (1480 2000 뉴클레오티드)의 보조 구조. 구조는 기본 쌍의 확률의 정도 따라 색깔의. 두 oligonucleotides 프로브 (SO1, SO2) 빨간색에서 Neat1 RNA 구조에 따라 배치 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
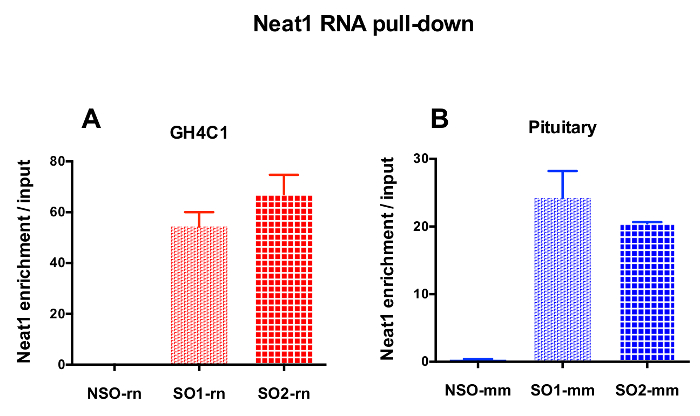
그림 3: 입력 대 Neat1 농축의 정량 확인. 두 개의 다른 특정 프로브 (SO1 rn 및 SO2-rn GH4C1 세포와 SO1 m m 및 뇌 조직에 대 한 s o 2 m m)는 일반적인 비교 하 여 정량 유효성 검사 Neat1 RNA 후 입력 대 Neat1 농축의 풀 다운 (통계청-rn GH4C1 세포와 통계청-m m 뇌 조직) GH4C1 쥐 세포 (A) 및 마우스 뇌 조직 추출 (B). 결과 평균 ± sem의 3 ~ 10 실험에서 얻은. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
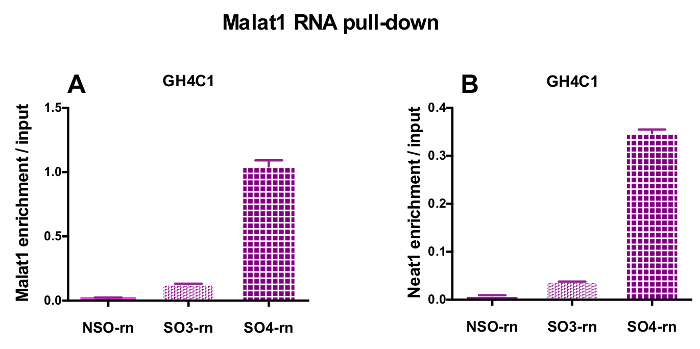
그림 4: 정량 유효성 검사 Malat1 RNA 후 입력 대 Malat1 및 Neat1 농축의 풀 다운. Malat1의 정량 유효성 검사 (A) 및 Neat1 Malat1 RNA 후 입력 대 (B) 농축 풀 다운 두 다른 특정 프로브 (SO3-rn 및 SO4-rn)는 일반적인 비교 하 여 하나 (통계청-rn) GH4C1 쥐 세포에서. 결과 평균 ± SEM 3 실험에서 얻은. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
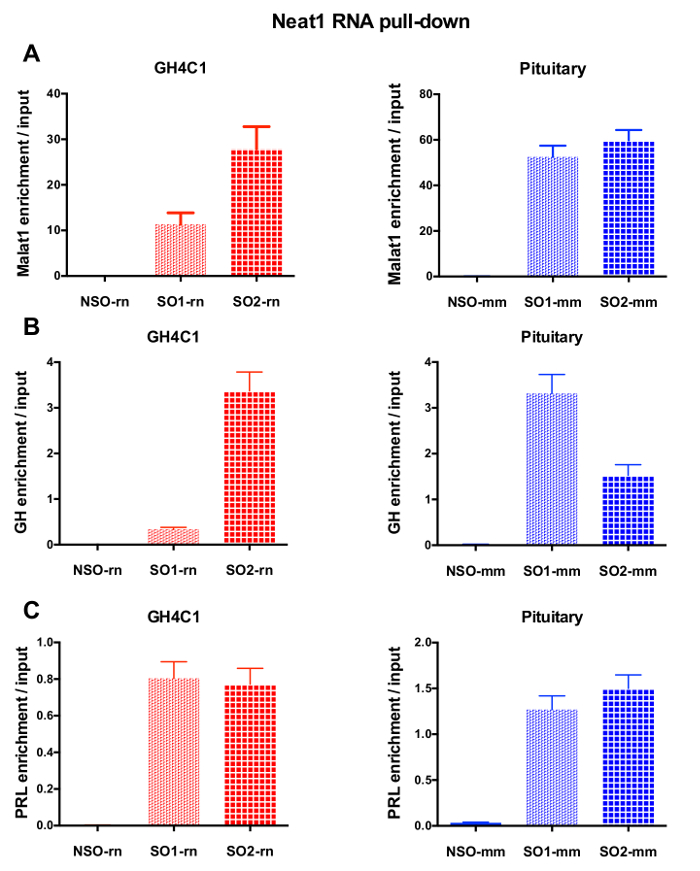
그림 5: 정량 Malat1, Gh, Prl 농축 입력 Neat1 RNA 풀 다운 후 대의 유효성 검사. Malat1의 정량 유효성 검사 (A), Gh (B), Neat1 RNA 후 대 입력 Prl (C) 농축 풀 다운 GH4C1 쥐 세포에서 일반적인 것에 비해 다른 특정 프로브를 사용 하 여 및 마우스 뇌 조직 추출. 결과 평균 ± sem의 3 ~ 8 실험에서 얻은. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 프로브 이름 | 시퀀스 | |
| 통계청-Rn | TAAAATACCATTTGATGTTTGAAATTAT | |
| SO1 Rn | CTCCACCATCATCAATCCTCTGGAC | |
| SO2-Rn | GCCTTCCCACATTTAAAAACACAAC | |
| SO3-Rn | AACTCGTGGCTCAAGTGAGGTGACA | |
| SO4-Rn | AAGACTCTCAGGCTCCTGCTCATTC | |
| 통계청-m m | GTTTGTGGTTTAACAGTGGGAAGGC | |
| SO1 mm | GCCTTCCCACTGTTAAACCACAAAC | |
| SO2-m m | CTCACCCGCACCCCGACTCCTTCAA | |
| 정량 Pcr 뇌관: | ||
| Rattus norvegicus | ||
| Neat1 | AAGGCACGAGTTAGCCGCAAAT | |
| TGTGCACAGTCAGACCTGTCATTC | ||
| Malat1 | GAAGGCGTGTACTGCTATGCTGTT | |
| TCTCCTGAGGTGACTGTGAACCAA | ||
| Gh1 | CCGCGTCTATGAGAAACTGAAGGA | |
| GGTTTGCTTGAGGATCTGCCCAAT | ||
| Prl | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
| 생쥐 | ||
| Neat1 | TGGGCCCTGGGTCATCTTACTAGATA | |
| CACAGCTGTTCCAATGAGCGATCT | ||
| Gh1 | CTCGGACCGTGTCTATGAGAAACTGA | |
| TTTGCTTGAGGATCTGCCCAACAC | ||
| Prl | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
표 1: DNA oligonucleotide 조사 및 정량 Pcr 뇌관의 시퀀스
토론
긴 noncoding RNAs (lncRNAs) 그들의 수 그리고 다양성에 의해 연구의 큰 분야 나타내고 그들의 역할의 대부분은 아직 발견 되. 이 lncRNAs의 많은 핵 지역화 하 고, 그들 가운데 일부는에서 내포 된 유전자 발현의 규정 경로 transcriptional 또는 posttranscriptional 메커니즘을 통해. 이 분야에 있는 현재 도전 중 하나는 RNAs의 post-transcriptional 처리에 그 lncRNAs의 관련성을 이해 하는 것입니다. 이 목적에 대 한 lncRNAs에 의해 표적으로 하는 RNAs를 식별할 수 있다. Chromatin와 lncRNAs의 협회에 집중 하는 이전 연구에 의해 영감을, 우리는 lncRNA와 관련 된 RNAs의 식별을 허용 하는 절차를 개발. RNA 풀-다운, 라는이 프로토콜의 성공은 이다 2 개의 중요 한 단계에 주로 의존, 즉 DNA oligonucleotide 조사는 반대로 감각의 디자인을 구체적으로 그리고 독점적으로 관심, lncRNA 및 조직의 조건 교배 또는 셀 고정 된 모든 분자 파트너 사이의 네트워크의 무결성을 유지 해야 합니다.
이전 게시 프로토콜의 연결된 chromatin 시퀀스 (짹짹1,2, 차트3,4) 함께 lncRNA를 분리 하는 절차를 제공 했습니다. 해당 프로토콜에서 다른 전략 반대로 감각 DNA biotinylated oligonucleotide 조사 디자인을 채택 되었다. 짹짹 절차에서 저자 모든 중복 및 일반적인 프로브1,2의 제외 후 관심의 lncRNA의 전체 길이 포함 하는 DNA biotinylated oligonucleotide 조사의 풀을 사용 합니다. 차트 프로토콜에서 저자는 lncRNA의 교 잡에 대 한 더 많은 액세스할 수 있는 영역을 식별 하 고 캡처 oligonucleotides 이러한 영역을 대상으로 설계 되었습니다. 이 지구는 그들의 RNase H 감도 근거 하 여 선정 됐다. 실제로, RNAs의 RNA DNA 바인딩 사이트에은 하의 RNAse H 속성을 사용 하 여 액세스할 수 있는 사이트는 lncRNA에 교배 oligonucleotides RNA DNA 하이브리드 생산 고는 lncRNA의 효소 분열. 저자는 이러한 후보 캡처 oligonucleotides의 3을 선택 하 고 칵테일3,4에 그들을 사용.
절차는 우리 디자인 안티 감각 DNA biotinylated oligonucleotide 조사에 가까운 차트 프로토콜에 사용 하는 데 사용 하지만 원하는 lncRNA의 교 잡 가능한 지역 그들의 RNAse H 감도 근거 하 여 선택 하지 했다 하지만 lncRNA 이차 구조의 생물 정보학 모델링 결정 내부 기본 쌍의 그들의 낮은 확률에 따라. 그것은 다른 알고리즘을 사용 하 여 다른 2 차 구조를 예측 것입니다 및 프로브를 선택 그 이차 구조 예측의 가장 큰 수에서 lncRNA의 사용 가능한 시퀀스에 교배 해야 발견 해야 합니다. 동일한 결과 개별적으로 설계 된 3의 칵테일, 특정 프로브 또는 단일 프로브를 사용 하 여 얻은 했다. 이 두 개의 별도, 특정 프로브를 사용 하 여 및 이러한 두 프로브에 공통으로 긍정적인 결과의 고려 라는 메시지가 나타납니다. 마지막으로, 따라서 최적의 결과 위한 방법의 개발의 시작 부분에 것이 좋습니다 하 고 풀 다운, 3 다른 반대로 감각 oligonucleotide 디자인의 결과의 특이성 평가 수 프로브 그리고 비교 실험적으로 그들의 효율성, 특히 이후 조사 효율성 세포 lysate 준비에 의해 변경 될 수 있습니다. 그럼에도 불구 하 고, 우리가 사용 하는 구조 유지 기와 oligonucleotide 조사2, 풀에 따라 보다 저렴 하 고이 기반으로 하는 방법 보다 적은 시간이 소요 되었다 보조 lncRNA의 생물 정보학 모델링에 따라 조사 설계의 절차 RNAse H 감도4에.
부정적인 통제 또한 부정적인 캡처 oligonucleotide 중 하나는 감각 DNA biotinylated oligonucleotide 프로브를 사용 하 여 수행 해야 또는 발진 oligonucleotide 조사, 또는 oligonucleotides 없는 RNA에 대 한 감독. 자연 센스 사본 lncRNAs의 존재 때문에 감각 oligonucleotide 프로브를 사용 하 여 때때로 수 있습니다 적절 한. 부정적인 컨트롤 선택 oligonucleotide 조사에 관계 없이 그것이 알려진된 RNA와 교배 하지 않는 폭발에 의해 확인이 oligonucleotide 수 여전히 취소 주석 lncRNA를 교배 하는 것을 명심 하 고 필요 합니다.
이 RNA 풀 다운 실험에 사용 되는 세포 lysates 10에서 가져온6 107 셀 작업을 조직 할 때 배양된 세포, 그리고 10 mg 1에서 작업 하는 경우에. 세포 lysates의 준비 최적화 될 수 있는 두 가지 주요 단계와 함께 사용 되는 조직 또는 세포 유형에 따라 적용할 필요가: 즉, 가교 단계는 lncRNA와 그것의 분자 파트너 사이 공유 결합의 형성을 허용 하 고는 쥡니다 chromatin를 분쇄 하 여 점도 감소 시키는 단계.
Cross-linking 단계의 목표는 모든 RNA 대상 모든 분자 파트너 사이의 네트워크의 형성을 유도 하 여는 lncRNA에 닫힌 유지 되도록 것입니다. lncRNA와 파트너 사이 공유 결합을 형성할 것 이다 paraformaldehyde 치료 단계 수 수 그물 모양의. 네트워크 차트 프로토콜에서 온 lysate 세포 핵 lncRNA paraformaldehyde로 첫 번째 치료를 수행 하기 위해 작업 하는 경우와 두 번째 제안 했다 고립 된 핵 분수3,4에 치료. 우리는이 보충 단계 감소, 조사의 효율성 아마 셀에 lncRNA 접근을 감소 시켜 관찰. 따라서, paraformaldehyde 여 망사 효과의 정도 적응 셀을 고려 또는 조직 유형 사용, 관심의 lncRNA 그리고 설계 된 프로브의 효율성의 지역화.
세포를 lysing 동안는 chromatin는 lysate에서 발표 되 고 증가 점도; 그것은 샘플의 유동성을 증가 하는 oligonucleotide의 접근성을 용이 하 게 따라서 쥡니다 여는 chromatin를 조각 하는 데 필요한 관심의 lncRNA를 조사 하는 다음. 그러나, 쥡니다 RNAs의 lncRNA 추출 분쇄기 또한 것 이다. 그것은 다음 200-800 bp. 쥡니다 시간 매우 있을 것 이다는 사이 구성 하는 동안 효율적으로 lysate의 점성을 감소 시킨다, 또한 수 RNA의 획득으로 조각 하는 방식으로 쥡니다 시간을 최소화 하는 것이 중요 수량 및 조직 또는 사용 하는 배양된 세포의 유형에 의존
끝으로, 여기에 설명 된 절차 수 있습니다 2-3 일에 원하는 lncRNA의 RNA 대상의 캡처를. 실시간 정량 Pcr와 결합, 이러한 방법을 찾고 특정 협회는 mRNA의 후보 접근 방식으로 원하는 lncRNA에 의해 허용 합니다. 게놈 넓은 접근에 대 한 RNA 풀 다운 실험 높은 처리량 RNA 시퀀싱 원하는 lncRNA와 관련 된 모든 RNAs의 검색을 허용 하 여 분석할 수 있습니다. 어떤 분석 전략 선택, RNA 풀 다운 절차 제공 해야 새로운 중요 한 지식을 RNA 규제에 lncRNAs에 의해.
공개
저자는 공개 없다.
감사의 말
이 작품 Aix 마 르 세 이유 대학과 CNRS에 의해 지원 하 고 화 이자 연구소에서 교부 금에 의해 투자 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Bioruptor Plus | Diagenode | B01020001 | Sonicator |
| Dynabeads My One | Thermo-Fisher | 65001 | Magnetic streptavidin beads |
| Formamide | Thermo-Fisher | 15515-026 | |
| Gel electrophoresis apparatus | Advance | Mupid-One | Gel electrophoresis apparatus |
| Proteinase K | Sigma | P2308 | |
| RNA XS purification kit | Macherey-Nagel | 740902 | RNA purificationkit |
| RNAseOUT | Thermo-Fisher | 10777-019 | RNAse inhibitor |
| Trizol | Thermo-Fisher | 15596018 | RNA purification |
| Tube Rotator | Stuart | SB2 | Eppendorf tube rotator |
| RNA to DNA | Thermo-Fisher | 4387405 | Reverse transcription kit |
| iTaq Universal SYBR Green Supermix | BioRad | 1725124 | qPCR reagent |
| Applied 7500 Fast | Thermo-Fisher | 4351107 | qPCR apparatus |
| Illumina TruSeq Stranded mRNA Sample Preparation kit | Illumina | 20020594 | DNA library construction kit |
| Illumina NextSeq 500 | Illumina | SY-415-1002 | NGS system |
참고문헌
- Chu, C., Qu, K., Zhong, F. L., Artandi, S. E., Chang, H. Y. Genomic maps of long noncoding RNA occupancy reveal principles of RNA-chromatin interactions. Mol Cell. , 667-678 (2011).
- Chu, C., Quinn, J., Chang, H. Y. Chromatin isolation by RNA purification (ChIRP). J Vis Exp. , e3912(2012).
- Simon, M. D., Wang, C. I., Kharchenko, P. V., West, J. A., Chapman, B. A., Alekseyenko, A. A., Borowsky, M. L., Kuroda, M. I., Kingston, R. E. The genomic binding sites of a noncoding RNA. Proc Natl Acad Sci U S A. , 20497-20502 (2011).
- Simon, M. D. Capture hybridization analysis of RNA targets (CHART). Curr Protoc Mol Biol. , Unit 21.25 (2013).
- Reuter, J. S., Mathews, D. H. RNAstructure: software for RNA secondary structure prediction and analysis. BMC Bioinformatics. 11, 129(2010).
- Sun, X., Haider Ali, M. S. S., Moran, M. The role of interactions of long non-coding RNAs and heterogeneous nuclear ribonucleoproteins in regulating cellular functions. Biochem J. , 2925-2935 (2017).
- Gruber, A. R., Lorenz, R., Bernhart, S. H., Neuböck, R., Hofacker, I. L. The Vienna RNA websuite. Nucleic Acids Res. , W70-W74 (2008).
- Tollervey, J. R., Curk, T., Rogelj, B., Briese, M., Cereda, M., Kayikci, M., König, J., Hortobágyi, T., Nishimura, A. L., Zupunski, V., Patani, R., Chandran, S., Rot, G., Zupan, B., Shaw, C. E., Ule, J. Characterizing the RNA targets and position-dependent splicing regulation by TDP-43. Nat Neurosci. , 452-458 (2011).
- Riva, P., Ratti, A., Venturin, M. The long non-coding RNAs in neurodegenerative diseases: novel mechanisms of pathogenesis. Curr Alzheimer Res. (27338628), (2016).
- Barry, G., Briggs, J. A., Hwang, D. W., Nayler, S. P., Fortuna, P. R., Jonkhout, N., Dachet, F., Maag, J. L., Mestdagh, P., Singh, E. M., Avesson, L., Kaczorowski, D. C., Ozturk, E., Jones, N. C., Vetter, I., Arriola-Martinez, L., Hu, J., Franco, G. R., Warn, V. M., Gong, A., Dinger, M. E., Rigo, F., Lipovich, L., Morris, M. J., O'Brien, T. J., Lee, D. S., Loeb, J. A., Blackshaw, S., Mattick, J. S., Wolvetang, E. J. The long non-coding RNA NEAT1 is responsive to neuronal activity and is associated with hyperexcitability states. Sci Rep. , 40127(2017).
- Adriaens, C., Standaert, L., Barra, J., Latil, M., Verfaillie, A., Kalev, P., Boeckx, B., Wijnhoven, P. W., Radaelli, E., Vermi, W., Leucci, E., Lapouge, G., Beck, B., van den Oord, J., Nakagawa, S., Hirose, T., Sablina, A. A., Lambrechts, D., Aerts, S., Blanpain, C., Marine, J. C. p53 induces formation of NEAT1 lncRNA-containing paraspeckles that modulate replication stress response and chemosensitivity. Nat Med. , (2016).
- Fang, J., Qiao, F., Tu, J., Xu, J., Ding, F., Liu, Y., Akuo, B. A., Hu, J., Shao, S. High expression of long non-coding RNA NEAT1 indicates poor prognosis of human cancer. Oncotarget. , (2017).
- Torres, M., Becquet, D., Blanchard, M. P., Guillen, S., Boyer, B., Moreno, M., Franc, J. L., François-Bellan, A. M. Circadian RNA expression elicited by 3'-UTR IRAlu-paraspeckle associated elements. Elife. , (2016).
- Fox, A. H., Lamond, A. I. Paraspeckles. Cold Spring Harbor Perspectives in Biology. , Available from: http://cshperspectives.cshlp.org/content/2/7/a000687.long (2010).
- Chen, L. L., DeCerbo, J. N., Carmichael, G. G. Alu element-mediated gene silencing. EMBO J. , 1694-1705 (2008).
- Tripathi, V., Ellis, J. D., Shen, Z., Song, D. Y., Pan, Q., Watt, A. T., Freier, S. M., Bennett, C. F., Sharma, A., Bubulya, P. A., Blencowe, B. J., Prasanth, S. G., Prasanth, K. V. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation. Mol Cell. , 925-938 (2010).
- Engreitz, J. M., Sirokman, K., McDonel, P., Shishkin, A. A., Surka, C., Russell, P., Grossman, S. R., Chow, A. Y., Guttman, M., Lander, E. S. RNA-RNA Interactions Enable Specific Targeting of Noncoding RNAs to Nascent Pre-mRNAs and Chromatin Sites. Cell. , 188-199 (2014).
- Nakagawa, S., Ip, J. Y., Shioi, G., Tripathi, V., Zong, X., Hirose, T., Prasanth, K. V. Malat1 is not an essential component of nuclear speckles in mice. RNA. , (2012).
- Zhang, B., Arun, G., Mao, Y. S., Lazar, Z., Hung, G., Bhattacharjee, G., Xiao, X., Booth, C. J., Wu, J., Zhang, C., Spector, D. L. The lncRNA Malat1 is dispensable for mouse development but its transcription plays a cis-regulatory role in the adult. Cell Rep. , 111-123 (2012).
- Trapnell, C., Roberts, A., Goff, L., Pertea, G., Kim, D., Kelley, D. R., Pimentel, H., Salzberg, S. L., Rinn, J. L., Pachter, L. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks. Nat Protoc. , 562-578 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유