JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
합성 및 전기 화학적 CO2 감소를 위한 전이 금속 단일 원자 촉매의 성능 Characterizations
요약
여기, 우리 합성에 대 한 프로토콜을 제시 하 고 수성 해결책에서 일산화 탄소를 선택적 이산화탄소 감소를 위한 활성 중심으로 그래 공석에 조정 전이 금속 단일 원자의 전기 테스트.
초록
이 프로토콜 모두 Ni 단일 원자 촉매의 합성 방법 및 그것의 촉매 활동 그리고 수성 CO2 감소 선택도의 전기 테스트를 제공 합니다. 다른 전통적인 금속 나노, 금속 단일 원자의 합성 그 단일 원자를 제한 하 고 집계에서 그들을 막을 수 있는 매트릭스 자료를 포함 한다. 우리는 전기 및 열 어 닐 링 Ni 단일 원자 분산 및 CO에 CO2 감소를 위한 활성 중심으로 그래 핀 셀, 조정 준비 하는 방법 보고. 합성을 하는 동안 N dopants Ni 원자를 트랩 하 그래 공석을 생성에 중요 한 역할을 재생 합니다. 수 차 수정 스캐닝 전송 전자 현미경, 3 차원 원자 조사 단층 그래 핀 공석에서 단일 Ni 원자 사이트 식별 채택 되었다. 전기 화학 공동2 감소 장치는 온라인 가스 착 색 인쇄기와 결합의 자세한 설정도 시연 했다. 금속 Ni에 비해 Ni 단일 원자 촉매 극적으로 향상 된 CO2 감소를 전시 하 고 H2 진화 측 반응 억제.
서문
화학 물질이 나 깨끗 한 전기를 사용 하 여 연료로 변환 CO2 CO2 배출량1,2,3,4,를 더 방지 하기 위하여 잠재적인 노선으로 점점 더 중요 해지고 있다 5,6. 그러나,이 실용적인 응용 프로그램은 현재 도전 저조 및 CO2 감소 반응 (CO2RR) 높은 운동 장벽과 경쟁 때문에 수성 수소 진화 반응 (그녀의)의 선택 미디어입니다. 전통적인 전이 금속 촉매 Fe, Co, Ni, 등의 대부분 때문에 그들의 뛰어난 활동 그녀의7,8낮은 CO2RR 선택도 전시 한다. 이러한 전이 금속 촉매의 반응 경로 변경 하려면 그들의 물성을 효과적으로 조정 된다 그들의 CO2RR 선택도 향상 시키기 위해 중요 한. 촉매의 전자 속성을 수정 하려면 다른 방법 중에서 그들의 대량 대응에 비해 그들의 극적으로 변경 된 촉매 행동 때문에 최근 집중적인 관심을 끈다 단일 원자 형태에 금속 원자를 분산 9 , 10 , 그러나 11., 무제한 원자의 높은 기동성으로 인해 그것은 매우 지지 물질의 존재 없이 단일 금속 원자를 도전. 따라서, 호스트 매트릭스 소재 제한 및 전이 금속 원자와 조정 하기 위해 만든 결함은 필요입니다. 이 새로운 기회를 열 수: 1) CO2RR 액티브 사이트, 및 2로 전환 금속의 전자 속성 조정) 동시에 비교적 간단한 원자 조정 기본적인 메커니즘 연구에 대 한 유지. 또한, 한정 된 환경에 갇혀 그 전이 금속 원자 수 없습니다 쉽게 이동 촉매 nucleation 또는 많은 경우12,13 에서에서 관찰 된 표면 원자의 개조를 방지 하는 동안 14.
CO2 감소와 그녀의 촉매 반응에 그들의 높은 전자 전도도, 화학적 안정성, 및 inertness 금속 단일 원자에 대 한 호스트 특정 관심의 2 차원 다층된 그래 핀이입니다. 더 중요 한 것은, Fe, Co와 Ni 금속15그들의 표면 탄소 graphitization 프로세스를 catalyze 수 알려져 있었다. 즉, 그 전환 금속 높은 온도 열 어 닐 링 과정 중 탄소와 합금 것 이다. 때 온도, 탄소 합금 위상 침전을 시작 하 고 양식 그래 레이어에 전이 금속 표면에 촉매. 이 과정 동안, 그래 핀 결함 생성, 금속 단일 원자 것 갇혀 있을 그 그래 핀 결함에 CO2RR16,17,,1819에 대 한 활성 사이트. 여기, 우리는 제공 온라인 공동의 명시적 데모2 감소 제품 분석 단일 원자 촉매 분야에 새로운 실무자 수 있도록 하려는이 상세한 프로토콜을 보고 합니다. 자세한 내용은 우리의 최근에 출판 된 제19 와 관련된 작품20,21,,2223의 시리즈에서 찾을 수 있습니다.
프로토콜
1. Ni 단일 원자 촉매 (닌-GS)의 준비
- 전기 전조 솔루션의 준비
- 20 mL 섬광 유리병, 분해의 polyacrylonitrile 0.5 g (Mw= 150000), polypyrrolidone의 0.5 g (Mw= 1300000), Ni (3)2·6H2의 0.5 g O, 그리고 dicyandiamide (DCDA) 10 ml에서의 0.1 g dimethylformamide (DMF).
- DMF 혼합 80 ° C에가 열 하 고 모든 고분자와 소금을 녹이 고 명확한 솔루션은 관찰 될 때까지 지속적인 감동으로 80 ° C에 혼합물을 유지.
- 고분자 섬유를 생산 하는 전기
- 기존의 전기 매개 변수 설정: 15 kV 정적 전기 전압, 공기의 15 cm의 간격 거리, 8 × 8 cm 탄소 섬유 종이 (CFP)-컬렉션 기판 4 kV 전기 전압.
- 5 mL 주사기로 전조 솔루션의 5 mL을 추출, 1.2 mL의 유량에 주사기 펌프 시작 h−1, 그 후에 시작 된 전기.
참고: 높은 전압 전기 사용 됩니다. 비록 매우 낮은 전류 되 면 시스템을 통해 프로세스를 회전 하는 동안 절연된 나무 캐비닛은 좋습니다. - 전기 프로세스가 완료 되 면 CFP 기판 꺼내 주세요. 고분자 섬유 영화 CFP 표면 커버.
- 탄소 나노튜브에 어 닐 링 폴리머 섬유
- 준비로 폴리머 섬유 영화/c f P 상자 용광로에서 1.5 h에서 300 ° C에가 열 하 고 0.5 h는 고분자를 산화를 위한 온도 유지.
참고: 산화 과정 후 nanofibers (NFs)은 자체 독립 영화 인 탄소 종이에서 분리. - 가 위를 사용 하 여 그 nanofibers 작은 조각으로 잘라 (~ 0.5 c m × 2 c m) 석 영 보트에 그들을 놓습니다.
- 석 영 보트 튜브로 놓고 가스 (5% H2 ar에서) 분위기를 형성 하는 내 deaerate. 100 sccm으로 가스 유량과 1 토르로 압력 유지.
- 이내 10 분 300 ° C에 올 렸 고 2 h 750 ° C, 또 다른 1 시간에 대 한 유지 및 자연 냉각 이어서 어디에 올 렸 열.
- 준비로 폴리머 섬유 영화/c f P 상자 용광로에서 1.5 h에서 300 ° C에가 열 하 고 0.5 h는 고분자를 산화를 위한 온도 유지.
- 볼 밀으로 합성 닌 GS 촉매 촉매 및 characterizations nanopowders 5 분.
2. 전기 CO2 감소 측정
- 셀 및 전극
- 다음 측정 0.1 M KHCO3 전해질을 준비, 먼저 KHCO3 초순의 250 ml의 2.5 g 녹 다음 0.1에서 2 개의 흑연 막대 사이의 전기 분해에 의해 전해질을 정화 제거를 24 h에 대 한 mA 추적 양의 금속 이온입니다.
- 신선한 (화학적) 광택된 유리 탄소 (1 cm × 2 c m), 고는 화학적 불활성, 소수 성 왁 스, 작업 전극 기판으로 가진 그것의 후부를 커버.
- 4 mL 섬광 유리병을 받아, 에탄올의 1 mL와 유리병, 내 오노 솔루션 2-proponal (5%)의 100 µ L 닌 GS 촉매로 준비의 5 mg을 혼합 하 고 균질 촉매 잉크 정지를 20 분 동안 sonicate.
- 피펫으로 80 µ L 2 cm2 유리 탄소 표면 (0.2 mg cm-2 대량 로드), 고 진공에 촉매 잉크의 건조는 촉매 사용 전에 desiccator 덮여 전극.
- 백 금 포 일 및 포화 calomel 전극 (SCE)는 카운터 및 참조 전극으로 각각 사용 합니다.
- 사용자 지정 된 기밀 H 형 유리 셀, 양성자 교환 멤브레인, 위의 3 전극 조립 뿐만 아니라 전기 테스트 실행에 대 한 구분을 사용 합니다.
- 작업 전극 및 H-셀의 한 구획에 SCE 기준 전극과 Pt 호 일 전극 다른 챔버에 배치 합니다. 주사 ~ H-셀의 각 구획에 전해질의 25 mL.
- H-셀에 3 전극 잠재적인 제어를 위한 전기 화학 워크 스테이션에 연결 합니다.
- N2으로 30 분 (질량 유량 컨트롤러에 의해 모니터링) 50.0 sccm에 N2 와 전해질 거품-0.1 m M KHCO3포화.
- EC 연구소 소프트웨어에서 주기적 Voltammetry (CV) 기법을 선택, "10 V V-10", "E (잠재력) 범위" 설정 5 연속 이력서 검색을-0.5 V에서에서-1.8 V (SCE) 대 N2에서 50 mV/s의 스캔 속도로 수행 "나 범위 (현재)" "자동"으로-0.1 m M KHCO3포화.
- 50 sccm CO2 가스 흐름을 변경, CO2로 30 분 대기-0.1 m M KHCO3 전해질 포화 및 다음 전기에 걸쳐 같은 공동2 흐름 유지.
- EC-실험실 소프트웨어에 CV 기법을 선택, "10 V V-10", "E (잠재력) 범위" 설정 5 연속 이력서 검색을-0.5 V에서에서-1.8 V (SCE) 대 공동250 mV/s의 스캔 속도로 수행 "나 범위 (현재)" "자동"으로-0.1 m M KHCO3포화.
- 즉,전해질의 pH 값을 결정 하는 pH 미터를 사용 하 여., 0.1 m M KHCO3 N2 또는 CO2와 함께 포화.
- 변환 모든 잠재력을 사용 하 여이 작업에 해독 가능한 수소 전극 (토크쇼) 규모를 SCE에 대 한 측정 전자 (vs RHE) = E (vs SCE) + 0.244 V + 0.0591 × pH.
- 200 kHz를 0.1 Hz에서 Potentiostatic 전기 임피던스 분광학 (PEIS) 기술, 다음 설정된 주파수 범위를 선택 하 여 EC 연구소 소프트웨어에서 솔루션 저항 (Ru)를 결정 합니다, 그리고 저항 값을 기록 합니다.
- 수동으로 iR보상-E로 드롭 (iR 수정 vs RHE) = E (vs 토크쇼)-Ru × 나 (평균 전류 암페어).
- 온라인 가스 크로마 토 그래프 (GC)에 의해 CO2 감소 제품 분석
- GC, CO2RR 중 가스 제품 분석을 위한 분자 체 5A 및 micropacked 열의 조합으로 장비를 사용 합니다.
참고: 자세한 GC 열 형식은 연결 된 테이블의 자료에서 찾을 수 있습니다. - Methanizer 정량 분석 공동 콘텐츠 또는 다른 알칸 종 계량 H2 농도, 열 전도성 검출기 (TCD) 불꽃 이온화 검출기 (FID) 사용 합니다.
- H2 와 CO 농도의 보정 곡선에 대 한 두 개의 다른 표준 가스를 사용 하 여 (H2: 100, 1042 ppm; CO: 100와 496.7 ppm; 균형 아르곤).
- CO2를 포함 하는 음극 구획에 CO2 를 제공 하는 전기 분해, 동안 50.0 sccm에서 CO2 가스 유량을 유지-포화 0.1 M KHCO3 전해질, 및 환기 GC에 배기.
- 단계적 조정-0.3에서-1.0 V 토크쇼, 대에 이르기까지 작업 전극에 전압 유지 ~ 각 잠재력과 레코드 해당 chronoamperimetric 곡선에 대 일 분.
- H2 와 FID 및 TCD 신호에서 배기 가스에 CO 내용을 각각 결정 합니다.
참고: 가스 제품의 지속적인 전기 분해 후 샘플링 됩니다 ~ 각 잠재력에서 10 분. 50 sccm의 CO2 가스와 함께 지속적으로 혼합 생산 H2 와 공동, 전기 분해 동안 GC의 샘플링 루프 (1 mL)을 통해 흘 렀 다. - 아래 주어진된 가스 제품에 대 한 부분 전류 밀도 계산.
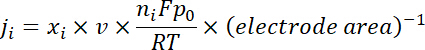
x나 보정 곡선 참조 온라인 GC에 의해 결정 하는 특정 제품의 볼륨 분수는 2 개의 표준 가스 샘플에서 (스 캇과 Airgas), v 50 sccm의 유량, n나 수 전자의 참여, p0 = 101.3 kPa, F Faradaic 상수 이며 R 은 기체 상수 이다. - 해당 Faradaic 효율성 (FE)로 각 잠재력에서 계산
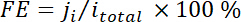 .
.
참고: 전체 Faradaic 효율성 가스 유량, 전류 밀도, 그리고 GC에 가스 농도 분석에서 오류로 인해 90 ~ 110%의 범위 내에서 될 수 있습니다.
- GC, CO2RR 중 가스 제품 분석을 위한 분자 체 5A 및 micropacked 열의 조합으로 장비를 사용 합니다.
결과
스캐닝 전자 현미경 (SEM), 스캐닝 전송 전자 현미경 (줄기) 및 에너지 흩어진 엑스레이 분광학 (EDX) 매핑 이미지 닌-GS의 형태학 특성에 대 한 그림 1 에 나와 있습니다. 3 차원 원자 조사 단층 촬영 (3D-아파트) 결과 그들의 이웃 화학 환경 뿐 아니라 단일 Ni 사이트 배포의 직접 식별에 대 한 그림 2 에 표시 됩니다. 온라인 전기 GC 측?...
토론
위의 전기 과정에서 두 가지 중요 한 단계 소재 합성 절차에 주목 한다: 1) 난방 DMF 혼합 (1.1.2 단계), 및 회전 속도 맞게 2) 펌프 속도 조정 (1.2.2 단계). 그림 1A 에서 SEM 화면은 서로 상호 얻은 탄소 nanofibers (~ 200 nm 직경에서). 그들은 작은 조각으로 characterizations 그림 1B와 같이 대 한 밀링 공에 의해 깨진 했다. Ni 나노 탄소 nanofibers에 균일 하 게 분산 되었습...
감사의 말
이 작품은로 랜드 연구소의 하버드 대학에서로 랜드 휄 로우 프로그램에 의해 지원 되었다. 이 작품 수행한 일부 센터에서 대 한 나노 시스템 (CNS), 수상에서 국립 과학 재단에 의해 지원 되는 국가 나노기술 인프라 네트워크의 일원이 아니. ECS-0335765입니다. CNS는 하버드 대학교의 일부입니다.
자료
| Name | Company | Catalog Number | Comments |
| syringe pump | KD Scientific | KDS-100 | |
| tube furnance | Lindberg/Blue M | TF55035A-1 | |
| ball miller | SPEX SamplePrep | 5100 | |
| electrochemical work station | BioLogic | VMP3 | |
| pH meter | Orion | 320 PerpHecT | 2 points calibration before use |
| gas chromatograph | Shimadzu | GC-2014 | a combined seperation system consisting of molecular sieve 5A, Hayesep Q, Hayesep T, and Hayesep N |
| mass flow controller | Alicat Scientific | MC-50SCCM-D/5M | |
| ultrapure water system | Millipore | Synergy | |
| vacuum desiccator | PolyLab | 55205 | |
| polyacrylonitrile | Sigma-Aldrich | 181315 | Mw=150,000 |
| polypyrrolidone | Sigma-Aldrich | 437190 | Mw=1,300,000 |
| Ni(NO3)26H2O | Sigma-Aldrich | 244074 | |
| dicyandiamide | Sigma-Aldrich | D76609 | |
| dimethylformamide | Sigma-Aldrich | 227056 | |
| carbon fiber paper | AvCarb | MGL370 | |
| Nafion 117 membrane | Fuel Cell Store | 117 | used as proton exchange membrane in H-cell |
| KHCO3 | Sigma-Aldrich | 431583 | further purified by electrolysis |
| platinum foil | Beantown Chemical | 126580 | |
| saturated calomel electrode | CH Instruments | CHI150 | |
| glassy carbon electrode | HTW GmbH | SIGRADUR | 1 cm × 2 cm |
| wax | Apiezon | W-W100 | |
| Nafion 117 solution | Sigma-Aldrich | 70160 | used as ionomer in catalyst ink preparation |
| forming gas | Airgas | UHP | 5% H2 balanced with Ar |
| carbon dioxide | Airgas | LaserPlus | |
| sandard gas | Airgas | customized | 500 ppm CO, 500 ppm CH4, 1000 ppm H2 balanced with Ar |
| sandard gas | Air Liquide | customized | 100 ppm H2, 100 ppm CO and other alkanes balanced with Ar |
참고문헌
- Lewis, N. S., Nocera, D. G. Powering the planet: Chemical challenges in solar energy utilization. P. Natl. Acad. Sci. USA. 103, 15729-15735 (2006).
- Appel, A. M., et al. Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation. Chem. Rev. 113, 6621-6658 (2013).
- Jhong, H. R., Ma, S. C., Kenis, P. J. A. Electrochemical conversion of CO2 to useful chemicals: current status, remaining challenges, and future opportunities. Curr. Opin. Chem. Eng. 2, 191-199 (2013).
- Ashford, D. L., et al. Molecular Chromophore-Catalyst Assemblies for Solar Fuel Applications. Chem. Rev. 115, 13006-13049 (2015).
- Nocera, D. G. Solar Fuels and Solar Chemicals Industry. Accounts. Chem. Res. 50, 616-619 (2017).
- Larrazabal, G. O., Martin, A. J., Perez-Ramirez, J. Building Blocks for High Performance in Electrocatalytic CO2 Reduction: Materials, Optimization Strategies, and Device Engineering. J. Phys. Chem. Lett. 8, 3933-3944 (2017).
- Hori, Y., Wakebe, H., Tsukamoto, T., Koga, O. Electrocatalytic Process of Co Selectivity in Electrochemical Reduction of Co2 at Metal-Electrodes in Aqueous-Media. Electrochim. Acta. 39, 1833-1839 (1994).
- Hori, Y. . Modern aspects of electrochemistry. , 89-189 (2008).
- Lin, S., et al. Covalent organic frameworks comprising cobalt porphyrins for catalytic CO2 reduction in water. Science. 349, 1208-1213 (2015).
- Zhang, X., et al. Highly selective and active CO2 reduction electrocatalysts based on cobalt phthalocyanine/carbon nanotube hybrid structures. Nat. Commun. 8, 14675 (2017).
- Zhao, C. M., et al. Ionic Exchange of Metal Organic Frameworks to Access Single Nickel Sites for Efficient Electroreduction of CO2. J. Am. Chem. Soc. 139, 8078-8081 (2017).
- Manthiram, K., Beberwyck, B. J., Aivisatos, A. P. Enhanced Electrochemical Methanation of Carbon Dioxide with a Dispersible Nanoscale Copper Catalyst. J. Am. Chem. Soc. 136, 13319-13325 (2014).
- Yang, M., et al. Catalytically active Au-O(OH)(x)-species stabilized by alkali ions on zeolites and mesoporous oxides. Science. 346, 1498-1501 (2014).
- Manthiram, K., Surendranath, Y., Alivisatos, A. P. Dendritic Assembly of Gold Nanoparticles during Fuel-Forming Electrocatalysis. J. Am. Chem. Soc. 136, 7237-7240 (2014).
- Amini, S., Garay, J., Liu, G., Balandin, A. A., Abbaschian, R. Growth of large-area graphene films from metal-carbon melts. J. Appl. Phys. 108, 094321 (2010).
- Krasheninnikov, A. V., Lehtinen, P. O., Foster, A. S., Pyykkö, P., Nieminen, R. M. Embedding Transition-Metal Atoms in Graphene: Structure, Bonding, and Magnetism. Phys. Rev. Lett. 102, 126807 (2009).
- Jiang, K., Siahrostami, S., Zheng, T., Hu, Y., Hwang, S., Stavitski, E., Peng, Y., Dynes, J., Gangishetty, M., Su, D., Attenkofer, K., Wang, H. Isolated Ni Single Atoms in Graphene Nanosheets for High-performance CO2 Reduction. Energy Environ. Sci. , (2018).
- Rodríguez-Manzo, J. A., Cretu, O., Banhart, F. Trapping of Metal Atoms in Vacancies of Carbon Nanotubes and Graphene. ACS Nano. 4, 3422-3428 (2010).
- Jiang, K., et al. Transition metal atoms in a graphene shell as active centers for highly efficient artificial photosynthesis. Chem. 3, 950-960 (2017).
- Jiang, K., Wang, H., Cai, W. B., Wang, H. T. Li Electrochemical Tuning of Metal Oxide for Highly Selective CO2 Reduction. ACS Nano. 11, 6451-6458 (2017).
- Jiang, K., et al. Silver Nanoparticles with Surface-Bonded Oxygen for Highly Selective CO2 Reduction. ACS Sustain Chem. Eng. 5, 8529-8534 (2017).
- Siahrostami, S., et al. Theoretical Investigations into Defected Graphene for Electrochemical Reduction of CO2. ACS Sustain Chem. Eng. 5, 11080-11085 (2017).
- Jiang, K., et al. Metal Ion Cycling of Cu Foil for Selective C-C Coupling in Electrochemical CO2 Reduction. Nat. Catal. , (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유