JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
말 초 혈액 및 림프 조직에서 기본 인간 T 세포의 시 냅 스 인터페이스의 평가
요약
프로토콜 평면 지질 bilayers를 사용 하 여 시 냅 스 인터페이스를 형성 하는 기본 polyclonal 인간 T 세포의 기능을 연구 하는 기법을 설명 합니다. 우리 림프절과 주변 혈액에서 파생 하는 인간의 기본 T 세포의 차별 시 냅 스 형성 기능을이 기법을 사용 합니다.
초록
역학의 현재 이해 및 T-세포 시 냅 스 인터페이스의 구조 기능 지원 되는 유리 평면 bilayers 및 생체 외에서의 사용을 통해 주로 결정 되었습니다-파생 된 T-세포 복제 또는1,2 라인 ,,34. 이러한 연구 결과 혈액에서 격리 또는 림프 기본 인간 T 세포에 적용 하는 방법 조직은 모른다, 분석5셀의 충분 한 수를 취득에 상당한 어려움 때문에 부분적으로. 여기 우리가 구축 활성화 및 접착 분자를 포함 하는 평면 지질 bilayers 멀티 채널 흐름 슬라이드를 이용 하는 기술 개발을 통해이 해결 합니다. 흐름 슬라이드의 낮은 높이 시 냅 스 인터페이스 형성의 동적과 립 방출의 속도 론을 공부 하 고 연구 함으로써 셀: bilayer 첨부 파일을 동기화 하기 위해 빠른 셀 침전을 촉진 합니다. 우리는 10 몇의 시 냅 스 인터페이스를 분석에이 접근을 적용 105 주 cryopreserved T 세포 림프 노드 (LN) 및 말 초 혈액 (PB)에서 절연 된4 . 결과 공개 소설 평면 지질 bilayer 기술 기본 인간 T 세포에서 혈액과 조직 건강과 질병의 맥락에서 파생 된의 생물 속성의 연구를 수 있습니다.
서문
T 세포의 기능 활동에 그들의 링크와 T 세포 면역 시 냅 스의 구조적 기능의 과학적 지식을 셀 라인의 연구에서 주로 생성 되 고 클론 PB에서 파생. 어느 정도 기본 T 세포에 관련 된 이러한 연구 결과에서 얻은에 혈액 또는 인간 림프 조직 남아 있다 불분명, 림프 및 다른 조직에서 T 세포의 시 냅 스 인터페이스는 지금까지 분석 되지. 중요 한 것은, 새로운 데이터 조직 상주와 림프 기관 파생 된 T 세포의 표현 형 및 PB6,7에 비해 기능 활동에 큰 차이가 있을 수 있습니다 것이 좋습니다. 이 추가 기본 인간 T 세포에서 T 세포 시 냅 스 인터페이스의 기능을 더 잘 이해할 필요가 고형화 했다.
이 위해 악용 하는 멀티 채널 흐름 슬라이드를 T-셀/bilayer 인터페이스의 이미징 105 주 T 세포와 인간의 PB를 ln. 격리 수행에 내장 된 지질 bilayers 소설 미니 규모 접근 개발 했습니다. 이 새로운 기술은 더 나은 모델 하 고 vivo에서 세포 세포 상호 작용을 이해 하기 위해 기본 인간 T 세포 시 냅 스 인터페이스의 생물 속성의 연구를 수 있습니다.
프로토콜
헬싱키의 선언에 따라 연구 되었다. 모든 참가자에 게 서 얻은 서 면된 동의 하 고 혈액과 림프 노드 샘플 펜실베니아 대학 (IRB #809316, IRB # 815056) 기관 검토 위원회의 승인으로 인수 했다. 모든 인간의 과목 성인 이었다입니다. 코드 혈액 샘플을 친절 하 게 노동과 학과의 산부인과 토마스 제퍼슨 대학에서의 납품에 의해 제공 되었다. 모든 샘플 드 확인 했다입니다.
1. 절연 CD4의 이미지 분석에 대 한+ T 세포
-
107 냉동 주변 혈액 단 세포 (PBMCs) 또는 림프 노드 단 세포 (LNMCs) 수집 된 샘플에서 포함 된 1 mL 약 수 동 살 균 후드에서 RPMI 페니실린/스와 글루타민 보충의 9 mL에 해 동된 셀을 추가 합니다.
- Centrifugate에서 4 ° C, 300 x g 에서 10 분 동안 셀 상쾌한, 발음 및 10%를 포함 하는 보충된 RPMI의 5 mL에 셀 resuspend FBS (완전 한 매체). 37 ° c.에 CO2 배양 기에서 하룻밤 셀을 품 어
- 다음 날, 정화 CD4 부정적인 immunomagnetic 제조업체의 지시에 따라 상용 키트를 사용 하 여 정렬 하 여+ T 세포.
- 갓 순화 CD4 수를 측정 하기 위해+ T 세포, trypan 블루 솔루션의 동등한 볼륨 세포 현 탁 액의 5 µ L를 혼합. 로드 셀 trypan과 hemocytometer 혼합물을 블루와 hemocytometer의 5 섹션 안에 라이브 셀.
- 휴대폰 번호의 평균을가지고 고 원래 세포 현 탁 액에 있는 셀의 수를 결정: 셀/1 mL의 수 = 2 × 104x 평균 수. 고립 된 세포의 총 수 너무 작은 경우 셀 계산 하지 않고 그대로 사용 합니다.
- 10 분에 대 한 300 x g 에서 세포를 원심 및 105에 분석 결과 버퍼 (20 mM HEPES, pH 7.4, 137 mM NaCl, 2mm 나2HPO4, 5 m D-포도 당, 5 m KCl, 1 mM MgCl2m m, 2 m m CaCl2및 1% 인간 혈 청 알 부 민)에 그들을 resuspend < /c13 > 셀/50 µ L 이하로 실험에 사용할 준비가 될 때까지 4 ° C에서 (1-2 h) 세포를 유지 하 고.
- 관련 기관 지침에 따라 모든 생물 학적 폐기물의 처분.
- 원하는 경우 컨트롤 셀 인구로 서, 탯 줄 혈액 PBMC에서에서 CD8 T 세포 활성화를 준비, 10 µ g/mL 및 1 µ g/mL에서 안티-CD3 및 안티 CD28 항 체의 혼합물으로 덮여 T25 문화 플라스 크에 완전 한 매체의 5 mL에 107 셀 장소 각각.
- 다음 날, 플라스 크에서 활성화 코드 혈액 세포를 제거 그들을 씻어 1 x 신선한 매체를 완료 하 고 재조합 일리노이-2의 셀 확장 (100 U/mL) 2 주 동안.
- 코드-혈액 CD8 정화+ T 세포의 부정적인 immunomagnetic 제조업체의 지시에 따라 상용 키트를 사용 하 여 정렬. 셀을 계산 하 고 LN 및 PB CD8 1.3-1.6 단계에 설명 된 대로 분석 결과 버퍼에 미디어를 교환+ T 세포.
2. 평면 지질 Bilayers의 준비에 대 한 구성 요소
- 5설명 되어 있는 대로 리의 3 종류 준비: (a) 0.4 m m DOPC (1, 2-dioleoyl-sn-glycero-3-phosphocholine) 리, (b) 0.4 m m DOPC 리 33 mol % 개 NTA를 포함 (1, 2-dioleoyl-sn-glycero-3-[(N-(5- 아미노-1-carboxypentyl) iminodiacetic 산) succinyl] (염화 소금)) 지질, 4 mol %Biotinyl-모자-PE를 포함 하는 (c) 0.4 m m DOPC 리 (1, 2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(모자 biotinyl) (나트륨 소금)).
-
앞에서 설명한55% 카 세 인 솔루션을 준비 합니다.
- 초순의 100 mL에 카 세 인 분말의 5 g을 녹이 고 수산화 나트륨 10 M의 350 µ L을 추가. 2 시간, 실 온에서 사용할 수 있는 규모에 따라 느린 속도로 일반 자력에 모든 것을 저 어 하 고 4 ° c.에서 하룻밤 7.3 및 ultracentrifuge에서 4 ° c.에 100000 x g 2 h에 대 한 솔루션에 pH를 조정 0.22 μ m 살 균 필터는 상쾌한 필터링 및 솔루션-80 ° c.에 aliquots에 저장
주의: 수산화 나트륨 용액 화학 화상을 일으킬 수 있습니다 하 고 눈과의 접촉에 따라 영구적인 실명을 일으킬 수 있습니다. 이 화학 제품 또는 그것의 솔루션을 다룰 때 고무 장갑, 안전 복과 눈 보호를 사용 합니다.
- 초순의 100 mL에 카 세 인 분말의 5 g을 녹이 고 수산화 나트륨 10 M의 350 µ L을 추가. 2 시간, 실 온에서 사용할 수 있는 규모에 따라 느린 속도로 일반 자력에 모든 것을 저 어 하 고 4 ° c.에서 하룻밤 7.3 및 ultracentrifuge에서 4 ° c.에 100000 x g 2 h에 대 한 솔루션에 pH를 조정 0.22 μ m 살 균 필터는 상쾌한 필터링 및 솔루션-80 ° c.에 aliquots에 저장
-
앞에서 설명한 방법은8모노-bionylated 항 체 분자를 생산 하기 위해 biotin과 레이블 안티-CD3 항 체.
- 0.1 mg/mL에 디 메 틸 sulfoxide (DMSO)에 Biotin PEO4 NHS의 솔루션을 준비 합니다. 0.5 ml의 인산 염 버퍼 식 염 수 (PBS) 100 mM 탄산수 소 나트륨을 포함 하는 항 체의 1 밀리 그램 Biotin PEO4 NHS 솔루션의 3.7 µ L를 추가 합니다.
- 실 온에서 2 h에 대 한 혼합물을 품 어. 알 렉 사 Fluor 488 NHS 에스테 르 DMSO에 10 mg/mL에서의 솔루션을 준비 합니다. 10 어 금 니 과잉에 Biotin PEO4 보 건국에 의해 표시 된 항 체에 알 렉 사 Fluor 488 NHS 에스테 르 솔루션을 추가 합니다.
- 정기적으로 자력에 느린 교 반으로 실 온에서 1 h에 대 한 혼합물을 품 어. 크기 배제 크로마토그래피를 사용 하 여 언바운드 염료를 구분 합니다.
- 280에서 항 체 용액의 광학 밀도 측정 하 여 항 체 농도 결정 nm (280). 577에서 레이블이 지정 된 항 체의 광학 밀도 측정 nm (577).
- 다음 수식을 사용 하 여 염료를 항 체 비율을 확인 합니다.
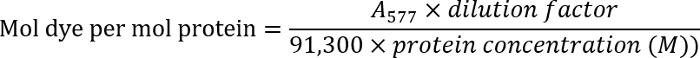
참고: 제조업체의 프로토콜에서 추가 세부 정보를 찾을.
-
앞에서 설명한3,4,,910 초파리 식 시스템에서 재조합 형 수용 성 ICAM-1 단백질을 표현 한다.
- 복제, cDNA 인코딩으로 초파리 식으로 ICAM-1의 ectodomain pMT/V5-그는 그의 추가 재조합 단백질을 생산 하는 유도할 수 있는 metallothionein 모터와 벡터 C 터미널 끝에6 태그.
- 공동 transfect S2 셀 결과 ICAM-1 포함 플라스 미드와 G418 식 벡터. 안정적인 transfectants 슈나이더의 초파리 미디어 3 주 동안 10% 태아 종 아리 혈 청 (FCS) 및 0.5 mg/mL G418의 보충을 사용 하 여 선택 합니다. 혈 청 무료 곤충 매체에 셀을 확장 하 고 0.5 m m CuSO4 3 d와 단백질 발현을 유도.
- 문화 표면에 뜨는 배를 집중 하 고 앞에서 설명한11로 접선 흐름 집중 장치를 통해 PBS에 대 한 dialyze.
- Covalently 고정된 안티-ICAM-1 단일 클론 항 체와 Sepharose를 포함 하는 열을 표면에 뜨는 집중된 문화를 적용 하 고 50mm 글리신 버퍼, pH 3.0으로 바인딩된 ICAM-1을 elute. 즉시 2 M Tris 버퍼, pH 8.0 eluted ICAM-1 단백질을 무력화.
- PBS, pH 8.0에 대하여 eluted 물자 dialyze 고 열 포함 Ni NTA agarose를 dialyzed 자료를 추가 합니다. 녹는 ICAM-1 200 mM 이미, pH 8.0 elute PBS 버퍼, pH 8.0에 eluted 소재 dialyze
- 레이블을 Cy5 NHS 에스테 르 제조 업체의 지시에 따라 정화 ICAM-1.
참고: 최고의 마지막 염료 단백질 비율은 1:1입니다.
- 팹 생산 papain 소화에 의해 안티-CD107a 항 체에서 조각 하 고 팹 정화 이온 교환 크로마토그래피3위에서 설명한 대로 의해 조각. 레이블 제조업체의 지시에 따라 알 렉 사 Fluor 568 NHS 에스테 르는 팹 조각.
3. 지원 되는 유리 평면 지질 Bilayers의 대형
- 집중된 한 황산과 과산화 수소 30%의 60 mL 140 mL를 혼합 하 여 신선한 산 성 피 솔루션을 준비 합니다. 몸을 담글 하 여 그들 30 분 대기에 대 한 산 성 피 솔루션에 유리 coverslip 폴 리 프로필 렌가 위 형 집게와 흐름 슬라이드 유리 coverslips 세척.
주의: 피 솔루션은 매우 강한 산화 제. 솔루션을 처리 하는 동안 항상 착용 안전 유리 또는 고글 또는 두꺼운 고무 장갑 함께 들고 방패를 기억 하십시오. 증기 두건에서 피 솔루션 에서만 작동 합니다. 폭발 수 있습니다으로 난방, 수송, 또는 언제 든 지 사용 하는 동안 그것을 동요 하는 하지 마십시오. 포함 하는 리드 구멍 유리 병에 고생 폐기물을 수집 합니다. 문의 적절 한 폐기물 활용에 대 한 제도적 인 안전 위원회. -
린스 세척된 coverslips 7 초순 순차적으로 신선한 물을 포함 하는 비 커에 그들을 전송 하 여 x. 설정 옆으로 물이 남아 있도록 젖은 coverslips 롤 건조 유리를 남겨두고 깨끗 한 유리 합니다.
- 또는, 진공 펌프에 연결 된 피 펫 팁을 사용 하 여 신중 하 게는 coverslips에서 나머지 물방울을 제거.
- 살 균 후드에서 희석 다양 한 지질 bilayers 만들기 위한 liposome 믹스를 생산 하기 위해 수행 합니다. 첫째, DOPC 리의 37 µ L 3 µ L Biotinyl-모자-PE 리의 결합. 둘째, DOPC 리의 14 µ L 고 개-NTA 리의 15 µ L를 혼합. 셋째, 결승전 liposome 혼합물을 조작 하는 두 번째의 29 µ L를 첫 번째 믹스 1 µ L를 추가 합니다.
-
살 균 후드 작업 공간 가까이 의해 건조 coverslips로 설정 합니다. 결승전 liposome 혼합물의 aliquot 2 µ L (단계 3.3 참조) 접착 슬라이드 채널의 중심에 정확 하 게. 즉시 고 매우 정확 하 게 정렬 깨끗 하 고 건조 coverslip 슬라이드 및 슬라이드의 끈 적 한 면에 coverslip 부드럽게.
- 하나 이상의 슬라이드를 준비 하는 경우 한 슬라이드에 한 번에 이후 작동 liposome 혼합물 빠르게 증발. 슬라이드를 뒤집어 놓고 형 폴 리 프로필 렌가 위 집게의 외부 반지를 사용 하 여 슬라이드, 슬립 누설을 방해 하기 위해 슬라이드에 단단히 연결 되어 있는지 확인 하는 coverslip의 주변 접촉에 부드러운 압력을 적용 합니다.
참고: 깨고 나는 coverslip 크래킹을 피하기 위해 슬라이드의 채널에 대 한 누르지 마십시오. - 다시 슬라이드를 설정 하 고 어셈블리의 외부 슬라이드에 bilayer 주위 영구 표시와 함께 그리기 4 점으로 coverslip 사이의 채널 슬라이드 드롭 처럼 보이는 형성된 된 bilayer의 위치를 표시 합니다.
- 하나 이상의 슬라이드를 준비 하는 경우 한 슬라이드에 한 번에 이후 작동 liposome 혼합물 빠르게 증발. 슬라이드를 뒤집어 놓고 형 폴 리 프로필 렌가 위 집게의 외부 반지를 사용 하 여 슬라이드, 슬립 누설을 방해 하기 위해 슬라이드에 단단히 연결 되어 있는지 확인 하는 coverslip의 주변 접촉에 부드러운 압력을 적용 합니다.
- 채널에는 액체의 첫 번째 주입, 전에 엔트리 포트와 출구 포트 다른 채널의 한 포트를 지정 하 고 실험을 통해이 지정을 유지 합니다.
- 거품 형성을 방지 하려면 채널의 엔트리 포트에 직접 피펫으로 팁의 끝을 삽입 합니다. 천천히 따뜻한의 50 µ L를 채울 슬라이드의 채널 (적어도 룸 온도) 분석 결과 버퍼 (버퍼 구성에 대 한 1.5 단계 참조).
- 0.5 M nickel(II) 염화 물 솔루션을 준비 합니다. 30 분 동안 37 ° C에서 물 욕조에 카 세 인 솔루션의 2 mL 약 수를 녹여 하 고 그것 200 µ M의 최종 농도에 니켈 염화 물 솔루션을 보완.
- 먼저 채널의 엔트리 포트에서 카 세 인 솔루션의 100 µ L를 주입 하 고 즉시 pipetting으로 슬라이드에 출구 포트에서 100 µ L을 제거 하 여 있는 bilayers 워시. 각 채널의 입력 포트에 카 세 인 솔루션의 100 µ L를 주입 하 고 실 온에서 45 분에 대 한 슬라이드 배양 하 여 동일한 솔루션 bilayers 차단.
- Aliquots Cy5-ICAM-1-그의6 와 streptavidin 단백질의 해빙 각 2 µ g/m l의 최종 농도에 분석 결과 버퍼에 단백질을 결합 한다. 20000 x g 및 모든 집계 제거 하 4 ° C에서 30 분 동안 솔루션 원심
- Pipetting으로 슬라이드 채널의 출구 포트에서 차단 솔루션의 나머지 부분을 제거 합니다. ICAM-1와 streptavidin 엔트리 포트에 포함 된 솔루션의 100 µ L를 주사.
- 실 온에서 45 분에 대 한 슬라이드를 품 어. 출구 포트에서 단백질 해결책의 어떤 과잉을 제거 합니다. 씻어 bilayer 2 채널의 입력 포트에 분석 결과 버퍼의 100 µ L를 먼저 주입 하 고 출구 포트에서 100 µ L를 즉시 제거 하 여 x.
- 2 µ g/mL의 최종 농도에 분석 결과 버퍼와 알 렉 사-형 석-488-셔 서 반대로 CD3 항 체 희석. 슬라이드의 엔트리 포트에 항 체 솔루션의 100 µ L를 주사 하 고 실 온에서 45 분 동안 품 어. 출구 포트에서 단백질 해결책의 어떤 과잉을 제거 합니다. Bilayer 2 세척 단계 3.11에서와 같이 분석 결과 버퍼의 100 µ L x.
4. 평면 Bilayer와 T 세포 상호 작용의 이미징
-
무대와 confocal 또는 총 내부 반사 형광 (TIRF) 현미경의 목표 온도 37 ° c.에 equilibrated 때까지 예 열 열띤된 무대에는 bilayer(s)와 함께 슬라이드를 설정 합니다. 잉크 자국에 따라 적절 한 위치에 무대를 이동 하 고 사 셔 서 ICAM-1 분자의 형광을 채용 하는 bilayer에 초점.
- Confocal 현미경에 대 한 61 X 목표 또는 100 X 목표를 사용 하 여 적절 한 필터 설정으로 TIRF 현미경에 대 한.
-
과 립에 대 한 이미징 TIRF 현미경 분리, 알 렉 사 Fluor-568-표시 된 안티-CD107a를 추가 엔트리 포트에 세포를 주입 하기 전에 4 µ g/mL의 최종 농도에 세포 현 탁 액에 항 체 Fab 조각.
- 준비 된 CD4 resuspend+ T 세포 선 또는 PB 또는 코드에서 격리 혈액 및 슬라이드 채널을 포함 하는 bilayer의 엔트리 포트에 세포 현 탁 액의 50 µ L를 주입.
- 주사 후 필드의 원하는 숫자와 30 분 동안 2 분 마다 x 각 필드 1의 이미지를 기록을 선택 합니다.
- 밝은 분야, 반사 빛, 및 형광 채널 (알 렉 사 488와 Cy5)는 이미지 공초점 현미경의 이용. TIRF 모드를 사용 하 여 알 렉 사-형 석-488와 알 렉 사-형 석-568 형광와 Cy5 형광, 뿐만 아니라 밝은 필드 이미징, TIRF 현미경에 widefield.
5. 이미지 분석
- 적절 한 소프트웨어를 사용 하 여 인수 이미지 분석. 전송 된 가벼운 이미지와 제외 클러스터와 눈에 띄게 손상 또는 apoptotic 세포 분석에서 셀 형태를 관찰 합니다. 생산적 bilayer 표면 (즉, 인터페이스에 알 렉 사-형 석-488 형광 (안티-CD3 항 체)를 축적 하는 세포)와 상호 작용 하는 셀에만 분석에 포함 됩니다.
- 셀 bilayer 상호 작용의 개시 후 20 분에 셀 접착 영역의 크기를 결정 합니다.
참고: 접착 지역 방해 반사 현미경 (IRM) 이미지에 셀 bilayer 인터페이스에서 개발 된 어두운 영역이입니다. - 셀 bilayer 인터페이스에서 차별 Cy-ICAM-1 분자 Cy5-ICAM-1 형광의 어떤 축적과 링 접합의 형성을 관찰 합니다. 누적된 ICAM-1 분자 두 개 이상의 연속 이미지에 접착 링 접합 형성, 세포는 주변 supramolecular 활성화 클러스터 (pSMAC)12개발로 같은 셀을 지정 합니다.
- 셀에 가까운 근접에서 연락처 영역 밖에 배경 형광에 T 세포 bilayer 인터페이스에 알 렉 사-형 석-568 형광 강도 측정 하 여과 립 자료를 평가 합니다. Degranulating 셀 셀 배경의 알 렉 사-형 석-568 신호-를-적어도 1.3의 비율을 지정 합니다.
결과
첫째, 우리는 활성화 코드 혈액 파생 CD8에 의해 형성 된 시 냅 스 인터페이스의 구조를 비교+ T 세포 지질 bilayers에 노출 내장 중에서 전통적인 대규모 흐름 전지 시스템 (대 한 자세한 내용은 테이블의 자료 를 참조)1 ,2,,34 또는 멀티 채널 흐름 슬라이드. bi...
토론
여기에 설명 된 소설 기법 기존의 흐름 셀5 평면 bilayers 구축 하는 데 필요한 유사한 시 약을 활용 하 고 수행 기본 인간 T 세포-bilayer 인터페이스3,4의 이미징에 성공적으로 적용 될 수 있습니다. ,15. 기술은 형광 분자 사용법에 있는 뜻깊은 감소를 제공 하며 10-20는 흐름 셀 시스템5, 혈액 및 ?...
공개
저자는 공개 없다.
감사의 말
이 작업을 지원 했다 마이클 R. Betts에 R01AI118694 NIH 교부 금에 의해 하위 수상 566950 유리 Sykulev 포함. 우리는 Sidney Kimmel 암 센터 Bioimaging 공유 리소스 그들의 탁월한 지원 위한 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
참고문헌
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유