JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
제 브라 피시에서 선천적인 스트레스를 연구 하는 행동 접근법
요약
이 원고는 성인 제 브라 피시에서 행동 하는 스트레스를 측정 하는 간단한 방법을 설명 합니다. 이 접근법은 zebrafish가 스트레스가 많은 상태일 때 탱크의 아래쪽 절반을 선호 하는 타고 난 경향을 활용 합니다. 우리는 또한 약리학으로 분석을 결합 하는 방법을 설명 합니다.
초록
스트레스 자극에 적절 하 게 대응 하는 것은 유 기체의 생존을 위해 필수적입니다. 광범위 한 연구는 스트레스 관련 질병 및 정신 질환의 넓은 스펙트럼에 이루어졌다, 그러나 스트레스의 유전 및 신경 조절에 대 한 추가 연구는 여전히 더 나은 치료법을 개발 하는 데 필요한. Zebrafish는 돌연변이 및 형질 전환 라인의 큰 컬렉션이 존재 하기 때문에 스트레스의 신경 기초가 되는 것을 조사 하기 위한 강력한 유전 모델을 제공 합니다. 또한, 약리학은 쉽게 제 브라 피쉬에 적용 할 수 있습니다, 대부분의 약물은 물에 직접 추가 할 수 있습니다. 우리는 여기에서 ' 소설 탱크 테스트 '를 사용 하 여 zebrafish에서 선천적인 스트레스 반응을 연구 하 고 분석 법을 사용 하 여 잠재적인 완화 약물을 검증할 수 있는 방법을 보여줍니다. 이 방법은 쉽게 zebrafish 라인과 결합 될 수 있다 유전자 돌연변이를 품고, 또는 정확한 신경 회로를 조작 하기 위한 트랜스 제 닉 접근이 사용 되는 그. 분석은 또한 다른 물고기 모형에서 사용 될 수 있습니다. 함께, 설명 된 프로토콜은 다른 실험실에이 간단한 분석의 채택을 촉진 한다.
서문
스트레스 반응은 잠재적으로 유해한 또는 회피 자극으로 인해 변경 된 행동 및 생리 적 상태입니다. 스트레스 반응은 동물의 왕국 전체에 걸쳐 보존 되 고, 유기 체1의 생존에 중요 하다. 수십 년의 연구는 스트레스 상태를 기본으로 하는 유전 및 신경 메커니즘의 일부에 대 한 우리의 지식을 크게 확장 했습니다. 오늘, 복숭아 류 및 striatum와 같은 뇌의 영역2, 및 글 루 코 코르 티코 이드 (gr) 및 mineralocorticoid 수용 체 와 같은 유전적 요인 ( 씨)는 광범위 하 게 연구 되었다3,5,6. 이러한 중요 한 결과에도 불구 하 고, 많은 스트레스의 유전 및 신경 조절에 대 한 알려지지 않은 남아. 이와 같이, 많은 스트레스 관련 장애는 치료제의 부족으로 고통.
유전적으로 amendable 모형 유기 체는 행동의 유전 그리고 신경 세포 통제의 연구 결과에 있는 유용한 공구를 제공 합니다. 특히 물고기 모델은 매우 강력 합니다: 그들은 짧은 생성 시간을 가진 작은 유기 체 이며, 실험실 설정에서의 사용은 facile, 그들의 게놈은 쉽게 수정, 척추 동물로, 그들은 뿐만 아니라 유전을 공유, 뿐만 아니라 신경 해부학 포유류 대응7,8과 상 동성. 스트레스를 측정 하기 위한 표준 분석은 유전자 돌연변이를 하는 zebrafish 라인과 짝을 이룰 수 있고, 또는 정확한 뉴런 서브 세트의 조작이 가능 하며, 단일 유전자 또는 정의 된 뉴런의 효과를 신속 하 고 효율적으로 평가할 수 있습니다.
행동, 스트레스 반응은 하이퍼 활동의 기간 또는 비활동의 장기간 (' 동결 '과 유사)9, 감소 된 탐사10, 급속 한 호흡, 감소 된 음식 섭취 량 (11) 및 장소-탱크의 바닥에 대 한 선호도12. 예를 들어, 익숙하지 않은 탱크에 배치 할 때, 성인 제 브라 피시 및 기타 작은 물고기 모델은 탱크의 하단 절반에 대 한 초기 선호도를 보여 아직, 시간이 지남에 따라, 물고기는 거의 동등한 주파수12로 상단과 하단 반쪽을 탐험 하기 시작 합니다. 불안을 감소 시키는 것으로 알려진 약물을 가진 성인의 치료는 물고기를 바로 상단10,13을 탐구 하는 원인. 반대로, 불안을 증가 시키는 약은 수조12,14,15의 아래쪽 절반에 대 한 강한 선호도를 표시 하는 물고기를 야기 한다. 따라서, 탱크의 하단 절반에 대 한 탐사 및 선호도 감소는 스트레스의 간단 하 고 신뢰할 수 있는 지표입니다.
대부분의 척추 동물과 마찬가지로, 어류의 스트레스 반응은 시상 하 부 뇌 하 수 체 간 신장 축 (hpi)의 활성화에 의해 구동 됩니다 (포유류에서 시상 하 체-뇌 부 신 (HPA) 축과 유사 하다)14,16. 시상 하 부 뉴런 호르몬 corticotropin 호르몬을 발현 (CRH) 뇌 하 수 체에 신호, 차례 차례로 출시 호르몬을 방출 자극 (ACTH). Acth는 다 수의 하류 표적을가지고 있는 코 티 솔을 생산 하 고 분 비 하는 간 신장 동맥에 신호를 보냅니다16, 그 중 하나는 crh-시상 하 부 뉴런을 생산 하는 것의 부정적인 피드백 인3,17, 18,19.
여기에서, 우리는 타고 난 스트레스의 행동 측정을 평가 하는 방법을 설명 합니다. 행동을 위해, 우리는 새로운 탱크 다이빙 테스트12,14를 사용 하 여 프로토콜을 자세히 설명 합니다. 그런 다음 우리는 예를 들어, 알려진 완화 약물, 부 피 라 네가 스트레스의 행동 조치를 감소 시킨다는 것을 보여줍니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 의정서는 제도적 동물 관리에 의해 승인 되었으며, 플로리다 대서양 대학에 커 먹 잇을 사용 합니다.
1. 준비
- 행동 연구를 수행 하기 위한 고립 된 방을 지정 하거나 고립 되어 있도록 룸의 섹션을 닫습니다.
참고: 객실은 방해 받지 않고 물고기의 정상적인 행동을 방해 하지 않도록 트래픽이 낮습니다. - 다음과 같은 재료와 장비를 행동 실에 옮깁니다: (i) 카메라와 렌즈, 렌즈에 부착할 수 있는 적외선 필터 (iii) 카메라를 장착 하는 컴퓨터에 카메라를 장착 하는 소프트웨어, (v)에는 견고 하 고 안정적인 테이블 분석을 수행 하는 (vi) 적외선 조명 (IR 조명, 850 nm 또는 940 nm), (vii) 기록 탱크의 길이 보다 긴 백색 아크릴 디퓨저 (viii) 1.8 L 사다리꼴 플라스틱 분석 탱크 (' 신규 탱크 ' 라 함) 여기에 사용 되는 것은 12 x 18 인치) 및 (ix) 물고기 시스템 물 양동이.
참고: 새로운 탱크의 경우, 우리의 실험실은 사다리꼴 모양의 상용 플라스틱 용기를 사용 합니다. 탱크의 치수는 대략 6 x 9에 있습니다 (상세 치수는 그림 1A에 나와 있습니다). 우리가 사용 하는 디퓨저 보드는 신규 탱크 (12 x 18in) 보다 약간 큽니다. 새로운 탱크 실험은 직사각형 또는 다른 사다리꼴 치수20,21과 같은 서로 다른 모양을 갖는 탱크로 수행 되었습니다. 일반적으로 물고기의 행동은 크기에 관계 없이 모든 탱크에서 유사 합니다. 모든 컨테이너의 경우, 물고기는 처음에는 하단 절반을 선호 아직 시간이 지남에 따라 더 큰 주파수로 상단을 탐험 하기 시작 합니다. - 적외선 필터를 카메라 렌즈에 부착 합니다. 적외선 빛 스트립의 파장은 일반적으로 850 nm에서 940 nm 까지입니다. 이 필터는 720 nm 미만의 파장의 빛을 카메라에 전달 하는 것을 제한 하는 긴 패스 필터입니다.
- 카메라 수집 소프트웨어에 적합 한 매개 변수를 선택 합니다. 대부분의 레코딩의 경우 카메라 캡처를 초당 30 프레임의 속도로 설정 하 고 시간을 10 분으로 기록 합니다.
참고: 이러한 매개 변수는 실험에 따라 다를 수 있습니다. 예를 들어 새로운 탱크22,23에서 습관을 공부 하기 위해 더 긴 녹화가 필요할 수 있습니다.
2. 설정
참고:이 섹션의 단계에서는 신규 탱크 분석 설정에 대해 설명 합니다. 최종 제품의 다이어그램이 그림 1B에 나와 있습니다.
- 테이블 중앙에 신규 탱크를 놓습니다.
- 탱크 뒤에 적외선 조명을 배치 하 고 탱크와 LED 광원 사이에 흰색 아크릴 시트 또는 디퓨저 화면을 놓습니다.
- Led에서 나오는 빛을 최대한 확산 하도록 디퓨저를 배치 하 고 빛의 강도는 새로운 탱크를 조명 하기에 충분 합니다. 보드가 광원에 가까울수록 조명이 밝아 지지만 확산 되는 것이 적습니다. 이와 대조적으로, 디퓨저 보드를 광원에서 멀리 두면 빛의 강도가 감소 하지만 빛이 더 잘 퍼질 것입니다.
- 물고기 시스템 물로 소설 탱크의 약 3/4을 채 웁 니다.
참고: 시스템 물은 수돗물의 역삼 투를 사용 하 여 생성 되며 전도도가 900 ± 100 µS, pH는 중성 (7.2) 이며 온도는 27±1°c가 되도록 투약 합니다. - 카메라를 카메라 스탠드에 부착 하 고 카메라를 컴퓨터에 연결 합니다. 비디오 수집 소프트웨어를 열고 탱크 전면을 향하도록 카메라를 조정 하 고 전체 신규 탱크를 볼 수 있으며 비디오에 가려진 영역이 없는지 확인 합니다. 카메라를 통해 관찰할 때 탱크 전체에 충분 하 고 균일 한 조명이 되도록 탱크와 적외선 조명을 조정 하십시오.
참고: 실험을 진행 하기 전에 물고기의 비디오가 캡처되며 추적이 수행 되는 시험 실행을 수행 하는 것이 유용할 수 있습니다. 이렇게 하면 동작 실험에 충분 한 설정이 됩니다.
3. 새로운 탱크 테스트 설정
- 물고기 시스템 물로 미리 채워진 250 mL 비 커를 준비 하 고, 적어도 두 개의 홀딩 탱크가 있습니다.
- 시험의 아침에, 적어도 10 시험 성인 zebrafish를 유지 탱크에 물고기 시설에서 각 실험 조건 (대조 군 및 실험 성인)에 사용 되는 전송 하 고, 그들을 행동 방으로 전송 하 고, 적어도 하나를 위해 적응 하도록 허용 시간.
참고: 실험 전에 전력 분석을 수행 해야 하지만, 우리 손에서는 n = 10이 통계적 유의 성을 감지 하기에 충분 합니다. 또한, 홀딩 탱크는 물 리터 당 5 명 이하의 개인을 포함 해야 합니다. 제 브라 피시 성인은 새로운 탱크 (22)의 30 분 이내에 습관을 보인 것으로 한 시간의 적응이 충분 하다. 또한, 행동 리듬은 circadian 프로세스에 의해 영향을 받으며, 따라서 다른 일에 수행 되는 실험적 복제는 동일한 시간 내에 수행 되어야 한다. 우리는 일반적으로 11:00의 시간과 6:00 pm 사이의 모든 실험을 수행 합니다. - 동물의 상태나 유전자 형이 실험 자에 게 맹인이 되도록 탱크에 라벨을 부착 합니다.
참고: 실험 자는 문자 또는 숫자 시스템을 사용 하 여 탱크를 라벨링 하는 것으로 쉽게 눈을 멀게 할 수 있습니다 (즉, 한 탱크는 ' A ', 다른 B '로 레이블이 지정 됨). 실험에 관여 하지 않은 당사자는 이러한 시스템으로 탱크에 라벨을 부착 하 고 사후 분석이 완료 될 때까지 시험 자의 신원을 마스크 합니다. - 그물을 사용 하 여, 3.1 단계에서 미리 채워진 비 커에 단일 성인을 부드럽게 배치 하십시오. 성인 물고기가 10 분 동안 비 커에 순응 하도록 하십시오.
참고: 성 특정 차이를 찾기 위해 중요 한 사후 분석 일 수 있으므로 성인의 성별을 기록 하십시오. - 비 커에 순응 시킨 후, 비이 커 로부터 물과 성인을 부드럽게 붓는 것으로 물고기를 신규 탱크 (제 1 섹션에 설치)로 소개 합니다.
- 새로운 탱크에 성인을 소개 한 후, 카메라 녹화를 시작 하 고 물고기에 추가 고통을 방지 하기 위해 설정에서 멀리 이동 합니다.
- 기록이 완료 되 면, 신규 탱크에서 개인을 제거 하 고 새로운 유지 탱크에 배치 합니다.
참고: 동일한 개인에 대 한 반복 테스트를 방지 하기 위해 3.2 단계에서 다른 유지 탱크를 사용 해야 합니다. - 모든 동물이 시험 될 때까지 각 성인에 대해 3.4 ~ 3.7 단계를 반복 하십시오.
참고: 실명 또는 유전자 형 외에도 시험을 무작위로 추출 하십시오. 난수 생성기 또는 임의의 도구를 사용 하 여 시험 중 하나를 무작위로 지정할 수 있습니다. 실험이 시작 되기 전에 각 평가판이 결정 되도록 실험 전에이 작업을 수행 해야 합니다. - 모든 검사가 끝날 때 물고기를 다시 물고기 시설에 반납 하십시오.
4. 약물 전처리
참고: 다음 단계의 목적은 약물 사용 전후에 개인의 행동을 비교 하는 것입니다. 이러한 비교는 제 1 단계 3.4 내지 3.6에서와 같이 신규 한 탱크 시험을 수행 하 고, 이어서 약물 처리 후 제 2 신규 한 탱크 시험 (도 3a)에 의해 달성 된다.
- 포지티브 및 네거티브 컨트롤을 포함 하 여 약물의 스톡 솔루션을 준비 합니다.
참고: 약물이 문헌에 이전에 사용 된 경우 적절 한 작업 복용량을 찾아 사용 하십시오. 예를 들어, 대표 결과에서 부스 피 라 네의 경우, 상기 문헌13,20에 기재 된 바와 같이 100 배 스톡 용액을 만들고 최종 농도로 0.05 mg/ml을 사용 한다. 제안 된 복용량을 알 수 없는 경우, 복용량 응답 곡선 몇 가지 농도 검사 하 여 수행 해야 합니다. 약물의 연속 희석으로 더 많은 비 커를 설정 합니다. 약물이 물에 용 해 되지 않으면 디 메 틸 설 폭 사이드 (DMSO)를 용 매로 사용 하십시오. - 시스템 물과 250 mL 비 커에서 작업 농도에 약을 희석. 예를 들어 100 배 용액을 만든 경우 시스템 물에 1:100을 희석 하십시오. 시스템 물만 제어로 비 커를 설정 합니다.
참고: DMSO를 3.1 단계에서 용 매로 사용한 경우, 대조 비 커에 동일한 부피의 DMSO를 사용 한다. - 다른 연구자의 도움으로, 약물 및 제어 비 커의 정체성을 마스크 하 여 테스터가 사후 분석을 할 때까지 치료 조건에 대 한 시각 장애가 있는지 확인 합니다.
참고: 숫자 또는 문자 시스템을 사용할 수 있습니다. - 3.1 내지 3.6 단계에 따라 신규 한 탱크 테스트를 수행 하 여 기준선 동작 스트레스 응답을 얻었다.
- 기준 기록 후, 4.2 단계에서 기재 된 바와 같이, 즉시 신규 한 탱크 로부터 성체 물고기를 제거 하 고 약물 또는 비 히 클로 투약 하는 비 커에 배치 하는 그물을 사용 한다. 성인이 비 커에 10 분간 유지 되도록 하십시오.
주의: 그물이 약물의 교차 오염을 방지 하기 위해 비 커의 물에 닿지 않는지 확인 하십시오. 사용 하는 약물에 따라 적절 한 복용량과 투여 시간을 보장. 10 분 치료 시간은 모든 약물에 대해 작동 하지 않을 수 있습니다. - 처리 후, 4.5 단계에서 그물을 사용 하 여 비 커 로부터 성인을 제거 하 고 신선한 시스템 물로 채워진 다른 비 커에만 배치 한다. 이것은 제 2 신규 탱크 시험 중에 추가로 투약을 최소화 하기 위한 세척 기간 이다. 성인은 추가로 10 분 동안 워시 아웃 비 커에 머물 수 있습니다.
참고: 약물의 원치 않는 교차 치료를 방지 하기 위해 각 약물 상태에 대해 별도의 그물을 사용 해야 합니다. 실험 자가 희망 하는 경우에는 세척 기간을 건너뛸 수 있습니다. - 이전 단계에서 비 커 로부터 그 성인을 제거 하 여 신규 탱크 다이빙 테스트를 두 번째로 수행 하 고, 새로운 신규 탱크에 배치 하 고, 3.5 단계를 3.6에 따른다.
- 두 번째 신규 탱크 시험 후, 개별 유지 탱크에 개인을 제거 합니다. 두 번째 노벨 탱크에 시스템 물을 붓고 다음 테스트를 위해 신선한 시스템 물로 채우십시오. 이 단계는 어떤 약물의 교차 오염을 방지 합니다.
참고: 약물의 반감기에 따라 약을 포함 하는 신선한 비 커는 3 시간 마다 이루어져야 합니다. 부스 피 라 네를 위해 3 시간 마다 신선한 솔루션을 만드십시오. 또한, 3.8 단계에서 메모를 따라, 실험 컨트롤 및 약물 치료 사이 무작위로 해야. - 모든 시련이 끝날 때, 개인을 다시 물고기 시설로 돌려 준다.
참고: 사용 하는 약물의 종류에 따라, 개인에 이러한 치료의 효과 오래 지속 될 수 있습니다. 따라서 다른 실험에서 이러한 개인을 사용 하지 마십시오.
5. 비디오 분석
- 모든 시험 후, 선택의 추적 소프트웨어에 비디오 파일을 로드.
참고: 당사는 일반적으로 시판 되는 추적 소프트웨어를 사용 하지만, 무료로 제공 되는 소프트웨어 패키지를 사용할 수 있습니다. 추적을 달성 하는 단계는 사용 되는 소프트웨어 패키지에 따라 다를 수 있습니다. - 비디오의 스틸 프레임을 사용 하 여 (i) 물로 채워진 전체 신규 탱크 투기 장, 그리고 상위 세 번째 (iii) 중간 세 번째, 그리고 탱크의 하단 1/3을 중심으로 상상의 경계를 정의 합니다. 이를 사용 하 여 물고기 들이 신규 탱크의 각 부분에서 소비한 시간을 설정 합니다.
- 5.2 단계에서 정의한 각 경기장에 대해 프레임당 x-y 변위를 계산 합니다.
- 탱크의 상단, 중간 및 하단 영역을 정의 합니다. 각 지역은 크기가 비슷해야 합니다. 이러한 영역을 결정 하는 간단한 방법은 탱크의 길이를 y 방향으로 계산 하 고이를 3으로 나누는 것 이다.
참고: 일반 프로토콜의 변형이 존재 합니다. 예를 들어 일부 랩은 2/3 대신 반쪽을 사용합니다. - 각 경기장, 거리 및 속도에 소요 되는 시간을 결정 합니다.
참고: 대부분의 추적 패키지는 자동으로 사용자에 대해이를 계산 합니다. 그러나 추적 소프트웨어가 없는 경우에는 x-y 변위 값에서 쉽게 계산할 수 있습니다. 예를 들어, 다음 공식을 사용 하 여 거리를 결정할 수 있습니다.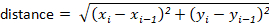
그리고 속도는 공식에 따라 결정 될 수 있다: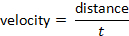
- 5.2 단계를 반복 5.4 하 여 모든 시험에 대 한 트랙과 측정값을 획득 합니다.
참고:이 일반 프로토콜의 변형은
6. 정규 성 테스트
- 통계적 차이를 계산 하기 위해 계속 하기 전에 통계를 수행 합니다. 데이터를 정상적으로 분산 하 고 있는지 확인 하십시오.
- 데이터가 정상적으로 분산 되는 널 가설이 거부 된 경우 (즉, 데이터가 가우스 분포를 따르지 않는 경우) 비 모 수 테스트를 사용 하 여 모든 테스트를 수행 하십시오. 반대로, 데이터가 정규 분포를 따르는 것으로 확인 되 면 파라메트릭 테스트 사용을 진행 합니다.
참고: 우리는 통계를 수행 하기 위해 상업적으로 사용 가능한 소프트웨어를 사용; 그러나 R 프로그래밍 언어를 사용할 수도 있습니다. 샤이로-Wilk 분석은 R의 샤로이로 테스트 기능을 사용 하 여 수행할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
결과
제 브라 피시에서의 스트레스 검사
야생 형 제 브라 피시에서 시간이 지남에 따라 스트레스 거동을 검사 하기 위해, 우리는 새로운 탱크 테스트에서 AB 스트레인24 에서 성인 물고기를 테스트 했습니다. AB 성인은 상기와 같은 프로토콜을 실시 하였다. 간단히, 물고기는 행동 실에 있는 탱크에서 1-h 순응 기간을 받았다. 개인은 10 분 동안 비 커에 ?...
Access restricted. Please log in or start a trial to view this content.
토론
제 브라 피시는 새로운 탱크에서 강력한 스트레스 반응을 보입니다.
여기서, 우리는 성인 zebrafish에서 스트레스 응답을 검사 하기 위한 간단한 행동 접근법을 설명 하 고 약리학을 사용 하 여 스트레스의 간단한 측정으로 접근 방식을 검증 합니다.
새로운 탱크 시험은 제 브라 피시와 다른 종의 물고기12,14,
Access restricted. Please log in or start a trial to view this content.
공개
저자는 경쟁 또는 재정적 이익이 없음을 선언 합니다.
감사의 말
이 작품은에 드와 ACK에 플로리다 애틀랜틱 대학의 목성 생명 과학 이니셔티브에서 자금 지원. 이 저작물은 또한 R21NS105071에 게 부여 된 보조금으로 지원 되었으며, 국립 보건부에서 R15MH118625 (ERD)로 지급 되었습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
참고문헌
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, Ø, Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, New York, N.Y. 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143(2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7(2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유