Method Article
면역의 혼합된 공상 모델에 Photoactivation에 의해 개별 Autoreactive 어린 싹 센터 질문
요약
이 프로토콜 어떤 autoreactive 세포 photoactivatable 녹색 형광 단백질 (GFP PA) 기자를가지고 자연 면역 어린 싹 센터와 혼합된 murine 골 키메라의 생성을 설명 합니다. 이 다운스트림 분자 및 기능 분석 조직에 세포 위치를 연결 하는 기능을 제공 합니다.
초록
자가 면역 질환은 중요 한 건강 부담 제시. 개발 및 자가 면역 질환의 진행에 관한 근본적인 질문은 답이 남아 있다. 기본 질병 메커니즘 및 세포 역학의 우리의 이해에 있는 전진에 대 한 요구 사항 중 하나는 다운스트림 분자 또는 기능 분석; 셀 하위 집합의 microanatomical 위치의 정확한 커플링 전통적으로 달성 하기 어려운 목표. 안정적인 photoactivatable 생물 fluorophores 기자 긴장에 그들의 통합의 개발은 최근 정확한 microanatomical 라벨 및 murine 모델에서 세포 부분 집합의 추적 활성화 됩니다. 여기, 우리가 설명 어떻게 autoreactive 림프 구 단일 본 원 센터에서 분석 하는 능력 면역에 새로운 통찰력을 제공 하기 위해 도움이 될 수 있습니다 예를 들어 photoactivatable 기자와 면역의 소설 공상 모델의 조합을 사용 하 여 . 생성 하기 위한 절차 섞인 키메라 자발적인 autoreactive 어린 싹 센터 photoactivatable 녹색 형광 단백질 리포터를 운반 하는 림프 톨에 의해 채워진 설명 합니다. Vivo에서 레이블 전략을 사용 하 여, 단일 어린 싹 센터 수 구상 될 explanted 림프 조직에 그들의 세포 성분 photoactivated 2 광자 현미경 검사 법에 의해. 단일 본 원 센터에서 림프 톨 Photoactivated 다음 분석할 수 있습니다 또는 단일 셀 또는 대량, 흐름 cytometrically를 정렬 하 고 추가 다운스트림 분자 및 기능 분석을 받게 될 수 있습니다. 이 방법은 직접 면역의 분야에서 새로운된 통찰력을 제공 하기 위해 적용 될 수 있습니다 하지만 골 키메라와 photoactivation 프로시저 생성 하기 위한 절차 또한 전염병의 연구에서 광범위 한 응용 프로그램을 찾을 수 있습니다, 종양 전이입니다.
서문
자가 면역 질환의 발병 률 특히 서양 사회에서에서 지난 수십 년간에서 급속 하 게 상승 했다. 오늘, 자가 면역 질환의 병 적 상태와 사망률1서방 세계 가장 널리 퍼진 원인의 목록에 3 계급. 개발 및 자가 면역 질환의 진행에 관한 근본적인 질문은 답이 남아 있다. 기본 질병 메커니즘 및 세포 역학의 우리의 이해에 있는 전진에 대 한 요구 사항 중 하나는 다운스트림 분자 또는 기능적인 분석 셀 하위 집합의 microanatomical 위치의 정확한 커플링. 지난 10 년간에서 정확한 microanatomical 라벨 및 추적 휴대의 안정적인 photoconvertible, photoactivatable, 또는 photoswitchable 생물 fluorophores 기자 긴장에 그들의 통합의 숫자의 개발이 활성화 murine 모델에서 하위 집합입니다.
데, 돌 산호에서 발생 하는 photoconvertible 형광 단백질 보라 빛 또는 자외선 빛2노출 시 붉은 형광을 녹색 형광에서 돌이킬 수 없는 photoconversion를 겪 습. Organotypic 뇌 조각3개발에 개별 셀의 동적 동작을 따라 처음 고용, 세대의 노크 마우스 이후에 허용 vivo에서 세포 움직임을 모니터링 하는 데와 시스템의 분석에 적용 된 면역 세포는 림프절4에서 마이그레이션. 이 접근은 2 세대 기자5이후 세련 된 이었다. 유사한 기자 Dendra입니다6, 최근 vivo7림프절 전이 추적 하는 데 사용 했다.
첫 번째 photoactivatable 단백질 개발 녹색 형광 단백질 (GFP) 단일 지점 돌연변이 (T203H), 설계 된 550 nm8450에서 파장 영역에서 매우 낮은 흡 광도을 선도 했다. 보라색 빛에 의해 photoactivation, 후이 photoactivatable 녹색 형광 단백질 (GFP PA) 스위치를 400 ~ 흡수 최대 ~ 500 nm, 저조한 대략 100 강도 증가 488의 파장 nm. 모든 조 혈 모 세포가 PA GFP를 표현 하는 유전자 변형 생쥐의 생성 허용, 처음으로, 어린 싹 센터9의 해부학 정의 빛과 어두운 영역에서 B 세포 선택의 심층 분석.
Photoactivation 형광 상태로 비 형광 상태에서 돌이킬 수 없는 변환 이며 photoconversion는 다른 1 개의 파장에서 단방향 전환, 반면 photoswitchable 단백질10 두 조건 사이 셔틀 수 있습니다. . 이 후자의 능력은 최근 단백질 활동11의 광학 제어를 무력화 됩니다.
PA GFP 기자를 활용 하 여, 우리 최근 자발적인 루 푸 스 같은 자가 면역12의 새로운 모델에서 단일 어린 싹 센터 B 세포 레파토리를 특징. 이 모델은 1 개 부품 골 autoreactive B 세포 수용 체 노크에는으로 ribonuclear-단백질 복합물 (564Igi13,14)에 대 한 2 개 부품에서 골 수를 함께 품고 함께 혼합된 키메라 기반 원하는 기증자입니다. 약 6 주 게시물 재구성에 항상성 조건 어떤 자발적인 autoreactive 어린 싹 센터 장과 피부 림프절에는 달성 된다. 특히, 어린 싹 센터 B 세포 인구는 거의 독점적으로 (~ 95%) 비 564Igi 구획에서 파생 된 셀으로 구성 하 고 이러한 야생 유형 파생 B 세포 autoreactive 되었다. 따라서, 모델, 사용 하 여 다양 한 transgenes 노크 아웃 기자 autoreactive 어린 싹 센터 B 세포의 분석에 대 한 ' 플러그와 플레이 ' 접근 수 있습니다. 여기, 우리는 자발적인 autoreactive 어린 싹 센터 PA GFP 기자를 운반 하는 림프 톨에 의해 채워집니다와 혼합된 키메라를 생성 하기 위한 절차를 설명 합니다. Vivo에서 레이블 전략을 사용 하 여, 단일 어린 싹 센터 explanted 림프 조직에 그들의 세포 성분 photoactivated 2 광자 현미경을 사용 하 여 구상 될 수 있습니다. 단일 본 원 센터에서 Photoactivated 세포 수 이후에 cytometry 분석 또는 형광 색소 활성화 셀 정렬 (FACS)에 의해 정렬 되며 추가 다운스트림 분자 및 기능 분석을 복종. 단일 본 원 센터에서 autoreactive 세포를 분석 하는 능력 직접 면역의 분야에서 새로운된 통찰력을 제공 하기 위해 적용 될 수 있습니다 하지만 기술과 설명 하는 방법을 찾을 수 있습니다 또한 관련 응용 프로그램의 연구에 감염 증 그리고 종양 전이입니다.
프로토콜
모든 동물 사용 유럽 공동체 지침을 준수 하 고 덴마크 동물 연구 검사자 (2017-15-0201-01348)에 의해 승인 되었다.
1. 일반 마우스 축산 및 버퍼 및 도구 준비
- 특정 병원 체 자유롭게 (SPF) 조건에서 표준 지침에 따라 건강 상태를 정기적으로 모니터링을 집 마우스 라인.
- 선택 사항: 순진한 쥐 비 모니터링 우발적인 감염 때문에 자발적인 어린 싹 센터의 부재를 확인 합니다. 이 면역 형광 검사 현미경 검사 법 (어린 싹 센터 구조의 존재)에 의해 할 수 있다 또는 흐름을 앞에서 설명한12cytometry (어린 싹 센터 B 세포의 주파수).
참고: 어느 여성 또는 남성을 사용할 수 있습니다. 일반적으로, 섹스의 불일치가 발생할 수 있습니다 이론적으로 남성 Y 항으로 alloreactivity 여성 받는 사람/기증자15로 섹스 일치 기증자와 받는 사람에 이상적입니다. - 사용 CD45.1 받는 사람 (b 6. SJL-Ptprc는는 Pepcb/BoyJ) 나이의 6-10 주 주변에. 564Igi를 사용 하 여 (b 6. Cg-Ightm1 (Igh564) TikIgktm1 (Igk564) Tik/J) 및 PA-GFP (나이의 6-12 주에 B6.Cg-Tg(UBC-PA-GFP)1Mnz/J) 기증자.
- 압력가 마로 소독 하 여 수술 도구 (똑바로 잘가 위 및 Dumont 집게 # 5와 #7) 소독 일상적인 소독 지침에 따르면 그들.
- 500 mL의 인산 염 버퍼 식 염 수 (PBS), 2% 태아 둔감 한 혈 청 (FBS), pH 7.4에 1 mM ethylenediaminetetraacetic 산 (EDTA)를 포함 하 골 (BM) 버퍼를 준비 합니다. BM 버퍼를 준비 하려면 추가 열 비활성화 (1 시간 보완을 비활성화 하는 56 ° C 물 목욕에서)의 10 mL FBS와 1.25 mL 500 ml PBS, pH 7.4, 및 잘 혼합 (pH 7.4에 조정) 400 mM EDTA 솔루션의. 0.2 µ m 필터 플라스 크를 사용 하 여 버퍼를 필터링 합니다.
- 시 약 학년 물 총 볼륨의 10 mL를 10 배 재고의 1 mL를 diluting 하 여 적혈구 (RBC) 세포의 용 해 버퍼 (155mm NH4Cl, 12 m m NaHCO3, 0.1 mM EDTA) 10 mL를 준비 합니다. 5 m m EDTA, pH 7.4 PBS의 50 mL를 준비 합니다.
2입니다. 혼합된 골 키메라의 설립
- 받는 사람 (0 일)의 조사
- CD45.1 골 수 받는 사람 컨테이너를 적절 한 방사선 놓고 1100으로 비추는 방사선 감마 irradiator에.
참고: 대체 방사선 소스를 사용할 수 있습니다. 소스에 관계 없이 복용량/타이밍 동물에 최소한의 부수적인 조직의 손상 최대한 myeloablative 효과를 최적화할 수 있다. - 항생제에 물 ad libitum (1 mg의 sulfadiazin 및 trimethoprim/mL 식 수의 0.2 mg).
- CD45.1 골 수 받는 사람 컨테이너를 적절 한 방사선 놓고 1100으로 비추는 방사선 감마 irradiator에.
- 뼈 (주 1)의 추출
- 4 %isoflurane 공기에서의 지속적인 흐름에 의해 564Igi 골 수 기증자를 anesthetize 하 고 자 궁 경부 전위에 의해 안락사. 에탄올과 기증자 아래로 스프레이 흐름 후드에서 무 균 수술 패드에 그들을 배치. 살 균 버퍼 및 장비를 사용 하 여 살 균 조건을 유지 작업을 진행 합니다.
- 대 퇴 골과 경골, 먼저 발목 주위 절 개 한 똑바로 잘가 위를 사용 하 여 엉덩이를 위쪽으로 확장. 몸 쪽으로 다리를 끄고 using 중장비 집게 또는 엄지와 집게 손가락, 피부를 당겨. 마찬가지로 아래로 발 떨어져 피부를 당겨.
- 엉덩이에서 다리를 잡아와 강제로 발을 당겨 무릎과 발목 관절에 밖으로 팝업. 발목 관절 휴식과 경골, 그로 인하여 힘 줄과 근육 경골 오프 스트립에 들고 하는 동안 발을 몸 쪽으로 당겨 이동 합니다.
- 무릎을 공동 출시 경골, 휴식 하 고 유사 하 게 함으로써 스트립 힘 줄과 근육은 대 퇴 골에서 대 퇴 골에 들고 하는 동안이 몸 쪽으로 당겨. 엉덩이 관절에 절 개를 확인 하 고는 힘 줄을 잘라 다음 엉덩이 소켓에서 대 퇴 골을 꺼내. 단계 2.2.2-2.2.4 contralateral 측면에 대 한 반복 합니다.
- 거친 종이 타월로 나머지 모든 근육과 결합 조직을 제거 하기 위해 그들을 문 지르고 하 여 뼈를 신중 하 게 청소. 다음 그들에 린스 차가운 BM 버퍼 마침내 Dumont #7 집게의 쌍을 사용 하 여 얼음에 신선한 찬 BM 버퍼에 그들을 전송 하기 전에. PA GFP 기증자에 대 한 2.2 단계를 반복 합니다.
참고: 단일 기증자 로부터 골 수 세포의 수는 성별과 나이 따라 다릅니다. 받는 사람 원하는 수와 원하는 입력된 골 비율 및 숫자에 따라 기증자의 수를 확장. 기증자 부족 한 경우, 정면 사지 골 추출에 포함할 수 있습니다. 이 일반적으로 추가 1/3 ½ 뒷 다리 사지에서 얻은 세포의 생성 합니다. 일반적으로, 어디서 나 50-200 백만 셀에서 복구할 수 있습니다 기증자, 나이, 성별, 배경 및 여부만 뒷 다리 또는 뒷 다리와 앞 다리는 포함에 따라 당.
- 골 수 세포 추출
- 얼음 처럼 차가운 BM 버퍼에서 rinsing 하 여 박격포를 준비 합니다. 린스 버퍼 배수와 10 mL 혈 청 학적인 피 펫과 전기 피펫은 컨트롤러를 사용 하 여 신선한 얼음 BM 버퍼의 10 mL를 추가.
- Dumont #7 집게의 쌍을 사용 하 여 박격포를 564Igi 기증자 로부터 뼈를 전송 사용 하는 유 봉 분쇄 하 고 출시 골 뼈 분쇄. 골 추출 물 10 mL 혈 청 학적인 피 펫으로 발음 하 고 얼음에 50 mL 튜브에 70 µ m 셀 스 트레이너를 통해 전달 합니다.
- 박격포를 신선한 얼음 BM 버퍼의 추가 10 mL을 추가 하 고 셀의 완전 한 복구를 보장 하기 위해 반복. 종이 타월로 박격포에서 뼈 재료를 제거 하 고 적절 하 게, 삭제 70% 에탄올, BM 버퍼 다음으로 신중 하 게 박격포를 헹 굴. PA GFP 골 수 기증자 그룹에 대 한 2.3 단계를 반복 합니다.
- 골 수 세포를 계산
- micropipette를 사용 하 여 플라스틱 파라핀 영화의 조각에 RBC 세포의 용 해 버퍼의 40 µ L을 포함 하는 물방울을 놓습니다. 반전 564Igi 골 관 몇 번 하 고는 micropipette를 사용 하 여 aliquot 10 µ L을 꺼내. RBC 세포의 용 해 버퍼 드롭의 40 µ L와 함께 믹스.
- 그 후 드롭 Trypan 블루 (수성 해결책에서 0.4%)의 50 µ L를 추가 합니다. Burker-터키어 hemocytometer 및 현미경 조사 결과 믹스의 10 µ L를 즉시 로드 합니다. 총 희석 요인 x 10을 사용 하 여 mL 당 셀의 수를 계산 합니다. 적절 한 세포 생존 능력을 확인 > 90%. PA GFP 골 수 기증자 그룹에 대 한 2.4 단계를 반복 합니다.
- 기증자 정지를 준비
- 건의 단계 2.4 및 원하는 받는 사람 수에 따라 달라 집니다, 기증자 혼합 관에서 혼합 두 기증자 그룹의 각각에서 골 수 기증자의 볼륨을 계산 합니다.
참고: 예: 1:2 혼합된 564Igi:PA의 한 그룹을 설정-6 CD45.1 받는 GFP 키메라: 2 부품 PA-GFP와 각 받는 사람 필요 20 x 106 기증자 세포 총, 1 부 564Igi. 따라서,이 10 x 20 x 6 x 1/3를 요구 한다6 = 40 x 106 564Igi 기증자 세포 및 6 x 2/3 10 x 20 x6 = 80 x 106 PA GFP 기증자 세포. - 50 mL 원뿔 튜브에 PA-GFP와 564lgi 기증자 수의 적절 한 금액을 믹스. 진동 물통 회전자를 사용 하 여 10 분 동안 골 혼합물 g 와 4 ° C x 200에서 원심.
- 가만히 따르다는 상쾌한 고 mL 당 1 x 108 셀의 밀도에 얼음 처럼 차가운 BM 버퍼에 셀 resuspend. 얼음에 microcentrifuge precooled 1.5 mL 튜브에 전송.
- 건의 단계 2.4 및 원하는 받는 사람 수에 따라 달라 집니다, 기증자 혼합 관에서 혼합 두 기증자 그룹의 각각에서 골 수 기증자의 볼륨을 계산 합니다.
- 골 수 기증자와 받는 사람 골 수를 재구성
- 4% isoflurane 3.75% 유지 보수 다음 공기에서의 지속적인 흐름으로 유도 사용 하 여 받는 사람 anesthetize 발가락-핀치 반사의 부재에 의해 마 취의 적절 한 평면을 확인 합니다.
- 신중 하 게 포함 하는 보장, 골 수 세포의 적절 한 물의 resuspension 골 믹스 (~ 106 셀 x 20), 0.3 mL의 aspirate 200 µ L을 골 혼합 튜브 영화, 30 게이지 인슐린 주사기.
- 받는 사람 옆에 배치, 위와 약간 ' 눈을 밖으로 팝업 ' 눈 아래 피부를 부드럽게 스트레칭, 부드럽게 눈 소켓, 주변 조직과 눈을 피하기 위해 돌의 앞에 30 ° 각도로 약 주사기의 끝을 삽입. 바늘의 팁은 눈 소켓을 밑줄 뼈를 만질 때, 약간 철회 (~0.5 m m)와 꾸준한 압력을 사용 하 여 골 기증자를 천천히 주입.
참고: 이어야 한다 아무 출혈, 액체 및 더 주입 시 눈의 아주 사소한 불 룩 하 누설 없음. - Ad libitum 항생제 물으로 케이지를 마우스를 반환 하 고 프로시저에서 즉시 복구 확인 합니다. 각 받는 사람에 대 한 2.6 단계를 반복 합니다.
그러나 참고: 꼬리 정 맥 주입 retroorbital 주입 비슷한 결과 대신에 사용할 수 있습니다, 그리고, 우리의 손에서 그것은 상당히 느린 받는 사람의 큰 그룹으로 작업할 때 문제가 있을 수 있습니다. 포부 및 질 식 위험 포즈 직접 작은 직경 침구 anaesthetized 동물의 복구 피해 야 한다
- 제거 하는 항생제 물 (14 일)
- cage(s)에서 항생제 물을 제거 하 고 신선한 일반 식 수를 바꿉니다.
3. 성공적인 재구성을 검사 하 고 chimerism (주 6)의 적절 한 학위를 확인
-
Retroorbital 키메라와 컨트롤의 출혈
- 받는 사람 귀 태그 숫자 microcentrifuge 튜브 1.5 mL 라벨 5 mM EDTA를 포함 하는 PBS의 50 µ L을 추가 하 여 혈액 컬렉션 튜브를 준비 합니다.
참고: PA-GFP, CD45.1 및 CD45.2, 및 9D 11 (idiotype)에 대 한 적절 한 컨트롤을 포함 합니다. 이것은 1를 포함 하 여 행 해질 수 있다 PA-GFP + 마우스, 1 CD45.1 마우스, 1 b 6 마우스 및 1 564Igi 마우스. - 마우스를 anesthetize 고 마 취 단계 2.6.1에서의 적절 한 평면을 확인 합니다. 부드럽게 위와 약간 ' 눈을 밖으로 팝업 ' 눈 아래 피부를 스트레칭, 그것의 측면에 키메라를 놓습니다.
- 부드럽게 눈과 주위 조직 손상을 방지 하도록 눈 소켓의 앞에 약 40 ° 각도에서 BoPET 포장 heparinized 모 세관 튜브 (60 µ L 내부 볼륨)를 삽입 합니다. 부드럽게 트위스트/회전 튜브 피와 채우기 위해 시작 될 때까지.
- 수 동적으로 모 세관 작용 때까지 거의 완전히 풀로 튜브를 채우기 위해 혈액을 허용 다음 튜브를 철회 하 고 즉시 눈을 있도록 눈 주위 한 파악을 푸는 동시에 해당 사전 이라는 컬렉션 튜브 장소 위치로 다시 침전 하는. 출혈은 즉시 중지 해야 합니다.
- 모 세관 튜브 컬렉션 튜브에 비운은 고 sharps 용기에 그것을 폐기. 튜브를 닫고 PBS/EDTA와 완전 한 혼합 되도록 세 번 반전.
- 마우스 케이지를 반환 하 고 프로시저에서 즉시 복구 확인. 각 실험 마우스와 적절 한 컨트롤에 대 한 3.1 단계를 반복 합니다.
참고:이 방법은 전에이 완벽 하 게 재구성은 우발적인 감염 조사 받는 사람에 대 한 더 큰 위험 포즈 수 있습니다 submandibular 정 맥 빵 꾸를 사용 하 여 주의 가져가 라. 또한, 우리의 경험에서 우리는 혈액의 수집 그리고 분실 과도 한 출혈로 인해 혈액의 양이 더 많은 변수 찾으십시오. 골 수 키메라는 재구성 단계에서 중요 한 새로운 골 수는 완전히 engrafted 조 정상 수준을 다시 시작 하기 전에 이러한 사항을 모두 중요 하다.
- 받는 사람 귀 태그 숫자 microcentrifuge 튜브 1.5 mL 라벨 5 mM EDTA를 포함 하는 PBS의 50 µ L을 추가 하 여 혈액 컬렉션 튜브를 준비 합니다.
-
말 초 혈액 단 세포 (PBMC) 정화
- 짧게 혈액 컬렉션의 완료 후 (10 s) 낮은 속도로 튜브 원심 (< 200 x g)는 희석 수집 하는 튜브의 하단에 혈액 안정.
- 림프 구 분리 매체와 10 mL 주사기를 18 G 바늘을 연결. 첫 번째 튜브의 아래쪽에 바늘을 삽입 하 고 림프 구 분리 매체의 1 mL와 함께 혈액 샘플을 underlayer. 조심 스럽게 바늘을 철회 하 고 샘플의 교차 오염을 방지 하기 위해 종이 타월로 닦아냅니다.
- 모든 예제를 통해 진행 하십시오 다음 낮은/오프로 설정 하는 브레이크와 함께 800 x g, 스윙 양동이 원심 분리기에서 실내 온도에에 25 분 동안 원심.
- 대응 하 게 레이블이 1.5 mL의 집합 차가운 BM 버퍼의 1 mL를 포함 하는 microcentrifuge 튜브 준비.
- 각 샘플에 대 한 다음 원심 분리 200 µ L micropipette 위 (플라즈마) 레이어를 입력 하 고 바로 인터페이스 위에 단 셀 (MNC) 레이어를 발음. BM 버퍼의 1 mL를 포함 하는 대응 하 게 레이블이 지정 된 튜브에 세포를 전송. 뚜껑 닫고 혼합을 반전 합니다. 림프 구 분리 매체 포함 된 튜브를 삭제 합니다.
- 모든 예제를 통해 진행 하십시오 하 고 200 x g 5 분, 진동 물통 회전자에 4 ° C에서 원심. 발음 하 고 상쾌한, 삭제 차가운 BM 버퍼의 200 µ L에 펠 릿을 resuspend. 샘플 항 체 얼룩이 지 고 흐름 cytometric 분석에 대 한 준비가 있다.
-
흐름 cytometric 평가 위한 얼룩
참고: 제안 패널: CD45.1 FITC, B220-PerCP-Cy5.5, 9 D 11-A568, CD45.2-APC. 비 활성화 PA-GFP 태평양 오렌지 (또는 동등한) 채널에서 검색 됩니다. 아니 생존 염료는 림프 구 분리 되 면 죽은 세포의 제거로 필요 합니다.- micropipette 사용 하 여, 96 잘 접시에 각 키메라 및 제어 샘플을 잘 당 세포 현 탁 액의 100 µ L를 추가 합니다.
- 3 비 PA GFP 컨트롤 샘플에 대 한 나머지 100 µ L 각 샘플 (총 300 µ L)의 수영장. 흠 없는 제어 및 단일 스테인드 제어 우물을 위한이 물자의 50 µ L를 추가 합니다. PA-GFP에 대 한 단일 스테인드 제어 또한 흠 없는 PA GFP 샘플의 50 µ L를 추가 합니다.
- 각 잘 버퍼 (흠 없는) 100 µ L를 추가, 단일 항 체 (단일 스테인드 보상 제어, PA GFP 보상 제어 제외) 또는 항 체 믹스 (샘플). 20 분 동안 얼음에 품 어.
- 4 ° c.에 5 분 동안 200 x g 에서 원심 버퍼를 터치 합니다. 각 우물에 BM 버퍼의 200 µ L을 추가 하 고 다시 씻어 원심. 버퍼에 밖으로 터치 한 각 잘 BM 버퍼의 200 µ L에서 셀 resuspend 합니다. 샘플 분석 흐름 cytometer (그림 1)에 대 한 준비가 있다.
참고:는 키메라에 어린 싹 센터 응답 6 주 이후부터 언제 든 지 분석할 수 있습니다.
4. vivo에서 단일 본 원 센터의 식별을 돕기 위해 한계 영역/subcapsular 공동의 라벨
참고: 현재 프로토콜 노상 강도/호크 (오 금 림프절)과 정 맥 (i.v., 비장) 주사에 대 한 증명은 되지만 대상 사이트는 다양 한 수 있습니다.
-
오 금 림프절 라벨에 대 한 양자 노상 강도 주입
- 2.6.1 단계 에서처럼 마우스 anesthetize
- 1.5 mL microcentrifuge 관에서 2 µ L의 PBS, pH 7.4의 18 µ L에서 PE 라는 쥐 반대로 마우스 CD169 항 체 희석. 한 조각의 플라스틱 파라핀 영화에 10 µ L 각 혼합물의의 두 방울을 배치 합니다. 30 게이지 바늘으로 0.3 mL 인슐린 주사기를 사용 하 여 각 방울 발음
- 라벨에 믹스는 노상 강도 10 µ L를 주입 (노상 강도, 인접 발가락의 시작 부분에서의 중앙 부분에 5-10 ° 각도로 바늘으로 입력 하 고 약 중간 뒤꿈치 쪽으로 바늘을 삽입) 또는 호크 (바늘 5-입력 10 ° 뒤꿈치 바로 위에 각도 위치에 대 한 삽입의 무릎 쪽으로 방향에서 아 킬 레 스 힘 줄의 축 길이 절반). 그들의 감 금 소를 생쥐를 반환 하 고 5 단계를 계속 하기 전에 대략 15 분을 기다립니다.
-
비장 라벨에 대 한 정 맥 주입
- 포인트 2.6.1에서 마우스 anesthetize
- 1.5 mL microcentrifuge 튜브에서 PBS의 90 µ L에서 PE 라는 쥐 반대로 마우스 CD169 항 체의 10 µ L를 희석. 인슐린 주사기 0.3 mL와 혼합을 발음.
- 수행 단계 2.6에 의하여 retroorbital i.v. 주입 합니다. 그들의 감 금 소를 생쥐를 반환 하 고 5 단계를 계속 하기 전에 대략 15 분을 기다립니다.
참고: isoflurane, 케 타 민/Xylazine 혼합 사용할 수 있습니다;와 같은 마 취 주사 대신으로 그러나,이 일반적으로 느린 복구 시간으로 이어집니다. 림프 배수는 일반적으로 골격 근육 운동에 의해 영향을, 이후이 느린 배수 시간이 이어질 예정 이다.
5. explanting 비장 및 림프절 및 photoactivation에 대 한 준비
-
이중 면 이미징 및 photoactivation 챔버 준비
- 20 mL 주사기에서 플런저를 제거 하 고 다시 로드 그것 진공 그리스와 그것에 진공 그리스의 튜브의 노즐을 삽입 하 여. 다음 5 mL 주사기에서 플런저를 제거 하 고 다시-진공 그리스와 함께 그것은 부하를 20 mL 주사기를 사용 하 여.
- 진공 그리스 로드 5 mL 주사기를 사용 하 여 사각형 coverslip 평평한 표면에 배치 하 고 진공 그리스 (약 1-2 m m 가장자리에서)으로 coverslip의 가장자리를 따라 추적 하 여 이미징 및 photoactivation 챔버 준비.
참고: 침수 물에 유화 진공 그리스의 microdroplets 렌즈 오염 수로 이후에 현미경 렌즈 접촉 모든 표면의 진공 기름 오염 방지 주의. - 얼음 처럼 차가운 BM 버퍼와 커버 슬립 진공 그리스 챔버를와 차가운 평평한 표면에 놓습니다.
-
수확 하는 림프절, 비장
- Vivo에서 분류 단계 2.2.1에 의하여 분석할 공상 마우스를 안락사. 70% 에탄올과 시체를 스프레이.
- 오 금 림프절에 액세스 하려면 바로 무릎 구 덩이 아래 피부에 절 개를 만들기 위해 똑바로 잘가 위를 사용 하 고 엉덩이 관절까지 햄 스트링 라인을 따라 위쪽으로 컷을 거의 확장. Dumont #5 또는 # 7을 사용 하 여 집게, 각각 오 금 fossa (그림 2A)에서 조직 노출 피부 바깥쪽의 노출된 플랩의 당겨.
- 신중 하 게 오 금 정 맥에 그냥 중간 오 금 fossa을 입력 하 고 해 부 몬 트 #5 집게의 쌍을 사용 하 여 삽입 하 고 개폐는 다리의 축 집게 기본 오 금 림프절을 노출 하려면 지방 열.
- 엄지 및 집게 손가락 (그림 2B)를 사용 하 여 무릎 근 전면에서 quadriceps 근육을 곤란 하 게 하 여 여 포에서 림프절을 팝. 주변 조직 (그림 2C)에서 그것을 해방 다음 단계 5.1에서에서 준비 진공 그리스 상공에 집게와 림프 노드를 아래에서 잡아.
- 단계 5.2.2-5.2.4 contralateral 측면에 대 한 반복 합니다. 원하는 경우 여러 개의 림프절 단일 챔버에 장착 될 수 있습니다.
- 마지막으로 두 번째 coverslip 진공 그리스 테두리 위에 놓고 모든 기포를 돌출 하도록, 부드럽게 눌러 챔버를 닫습니다.
참고: 버퍼의 일부 밖으로 뿐만 아니라, 밀어 수 있습니다 하지만 진공 그리스 (그림 2D) 유체의 누설 방지 단단한 물개를 형성 한다. 림프절 양면 이미징 상공에 지금 있다. - 비장을 앞쪽 중간 라인에 proximal 마우스의 왼쪽에 복 벽을 통해 절 개 바로 미세가 위의 쌍을 사용 하 여 액세스 하려면 바로 흉 곽, 아래 하 고 뒷부분 axillary 라인에 몸 주위 확장 합니다. 비장의 팁 표시 (그림 3A) 해야 합니다.
- 뒤 몽 #7 집게의 쌍으로 비장을 당기고 그것을 발표 하기에 유착을 잘라. 똑바로 잘가 위의 쌍을 사용 하 여 잘라 ~ 2 m m 두께, 단면, 슬라이스.
- 5.1 단계에서 진공 그리스 상공에는 슬라이스를 놓습니다. 원하는 경우 여러 비장 조각은 단일 챔버에 장착 될 수 있습니다.
- 마지막으로 두 번째 coverslip 진공 그리스 테두리 위에 놓고 모든 기포를 돌출 하도록, 부드럽게 눌러 챔버를 닫습니다. 이미징 및 photoactivation 동안 제외 하 고 모든 시간에 얼음에 모든 이미징 챔버 유지.
참고: 버퍼의 일부 밖으로 뿐만 아니라, 밀어 수 있습니다 하지만 진공 그리스 유체의 누설 방지 단단한 물개를 형성 한다. 비장 조각 양면 이미징 챔버 (그림 3B)에 있다.
6입니다. Photoactivation
-
단일 어린 싹 센터를 식별
참고:이 프로토콜은 비장에 대 한 설명 하지만 전적으로 림프절에 대 한 유사.- 현미경 단계에 이미징 챔버를 놓습니다. 3.5 mL 플라스틱 전송 피 펫을 사용 하 여, 위 coverslip 위에 증류수 한 방울을 배치 및 목표는. 조직 전송된 빛을 사용 하 여 위에 초점.
- 어두운 모드 및 2 광자 여기로 전환 하 고 940 레이저 조정 nm.
참고: 적절 한 필터 세트와 함께이 파장 여기 및 허용 단계 4.2, 주입 CD169 PE로 콜라겐-포함 된 구조 주요 혈관 및 구조 요소와 관련 된 두 번째 고조파 발생의 탐지는 한계 영역을 식별합니다. 그러나, 940 nm 여기 photoactivate PA-GFP 하지 않습니다. - 개별 백색 펄프 분야 (CD169-PE 얼룩에 의해 제한) 조직의 표면 근처를 지역화 하 고 중앙 되와 관련 된 두 번째 고조파 발생에 의해 periarteriolar 림프 칼 집 (친구, T 셀 영역)를 식별 합니다. 친구와 한계 영역 사이의 영역에서 찾아 높은 autofluorescent의 존재 활성화 tingible 신체 세포 (모든 채널에 강한 autofluorescent 신호, 어두운 그들으로 blob 같은 모습) (그림 4A).
참고: 필요한 경우, 조직의 바람직하지 않은 방향으로, 이미징 챔버가 성을 상실 될 수 있습니다 및 이미징 다른 방향에서 수행할 수 있습니다. - 6.1.3 단계에서 식별 하는 특징에 따라., 단일 새싹 센터의 영역을 식별 하는 관심 영역을 그립니다. Z-의 스택 주위를 설정 100-150 µ m 깊이, 조직, 표면에서 시작 하 고 ~ 3 µ m의 단계 크기를 사용 하 여.
- 830 nm 여기 파장으로 전환 합니다. 차단 또는 감지기에 photodamage를 방지 하기 위해 모든 채널을 어둡게 (로 레이저 파워 및 출력 형광은 일반적으로이 파장에 극적으로 더 높은), 그리고 다음 스택 '이미지'.
참고: 레이저 파워 및 픽셀 망설임 시간 등의 특정 설정을 사용 하 고, 특정 조직의 조직과 이미징 시스템에 깊이에 따라 달라 집니다. 각 응용 프로그램 특정 이미징 시스템 사용에 대 한 최적화할 수 있다. 스택을 통해 효율적인 photoactivation을 얻을 것이 필수적입니다, 하는 동안 한다 주의 하지 photodamage에 셀. - 940 nm 여기 파장에 다시 전환 하 고 채널을 다시 합니다. (그림 4B)를 통해 효율적인 photoactivation photodamage (확산, 셀 경계 비 PA GFP 신호, 어두운 반점 또는 photoactivated 지역에서 높은-학위를 autofluorescence)의 부재를 확인 하려면 스택을 통해 스캔.
- Photoactivate 영상 실에서 모든 관련 조직 이동 합니다 다음 신속 하 게 추가 처리까지 얼음에 그것을 반환 합니다. 추가적인 이미징 챔버의 photoactivation와 함께 진행 합니다.
참고: 조직 explanting, 장착 및 특히 photoactivation는 시간이 많이 걸리는 프로세스, 하지만 전체 설정-주위에 세포 생존 능력에 있는 극적인 감소를 방지 하기 위해 4-6 시간을 제한 한다.
7. 복구 및 photoactivated 세포의 분석
-
임 파선 및 비장 세포의 추출
- 각 photoactivated 샘플에 대 한 얼음에 BM 버퍼의 500 µ L을 포함 하는 따라 레이블이 1.5 mL microcentrifuge 튜브 준비. 비-PA-GFP 제어 및 비-활성화 PA GFP 마우스에서 샘플을 포함 합니다. 이 하나의 B6 제어 및 한 PA GFP 컨트롤 마우스를 포함 하 여 수행할 수 있습니다.
- 조심 스럽게 이미징 챔버 (해당 되는 경우 여러 샘플은 단일 챔버에 존재), 샘플의 위치를 유지 하 고 각 샘플의 각각 샘플 튜브를 돌보는에서 상단 커버 슬립을 제거.
- 유 봉 균질 화기를 사용 하 여 조직을 짜 내 고 세포 분리를 튜브에는 유 봉 트위스트. micropipette 사용 하 여, lysate를 발음 하 고 신선 하 고, 미리 냉각 1.5 mL microcentrifuge 튜브로 70 µ m 셀 스 트레이너를 통해 필터링. 림프절 샘플, 7.1.5 단계로 건너뜁니다.
- 비장 샘플에 대 한 진동 물통 회전자에 4 ° C에서 5 분 동안 200 x g 에서 원심. 삭제는 상쾌한 고 RBC 세포의 용 해 버퍼의 200 µ L에 펠 릿을 resuspend. 실 온에서 5 분 동안 incubate 다음 차가운 BM 버퍼의 800 µ L을 추가 하 고 7.1.5 단계로 진행.
- 진동 물통 회전자에 4 ° C에서 5 분 동안 200 x g 에서 원심. 삭제는 상쾌한 고 차가운 BM 버퍼의 200 µ L에서 resuspend. 원하는 경우는 샘플 흐름 cytometric 평가 대 한 얼룩 및 정렬에 대 한 준비가 있다.
-
흐름 cytometric 평가 위한 얼룩
참고: 제안 패널: CD169 PE, B220-PerCP-Cy5.5, 9 D 11-A647, CD38-PE-Cy7, 고칠 수 생존 염료 Efluor-780, GL7-태평양 파랑. 비 활성화 PA-GFP 태평양 오렌지 (또는 동등한) 채널에서 검색 됩니다. Photoactivated 펜 실바 니 아-GFP GFP 채널에서 검색 됩니다. (하 수도 되지 않았을 수도 vivo에서 CD169 PE와 함께 표시) 모든 공동 순화 된 대 식 세포는 CD169 PE와 얼룩 덤프 게이트로 이것을 사용 하 여 제외할 수 있습니다.- micropipette 사용 하 여, 96 잘 접시에 각 키메라 및 제어 샘플을 잘 당 세포 현 탁 액의 100 µ L를 추가 합니다.
- B6 컨트롤 샘플에 대 한 흠 없는 제어 및 단일 스테인드 제어 우물을 위한이 물자의 50 µ L를 추가 합니다. PA-GFP 비 활성화에 대 한 단일 스테인드 제어 또한 흠 없는 비 활성화 PA GFP 샘플의 50 µ L를 추가 합니다. 활성화 된 PA GFP 단일 스테인드 컨트롤에 대 한 모든 photoactivated 샘플에 대 한 나머지 자료 수영장.
- 각 잘, 버퍼 (흠 없는 및 PA GFP 보상 제어)의 100 µ L를 추가, 단일 항 체 (단일 스테인드 보상 컨트롤) 또는 항 체 믹스 (photoactivated 샘플). 20 분 동안 얼음에 품 어.
- 200 x g 에서 4 ° c.에서 5 분 원심 버퍼를 터치 합니다. 각 우물에 BM 버퍼의 200 µ L을 추가 하 고 다시 씻어 원심. 버퍼에 밖으로 터치 한 각 잘 BM 버퍼의 200 µ L에서 셀 resuspend 합니다. 샘플 분석 흐름 cytometer 또는 정렬 (대표 결과 그림5에서)에 대 한 준비가 있다.
결과
혼합된 골 키메라의 세대
(대 한 통계적 의미 12를 참조 하십시오) 대표는 그림 1 에 표시 된 현재 프로토콜 튼튼하게 B 세포 구획에 가까운 완전 한 chimerism와 혼합된 골 키메라를 달성 한다. Serotyping 밝혀 정규화 된 B 세포 숫자 6 주 9D 11 (idiotype)의 낮은 주파수로 재구성 (그림 1A), 564Igi 구획 (그림 1B)에서 파생 하는 긍정적인 순환 B 세포 게시할 수 있습니다. 총 림프 구 게이트 내에서 잔여 받는 파생 셀 ~ 6%의 낮은 주파수는 CD45.1 (1 분기) ~ 94% (그림 1C)의 chimerism의 전반적인 정도 나타내는. 기증자에서 구획 (CD45.1-, 4 분기 + q 3) 564Igi의 비율 (4 분기) PA GFP를 (Q3)는 약 23% ~ 77%. 이 B 세포의 무거운 부정적인 선택에 의해 입력된 33% ~ 66% 비율 설명 보다 약간 낮은 564Igi 구획 12에서 파생. 그림 1D에 볼, 거기에 거의 완전 한 chimerism B 세포 격실 (99.9 %CD45.1-)와 564Igi에서 파생 된 B 세포의 무거운 부정적인 선택의 결과 PA GFP 골 파생 B 세포 (3 분기)의 지배.
조직, 처리 및 흐름 cytometric 평가의 수확
그림 2 및 그림 3 절차를 설명 하 고 explanting의 결과 갓 고립 림프절과 비장 조각. 그림 4 는 vivo에서 레이블 및 photoactivation explanted 비장 조각에 단일 새싹 센터 지역의 대표적인 결과를 선물 한다. 볼 수 있듯이 (그림 4A), CD169-PE와 vivo에서 라벨 튼튼하게 한계 영역 표시는 (빨강, "MZ"으로 표시). 두 번째 고조파 신호 콜라겐-포함 된 구조적 요소 및 주요 혈관 (청색), periarteriolar의 칼 집 (친구) 림프의 중앙 되를 포함 하 여 명백한 것입니다. 높은 autofluorescent, 활성화 된 tingible 몸 세포 어린 싹 센터 활동 (화살촉)와 연결 됩니다. 함께 찍은, 한계 영역, 친구, 그리고 tingible 신체 세포의 식별을 가능성이 단일 어린 싹 센터를 포함 하는 관심 영역 식별을 수 있습니다. 그림 4B에서 볼 수 있듯이 관심 영역 photoactivated입니다. 바와 같이 photoactivation microanatomically 정확한9를 저조한 활성화의 정의 된 영역입니다. 제시 결과 또한 PA의 높은 밀도의 확인 역할-GFP + 림프 톨이 재구성된 키메라에 자발적인 어린 싹 센터의 존재. 정규화 된 B 세포 구획 번호 (그림 5D), 자발적인 새싹 센터 인구 (그림 5E), 및 어린 싹 센터 B 세포는의 부분 집합의 존재를 확인 하는 다운스트림 흐름 cytometric 평가 추가 photoactivated (그림 5F)입니다.
따라서, 현재 프로토콜 선물 강력한 방법이 혼합된 골 키메라의 세대에 대 한 자발적인 autoreactive 어린 싹 센터는 주로 야생-타입 파생 B 셀 photoactivatable 기자를 운반로 구성. 차례로 개별 어린 싹 센터 (그래픽 개요 그림6에서)의 다운스트림 분석 가능합니다.
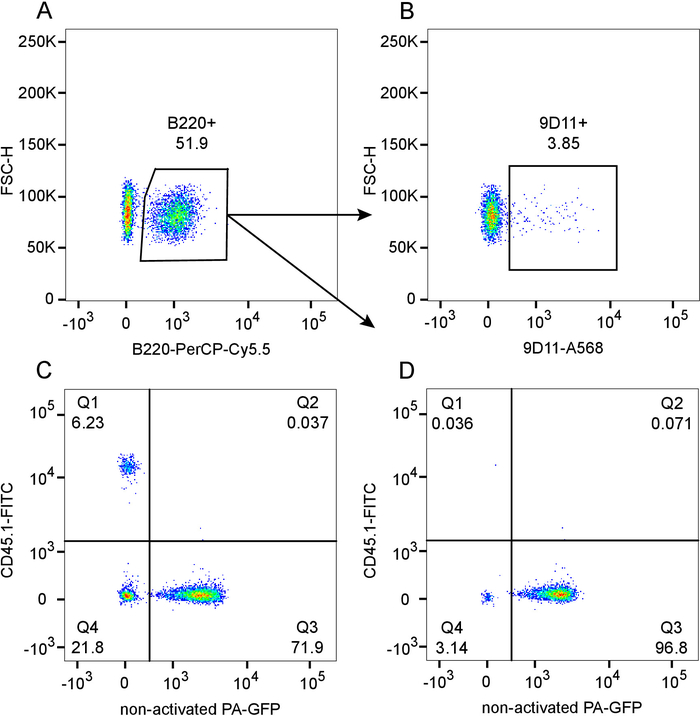
그림 1: Cytometric chimerism 564Igi의 피에서의 정도의 평가 흐름 (CD45.1-, 펜 실바 니 아-GFP-): PA-GFP (CD45.1, PA-GFP +) 치명적 방사능된 CD45.1 받는 사람 (CD45.1 +, 펜 실바 니 아-GFP-)에 키메라를 혼합, 6 주 게시물 재구성. 미리 내의 림프 톨에 문이 B220 + B 세포의 게이팅 보여주는 A) 줄거리. 그림 A, B 세포 인구 내에서 보여주는 9D 11 + (idiotype) 주파수에서에서 B) Subgate. C) 플롯의 PA-GFP CD45.1, 미리 내의 림프 톨에 문이 대. D) 줄거리의 PA-GFP 줄거리 대답에서에서 B 세포 subgate에 CD45.1 대 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
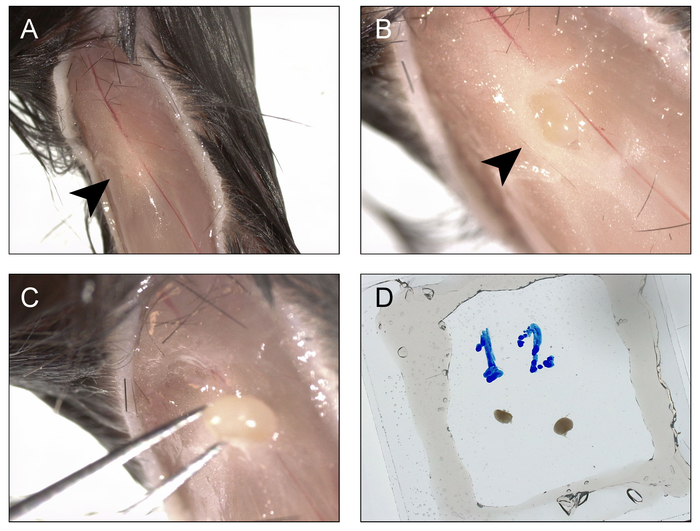
그림 2: 수확 및 이미징 및 photoactivation에 대 한 오 금 림프절 장착 절차. A) 절 개는 무릎 아래 하 고 엉덩이 관절까지 연장 및 가장자리 (화살촉) 오 금 fossa을 노출 하려면 양쪽에 제거 됩니다. B) overlying fatpad 열리고 오 금 림프절은 노출된 (화살촉). C) 오 금 림프절은 포에서 검색 됩니다. D) 절차 contralateral 측면에 대 한 반복 하 고 두 노드 BM 버퍼 가득 양면 coverslip/진공-그리스 챔버에 탑재. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
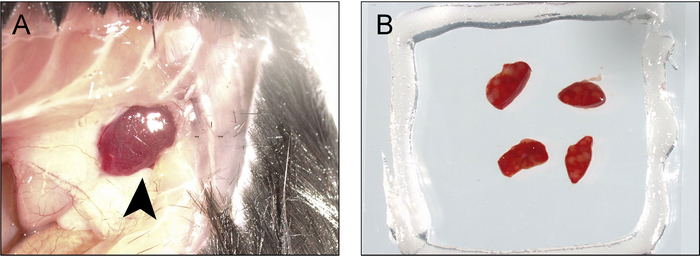
그림 3: 수확 및 이미징 및 photoactivation에 대 한 비장 장착 절차. ) 절 개 바로 흉 곽 아래 앞쪽 중간 라인에서 후부 axillary 라인, 몸 주위에 확장 하 고 비장 (화살촉)의 끝을 노출 하는 가장자리 제거 됩니다. B) 비장은 철회 excised, 그리고 BM 버퍼 가득 양면 coverslip/진공-그리스 상공에 탑재 되는 얇은 (1-2 m m) 조각으로 잘라. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
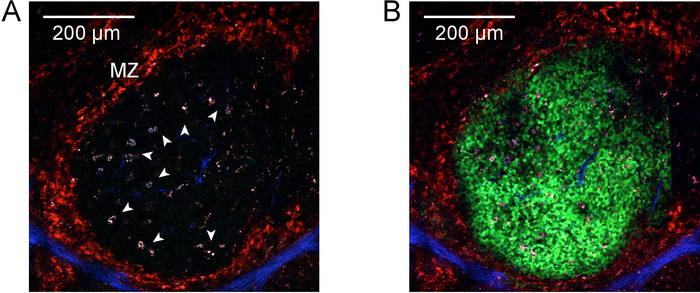
그림 4: Photoactivation. A) 2-광자 photoactivation 전에 비장에 어린 싹 센터의 현미경 사진. 한계 영역을 비장의 수확을 하기 전에 수행 했다 vivo에서 안티-CD169-PE와 라벨 (빨강, "MZ"으로 표시). 두 번째 고조파 신호 명백한에 콜라겐-포함 된 구조는 외피 및 주요 혈관 (청색)와 관련 된. 화살촉 높은 autofluorescent, 활성화 된 tingible 몸 대 식 세포는 어린 싹 센터 활동과 관련 된 식별 합니다. 이미징 940 nm 여기에서 수행 되었다. 왼쪽 위 모퉁이에서 눈금 막대 나타냅니다 200 µ m. B),에 관해서는 하지만 830에서 photoactivation 후 nm. Photoactivated 세포는 지금 표시 (녹색) 정의 된 지역에 제한의 한계 영역으로 포괄 이전 확인 된 tingible 몸 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
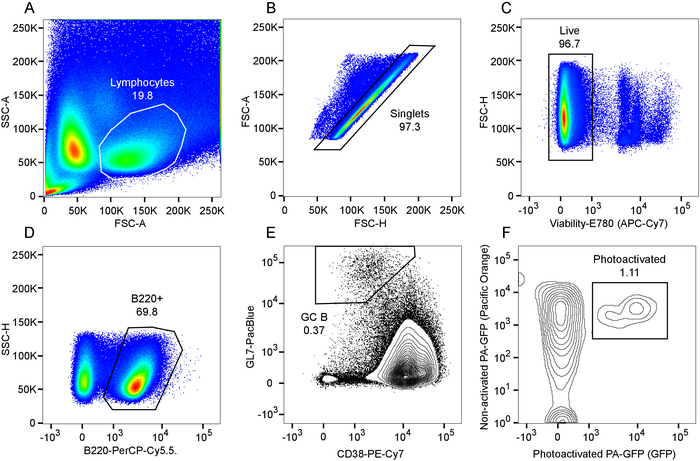
그림 5: Photoactivated 어린 싹 센터 B 세포의 cytometric 분석 흐름. 앞으로 사이드 분산형 및 림프 구 게이트 대의 A) 줄거리. 림프 구 게이트, 결과 내의 게이트 내에서 앞으로 살포 높이의 기능으로 앞으로 피해 지역의 B) 줄거리. C) 생존 제외 플롯 내의 게이트와 결과 라이브 셀 게이트 내에서 염료. D) Gating B220 + B 세포의. E) Gating B220 + 게이트 내의 CD38lo GL7hi 셀으로 식별 어린 싹 센터 B 세포의. F) Gating 셀 공동 비 활성화 표현 및 photoactivated PA-GFP의 하위 집합으로 식별 된 GC B 세포 인구 내의 photoactivated 세포의. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
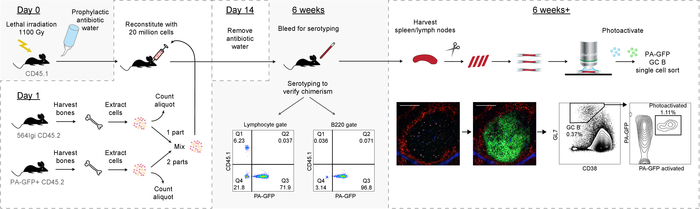
그림 6: 프로토콜의 그래픽 개요. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
면역의 murine 모델의 큰 수를 사용할 수 있습니다, 그리고 많은 자발적인 어린 싹 센터16와 함께 제시. 그러나, 사용 가능한 모델의 많은 복잡 한 유전 배경 또는 돌연변이 중앙 레 귤 레이 터에서 림프 구 증식 또는 활성화, 저조한 intercrossing 기자 라인과 정상적인 림프 구 동작의 연구에 적합 한 그들을 렌더링의 항구 면역에 각각. 현재 모델, 그와 반대로, autoreactive 야생 유형 파생 어린 싹 센터 B 세포로 표현 하는 현재의 경우에서 transgenes, 노크-아웃 및 기자, 원하는 조합을 사용 하 여 심층 분석 하는 ' 플러그 앤 플레이 ' 접근 허용 photoactivatable GFP입니다. Vivo에서 레이블 전략을 사용 하 여, 단일 어린 싹 센터 explanted 림프 조직에 그들의 세포 성분 photoactivated 2 광자 현미경을 사용 하 여 구상 될 수 있습니다. 다음 단일 본 원 센터에서 Photoactivated 세포는 단일 셀 또는 대량에서 분석 또는 정렬 흐름 cytometrically를 될 수 있습니다. 이 세포 면역의 분야에서 새로운된 통찰력을 제공 하기 위해 추가 다운스트림 분자 및 기능 분석 이후에 받게 수 있습니다.
이 절차의 성공적인 성능에 대 한 몇 가지 중요 한 단계가 있습니다. 대표 결과, 방사선에 의해 같이 (1100 Rad) 기증자 골 재구성 성공적으로 B 세포 구획에 가까운 완전 한 chimerism를 양보 받는 사람 골 구획 대체. 이것은 중요 한 포인트, 잔여 받는 파생 B 세포는 어린 싹 센터의 하위 집합 '어두운' 렌더링. 조사에 사용 되는 소스에 방사선의 복용량/타이밍 동물에 최소한의 부수적인 조직의 손상 최대한 myeloablative 효과를 최적화할 수 있다. 재구성에 대 한 뼈 호감 프로토콜 및 20 백만 총 기증자 세포와 재구성 튼튼하게 수익률 높은 재구성도 발견 되었습니다. 살 균 및 냉/얼음 골 추출에 대 한 작업 골 수 기증자의 높은 생존 능력을 보장 합니다. 도달 하기 위해 원하는 기증자 골 비율, 계산 자체 계산 및 계산에 대 한 골 수의 subsample 밖으로 데리고 때 셀의 aliquots 주의 운동에 필수적 이다. 혼합 및 공동 기증자 marrows 대신 centrifuging와 별도로 resuspending 하 고 다음 혼합 산 기증자 비율 계산 셀 다음에 어떤 스큐를 방지 하기 위해 제공 합니다.
프로토콜의 혼합된 골 키메라 생성, 혼자 설 수 있습니다 하 고 원하는 기자, transgene 또는 노크 아웃 autoreactive 어린 싹 센터와 키메라의 세대 수 있습니다. 그러나,이 1 개의 제한은 histocompatible 기증자를 사용 하는 필요입니다. 564Igi 긴장 C57Bl/6J congenic 배경에 그리고 결과적으로, 다른 donor(s)와 한다 H-2b congenic 배경 (또는 양자 택일로, 564Igi 긴장 원하는 긴장과 면역 표현 형을 backcrossed 해야 새로운 배경에서 확인). 조사 절차 tolerogenic 환경17, 선호 하는 경향이 있다 그리고 몇 가지 작은 조직 적합성 항 원 불일치를 용납 수 있습니다. 그러나,이 부분 고려 되어야 한다 철저 하 게, 남성과 여성의 기증자 또는 받는 사람, 남성 제한 Y 항으로 여성 반응성에 대 한 잠재력을 혼합 하는 경우에 특히.
마찬가지로, 프로토콜의 photoactivation 측면, 혼자 서 있을 수 있다 그리고 많은 다른 문맥에서 사용 될 수 있습니다. 그러나, PA GFP 기자는 현재만 아니라 stromal 세포 하지만 모든 조 혈 계보 세포에서 활성화 되어 UBC promotor. 소개에서 설명 했 듯이, 다른 photoactivatable, photoswitchable, 또는 photoconvertible 기자 변종 사용할 수 있으며 실험 조건의 적절 한 조정으로 PA-GFP에 대 한 대체 될 수 있습니다.
900 이상 레이저를 유지 하 여 바람직하지 않은 분야의 실수로 photoactivation를 방지 하는 것이 중요 하다 때 이미징,이 파장은 하지 photoactivate PA-GFP로 nm. Photoactivation 자체, 레이저 파워 및 픽셀 망설임 시간 등의 특정 설정을 사용 하 고, 특정 조직의 조직과 이미징 시스템에 깊이에 따라 달라 집니다 및 각 응용 프로그램은 특정 이미징 시스템 사용에 대 한 최적화. 주의 해야 하지 photodamage에 셀, 하지만 필수적인 다운스트림 분석에 대 한 활성화 된 셀의 충분 한 대표를 얻기 위하여는 스택을 통해 효율적인 photoactivation을 동시에. 어린 싹 센터 B 세포 일반적으로 구성 어디서 나 0.5%에서 ~ 2%, 비장 또는 피부 림프 노드 B 세포의 그리고 대표 결과 (그림 5)에서 볼 수 있듯이 photoactivated 단일 어린 싹 센터 B 세포 총의 ~ 1%를 할 수 있습니다. 인구는 단일 비장 조각에. 따라서, 성공적인 분석 또는 셀의 상당수의 정렬 많은 수의 이벤트를 처리 해야 합니다.
공개
저자는 공개 없다.
감사의 말
SE Degn Lundbeckfonden 동료 이며 칼 재단 고유 동료. 이 작품 또한 일부 NNF 생명 부여 (SE Degn)에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Antibody, 9D11-A568 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Biotium 92255 | |
| Antibody, 9D11-A647 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Nordic Biosite ABD-1031 | |
| Antibody, FITC anti-mouse CD45.1 | Biolegend | 110705 | |
| Antibody, Pacific Blue anti-mouse/human GL7 Antigen (T and B cell Activation Marker) | Biolegend | 144613 | |
| Antibody, PE anti-mouse CD169 (Siglec-1) | Biolegend | 142403 | |
| Antibody, PE/Cy7 anti-mouse CD38 | Biolegend | 102717 | |
| Antibody, PerCP/Cy5.5 anti-mouse/human CD45R/B220 | Biolegend | 103235 | |
| Capillary tube, Mylar-wrapped, heparinized | Fisher Scientific | 211766 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Conical tubes, 50 mL | Falcon | 352235 | |
| Cover slip, square, 22x22 mm, 0.13-0.17 mm | Thermo Fisher Scientific | 22X22-1 | |
| EDTA | Merck | 1,084,180,250 | |
| Ethanol, 70% | VWR | 8301.360 | |
| Fetal bovine serum | Life Technologies | 10270106 | |
| Flow cytometer, FACS Canto II | BD Biosciences | 338962 | |
| Flow cytometer, LSRFortessa SORP | BD Biosciences | - | Special order product with 4 lasers (405 nm, 488 nm, 561 nm and 640 nm) |
| Grease, high vacuum, Dow Corning | VWR | DOWC1597418 | |
| Hemocytometer, Burker-Türk | VWR | 630-1544 | |
| Isoflurane, IsoFlo vet. | Orion Pharma | 9658 | |
| Lymphocyte separation medium (Lympholyte-M Cell Separation Media) | Cedarlane | CL5035 | |
| Microcentrifuge tube, 1.5 mL (Eppendorf) | Sarstedt | 72.690.550 | |
| Microscope, Two-photon | Prairie Technologies (now Bruker) | - | Special order Ultima In Vivo Two Photon Microscope |
| Mortar w. lip, unglazed, 75 ml | VWR | 410-0110 | |
| NaHCO3 | Merck | 1063290500 | |
| Needle, 18 gauge | BD Medical | 304622 | |
| NH4Cl | VWR | 87,769,290 | |
| PBS | Sigma | d8537 | |
| Pestle homogenizer | VWR | 47747-358 | |
| Pestle, unglazed, 175 mm | VWR | 410-0122 | |
| Pipette, Serological, 10 ml | VWR | 612-3700 | |
| Pipette, transfer, plastic | Sarstedt | 861,172,001 | |
| Plastic paraffin film (Parafilm M) | Bemis | PM996 | |
| Plate, 96-well | Falcon | 353910 | |
| Surgical forceps, Student Dumont #5 Forceps | FST - Fine Science Tools | 91150-20 | |
| Surgical forceps, Student Dumont #7 Forceps | FST - Fine Science Tools | 91197-00 | |
| Surgical scissors, Student Fine Scissors, Straight | FST - Fine Science Tools | 91460-11 | |
| Syringe, 10 mL | Terumo | SS-10ES1 | |
| Syringe, 20 mL | Terumo | SS-20ES1 | |
| Syringe, 5 mL | Terumo | SS-05S1 | |
| Syringe, Insulin, 0.3 cc | BD Medical | 324827 | |
| Tribrissen vet. 24% inj., containing 200 mg sulfadiazin and 40 mg trimethoprim/ml | MSD Animal health | 431577 | |
| Trypan blue solution, 0.4% | VWR | K940-100ML | |
| Viability dye, eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific | 65-0865-14 |
참고문헌
- Lerner, A., Jeremias, P., Matthias, T. The World Incidence and Prevalence of Autoimmune Diseases is Increasing. International Journal of Celiac Disease. 3 (4), 151-155 (2015).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Mutoh, T., Miyata, T., Kashiwagi, S., Miyawaki, A., Ogawa, M. Dynamic behavior of individual cells in developing organotypic brain slices revealed by the photoconvertable protein Kaede. Experimental neurology. 200 (2), 430-437 (2006).
- Tomura, M., et al. Monitoring cellular movement in vivo with photoconvertible fluorescence protein “Kaede” transgenic mice. Proceedings of the National Academy of Sciences. 105 (31), 10871-10876 (2008).
- Tomura, M., et al. Tracking and quantification of dendritic cell migration and antigen trafficking between the skin and lymph nodes. Scientific Reports. 4, 6030 (2014).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature biotechnology. 24 (4), 461-465 (2006).
- Pereira, E. R., et al. Lymph node metastases can invade local blood vessels, exit the node, and colonize distant organs in mice. Science (New York, NY). 359 (6382), 1403-1407 (2018).
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science (New York, NY). 297 (5588), 1873-1877 (2002).
- Victora, G. D., et al. Germinal center dynamics revealed by multiphoton microscopy with a photoactivatable fluorescent reporter. Cell. 143 (4), 592-605 (2010).
- Habuchi, S., et al. Reversible single-molecule photoswitching in the GFP-like fluorescent protein Dronpa. Proceedings of the National Academy of Sciences of the United States of America. 102 (27), 9511-9516 (2005).
- Zhou, X. X., Chung, H. K., Lam, A. J., Lin, M. Z. Optical control of protein activity by fluorescent protein domains. Science (New York, NY). 338 (6108), 810-814 (2012).
- Degn, S. E., et al. Clonal Evolution of Autoreactive Germinal Centers. Cell. 170 (5), 913-926 (2017).
- Berland, R., et al. Toll-like receptor 7-dependent loss of B cell tolerance in pathogenic autoantibody knockin mice. Immunity. 25 (3), 429-440 (2006).
- Chatterjee, P., et al. Complement C4 maintains peripheral B-cell tolerance in a myeloid cell dependent manner. European journal of immunology. 43 (9), 2441-2450 (2013).
- Toubai, T., et al. Induction of acute GVHD by sex-mismatched H-Y antigens in the absence of functional radiosensitive host hematopoietic-derived antigen-presenting cells. Blood. 119 (16), 3844-3853 (2012).
- Luzina, I. G., et al. Spontaneous formation of germinal centers in autoimmune mice. Journal of leukocyte biology. 70 (4), 578-584 (2001).
- Sachs, D. H., Kawai, T., Sykes, M. Induction of tolerance through mixed chimerism. Cold Spring Harbor perspectives in medicine. 4 (1), a015529 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유