Method Article
녹고, 경작, 그리고 초파리 셀 라인 Cryopreserving
요약
Drosophila 셀 라인은 기본 및 생물 의학 연구를 위한 중요 한 시 약. 이 문서는 녹고, subculturing, 및 그들의 연구에서이 약의 사용을 통합 연구원을 지원 하기 위해 일반적으로 사용 되 초파리 셀 라인의 cryopreservation 프로토콜을 제공 합니다.
초록
160 가지 초파리 셀 라인 초파리 게놈 자원 센터 (DGRC)에 의해 배포 현재 있다. 게놈 엔지니어링, 새로운 세포의 수 증가 예정 이다. DGRC 연구원은 실험 도구로 초파리 셀 라인을 사용 하 여 보완 하 고 그들의 연구 의제를 드라이브에 익숙해지도록 하는 것을 목표로. 독특한 특성을 가진 초파리 세포 라인의 다양 한 작업에 대 한 절차, 녹고, 경작, 및 cryopreserving 세포에 대 한 프로토콜을 포함 하 여 제공 됩니다. 중요 한 것은,이 게시 초파리 셀 라인 오염 우발적인 미생물 또는 다른 셀 라인에서의 위험을 최소화 하기 위해 함께 작동 하는 데 필요한 모범 사례를 보여 줍니다. 이러한 절차에 익숙해 연구팀 초파리 배양 세포 생화학, 세포 생물학 및 기능 유전체학을 포함 하 여 사용 하는 많은 응용 프로그램으로 탐구 수. 있습니다
서문
초파리 를 사용 하 여 보완 vivo에서 유전자 분석을 비행 하 고 많은 기본적인 생물 학적 질문1,2,3을 해결 하기 위한 기본 조회 도구 역할 세포 배양. Drosophila 셀 라인 독특한 유전적 배경 가진 다른 조직 소스에서 파생 된 셀의 독특한 homogenous 인구를 제공 합니다. 셀 라인은 유전자 변형 유전자 발현 유전체학, transcriptomics, proteomics, metabolomics, 높은 처리량 RNA 간섭 (RNAi) 스크린, 세포 생물학, 현미경 등 많은 응용 프로그램에 적합 합니다. 중요 한 것은, 초파리 세포 배양의 사용 알려진된 자극에 즉시 임시 응답의 특성화를 촉진 한다. 또한, 초파리 세포 배양은 CRISPR Cas9 게놈 편집, 비교적 손쉽게 특정 게놈 수정4,,56, 새로운 셀 라인을 만들 의무가 7.
초파리 게놈 자원 센터 (DGRC) 초파리 세포 라인에 대 한 저장소 및 유통 센터 역할을 합니다. DGRC의 목표 중 하나는 구성원 들을 돕는 연구 커뮤니티의 초파리 세포 culture 리소스를 사용 하 여입니다. 이 문서는 초파리 셀 라인의 처리에 대 한 기본 프로토콜을 표시합니다. 연구팀은 초파리 세포 배양을 처리와 함께 편안 하 게 하 고 그들의 실험1,2,8,9에서에서 독립의 수준을 달성할 수 있도록 기존 자원을 보완합니다 ,10.
가장 일반적으로 사용 되 초파리 셀 라인: 슈나이더11, Kc16712, 미쓰비시/미 야 케 imaginal 디스크 고 중앙 신경 시스템 (CNS) 라인13,14, Milner 실험실 imaginal 디스크 라인 15, 성인 난소 세포 라인16,17, 그리고 Ras 라인18 (표 1). 슈나이더와 Kc167 라인은 생화학, 재조합 유전자 변형 유전자 발현, 그리고 역방향 유전 스크린에 사용 하기 위해 일반적인 다목적 셀 라인. 미쓰비시/미 야 케 실험실 (ML) 라인 애벌레 imaginal 디스크 또는 중앙 신경 시스템 (CNS)에서 파생 했다 그리고 그들은 neurosecretion, 전사, 규정과 RNA 처리에 관련 된 연구에 유용. Milner (CME) 디스크 라인 신호 변환 공부에 대 한 중요 한 되었습니다. FGS/OSS 셀 라인 돌연변이 성인 난소에서 파생 된 비 코딩 작은 RNA 생물학 생식 세포 유지와 분화17,19의 영향을 연구 하는 중요 한 시 약에 남아 있다. 마지막으로, Ras 라인 배아 Ras oncogene를 표현 하는 ectopically에서 파생 된 셀 라인 이기 때문에 유일 하다. 그들은 근육 선구자 세포의 transcriptional 서명 있고 활성 piRNA 기계20을 표현 한다. 최근 리뷰 기사 및도 서 챕터 자세한 내용은2,,39이 인기 있는 셀 라인의 애플 리 케이 션을 커버.
이러한 모든 셀 라인 subcultured 고 고정 될 수 있습니다. 각 셀 라인을 유지 하 고 cryopreservation 준비 하는 방법에 대 한 중요 하지만 약간 다른 요구 사항이 있습니다. 예를 들어 고유한 셀 라인 필요 다른 미디어와 보충 (표 1). 라인도 다 표면 부착 속성, 형태학 (그림 1 및 그림 2), 유전자 형 및 배 시간 (표 2). 우리는 기본 프로토콜을 제시 하 고 다양 한 널리 초파리 세포 라인을 처리 하기 위한 독특한 차이점을 강조.
프로토콜
1. 해빙 및 냉동된 초파리 셀 라인 살리기
- 70% 에탄올과 작업 면을 닦아 하 여 후드를 소독. 25 cm2 T-플라스 크 (T-25)에 적절 한 매체 (표 1)의 5 mL을 분배.
- 액체 N2 또는 드라이 아이스에서 cryovial/용액을 제거 합니다. 70% 에탄올과 cryovial을 닦아, 신중 하 게를 풀고는 용액의 봉인을 해제 합니다.
- T-25 플라스 크에서 실 온 (RT) 미디어의 1 mL를 철회할 파스퇴르 피 펫을 사용 하 여. 천천히는 cryovial에 미디어를 추가 하 고 부드럽게 녹여 냉동된 세포, 세포 현 탁 액 오버플로 하지 않는지 확인을 혼합.
- T-25 플라스 크에는 용액에서 해 동된 세포 현 탁 액의 전체 볼륨을 전송. 세포 현 탁 액 완전히 전송 되도록 반복 합니다.
- 25 ° C 배양 기에서 플라스 크, 대부분의 세포는 성장 표면에 정착 되도록 현미경으로 세포를 검사 정착 하 고 최소한 2 h. 준수 세포 허용. 부드럽게 오래 된 미디어를 제거 하 고 신선한 미디어의 5 mL을 바꿉니다. 인큐베이터에 플라스 크를 반환 합니다.
- 다음 날, 부드럽게 오래 된 미디어를 제거 하 고 신선한 미디어의 5 mL을 바꿉니다. 인큐베이터에는 문화를 반환 합니다.
2. 해빙 하 고 되살리는 냉동된 초파리 셀 라인 (대안)
- 살 균 후드, 실시간 미디어의 1 mL와 함께 냉동된 펠 릿 resuspending에 의해 세포를 녹여. 모든 해 동된 세포 현 탁 액 15 mL 원뿔 튜브로 전송 합니다.
- 작은 셀 공의 5 분 삭제에 대 한 1000 x g 에서 원심 분리 하 여는 상쾌한 고 신선한 미디어의 5 mL에 셀 펠 릿 resuspend.
- T-25 플라스 크에 세포 현 탁 액의 전체 볼륨을 전송 및 25 ° c.에 문화를 품 어
- 1 ~ 2 시간 후, 대부분의 세포는 성장 표면에 정착 되도록 현미경 세포 검사 합니다. 다음 날, 신선한 미디어의 5 mL와 함께 기존 미디어를 대체 하 고 인큐베이터에 문화를 반환 합니다.
3. 100 m m 배양 배지에서 자란 반 부착 셀 subculturing
- 70% 에탄올으로 닦아 하 여 후드를 소독. 후드, 등 미디어 병, 펫, 피 펫 에이드, 문화 판에 subculturing에 대 한 불 임 자료를 가져와.
- 형태학과 현미경 문화의 합류를 검사 합니다. Microorganismal 오염 문화에의 명확한 표시를 찾습니다. 문화권의 특성에 따라 셀 passaged 될 준비가 되어 있는지 여부 확인: 세포 밀도 및 마지막으로 그들은 subcultured 했다를 포함 하 여 시간을 두 배로.
- 높은 문화 나타나면 합칠 (그림 1), 결정 셀 밀도. 살 균 후드에 pipetting 접시에서 매체의 최대 10 mL와 셀에 분배 하 여 성장 표면에서 세포를 분리 하십시오. 몇 번 반복 성장 표면 취소 될 때까지 거품을 만들 수 없습니다 보장 합니다. 셀 밀도 hemocytometer 또는 자동 입자 카운터 (섹션 5, 그림 3)를 사용 하 여 결정 합니다. Subculture 셀 경우 셀 밀도 5 x 106 ~ 1 x 107 셀/mL.
참고: 1 x 106 셀/mL 아래 셀 밀도 하지 subculture 초파리 세포 라인을 할. -
1 x 10 이상6 셀/mL의 최종 시드 농도에 적절 한 매체를 사용 하 여 그에 따라 세포 현 탁 액을 희석.
- 일상적인 뿌리고 및 유지 보수에 대 한 원하는 시드 셀 밀도 달성 하기 위해 새로운 문화 접시에 있는 매체의 미리 결정 된 볼륨 세포 현 탁 액의 적절 한 볼륨을 추가 합니다.
- 문화를 확장, 큰 술병으로 모든 세포 현 탁 액을 전송 합니다. 원하는 셀 밀도 매체의 적절 한 볼륨 세포 현 탁 액을 희석. 새로운 번호판을 희석된 셀 서 스 펜 션의 동일한 볼륨을 배포 합니다. 이 방법은 판 사이의 셀 밀도 변화를 최소화합니다.
- 커버 및 연산자 이니셜, 날짜, 분할 비율, 시드 셀 밀도, 셀 라인 식별자, 미디어, 통로 번호와 항생제 같은 미디어 추가 접시 레이블.
- 플라스틱 용기에 접시를 놓고 인큐베이터에 상자를 반환 합니다.
참고: 표 3 경작 초파리 세포 선 및 관련된 작업 볼륨에 대 한 일반적으로 사용 되는 문화 혈관을 나열.
4. dislodging 부착 세포 100 mm 배양 배지에서 성장
- 새로운 메 마른 플라스 크를 접시에서 모든 매체를 전송. 매체를 저장 합니다.
- 접시에 0.05% 트립 신-EDTA의 1 mL를 천천히 추가 하 여 셀을 씻어. 트립 신 솔루션 전체 성장 표면을 커버 되도록 부드럽게 소용돌이 친다. 트립 신 솔루션을 삭제 합니다.
- 부드럽게 접시에 0.05% 트립 신-EDTA의 1 mL를 추가 합니다. 3−10 분 동안 셀 레이어 분리의 보이는 표시에 대 한 모니터링 및 슬라이딩 떨어져 성장 표면 사이 25 ° C에서 접시를 품 어.
- 트립 신 활동 중지를 접시에 저장 된 매체의 9 mL를 추가 합니다. 믹스 셀 덩어리 해리에 세포 현 탁 액. 모든 셀 빠질 되었습니다 일단 성장 표면 분명 있을 것입니다.
참고: 트립 신 같은 소화 효소를 사용 하 여 강력 하 게 부착 셀 라인을 뿌리고에 에이즈. 트립 신 종종 돼지 췌 장에서 파생 하는 프로 테아의 혼합물 이며, 순수성의 다른 급료에서 상업적으로 사용할 수 있습니다.
5. 수동 셀 슬라이드 세 Neubauer 셀을 사용 하 여 계산
- 70% 알코올로 표면을 닦아 의해 hemocytometer 슬라이드와 coverslip를 준비 합니다.
- 세포 현 탁 액을 혼합 하 고 (그림 3A)는 hemocytometer의 첫 번째 챔버를 채우기 위해 hemocytometer의 홈된 가장자리에 세포 현 탁 액의 15 µ L을 분배. hemocytometer의 두 번째 챔버를 입력 합니다. 세포 현 탁 액 모 세관 작용에 의해 세 챔버로 도출 될 것입니다.
- 현미경 목표 x 10을 사용 하 여 계산 그리드 병렬 라인 (그림 3C,D)으로 중간에 1 m2 영역 내의 셀. 중복 계산을 방지 하려면 위쪽 및 왼쪽된 경계, 오버레이 셀 하지만 200 µ m2 사각형의 오른쪽 및 아래쪽 경계를 교차 하는 셀 하지 계산. 100−200 셀 사이의 셀. 두 번째 챔버와 횟수를 반복 합니다.
- 두 수의 평균을 계산 하 고 다음 수식에 따라 셀 밀도 결정: 세포 밀도 (셀/mL) 평균 세포 수 (n1 + n2/2) x 10 =4.
참고: 세포 생존 능력 총 셀에 실행 가능한 세포의 백분율로 표현 됩니다. 세포 생존 능력 결정, 혼합 세포 현 탁 액 trypan 파랑의 동등한 양으로 (0.4%) 수동 또는 자동 셀 카운팅 이전 솔루션입니다. 라이브 셀 동안 죽은 세포 파란색 물 들일 것 이다 염료을 차지 하지 것입니다.
6. cryopreservation 초파리 셀 라인의
- 건강 한 형태학, 성장, 오염 물질의 부족에 대 한 문화를 확인 하십시오. 수확에서 문화는 중반 후반 로그 성장 단계 (단계 3.3, 또는 제 4). 많은 초파리 셀 라인, 그것은 약 4 × 10 8 × 106 셀/mL6 셀/mL 사이.
- 15 mL 또는 50 mL 원뿔 튜브로 전체 세포 현 탁 액을 전송 합니다. 5 분 동안 1000 x g 에서 원심 분리 하 여 세포를 수집 하 고는 상쾌한 삭제.
- 냉동 매체 (표 4)를 적어도 4 x 107 셀/mL의 최종 셀 밀도의 볼륨에서 셀 펠 릿을 resuspend.
- Dropwise cryoprotectant 디 메 틸 sulfoxide (DMSO)의 적절 한 금액에 추가 셀 서 스 펜 션 최종 DMSO 농도 10%. 부드럽게 혼합 세포 현 탁 액.
- 신중 하 게 미리 분류 cryovials (2 ~ 107 셀/유리병 x)의 aliquots에 세포 현 탁 액의 0.5 mL을 분배. 소 프로 파 놀 (그림 4A)로 가득 냉동 컨테이너에는 ampules를 놓습니다. 천천히 드롭 cryovials의 온도 수 있도록 밤새-80 ° C 냉장고에 냉동 컨테이너를 전송 (-1 ° C/min) 냉장고 온도.
- 냉동된 cryovials를 꺼내와 빠르게 지팡이 (그림 4B) 그들을 연결할. 용기 (그림 4C)에 cryovials를 포함 하는 지팡이 삽입 합니다. 또한, 장소는 미리 냉각된 냉동 상자 (그림 4D) 안에 cryovials 냉동 하는. 상점 N2 냉동 고 (그림 4E,F)의 액체 단계에서 cryovials을 냉동.
참고: 냉동 미디어 포함 된 DMSO를 사용 하 여, RT에서 최대 30 분의 지연이 셀에 해로운 되지 않습니다.
결과
그것은 중요 한 냉동된 초파리 세포를 빠르게 해 동 하 고 다시 성장 단계에는 문화를 제공 하는 셀 밀도에 문화. Cryopreservation 및 해빙에 대 한 절차를 준수 하는 경우 T-25 플라스 크에 세포 밀도 적어도 4 x 106 셀/mL을 동일 하 게 됩니다. 1 ~ 2 시간 후에 녹고, 대부분 초파리 셀 라인 성장 표면에 연결할 시작 됩니다. 없는 세포의 대부분 하지 첨부 성장 표면에 녹고 후 2 시간 이내 상황에서 미디어를 변경 하기 전에 하룻밤 셀을 품 어 하는 것이 좋습니다.
Subculturing의 목표는 건강 한 지 수 로그 성장 곡선의 단계에서 셀을 유지 하는 것입니다. Subculturing에 대 한 기준 microorganismal 오염, 세포 밀도, 그리고 정기적인 유지 관리 일정을 설정 하는 필요의 보이는 부족에 따라 달라 집니다. 그것은 먼저 셀의 상태를 평가 하 고 동결 전에 우발적인 오염 물질의 부재를 확인 해야 합니다. 대부분의 세균과 곰 팡이 오염 물질은 시력 검사 하면 검출 하기 쉽다. 오염 된 문화 미디어 탁도의 증가 의해 식별할 수 있습니다. 현미경, 오염 세균 봉, 효 모 세포 또는 문자열 같은 곰 팡이 균 신진 cocci 나타날 수 있습니다. 오염 비 cytopathic mycoplasma 등의 다른 소스는 시각적으로 검출 될 수 없다 하 고 PCR 기반 분석21에 의해 정기적으로 시험 될 수 있다.
셀 라인의 합류를 시각적으로 확인할 수 있습니다 (그림 1). 빠르게 성장 하 고 있는 셀 라인 일찍 합류를 도달 하 고 정기적으로 passaged 하는 데 필요한. 같은 라인은 일주일에 두 번까지 subcultured. 반면, 느린 성장 세포는 2 주에 한 번 이상 passaged 이상. 그러나, 세포는 매주 신선한 미디어 먹이 필요가 있다. 이것은 미디어 피로 방지 하 고 세포에서 대사 폐기물을 희석입니다. 셀 라인 소스 그들의 형태학 (그림 2), 준수 속성, 미디어 요구 사항 (표 1)에 다 조직 변화 및 배로 시간 (표 2)에서 파생 된. 표 5, 표 6 표 7, 표 8 은 다양 한 초파리 세포 배양에 대 한 조리법을 나열합니다.
셀 계산 정확한 시드 밀도 subculturing에 대 한 예측 가능한 루틴을 보장합니다. 정량적 실험에 대 한 셀 계산 필수적 이다입니다. 셀 중 하나 사용 하 여 (그림 3A) hemocytometer 또는 (그림 3B)는 자동된 입자 카운터 계산 됩니다. 자동된 카운터를 사용 하는 경우 제조업체의 지침을 따르십시오. 경제적이 고 쉽게 이다는 hemocytometer를 사용 하 여 셀을 수동으로 계산. 중간 Neubauer 격자에 포함 하는 셀의 수를 계산 하 고 셀 밀도 계산 됩니다; 예를 들어, n = 214 셀,6 셀/10ml (그림 3D) x 2.14의 셀 밀도 결과로.
세포 현 탁 액 두 100 mm 접시, 4 x 106 셀/mL에 세포 현 탁 액의 각 포함 10 mL에서에서 수집 되며 4 x 107 셀/mL의 조밀도 달성 하기 위해 미디어를 동결의 2 mL에 resuspended. 세포 현 탁 액의 0.5 mL와 함께 각 냉동된 cryovial 2 x 107 셀을 포함합니다. 이 문화 4 x 106 셀/mL 프로토콜 섹션 1에 따라 해 동 될 때 발생 합니다.
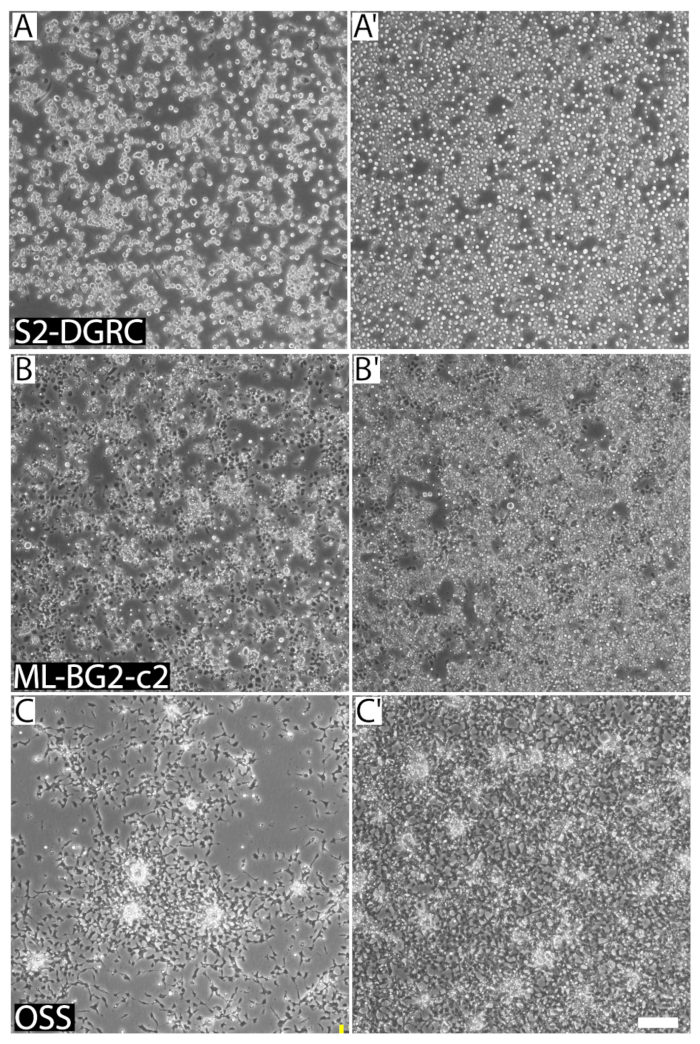
그림 1 : 세 가지 별개의 대표 이미지 초파리 다른 합류와 세포 밀도에 라인 셀. (A) S2 DGRC 1 x 106 셀/mL에서 문화. (A') 6 셀/10ml x 4.5에서 S2 DGRC 문화. (B) ML-BG2-c 2는 2 x 106 셀/mL에서 문화. (B') 8 x 106 셀/mL 셀 말뚝 및 포커스로 집계에서 c 2 ML-BG2 문화. 1 x 106 셀/mL에서 (C) OSS 문화. (C') 4 x 106 셀/mL에서 OSS 문화. 셀 서 스 펜 션에는 동일한 초점 비행기에 캡처되지 않습니다. 눈금 막대 = 100 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
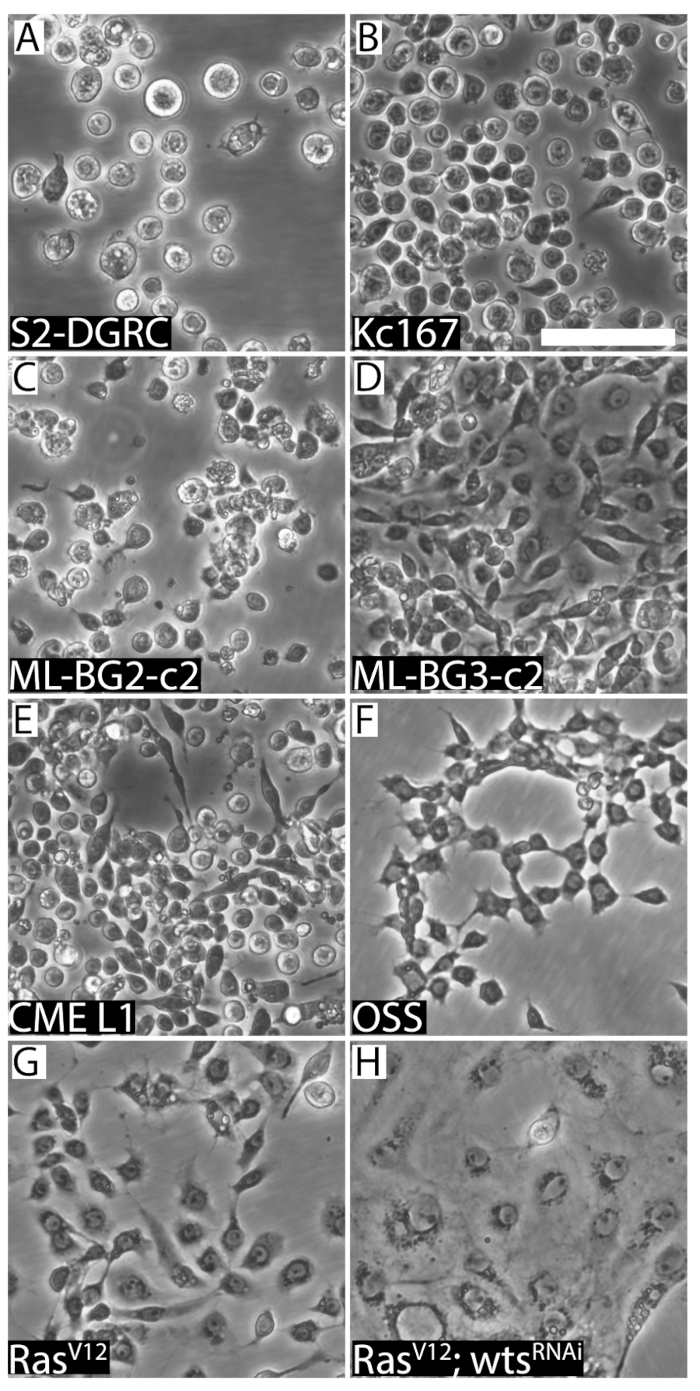
그림 2 : 8 가지 초파리 세포 라인의 대표 이미지. (A) 라운드 배아에서 파생 된 S2-DGRC. (B) 라운드 배아 파생 Kc167. (C) 애벌레 CNS 파생 ML-BG2-c 2 라운드. (D) 라운드 애벌레 스핀 들-모양 ML-BG3-c2. (E) CME L1, 애벌레 다리 imaginal 디스크에서 파생 된 셀 라인 작은 이며 라운드/방 추상 형태를 하고있다. (F) OS, 셀 라인 성인 난소에서 파생 된 스핀 들 모양의 형태를 표시 합니다. (G) 스핀 들 모양의 RasV12 셀 라인 표현 Ras 활성화. (H) RasV12; wtsRNAi (WRR1), 활성화 된 Ras와 이중 가닥 RNA 종양 억제기 사마귀 (wts)를 대상으로 셀 선 상피 특성을 표시 합니다. 눈금 막대 = 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
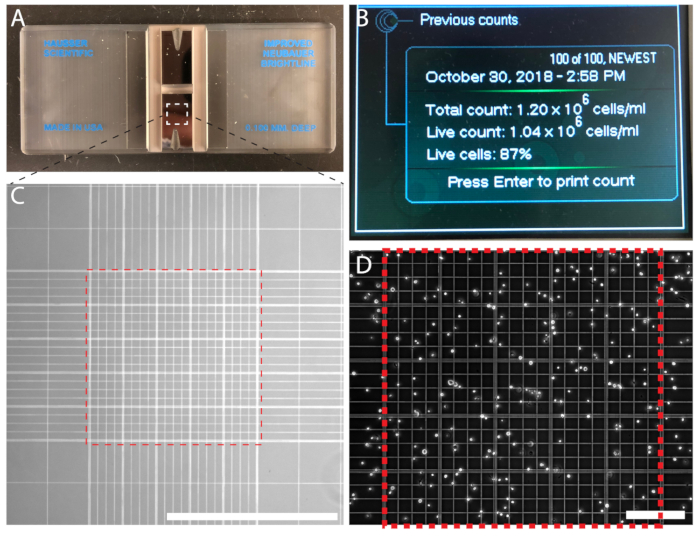
그림 3 : 셀 밀도 hemocytometer를 사용 하 여 수동으로 또는 자동화 된 입자 카운터를 사용 하 여 자동으로 계산 하실 수 있습니다. (A) A hemocytometer 두 챔버와 함께. (B)는 세포 수의 출력을 표시 하는 자동화 된 셀 카운터. (C) 10 배 목표 아래 향상된 Neubauer 셀 계산 그리드 볼. 0.1 m m3 중앙 격자 (빨간색 점선 사각형)으로 셀을 계산 합니다. (D)는 hemocytometer에 중앙 그리드 셀 계산으로 가득합니다. 눈금 막대 = 1 mm (C); 0.2 m m (D)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 : Cryopreservation 장비. (A) A 냉동 컨테이너 매장 직 립 위치에 ampules 느린 동결. (B) A 냉동된 ampules 개최 금속 지팡이. 지팡이 들고에 대 한의 (C) 용기 (D) A 플라스틱 냉동 상자 (cryobox). (E) A 용기 액체 N2 저장 탱크에 삽입 하는 여러 개의 지팡이 들고. (F) 액체 N2 저장 탱크. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 세포 변형 | 미디어 | 준수 | 트립 신 |
| 슈나이더 라인 | M3 + BPYE + 10% 태아 종 아리 혈 청 (FCS), pH 6.6 | 반 점착 | 아니요 |
| (S2R +, s 2-DRSC, s 2-DGRC, Sg4) 11 | |||
| 슈나이더의 미디어+ + 10% FCS | |||
| Kc 라인 (Kc167, Kc7E10)21,22 | M3 + BPYE + 5 %FCS, pH 6.6 | 반 점착 | 아니요 |
| Hyclone-CCM3, pH 6.2 | |||
| Imaginal 디스크 및 CNS 라인 (ML-라인)13,14 | M3 + BPYE + 10 %FCS, pH 6.6 | 반 점착 | 아니요 |
| 10 µ g/mL 인슐린 | |||
| Milner imaginal 디스크 라인 (CME-라인)15 | M3 + 2% FCS | 반 점착 | 아니요 |
| 5 µ g/mL 인슐린 | |||
| 2.5% 비행 추출 | |||
| fGS/OSS16 | M3 + 10 %FCS, pH 6.8 | 점착 | * |
| 10 µ g/mL 인슐린 | |||
| 1 mg/mL C5H8알 것4 | |||
| 0.5 mg/mL KHCO3 | |||
| 0.6 mg/mL 티 | |||
| 10% 비행 추출 | |||
| RasV12 라인18 | M3 + BPYE + 10 %FCS, pH 6.6 | 점착 | 예 |
표 1: 다양 한 속성 및 미디어 요구 사항 초파리 라인 셀. S2R +, S2-초파리 RNAi 심사 센터 (DRSC), S2-초파리 게놈 자원 센터 (DGRC), 및 Sg4 반 부착 슈나이더 선의 다른 격리는 증식 튼튼하게 M3 매체에서 경작 하는 때 일반적으로 사용 되는 셀 라인 + Bactopetone 효 모 추출 물 (BPYE) 10% 태아 종 아리 혈 청 (FCS) 보충. 또는, 슈나이더의 미디어 (pH 6.7 6.8)은 자주 M3 + BPYE 대신 사용 됩니다. Kc 라인 확산 M3 + BPYE (5 %FCS) 또는 혈 청 무료 CCM3 미디어. ML imaginal 디스크 및 중앙 신경 조직 (CNS) 라인 확산에 대 한 인슐린 보충을 해야합니다. Milner imaginal 디스크 라인 인슐린 및 비행 보충을 추출 해야 합니다. 부착 fGS/OSS 셀 라인 성장을 위한 인슐린, 비행 추출 glutathione의 높은 농도 요구 한다. M3 + BPYE에 잘 부착 RasV12 라인 성장 (10 %FCS). 트립 신 성장 표면에서 부착 셀 라인을 꺼내 하는 데 사용 됩니다.
| 선 세포 (# 재고) | 유전자 형 | 배로 시간 (h) * | 조직 소스 |
| S2R + (150) | OreR | 39 | 늦은 배아 |
| S2-DGRC (6) | OreR | 23 | 늦은 배아 |
| S2-DRSC (181) | OreR | 46 | 늦은 배아 |
| Kc167 (1) | e/se | 22 | 6−12 h 배아 |
| ML-BG2-c2 (53) | y v f 말 | 48 | 3rd 탈피 애벌레 CNS |
| ML-BG3-c2 (68) | y v f 말 | 104 | 3rd 탈피 애벌레 CNS |
| ML-DmD8 (92) | y v f 말 | 66 | 3rd 탈피 애벌레 윙 디스크 |
| CME W1 Cl.8+ (151) | OreR | 46 | 3rd 탈피 애벌레 윙 디스크 |
| CME L1 (156) | OreR | 47 | 3rd 탈피 애벌레 다리 디스크 |
| OSS (190) | bamD86 | 45 | 성인 bam 돌연변이 난소 |
| RasV12 라인 | UAS-GFP; P(UAS-Ras85D.V12) / P (Act5C-GAL4) 17bFO1 | 41−65 | 배아 |
표 2: 유전자, 배로 시간과의 조직 소스 널리 사용 초파리 라인 셀. 조직 유전자, 소스 및 인구 일반적으로 사용 되 셀 라인의 시간을 두 배로 표시 됩니다. 25 ° c.에 추천 미디어에서 성장에 따라 시간을 두 배로
| 문화 배 | 미디어 (mL)의 볼륨 |
| 12.5 cm2 T-플라스 크 | 2.5 |
| 25 cm2 T-플라스 크 | 5 |
| 75 cm2 T-플라스 크 | 15 |
| 35 m m | 1 |
| 60 m m | 4 |
| 100 m m | 10 |
| 384-잘 접시 * | 0.04/잘 |
| 96 잘 접시 * | 0.1/잘 |
| 48-잘 접시 * | 0.3/잘 |
| 24-잘 접시 * | 0.5/잘 |
| 12-잘 접시 | 1.0/잘 |
| 6 잘 플레이트 | 2.0/잘 |
표 3: 선박 및 권장된 미디어 볼륨 문화. 다양 한 크기의 문화 혈관 초파리 세포 배양에 사용할 수 있습니다. 적절 한 미디어 볼륨 (mL)는 각 선박에 대 한 것이 좋습니다. 다 잘 플레이트 세포 현 탁 액 증발 때문 미디어 손실을 줄이기 위해 파라핀 영화와의 미만 0.5 mL를 포함 인감.
| 볼륨 | |
| M3 + BPYE, pH 6.6 | 70 mL |
| 열 비활성화 FCS | 20 mL |
| 살 균 필터링 된 DMSO * | 10 mL |
표 4: 동결 매체 (M3 + BPYE, FCS 20%, 10 %DMSO) 100 mL를 준비 하기 위한 조리법. 필요에 따라 냉동 미디어를 준비 하 고 DMSO를 포함 하는 연장된 기간에 대 한 동결 미디어를 저장 하지 마십시오.
| M3 + BPYE 매체 | 금액 |
| 방패와 상의 M323 | 1 병 |
| KHCO3 | 0.5 g |
| 선택 효 모 추출 물 | 1.0 g |
| Bactopeptone | 2.5 g |
| 살 균 정화 물 | 1000 mL |
표 5: M 3 + BPYE의 1 리터를 준비 하기 위한 조리법 조직 문화 매체. 6.6에 pH를 조정 합니다. 0.22 μ m 필터를 통해 매체를 전달 하 여 소독.
| FGS/OSS 셀 라인에 대 한 기본 M3 매체 | 금액 |
| 방패 및 M3 이상 | 1 병 |
| KHCO3 | 0.5 g |
| C5H8알 것4 | 1.0 g |
| 살 균 정화 물 | 1000 mL |
표 6: FGS/OSS M3 기본 매체의 1 L에 대 한 제조 법. PH 6.8로 조정 합니다. 0.22 μ m 필터를 통해 매체를 전달 하 여 소독.
| Hyclone-CCM3 | 금액 |
| CCM3 분말 | 28.6 g |
| NaHCO3 | 0.35 g |
| 10 N NaOH | 2.5 mL |
| CaCl2 | 0.5 g |
| 살 균 정화 물 | 1000 mL |
표 7: Hyclone-CCM3 조직 문화 매체의 1 L에 대 한 제조 법. 6.2에 pH를 조정 합니다. 0.22 μ m 필터를 통해 매체를 전달 하 여 소독.
| M3 + BPYE + 10% FCS | 미 야 케 디스크 및 CNS 라인 매체 | Milner 디스크 라인 매체 | fGS/OSS 완전 한 매체 | |
| M3 + BPYE, pH 6.6 | 90 mL | 90 mL | - | - |
| 열 비활성화 FCS * | 10 mL | 10 mL | 2 mL | 10 mL |
| 인슐린 (10mg/mL) | - | 100 Μ L | 50 Μ L | 100 Μ L |
| 플라이 추출 | - | - | 2.5 mL | 10 mL |
| 티 (60 mg/mL) | - | - | 1 mL | |
| M3, pH 6.6 | - | - | 97.5 mL | - |
| fGS/OSS M3, pH 6.8 | - | - | 79 mL |
표 8: 다양 한 일반의 100 mL를 준비 하기 위한 조리법 초파리 셀 문화 미디어. 1 시간 56 ° C에서 FCS를 품 어 고 열 비활성화 보충 단백질에 5 분 마다 흔들.
토론
초파리 세포 배양은 높은 처리량 셀 기반 화면에 대 한 기본 시 약. 그들의 사용 또한 세포 생화학, 급속 한 파리, 세포 생물학, 현미경 검사 법 그리고 더 최근의 체세포 유전자를 주입 하기 전에 유전자 변형 구조 테스트에 적합의 균질 성 인구를 제공 하 여 vivo에서 유전자 연구를 보완 1,2,3,8,,910을 편집 하는 게놈에 의해의 조작
생존 능력 및 냉동된 초파리 세포의 복구는 낮은 온도 에서도 급격 한 변동에 민감합니다. DGRC N2 (-196 ° C)의 액체 단계에서 냉동된 세포를 저장 하 고 드라이 아이스 (-78.5 ° C)에 그들을 전송. 드라이 아이스에 이송 되어 냉동된 ampules 액체 N2 또는 저장을 위해-80 ° C 냉장고에 다시 전송 되지 한다. 대신, 고정 된 셀 해야 해 동, 최대한 빨리 도착 (프로토콜 섹션 1) 높은 세포 조밀도에 다시 시드해야 되며 그들의 의도 된 목적 (프로토콜 섹션 3)에 대 한 교양. 셀 라인은 즉시 실험에 대 한 활용 하지, 하는 경우 셀 라인 이어야 한다 그들은 사용 하기 위해 준비가 될 때까지 (프로토콜 섹션 6) cryopreserved.
ML-BG2-c2 및 Ras 라인 등 일부 셀 라인, cryopreserved 상태에서 부활 되 고의 효과에서 회복 하기 위해 몇 가지 일을 해야 합니다. 세포질 파편 상당한 양의 함께 이러한 셀 라인 녹고 후 처음 몇 일. 그대로 왼쪽, 세포 회복 되며 증식. DGRC에서 많은 초파리 셀 라인 M3 기반 미디어22성장에 적응 되었습니다. 해빙의 효과에서 회복 하기 위해 느린 세포 라인에 대 한 바른된 미디어를 사용 하 여 유용할 수 있습니다. 바른된 미디어 가능성이 복구 녹고 후 세포의 확산을 장려 수 있는 미디어로 세포에서 분 비 하는 성장 인자를 포함 합니다.
세포는 일반적으로 지연 위상, 지 수 단계, 고원 단계 및 악화 단계 구성 된 틀에 박힌 성장 곡선을 따릅니다. 1 x 106 와 25 ° c.에서 1 x 107 셀/mL 농도에서 교양 때 많은 초파리 셀 라인 성장의 로그 단계에서 확산 그들은 항상 지 수 성장 단계는 세포 passaged는 필수적 이다.입니다.
백분율로 표시, 문화의 합류 성장 영역을 셀에 포함 된 설명 합니다. 셀 라인 셀 합류의 셀 모양과 크기에 따라 달라 집니다. 고유 셀 라인 다른 형태학 및 준수 속성 있다. 그 결과, 대략 비슷한 합류에 다른 셀 라인 훨씬 뚜렷한 세포 밀도 (그림 1)를 할 수 있습니다. 문화 합류 초파리 셀 라인 성장 표면이 되었습니다 후에 서로 말뚝 foci 또는 정지에서 하 여 증식을 계속 하기 때문에 초파리 세포 배양을 뿌리고 위한 이상적인 지표를 되지 않을 수 있습니다. (그림 1)을 적용. 그러나, 특정 셀 라인 경험 있는 사용자가 사용할 수 있습니다 자주 합류에 대 한 빠른 시각적 가이드로 subculture에 때.
19−25 ° C 사이 주위 RT에 초파리 라인 성장 수는, 하는 동안 주위 온도 변동 확산 속도 영향을 미칠 수 있기 때문에 권장 하지 않습니다. 25 ° C 전용된 인큐베이터를 사용 하 여 것이 좋습니다. 초파리 의 세포 배양에 대 한 보육 초파리 세포 배양 버퍼링에 CO2 를 사용 하지 않기 때문에 CO2 가스 교환을 촉진 하기 위하여 필요 하지 않습니다. 세포 배양을 위한 인큐베이터 내부 습도 하지 배양 접시에 셀 때 간과 하는 중요 한 요소 이다. 유형에 따라 인큐베이터와 작업 환경에, 인큐베이터 내부 살 균 물의 비 커를 필요할 수 있습니다. 미디어 증발 최소화, 닫힌된 T-플라스 크를 사용 하거나 배양 배지 인큐베이터 안에서 단단히 밀폐 된 플라스틱 컨테이너에 저장 합니다.
그것은 초파리 셀 라인 subculturing에 대 한 일정을 개발 하는 것이 중요입니다. 성장 속도 모니터 일관성 추정, (분할 비율 1:2, 1:4, 1:8)도 기하학적 비율로 subculture에 편리 하다. 예를 들어 8 x 106 셀/mL에서 Kc167 세포의 10 mL confluent 플레이트 1 x 106 셀/mL (1.25 mL 신선한 매체의 8.75 mL로 희석 세포 현 탁 액의)의 시드 밀도 달성 하기 위해 1:8 비율로 분할할 수 있습니다. 72 h, Kc167 문화에 8 x 106 셀/mL의 조밀도에 주어진 24 h의 2 배 시간으로 예상 된다. 분할 비율 따라서 편리한 하위 루틴의 일주일에 두 번, 최대 그 세포 성장의 그들의 지 수 로그 단계에 교양 항상 확보를 용이 하 게 결정 됩니다. 합류 하는 시간이 너무 짧아도 너무 오래 되도록 셀을 subculturing에 대 한 정기적인 일정에 대 한 수 있습니다. 합류 하는 시간이 너무 짧은 경우에, 세포는 더 낮은 세포 밀도 (높은 분할 비율)에 subcultured는. 마찬가지로, 합류를 도달 하는 시간이 너무 긴 경우에, 세포 높은 세포 밀도 (낮은 분할 비율)에 subcultured는. 대부분 초파리 셀 라인 낮은 세포 밀도에 아주 과민 하다는 것이 중요 하다 (< 1 x 105 셀/mL), 셀 거의 증식 하 고 결국 죽을 수도 있습니다.
Drosophila 셀 라인 성장 특성 및 형태에서 변화 한다. 그 결과, 셀 라인 고유 속성을 다르게 처리 될 수 있을 수 있습니다. 대부분 초파리 셀 라인은 반 부착. 더 낮은 세포 밀도, 그들은 더 강한 성장 표면에 및 준수 문화 confluent, 셀이 부착 되 고 고 쉽게 분리. 세포 부착에이 점차적인 변화 용이 가장 널리 초파리 셀 라인 (슈나이더, Kc 라인, imaginal 디스크 및 CNS 라인)의 쉬운 subculturing 그것은 단순히 그들을 꺼내 려 셀 단층을 통해 미디어를 분배 하는 연산자를 허용 때 문화는 조밀한 성장 표면에서 있는 표면 부착과 같은 줄에 대 한 여성 생식 선 줄기/난소 체세포 칼 집 (fGS/OSS) 및 Ras 라인, 그것 성장 표면에서 세포를 분리에서 원조 하기 위하여 짧은 기간에 대 한 트립 신에 셀을 품 어 필수적입니다.
대부분 초파리 세포 라인에 대 한 미디어 추가 송아지 태아 혈 청 (FCS) 포함 되어 있습니다. 인슐린 및 성인 비행 추출 (FEX)는 일부 특정 라인에 필요 합니다. FEX 특정 애벌레 imaginal 디스크 라인과 성인 난소 세포 라인의 성장에 필수적인 정의 되지 않은 구성 요소를 포함합니다. DGRC 준비 하 고 만들어 사용할 수 있는 성인 FEX 1 주 오래 된 오 레 곤-R-modENCODE 파리에서 파생 된 (RRID: BDSC_25211) 2.5 mL와 10 mL aliquots에. DGRC는 또한 그것의 웹사이트에 작은 규모 FEX 준비에 대 한 지침을 제공 합니다 < https://dgrc.bio.indiana.edu/include/file/additions_to_medium.pdf>. 그러나 FEX 준비,, 시간이 소요 되 고 성인 파리의 대량을 요구 한다.
초파리 셀 라인의 cryopreservation는 즉시 사용에서 시간과 세포의 유지 보수에 대 한 시 약을 절약할 수 있습니다. Cryopreservation은 DMSO, cryoprotective 에이전트를 포함 하는 매체에서-80 ° C를 천천히 셀 (-1 ° C/min)를 동결에 의해 이루어집니다. 느린 냉각 단계 성공적인 cryopreservation 중요 하다. -80 ° C 냉장고에서 셀의 용액은 소 프로 파 놀으로 가득 냉동 컨테이너에 배치 될 때-1 ° C/min의 속도로 냉각 된다. -80 ° c.에 도달 ampules에 온도 대 한 최대 2 시간 걸릴 것 이다 25 ° C 주변 온도에서 시작, 그것은 하룻밤 동결 ampules 떠날 것이 좋습니다.
냉동된 ampules 장기간된 보관에 대 한 질소의 액체 단계에 빠르게 전송 합니다 다음. 주위 온도에 cryovial 약 10 ° C/min에서 빠르게 데워 것 이다 하 고 생존23-50 ° C 이상에서 손상 될 것입니다. 전송, 신속한 유지 하려면 ampules 주위 온도에 노출을 최소화 하기 위해 작은 일괄에서 처리 합니다. 또는, 액체 N으로 그들의 전송을 위해 준비 하는 동안 드라이 아이스에 냉동된 cryovials을 배치2. 액체 질소를 사용할 수 없는 경우 셀 비록 시간이 지남에 중요 한 악화의 위험을-80 ° C 냉동 실에 저장할 수 있습니다.
셀 밀도 성공적인 cryopreservation와 셀 라인의 후속 부흥에 대 한 중요 하다. 일반적으로, 새로운 셀 초기 만들려고 라인을 동결 해야 합니다 최대한 빨리 셀의 초과 사용할 수 있게 됩니다 (1−3 ampules)를 고정 합니다. 셀 라인은 되었습니다 더 교양 안정적으로, 일단 10−20 ampules 냉동된 재고 만들어야 합니다. 이 주식은 다음의 후 동결 세포 복구 및 생존 능력, 실험에 대 한 전파 됩니다 후 확인 하거나 냉동된 재고 ampules 수가 5 개 미만으로 떨어질 때 주식을 대체 하는 해 동 됩니다. 마지막으로, 그것은 해 동된 세포에 그것의 부모의 재고 특성 유지 셀 라인3,24진화 알려져 있습니다 확인 하는 것이 중요.
결론적으로,이 문서 초파리 세포 배양 초파리 셀 라인의 기본 처리에 대 한 다양 한 선, 모범 사례 및 시청각 프로토콜에 기본 정보를 제공 하 여 작업에 대 한 입문서를 제공 합니다. 이 액세스할 수 있는 리소스는 교양된 초파리 셀 작업에 대 한 소개를 원활 하 게 쉽게 하 고 어떤 연구 실험실에서 기존 교육 가이드를 보완 하기 위해 의미입니다.
공개
저자는 공개 없다.
감사의 말
우리는 DGRC에서 큐레이터 다양 한 D. melanogaster DNA/벡터/셀 리소스 활용을 위한 건강의 국가 학회 (NIH P40OD010949 상) 및 연구 커뮤니티 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 mm tissue culture plates | Corning | 430167 | Subculturing |
| 25 cm2 T-flask | Corning | 430168 | Subculturing |
| 35HC Liquid Nitrogen Storage Tank | Taylor-Wharton | 35HCB-11M | Cryopreservation |
| Automated Cell counter | BIO-RAD | TC20 | Counting |
| Bactopeptone | BD BioSciences | 211677 | Medium additions |
| Counting Slides | BIO-RAD | 145-0011 | Counting |
| Cryovial 1 mL | Greiner | 123263 | Cryopreservation |
| DMSO | Sigma Aldrich | D5879 | Cryopreservation |
| Freezing Box | Nalgene | 5029-0909 | Cryopreservation |
| Freezing Container | Fisher Scientific | 15-350-50 | Cryopreservation |
| Hematocytometer | Fisher Scientific | #0267110 | Counting |
| Human Insulin | Millipore Sigma | I9278 | Medium additions |
| Hyclone CCM3 media | GE Healthcare Life Sciences | SH30061.03 | Medium |
| Hyclone Fetal Bovine Serum | GE Healthcare Life Sciences | SH30070.03 | Medium additions |
| L-Glutamic acid potassium salt monohydrate | Millipore Sigma | G1149 | Medium additions |
| L-Glutathione reduced | Millipore Sigma | G6013 | Medium additions |
| Potassium Bicarbonate | Millipore Sigma | 237205 | Medium additions |
| Select Yeast Extract | Millipore Sigma | Y1000 | Medium additions |
| Shields and Sang's M3 Insect medium | Millipore Sigma | S8398 | Medium |
| Trpsin-EDTA (0.05 %), phenol red | ThermoFisher Scientific | 25300054 | Subculturing |
| Trypan Blue (0.4%) | BIO-RAD | 145-0013 | Counting |
참고문헌
- Baum, B., Cherbas, L., Dahmann, C. Drosophila: Methods and Protocols. Methods in Molecular Biology. 420, 391-424 (2008).
- Cherbas, L., Gong, L. Cell lines. Methods. 68 (1), 74-81 (2014).
- Luhur, A., Klueg, K. M., Zelhof, A. C. Generating and working with Drosophila cell cultures: Current challenges and opportunities. Wiley Interdisciplinary Reviews: Developmental Biology. , e339 (2018).
- Franz, A., Brunner, E., Basler, K. Generation of genome-modified Drosophila cell lines using SwAP. Fly (Austin). 11 (4), 303-311 (2017).
- Housden, B. E., et al. Identification of potential drug targets for tuberous sclerosis complex by synthetic screens combining CRISPR-based knockouts with RNAi. Science Signaling. 8 (393), r9 (2015).
- Kunzelmann, S., Bottcher, R., Schmidts, I., Forstemann, K. A Comprehensive Toolbox for Genome Editing in Cultured Drosophila melanogaster Cells. G3 (Bethesda). 6 (6), 1777-1785 (2016).
- Ishizu, H., Sumiyoshi, T., Siomi, M. C. Use of the CRISPR-Cas9 system for genome editing in cultured Drosophila ovarian somatic cells. Methods. 126, 186-192 (2017).
- Echalier, G. . Drosophila Cells in Culture. , (1997).
- Echalier, G., Perrimon, N., Mohr, S. . Drosophila cells in culture. 2nd edition. , (2017).
- Cherbas, L., Cherbas, P., Roberts, D. B. . Drosophila: A practical approach. 10, 319-346 (1998).
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. Journal of Embryollgy and Experimental Morphology. 27 (2), 353-365 (1972).
- Echalier, G., Ohanessian, A. Isolement, en cultures in vitro, de lignees cellulaires diploides de Drosophila melanogaster. Comptes rendus de l'Académie des Sciences. 268, 1771-1773 (1969).
- Ui, K., et al. Newly established cell lines from Drosophila larval CNS express neural specific characteristics. In Vitro Cellular & Developmental Biology − Animal. 30A (4), 209-216 (1994).
- Ui, K., Ueda, R., Miyake, T. Cell lines from imaginal discs of Drosophila melanogaster. In Vitro Cellular & Developmental Biology. 23 (10), 707-711 (1987).
- Currie, D. A., Milner, M. J., Evans, C. W. The growth and differentiation in vitro of leg and wing imaginal disc cells from Drosophila melanogaster. Development. 102, 805-814 (1988).
- Niki, Y., Yamaguchi, T., Mahowald, A. P. Establishment of stable cell lines of Drosophila germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 103 (44), 16325-16330 (2006).
- Saito, K., et al. A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature. 461 (7268), 1296-1299 (2009).
- Simcox, A., et al. Efficient genetic method for establishing Drosophila cell lines unlocks the potential to create lines of specific genotypes. PLoS Genetics. 4 (8), e1000142 (2008).
- Sumiyoshi, T., et al. Loss of l(3)mbt leads to acquisition of the ping-pong cycle in Drosophila ovarian somatic cells. Genes & Development. 30 (14), 1617-1622 (2016).
- Dequeant, M. L., et al. Discovery of progenitor cell signatures by time-series synexpression analysis during Drosophila embryonic cell immortalization. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 12974-12979 (2015).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Shields, G., Sang, J. H. Improved medium for culture of Drosophila embryonic cells. Drosophila Information Service. 52, 161 (1977).
- Freshney, R. I., Capes-Davis, A., Gregory, C., Przyborski, S. . Culture of animal cells : a manual of basic technique and specialized applications. Seventh edition. edn. , (2016).
- Lee, H., et al. DNA copy number evolution in Drosophila cell lines. Genome Biology. 15 (8), R70 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유