Method Article
모 세관 전기 영동-질량 분 광 법에의 한 대사체학 분석을 위해 배양 된 부착 세포 로부터 수성 대사 산물의 추출
요약
본 기사의 목적은 대사체학 분석, 특히 모 세관 전기 영동-질량 분 광 법을 위해 배양 된 부착 세포 로부터 수성 대사 산물을 추출 하기 위한 프로토콜을 설명 하는 것 이다.
초록
대사체학 분석은 정상 세포에 비해 암 세포의 특정 대사 조절을 이해할 뿐만 아니라 초기 단계의 암 검출 및 화학요법 반응의 예측을 위한 바이오 마커를 파악 하는 유망한 오 믹스 접근법입니다. 암 환자. 대사체학 분석을 위한 균일 한 샘플의 제조는 해결 될 수 있는 중요 한 문제입니다. 여기에서, 우리는 모 세관 전기 영동 질량 분 광 법 (CE-MS)을 사용 하 여 대사체학 분석을 위해 배양 된 부착 세포 로부터 수성 대사 산물을 추출 하기 위한 쉽고 신뢰할 수 있는 프로토콜을 제시 합니다. 배양 세포 로부터의 수성 대사 산물은 세포를 배양 및 세척 하 고, 세포를 메탄올로 처리 하 고, 대사 산물을 추출 하 고, CE-MS 분석용 스핀 컬럼을 사용 하 여 단백질 및 거 대 분자를 제거 함으로써 분석 된다. 산화 성 시 약, 디 아민으로 처리 된 폐암 세포 주를 사용 하는 대표적인 결과는 산화 적 스트레스 하에서 세포의 명확 하 게 관찰 가능한 신진 대사 변화를 보여줍니다. 이 문서는 CE-MS에 의해 분석을 위한 세포 라인에서 수확 대사 산물에 새로운 대사체학 연구에 관여 하는 학생 및 조사자에 특히 가치가 있을 것입니다.
서문
Otto warburg는 암 세포가 포도 당을 차지 하 고 적절 한 산소의 존재 하에 젖 산을 생산 하기 위해 그것을 발효 하는 비정상적인 능력을 습득 관찰-warburg 효과 또는 호 기성 분해로 불리는 현상1,2. 미토 콘 드리 아 호흡 결함은 암 세포에서 호 기성 분해의 기저 기준으로 서 추측 된다3. 실제로, 워 부르 크 효과는 임상 실습4,5에서 널리 이용 되는 fluorodeoxyglucose (fdg)-positron 방출 단층 촬영 (PET)에의 한 종양 이미징의 기초가 된다. 호 기성 분해의 높은 비율은 암의 주요 특징으로 간주 되 고 최근에 잘 알려진 "암의 특징"의 하나로 서 채택 되었습니다, d. 하나 한과 b. 와인 버그에 의해 설명 된 바와 같이. 암 유전자 및 종양 억제 유전자의 체세포 돌연변이-예를 들어 h라스/크 라스/nras, EGFR, braf, MYC, TP53,이 소시 아타 탈 수소 효소 및 푸 마 레이트 타제 (FH ) — 전쟁 부르 크 효과7의 결과로 여겨지는 암 세포의 특정 대사 변화에 연결 되었습니다.
대사체학 분석은 암 세포의 신진 대사 조절을 이해 하는 것 뿐만 아니라 초기 단계의 암 바이오 마커와 화학요법 반응 예측을 파악 하는 데에도 유망한 접근법입니다. 항 암 화합물을 가진 과민 하거나 저항 하는 암 세포의 처리 후에, 그들의 신진 대사 응답의 추적은 암 환자에 있는 특정 항 암 치료의 효 험을 예측 하기 위하여 신진 대사 바이오 마커의 확인을 용이 하 게 합니다8 ,9,10,11. 본 문서에서, 산화 적 스트레스를 유발 하는 디 아 미드로 처리 된 EGFR 돌연변이를 갖는 폐 선 암 으로부터 유래 된 폐암 세포 주-대사체학 분석을 위한 모델로 사용 되었다. 모 세관 전기 영동 질량 분 광 법 (CE-MS)을 사용 하는이 분석 방법의 이점은 질량 범위 m/z 50-100012,13을 사용 하 여 충전 된 대사 산물을 포괄적으로 측정 하는 것입니다. 이 기사의 목적은 초보자에 게 배양 암 세포 및 후속 대사체학 분석에서 수성 대사 산물의 제조를 위한 상세한 단계적 시각 프로토콜을 제공 하는 것입니다, 특히 CE-MS에 의해.
프로토콜
1. 첫째 날의 세포 배양
참고: 대사 산물 추출에 대 한 각 샘플은 적당 하지만 완전히 confluent (약 2 ~ 5 백만 개의 세포가 포함 되어 있는) 단일 100 mm 조직 배양 접시에서 준비 해야 합니다. 분석에 필요한 요리의 수를 계산 하 고 그에 따라 준비 합니다.
- 배양 HCC827에서 37 ° c에서 5% CO2의 세포를 rpmi-1640 배지에서 10% 소 태아 혈 청 (FBS)으로 보충 하였다.
- 100 mm 배양 접시에서 세포 배양 배지를 흡 기 합니다.
- 칼슘과 마그네슘이 없는 인산 완충 식 염 액 (PBS) 용액 2 mL를 사용 하 여 각 접시에 있는 세포를 세척 합니다. PBS 용액이 요리의 표면을 완전히 덮을 수 있도록 각 접시를 부드럽게 흔들어 줍니다.
- 배양 접시에서 세척 완충 액을 흡입 합니다.
- 따뜻한 0.25% 트립 신-EDTA 용액을 37 ° c에 넣고 5Ml의 트립 신-EDTA 용액을 5 mL 혈 청 학적 피 펫과 함께 첨가 한다. 트립 신이 요리의 표면을 완전히 덮을 수 있도록 각 접시를 부드럽게 흔들어 줍니다.
- 약 5 분 동안 37 ° c에서 배양 요리를 배양 합니다.
- 요리 당 미리 데워 진 완전 성장 배지 4 mL를 추가 하십시오. 여러 번 부드럽게 파이 펫 팅 하 여 배지에서 세포를 소생 시킵니다.
- 각 세포 현 탁 액을 별도의 15ml 원추형 튜브로 전송 하 고 5 분 동안 800 × g 에서 원심 분리 합니다.
- 미리 데워 진 완전 성장 배지의 2 mL에 각 세포 펠 렛을 소생 시켰다.
- 자동 셀 카운터와 0.4% 트리 판 blue 솔루션을 사용 하 여 셀의 총 수와 퍼센트 생존 율을 결정 합니다.
- 10 μ l의 세포 현 탁 액과 10 μ l의 0.4% 트리 판 청색 용액을 섞어 줍니다.
- 모 세관 작용을 통해 시료의 10 μ l를 세포 계수 챔버로 밀어 넣습니다.
- 챔버 슬라이드를 자동 셀 카운터에 삽입 합니다. 전송 된 표시등이 자동으로 켜지 고 계측기가 셀에 자동으로 초점을 맞춥니다.
- 캡처 버튼을 눌러 이미지를 캡처하고 결과를 표시 합니다.
- 필요한 경우, 원하는 세포 농도를 얻기 위해 성장 배지를 더 추가 한다.
- 100 mm 세포 배양 접시 당 약 1 ~ 2.5 백만 세포를 종자.
참고: CE-MS 분석에 의해 결정 된 대사 산물 농도는 생존 가능한 세포의 수에 기초 하 여 정상화 될 것 이다. 세포 계수를 목적으로, 각 그룹에 대해 적어도 하나의 여분의 시드 배양 접시를 준비 할 필요가 있다. - 18 시간 동안 37 ° c에서 5% co2로 배양 접시를 배양 합니다.
2. 시 약의 제조
- 상용 내부 표준 용액을 L-메티오닌 설 폰 및 d-장뇌-10 술 폰을 초순 수에 1000를 포함 하 여 희석 한다.
참고: 80 샘플 미만인 경우, 50 mL 용적 플라스 크에 내부 표준 용액 1과 45 mL의 초순 수의 50 μ l를 혼합 한 다음 초순 수로 용액을 최대 50 mL까지 가져온다. - 초순 수 내 세척 완충 액으로 0.05 g/mL만 니 톨 용액을 제조 한다.
참고: 30 개 미만의 샘플에 대해서는 초순 수 500 mL의만 니 톨 25g을 녹여 주세요. 100 mm 배양 접시 당 약 15ml의 워시 버퍼가 필요 하므로 샘플 수에 따라 충분 한 양의 세척 완충 액을 준비 하십시오.
3. 사전 세척 원심 필터 장치
- 각 원심 필터 유닛의 필터 컵에 초순 수 250 μ l를 피 펫 한다 ( 재료 표참조).
참고: 샘플 당 2 개의 필터 유닛이 필요 합니다. - 필터 유닛을 단단히 캡 하 고 4°c에서 9100 × g 에서 5 분간 원심 분리기.
- 각 여과 액의 부피 확인-첫 번째 짧은 스핀 중에 상당한 여 액이 축적 된 경우, 필터 장치에 결함이 있을 수 있습니다. 이 경우 필터 유닛을 버리고 대신 새 필터 유닛을 사용 하십시오.
- 필터 유닛의 뚜껑을 단단히 닫고 4°c에서 30 분 동안 9100 × g 로 다시 원심 분리 하십시오.
- 필터 컵에 초순 수가 남아 있지 않은지 확인 하십시오. 각 수집 튜브에서 여과 된 초순 수를 파이 펫으로 제거 하 고 폐기 하십시오.
참고: 필터 컵의 잔류 수를 피 펫과 함께 제거 하면 필터가 손상 될 수 있습니다. - 필터 컵을 컬렉션 튜브로 교체 하십시오.
참고: 건조 시 필터가 손상 될 수 있으므로 1 시간 이내에 원심 필터 유닛을 사용 하십시오.
4.2 일째 세포 배양
-
인큐베이터에서 100 mm의 배양 접시를 꺼내 세요.
참고: 권장 세포 배양 기간은 18 시간입니다. - 각 100 mm 배양 접시에서 세포 배양 배지를 흡 기 한다.
- 각 접시에 적절 한 농도의 화합물 또는 약물을 포함 하는 10 mL 세포 배양 배지를 추가 하 여 세포 층을 방해 하지 않도록 주의 하십시오.
참고: 데모용으로,이 실험에서는 PBS에 녹 인 250의 10 μ l (최종 농도 250 μ m)을 추가 했습니다. - 대조 군으로 디 아 미드 또는 PBS의 존재 하에서 30 분 동안 37 ° c에서 배양 접시를 배양 하였다.
- 각 100 mm 배양 접시에서 세포 배양 배지를 흡 기 한다.
- 각 요리의 가장자리에 5%만 니 톨 용액 2 mL를 부드럽게 추가 하 여 세포 층을 교란 하지 않도록 조심 하 고 접시를 살짝 기울입니다.
주: PBS 또는 식 염 수 용액은 CE-MS 기반 대사체학 분석을 방해 하 고 측정 결과에 악영향을 미치므로 세척 버퍼로 사용해 서는 안 됩니다. - 각 배양 접시에서 세척 완충 액을 흡입 한 다음 접시 당 10 mL의 세척 완충 액을 부드럽게 추가 하 여 세포를 다시 세척 하 고 접시를 약간 기울여 줍니다.
- 각 배양 접시의 가장자리에서 세척 완충 액을 완전히 흡 기 시킵니다.
참고: 셀을 흡입 하지 않도록 주의 하면서 가능한 한 많은 세척 완충 액을 흡입 하십시오. 잔류만 니 톨은 CE-MS 분석을 방해할 수 있다; 세포의 포부는 세포의 수를 감소 하 고 따라서 데이터 정규화에서 오류의 원인이 될 것입니다.
5. 배양 세포에서 대사 산물 추출
- 배양 접시 당 800 μ l의 99.7% 메탄올을 첨가 하십시오. 각 배양 접시를 앞뒤로 부드럽게 흔들어 표면 전체를 덮으 십시오. 30 초 동안 상 온에서 접시를 남겨 주세요.
- 파이 펫의 끝을 메탄올에 침 지 하 고 위아래로 여러 번 부드럽게 파이 펫 팅 하 여 접시 당 희석 된 내부 표준 용액의 550 μ l을 천천히 추가 하십시오.
- 각 배양 접시를 앞뒤로 부드럽게 흔들어 표면 전체를 덮으 십시오.
- 30 초 동안 상 온에서 접시를 남겨 주세요.
6. 세포 추출 물 한 외 여과
- 추출 된 용액을 각 배양 접시에서 별도의 1.5 mL 마이크로 원심 분리기 튜브로 옮깁니다.
- 튜브를 4 ° c에서 2300 × g 에서 5 분간 원심 분리기.
- 각 상층 액의 350 μ l를 시료 당 2 개의 원심 필터 유닛으로 전달 합니다.
참고: 각 배양 접시에서 추출 된 용액의 총 700 μ l가 2 개의 필터 튜브 (350 μ l/튜브)로 전달 됩니다. - 필터 튜브를 4 ° c에서 약 2 시간 동안 9100 × g 에서 원심 분리 하 여 필터 컵에 액체가 남지 않습니다.
- 필터 컵을 제거 하 고 단단히 수집 튜브의 뚜껑을 닫습니다.
7. 샘플 증발
- 원심 증발 기 준비-일반적으로 증발 기, 콜드 트랩 및 진공 펌프로 구성 됩니다.
- 원심 증발 기에 수집 튜브를 놓습니다.
참고: 튜브의 뚜껑을 열어 두십시오. - 실 온에서 진공 조건 하에서 추출 된 샘플 용액을 증발 시킵니다.
주: 회전과 압력의 수에 대 한 일반적인 구성은 각각 1500 rpm 및 1000 Pa이 고, 일반적으로 샘플을 완전히 증발 시키기 위해 약 3 시간 소요 됩니다. - 수집 튜브에 액체가 남아 있지 않은지 확인 하 고 튜브 뚜껑을 단단히 닫으십시오.
- 대사체학 분석까지 초 저온 (-80 ° c) 깊은 냉동 고에 수집 튜브를 보관 하십시오.
8. CE-MS에의 한 대사체학 분석
- 여과 액을 세 륨-MS 분석 직전 초순 수의 50 μ l로 소생 시켰다.
- 이전에 설명 된 방법에 의해 CE-ms 분석을 수행12,13 모 세관 전기 영동 시스템을 사용 하 여 비행 시간 질량 분 광 계 시스템은 등 용 매 펌프, ce-ms 어댑터 및 ce-ESI-ms 분무기가 장착 되어 있습니다.
참고: 두 시스템은 시스템 벤더의 소프트웨어로 제어할 수 있으며 용융 실리 카 모 세관 (50 μ m 내경 × 80의 전체 길이)으로 연결 됩니다.- 계측기 및 샘플 바이 알을 설정 하 고 모 세관 카세트를 사용 하 여 모 세관을 준비 하 고 음이온 또는 양이온 분석 모드에 따라 칼 집 액체 및 적절 한 전기 영동 완충 액을 보충 한 다음 전압을 적용 하십시오.
참고: 계측 및 분석 조건에 대해서는12,13에서 자세히 설명 합니다. - 소프트웨어를 열고 데이터 수집 방법 및 샘플 정보를 포함 하는 작업 목록을 준비 합니다.
- 테스트 실행을 시작 하 고 신호 강도 및 내부 표준의 피크 모양과 다른 표준 화합물의 최고 분해능과 같은 데이터를 확인 합니다.
- 필요한 경우 분석 조건을 미세 조정 합니다.
- 샘플 솔루션을 50에서 3 초 동안, 30kv의 전압으로 주입 합니다.
참고: CE-MS는 양극 또는 음이온 모드 중 하나에서 진행 되었습니다. 분 광 계를 설정 하 여 질량 범위 m/z 50 ~ 1000을 스캔 합니다. 상기 모 세관 전압은 4Kv에서 설정 되었다; 질소 가스 (히터 온도 300 ° c)의 유 속. 포지티브 모드에서 fragmentor, 스키 머 및 OCT RFV 전압은 각각 75, 50 및 125 V로 설정 되었습니다. 음이온 모드의 경우, fragmentor, 스키 머 및 OCT RFV 전압은 각각 100, 50 및 200 V로 설정 되었습니다.
- 계측기 및 샘플 바이 알을 설정 하 고 모 세관 카세트를 사용 하 여 모 세관을 준비 하 고 음이온 또는 양이온 분석 모드에 따라 칼 집 액체 및 적절 한 전기 영동 완충 액을 보충 한 다음 전압을 적용 하십시오.
- 스펙트럼 데이터를 분석 합니다.
- M/z, 피크 영역 및 마이그레이션 시간 (MT)을 포함 한 피크 정보를 얻기 위해 자동 통합 소프트웨어를 사용 하 여 질량 스펙트럼 데이터에서 피크를 추출 합니다.
참고:이 방법은 다른14에 자세히 설명 되어 있습니다. - 이 소 지형, 부가 물 이온 및 기타 알려진 대사 산물의 제품 이온에 해당 하는 신호 피크를 배제 합니다.
- M/z 값 및 MTs에 따라 hmt 대사 산물 데이터베이스의 정보로 남은 피크에 주석을 답니다.
- 주석이 달린 최고점의 영역을 내부 표준 수준과 샘플 당 셀 수로 정규화 합니다.
- 각 대사 산물에 대해 준비 된 표준 곡선을 이용 하 여 배양 된 세포 (pmol/106 세포) 내의 각 대사 산물의 농도를 평가 한다.
- 후속 통계 분석 및 생물학적 해석을 위해 정량화 된 대사 산물 농도를 사용 하십시오14.
- M/z, 피크 영역 및 마이그레이션 시간 (MT)을 포함 한 피크 정보를 얻기 위해 자동 통합 소프트웨어를 사용 하 여 질량 스펙트럼 데이터에서 피크를 추출 합니다.
결과
암 세포에서 대사 산물 농도는 (pmol/106 세포) 생존 가능한 세포 수로 정규화 되기 때문에, 실험 조건은 조건 사이에 생존 가능한 세포의 수의 변동을 최소화 하도록 주의 하 여 설정 되어야 한다. 예를 들어, 디 아민 처리는 상대적으로 고 농도 (250 μ m)에 있으 나 짧은 시간 동안 모든 세포가 최대한 동등 하 게 성장할 수 있도록 하 여, 분석 가능한 세포 수를 균일화 시킨다. 이러한 실험 조건 하에서 HCC827 세포는 3 시간 동안 동등 하 게 성장 하였다 (그림 1). HCC827 세포에서 PBS 처리 된 세포 (대조) 세포에 비해 디 아 미드 처리 셀에 대 한 CE-MS 분석은 각각 175 및 150 차등 대사 산물을 밝혀 내었다. 이들 중에서, pentose 인산 통로 (PPP)와 상부이 염에서의 여러 중간체 들은 두 세포 주 모두에서 다이 미드 처리 된 조건에서 상당히 높 았으 나, 반면에 몇몇 tricarboxylic 산 (TCA) 사이클 중간체 들은 치료 된 (그림2 와 그림 3).
PPP는 산화 환 원 항상성 유지 및 지방산 생 합성에 사용 되는 감소 된 니코틴 아마 이드 디뉴클레오티드 인산 염 (NADPH)의 형태로 환 원성 등가물을 생성 한다. 디 아 미드 처리 후에, 글 루 콘 산의 수준-산화 된 포도 당은 HCC827 세포에서 12 겹으로 증가 하 고 10 배는 PC에서 9 배입니다; 유사 하 게, 디 아 미드 처리에 이어서, 글루코스 6-인산 염 (G6P)의 수준-인 산화 된 포도 당과 첫번째 헥 소 키나 제 촉매 분해 생성물-또한 HCC827 및 세포에서 각각 6.3 및 3.5 배 증가 하였다 (도 4). 또한, 디 아 미드 처리에 따르면, phosphogluconate의 첫 번째 중간체 인 6-10의 레벨은 PBS 컨트롤에서 볼 수 있는 수준과 비교 하 여 HCC827 셀에서 89 배 증가 하 고 231-접기 세포의 수치를 극적으로 높였습니다 (그림 4). 대조적으로,과 당 6-포스 페이트 (F6P) 및과 당 1, 6-비스 포스 페이트 (F1, 6p)와 같은 다른 분해 중간체의 수준은 디 아민 실험 조건에서 변하지 않았다 (도 4). 총 니코틴 아 미드 디뉴클레오티드 인산 (NADP+) 수준은 디 아 미드 처리와 PBS 제어 조건 (도 4) 사이에서 거의 동등 하였으며, 글루코스가 주로 PPP를 통해 카 울 화 된 것을 시사 한다.
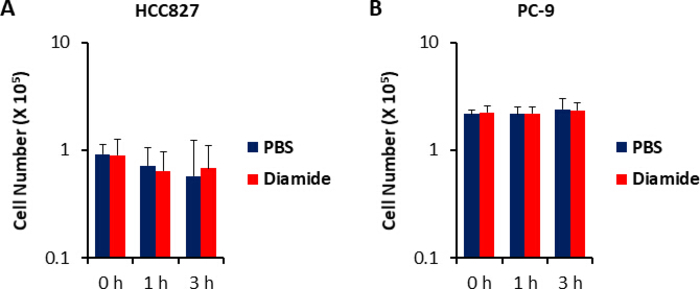
그림 1입니다. 디 아민 처리 시 변경 되지 않은 세포 번호. 250 μ m의 디 아민에 대 한 세포 성장 반응은 트리 판 청색 염색을 이용 하 여 측정 하였다. (A) HCC827 세포의 세포 수는1 또는 3 시간 동안 PBS (청색) 또는 디 아 미드 (적색250 μ m)로 처리 하 여 나타낸다. 데이터는 평균 ± 6n=6으로 표시 된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
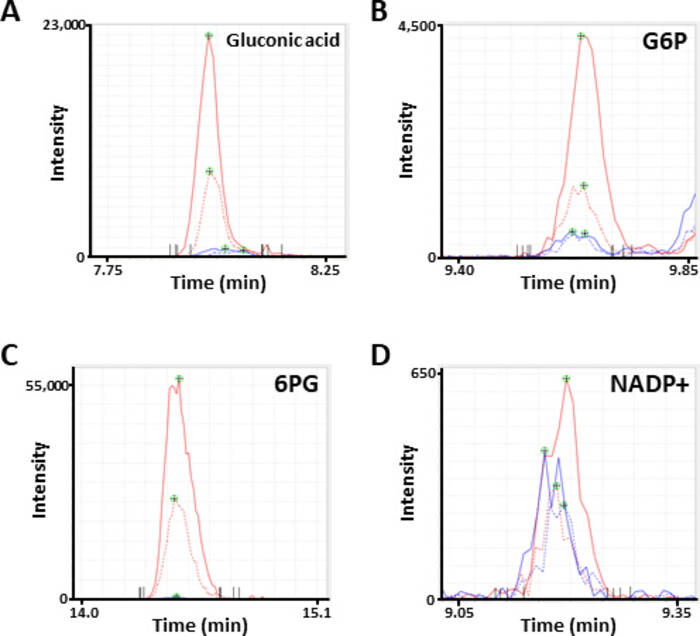
그림 2입니다. 대사 산물의 대표 MS 봉우리. Electropherograms 주석으로 서 글 루 콘 산, (B) 글루코스 6 인산 염 G6P) 및 (D) 아미드아데 노이드를 세 륨-MS 분석에 의해 얻어진 인산 염 (nadp+)으로 서 주석을 하였다. 각 선은 사용 된 세포 선 (고체, HCC827, 도트, 적색, 디 아민)을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
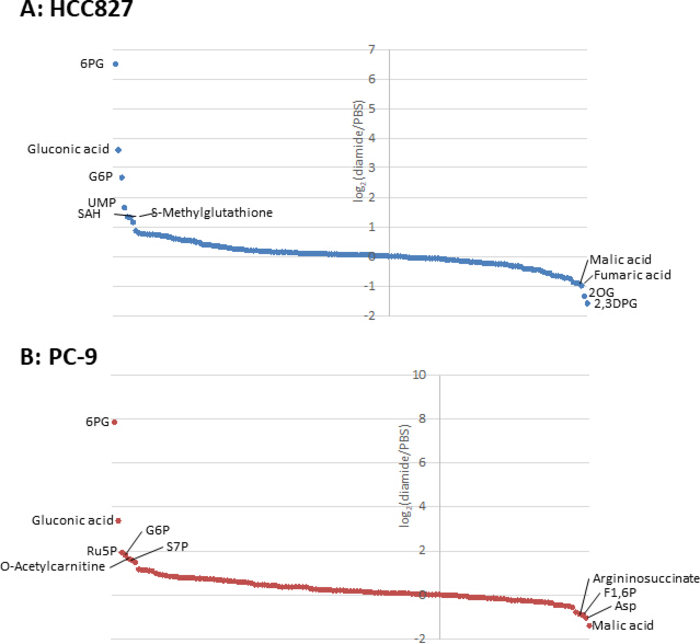
그림 3입니다. 세포내 대사 산물의 대사체 프로필. (A) HCC827의 대사 산물의 접힘 변화 및 디 아 미드로 처리 된 (B) PC-9 세포는 로그2(디 아 미드/PBS)로 나타내 었 다. 총 175 및 150 대사 산물은 각각 HCC827 및 PC-9 세포에서 주석 처리 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
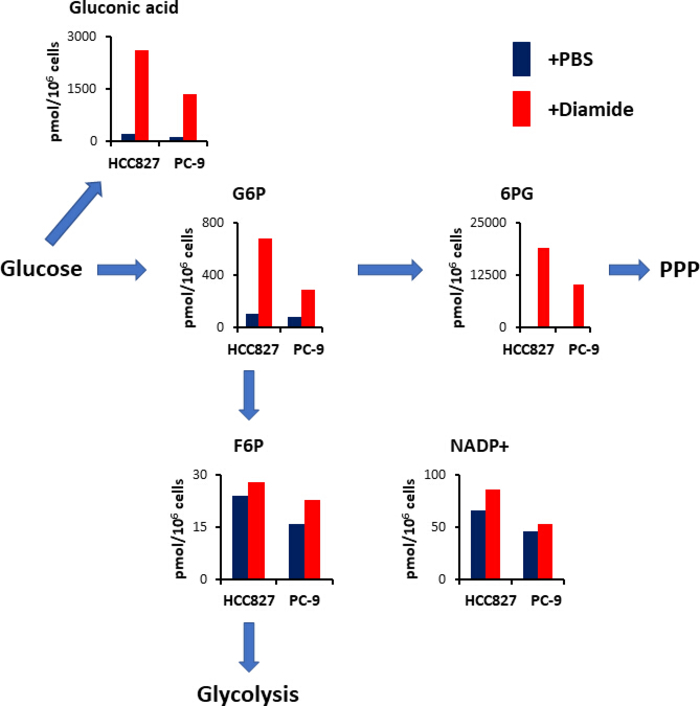
그림 4입니다. 디 아민 처리 시 PPP의 상향 조절. 디 아민으로 처리 한 후 해당 분해 및 pentose 인산 통로 (PPP) 에 관여 하는 주요 대사 산물의 세포내 농도 (pmol/106 세포)가 표시 됩니다. 대사 산물은 PBS (청색) 또는 디 아민 (적색, 250 μ m)으로 처리 된 HCC827 세포 로부터 30 분 동안 추출 하였다. 글 루 콘 산, 글루코스 6 인산 염 (G6P),과 당 6 인산 염 (F6P)과 같은 대표적인 대사 산물, 6 -phosphogluconate (6Pg) 및 니코틴산 아 미드 디뉴클레오티드 인산 염 (nadp+)이 도시 되어 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
여기서, 우리는 CE-MS 기반 대사체학 분석을 위해 배양 암 세포 로부터 대사 산물을 준비 하기 위해 널리 접근 가능한 방법론을 설명 한다. 이 프로토콜에서 가장 중요 한 점 중 하나는 측정 된 대사 산물 농도가 생존 가능한 세포 수로 정상화 되기 때문에 암 세포를 적절 하 게 준비 하는 것입니다. 세포 수의 정확한 추정을 위해, 대사체학 분석을 위한 대사 산물의 추출과 병행 하 여 실행 가능한 세포의 수를 세는 실험 군 당 적어도 하나의 추가 배양 접시를 제조할 필요가 있다. 또한, 동일한 수의 세포를 반복 하 고 계산을 위한 접시에 각 접시에 시드 되어야 한다; 앞으로는,이는 스트레스 (예를 들어, 트립 신이 없는) 세포 계수 프로토콜을 이용 하 여 동일한 요리가 생존 가능한 세포를 카운팅 하 고 대사 산물을 추출 하는 데 모두 사용 될 수 있게 합니다. 셀이 요리의 표면에서 분리 되지 않도록 세척 중에 주의를 기울여야 합니다. 세포 부착을 감소 시키는 심각한 세포 독성 시험 및 기타 실험은 세척 과정 중에 세포의 잠재적인 손실로 인 한이 추출 프로토콜에 부적합 할 수 있다.
PBS와 같은 염-기반 버퍼가 대사체학 분석을 방해 하 고 측정에 악영향을 미치기 때문에 세 륨-MS 기반 대사체학 분석을 위해 배양 된 세포에서 대사 산물을 추출 하기 위한 세척 완충 액으로 5%만 니 톨 용액을 사용 하는 것이 중요 합니다.
두 개 또는 세 개의 요리는 개별적으로 각 접시에서 대사 산물을 추출 하 고 샘플을 풀링 하 여 단일 샘플로 결합 될 수 있다; 그러나, 여러 요리를 결합 하는 것은 종종 추출 된 대사 산물 용액에서 잔류만 니 톨을 증가 시킨다. 이것은 또한 CE-MS에의 한 대사체학 분석을 방해할 수 있습니다. 따라서, 하나의 샘플로 여러 요리 나 우물을 사용 하지 않는 것이 좋습니다.
50 및 1000 Da 사이의 분자량을 가진 충전 된 분자의 포괄적 인 측정을 위해 CE를 사용 하는이 대사체학 분석 방법이 개발 되었습니다. 따라서,이 프로토콜은 수성, 저 분자량 화합물의 추출을 위해 최적화 된다. 따라서,이 프로토콜은 단백질 및 핵 산과 같은 지질 또는 거 대 분자와 같은 소수 성 대사 산물을 추출 하는데 적합 하지 않다. 배양 된 세포 샘플의 종합적인 지질 분석 또는 지질학 대 한 수요가 증가 하 고 있기 때문에, 친수성 및 소수 성 대사 산물 모두의 동시 추출을 위한 쉽고 효과적인 프로토콜의 개발이 필요 하다.
대사 산물 추출의 첫 번째 단계 — 흡입 배지 및만 니 톨을 이용한 세 정 세포-세포의 대사 프로 파일의 변화를 최소화 하기 위해 가능한 한 빨리 수행 되어야 한다. 만 니 톨로 세척 한 후 메탄올로 세포를 치료 하는 것은 단백질을 변성 시키는 것으로 가정 하 고 더 나아가 대사 반응을 촉진 하는 효소를 방지 합니다. 그러나 메탄올 처리 후에도 산화 환 원 반응, 일부 탈 탄산 공정 및 싸이 올과 같은 비 효소 화학 반응이 발생할 수 있습니다. 이와 같이,이 프로토콜에 의해 측정 된 이러한 반응에 관여 하는 대사 산물의 어떤 농도 주의 하 여 해석 되어야 한다. 게놈 또는 전사체와는 대조적으로, 대사체는 다양 한 화학적 특성을 가진 분자 들로 이루어져 있습니다. 따라서, 어떤 단일 프로토콜 손실 또는 방해 없이 모든 대사 산물을 추출할 수 있습니다. 이러한 매우 반응성 대사 산물의 보다 정확한 측정을 위해, fractionations 및 유도체 화를 필요로 하는 특정 대사 산물 그룹을 추출 하기 위해 특별히 설계 된 프로토콜이 상담 되어야 합니다. 그러나 여기에 제시 된 프로토콜은 세 륨-MS에의 한 대사체학 분석을 위해 배양 된 세포 샘플 로부터 수성 대사 산물의 간단 하 고 빠른 추출을 기술 한다. 이 논문에서는 본 원고의 초점이 다르기 때문에 CE-MS를 상세히 설정 하는 방법을 설명할 수는 없지만, CE를 설정 하는 세부적인 단계를 설명 하기 위해서는 별도의 전용 기사가 필요할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
쇼 나이 지역 산업 진흥 센터의 모든 회원 들에 게 도움을 주셔서 감사 합니다. 이 작품은 야마가타 현과 쓰루 오카 시의 연구 기금, 국립 암 센터 연구 개발 기금 [보조금 번호 28-9]에 의해 부분적으로 지원 되었으며, 일본 과학 진흥 협회 (JSPS)가 카 엔 나는 [교부 수 17K07189] HM.
자료
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Thermo Scientific | AMQAX1000 | Countess II automated cell counter |
| Automatic integration software | Agilent Technologies | MassHunter G3335-60041 | version B.02.00 |
| CE system | Agilent Technologies | Agilent 7100 CE system | |
| CE/MS adapter kit | Agilent Technologies | G1603A | |
| CE-ESI-MS Sprayer kit | Agilent Technologies | G1607A | |
| Cell counting chamber slide | Thermo Scientific | C10282 | Countess cell counting chamber slides |
| Centrifugal filter device, 5 kDa | Human Metabolome Technologies | ULTRAFREE MC PLHCC, UFC3LCCNB-HMT | |
| Conical sterile polypropylene tube, 15 ml | Thermo Scientific | N339651 | |
| Conical sterile polypropylene tube, 50 ml | Thermo Scientific | N339653 | |
| Costar stripette, 10 ml | Corning | 4488 | |
| Costar stripette, 5 ml | Corning | 4487 | |
| D(-)-Mannitol | Wako | 133-00845 | 500 g |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma-Aldrich | D8537-500ML | |
| Electrophoresis buffer | Human Metabolome Technologies | H3301-1001 | for cation analysis |
| Electrophoresis buffer | Human Metabolome Technologies | H3302-1021 | for anion analysis |
| Fetal bovine serum | Biowest | S1780 | |
| Filter tip, 1000 μl | Watson | 124P-1000S | |
| Filter tip, 20 μl | Watson | 124P-20S | |
| Filter tip, 200 μl | Watson | 1252-703CS | |
| Fused silica capillary | Polymicro Technologies | TSP050375 | 50 μm i.d. × 80 cm total length |
| HCC827 | American Type Culture Collection | CRL-2868 | |
| Internal standard solution | Human Metabolome Technologies | H3304-1002 | |
| Isocratic pump | Agilent Technologies | Agilent 1100 Series Isocratic Pump | |
| Methanol | Wako | 138-14521 | 1 L, LC/MS grade |
| Microtube, 1.5 ml | Watson | 131-415C | |
| Operating Software | Agilent Technologies | ChemStation G2201AA | version B.03.01 for CE |
| PC-9 | RIKEN Bio Resource Center | RCB4455 | |
| RPMI-1640 | Sigma-Aldrich | R8758-500ML | |
| Sterile tissue culture dish, 100 mm | Corning | 430167 | |
| Time-of-flight mass spectrometer | Agilent Technologies | Agilent G1969A Time-of-Flight LC/MS | |
| Trypan blue solution, 0.4% | Thermo Scientific | T10282 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Ultrapure water | Merck | Milli-Q water | 18.2 MΩ·cm pure water |
| Volumetric flask, 50 ml | Iwaki | 5640FK50E | TE-32 |
참고문헌
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review Cell and Developmental Biology. 27, 441-464 (2011).
- Soga, T. Cancer metabolism: key players in metabolic reprogramming. Cancer Science. 104 (3), 275-281 (2013).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and Cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Fukuda, H., et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. European Journal of Nuclear Meddicine and Molecular Imaging. 7 (7), 294-297 (1982).
- Miles, K. A., Williams, R. E. Warburg revisited: imaging tumour blood flow and metabolism. Cancer Imaging. 8, 81-86 (2008).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Levine, A. J., Puzio-Kuter, A. M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes. Science. 330 (6009), 1340-1344 (2010).
- Makinoshima, H., et al. Epidermal growth factor receptor (EGFR) signaling regulates global metabolic pathways in EGFR-mutated lung adenocarcinoma. The Journal of Biological Chemistry. 289 (30), 20813-20823 (2014).
- Makinoshima, H., et al. Signaling through the Phosphatidylinositol 3-Kinase (PI3K)/Mammalian Target of Rapamycin (mTOR) Axis Is Responsible for Aerobic Glycolysis mediated by Glucose Transporter in Epidermal Growth Factor Receptor (EGFR)-mutated Lung Adenocarcinoma. The Journal of Biological Chemistry. 290 (28), 17495-17504 (2015).
- Makinoshima, H., et al. Metabolic Determinants of Sensitivity to Phosphatidylinositol 3-Kinase Pathway Inhibitor in Small-Cell Lung Carcinoma. Cancer Research. 78 (9), 2179-2190 (2018).
- Sato, Y., et al. Metabolic Characterization of Antifolate Responsiveness and Non-responsiveness in Malignant Pleural Mesothelioma Cells. Frontiers in Pharmacology. 9, 1129 (2018).
- Ohashi, Y., et al. Depiction of metabolome changes in histidine-starved Escherichia coli by CE-TOFMS. Molecular BioSystems. 4 (2), 135-147 (2008).
- Ooga, T., et al. Metabolomic anatomy of an animal model revealing homeostatic imbalances in dyslipidaemia. Molecular BioSystems. 7 (4), 1217-1223 (2011).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Patra, K. C., Hay, N. The pentose phosphate pathway and cancer. Trends in Biochemical Sciences. 39 (8), 347-354 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유