Method Article
재발 동작 전위 기록을 위한 멀티웰 마이크로 전극 어레이의 인간 iPSC 유래 심근구 네트워크
* 이 저자들은 동등하게 기여했습니다
요약
본 문서는 멀티웰 MEA 플레이트상에서 배양된 인간 유도 만능 줄기 세포 유래 심근세포(hiPSC-CM) 네트워크의 개발을 위한 프로토콜 세트를 함유하고 있으며, 작용 전위 측정을 위해 세포막을 가역적으로 전기화한다. 높은 처리량 기록은 며칠 동안 반복적으로 동일한 셀 사이트에서 얻어진다.
초록
심장 안전 검사는 약물 발견 및 치료에 가장 중요합니다. 따라서, 효율적인 약물 검사를 위해 hiPSC 유래 심근세포(hiPSC-CM) 제제에 대한 새로운 고처리량 전기 생리학적 접근법의 개발이 매우 필요하다. 다중 전극 어레이 (MEA)는 흥분 성 세포의 필드 잠재적 인 측정을 위해 자주 사용되지만, Joshi-Mukherjee 및 동료에 의해 최근 간행물은 반복 적 행동 전위 (AP) 기록에 대한 응용 프로그램을 설명하고 검증했습니다. 며칠 동안 동일한 hiPSC-CM 준비에서. 여기서 목적은 MS를 시드하고 1 μs의 시간 분해능으로 전기를 통해 AP 파형을 측정하기 위한 상세한 단계별 방법을 제공하는 것입니다. 이 접근 방식은 신뢰할 수 있는 전기 생리학적 조사를 위해 처리량이 높은 AP 측정을 위한 세포내 액세스를 얻기 위해 사용하기 쉬운 방법론의 부족을 해결합니다. 멀티웰 MEA 플레이트에서 hiPSC-C를 도금하기 위한 자세한 작업 흐름 및 방법에 대해 논의하여 관련있는 모든 단계에서 중요한 단계를 강조합니다. 또한, 신속한 데이터 처리, 추출 및 분석을 위한 맞춤형 MATLAB 스크립트가 파형 분석에 대한 포괄적인 조사를 위해 보고되어 관련되는 다양한 AP 지속 시간 파라미터에 대한 형태학의 미묘한 차이를 정량화합니다. 부정맥과 심장 독성.
서문
인간 유도 만능 줄기 세포 유래 심근세포(hiPSC-CM)는 실험실 1,2,3,4,5,6의 증가수에 대한 금 본위제입니다. ,7,8,9,10. 구타 배아 몸11,12,13 및 단층3,7,10,11,12, 13,14,15,16,17 분화는 심근세포 생산을 위한 바람직한 방법이며 다중전극 어레이(MEA)는 일반적인 양상이 되었다. 이러한 네트워크의 전기 역학을모니터링18,19,20. 비트 속도, 진폭, 지속 시간 및 RR 간격과 같은 필드 전위 (FPs)에서 추출 할 수있는 매개 변수는 자발적으로 단층18,21을치는 기준 전기 생리학적 반응입니다. 22,23,이러한 세포외 FP 신호의 기초가 되는 작용 전위(AP) 성분은24를추정하기 어렵다. 직접 재발 AP 측정을 위한 MEA 의 응용의 발견에 대한 당사의 최근 간행물은 여러 재분극 단계에서 광범위한 파형 분석을 통해 예시적인 세포 내 AP 판독에 대한 방법론의 증거를 제공합니다. hiPSC 파생 심근 세포 네트워크의 배치3. 이 연구에서 우리는 hiPSC 유래 심근세포의 네트워크에 전기 포어레이팅 펄스를 전달하면 AP 기록을 위한 세포내 접근을 가능하게 한다는 것을 입증했습니다. 이러한 과도 AP 기록은 부상 부위3,25,26을통해 관찰된 막 횡단 전위 회복에 의존한다. MEA 및 패치-클램프를 통해 기록된 파형은 유사한 AP 형태와 유사한접근법 3의 신뢰성을 검증하는 것으로 나타났다.
몇몇 실험실은 주문을 받아서 만들어진 MEA18,21,26,27,28,29를 사용하여 각종 전기 전자세포에서 AP를 측정했다고 보고했습니다. 도 30은일관되고 재발하는 AP 측정을 위해 MEA를 사용하는 신뢰성은 평가되지 않았다. 현재, 금 표준 패치 클램프 기술은 단말 기록7,31로 제한되는 반면, MEA 기반 AP 측정은 과도하므로 동일한 셀에서 여러 번 수행될 수 있다. 또한 최소한의 필터링이 필요한 밀리볼트 범위에서 고품질 AP 신호를 쉽게 기록할 수 있음을 보여줍니다. 따라서 연구원은 MEA를 사용하여 동일한 제제에서 급성뿐만 아니라 만성 약물 연구를 수행 할 수 있습니다. 또한,이 기술은 짧은 시간에 전기 바이임 라이브러리를 생성하는 동시 FP / AP 측정을 허용합니다. 부정맥 예측 및 약물 관련 심장 독성에 대한 강조를 감안할 때24,32,33,34,35,AP 측정의 통합 접근법은 약물 안전및 효능 평가를 강화할 것입니다.
여기서, 우리는 성숙을위한 저온 보존 hiPSC-C의 사전 도금, 2) 멀티 웰 MEA에 hiPSC-C의 해리 및 도금, 3) hiPSC-CM 네트워크에서 FPs 및 AP의 기록, 4) 분석을위한 데이터를 분할 및 추출하기위한 프로토콜을 제시하고 5) 여러 번 재사용할 수 있는 배열을 복원할 수 있습니다. 각 단계는 관련이 있는 모든 곳에서 중요한 단계를 강조하여 최적화되었습니다. 구타 동기화 단층을 보장하기 위해 세포 부착에 대한 요구 사항이 논의되고 반복적 인 전기 생리학 연구를위한 멀티 웰 MEA 복원절차에 대해 설명합니다. 마지막으로, 실험실에서 개발된 맞춤형 GUI가 AP 신호 추출, 품질 보증 및 세분화 워크플로우를 위해 제시되어 AP 파라미터를 정량화하고 분석합니다.
프로토콜
1. 솔루션 및 재료의 준비 (재료 표 참조)
-
6 웰 조직 배양 플레이트 기판 코팅
- 얼음 또는 4 °C에서 코팅 기판을 해동합니다.
- 차가운 DMEM/F12 매질에 1:100 코팅 기판 희석을 준비합니다. 느린 파이펫팅으로 용액을 혼합합니다.
- 6웰 조직 배양 판의 웰당 코팅 기판 용액(단계 1.1.2)의 2 mL을 전달한다.
- 코팅된 조직 배양판을 세포 배양 인큐베이터에 37°C 및 5% CO2에 적어도 7시간 동안 놓고 7일 이내에 사용한다.
-
hiPSC-CM 배양 매체
- CM 염기 배지의 4°C ~ 500 mL에서 해동된 CM 배지 보충제 10 mL를 첨가합니다. 최대 2주 동안 4°C에서 보관하십시오.
- Aliquot는 하루 동안 필요한 양의 미디어를 사용하고 사용하기 전에 실온으로 가져 오십시오.
- hiPSC-CM 해동 배지: hiPSC-CM 배양 배지(1.2단계)를 10% 태아 소 혈청(FBS)과 혼합하여 신선히 준비합니다. 서스펜션을 위해 CM을 해동하기 전에 미디어를 실온으로 가져옵니다.
- Fibronectin 1 mg/mL 스톡 솔루션: Aliquot 200 μL을 1.5 mL 멸균 마이크로퍼지 튜브에 넣고 나중에 사용하기 위해 4°C에서 보관하였다. 얼음에 갓 50 μg/mL 농도의 작업 용액을 준비합니다.
- 멀티웰 세척 액: 0.5 g의 효소 세제와 멸균 이중 증류수 50 mL(ddH 2O)를 결합합니다. 내용물 혼합을 위해 소용돌이. 최대 1주일 동안 4°C에서 걸기 및 보관하십시오.
2. 성숙을위한 냉동 보존 hiPSC-CM의 사전 도금 (그림 1)
참고: 이 섹션은 피더가 없는 단층 방법3,16 및 10일 후 액체 질소에서 냉동 보존된 1-2백만 개의 세포/바이알에서 동결 보존된 hiPSC-CM을 해동 및 배양하기 위한 것입니다. 1바이알로부터의 세포는 6웰 조직 배양판의 2개의 기판 코팅웰로 도금된다. 심근세포는 튜브 바닥에 정착하는 경향이 있으므로 사전 도금 시 부드러운 혼합은 우물 에서 균등한 세포 밀도를 달성하는 데 중요합니다.
- HiPSC-CM의 바이알당 2 mL의 FBS를 15 mL 원추형 튜브로 해동하고 실온으로 가져온다.
- 냉동 보존 hiPSC-C의 바이알을 37°C 수조에 넣고 3분 이상 해동할 수 있도록 부드럽게 소용돌이치세요.
- 즉시 FBS를 함유한 튜브에 바이알 내용체를 옮기고(2.1단계 참조), 소용돌이및 원심분리기를 200 x g에서 5분 동안 혼합한다.
- 상판을 흡인하고 바이알 해동 당 hiPSC-CM 해동 배지의 1 mL에서 세포 펠릿을 재중단한다(단계 1.3 참조). 전사 파이펫을 사용하여 부드러운 삼각작용으로 펠릿을 다시 놓습니다. 세포 생존능력을 평가합니다.
- 2.4단계에서 해동된 hiPSC-CM 의 바이알당 3 mL의 해동 배지를 추가하고 이동 피펫을 사용하여 부드럽게 현탁하여 세포 덩어리를 추가로 해리한다.
- 2 mL의 셀 서스펜션을 기판 코팅 된 6 웰 플레이트의 각 웰에 부드럽게 분배하십시오 (단계 1.1 참조). 37°C 및 5% CO2에서 세포 배양 인큐베이터에 놓는다.
- 24시간 후 신선한 hiPSC-CM 배양 배지로 교체하고 그 후 20일 동안 매주 3회 교체하십시오.
참고 : 세포는 24 h로 기판 코팅을 부착하고 48 시간 후 도금에서 자발적으로 이길 수 있어야합니다 (비디오 1 및 비디오 2참조).
3. 멀티웰 MEA 플레이트 살균 및 코팅(그림 2 및 그림 3)
참고 : 여기에 설명 된 프로토콜은 hiPSC-CM 도금용 유리에 12 마이크로 골드 PEDOT 코팅 전극24 웰 MEA 플레이트를 준비하는 것입니다. 전극이 손상될 수 있기 때문에 플레이트 바닥을 만지지 마십시오.
- 셀 도금 2일 전에, 0.5 mL의 hiPSC-CM 배양 배지(단계 1.2 참조)를 각 웰에 추가하고 MEA의 품질 검사를 위해 신호 대 잡음 비를 확인하기 위해 기준선 기록을 수행합니다.
- 매미를 흡인하고 멸균 ddH2O로 헹구고 밤새 층류 후드 내부의 UV 광 하에서 멸균합니다.
- 세포 도금 전날, MEA 표면의 친수성 치료를 위해 각 우물에 0.1 mL의 FBS를 추가합니다. 실온에서 30 분 동안 배양하십시오. 이 단계는 셀 부착에 필요합니다.
- 잘 당 멸균 ddH2O의 0.5 mL로 FBS를 흡인하고 헹구는다. 한 번 더 반복합니다.
- 하룻밤 동안 층류 후드에서 건조 플레이트를 둡니다.
- 육수에서 차가운 DMEM/F12 배지에 50 μg/mL 피브로넥틴의 작동 희석을 준비합니다(1.4단계 참조). 용액을 얼음 위에 보관하십시오.
- 피펫 5 μL의 작업 피페넥틴 희석(3.6 참조)을 조심스럽게 각 웰의 중앙에 액적을 분배하여 12개의 전극을 모두 커버한다. 물방울이 건조되는 것을 방지하기 위해 24개의 우물에서 신속하게 작업하는 것이 중요합니다.
- 즉시 전체 접시 표면을 커버멸 ddH2O를 포함하는 가습 챔버 내부의 상승 표면에 섬유넥틴 코팅 멀티 웰 MEA 플레이트를 배치합니다. 세포 배양 인큐베이터에서 3시간 동안 멀티웰 MEA 플레이트와 챔버를 놓는다.
참고 : 가습 챔버에 24 웰 MEA 플레이트를 배치하는 것은 잠복기 동안 섬유넥틴 방울이 건조되는 것을 방지하는 데 중요합니다.
4. 멀티웰 MEA 플레이트의 hiPSC-CM 해리 및 도금(그림 3)
참고: MEA 피브로넥틴 배양이 완료되기 약 1시간 전에 이 단계를 시작하십시오. 세포 해리 액이 37°C이고 iPSC-CM 해동 매체가 실온에 있는지 확인합니다. 해리 방법은 MEA 도금에 대한 약 90%의 가능한 CM을 얻기 위해 기판 코팅 된 6-웰 플레이트 (단계 2 참조)에 배양 된 후 분화 hiPSC-CM에 대해 30 일 동안 최적화되었습니다. 세포 사멸을 방지하기 위해 삼투를 하는 동안 기포를 도입하지 않도록 주의해야 합니다.
- 30일 후 분화된 hiPSC-CM 배양물로 6웰 조직 배양 접시의 각 웰로부터 배양배지를 흡인하고(단계 2.7 참조) 웰당 멸균 D-PBS 2 mL로 세척한다.
- 잘 당 미리 온난화 된 세포 해리 액 1 mL (재료 표참조)를 넣고 37 °C에서 4 분 동안 배양하십시오. 전사 파이펫을 사용하여 부드럽게 삼중화하여 분리를 위해 셀을 느슨하게 하십시오. 대부분의 세포가 여전히 부착되어 있는 경우, 37°C에서 또 다른 3분 동안 배양하고 다시 삼중화한다. 이 추가 배양최대 세포 복구에 대 한 도움이 될 것입니다. 낮은 세포 생존력을 초래할 수 있기 때문에 7분 이상 배양하지 마십시오.
- 전사 파이펫을 사용하여 모든 해리된 세포를 hiPSC-CM 해동 배지를 포함하는 원추형 튜브로 풀링합니다(1.3단계 참조). 세포 해리 액의 활성을 차단하기 위해 적어도 두 배의 매질 (수확되는 웰빙 당 2 mL)에서 세포를 일시 중단하는 것이 좋습니다.
- 원심분리기는 200 x g에서 5분.
- 펠릿이 표면에 느슨하게 부착되어 hiPSC-CM 해동 매체의 0.1 mL에서 재중단될 때 용액을 조심스럽게 흡인합니다. 전사 파이펫을 사용하여 펠릿을 부드러운 삼각측량으로 몇 번 다시 놓습니다.
- Aliquot 2 μL의 해리 된 세포를 1.5 mL 마이크로 퍼지 튜브에서 18 μL의 매체로 희석합니다. 20 μL의 Trypan Blue를 추가하고 세포 수와 생존 가능성 평가를 위해 혼합하십시오.
- hiPSC-CM 해동 배지의 적절한 부피를 추가하여 세포 밀도를 6,000셀/μL로 조정합니다. 펠릿을 몇 번 부드럽게 쓸어 넘기면 됩니다. hiPSC-CM은 특히 높은 밀도로 도금될 때 유리 표면에서 쉽게 분리됩니다. 우리는 15 일간의 전기 기록을 달성하기 위해 시딩 밀도 및 도금 조건을 최적화했습니다.
- 준비가 되면 멀티웰 MEA 플레이트를 셀 파종을 위한 층류 후드에 넣습니다. 피브로넥틴이 건조되는 것을 방지하기 위해 다음 두 단계를 한 번에 하나씩 잘 수행하는 것이 중요합니다.
- 전극을 건드리지 않고 P10 파이펫을 사용하여 섬유넥틴 방울을 조심스럽게 제거합니다.
- 즉시 5 μL 세포 방울 (30,000 셀)을 모든 12 개의 전극을 덮는 MEA 플레이트의 우물 중앙에 분배하십시오. 모든 24개의 웰이 도금될 때까지 단계를 반복합니다. 플릭에 의한 세포 현탁액의 간헐적 혼합이 권장됩니다.
- 멀티웰 MEA 플레이트를 느슨하게 덮인 가습 챔버에 다시 놓고 세포 부착을 위해 37°C 및 5% CO2에서 세포 배양 인큐베이터로 되돌아갑니다.
- P200 파이펫을 사용하여 세포를 방해하지 않고 각 우물에 hiPSC-CM 해동 배지 200 μL을 조심스럽게 추가하십시오. 웰 의 측면에 미디어를 드롭 와이즈로 추가합니다.
- 멀티웰 MEA 플레이트를 세포 배양 인큐베이터에 다시 놓습니다.
- 24 시간 포스트 도금에서 신선한 hiPSC-CM 배양 매체로 교체하십시오. 심근세포의 자발적인 박동은 이 시점에서 관찰될 수 있다(비디오 3참조).
- 실험이 끝날 때까지 2일마다 미디어를 변경합니다.
5. hiPSC-CM 전기 간계 및 신호 수집 (그림 4 – 6)
참고: 이 프로토콜은 고처리량 전극 신호(24개의 웰 각각에 대해 12개 사이트)를 동시에 기록하기 위한 것입니다. 24웰 멀티웰 MEA 시스템은 수집 소프트웨어와 함께 사용됩니다(재료 표참조). 모든 MEA 기록은 37°C에서 수행됩니다.
- 인터페이스 보드를 켜고 수집 소프트웨어를 시작합니다. 멀티웰 MEA 헤드스테이지가 37°C 온도에 도달할 때까지 충분한 시간을 두세요(그림 4의 화살표 1 참조).
- 4단계에서 멀티웰 MEA 플레이트를 멀티웰 MEA 헤드스테이지에 삽입하여 기록 플랫폼 위에 덮고 삽입 버튼을 클릭합니다(그림 4의화살표 2 참조). 레코딩을 시작하기 전에 온도가 안정될 수 있도록 합니다.
-
수집 및 전기 화 설정 조정
- 실험 흐름 정의 아이콘(그림 4의 화살표 3 참조)을 클릭하고 녹화 시간을 2분 또는 원하는 대로 설정합니다.
- 데이터 수집 설정 아이콘(그림 4의 화살표 4 참조)을 클릭하고 샘플링 속도를 20kHz로 설정하고 하이패스 필터를 0.1Hz로 설정하고 로우 패스 필터를 3500Hz로 설정합니다.
- 자극기 설정 아이콘을 클릭합니다(그림 5참조). 자극 정의 탭에서 자극을 1mV, 1ms 및 1Hz의 이파대칭 전압 펄스로 정의합니다. 자극 전극 탭에서 모든 관련 전극을 강조 표시하여 전기 화전 을 선택합니다.
- 탐색 단추를 클릭하여 모든 웰에서 신호를 시각화합니다. 신호 품질 및 정상 상태 상태를 확인합니다. mV 범위의 FP 신호가 있는 전극을 메모합니다. 동일한 버튼을 클릭하여 탐색을 중지합니다. 지금까지 데이터가 기록되지 않았습니다.
- 이동 버튼을 클릭하여 녹음을 시작합니다. 각 웰의 전극은 원시 데이터 창에 FP신호를 표시합니다(그림 6). 30 초 의 기록 후, 자극 버튼을 클릭하고 30 초에 대한 선택한 사이트에서 전기 천공이 일어날 수 있도록; 그런 다음 동일한 버튼을 클릭하여 자극을 중지하고 나머지 60초 동안 녹화를 계속합니다.
참고: 녹음된 파일은 '애플리케이션' 드롭다운 메뉴에서 '리플레이 모드'로 전환하여 재생할 수 있습니다.
6. 재사용을 위한 멀티웰 MEA 플레이트 클리닝
- 최종 실험 후, 각 우물의 모든 미디어 내용을 흡족히 하고 조심스럽게 전극 표면에 닿지 않도록 하여 멀티웰 플레이트의 모든 웰을 청소합니다.
- 잘 당 멸균 ddH2O의 1 mL를 추가합니다. 흡입하고 한 번 반복합니다.
- 웰당 0.3 mL의 멀티웰 클리닝 솔루션(단계 1.5 참조)을 추가합니다. 실온에서 밤새 배양하여 세포와 이물질을 빼내.
- 다음 날 아침, 용액을 흡인하고 멸균 ddH2O. 5 - 7 분 동안 1 mL로 헹구고 흡인합니다. 5회 반복합니다.
- 잘 당 멸균 ddH2O의 0.5 mL를 추가합니다. 세척된 MEA의 품질 검사를 위해 세척된 멀티웰 플레이트의 기준선을 기록합니다(그림 7).
- 사용할 준비가 될 때까지 4°C에서 보관하십시오.
7. 데이터 파일 변환 및 내보내기
참고: 모든 레코딩에 대해 MWR, MWC, MWD 및 MWS 파일의 4개의 데이터 파일이 생성됩니다. 변환기 소프트웨어를 사용하여 MWD 파일을 H5 파일로 변환하여 사용자 지정 스크립트를 사용하여 후속 분석을 할 수 있습니다(보충 파일 1참조).
- 변환기 소프트웨어를 시작합니다(재료 표참조).
- 파일 메뉴에서 입력 경로 설정을 선택합니다. 관심 있는 데이터 파일이 포함된 폴더를 선택합니다.
- 파일 메뉴에서 출력 경로 설정을 선택합니다. 변환된 파일을 저장할 폴더를 선택합니다.
- 관심 있는 MWD 파일을 강조 표시합니다.
- HDF5로 내보내기 버튼을 클릭합니다.
8. 데이터 세분화 및 분석 (그림 8-10)
참고: Matlab 기반 사용자 지정 소프트웨어는 다양한 FP 및 AP 데이터 매개 변수를 분류하고 추출하는 데 사용됩니다. 소프트웨어는 주문형으로 사용할 수 있습니다.
- Matlab을 사용하여 파형 분석 코드를 실행합니다(GUI의 기본 창보기는 그림 8 참조).
- 파일을 클릭하고 프로세스 .h5를선택합니다.
- 위의 7단계에 따라 작성된 mwd.h5 파일을 찾아 선택합니다.
- 디렉터리 저장 버튼을 클릭하여 출력 파일의 저장 위치를 변경합니다.
- 관심 있는 전극/웰 조합을 선택한 다음 Queue 버튼을 클릭하여 신호 처리 큐를 만듭니다. 이 단계를 반복하여 큐에 처리할 더 많은 전극/웰 조합을 추가합니다.
- 세포가 약물로 처리된 경우 메드 이름/메드 농도를직접 클릭하여 큐를 편집합니다(그림 8).
- 대기열이 완료되면 파형 초기화 버튼을 클릭합니다. 이렇게 하면 세분화를 위해 신호가 식별되고 추출되는 예비 처리가 시작됩니다.
- 확대 단추를 클릭하고 커서를 사용할 수 있는 작업 잠재 영역을 선택합니다(그림 9).
- 보관 단추를 클릭하고 패널을 검토합니다. 모든 파형에 대해 피크(빨간색 'x')와 트로프(노란색 원)가 감지되고 정규화된 동작 전위가 중첩됩니다. 보관 단추를 클릭하고 큐의 다음 추적으로 이동합니다(그림10).
- 큐의 나머지 전극/웰 조합 신호에 대해 8.8-8.9 단계를 반복합니다.
참고: .csv 파일은 모든 파형에 대해 측정된 APD 매개변수로 생성됩니다. 각 .h5 파일에 대한 .mat 파일도 저장되어 분할된 데이터를 추가로 처리할 수 있습니다.
결과
해동 후 hiPSC-CM의 생존 가능성과 도금 밀도는 멀티웰 MEA 배양에 매우 중요합니다. 50% 이상의 생존율을 가진 6웰 조직 배양 판의 두 개의 우물에 1-2백만 hiPSC-CMs/바이알을 사전 도금하면 48시간에서 자발적으로 구타하는 건강한 단층 문화를 생성합니다. 비 근세포 인구. 이러한 단층은 멀티웰 MEA 도금에 대해 해리될 때 일반적으로 일관되지 않은 결과와 나쁜 품질 신호를 생성하므로 폐기되어야 합니다. 도 1은 48시간 포스트 도금에서 최적 hiPSC-CM 배양물의 예를 나타낸다. 멀티웰 MEA에서 직접이 아닌 기판 코팅 된 조직 배양 판에 MS를 해동하면 세포 회복 및 성숙을 허용합니다3. 어레이에 저온 보존된 CM의 직접 도금은 일관되지 않은 결과를 생성하기 때문에 권장되지 않습니다.
해리된 CM의 품질 외에도, 멀티웰 MEA에 대한 세포 부착은 세포 밀도 및 피브로넥틴 코팅 기술에 크게 의존한다. 섬유넥틴 액적 크기는 CM이 섬유넥틴 코팅 영역의 경계를 준수하기 때문에 매우 중요합니다. 이러한 이유로, 피브로넥틴 용액의 5 μL만이 전극 어레이 영역에 직접 분배된다. 물방울이 분산되지 않도록하려면 코팅 시 우물 표면이 완전히 건조되어야합니다. 도 2는 최적의 준비를 위한 단계별 전처리 회로도가 있는 멀티웰 MEA 플레이트의 레이아웃을 나타낸다. 또한, 피브로넥틴이 다중웰 MEA 플레이트를 건조시키는 것을 방지하기 위해 3시간 이하의 잠복기 동안 가습 챔버 내부에 배치되어야 한다(단계 3.8 참조). 잠복기가 완료되면 CM 도금 직전에 각 우물에서 섬유넥틴 방울을 제거하고 다음 잘 도금으로 진행하는 것이 중요합니다. MC를 신속하고 신중하게 분배하는 것은 성공적인 셀 부착의 열쇠입니다.
hiPSC-CM 배양액은 30일 후 분화후 효소 세포 해리 방법을 사용하여 멀티웰 MEA 도금에 대해 해리된다(단계 4 참조). CS는 섬유넥틴 코팅 MEA 표면에 3시간 까지 부착하고 어레이를 덮는 단층은 24시간 후도금 후 볼 수 있다(그림 3). 단층의 동시 박동은 24-48 시간에서 관찰될 것이다. 세포 액적 분산은 배양 밀도에 영향을 미치거나 심지어 건조 및 세포 사멸을 초래할 것이다. 어레이에 직접 정확한 셀 배치가 가장 중요하므로 최적의 도금을 위해 기술을 연습해야 합니다. 기준 전극에 대한 전지 접착은 전기 신호 생성을 방해합니다. 최적의 CM 배치 및 24시간 이후의 배양 이미지는 그림 3을 참조하십시오.
멀티웰 MEA에서 배양된 CM은 48시간 후 도금에서 전기 활동에 대한 품질 검사를 받습니다. 일반적으로 FP 신호 진폭은 약 4일 3일 만에μV 범위에서 mV로 증가합니다. 네트워크 내의 전극의 50%와 전체 네트워크의 70%가 FP 신호를 생성하지 않는 경우 네트워크 또는 배양이 최적이 아니며 폐기해야 합니다. 품질 검사를 통과한 문화권만 FP 및 AP 분석을 위해 처리됩니다. 도 6은 양호및 표준 이하FP 신호의 예를 나타낸다.
전기 개공 매개 AP 기록은 MEA 후 48시간 배양물로부터 여러 번 수득될 수 있다. 전기 천공을 사용하여, 우리는 여러 hiPSC 파생 심근 세포 네트워크에서 고해상도 AP를 기록하기 위해 세포 내 액세스를 얻었다. 30초용 저전압 펄스(1V, 1ms, 1Hz)는 FP를 AP로 일시적이고 가역적인 변환을 위해 전달되었습니다. 전기 천공은 전극의 약 75 %에서 AP 측정을위한 성공적인 세포 내 액세스를 허용합니다. 전기 신호는 30 초 전 전기 화기, 30 초 동안 및 1 분 전기 천공 후를 포함하는 2 분 동안 기록됩니다. 10s AP 파형 10초 의 전산 후 열차는 신호 품질 및 분석을 위해 모든 사이트에서 평가됩니다. 순수 AP 신호를 준수하지 않는 모든 추적은 삭제됩니다. AP 진폭이 FP 신호와 상관관계가 있는지 조사하기 위해 288개 사이트를 모두 전기화하여 파형을 동시에 기록했습니다. 두 개의 상이한 전극으로부터 동일한 셀 사이트에서 기록된 대표적인 FP 및 AP 신호는 도 11A에도시되어 있다. 우리는 FP 진폭과 같은 세포 사이트에서 기록 된 포스트 전기 AP 진폭 사이의 상관 관계를 관찰하지 않았다. 부가적으로, 0, 24, 48, 72 및 96h에서 동일한 세포 부위의 다중 전기천자는 시간이 지남에 따라 AP 형상에 유의한 영향을 미치지 않았다(도11B).
시스템의 높은 처리량 특성을 감안할 때 RR 간격, 순간 주파수 및 차동 동작 전위 기간과 같은 관심 있는 매개 변수를 추출하고 정량화하는 수동 기술은 비효율적이고 시간이 많이 걸립니다. 요청 시 연구 커뮤니티에서 사용할 수 있는 맞춤형 MATLAB 스크립트를 사용하여 1 μs 해상도의 파형 측정을 수행합니다. 전기개공화 시간포인트는 추출된 신호와 중첩되어 10초의 AP 포스트 전기포기를 식별하여 신호 추출, 품질 보증 및 세분화 워크플로우를 수행합니다(그림8, 그림9, 그림) 10).사용자 인터페이스는 가이드로 중첩 전기 천공 지표를 사용하여 원하는 세그먼트의 선택을 할 수 있습니다. 세분화된 파형은 서브루틴에 의해 처리되어 개별 AP 파형을 더욱 식별합니다. 이는 피크 감지를 통해 완료되며, 각 사이클마다 최고 전압과 최저 전압이 식별됩니다. 이 프로세스가 완료되면 진폭이 정규화되고 연결 시간 벡터가 이동되어 피크 값 1에서 시간 0을 정의합니다. 개별 사이클을 따라 교차점의 보간은 APD 측정을 결정하는 데 사용되었다. 따라서 AP 파형 세분화를 위한 부분 자동화 워크플로우를 통해 단기간에 여러 배양물 에서 다양한 APD 파라미터에 대한 효율적인 데이터 분석을 수행할 수 있습니다. 실시간 데이터 분석을 위해 FP 및 AP에 대한 포함 및 제외 기준의 추가 자동화가 진행중입니다.
멀티웰 MEA 플레이트의 중요한 장점은 여러 번 재사용할 수 있다는 것입니다. 이러한 복원을 통해 비용 효율적이고 일관된 데이터 수집을 위한 반복적인 전기 생리학 연구가 가능합니다. 6개의 복원 후 동일한 배열의 AP 기록은 그림 12에나와 있습니다. 신호 대 잡음 비율은 여러 재사용에서 유사합니다. 반복적인 전기 생리학 연구를 위한 어레이의 신뢰성을 입증하기 위해 총 3815개의 AP 파형이 3개의 복원 배치에서 풀링되고 AP 지속 시간 데이터가 추출되어 결과의 반복성을 조사합니다. 개별 파형 APD30,APD80,삼각측량(APD 80—APD30)및 분수 단축(APD 80-APD30)에대한 분포 플롯이 표시됩니다(APD80)/(APD80)).

그림 1: 성숙을 위해 저온 보존 hiPSC-CM의 사전 도금. (A) 10일 후 분화 후 1바이알을 사전 도금하기 위한 세포 처리 [B] 단계 대비 이미지의 성공(왼쪽) 및 실패한(오른쪽) hiPSC 배양물. 스케일 바: 275 μm. 성공적인 14일 및 24일 후 차별화 문화 예는 비디오 1 및 비디오 2를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 멀티웰 MEA 플레이트 설정 및 준비. (A) Multiwell MEA 플레이트 회로도: 플레이트는 각각 12개의 마이크로전극 어레이와 4개의 주변 기준 전극을 포함하는 24개의 웰(A1~D6)으로 구성되어 있습니다. 전극 직경 : 30 μm / 인터 전극 거리 : 300 μm. 기록은 동시에 288 전극에서 얻을 수있다. (b) hiPSC-CM 도금 전에 실시되어야 하는 살균 및 친수성 치료 단계. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 멀티웰 MEA 플레이트상에서 hiPSC-CM 해리 및 도금. (A) 각 우물에 대한 hiPSC-CM MEA 도금 단계의 회로도. (B) 4개의 기준 전극으로 확산되지 않고 12개의 전극을 모두 덮는 올바른 세포 방울 배치를 보여주는 현미경 이미지. (C) 24시간 후 도금에서 MEA상에서 예시적인(왼쪽) 및 최적이 아닌 hiPSC-CM 플래팅의 위상 대비 현미경 이미지. 배율 막대 = 275 μm. 성공적인 MEA 도금 예제는 비디오 3을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 멀티웰 스크린 수집 소프트웨어. 화살표는 텍스트에서 참조되는 주요 기능 및 기능의 위치를 나타냅니다: 온도 제어 (1) 패널은 실험 전반에 걸쳐 실시간 온도 모니터링을 허용합니다. 삽입/꺼미(2) 버튼이 멀티웰 MEA 플레이트를 끼우고 놓습니다. 실험 흐름(3) 함수 정의기능을 통해 사용자는 레코딩 기간을 설정할 수 있다. 데이터 수집 설정(4) 기능을 통해 사용자는 샘플링 속도 및 수집 필터 설정을 설정할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: hiPSC-CM 전기 포공 및 신호 수집 . 자극 정의 탭을 사용하면 사용자가 전기 펄스 파라미터를 정의할 수 있습니다. 자극 전극 탭을 통해 사용자는 전극을 선택할 수 있습니다. 288개의 전극의 모든 조합을 선택할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 전기 활동에 대한 Multiwell MEA의 품질 검사. 멀티웰- 최적의 (A) 및 하위 표준(B) FP 신호의 대표적인 예와 원시 데이터 창을 보여주는화면 수집 소프트웨어. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 새 어레이와 복원된 어레이의 FP 및 AP 신호입니다. 멀티웰 MEA 효소 세척단계 (A). 새로운 어레이의 기준선 신호는 최소한의신호 대 잡음비(B) 및 FP 신호가 네트워크(C)의 전기적 활성을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 데이터 세분화 및 분석. 파형 분석을위한 GUI의 기본 창 보기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9: 데이터 세분화 및 분석. 파형 버튼을 초기화하여 세분화를 위해 AP 파형을 식별하고 추출하고 관심 있는 동작 잠재 영역을 확대 및 선택하여 예비 처리를 시작합니다. 빨간색 원은 전기 개화 지표입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 10: 데이터 세분화 및 분석. 모든 파형에 대해 피크(빨간색 'x')와 트로프(노란색 원)가 감지되고 정규화된 AP가 파형의 품질 검사를 위해 중첩됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 11: 동일한 셀 사이트에서 여러 레코딩을 위한 FP 신호에 대한 AP 진폭 의존도. μV 범위(A, 왼쪽상단 패널) 또는 mV 범위(A, 오른쪽 상단 패널)의 FP 진폭은 두 개의 독립전극에서 기록되어 mV 범위(A, 왼쪽 아래 및 오른쪽 패널)에서 AP 진폭을 생성하여 FP 진폭과 및 상관 관계를 나타내지 않습니다. 전기 화 후 AP 진폭. 각 레코딩에 대해 정규화된 AP 파형은 각 레코딩에 표시된 대로 중첩됩니다. 0 내지 96h에서 동일한 세포 부위의 여러 전기 천자는 멤브레인 전기역학 (B)의 추적을 허용하는 고품질 AP 파형을 생산했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
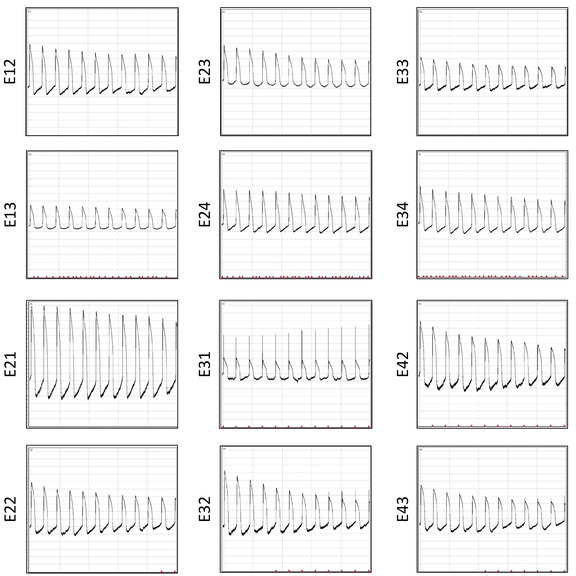
그림 12: 6번의 복원 후 AP 녹화. 동일한 웰에서 12개의 전극에서 동시에 10초의 포스트 전기화로 기록된 AP 파형이 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 13: 여러 수복수작업에서 APD 매개변수 히스토그램. 개별 파형 APD30 (A), APD80 (B), 삼각측량 (APD80—APD30)(C) 및 분수 단축 ((APD80-APD30)/(APD 80)에대한분포 플롯 (D)가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
추가 파일. 동영상 1-3. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
수년에 걸쳐, MEA의 적용은 그들의 전기 생리학적 특성을 연구하기 위해 흥분성 세포의 FP 측정을 수행하는 것으로 제한되어 왔다36,37,38,39. 사용자 정의 MEA 기반 기술18,29,30을사용하여 전기 전지에서 AP 추적을보고 한 그룹은 소수에 불과하다. 그러나, 이러한 접근법은 동일한 제제에서 반복되는 기록에 대해 조사되지 않았다. 우리는 동시에 여러 hiPSC-CM 네트워크에서 일 동안 동일한 세포 사이트에서 AP를 연구하기위한 혁신적이고 정확한 방법론을 개발3. 우리의 간행된 연구 결과에서는, multiwell 마이크로 금 MEA 플랫폼은 높은 정밀도 및 1 μs의 시간 분해능을 가진 hiPSC-CM 배양물의 다중 배치에서 AP 파형 라이브러리를 생성하기 위하여 이용되었습니다. 여기에 설명된 프로토콜은 높은 처리량의 AP 레코딩을 위한 동기화 CM 네트워크의 효율적인 개발을 위해 어레이에서 hiPSC-CM의 시드를 설명합니다. 프로토콜의 몇 가지 중요한 단계는 다음과 같습니다 : 1) 냉동 보존 뱅킹을위한 품질 제어 CM의 여러 고순도 배치의 생산, 2) 사전 도금 및 성숙을위한 매우 실행 가능한 후 해동 후 CM, 3) CM을위한 멀티 웰 MEA 플레이트의 치료 시드, 4) HIPSC-CM 배양 해리는 MEA 도금에 대한 30일 후 분화, 및 5) 다중 재사용을 위한 MEA의 복원.
hiPSC 차별화의 일괄 배치 대 배치 변형은 실험 결과에 영향을 줄 수 있습니다. 분화의 단층 방법은 고퍼센트 심근세포 생산3,40에대해 사내에서 최적화되었다. 우리의 배양의 MLC2v 와 TNNT2 마커의 FACS 분석은 ≥90% 심실 같이표현형 3를 보여줍니다. 이러한 품질 제어 문화는 실험 연구를 위해 냉동 보존됩니다. 현재 분화 접근법은 결절, 심방 및 심실 유사 세포3,16,17,41의이기종 혼합을 산출한다. 따라서 CM 아류형 인구 보강에 사용되는 전략은 문화의 특이성을 더욱 향상시킬 수 있습니다. 추가적으로, 조직 공학 접근은 그들의 성숙을 강화하기 위하여 이용될 수 있습니다. 여기서 제안된 방법은 다른 CM 소스에 대해 쉽게 구현할 수 있습니다.
MEA를 사용하여 기록된 AP 파형은 광학 매핑42,43,상보성 금속 산화물 반도체 기반 MEA18,21및 시뮬레이션 AP에 의한 심근세포의 네트워크에서 기록된 것과 유사했습니다. FP 레코딩20을사용하여 . MEA Hai 및 Spira25를 통한 AP 측정 메커니즘을 해결하기 위해 전기 기공-전극 인터페이스가 확립된 날카로운 유리 마이크로 전극 기술을 모방한다는 것을 입증했습니다. 그러나, 우리의 연구에서 나머지 멤브레인 전위 및 진정한 진폭 값은 MEA 시스템의 전극-전극 인터페이스가 보정되지 않고 진폭이 감도 및 해상도의 함수라는 점을 감안할 때 확립될 수 없습니다. 기술. AP 진폭과 관련하여 광학 매핑과 유사한 제한 사항이 있습니다.
멀티웰 MEA 기반 FP/AP 판독은 여기에서 보고된 약물 안전 성 평가를 위한 새로운 가능성을 열어줍니다. 자발적이지만, 이러한 hiPSC-CM 단층은 일정한 속도로 이길 수 있습니다. 여러 네트워크에서 APD 파라미터를 분석하여 전기 이질성에대한 통찰력을 제공합니다(그림 13). 그러나 포괄적인 APD 복원 해석에는 이전 확장기 간격을 통합해야 합니다. 또한, 96시간 이상 동일한 세포 부위에서 기록된 고품질 AP 파형(그림11B)은발달 및 질병에서 가치가 있을 멤브레인 전기역학을 시간이 지남에 따라 추적하는 최초의 보고서입니다.
AP 파라미터를 정량화하기 위해 여기에 설명된 프로토콜은 화합물을 시험하기 위해 투여량-응답 곡선을 생성하는데 사용될 수 있다. 최근 Edwards et al.3에 의해 보고된 바와 같이, 노르에피네프린, 이소프로테레놀 및 E 4031의 투여량 반응은 다양한 재분극 단계에서 APD에 대해 플롯된다. 발표된 연구는 AP 파형의 용량 의존적 미묘한 변화를 실시간으로 식별하기 위한 접근법의 정확성과 신뢰성을 입증하였다. 이 기술은 다양한 전기 생리학적 반응을 이해하기 위한 다른 화합물 또는 소분자 라이브러리를 위해 쉽게 확장될 수 있었다.
이 연구에서 제시된 AP 측정을 위한 MEA 기지를 둔 접근은 전기 생리학자 뿐 아니라 세포 생물학자 및 in-silico modelers에 뿐만 아니라 관심사일 것입니다. 또한 hiPSC-CM의 동일한 셀 사이트에서 녹음된 FP/AP 기록을 통해 연구원은 단기간에 다양한 흥분셀룰러 네트워크의 생체 전기 데이터 라이브러리를 생성할 수 있습니다. 이러한 자원의 가용성은 약물 발견 및 질병 모델링에 유용할 것입니다.
공개
저자는 공개 할 것이 없다.
감사의 말
없음
자료
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
참고문헌
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726(2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100(2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110(2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206(2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유