JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐에 대 한 확장 된 공포 컨디셔닝 프로토콜을 사용 하 여 공포 잠복
요약
우리는 쥐에 있는 과잉 훈련 그리고 공포 잠양을 생성하는 확장된 공포 조정 프로토콜을 기술합니다. 이 프로토콜은 25톤 쇼크 페어링(즉, 과잉 교육)과 조건부 동결 응답의 비교와 함께 단일 교육 세션을 수반하며, 문맥 및 큐 테스트 중 48h(단기) 및 6주(장기)를 훈련후 수반합니다.
초록
정서적 기억은 주로 공포 조절 패러다임으로 연구되었습니다. 공포 컨디셔닝은 개인이 역경 사건과 그렇지 않으면 중립적 인 자극 사이의 관계를 배울 수있는 학습의 한 형태입니다. 정서적 기억을 공부하기 위한 가장 널리 이용된 절차는 쥐에 있는 공포 조정을 수반합니다. 이러한 작업에서, 무조건 자극 (미국)은 단일 또는 여러 세션에서 한 번 또는 여러 번 제시 된 풋 쇼크이며, 조건부 응답 (CR)은 동결된다. 이러한 절차의 버전에서, 라는 cued 공포 컨디셔닝, 톤 (조건된 자극, CS) 풋 쇼크와 쌍 (미국) 훈련 단계 동안. 첫 번째 테스트 중에 동물은 훈련이 일어난 것과 동일한 컨텍스트에 노출되며, 발충격과 톤이 없는 경우 동결 응답이 테스트됩니다(예: 컨텍스트 테스트). 두 번째 시험 동안, 동결은 문맥이 변경될 때 측정되며(예를 들어, 실험 챔버의 냄새와 벽을 조작하여) 발충격(즉, 큐 테스트)이 없는 상태에서 톤이 제시된다. 대부분의 공포 컨디셔닝 절차는 몇 가지 톤 쇼크 페어링을 수반한다 (예를 들어, 단일 세션에서 1-3 시험). 공포 인큐베이션 (즉, 공포 응답은 역경 이벤트 또는 조건된 자극에 추가 노출없이 시간이 지남에 따라 증가)라는 오래 지속되는 효과와 관련된 광범위한 수의 페어링 (즉, 과잉 교육)과 관련된 덜 일반적인 버전에 대한 관심이 증가하고 있습니다. 확장된 공포 컨디셔닝 작업은 다른 심리적 현상(예: 외상 후 스트레스 장애)과의 관계를 포함하여 두려움 잠복기의 행동 및 신경 생물학적 측면의 이해에 핵심이 되었습니다. 여기에서, 우리는 쥐에 있는 과잉 훈련 그리고 공포 잠양을 생성하는 확장한 공포 조정 프로토콜을 기술합니다. 이 프로토콜은 25톤 쇼크 페어링(즉, 과잉 교육)과 조건부 동결 응답의 비교와 함께 단일 교육 세션을 수반하며, 문맥 및 큐 테스트 중 48h(단기) 및 6주(장기)를 훈련후 수반합니다.
서문
메모리는 정보 수집, 통합(획득된 정보의 안정성 허용) 및 검색(통합 프로세스에 대한 증거) 등 다양한 단계를 포괄하는 심리과정입니다. 통합 단계에서는 새로운 시냅스 연결의 구축과 기존 연결 수정이 발생합니다. 이것은 이러한 변화에 대한 책임이있는 분자 및 생리적 사건이1,2에서발생하는 기간 동안의필요성을시사한다. 이러한 생리적 또는 분자 변화는 검색된 이벤트가 감정적으로 충전되는지 여부에 따라 달라집니다(즉, 정서적 기억). 예를 들어, 연구에 따르면 측면 핵 및 바소포측 편도체 복합체는 정서적 기억3,,4,5와5특히 관련이 있는 것으로 나타났다.
정서적 기억 현상은 주로 공포 컨디셔닝 패러다임5,,6로연구되었습니다. 공포 컨디셔닝은 개인이 역경 사건과 그렇지 않으면 중립적 인 자극7사이의 관계를 배울 수있는 학습의 한 형태입니다. 공포 컨디셔닝 패러다임은 편도체에 있는 분자, 세포 및 구조적인 변경을 생성합니다. 또한, 공포 컨디셔닝은 정서적 기억의 통합 및 검색 과정 동안 해마의 연결을 수정합니다.
공포 기억을 공부하기 위한 가장 일반적으로 사용되는 절차 중 하나는 쥐의 고전 (파블로비안) 컨디셔닝입니다. 이 절차는 일반적으로 발자국(미국)을 역경 자극으로 사용하며, 이는 하나 또는 여러 세션에서 한 번 또는 여러 번 전달됩니다. 이 절차에 노출된 쥐의 조절된 반응(CR)은 동결(즉, "호흡에 사용된 근육을 제외한 동물의 골격 근동의 일반화된 강장제 반응에 기인하는 일반화된부동성"). 이 응답은 컨텍스트 및 큐 테스트의 두 가지 유형에서 평가될 수 있습니다. 컨텍스트 테스트의 경우, 대상은 훈련 세션 중에 주어진 수의 풋쇼크를 겪은 다음 지정된 시간 동안 실험 챔버에서 제거됩니다. 시험 중에, 피험자는 훈련이 일어난 것과 동일한 맥락으로 반환되고, 동결의 다른 측정은 발자국(예: 기간, 백분율 또는 동결 에피소드의 빈도)의 부재에서 수집되고, 훈련 단계에서 확립된 기준 수준에 비해 수집됩니다. 두 번째 유형의 테스트, 큐 테스트의 경우, 자극(일반적으로 톤)은 훈련 단계(즉, 조건부 자극, CS)에서 풋쇼크와 결합된다. 훈련이 완료된 후, 동물은 정의된 시간 동안 훈련 컨텍스트에서 제거되고 수정된 컨텍스트(예: 벽과 다른 냄새가 다른 다른 실험 챔버)에 배치됩니다. 큐는 지정된 횟수를 제시하고 큐에 대한 동결 응답을 측정하고 훈련 중에 수집된 기준 수준에 비해 비교됩니다. 이 패러다임의 가장 일반적인 버전은 단일 교육 세션 동안 1~ 3톤의 톤 쇼크 페어링을 사용하고, 컨텍스트 및 큐 테스트가 몇 시간 또는 며칠 후에 수행되었습니다.
다른 덜 자주 구현 된 공포 컨디셔닝 절차는 종종 초과 훈련 절차8이라고불리는 광범위한 충격 큐 페어링 (즉, 예 : 예 : 예 : 예 : 예 : 예 : 예 : 시험)을 포함합니다. 이러한 작업에 대한 관심이 증가하는 것은 공포 인큐베이션(즉, 조건부 공포 응답이 시간이 지남에 따라 증가)99,10,,11에관한 것이다. 이러한 과잉 훈련 절차의 예로는 10개 세션에 걸쳐 배포된 100개의 톤 쇼크 페어링의 교육 단계가 수반되며, 그 다음에는 48시간 및 30일 후11,,12일 후에 실시된 컨텍스트 및 큐 테스트가뒤따릅니다. Maren (1998)은 며칠 에 걸쳐 광범위한 교육 확산을 피하기 위해 25 개의 페어링8과함께 단일 세션에서 과잉 교육을 확립하고 최적화 할 수 있다고보고했습니다. 잠복기 효과는 훈련 후 31 일 테스트 쥐에 조건부 공포의 상당히 높은 수준에서 입증된다, 후 테스트 쥐에 비해 48 시간. 확장된 공포 조절 작업은 다른 심리적 현상(예를 들어, 지연된 발병 후 외상 후 스트레스 장애)과의 관계를 포함하여, 근본적인 공포 잠복의 근본적인 행동 및 신경생물학적 측면의 이해를 위한 열쇠가 되었습니다 (예를 들어, 지연된 개시 후 외상 후 스트레스 장애)11,,12,,13.
여기에서, 우리는 쥐에 있는 과잉 훈련 그리고 공포 잠양을 유도하는 확장한 공포 조정 프로토콜을 기술합니다. 교육11의며칠을 필요로 다른 패러다임과 는 달리, 현재 프로토콜은 단일 교육 세션8에초점을 맞추고있다. 우리는 25 톤 충격 쌍을 사용하여 48 h 후에 실시 된 테스트와 비교하여 교육 후 6 주 동안 진행된 컨텍스트 및 큐 테스트 중에 더 높은 조건부 동결 응답을 생성했습니다.
프로토콜
다음 프로토콜은 Fundación Universitaria 콘라드 로렌츠 (IACUC-KL)의 기관 동물 관리 및 사용위원회에 의해 승인되었다. 국제동물권연맹(1989년)이 발행한 동물권 의 보편적 선언과 ICLAS가 발행한 동물 실험의 윤리적 원칙이 존중되었다.
1. 주제 준비
- 남성 성인 위스타 쥐(n = 12)를 선택합니다. 교육 및 테스트 프로토콜이 시작되기 전에 3 일간의 적응을 위해 케이지 당 4 명으로 구성된 그룹으로 보관하십시오. 실험 기간 내내 쥐에게 물을 무료로 이용할 수 있도록 하십시오. 12h 의 밝은 어두운 주기 (07:00 h에서 켜진 조명)에서 20 °C에서 25 °C 사이의 실온을 제어하십시오.
참고 : 쥐 균주는 공포 컨디셔닝 중에 차등 성능을 보였다. 예를 들어, Schaap et al. (2013)는 Wistar와 루이스 균주가 폰 후드와 브라운 노르웨이 쥐12에비해 동결 행동의 더 긴 기간을 보였다고보고했다. 따라서 통증과 열 임계값의 차이는 충격의 강도와 지속 시간을 조정하기 위해 평가되어야합니다. - 매일 같은 시간에 제한된 음식 접근을 제공함으로써 쥐를 무상 급식 무게 (350-400g 사이의 정상 체중)에서 85 %로 유지하십시오. 가벼운 주기 동안 같은 시간에 매일 쥐의 무게. 확장 된 공포 컨디셔닝 교육이 시작되기 3 일 전에 광고 lib 무게 (100 % 무게)를 계산합니다.
참고: 본 실험에 사용된 동물은 여기에서 보고되지 않는 추가 기악 시험에서 시험되었습니다. 추가 검사를 위해서는 식량 박탈이 필요했습니다. 이 절차 적 변화는 기악 공포 결합 테스트의 잠재력을 시사하기 때문에 현재 절차의 범위를 확장 할 가능성이 있다고 가정됩니다. 그러나, 두려움 컨디셔닝 테스트를 사용 하 여 연구 음식 박탈을 필요로 하지 않습니다. - 다음 그룹 중 하나에 피사체를 무작위로 할당합니다: 훈련 후 6주 간의 정서적 테스트(n = 6); 정서적 테스트 48 훈련 후 h (n = 6).
- 어두운 빛 주기의 광상 동안 유사한 시간에 훈련 및 테스트를 수행합니다. 동일한 실험 챔버에 동물을 할당하고 훈련 및 테스트 하는 동안 동물의 동일한 순서를 유지 합니다.
참고: 구현될 수 있는 추가 제어는 훈련 및 테스트 단계에서 동물의 순서를 재조정하는 것입니다. 다중 그룹을 평가하거나 실험 전반에 걸쳐 다른 작업이 적용될 때 이 기술을 사용하여 동작에 대한 작업 순서의 가능한 효과를 줄이는 것이 좋습니다.
2. 장치 설정 및 충격 보정
- 실험 챔버와 스테인레스 스틸 그리드 바닥의 모든 내부 표면을 10 % 에탄올로 청소하십시오. 각 동물을 테스트하기 전에 반복합니다.
- CPU, 제어 캐비닛, 적외선, 역경 자극기/스크램블러, 충격 강도 교정기 등 장비를 USB 케이블을 사용하여 컴퓨터에 장비를 연결하고 동결 감지 시스템 장비를 시작합니다.
참고 : 이 프로토콜은 시판되는 악기(재료의 표)를사용하여 실행되었지만 다른 브랜드의 장비 및 소프트웨어를 사용할 수 있습니다. 이 장치는 플라스틱 포혈로 덮인 나무 상자에 내장 된 내부 아크릴 사각형 챔버 (29.53cm x 23.5 cm x 20.96 cm, 실험 챔버라고함)로 구성됩니다. 외부 도어를 사용하면 사운드, 노이즈 또는 라이트(상자 도어 감쇠)를 분리할 수 있습니다. 카메라는 외부 도어의 내부 부분에 측면으로 배치됩니다. 바닥 금속 그리드 (36 스테인레스 스틸 막대, 각각 3mm 직경및 간격 8mm, 중앙) 내부 아크릴 상자는 풋 쇼크 배달을 허용합니다. 내부 측면 벽 중 하나에 스피커는 청각 단서를 제시하기 위해 바닥에서 6cm입니다. - 충격 강도 교정기(예: 양수 및 음수 커넥터)의 빨간색 및 검은색 클립을 그리드 플로어의 두 개의 다른 막대에 연결합니다. USB 케이블을 컴퓨터의 해당 포트에 연결합니다. 빨간색과 검은색 클립을 다른 막대로 구분된 막대에 연결해야 합니다.
참고: 이 섹션에서는 재료 표에 언급된 특정 장비 브랜드를 사용하여 충격 강도 교정 프로세스를 설명합니다. 그러나, 교정 공정은 다양한 장비 브랜드를 사용하여 수행될 수 있다. 일관되는지 확인하기 위해 그리드 바닥의 세 가지 섹터에서 충격의 강도를 보정하는 것이 좋습니다. 또한, 충격의 전달 시 간섭을 피하기 위해 그리드 바닥에서 항상 배설물 및 소변 잔류물을 제거한다. - 충격 강도 교정기 소프트웨어(재료표)를시작합니다. 범위 화살표를 클릭하여 응용 프로그램에서 1.0 mA의 강도를 선택합니다. 그런 다음 실행/중지 스위치를 실행으로 변경합니다.
참고 : 우리는 공포 컨디셔닝33,,34,35의연구에 적합한 0.75 mA에서 1.5 mA에 범위를보고 우리의 실험실및 문학에서 설치류 모델과 우리의 연구를 기반으로 1.0mA를제안한다. - 역경 자극기 또는 풋쇼크를 전달하는 데 사용되는 장비를 켜고 응용 프로그램 패널에 표시된 충격 강도를 살펴보십시오. 필요한 경우, 비버 자극기의 손잡이를 사용하여 강도를 1.0 mA로 조정합니다.
참고: 역경 자극기는 실험을 적절하게 테스트, 보정 및 실행하려면 "OUT"로 설정해야 합니다.
3. 동결 감지 시스템 교정
- 실험 챔버와 사운드 감쇠 상자 문을 닫습니다. 동결 검출 시스템 교정이 완료된 후 챔버에 배치되기 때문에 이 시점에서 동물을 소개하지 마십시오. 상자 내부의 빛의 강도가 20~30럭스 사이인지 확인합니다.
- 동결 감지 시스템 소프트웨어를 시작하고 실험 설정 대화 창을 엽니다. 각 주제의 세부 정보(예: 제목 식별 번호, 날짜 및 그룹)를 입력하고 http://doi.org/10.17605/OSF.IO/4NKFQ"교육 프로토콜 VFC.pro"(http://doi.org/10.17605/OSF.IO/4NKFQ 사용 가능)라는 제목의 파일을 로드합니다.
참고: 컨텍스트 및 큐 테스트는 다른 프로그램 구성을 사용합니다. 따라서 각 테스트에서 올바른 파일을 사용해야 합니다. 이 시점에서 올바른 파일은 "교육 프로토콜 VFC.pro"에 해당합니다. 테스트 단계 중에는 해당 파일이 교육 세션과 다를 수 있습니다. - 해당 카메라(들)를 선택하고 비디오 저장 옵션(필요한 경우)을 확인합니다. 모션 임계값을 100으로 설정하고 최소 동결 지속 시간을 30프레임으로 설정합니다.
참고: 이 모션 임계값은 사용된 종의 크기(픽셀 수 기준)를 기반으로 합니다. 최소 동결 기간 값은 제조업체에서 권장합니다. 이러한 값은 챔버에서 동물의 적절한 인식을 보장하기 위해 사용된다. - 선택한 카메라의 라이브 피드가 모션 임계값 그래프 및 학습 중에 표시되는 다른 자극의 타임라인과 함께 화면에 나타나는지 확인합니다(예: 사운드 및 충격).
참고: 다른 브랜드를 사용하여 장비 설정은 동물의 움직임을 측정하여 동물이 움직이거나 동결되는 시간에 대한 비교를 허용해야 하는 모션의 "인덱스"를 감지할 수 있는 가능성을 제공해야 합니다. 또 다른 가능성은 (실험 중 또는 실험 후) 동물이 운동 또는 동결에있는 시간의 양을 감지 할 수있는 소프트웨어를 사용하는 것입니다, 이러한 무료 소프트웨어 ImageFZ13,Matlab에서 오픈 소스 도구 상자14,또는 JAABA15로동물 행동의 무료 분류. - 모션 인덱스가 100(임계값) 미만으로 유지되어 있는지 확인하면서 교정 옵션을 세 번 클릭합니다. 그런 다음 화면의 해당 버튼을 클릭하여 장비를 잠글 수 있도록 설정합니다.
참고: 이 섹션에서는 재료 표에 나열된 특정 장비 브랜드를 사용하여 동결 감지 시스템 교정 프로세스에 대해 설명합니다. 앞서 언급했듯이, 교정 공정은 다양한 장비 브랜드를 사용하여 수행될 수 있다(장비 및 소프트웨어의 다양한 옵션 검토를 위해 Anagnostaras 등. 2010 참조)16.
4. 확장 공포 컨디셔닝 교육
- 동물 보호 시설에서 실험실의 행동 훈련실까지 천으로 덮인 집 새장에 있는 쥐를 수송합니다. 동물을 행동 훈련실에 운반하는 동안 소음이나 스트레스 발생 조건에 노출되지 마십시오. 여러 동물이 동시에 수송되는 경우, 실험 제어를 향상시키기 위해 보유 실에서 다른 쥐를 테스트하고 유지하도록 동물을 데려. 훈련을 시작하기 전에 동물을 2 분 동안 부드럽게 처리하십시오.
참고: 프로토콜에서 동물은 행동 훈련 전에 매일 2 분 동안 처리되었습니다. 취급에 따라, 동물은 실험 챔버에 소개되었다. 우리는 쥐가 연구원에게 습관화할 수 있도록 동물을 조작하는 것이 좋습니다. - 실험 챔버에 쥐를 소개합니다. 꼬리의 밑으로 부드럽게 처리하고 챔버의 중간에 놓습니다. 실험 챔버와 사운드 감쇠 상자 문을 닫습니다.
- 레코드 버튼을 클릭하여 세션을 시작합니다. 쥐가 3 분 동안 챔버에 적응하게하십시오. 이 3 분 기간은 장비 제조업체가 권장하는 표준이며 챔버에 대한 기준 및 습관 시간 역할을합니다.
- 세션 의 분 3에서 시작 60 의 시험 간 간격 (ITI)와 스물 다섯 톤 쇼크 페어링 (시험)을 제공합니다. 각 ITI의 마지막 10s 동안 톤(조건부 자극 – CS; 90 dB SPL, 2000Hz, 50-ms Rise Time)과 각 ITI의 마지막 2s 동안 충격(무조건 자극 – 미국)을 제시한다.
참고: 녹화 버튼의 활성화는 카메라가 제대로 보정되고 잠겨 있는 조건부입니다. - 28분 세션이 끝나면 실험챔버에서 쥐를 제거합니다. 동물을 각각의 홈 케이지로 돌려놓습니다. 행동 훈련실에서 동물 보호 시설로 천으로 덮인 집 새장에 있는 쥐를 수송합니다.
- 모든 피사체를 훈련시키기 위해 동결 감지 시스템 교정(3.1-3.5단계) 및 공포 조절(4.1 단계 및 4.3단계)을 반복합니다.
참고: 각 동물의 감지 시스템을 다시 보정하여 동결 감지에 대한 정보를 처리할 때 소프트웨어가 동일한 매개 변수를 유지하도록 하는 것이 좋습니다. - 휴식 기간: 이 기간 동안, 동물들이 집 새장에서 개별적으로 쉬게 하십시오. 인큐베이션 기간 의 6 주 동안 일주일에 두 번 동물의 무게를 모니터링합니다. 각 동물을 가중치가 있는 동안 2분 동안 부드럽게 조작합니다.
5. 컨텍스트 테스트 – 단일 10 분 세션
- 훈련 단계 후, 컨텍스트 테스트라는첫 번째 메모리 테스트에 동물을 노출. 이 10 분 단계 동안, 훈련이 일어났지만 단서 또는 충격을 제시하지 않는 동일한 맥락에 쥐를 노출. 동물 보호 시설에서 행동 훈련실로 덮인 집 새장에 있는 쥐를 운반합니다(예: 천으로). 동물이 그룹으로 나뉘어져 있었고, 따라서 한 그룹은 훈련 단계 후 48h를 테스트하고 다른 그룹은 훈련 후 6 주 동안 테스트된다(그림 1참조).
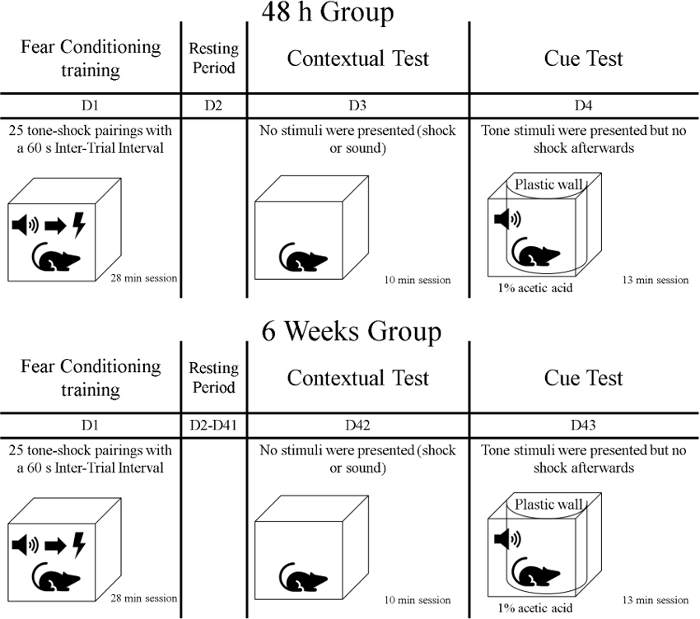
그림 1: 실험 의 타임라인입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 실험 챔버와 스테인레스 스틸 그리드 바닥의 모든 내부 표면을 10 % 에탄올로 청소하십시오. 각 동물을 테스트하기 전에 반복합니다.
- 반복 동결 감지 시스템 교정(단계 3.1 ~ 3.5). 실험 설정 대화 창을 열고 http://doi.org/10.17605/OSF.IO/4NKFQ "컨텍스트테스트 protocol.pro"라는 파일을 로드합니다.
참고: 이 파일에는 충격이나 톤이 없는 이 실험 단계에 대한 설정이 포함되어 있습니다. - 실험 챔버에 동물을 소개합니다. 꼬리의 밑으로 부드럽게 처리하고 챔버의 중간에 놓습니다. 실험 챔버와 사운드 감쇠 상자 문을 닫습니다.
- 레코드 버튼을 클릭하여 세션을 시작합니다. 이 단일 10분 컨텍스트 테스트 세션 동안 자극이 표시되지 않습니다(충격없음 사운드).
- 10분 세션이 끝나면 실험챔버에서 피사체를 제거합니다. 동물을 각자의 새장에 돌려보내 서 덮인 집 새장에 있는 쥐를 행동 훈련실에서 동물 보호 시설로 이송합니다. 모든 과목을 테스트하기 위해 5.2-5.5 단계를 반복합니다.
6. 큐 테스트 – 단일 13 분 세션
- 컨텍스트 테스트 후 하루, 동물이 큐 테스트라는 메모리의 두 번째 테스트를 받아야한다. 이 단계 동안, 쥐 는 13 분 동안 훈련의 다른 컨텍스트에 있을 것입니다.; 신호(톤)가 표시되지만 충격은 전달되지 않습니다. 동물 보호 시설에서 행동 훈련실로 덮개로 덮인 집 새장에 있는 쥐를 수송합니다. 공포 컨디셔닝 훈련 후 그룹 72h를 테스트하고, 훈련 후 6주 및 1일 다른 그룹을 테스트한다(그림1).
참고: 동물 보호 시설에서 실험실에 이르기까지 다른 교통 시스템을 구현하여 더 많은 맥락과 큐 테스트를 차별화할 수 있습니다. 동물들이 홈 케이지의 교육 세션 및 컨텍스트 테스트 세션으로 이송되었기 때문에 큐 테스트 세션으로 가는 동안 다른 운송 케이지, 침구 및/또는 덮개를 사용할 수 있습니다. - 실험 챔버와 스테인레스 스틸 그리드 바닥의 모든 내부 표면을 10 % 에탄올로 청소하십시오. 각 동물을 테스트하기 전에 반복합니다.
- 시각적 컨텍스트를 변경하려면 주변 플라스틱 벽을 실험 챔버에 삽입합니다.
- 후각 컨텍스트를 변경하려면 면기울면에 1% 아세트산을 적용하고 그리드 플로어17,,18,,19아래의 금속 트레이에 놓습니다.
- 동결 감지 시스템 교정을 반복합니다(단계 3.1-3.5). 파일 "큐 테스트 protocol.pro" 파일을 로드하며, http://doi.org/10.17605/OSF.IO/4NKFQ.
참고: 이 파일에는 훈련 단계(CS) 동안 제시된 동일한 톤의 전달로 구성된 이 실험 단계에 대한 설정이 포함되어 있지만 충격이 없는 경우(미국). - 실험 챔버에 동물을 소개합니다. 꼬리의 밑으로 부드럽게 처리하고 챔버의 중간에 놓습니다. 실험 챔버와 사운드 감쇠 상자 문을 닫습니다.
- 레코드 버튼을 클릭하여 세션을 시작합니다. 단일 13분 큐 테스트 세션에서 CS 자극(tone)은 세션의 분 3에서 시작하여 10회 제시됩니다.
참고: 처음 3분은 이 세션의 기준선에 해당하며, 충격이 없는 경우 50s ITI로 전달된 10개의 큐 테스트 시험(즉, 각각 10초)이 전달됩니다. 이전에 로드된 파일을 사용하여 톤 전달은 자동으로 수행됩니다. - 13분 세션이 끝나면 실험실에서 동물을 제거합니다. 동물을 각 케이지로 돌려보내 동물 보호 시설로 운반하십시오. 6.2에서 6.5단계를 반복하여 모든 피험자를 테스트합니다.
7. 데이터 분석
- 동결 감지 시스템 소프트웨어를 사용하여 비디오 스트림에서 파생되는 일반 활동 지수(즉, 모션 인덱스)를 가져옵니다. 이 소프트웨어는 자동으로 모션 인덱스를 변환하여 세션당 동결 시간 의 백분율과 에피소드 동결 수를 제공합니다. 동결 임계값을 시스템의 기본 최소 동결 기간 설정(1 s = 30 프레임)으로 설정합니다.
- 추가 사용자 지정 프로그램(http://doi.org/10.17605/OSF.IO/4NKFQ에서 사용할 수 있는 파일)을 사용하여 다음을 얻습니다.
- 프로그램을 사용하여 교육 세션의 처음 3분 동안 동결 비율을 결정합니다(즉, 기준 동결, 충격이나 톤이 3분 기간 전에 또는 그 기간 동안 제시되지 않았기 때문에) 및 큐 테스트 세션의 처음 3분 동안.
- 이 프로그램을 사용하여 교육 세션의 83분 쓰레기통각각에 대한 동결 비율을 결정합니다.
- 이 프로그램을 사용하여 큐 프리젠 테이션 (즉, 톤 동안 동결) 및 무큐 기간 (심방 간 간격) 동안 동결의 비율을 결정합니다. IT) 교육 및 큐 테스트 세션 모두에 대해.
- 이러한 데이터를 얻으려면 동결 감지 시스템 소프트웨어를 엽니다.
- 파일 선택 | 보고서 | 일괄 구성 요소 요약입니다.
- 확장이 있는 파일을 선택합니다. cMP는 http://doi.org/10.17605/OSF.IO/4NKFQ 사용할 수 있습니다.
- 출력 파일의 이름을 지정하고 모션 임계값을 100으로 변경합니다. 그런 다음 확인을 클릭합니다.
- 분석할 파일을 선택합니다(확장. 원시). 이러한 파일은 세션이 끝나면 동결 감지 시스템 소프트웨어에서 자동으로 생성되며 각 세션의 원시 데이터에 해당합니다. 처음에는 파일이 컴퓨터의 바탕 화면에 저장되지만 사용자 지정 폴더(예: 문서-공포 컨디셔닝)에 저장하여 후속 식별 및 열이 필요할 때 쉽게 저장할 수 있습니다.
- 출력 파일 열기(확장. CSV). 추가 분석을 위해 스프레드시트 소프트웨어에서 편집할 수 있습니다. 이 파일에는 실험 세션 중에 동결 된 결과가 포함되어 있습니다.
참고: 전체 동결 비율을 얻으려면 총 세션 시간 동안 피사체가 움직이지 않는 시간을 나눕니다. 동결 에피소드 의 수는 세션을 통해 동결 이벤트의 수를 계산할 수 있습니다. 두 경우 모두 최소 동결 지속 시간을 기반으로 모션 임계값을 정의해야 합니다. 이것은 동결 에피소드가 기록되는지 여부를 정의하는 시간적 기준입니다. 자동 기록 시스템은 최소 동결 지속 시간을 측정하기 위해 초당 일정량(fps)을 사용할 수 있습니다. 예를 들어 샘플 속도가 30fps인 경우 최소 동결 지속 시간이 15프레임으로 기록되어 30프레임에 대한 비동동성 인스턴스가 동결됩니다.
- 각 세션(교육 및 테스트, 컨텍스트 및 큐 모두)의 각 동결 에피소드의 평균 기간을 총 동결 기간(초 단위로)을 동결 에피소드 총 수에 분할하여 계산합니다.
결과
트레이닝 세션의 상이한 단계에서 동결 시간의 백분율의 변화는 부양t 테스트(표1)를사용하여 모든 과목(n=12)에 대해 분석하였다. 동물은 훈련 세션의 첫 3 분 동안 실험 챔버를 탐색하고 (프로토콜의 첫 날), 어떤 톤이나 충격이 전달되지 않는 시간 (즉, 기준선-BL). 도 2A에도시된 바와 같이, 후속 25톤 쇼크페어링(M = 48.88) 동안 동...
토론
현재 확장된 공포 조절 프로토콜은 짧고(48시간) 및 장기 기간(6주)에 걸쳐 정서적 기억을 평가하는 효율적이고 타당한 방법입니다. 따라서, 프로토콜은 쥐에 있는 과잉 훈련 및 공포 잠복기 현상을 공부할 수 있습니다. 이 프로토콜의 다른 장점 중 에는 다음과 같습니다. 컨텍스트 및 큐 조작에 걸쳐 두 지연(48시간 및 6주)의 차등 효과를 식별할 수 있는 두 가지 유형의 메모리 테스트(즉 컨텍스트 ?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구에 대한 재정 지원은 Fundación Universitaria 콘라드 로렌츠에 의해 제공되었다 - 보조금 번호 9IN15151. 저자는 콘라드 로렌츠 대학의 커뮤니케이션 부서에 비디오, 특히 나탈리아 리베라와 안드레스 세라노 (프로듀서)를 녹화하고 편집하는 데 도움을 주셔서 감사합니다. 또한, 니콜 프폴러-사도프스키와 루시아 메디나는 원고에 대한 자신의 의견에 대한, 요한나 바레로, 코포라시온 대학 이베로 아메리카나에서 딘, 제도적 협력을 위해. 저자는 이해상충이 없습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid (ethanoic acid) | https://pubchem.ncbi.nlm.nih.gov/compound/acetic_acid | ||
| Aversive Stimulation Current Package | MED Associates Inc | ENV-420 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Contextual test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Cue test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Curved Wall Insert | MED Associates Inc | VFC-008-CWI | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Data processing.zip | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| NIR/White Light Control Box | MED Associates Inc | NIR-100 | |
| Quick Change Floor/Pan Unit for Mouse | MED Associates Inc | ENV-005FPU-M | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Small Tabletop Cabinet and Power Supply | MED Associates Inc | SG-6080D | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standalone Aversive Stimulator/Scrambler (115 V / 60 Hz) | MED Associates Inc | ENV-414S | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standard Fear Conditioning Chamber | MED Associates Inc | VFC-008 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Training protocol VFC.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Video Fear Conditioning Package for Rat | MED Associates Inc | MED-VFC-SCT-R | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
참고문헌
- Frankland, P. W., Bontempi, B. The organization of recent and remote memories. Nature Reviews Neuroscience. 6 (2), 119-130 (2005).
- Suzuki, A., Mukawa, T., Tsukagoshi, A., Frankland, P. W., Kida, S. Activation of LVGCCs and CB1 receptors required for destabilization of reactivated contextual fear memories. Learning & Memory. 15 (6), 426-433 (2008).
- Hermans, E. J., et al. How the amygdala affects emotional memory by altering brain network properties. Neurobiology of Learning and Memory. 112, 2-16 (2014).
- Moryś, J., Berdel, B., Jagalska-Majewska, H., ŁUczyńSka, A. The basolateral amygdaloid complex -its development, morphology and functions. Folia Morphologica. 58 (3), 29-46 (1998).
- LeDoux, J. E. Emotional memory systems in the brain. Behavioural Brain Research. 58 (1-2), 69-79 (1993).
- Labar, K. S. Beyond fear: Emotional memory mechanisms in the human brain. Current Directions in Psychological Science. 16 (4), 173-177 (2007).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Maren, S. Overtraining Does Not Mitigate Contextual Fear Conditioning Deficits Produced by Neurotoxic Lesions of the Basolateral Amygdala. The Journal of Neuroscience. 18 (8), 3097-3097 (1998).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, (2013).
- Morrow, J. D., Saunders, B. T., Maren, S., Robinson, T. E. Sign-tracking to an appetitive cue predicts incubation of conditioned fear in rats. Behavioural Brain Research. 276, 59-66 (2015).
- Pickens, C. L., Golden, S. A., Adams-Deutsch, T., Nair, S. G., Shaham, Y. Long-lasting incubation of conditioned fear in rats. Biological Psychiatry. 65 (10), 881-886 (2009).
- Schaap, M. W. H., et al. Nociception and Conditioned Fear in Rats: Strains Matter. PLoS ONE. 8 (12), 83339 (2013).
- Shoji, H., Takao, K., Hattori, S., Miyakawa, T. Contextual and Cued Fear Conditioning Test Using a Video Analyzing System in Mice. Journal of Visualized Experiments. (85), e50871 (2014).
- Patel, T. P., et al. An open-source toolbox for automated phenotyping of mice in behavioral tasks. Frontiers in Behavioral Neuroscience. 8, 349 (2014).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: Interactive machine learning for automatic annotation of animal behavior. Nature Methods. 10 (1), 64-67 (2013).
- Anagnostaras, S. G. Automated assessment of Pavlovian conditioned freezing and shock reactivity in mice using the VideoFreeze system. Frontiers in Behavioral Neuroscience. 4 (58), (2010).
- Moyer, J. R., Brown, T. H. Impaired Trace and Contextual Fear Conditioning in Aged Rats. Behavioral Neuroscience. 120 (3), 612-624 (2006).
- Schuette, S. R., Hobson, S. Conditioned contextual fear memory to assess natural forgetting and cognitive enhancement in rats. Journal of Biological Methods. 5 (3), 99 (2018).
- Chang, C. H., et al. Fear extinction in rodents. Current Protocols in Neuroscience. , (2009).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, 1-18 (2013).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Vetere, G., et al. Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice Article Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice. Neuron. 94 (2), 363-374 (2017).
- Koob, G. F., Zimmer, A. Chapter 9 - Animal models of psychiatric disorders. Neurobiology of Psychiatric Disorders. 106, 137-166 (2012).
- Bourin, M. Animal models for screening anxiolytic-like drugs: a perspective. Dialogues in clinical neuroscience. 17 (3), 295-303 (2015).
- Murray, S. B., et al. Fear as a translational mechanism in the psychopathology of anorexia nervosa. Neuroscience & Biobehavioral Reviews. 95, 383-395 (2018).
- Pamplona, F. A., et al. Prolonged fear incubation leads to generalized avoidance behavior in mice. Journal of Psychiatric Research. 45 (3), 354-360 (2011).
- Török, B., Sipos, E., Pivac, N., Zelena, D. Modelling posttraumatic stress disorders in animals. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 90, 117-133 (2019).
- Bhakta, A., Gavini, K., Yang, E., Lyman-Henley, L., Parameshwaran, K. Chronic traumatic stress impairs memory in mice: Potential roles of acetylcholine, neuroinflammation and corticotropin releasing factor expression in the hippocampus. Behavioural Brain Research. 335, 32-40 (2017).
- Uniyal, A., et al. Pharmacological rewriting of fear memories: A beacon for post-traumatic stress disorder. European Journal of Pharmacology. , 172824 (2019).
- Barad, M. Fear extinction in rodents: basic insight to clinical promise. Current Opinion in Neurobiology. 15 (6), 710-715 (2005).
- Haaker, J., et al. Making translation work: Harmonizing cross-species methodology in the behavioural neuroscience of Pavlovian fear conditioning. Neuroscience & Biobehavioral Reviews. 107, 329-345 (2019).
- Heroux, N. A., Horgan, C. J., Pinizzotto, C. C., Rosen, J. B., Stanton, M. E. Medial prefrontal and ventral hippocampal contributions to incidental context learning and memory in adolescent rats. Neurobiology of Learning and Memory. 166, 107091 (2019).
- Rossi, M. A., Yin, H. H. Methods for Studying Habitual Behavior in Mice. Current Protocols in Neuroscience. 60 (1), 8-29 (2012).
- Brady, A. M., Floresco, S. B. Operant Procedures for Assessing Behavioral Flexibility in Rats. Journal of Visualized Experiments. (96), (2015).
- Zoccolan, D., Di Filippo, A. Methodological Approaches to the Behavioural Investigation of Visual Perception in Rodents. Handbook of Behavioral Neuroscience. , (2018).
- Lguensat, A., Bentefour, Y., Bennis, M., Ba-M'hamed, S., Garcia, R. Susceptibility and Resilience to PTSD-Like Symptoms in Mice Are Associated with Opposite Dendritic Changes in the Prelimbic and Infralimbic Cortices Following Trauma. Neuroscience. 418, 166-176 (2019).
- Li, Q., et al. N-Acetyl Serotonin Protects Neural Progenitor Cells Against Oxidative Stress-Induced Apoptosis and Improves Neurogenesis in Adult Mouse Hippocampus Following Traumatic Brain Injury. Journal of Molecular Neuroscience. 67 (4), 574-588 (2019).
- Pantoni, M. M., Carmack, S. A., Hammam, L., Anagnostaras, S. G. Dopamine and norepinephrine transporter inhibition for long-term fear memory enhancement. Behavioural Brain Research. 378 (112266), 112266 (2020).
- Smith, K. L., et al. Microglial cell hyper-ramification and neuronal dendritic spine loss in the hippocampus and medial prefrontal cortex in a mouse model of PTSD. Brain, Behavior, and Immunity. 80, 889-899 (2019).
- Liu, X., Zheng, X., Liu, Y., Du, X., Chen, Z. Effects of adaptation to handling on the circadian rhythmicity of blood solutes in Mongolian gerbils. Animal Models and Experimental. 2 (2), 127-131 (2019).
- Landgraf, D., McCarthy, M. J., Welsh, D. K. The role of the circadian clock in animal models of mood disorders. Behavioral Neuroscience. 128 (3), 344-359 (2014).
- Refinetti, R., Kenagy, G. J. Diurnally active rodents for laboratory research. Laboratory annimals. 52 (6), 577-587 (2018).
- Hurtado-Parrado, C., et al. Assessing Mongolian gerbil emotional behavior: effects of two shock intensities and response-independent shocks during an extended inhibitory-avoidance task. PeerJ. 5, (2017).
- Frey, P., Eng, S., Gavinf, W. Conditioned suppression in the gerbil. Behavior Research Methods & Instrumentation. 4 (5), 245-249 (1972).
- Woolley, M. L., Haman, M., Higgins, G. A., Ballard, T. M. Investigating the effect of bilateral amygdala lesions on fear conditioning and social interaction in the male Mongolian gerbil. Brain Research. 1078 (1), 151-158 (2006).
- Ballard, T. M., Sänger, S., Higgins, G. a Inhibition of shock-induced foot tapping behaviour in the gerbil by a tachykinin NK1 receptor antagonist. European Journal of Pharmacology. 412 (3), 255-264 (2001).
- Luyten, L., Schroyens, N., Hermans, D., Beckers, T. Parameter optimization for automated behavior assessment: plug-and-play or trial-and-error. Frontiers in Behavioral Neuroscience. 8 (28), (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유