Method Article
종양 침투 T 세포 독성의 정형 외 췌장 종양 및 Ex 생체 특성의 생성
요약
이 프로토콜은 정형 외과 췌장 종양의 외과 생성 및 갓 단송된 뮤린 췌장 종양의 급속한 소화를 기술합니다. 소화 후, 실행 가능한 면역 세포 집단은 유세포 세포 분석에 의한 세포내 사이토카인 검출을 위한 T 세포의 생체내 자극을 포함하는 추가하류 분석을 위해 사용될 수 있다.
초록
췌장암의 생체 내 모델은 질병 역학, 면역 침투 및 새로운 치료 전략을 연구하기위한 귀중한 도구를 제공합니다. 정형외 무린 모델은 면역 적격 마우스의 큰 코호트에서 동시에 수행 될 수 있으며, 상대적으로 저렴하고 톱니 질 조직 미세 환경을 보존합니다. 정형외 종양 내의 T 세포 침투 및 세포 독성 활성의 정량화는 항종양 반응의 유용한 지표를 제공한다.
이 프로토콜은 5 μL 지하 막에서 췌장으로 직접 재중단된 적은 수의 합성 종양 세포를 주사함으로써 정형외과 췌장 종양의 외과적 생성방법을 설명한다. 정형외 종양을 낳는 마우스는 종점에 도달하는 데 약 30 일이 걸리며, 이 시점에서 종양은 종양 침투 T 세포 활성의 특성화를 위해 수확 및 처리될 수 있다. 콜라게나아제와 DNase를 이용한 빠른 효소 소화는 종양에서 단세포 현탁액을 추출하는 것을 허용합니다. 종양에서 추출된 면역 세포의 생존 가능성 및 세포 표면 마커가 보존됩니다. 그러므로, 배양 또는 RNA 추출을 위한 면역 세포의 교류 지원 세포 선별, 면역 세포 집단의 유량 세포 분석 분석을 포함하여 다중 다운스트림 신청에 적합합니다. 여기서, 우리는 전체 세포 독성의 척도로서 세포내 사이토카인 정량화(IFNγ 및 TNFα) 및 탈과립 활성(CD107a)에 대한 T 세포 집단의 생체 내 자극을 기술한다. 전체 종양 다이제스트는 5시간 동안 포르볼 마이리스테이트 아세테이트 및 요오마이신으로 자극하였고, 사이토카인 생산 및 탈과립을 업조절하기 위해 항 CD107a 항체의 존재. 마지막 4시간 동안 브레펠딘 A 및 모넨신을 첨가하여 세포외 수송을 차단하고 사이토카인 검출을 최대화하기 위해 수행되었다. 세포의 엑스트라-세포 내 염색은 유세포 분석 분석을 수행한 후, IFNγ+, TNFα+ 및 CD107a+ CD4+ 및CD8+T 세포의 비율을 정량화하였다.
이 방법은 종양 미세 환경의 포괄적인 분석을 수행하기 위한 시작 기반을 제공한다.
서문
이 방법은, T 세포 기능의 생체 분석 전을 포함하여 면역 세포 집단의 포괄적인 유동 세포 분석 분석을 위해 확립된 종양의 최소량의 세포 물질 및 후속 급속한 해리를 사용하여 정형외과 췌장 종양을 생성하는 수술적 시술부터 시작하여, T 세포 기능의 생체 분석까지의 상세한 것이다.
췌장 덕트 선암 (PDAC)은 5 년1생존 환자의 단지 8 %와 공격적인 암입니다. 환자의 20% 미만이 외과 절제술2를받을 자격이 있기 때문에, 신선한 참을성 있는 견본은 연구를 위해 쉽게 접근할 수 없고 따라서 생체 내 모형은 이 질병을 조사하기 위하여 필수적인 공구를 제공합니다. PDAC의 다중 뮤린 모델이 있습니다 : 직교, 피하, 형질전환, 정맥 및 환자 유래 이종이목 (PDX), 광범위하게 여기에 설명된 3. 여기에서 기술된 정형화 모델은 면역적격 마우스의 췌장으로 합성된 PDAC 세포를 주입할 수 있다. 이것은 야생형 또는 돌연변이 마우스의 큰 코호트에서 수행될 수 있고, 따라서 치료제의 비교를 위한 비용 효과적이고 일관된 모델을 제공한다. 중요한 것은, 정형화 모델은 종양 세포 성장을 위한 톱니체 미세 환경을 제공하고다른 4는 임상적으로 관련된 부위(예를 들어, 간)에 전이하여 피하 또는 화학적으로 유도된 모델보다 임상적으로 더 관련성이 높다. 직교 종양은 섬유아세포 및 세포외 기질 증착의 풍부를 가진 강한 desmoplastic 반응과 같은 PDAC의 중요한 특징을 표시합니다5. PDAC의 형질전환 모델은 뮤린 모델의 금 본위제이며 가장 일반적으로 사용되는 것은 췌장 별 Pdx-1-Cre 프로모터6하에서돌연변이 크라스G12D/+ 및 Trp53R172H/+를 표현하는 KPC 모델이다. 추가 KPC 및 기타 생체 내 PDAC 모델은 여기에서검토됩니다 7. KPC 마우스는 인간 PDAC6의특징을 충실하게 복제하는 질병 진행을 가진 췌장 종양을 자발적으로 개발한다. 그러나, 모든 형질전환 모형에 관해서는, 사육 프로그램은 비용이 많이 들고, 종양 진행은 가변적이고 그러므로 수시로 마우스의 큰 코호트가 필요합니다. PDX 모형은 그 때 면역 손상된 마우스에서 정형또는 더 수시로 피하로 성장되는 환자 파생한 종양 세포 또는 조각을 이용합니다. Xenograft 모델은 치료 화합물을 스크리닝하는 데 유용한 도구를 제공하고 환자 이질성을 고려합니다. 그러나, 그들은 완전한 면역 미세 환경을 제공하지 않으므로8,9.
일단 확립되면, 정형외 종양은 전형적으로 (사용된 세포주에 따라) 성장하고 진행을 추적하고 치료효능을결정하기 위해 초음파 또는 MRI에 의해 쉽게 영상화될 수 있는 큰 종양을 형성하는 데 약 1개월 이상이 소요된다4,5,10. 그러나, 일단 기하급수적으로 성장하면, 종양 성장의 마지막 단계가 급속할 수 있으므로 대부분의 치료 요법은 비교적 일찍 (예를 들어, 14 일)11,12. 면역 계통은 PDAC를 포함하여 종양 발달에 중요한 역할을 하며, 이는 T 세포의 상대적 빈약과 골수성 세포의 빈번한 존재와 함께 침투하는 면역억제 종양을 특징으로 한다13. PDAC에 있는 T 세포의 높은 존재는 더 나은예후를 수여합니다 14,15. 그러나, 단일 제제로서, 항-CTLA-416 및 항-PD-L117과같은 T 세포 면역억제를 완화시키는 면역 체크포인트 억제제는, PDAC 환자에서 임상적 이점을 나타내지 않았으며, 전체 적인 T 세포 반응성이 매우 낮기 때문이다. 그러나, 항CD40과 같은 주요 T 세포 반응을 나타내는 제제는, 항-PD-L1/CTLA-4저항성 18,19 및 백신 접종을 GM-CSF 분비 동종 PDAC 백신(GVAX)으로 극복할 수 있으며, 이는 PDAC종양(20)의면역원성을 증가시킬 수 있으며, 이는 T 세포 반응을 강화하는 것이 중요한 치료 적 길을 형성한다는 것을 나타낸다.
항종양 T 세포 반응에 중요한 것은 T 세포 수용체 (TCR)를 통해 종양 유래 항원의 인식과 세포 독성 사이토 카인 및 과립의 후속 생산이다. T 세포 항원 인식은 TCR 염기서열 화에 의해 결정될 수 있지만, 이러한 접근법은 비용이 많이 들고 시간이 많이 소요된다. 그러나, 종양 침투 T 세포 서브세트의 정량화는 항종양 반응의 좋은 표시를 제공한다. 탈과립, 사이토카인 생산 및 기타 세포 독성 인자의 관점에서 T 세포 활성 ex vivo의 추가 검사는 더 깊은 기능적 분석을 제공한다. 이러한 분석은 신선한 종양 샘플에서 수행될 수 있으며 T 세포 기능의 많은 매개 변수는 유세포 측정에 의해 빠르게 측정될 수 있다.
CD8+ 및CD4+ T 세포는 면역 반응을 약하게 하기 위해 IFNγ 및 TNFα 와 같은 사이토카인을생성한다(21). IFN은 표적 세포에 대한 MHCI 상향 조절을 유도하고, 면역 세포의 분화 및 모집을 유도하며, 세포 사멸을 돕습니다. IFNγCD8+ T 세포에 의한 생산은 항종양 반응의 일부가 되는 것을 잘 특징으로 하며 종양회귀(22,23)와상관관계가 있다. TNFα는CD8+ 및CD4+ T 세포 모두에 의해 생성된 또 다른 전염증성 사이토카인이다. 그것은 TCR 의존적 활성화 및 T 세포의 증식을 향상시켜 항 종양 반응을 돕습니다. TCR 결합 시, 세포독성CD8+ T 세포는 탈과립을 겪을 수 있으며, 여기서 세포독성 분자를 포함하는 미리 형성된 분비 리소좀은 표적 세포 분해를 유발하기 위해 면역학적 시냅스내로방출된다(21). 이 분자는 표적 세포막에 결합하는 단백질인 Perforin을 포함하며, 그 후 막 무결성을 방해하고 그란자임 B와 같은 다른 세포독성 분자의 확산21 또는 내분비증24를 표적 세포의 세포질로 직접 침투시키는 모공을 형성합니다. Granzyme B는 표적 세포 내의 다중 단백질의 분해를 제정하는 프로테아제이며, 세포사멸(21)을초래한다. 이러한 분자의 방출은 세포 표면에 내인성의 외세포증을 필요로하며, 여기서 내인성 마커 CD107a (LAMP-1라고도 함)는 세포막25에일시적으로 통합된다.
T 세포에 의한 사이토카인 분비의 측정은 많은 수의 샘플에서 동시에 쉽게 수행 할 수없는 유동 보조 세포 선별 또는 비드 기반 분리 측정법에 의해 격리가 필요합니다. 그러나 세포내 사이토카인의 측정은 사전 절연 단계를 필요로 하지 않으며 한 번에 여러 샘플에서 쉽게 수행될 수 있으므로 처리량이 높은 접근 방식을 사용할 수 있습니다. 사이토카인이 T 세포에 의해 급속히 분비되기 때문에 세포 내 수준은 탐지할 수 없으므로 T 세포는 기저 사이토카인 생산을 증가시키기 위해 자극을 필요로 합니다. 항원 구동 사이토카인 생산을 평가하기 위해, TCR에 의해 인식된 항원시험관내 프라이밍 APC에 의해 T 세포에 제시되어야 한다. 항원 특이성이 알려져 있지 않은 경우에, 광범위한 자극 접근이 요구됩니다. TCR 자극은 사이토카인 생산 및 증식을 유도하는 TCR 활성화 및 비용 모방을 모두 제공하는 안티 CD3/28 비드를 사용하여 모방될 수 있습니다. 그러나, 더 비용 효율적인 대안은 PMA와 요오마이신의 사용, 함께 광범위 하 게 합성 및 세포 내 사이 토 카인의 릴리스로 이어질 신호 경로 활성화. 특히, PMA는 단백질 키나아제 C(PKC)를 활성화하고 이오노마이신은 세포내Ca2+ 이온을 일으켜 세포 신호화 증가를 유도합니다. 사이토카인의 세포내 함량을 보존하기 위해, 이 자극은 골지의 단백질을 차단하고 따라서 세포 외 방출을 방지하는 단백질 수송 억제제 brefeldin A 및 monensin와 효과적으로 결합될 수 있습니다. PMA/이오노마이신의 사용은 T 세포를 자극하기 위한 잘 확립된 방법이며 세포외 방출과 세포내 사이토카인26사이에 강한 상관관계가 있다. PMA와 요오마이신을 가진 T 세포의 자극은 또한 세포막에 리소좀 인신 매매를 증가시키고 이렇게 CD107a는 세포로 재활용되기 전에 세포 표면에 일시적으로 통합됩니다. 자극 동안 항 CD107a 항체를 포함시킴으로써, 탈과립활성(25)의마커로서 이를 사용할 수 있다.
이 방법은 단세포 현탁액을 제공하기 위해 종양을 빠르게 소화한다. 이 시점에서 개별 모집단은 유세포 측정을 위해 직접 염색되거나 유동 보조 세포 선별 또는 자기 비드 분리와 같은 다운스트림 방법에 의해 정제될 수 있습니다. 유세포 분석 분석을 위한 단일 세포 현탁액의 준비는 다중 면역 세포 집단 및 그들의 표현형 마커의 높은 처리량 분석을 허용하여 면역 세포 수와 표현형의 정확한 정량화를 제공합니다.
마지막으로, 여기에 기술된 소화 프로토콜은 세포 표면 마커 손실을 방지하고 면역 세포 생존능력을 유지하여 면역 세포가 필요에 따라 추가적인 세포 정화 단계및 배양을 겪을 수 있도록 합니다. 그러나,이 방법은이 소화에서 상피 세포를 유도하기 위한 테스트되지 않았습니다.
프로토콜
정형외과 췌장 종양은 1986년 영국의 홈 오피스 동물 및 과학 절차법 및 유럽 지침 2010/63/EU에 따라 앞서 설명한대로 10을 생성했습니다. 모든 마우스는 통증 이나 고통의 징후를 위해 perioperative 모니터링 했다, 포함 하 여 체중 감소 (> 15% 에 72 시간 또는 20% 어떤 주어진된 기간에), piloerection, 눈의 협착, 제기 걸음 걸이, 구부러진 된 외관, 출혈을 포함 하 여 상처 감염의 징후의, 빨갛게 및 궤 양을 포함 하 여. 종양 성장은 촉진에 의해 감시되고, 종점의 표시가 도달했다는 것을 평가하기 위하여 노동한 호흡 황달 및 차가운 사지와 같은 추가 임상 표시는 또한 감시되었습니다. 모든 절차는 멸균 조건에서 수행되어야한다. 유세포분석기 염색 전에 사용된 모든 시약은 멸균 조건에서 제조되어야 한다.
1. 주입을 위한 종양 세포의 준비
- -20 °C에서 지하 막의 알리쿼트를 가지고 밤새 4 °C에서 얼음에 놓습니다.
참고 : 지하 막 농도는 배치마다 다를 수 있습니다. 따라서 재현성을 보장하기 위해 로트 특정 지하 멤브레인 배치를 생체 내에서 테스트해야 합니다. 지하 멤브레인의 새로운 배치는 하룻밤 동안 4 °C에서 얼음에 해동 한 다음 사용자 정의 aliquots, 얼음에 aliquoted, 다음 추가 필요할 때까지 -20 °C에 저장. 이렇게 하면 지하 멤브레인을 사용할 때 파이펫팅 및 동결 해동이 최소화됩니다.- 멸균 PBS를 밤새 4°C에 두어 식힙니다.
- 멸균 200 μL 및 1000 μL 파이펫 팁을 -20°C에서 하룻밤 동안 식힙니다.
- 마이코플라즈마가 없는 종양 세포를 사용하여, 해동 후 적어도 2-10개의 대구를 위해 재배하고 수확하기 전에 성장의 로그 상에서 사용하십시오. 이 프로토콜은 여성 뮤린 C57BL/6 KPC 유래 세포주: TB32048을 데이비드 튜브슨 의 실험실에서 후한 선물로 제공합니다.
- 종양 세포가 수확에 필요한 경우, 플라스크에서 배지를 제거하고 PBS에서 세포를 두 번 씻어냅니다 (37 °C로 미리 데운 것).
- 2x 트립신(미리 37°C로 예온)을 37°C에서 10분 동안 플라스크에 넣습니다(T175 플라스크에 5 mL추가).
- 10 분 후, 플라스크를 부드럽게 두드리고 배지에서 잘 재중단하여 완전한 배지 (10 % FBS, 1 x 페니실린, DMEM의 1 x 연쇄상 구균)를 플라스크에 넣고 세포를 해리시다.
- 300 x g 및 실온 (RT)에서 5 분 동안 튜브와 원심 분리기에 세포를 옮니다.
- 세포 계수를 위해 완전한 배지에서 상급 세포를 제거하고 다시 일시 중단합니다.
- 원심분리세포를 300 x g 및 RT에서 5분 동안 다시 제거하고, 상류를 제거한다.
- 1x106 세포 /mL의 농도를 달성하기 위해 미리 냉각 된 PBS에서 세포를 다시 중단하십시오.
참고: 이 스톡 농도는 5 μl에서 1000 세포의 최종 주입 농도를 달성하기 위해 제조된다. 우리는 낮은 주입 부피에 있는 세포의 더 낮은 수의 주입이 세포 누설을 극소화하고 그러므로 증가한 재현성을 찾아냈습니다 그러나, 종양 성장은 세포주 의존적일 지도 모르다 그러므로 사용자는 각 세포주를 낙관해야 합니다.
- 이와 함께, 미리 표기된 지하 막 알리쿼트(aliquot)를 얼음 위에 놓고 후드에 넣습니다.
- 주사를 위해 제조된 PBS에서 지하 막, PBS 및 종양 세포의 최종 용액의 비율은 5:3:2이다. 따라서 지하 멤브레인의 500 μL aliquot에 미리 냉각된 1000 μL 파이펫 팁을 사용하여 미리 냉각된 PBS의 300 μL을 추가합니다.
- 파이프팅을 최소화하기 위해 지하 멤브레인 aliquot에 직접 PBS를 추가합니다.
- p1000을 300 μL로 설정하고 PBS와 지하 막을 다시 일시 중단하여 튜브를 얼음 위에 유지하여 액체 상태로 지하 막을 보존하십시오.
- p1000 팁에서 모든 지하 멤브레인을 배출할 때 튜브에 팁을 두어 지하 멤브레인/PBS가 파이펫 팁을 내려갈 수 있도록 합니다.
- 5-10 분 후, p1000 팁에서 더 많은 지하 막을 튜브로 다시 꺼내서 튜브를 얼음위에 앉게하십시오.
- PBS에서 200 μL의 재부유 종양 세포를 취하고 미리 냉각된 200 μL 파이펫 팁을 사용하여 지하 막에 직접 추가하십시오.
- 신선한 미리 냉각 된 p1000 파이펫 팁을 가지고 300 μL에서 파이펫을 설정하고 30-40 번 다시 일시 중단하십시오. 낮은 부피에 설정된 더 큰 파이펫 팁은 지하 멤브레인이 팁을 위로 이동하여 재서스펜션 중에 파이펫 팁 필터를 만질 수 있기 때문에 바람직합니다.
- 종양 세포는 주입을 위한 준비됩니다. 수술 중 얼음에 종양 세포 / 지하실 막을 유지.
2. 종양 세포의 정형 외 주입
- 7일 동안 동물 시설에서 마우스를 적응시킴.
- 수술 전에 약 2 시간, 복부의 왼쪽을 면도하고 다시, 다음 목의 목 덜미 아래 피하 수술 전 진통을 관리 (50-100 μg / kg에서 Buprenorphine).
- 히트 매트로 수술 장을 준비하고 마우스를 놓고 주변 장비와 마우스 위에 커튼을 놓습니다. 모든 수술 도구를 살균; 각 마우스에 대한 도구의 충분한 세트를 준비합니다.
- O2 챔버가 의식이 없는 때까지 5% 이소플루란에 마우스를 놓습니다.
- 마우스를 등에 눕고 히트 매트에 옮기고 마스크를 사용하여 마취를 유지하십시오(보통 2-3% 이하의 이소플루란).
- 깊은 마취를 확인; 뒷발이 꼬집고 호흡 속도를 모니터링 할 때 페달 인출 반사의 손실에 의해 확인된 바와 같이 일정한 상태로 유지됩니다.
- 면도 부분만 노출된 채 드레이프로 몸을 덮습니다. 마우스가 마취 마스크에 단단히 고정되어 있는지 확인합니다.
- 멸균 면봉을 사용하여 면도 부위에 원을 그리며 요오드 용액을 추가합니다: 중앙에서 시작하여 가장자리까지 순환합니다. 신선한 면봉과 요오드로 다시 과정을 반복하십시오.
- 메스를 사용하여 췌장/비장 위치(왼쪽 위 사분면) 바로 위에 1cm 절개를 합니다. 멸균 가위는 또한 절개를 만들기 위해 사용될 수있다, 선호하는 경우.
- 집게를 사용하여 피부를 분리합니다. 새 집게를 사용하여 복막 벽을 찾아 가위를 사용하여 복막 벽을 통해 1cm 절개를 추가합니다.
- 두 번째 집게를 사용하여 몸에서 비장과 함께 제공 될 수있는 췌장을 추출하십시오.
- 부드럽게 혼합 종양 세포 / 지하실 막의 유리병을 여러 번 반전.
- 지하 막에 1,000 개의 종양 세포를 포함하는 5 μL로 유리 주사기를 준비하고 몇 초 동안 열 매트에 놓아 따뜻하게하십시오.
참고 : 주사기의 짧은 온난화는 누출없이 주입하기 쉽게하기 위해, 고체화 시작 지하실 멤브레인을 할 수 있습니다. 그러나, 이것은 너무 오래 방치하면 지하실 막이 완전히 굳어지고 주입되지 않을 것입니다, 짧게 유지해야합니다. 유리 주사기를 사용하면 낮은 볼륨을 정확하게 주입 할 수 있습니다. - 그것을 확장하고 눈에 보이는 혈관을 피하기 위한 노력으로 췌장 자체에 평행한 췌장의 중심에 바늘을 직접 삽입하기 위하여 꼬리에 췌장을 붙들기 위하여.
참고 : 췌장의 중심에는 넓은 영역이 있으며 주입하기가 가장 쉽습니다. 그러나, 췌장의 머리 또는 꼬리는 또한 바람직한 경우에 구체적으로 주입될 수 있다. - 천천히 췌장에 지하 막의 5 μL을 주입하고 지하 막이 고형화하고 누출을 방지하기 위하여 주입 후에 적어도 30 s를 위해 췌장에 있는 바늘을 꾸준히 붙들입니다. 지하 막은 작은 명확한 거품이 형성 될 것 같은 볼 수 있어야합니다; 그러나 표시되지 않을 수 있습니다.
참고 : 종양 세포 / 지하 막의 큰 볼륨을 주입 할 수있다; 그러나 누설이 발생하지 않도록 정확한 볼륨을 테스트해야 합니다. - 췌장에서 바늘을 제거하고 출혈이 발생하지 않은지 확인합니다. 췌장을 복강에 다시 부드럽게 삽입하여 지하 막 거품을 만지지 않도록주의하십시오.
- 함께 당막벽을 당기고 필요한 경우 단일 봉합사 또는 두 개의 중단 된 봉합사를 수행하십시오.
- 피부 절개의 두 면을 함께 당기고 필요에 따라 여러 개의 중단 된 봉합사를 수행하거나 두 개의 수술 클립을 삽입하십시오.
- 목덜미에 buprenorphine의 또 다른 피하 주입을 관리.
- 신선한 케이지로 다시 전송하기 전에 체온을 유지하기 위해 수술 후 적어도 30 분 동안 가열 된 37 °C 케이지로 마우스를 전송합니다.
- 케이지에서 사용할 수있는 매시 다이어트를 준비, 재 수화와 체중을 보장하기 위해.
- 권장대로 수술 후 진통을 다시 관리하고 상처 개방, 통증 또는 감염 및 체중 감소의 징후를 면밀히 관찰하십시오. 수술용 클립을 사용하는 경우, 이들은 클립 리무버를 사용하여 7-10일 후에 제거할 수 있다.
- 약 14 일 후에 흉터 조직은 복부를 촉지하기 시작하기에 충분히 치유될 것입니다. 마우스가 종점에 도달할 때까지 촉진을 통해 종양 크기를 면밀히 모니터링합니다.
- 종점에서 마우스는 참수 에 선행된 자궁 경관 탈구를 통해 컬링됩니다. 피부와 복막 구멍은 종양을 붙들기 위하여 집게를 사용하여 절제된 가위와 췌장 종양을 사용하여 열리고, 주위 조직을 제거하기 위하여 가위.
3. 췌장 종양의 소화
- 해부된 췌장 종양, 전이성 부위 종양 또는 건강한 췌장 조직을 얼음 차가운 PBS에 넣고 얼음 위에 보관하십시오.
- 집게를 사용하여 종양을 페트리 접시에 옮김을 옮김을 옮김을 사용하십시오.
- 5.0 mL의 소화 배지 (2 mg / mL 콜라게 나제, 0.025 mg / mL DNase RPMI)를 50 mL 튜브에 추가하십시오. 효소 활동이 재발하지 않도록 얼음에 보관하십시오.
참고: 이 프로토콜은 ≥1 단위/MG FALGPA 및 > 125 콜라겐 소화 단위(CDU)/mg 고체활성을 가지는 콜라게나제 타입 V를 사용합니다. 콜라게나아제 및 DNase 알리쿼트는 -20°C에서 보관하고 사용하기 전에 얼음위에 해동시킬 수 있습니다. 둘 다 멸균 RPMI에서 완전히 용해되면 0.2 μm 필터를 통과하여 오염 물질을 제거할 수 있습니다. 콜라게나아제는 물질의 손실을 피하기 위해 여과하기 전에 완전히 용해되어야 합니다. - 페트리 접시에 종양을 커버하기 위해이 솔루션의 작은 aliquot을 가져 가라.
- 멸균 메스와 집게를 사용하여 종양을 길이가 약 3mm 미만인 작은 조각으로 자릅니다.
- 종양 조각을 튜브에 긁어 내고 모든 조각이 소화 매체에 잠길 때까지 튜브를 부드럽게 반전시다. 다른 종양 샘플을 일괄 처리로 준비해야 하는 경우 얼음에 보관하십시오.
- 37 °C에서 20 분 동안 흔들기 장치로 옮김. 종양의 모든 조각이 침수되어 튜브가장자리에 달라붙지 않았는지 확인하십시오. 흔들림이 불가능한 경우, 5분마다 샘플을 소용돌이치면 소화를 돕습니다.
4. 소화 된 종양에서 단세포 현탁액의 준비
- 소화 단계 직후, 효소 활동을 늦추기 위해 튜브를 얼음 위에 놓습니다.
- EDTA를 추가하여 20 mM의 최종 농도를 달성하고 혼합 할 짧은 소용돌이 샘플을 얻을 수 있습니다. 이것은 효소 활동을 더 느리게 할 것입니다.
- 튜브를 열고 신선한 RPMI 배지로 튜브 뚜껑에서 종양 소화를 헹굴 수 있습니다.
- 얼음에 50 mL 오픈 튜브에 70 μm 스트레이너 (스트레이너의 μm 크기는 원하는대로 변경할 수 있습니다)를 준비합니다.
- 중간 으로 필터를 미리 적시다.
- 소화된 세포를 다시 일시 중단하고 25 mL 스트립, 또는 더 큰 을 사용하여 튜브의 측면을 세척합니다. 스트립의 넓은 개구부는 두꺼운 다이제스트가 쉽게 통과할 수 있도록 하는 것이 중요합니다.
- 25 mL 스트리펫을 사용하여 모든 다이제스트를 스트레이너에 옮니다.
- 1 mL 주사기 플런저를 사용하여 필터 위에 종양을 으깨. 세포에 대한 전단 응력만 을 최소화하기 위해 위아래로만 매쉬하십시오.
- 지속적으로 RPMI와 여과기를 통해 세포를 씻어. 세포를 밀어 낼 만큼 충분한 힘으로 씻어내십시오.
- 여전히 매시할 물질이 있지만 RPMI가 플러싱을 중지하면 스트레이너가 포화됩니다. 따라서 샘플을 새 필터로 전송하고 계속합니다.
참고 : 결국 세포외 매트릭스 구성 요소만 필터에 남아 있으며 모든 단일 셀은 통과해야합니다.
- 300 x g 및 4 °C에서 5 분 동안 튜브를 원심 분리합니다.
- 조심스럽게 전체 RPMI에서 세포 펠릿을 다시 중단하고 적절하게 다시 일시 중단 할 수없는 세포 외 매트릭스 또는 큰 세포 덩어리를 제거하기 위해 다른 필터를 직접 통과합니다.
- 이 시점에서 자극이 필요하지 않은 경우, 6.1 단계로 건너뛰면 유세포 분석분석을 위해 단리된 세포를 즉시 얼룩지게 한다. 또는 동결 매체(FBS의 10% DMSO)에 다시 중단하고 -80°C에 저장한 다음 액체 질소에 장기간 보관합니다.
참고 : 동결 단계는 나중에 면역 세포의 정제를 허용 할 수있다; 그러나, 면역 세포 서브세트의 정량화는 세포 수와 표현형이 동결/해동 과정에 의해 영향을 받지 않는다는 것을 확인하기 위해 최적화가 필요할 수 있다. ex vivo T 세포 자극은 신선한 종양 샘플상에서 가장 잘 수행된다. 이 시점에서 샘플은 필요한 경우 비드 계 죽은 세포 제거 또는 면역 세포 농축 검정에 의해 추가로 정제 될 수 있습니다.
5. 생체 내 자극을위한 세포 준비
- 완전한 배지에서 2 x 106/100 μL의 농도를 달성하기 위해 세포를 계산합니다 (RPMI 10 % FBS, 1X 페니실린 및 1X 스트렙토 마이신).
참고: 도금된 총 셀수가 많기 때문에 이 샘플 내에 적절한 T 세포가 분석될 수 있습니다. 그러나 샘플 가용성 및 관심 있는 T 셀 하위 집합의 드문 특성에 따라 숫자를 확장하거나 축소할 수 있습니다.- 플레이트 100 μL의 세포는 U-바닥 96웰 플레이트에 있다.
- PMA/이오노마이신의 2x 제제를 함유하는 완전한 배지 100 μL을 첨가합니다(제조업체에서 권장하는 대로 최종 농도 0.081 μM 및 1.34 μM을 각각 달성하기 위해).
참고: 탈과립/외래세포증을 측정하는 경우, 또한 여기에 형광성으로 공액된 반대로 마우스 CD107a를 미디어에 포함한다. CD107a를 포함하지 않는 제어 샘플도 수행해야 합니다. - 37°C 인큐베이터에 5%CO2를 1시간 동안 놓습니다.
- 브레펠딘 A와 모넨신의 10배 제제 20 μL을 첨가하여 완전 매체에 각각 1.06 μM 및 2.0 μM을 첨가합니다.
참고: 브레펠딘 A와 모넨신은 단백질 수송 억제제이므로 유세포 측정에 의한 검출을 허용하는 사이토카인 등의 세포외 방출을 차단합니다. ELISA 또는 유사한 방법에 의해 상판으로 사이토 카인 방출을 측정하는 경우 –이 단계는 건너 뛸 수 있습니다. - 플레이트를 37°C 인큐베이터에 5%CO2로 놓고 4시간 동안 더 놓습니다.
6. 유세포 분석측정을 위한 세포외 및 세포내 염색
- 플레이트를 제거하고 얼음에 놓인 V 바닥 판에 모든 재료를 전송하기 위해 각 우물을 다시 일시 중단합니다.
참고: 상피 세포, 대식세포 및 기타 부착 세포는 다시 일시 중단하여 완전히 검색되지 않을 수 있습니다. 그러나 다운스트림 분석은 T 셀에만 있기 때문에 이것은 문제가되지 않습니다.- 6.1.1 원심분리판을 300 x g 및 4°C에서 5분 동안 플레이트(명시되지 않는 한 후속 단계에 사용).
- 플레이트를 한 번의 날카로운 움직임으로 거꾸로 쓸어 넘기면 상판을 제거합니다.
- 얼음으로 차가운 PBS로 제조된 고정 가능한 생존 용염료의 50 μL로 다시 일시 중단하십시오. 다시 일시 중단할 때 는 거품이 발생하지 않도록 파이펫을 더 낮은 부피로 설정합니다.
- 4 °C에서 20 분 동안 배양, 어둠 속에서.
- 세척 단계: FACS 버퍼, 원심 분리기 100 μL을 추가하고 상급체를 제거합니다.
- FACS 완충액(0.5% BSA, PBS에서 2.0 mMEDA)에서 50 μL의 항 CD16/CD32(2.5 μg/mL)로 각 우물을 재중단하여 Fc 수용체에 대한 검출 항체의 비특이적 결합을 차단합니다.
- 4 °C에서 15 분 동안 배양, 어둠 속에서.
- FACS 버퍼에서 플루오로크롬 컨쥬게이트 안티 마우스 CD45, CD3, CD4 및 CD8(추가세포 외 마커를 원하는 대로 추가할 수 있음)의 2x 마스터믹스를 각 웰에 직접 추가합니다.
- 4 °C에서 30 분 동안 배양, 어둠 속에서.
- 세척 단계: FACS 버퍼, 원심 분리기 100 μL을 추가하고 상급체를 제거합니다.
- 100 μL의 1x 세포 내 (IC) 고정 버퍼를 추가하고 어둠 속에서 RT에서 30 분 동안 배양하십시오.
- RT에서 원심분리기를 준비합니다.
- FACS 버퍼 100 μL, 원심분리기를 300 x g 및 RT에서 5분 간 추가하고 상급체를 제거합니다. 300 x g에서5 분 동안 1 x 투과 버퍼 및 원심 분리기를 반복하십시오. 그런 다음 상급체를 제거하십시오.
- 1x 투과 버퍼로 제조된 플루오로크롬 컨쥬게이트 항 마우스 IFNγ, TNFα 및 기타 세포내 마커의 50 μL을 추가합니다.
- RT에서 1 시간 동안 배양하십시오.
- 세척할 투과 버퍼 100 μL을 추가합니다. 그런 다음 300 x g 및 RT에서 5 분 동안 원심 분리를 하고 상급체를 제거합니다.
- FACS 버퍼 100 μL을 추가하여 세척하고, 300 x g및 RT에서 5 분 동안 원심 분리기를 넣고 상급체를 제거하십시오.
- 이 최종 원심분리 후, 유동 세포계와 호환되는 부피로 세포를 다시 일시 중단한다. FACS 튜브의 크기에 따라 달라질 수 있습니다.
- 이 볼륨을 수집을 위해 적절한 FACS 튜브로 전송합니다.
- 빛을 가리고 냉장고에 보관하고 24 시간 이내에 샘플을 채취한다.
결과
1000 개의 TB32048 세포를 췌장에 주입 한 후, 정형 종양은 약 30 일이 걸리며 개발합니다(도 1A, B). 수술 중 지하 막 누설은 큰 종양이 피부를 통해 눈에 띄게 보이는 각벽에 직접 형성될 수 있습니다(그림 1C). 우리는 연구 결과에서 이 마우스를 제거할 것입니다. 그러나, 좋은 수술 기술로 누설의 부각이 최소화됩니다. 종점에서 수확된 정형파종양은 C57BL/6 야생형 마우스에서 상당한 크기로 성장할 수있다(도 1D). 수확된 정형암 종양은 단세포 현탁액을 달성하기 위해 콜라게나제/DNase에서 20분 동안 소화를 필요로한다(그림 2). 이 시점에서, 종양 유래 세포는 2 x 106 세포 /well에서 U 바닥 판에 도금 될 수 있습니다. 도금된 세포의 수는 샘플 내의 T 세포의 보급에 따라 변경될 수 있다; T 세포가 고밀도인 경우 셀 수를 낮출 수 있습니다. 제어 비장 또는 림프절 샘플은 자극을 위해 이 시점에서 도금될 수 있습니다. 각각의 웰은 5시간 동안 PMA 및 요오마이신으로 자극되고 1시간 배양 후, 브레펠딘 A 및 모넨신은 사이토카인의 세포외 방출을 차단하기 위해 첨가된다(도2). 배양 후, 샘플은 유세포 분석에 의한 분석을 위해 세포외 전형및 세포내 사이토카인에 대해 염색된다(그림2).
정형외 종양을 낳은 마우스로부터의 비장 및 종양의 샘플을 유세포측정에 의해 분석하였다. 비장 및 직교 종양에 대한 유동 세포 분석분석에 사용되는 게이팅 전략은 FSC-A, SSC-A, FSC-A/FSC-H 및 SSC-A/SSC-W에 의한 이물질을 제외한 후, 죽은 세포 또는 사멸세포를 고정 가능한 생존성 염료에 대해 양성으로한다(그림 3A). 면역 세포는CD45+로그 때 게이트되고, T 세포는CD4+ 및CD8+ 서브세트가 정의되는CD3+로 더 게이트된다(도3A). 형광 마이너스 1 (FMO)는 게이팅에 대한 배경 형광을 결정하기 위해 수행되고 브레펠딘 A / monensin 만 제어는 사이토 카인의 기저 생산을 결정하기 위해 수행됩니다(그림 3B-D).
IFNγ의 경우, 브레펠딘 A/모넨신을 배양한 결과 비장 및 종양 샘플 모두에서 FMO 대조군을 통해 IFNγ가 증가하지 않았다. 그러나, PMA 및 요오마이신의 첨가는 비장 및 종양 유래CD4+ 및CD8+ T 세포 모두에서 검출가능한 세포내 IFN의%를 증가시켰다.
양성 대조군으로 사용되는 비장 CD4+ 및 CD8+ T 세포는 종양-침윤 T 세포 서브세트보다 상대적으로 높은 IFNγ 생산을 가지며, 평균 6.60±1.5% 및 12.97±3.4%와 비교하여 4.81±1.0% 및 4.13±1.3% 내의 면역억제가 발생한다.(4.13±1.3% 종양 이외) 종양이 발생한다. TNFα에 대해 동일한 전략을 사용하여, 우리는 비장 CD4+ T 세포의 높은 비율이 종양 침투 CD4+ T 세포 (22.45 ±5.4 %)에 비해 세포 내 TNFα (65.93 ± 2.3%)에 대해 양성이라는 것을 시각화했습니다. 비장 및 종양 침투 CD8+ T 세포는 TNFα의 유사한 수준을 생성한다 (25.15 ± 3.7 % 및 19.91 ± 5.1 %, 각각)(그림 3C, 도 4B).
마지막으로, CD107a는 세포독성 과립 및 사이토카인의 외신방증 동안 세포 표면상에서 일시적으로 발현되는 내인성 마커이며, 이와 같이 세포독성에 대한 대리 마커로서 사용된다. 자극 동안 CD107a에 대한 염색의 이점은 모든 일시적 세포 표면 발현 CD107a가 형광 항체에 의해 포착될 것이라는 것이다. CD107a의 기저 수준은 브레펠딘 A/모넨신 만 처리된 세포에 나타내진다. 비장 CD8+ T 세포의 경우, PMA/이오노마이신을 가진 자극은 CD107a의 수준을 증가시키고,CD8+ 세포에서 가장 강한 업레귤레이션으로 23.95±3.5% CD107a+ 5.8±1.9%에 비해, 비장CD8+ 증변률을 나타냈다. 한편, 비장 및 종양 침투CD4+는 CD107a 9.37±1.5% 및 11.50±1.8%의 유사한 수준을 발현하였다(도3D 및 4C).
전반적으로 이러한 결과는 정형외 종양이 췌장으로 종양 세포의 매우 낮은 수 (1,000)의 주입으로부터 생성 될 수 있음을 강조한다. 이들 종양은 생체내 자극을 위한 T 세포의 분리를 위해 빠르게 소화될 수 있다. 세포내 사이토카인의 검출이 가능하고 이차 림프기관의 T 세포에 비해 침투 T 세포의 면역 억제의 기저 수준을 강조한다.
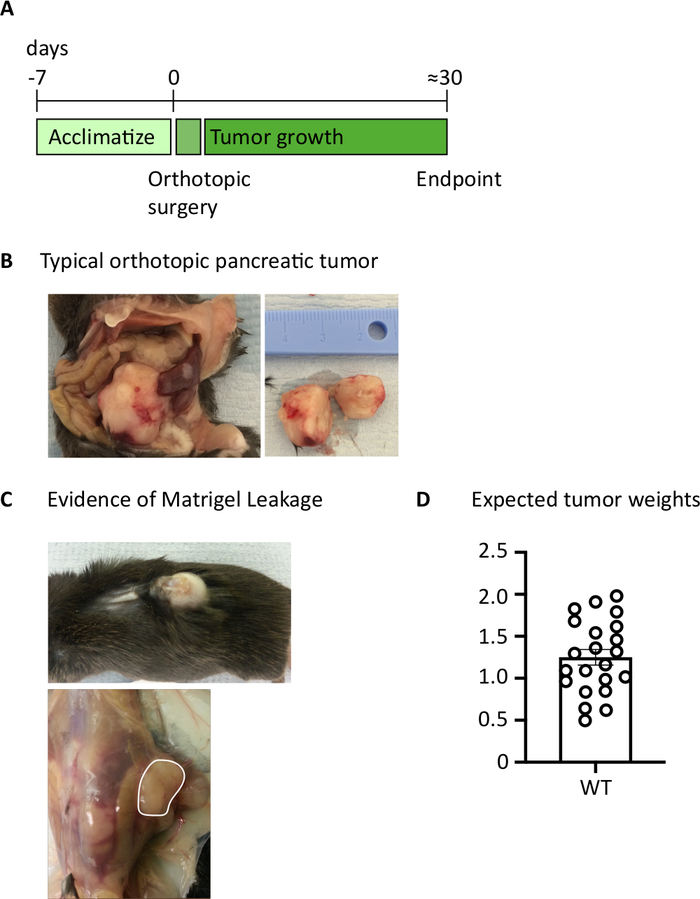
그림 1: 정형외 췌장 종양의 생성. (A) 생체 내 실험 일정. (B)복강 내 의 직교 종양의 거시적 외관 (왼쪽) 및 종양이 표시된 절제 후 (오른쪽) 반으로 절단되었습니다. (C)수술 중 지하 막 누출의 증거는 피부 (위 사진)를 통해 볼 수있는 종양이 발생하고 각벽 (아래 사진)에 형성될 수 있습니다. (D)종점에 도달한 마우스로부터 수확한 정형외 췌장 종양 가중치(n=22). 각 데이터 포인트는 개별 마우스를 나타내고, 막대 그래프는 평균 ±SEM을 나타낸다. 이 그림의 데이터는 이전에 게시된 작업10에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
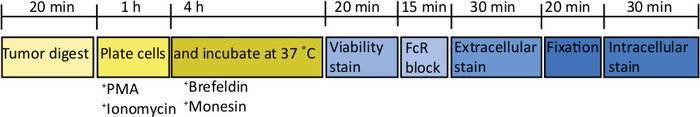
도 2: 생체 내 T 세포 자극에 대한 정형외 종양 처리의 회로도. 수확 후, 췌장 종양은 37 °C에서 20 분 동안 콜라게나아제 (2 mg / mL) 및 DNase (0.025 mg / mL)에서 빠르게 소화됩니다. 이에 따라, 세포는 완전한 RPMI 매체에서 2 x 10 6/mL에서 재중단되고 U-바닥 플레이트에서 도금된다. PMA 및 이오노마이신의 자극 칵테일이 5시간 동안 첨가되고, 이 때 항마우스 CD107a 항체는 또한 배양에 첨가될 수 있다. 1 시간 배양 후 세포 내 수송 차단제, brefeldin A 및 monensin이 첨가됩니다. 생체 내 자극 후 세포는 20 분 4 °C에 대한 고정 가능한 생존 성 염료 (PBS)로 염색을위한 V 바닥 플레이트로 전달됩니다. 세포는 FACS 버퍼로 세척하고 15 분 동안 항 CD16 /32 (FcR 블록)에서 배양 한 다음 세포 외 형광 컨쥬게이션 항체로 추가로 30 분 동안 배양합니다 (FACS 버퍼에서). 세포는 FACS 버퍼에서 다시 세척되고 20 분 동안 세포 내 고정 버퍼에서 다시 중단됩니다. 그 후, 세포는 FACS 버퍼에서 한 번 세척되고 1x 투과 버퍼에 한 번 세척됩니다. 세포는 1 시간 동안 세포 내 형광-컨쥬게이스 항체에서 RT에서 1 시간 동안 재중단된다 (1x 투과 완충제에서). 세포는 24 시간 이내에 유동 세포계에 취득FACS 버퍼에 다시 중단하기 전에 1x 투과 버퍼에 한 번 세척. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
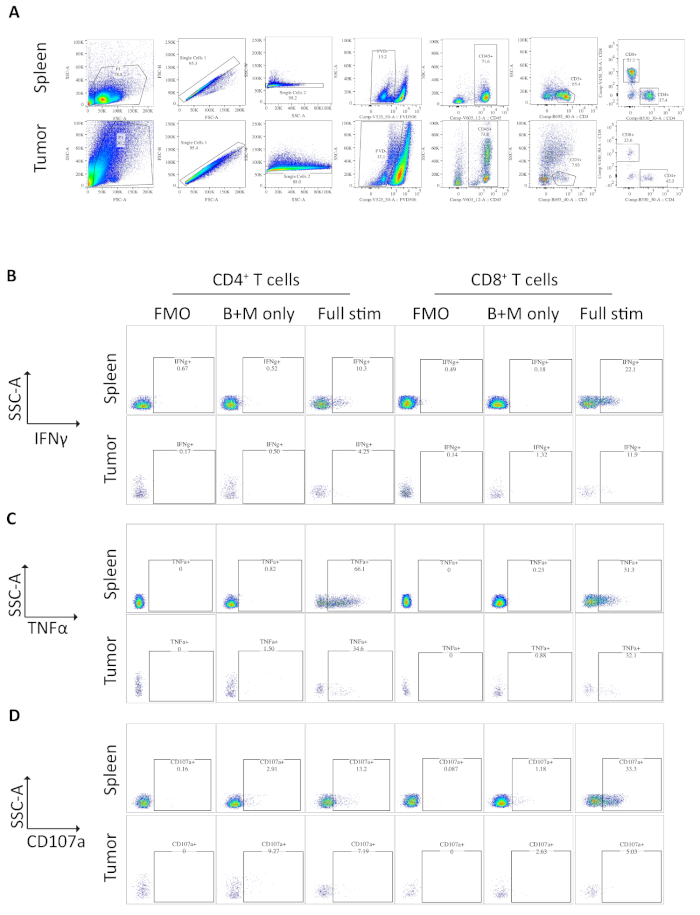
도 3: 생체외 의 유세포분석비장-및 종양 유래 T세포를 자극하였다. (A)비장 (양성 대조군) 및 직교 종양 샘플에 사용되는 유세포 분석 게이팅 전략. 세포는 FSC-A/SSC-A를 사용하여 파편에서 구별되고 단일 세포는 FSC-A/FSC-H 및 SSC-A/SSC-W를 사용하여 더욱 단리됩니다. 죽은 세포 또는 세포 사멸 세포는 고정 가능한 생존 성 염료 -FVD506을 사용하여 제외되고 면역 세포는 CD45+에의해 게이트됩니다. 이 CD3+ T 셀 및 CD4+ 및 CD8+ 하위 집합에 따라 정의됩니다. 데이터는 BD 포르테사에서 획득되었습니다. (B)IFNγ+ CD4+ 및 CD8+ T 세포를 정량화하는 데 사용되는 게이팅 전략. 형광 마이너스 하나 (FMO) 제어는 배경 형광을 결정하기 위해 완전히 자극 샘플 (PMA / 요오마이신 / brefeldin A / monensin)에 사용됩니다. 브레펠딘 A/모넨신 전용 제어(B+M만 해당)는 기저 사이토카인 생성을 결정하는 데 사용됩니다. 완전 자극된 샘플은 IFNγ+ T 세포 %를 계산하는데 사용된다. (C)TNFα+ CD4+ 및 CD8+ T 세포를 정량화하는 데 사용되는 게이팅 전략. FMO 대조군은 배경 형광을 결정하기 위해 완전히 자극된 샘플(PMA/요오마이신/브레펠딘 A/모넨신)에 사용됩니다. 브레펠딘 A/모넨신 전용 제어(B+M만 해당)는 기저 사이토카인 생성을 결정하는 데 사용됩니다. 완전 자극된 샘플은 다음 % TNFα+ T 세포를 계산하는데 사용된다. (D)CD107a+ CD4+ 및 CD8+ T 세포를 정의하는 데 사용되는 게이팅 전략. FMO 대조군은 배경 형광을 결정하기 위해 완전히 자극된 샘플(PMA/요오마이신/브레펠딘 A/모넨신)에 사용됩니다. 브레펠딘 A/모넨신 전용 제어(B+M만 해당)는 기저 탈과립을 결정하는 데 사용됩니다. 완전히 자극된 샘플은 다음 %CD107a+ T 세포를 계산하는 데 사용됩니다. 모든 유세포분석 데이터는 FlowJo 버전 10.6.1에서 분석되었습니다. 이 그림의 데이터는 이전에 게시된 작업10에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
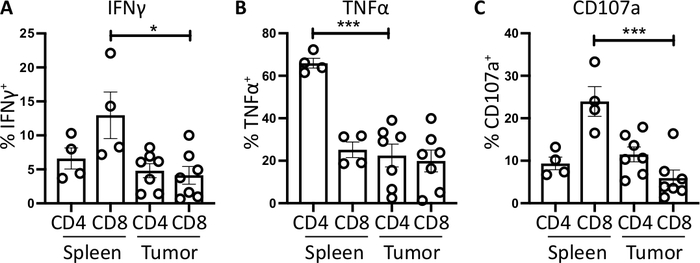
도 4: 생체내 비장-및 종양 유래 T 세포 활성의 정량화. CD4+ 및CD8+ T 세포에 대한 양성의 비율(A)IFNγ+(B)TNFα+와(C)CD107a+를 정형종양 베어링 마우스의 비장(n=4) 및 종양(n=7)에서 정량화하였다. 각 데이터 포인트는 개별 마우스 및 오차 막대 표시 평균 ±SEM. 통계적 유의성 * = p<0.05 및 *** = p<0.001의 페어링되지 않은 t 검정을 사용하여 테스트하였다. 모든 데이터는 프리즘 8을 사용하여 분석되었다. 이 그림의 데이터는 이전에 게시된 작업10에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
췌장암의 생체내 모델은 질병 진행을 이해하고 새로운 치료 대상을 평가하는 귀중한 도구를 제공한다3. 특히 정형화 모델은4,27마우스의 큰 코호트에동시에적용될 수 있는 비용 효율적이고 재현 가능한 모델이다. 정형화 모델은 또한 종양 성장을 위한 톱니체 미세 환경 및 손상되지 않은 면역 계통을 제공하며, 피하 및 PDX 모델보다 더 적합합니다. 그러나, 우리는 면역 침윤의 몇몇 요소가 정형및 KPC 마우스, 금 표준 뮤린모델(10)사이에서 다를 수 있다는 것을 발견하였다. 이것에 대한 1개의 이유는 정형외 모형에서 보인 가속한 종양 성장일 수 있었습니다. 면역 세포 서브세트의 밀도에 있어서의 추가적인 차이는 정형및 피하 모델3,28사이에 기술되었다. 따라서, 형질전환 KPC 모델은 더 비싸고가변적인 6이지만,주요 발견은 가능한 경우 KPC 마우스의 작은 코호트에서 검증되어야 한다.
정형외과 수술을 위한 종양 세포의 제제는 프로토콜에서 중요한 단계이다. 세포는 항상 성장 및 마이코 플라즈마- 및 감염없는 로그 단계에 있어야합니다. 종양 세포 성장에 대한 우려가있는 경우 직교 수술은 연기해야합니다. 지하막의 사용은 그것 없이 세포를 주입하는 종양 발생률을 향상시키고29및 이에 따라 세포 누설을 감소시키고 따라서 peritoneal 확산27. 그러나, 일단 지하실 막에 중단, 종양 세포는 신속 하 게 주입 해야 (내 2 시간) 어떤 세포 손실을 피하기 위해. 종양을 생성하는 데 필요한 종양 세포의 수는 세포주 의존적일 가능성이 높으며, 세포 수의 범위는 또한 종점에 도달하는 시간을 결정할 수 있는 (예를 들어, 100 – 100,000에서) 시험되어야 합니다. 주사를 위해 마우스 당 1,000 개의 세포를 준비 할 때 오차 범위가있을 가능성이 높습니다. 따라서, 수술의 여러 일이 필요한 경우, 그룹의 치료는 배치 효과를 제어하기 위해 일에 걸쳐 동등하게 확산되어야한다. 대부분의 수술 단계는 환경 설정에 따라 수정할 수 있습니다. 그러나 복강에서 췌장을 교체하거나 복막을 닫을 때 지하 막을 방해하지 않도록주의해야합니다. 지하 막 누설은 급속하게 형성하고 동물을 더 일찍 희생할 필요가 있는 귀착될 수 있는 막 벽에 종양 세포 성장을 일으키는 원인이 될 수 있습니다.
이상적으로, 췌장 종양은 수확 후 빠르게 소화되고 즉시 생체 내 자극을 위해 준비되어야 한다. 그러나, 이것은 수확하는 종양의 큰 배치가 있는 경우에 가능하지 않을 지도 모릅니다, 이 경우에 종양은 얼음에 보관되고 배치에서 소화되어야 합니다. 소화 효소에 대한 노출의 유형, 농도 및 길이는모두 면역세포30,31,32에많은 수의 표면 분자에 영향을 미치는 것으로 나타났다. 소화 시간은 또한 세포 사멸을 제한하기 위하여 의도적으로 짧습니다33. 소화 된 세포는 장기 저장을 위해 동결 매체에서 동결 될 수있다; 그러나 해동 시 일부 세포 손실이 발생합니다. 소화 과정은 종양 조각이 콜라게나제 배양 전에 충분히 다듬지 않고 단단한 종양 조각이 소화 후에 필터에 남아 있기 때문에 분명할 것입니다. 콜라게나아제 농도는 건강한 췌장 또는 초기 단계 종양으로 작업하는 경우 낮아질 수 있습니다. 건강한 췌장 덕트 세포를 추출에 대한 보고서는 상당히 낮은 농도를 사용34. 상피 세포 사멸의 높은 정도는 소화 동안 예상 될 수있다; 그러나, 면역 세포는 프로세스를 잘 용납 해야. 대체 방법은 유기체 성장을 위한 생존 가능한 상피 세포를 분리하는 존재(35) 또는 조직 구조를 보존하기 위해36.
자극 프로토콜에 대한 수정은 원하는 판독 및 면역 세포 분석(예를 들어, 대식세포 또는 B 세포)에 따라 용이하게 이루어질 수 있다. 범 자극 시약 PMA/요오마이신의 사용은 TCR 항원 특이성을 차별하지 않으므로 항원이 알려지지 않은 경우에 유용합니다. 그러나, IFN의 생산은 TCR약혼(37)과 밀접하게 연관되어 있으며, IFN 및 TNFα 생산 모두 PDAC 항종양반응(38)에서중요하다. PMA/요오마이신 자극은 종양 미세 환경 내의 T 세포에 의해 생성될 수도 있거나 생성되지 않을 수도 있는 사이토카인을 생성하는 T 세포의 최대 용량을 반영합니다. 내인성 생산은 자극없이 측정 될 수있다; 그러나, 레벨은 훨씬 낮거나 탐지 할 수 있습니다. T 세포를 자극 하는 대체 방법이 있다: 항 CD3/28 코팅 된 구슬, 또한 항원 또는 실제로 다른 면역 세포 인구를 필요로 하지 않는. 이 방법의 장점은 분리 방법없이 특정 T 세포 서브 세트에 의한 사이토 카인 생산의 정량화를 허용하는 것입니다. 세포 독성의 다른 마커 (그란자임 B 및 천포A), 활성 (IL-2) 또는 면역 억제 (IL-10) 또한21을첨가 할 수 있습니다. 그러나, 고품질 유동 세포 분석 항체는 모든 사이토카인 및 관심 요인을 검출하기 위하여 유효하지 않습니다. 따라서, ELISA와 같은 다른 적용이 필요한 경우 브레펠딘 A/모넨신을 포함하지 않고 자극을 수행할 수 있고, 사이토카인이 상판으로 방출될 수 있도록 한다. 그러나, 주의, 이것은 총 세포 사이토 카인 방출을 허용할 것이고 기여한 세포 집단을 결정하는 것은 가능하지 않을 것입니다.
IFNγ 생산은 항종양 T 세포 반응의 지배적특징이며, 종종 TCR 항원인식(37,38)의대용으로 사용된다. 항원 특이적 반응을 보다 정확하게 정의하는 다른 생체 내 방법은 Ovalbumin 또는 SV40과 같은 공지된 항원을 발현하는 종양 세포를 이용한다. 보편적 항원다음 T 세포 인식을 테스트하기 위해 ex vivo를 사용할 수 있거나 또는 TCR 제한 숙주 마우스와 조합하여 사용될 수 있다. 대안적으로, 항원이 알려지지 않은 경우, T 세포 클론 확장의 정량화는 벌크-TCR 염기서열 분석, 또는 최근에 는 단일 세포 TCR 염기서열분석(39,40)에의해 수행될 수 있다. 종양 내 T 세포 반응의 상태를 완전히 이해하려면, 고갈 또는 억제 수용체를 나타내는 마커도 다음을 측정해야 한다: CTLA-4, PD-1, LAG-3, TIM3, 2B4. 뿐만 아니라 이펙터 T 세포(CD44hi,CD62lo)의마커 및 증식 활성, Ki67+ 또는 CSFE 희석41,42,43,44. 전반적으로, 정형화 모델은 치료 전략을 빠르게 테스트하는 유용한 플랫폼을 제공하며, 특히 항종양 T 세포 반응을 조절할 수 있으며, 이는 형질전환, KPC, 마우스의 더 작은 코호트에서 검증될 수 있다.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 동물 기술자 서비스 및 박사 Alzbeta Talarovicova (바트 암 연구소, 런던, 런던, 영국의 퀸 메리 대학)에게 직교 수술 중 도움을 감사드립니다. 우리는 또한 제니퍼 모튼 박사 (암 연구를위한 Beatson 연구소, 글래스고, 영국) 외과 기술에 그녀의 지도에 대한 박사 제니퍼 모튼 (Beatson 연구소, 글래스고, 영국) 외과 기술에 그녀의 지도에 대한 감사드리고 싶습니다, 박사 크리스티나 Ghirelli (바트 암 연구소, 런던, 런던, 런던, 영국의 퀸 메리 대학) 종양 소화에 대한 그녀의 조언과 박사 파비엔 맥클라나한 (바츠 암 연구소, 런던, 런던, 영국) 박사 파비엔 맥클라나한 (바츠 암 연구소, 런던, 런던, 영국) 박사 에 대한 그녀의 조언에 대한 그녀의 조언에 대한 그녀의 조언에 대한 그녀의 조언, 런던, 런던, 영국, 박사 파비엔 맥클라나한 (바츠 암 연구소, 영국, 영국) 우리는 또한 의학 연구 위원회 (MRC), 췌장암 연구 기금 (PCFR) 및 이 연구를 투자한 난소암 행동에 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 6/0 gauge coated vicryl absorbable sutures | Ethicon | W9500T | |
| 70 μm pore-size cell strainer | Fisher Scientific | 11597522 | |
| 9 mm Clay Adams clips | VetTech Solutions | IN015A | |
| anti-CD107a PE (clone 1D4B) | Biolegend | 121612 | 1:100 to culture media |
| anti-CD16/CD32 | BD Biosciences | 553142 | Use at final dilution 1:200 |
| anti-CD3 PerCP eFluor710 (clone 17A2) | Biolegend | 46-0032 | Use at final dilution 1:50 |
| anti-CD4 FITC (clone GK1.5) | eBioscience | 11-0041 | Use at final dilution 1:100 |
| anti-CD45 Brilliant Violet 605 (clone 30-F11) | Biolegend | 103140 | Use at final dilution 1:200 |
| anti-CD8 Brilliant Violet 421 (clone 53-6.7) | Biolegend | 100738 | Use at final dilution 1:100 |
| anti-IFN-gamma PE/Cy7 (clone XMG1.2) | Biolegend | 505826 | Use at final dilution 1:50 |
| anti-TNF-alpha Alexa Fluor 647 (clone MP6-X) | Biolegend | 506314 | Use at final dilution 1:50 |
| BD Matrigel Basement Membrane Matrix High Concentration | BD Biosciences | 354248 | Aliquot on ice and store in -20 °C |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| Cell Stimulation Cocktail (500x) (phorbol 12-myristate 13-acetate (PMA) and ionomycin) | eBioscience | 00-4970-03 | 1x Final concentration PMA 0.081 μM, ionomycin 1.34 μM |
| Clay Adams Autoclip Applier | VetTech Solutions | IN015B | |
| Clay Adams Autoclip remover | VetTech Solutions | IN015B | |
| Collagenase Type V from Clostridium histolyticum | Sigma-Aldrich | C9263 | 2 mg/mL in media |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D2650-100mL | |
| DMEM High glucose (4.5 g/L) with L-Glutamine | PAA | E15-810 | |
| DNase (Deoxyribonuclease I from bovine pancreas Type II-S) stock 10 mg/mL in 0.15 M NaCl | Sigma-Aldrich | D4513 | Final concentration in digestion media 0.025 mg/mL |
| Fixable Viability Dye 506 (FVD506) | eBioscience | 65-0866 | Use at 1:200 in PBS |
| Foetal calf-serum (FCS) | GE Healthcare | A15-104 | 10% in RPMI |
| Hamilton syringe 700 series, 25 μL volume, 22s gauge needle bevel tip | Fisher Scientific | 10100332 | |
| Intracellular Fixation buffer and Intracellular Permeabilisation Buffer | eBioscience | 88-8824-00 | Dilute permeabilisation buffer to 1x in H2O |
| Penicillin/streptomycin | PAA | 15140122 | 100 units/mL Penicillin, 100 μg/mL Streptomycin |
| Protein transport inhibitor cocktail (500x) (brefeldin A and monesin) | eBioscience | 00-4980-03 | 1x Final concentration Brefeldin A 10.6 μM, monensin 2 μM |
| RPMI-1640 (containing 0.3 g/L Glutamine) | Sigma-Aldrich | R8758 | |
| Surgical Scalpel Blade No.10 | Swann-Morton | 0501 | |
| Trypsin-EDTA Solution 10x | Sigma-Aldrich | 594-18C | Trypsin (0.1%) EDTA (0.4%) final concentration |
| U-bottomed 96 microwell plate | VWR | 734-2080 | |
| Universal Cotton Tipped Applicators - 6 inch x 100 | Medisave | UN982 | |
| V-bottomed 96 microwell plate | VWR | 735-0184 |
참고문헌
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Conroy, T., et al. Current standards and new innovative approaches for treatment of pancreatic cancer. European Journal of Cancer. 57, 10-22 (2016).
- Lee, J. W., Komar, C. A., Bengsch, F., Graham, K., Beatty, G. L. Genetically engineered mouse models of pancreatic cancer: The KPC model (LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre), its variants, and their application in immuno-oncology drug discovery. Current Protocols in Pharmacology. 2016, (2016).
- Tseng, W. W., et al. Development of an Orthotopic Model of Invasive Pancreatic Cancer in an Immunocompetent Murine Host. Clinical Cancer Research. 16 (14), 3684-3695 (2010).
- Majumder, K., et al. A Novel Immunocompetent Mouse Model of Pancreatic Cancer with Robust Stroma: a Valuable Tool for Preclinical Evaluation of New Therapies. Journal of Gastrointestinal Surgery. 20 (1), 53-65 (2016).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Herreros-Villanueva, M., Hijona, E., Cosme, A., Bujanda, L. Mouse models of pancreatic cancer. World Journal of Gastroenterology. 18 (12), 1286-1294 (2012).
- Witkiewicz, A. K., et al. Integrated Patient-Derived Models Delineate Individualized Therapeutic Vulnerabilities of Pancreatic Cancer. Cell Reports. , (2016).
- Nicolle, R., et al. Pancreatic Adenocarcinoma Therapeutic Targets Revealed by Tumor-Stroma Cross-Talk Analyses in Patient-Derived Xenografts. Cell Reports. , (2017).
- Spear, S., et al. Discrepancies in the Tumor Microenvironment of Spontaneous and Orthotopic Murine Models of Pancreatic Cancer Uncover a New Immunostimulatory Phenotype for B Cells. Frontiers in Immunology. 10, 542 (2019).
- Zhu, Y., et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models. Cancer Research. , (2014).
- Lee, J. J., Huang, J., England, C. G., McNally, L. R., Frieboes, H. B. Predictive Modeling of In vivo Response to Gemcitabine in Pancreatic Cancer. PLoS Computational Biology. , (2013).
- Clark, C. E., et al. Dynamics of the Immune Reaction to Pancreatic Cancer from Inception to Invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Fukunaga, A., et al. CD8+ tumor-infiltrating lymphocytes together with CD4+ tumor-infiltrating lymphocytes and dendritic cells improve the prognosis of patients with pancreatic adenocarcinoma. Pancreas. 28 (1), 26-31 (2004).
- Tewari, N., et al. The presence of tumor-associated lymphocytes confers a good prognosis in pancreatic ductal adenocarcinoma: an immunohistochemical study of tissue microarrays. BMC Cancer. 13 (1), 436 (2013).
- Royal, R. E., et al. Phase 2 Trial of Single Agent Ipilimumab (Anti-CTLA-4) for Locally Advanced or Metastatic Pancreatic Adenocarcinoma. Journal of Immunotherapy. 33 (8), 828-833 (2010).
- Brahmer, J. R., et al. Safety and Activity of Anti–PD-L1 Antibody in Patients with Advanced Cancer. New England Journal of Medicine. 366 (26), 2455-2465 (2012).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Beatty, G. L., et al. CD40 Agonists Alter Tumor Stroma and Show Efficacy Against Pancreatic Carcinoma in Mice and Humans. Science. 331 (6024), 1612-1616 (2011).
- Lutz, E. R., et al. Immunotherapy converts nonimmunogenic pancreatic tumors into immunogenic foci of immune regulation. Cancer Immunology Research. 2 (7), 616-631 (2014).
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews. Immunology. 2 (6), 401-409 (2002).
- Mojic, M., Takeda, K., Hayakawa, Y. The dark side of IFN-γ: Its role in promoting cancer immunoevasion. International Journal of Molecular Sciences. , (2018).
- Castro, F., Cardoso, A. P., Gonçalves, R. M., Serre, K., Oliveira, M. J. Interferon-gamma at the crossroads of tumor immune surveillance or evasion. Frontiers in Immunology. , (2018).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nature Immunology. , (2011).
- Betts, M. R., et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. Journal of Immunological Methods. 281 (1-2), 65-78 (2003).
- Schuerwegh, A. J., De Clerck, L. S., Bridts, C. H., Stevens, W. J. Comparison of intracellular cytokine production with extracellular cytokine levels using two flow cytometric techniques. Cytometry. 55 (1), 52-58 (2003).
- Partecke, L. I., et al. A syngeneic orthotopic murine model of pancreatic adenocarcinoma in the C57/BL6 mouse using the panc02 and 6606PDA cell lines. European Surgical Research. , (2011).
- An, X., et al. Immunophenotyping of Orthotopic Homograft (Syngeneic) of Murine Primary KPC Pancreatic Ductal Adenocarcinoma by Flow Cytometry. Journal of Visualized Experiments. (140), (2018).
- Jiang, Y. J., et al. Establishment of an orthotopic pancreatic cancer mouse model: Cells suspended and injected in Matrigel. World Journal of Gastroenterology. , (2014).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. , (2017).
- Liu, Q., et al. Effects of enzymatic digestion, cell culture and preservation conditions on surface CD62L expression of primary murine CD3+CD4+T cells. Biomedical Research (India). 29 (10), 2153-2159 (2018).
- Seaman, S. A., Tannan, S. C., Cao, Y., Peirce, S. M., Lin, K. Y. Differential effects of processing time and duration of collagenase digestion on human and murine fat grafts. Plastic and Reconstructive Surgery. , (2015).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. EMBO Journal. , (2013).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. , (2015).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Scientific Reports. , (2019).
- Moran, A. E., Polesso, F., Weinberg, A. D. Immunotherapy Expands and Maintains the Function of High-Affinity Tumor-Infiltrating CD8 T Cells In Situ. The Journal of Immunology. , (2016).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. , (2015).
- Singh, M., et al. High-throughput targeted long-read single cell sequencing reveals the clonal and transcriptional landscape of lymphocytes. Nature Communications. 10 (1), 3120 (2019).
- Jiang, N., Schonnesen, A. A., Ma, K. Y. Opinion Ushering in Integrated T Cell Repertoire Profiling in Cancer. Trends in Cancer. 5, 85-94 (2019).
- Schietinger, A., et al. Tumor-Specific T Cell Dysfunction Is a Dynamic Antigen-Driven Differentiation Program Initiated Early during Tumorigenesis. Immunity. 45 (2), 389-401 (2016).
- Raghav, S. K., et al. Exhaustion of tumor-specific CD8+ T cells in metastases from melanoma patients. Journal of Clinical Investigation. , (2011).
- Gros, A., et al. PD-1 identifies the patient-specific in filtrating human tumors. The Journal of Clinical Investigation. , (2014).
- Miller, B. C., et al. Subsets of exhausted CD8 + T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. , (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유