Method Article
프로테오믹스 시설 제출 및 후속 데이터 분석을 위한 TMT 샘플 준비
요약
단백질 추출, 정량화, 강수량, 소화, 라벨링, 프로테오믹스 시설에 대한 제출, 데이터 분석 등 각 단계에 대한 자세한 정보를 포함하는 최적화된 탠덤 질량 태그(TMT) 라벨링 프로토콜을 제시합니다.
초록
프로테오믹 기술은 질병, 치료 또는 프로테오메에 대한 다른 조건이 전체적으로 미치는 영향에 대한 세계적인 견해를 제공함으로써 생물학적 시스템에서 의 작용 메커니즘에 대한 우리의 이해를 도울 수 있는 강력한 방법론입니다. 이 보고서는 단백질 샘플의 추출, 정량화, 침전, 소화, 라벨링 및 후속 데이터 분석을 위한 상세한 프로토콜을 제공합니다. 당사의 최적화된 TMT 라벨링 프로토콜은 낮은 태그 라벨 농도를 필요로 하며 일관되게 신뢰할 수 있는 데이터를 달성합니다. 우리는 시험관내에서 배양된 세포뿐만 아니라 다양한 마우스 조직(즉, 심장, 골격근 및 뇌)에서 단백질 발현 프로파일을 평가하기 위해 이 프로토콜을 사용했습니다. 또한 결과 데이터 집합에서 수천 개의 단백질을 평가하는 방법을 설명합니다.
서문
용어 "프로테오믹스"는 먼저 세포, 조직, 또는유기체1의 전체 단백질 보체의 대규모 특성화로 정의되었다. 프로테오믹 분석은 단백질 발현 수준의 상대적 정량을 수행하는 기술을 사용하여 질병 발달, 치료 경로 및 건강한 시스템에 관련된 메커니즘 및 세포 프로세스의 조사를 가능하게 합니다2. 이러한 연구의 초기 설명은 1975년에 발표되었으며, 이러한 목적을 위해 2차원 폴리아크릴아미드 겔 전기영동(2D-PAGE)의 사용을입증하였다 1,,3. 2D 방법은 전하(등전초점, IEF) 및 분자량(황산나트륨 폴리아페이트 폴리아크릴아미드 겔 전기영동체 또는 SDS-PAGE)에 기초하여 단백질을 분리한다 4.4 수년 동안, 각 겔 성분에 대해 수행된 2D-PAGE 및 후속 탠덤 질량 분석법의 조합은 가장 일반적인 비표적 단백질 발현 분석 기술이 수행되었고 수많은 이전에 알려지지 않은 단백질 발현 프로파일5,,6을확인하였습니다. 2D-PAGE 접근법의 일반적인 단점은 시간이 많이 걸리고 소수성 단백질에 대해 잘 작동하지 않으며, 낮은 민감도7,,8로인해 평가된 총 단백질 수에 한계가 있다는 것입니다.
세포 배양(SILAC) 방식에서 아미노산에 의한 안정한 동위원소 라벨링은 샘플9에서단백질 풍부도를 식별하고 정량화하는 다음 대중적인 접근법이 되었다. 표준 필수 아미노산이 결여된 배지에서 배양되고 그 특정 아미노산10의동위원소 표지 버전으로 보충되는 세포의 대사 라벨링으로 구성된다. 이 기술의 장점은 효율성과 정밀한 라벨링9입니다. SILAC 접근법의 주요 제한은 주로 동위원소 라벨 혼입에 의한 세포 성장 속도 감소이며, 이는 인간 질병을 모델링하는 비교적 민감한 세포주에서 특히 어려울 수있다(11).
2003년, 탠덤 질량 태그(TMT) 동위 원소 라벨을 포함하는 참신하고 강력한 프로테오믹스 기술이 필드12에도입되었다. TMT 라벨링은 상대단백질 발현 수준 및 번역 후 변형을 검출하는 민감도증가(13)로인해 강력한 방법이다. 이 발행일 현재, TMT 키트는 6, 10, 11 또는 16개의 샘플을 동시에 라벨로 지정할 수 있는 것으로 개발되었습니다. 그 결과, 생물학적 복제가 동시에14,,15,,16을가진 여러 조건에서 펩티드 풍부도를 측정할 수 있다. 우리는 최근에 바스 증후군 (BTHS)17의마우스 모델의 심장 프로테오믹 프로파일을 특성화하기 위해 TMT를 사용했습니다. 이렇게, 우리는 유전자 치료로 취급된 BTHS 마우스의 심장 단면도에 있는 광범위한 개선을 설명하고 심근병증에서 관련시킨 새로운 치료 통로를 밝힌 BTHS에 의해 영향을 받은 새로운 단백질을 확인할 수 있었습니다.
여기서, 우리는 조직 샘플 또는 세포 펠릿을 사용하여 멀티플렉스 TMT 정량 단백질학 분석을 수행하는 상세한 방법을 기술한다. 표지된 트립틱 펩타이드가 원시 냉동 샘플보다 더 안정적이기 때문에 코어에 제출하기 전에 시료 준비 및 라벨링을 수행하는 것이 유리할 수 있으며, 모든 코어가 모든 샘플 유형을 처리한 경험이 있는 것은 아니며, 실험실에서 샘플을 준비하면 종종 긴 백로그가 있는 코어에 대한 시간을 절약할 수 있습니다. 이 과정의 질량 분광 부분에 대한 자세한 설명은 Kirshenbaum 외 및 페루말 외18,19을참조하십시오.
시료 전처리 프로토콜은 추출, 정량화, 침전, 소화 및 라벨링과 같은 주요 단계로 구성됩니다. 이 최적화된 프로토콜의 주요 이점은 라벨링 비용을 절감하고, 단백질 추출을 개선하며, 고품질 데이터를 일관되게 생성한다는 것입니다. 또한 TMT 데이터를 분석하여 짧은 시간 내에 수천 개의 단백질을 선별하는 방법을 설명합니다. 우리는이 프로토콜이 자신의 연구에이 강력한 방법론을 통합 고려하는 다른 연구 그룹을 장려 바랍니다.
프로토콜
플로리다 대학의 기관 동물 관리 및 사용 위원회는 모든 동물 연구를 승인했습니다.
1. 시약의 준비
- CHAPS 용해 완충제 (150 mM KCl, 50 mM HEPES pH = 7.4, 0.1% CHAPS 및 완충액 50 mL 당 1 프로테아제 억제제 칵테일 정제)를 준비합니다. 프로테아제 억제제가 없는 완충액은 최대 6개월 동안 4°C에서 보관하거나 프로테아제 억제제가 -20°C에서 최대 1년까지 보관하여 완충할 수 있다.
- 100 mM 트리에틸라모늄 중탄산염 (TEAB) 준비: 초순수 4.5 mL에 1 M TEAB 의 500 μL을 추가하십시오.
- 200 mM 트리스 (2-카박스체틸) 포스핀 염산염 (TCEP) 준비 : 70 μL의 0.5 M TCEP, 변성 시약, 초순수 70 μL을 추가합니다. 그런 다음 1 M TEAB의 35 μL을 추가합니다.
- 5% 하이드록실라민 준비: 50% 하이드록실라민 50 μL을 100 mM TEAB의 450 μL에 추가하십시오.
2. 단백질 추출
- IACUC 승인 프로토콜에 따라 안락사 마우스로부터 사두근 근육을 분리합니다. -80°C에서 동결 및 유지하거나 즉시 사용하기 위해 프로토콜을 계속 사용하십시오.
- 신선하거나 냉동 된 사두근 마우스 조직의 약 10mg을 분리하기 위해 잘라냅니다. 골격 근으로 작업 할 때 핀셋을 사용하여 섬유를 분리하십시오. 대안적으로, 세포 배양물로 작업하는 경우, CHAPS 라시스 완충액의 300 μL에서 ~3 x 106 세포를 다시 중단하고 2.4단계로 건너뜁니다.
- 약 2mL의 1 mm 지르코니아/실리카 비드 및 500 μL의 CHAPS 용해 완충제으로 채워진 2 mL 튜브를 사용하여 비드 파괴기를 사용하여 조직을 균질화합니다. 적절하게 확장 또는 축소(예를 들어, CHAPS 용해 완충제 250 μL에서 5 mg의 조직).
- DNA에 결합된 단백질을 방출하기 위해 초음파 처리(진폭 50% 및 얼음 에 30초 간격으로 각각 10s의 경우 10배)를 수행합니다. 동일한 DNA 분해 결과는 1 mL 주사기에 부착된 21 G 바늘을 통해 용해10배를 통과시킴으로써 주사기 용해또는 30분 동안 37°C에서 벤조나아제 배양(44 U/mL)에 의해 달성될 수 있다.
- 4°C에서 10분 동안 16,000 x g에서 용해시키고 상구체를 새로운 원심분리관으로 옮긴다.
3. 단백질 측정
- 확립된 프로토콜을 사용하여 상수의 단백질 농도를 결정합니다(재료 표참조).
참고: ≥2 μg/μL에서 샘플을 사용하는 것이 가장 좋지만 덜 농축된 샘플도 사용할 수 있습니다. 덜 농축된 시료를 사용하는 경우 5.1단계에서 환원/알킬라이팅 시약의 부피를 적절히 조정해야 합니다. - CHAPS 용해 버퍼를 사용하여 BSA 표준 곡선 희석을 준비합니다.
- 제조업체의 지침을 따르고 15 분 후에 750 nm에서 흡광도를 읽으십시오.
4. 환원/알킬레이트 시약 처리
- 조건당 200 μg의 단백질을 새로운 원심분리기 튜브로 옮기고 CHAPS 용해 완충액을 사용하여 최종 부피 100 μL로 조정합니다. 단백질 농도가 너무 낮을 때 최대 200 μL까지 확장할 수 있지만 환원/알킬라이팅 시약의 부피를 적절하게 조정하는 것을 잊지 마십시오.
- 200 mM TCEP의 5 μL을 추가하고 1 시간 동안 55 °C에서 샘플을 배양하십시오.
- 사용 직전에, 100 mM TEAB의 132 μL로 요오도아세타미드(즉, 9 mg)의 튜브를 용해시킴으로써 375 mM 요오도아세타미드를 준비한다. 빛으로부터 이 솔루션을 보호하십시오.
- 시료에 375 mM 요오도아세타미드 5 μL을 넣고 빛으로부터 보호된 실온(RT)에서 30분 동안 배양합니다.
5. 메탄올/클로로폼 강수량20
- 단백질 100 μL과 간략하게 소용돌이 샘플에 400 μL의 메탄올을 추가합니다.
- RT에서 10초 동안 9,000 x g의 원심분리기. 이것은 샘플 튜브의 측면에 증착 된 액체를 통합하는 것입니다.
- 혼합물에 100 μL의 클로로포름을 넣고 잠시 소용돌이를 보입니다. 시료에 인지질 농도가 높은 경우 클로로폼 200 μL을 사용하십시오.
- RT에서 10초 동안 9,000 x g의 원심분리기. 이것은 샘플 튜브의 측면에 증착 된 액체를 통합하는 것입니다.
- 300 μL의 물과 소용돌이를 힘차게 넣습니다. 균일 한 용액을 얻는 것이 중요합니다.
- RT에서 1 분 동안 9,000 x g의 원심 분리기는 튜브를 랙으로 옮길 때 레이어가 방해되지 않도록 매우 주의하십시오.
참고 : 튜브는 이제 세 단계를 포함해야합니다 : 1) 상층 (즉, 상층), 물과 메탄올의 혼합물; 2) 중간 층 (즉, 상간), 백색 침전 단백질; 및 3) 바닥 층 (즉, 바닥 상), 클로로 포름. - 조심스럽게 장식품을 제거하십시오.
- 남은 상 간 및 바닥 단계에 300 μL의 메탄올을 추가합니다. 적극적으로 소용돌이.
- RT에서 2 분 동안 9,000 x g의 원심 분리기는 튜브를 랙으로 옮길 때 레이어가 방해되지 않도록 매우 주의하십시오.
- 조심스럽게 장식품을 제거하십시오.
- 펠릿이 약간 촉촉할 때까지 RT에서 공기 흐름(예: 진공 농축기 사용)에서 가능한 한 많은 액체를 부드럽게 흡인합니다(~10분). 각 샘플마다 필요한 시간이 다를 수 있기 때문에 2분마다 확인하여 평가합니다. 펠릿을 추가 처리될 때까지 -80°C에서 보관하십시오.
6. 단백질 소화
- TEAB 라시스 완충제 의 100 μL에서 침전된 단백질 펠릿을 다시 중단시.
참고: 이 단계에서 단백질 농도를 측정하는 것은 선택 사항입니다. - 사용 직전에 트립신 저장 용액(50 mM 아세트산)의 100 μL을 100 μg 트립신 유리 바이알 바닥에 첨가하여 1 μg/μL 트립신을 준비하고 RT. 저장소에 남은 시약을 -80°C에서 일회용 용량으로 5분 동안 배양합니다.
- 단백질 100 μg당 트립신 2.5 μL을 첨가하십시오. 샘플을 37°C에서 밤새 소화합니다. 이 단계는 단백질의 완전한 용해화를 위해 중요합니다. 이러한 조건을 수정하지 마십시오. 소화 에 이어, 표준 단백질 측정을 사용하여 단백질 농도를 측정하는 것은 선택 사항입니다.
7. 펩타이드 라벨링
- 사용 직전에 TMT 라벨 키트 시약을 RT와 평형화하십시오.
- 각 튜브에 무수 아세토니트릴 41 μL을 첨가하여 0.8 mg TMT 태그 바이알을 각각 용해시다. 가끔 소용돌이와 RT에서 5 분 동안 시약을 배양. 튜브를 잠시 원심 분리합니다.
참고: TMT 태그0.8 mg의 농도는 일반적으로 두 세트에 라벨을 붙이기에 충분합니다. 그러나 다른 연구자들은 이 농도가 더 감소될 수 있고 여전히 신뢰할 수 있는 데이터15를산출할 수 있음을 입증했다. - 각 100 μL 샘플에 TMT 라벨 시약 의 41 μL을 조심스럽게 추가하십시오.
- RT에서 1 시간 동안 반응을 배양하십시오.
- 시료에 5% 하이드록실라민 8 μL을 넣고 15분 동안 배양하여 반응을 담급질합니다.
- 샘플을 새로운 원심분리기 튜브에서 동일한 양으로 분할하고 -80°C에서 보관합니다.
참고 : 이 단계에서 샘플은 안정적이며 질량 분광법을 위해 제출 할 수 있습니다. 표준 단백질 측정을 사용하여 이 시점에서 농도를 측정하는 것은 선택 사항입니다.
8. 질량 분광법
- 샘플을 프로테오믹스 시설(이 연구는 UF ICBR Proteomics Core 시설을 사용함)에 제출하여 모든 샘플을 C18 스핀 컬럼을 사용하여 결합하고 정제합니다.
참고: 샘플을 준비하기 전에 샘플을 제출하는 방법을 핵심 시설과 상의하여 제출에 선호하는 정확한 단계를 확인합니다. - 결합된 멀티플렉스 샘플당 다음과 같은 절차를 요청하십시오: 고체 상 추출, HPLC (SCX, SE), 지퍼 팁 및 LC-MS/MS(단백질 ID의 경우 2시간 구배, 경우 >10QE Plus).
- 데이터가 수집되면 핵심 시설은 단백질 식별을 위해 공급업체에서 제공한 소프트웨어를 사용하여 RAW 파일을 처리합니다.
9. 데이터 분석
- 데이터는 일반적으로 코어에서 사용자에게 7z 형식으로 다시 전달되며, 각 데이터 집합당 약 16GB의 디스크 공간이 필요할 수 있습니다(이 경우 11개의 샘플). 데이터 처리의 경우 3.4GHz 이상의 컴퓨터를 사용할 수 있는지 확인합니다.
- 7-Zip 파일 관리자를 사용하여 파일을 추출합니다. 이러한 추출 된 파일은 RAW 데이터, pdStudy 형식 파일 및 pdResultView 형식 파일이 포함되어 있습니다. 추가 분석을 위해 모든 파일을 저장합니다.
- 프로테오메 디스커버리 2.2 소프트웨어를 사용하여 파일을 엽니다.
참고: 파일 형식은 "파일 name.pdStudy"입니다. "파일 name.pdResultView"를 열면 제어 샘플을 선택할 수 없습니다. - "샘플" 패널에서 제어 샘플을선택합니다.
- "분석결과"패널에서 ID를 선택하여 결과를 엽니다.
- 스프레드시트 소프트웨어로 내보냅니다.
- 원시 데이터(확인된 모든 단백질)를 저장합니다.
- 스프레드시트 소프트웨어 파일을 엽니다. 이것은 확인된 모든 단백질을 포함할 것입니다.
- 스프레드시트 소프트웨어 파일에서"필터"기능을 사용하여"단백질 FDR 신뢰도: 고(열 B)에서 " 결합" "#Unique펩타이드" 2 (열 K)이상, 그리고"풍부도 비율"중 하나를 단독으로(열 S최대 W).
- 함수와 함께"p-값"계산에 대한 열 삽입
=TTEST(대조군, 실험군, 꼬리, 유형) - 함수와 함께"통계적 유의성"열을 삽입합니다.
=IF(p-value<0.05, "중요성",NS") - "필터"기능을 사용하여"통계적 유의성"표시"의유"를 표시합니다. 결과는 대조군 및 실험군에서 통계적 유의를 갖는 분석된 단백질을 나타낸다.
- 대조군과 비교하여 실험군에서 단백질 발현량이 현저히 높거나 낮게 결정하며,"Regulation"에 대한 컬럼을 삽입한다.
=IF(평균(대조군)>평균(실험군),"업규제","하향규제")
10. 중요한 안타를 평가하는 방법
- TMT 연구에서 확인된 중요한 적중항 간의 단백질-단백질 상호 작용을 확인하려면 검색 도구를 사용하여 상호 작용 유전자/단백질(STRING) 버전 11.021: https://string-db.org/
- 그룹으로 분류하려면 (즉, 분자 기능, 생물학적 과정 및 단백질 클래스) 진화 적 관계 (PANTHER)를 통해 단백질 분석을 사용하여22: http://www.pantherdb.org/
- 다양한 경로에서 단백질 상호 작용을 식별하려면 경로 분석 소프트웨어23을사용합니다.
11. 저장소 은행에 프로테오믹 데이터 업로드
- Proteomics IDEntificantions 데이터베이스 (PRIDE) 또는 질량 분광인터랙티브 가상 환경 (MassIVE)에 프로테오믹스 데이터를 제출하려면 다음과 같은 정보가 포함됩니다 : 피크 목록 파일 (mzXML과 같은 표준 형식으로 처리 된 질량 스펙트럼 파일, mzML 또는 MGF), 결과 파일(mzIdentML 또는 mzTab과 같은 표준 형식의 스펙트럼 식별), 원시 스펙트럼 파일(예: 비표준 또는 계측기 별 형식의 원시 질량 스펙트럼 파일) RAW 파일 또는 . WIFF 파일)을 참조하십시오.
- 제출하려면 계정을 만들고 소속 및 프로젝트 세부 정보와 같은 정보를 포함합니다. 그런 다음 11.1단계에 나열된 파일을 선택하고 업로드합니다.
- 공식 데이터 집합을 만들려면 업로드된 파일에 대한 제출 워크플로를 실행합니다.
참고: 제출 후 데이터 집합은 리포지토리 뱅크에서 비공개로 설정됩니다. 개인 옵션을 사용하면 권한이 있는 사용자만 데이터를 사용할 수 있습니다. 두 가지 추가 옵션이 있습니다: 1) 저널 검토자 및 공동 작업자에 대 한 액세스를 제공 하는 공유 데이터 집합; 또는 2) 공개 데이터 집합에 표시됩니다. 이러한 리포지토리의 또 다른 중요한 기능은 업로드된 데이터를 업데이트하고 후속 게시를 기존 데이터 집합과 연결하는 기능입니다.
결과
건강하고 병에 걸린 세포는 CHAPS 버퍼에서 용해되었고, TMT 라벨링 방법에 자세히 설명되어 있으며, 플로리다 대학 생명 공학 연구 센터 (UF-ICBR) 프로테오믹스 코어와 탠덤 질량 분석법을 사용하여 액체 크로마토그래피에 제출했습니다. 코어로부터의 데이터 수집 및 전달에 이어, 데이터 세트는 공급업체가 제공한 소프트웨어에서 열렸고, 다음과 같은 컷오프 필터가 적용되었다: ≥2 고유 펩티드, 모든 채널에 존재하는 각 단백질 샘플에 대한 리포터 이온, 그리고 현저하게 변경된 단백질만을 포함한다(p ≤ 0.05). 표 1은 데이터를 요약합니다: 총 펩티드 39,653개, 그 중 7,211개는 2개의 고유 펩티드보다 동일하거나 더 큰, 3,829는 모든 채널에 대한 리포터 이온을 포함한다. 이들 3,829개의 펩티드에 대한 p 값은 학생의 t 시험에 의해 계산되었고 p ≤ 0.05는 유의한 것으로 간주되었다. 또한, 배-변화 차단은 건강한 세포에 비해 병에 걸린 단백질의 상대적 분포를 결정하기 위해 사용되었다: 하향조절(blue) 또는 업레테(red)(도 1).
현저하게 dysregulated 단백질 발현의 목록은 PANTHER 온톨로지 분류 시스템 및 STRING 분석을 사용하여 평가되었다. Panther 분석은 분자 기능에 근거를 둔 병에 걸린 세포에 있는 현저하게 더 낮은(그림 2A)또는 더 높은 풍부에 근거를 둔 단백질의 분류된 목록을 보여주었습니다(그림 2B). 현저히 낮은 단백질의 현성 분석(도 2C)이상(도 2D)풍부도는 단백질 사이의 다중 상호 작용 및 강한 연관성을 확인하였다.
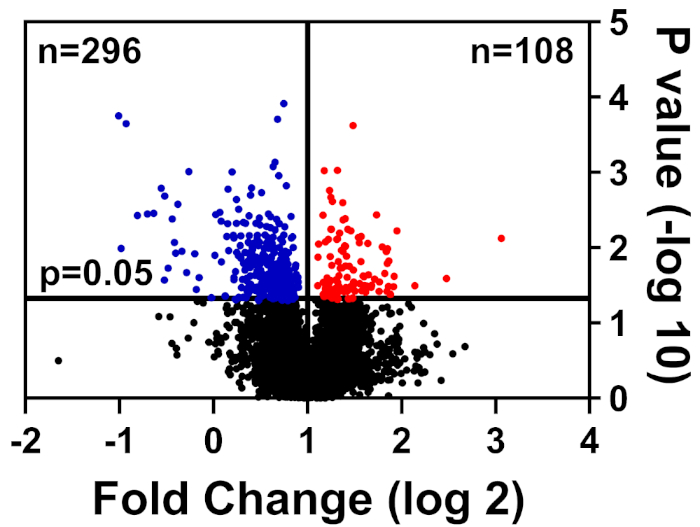
그림 1: 풍부도가 크게 변경되지 않은 단백질을 표시하는 화산 플롯(검은색), 현저히 낮아진(파란색), 또는 건강한 대조군 세포에서 현저히 증가(빨간색) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
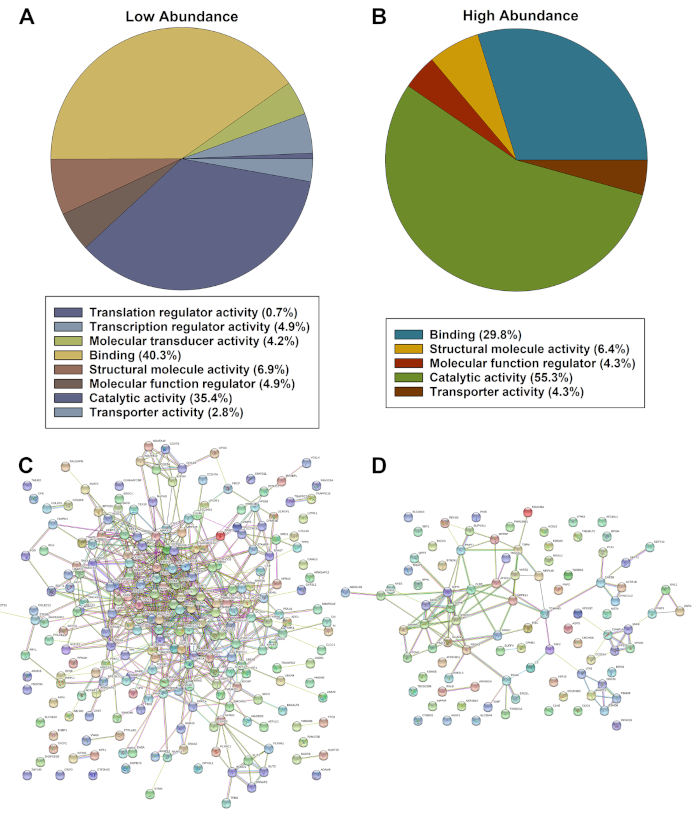
그림 2: 현저히 낮거나 더 높은 풍부 단백질의 PANTHER(A, B) 및 스트링(C, D)에 의해 확인된 현저하게 dysregulated 적중된 적중의 대표적인 평가. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 총 펩타이드 | 식별된 총 | ≥ 2 독특한 펩티드 | 정량화된 단백질 | 현저하게 변경된 단백질 | |
| 낮은 | 높은 | ||||
| 39653 | 7211 | 4457 | 3829 | 296 | 108 |
표 1: 데이터 집합 분석당 정량화된 단백질의 대표적인 표.
토론
TMT 기반 동위원소 안정 동위원소 라벨링 방법을 사용하여 프로테오믹 분석을 위한 샘플을 성공적으로 제조하려면 4°C에서 단백질 추출을 매우 신중하게 수행하고 프로테아제 억제제칵테일(24,,25)을포함하는 용해 완충제(lysis buffer)를 사용하는 것이 중요하다. 프로테아제 억제제 칵테일은 단백질 소화 중에 예기치 않은 단백질 분해를 피하기 위한 중요한 시약입니다. 우리의 프로토콜과 공급 업체에 의해 제공 된 현재 의정서 사이의 한 가지 주요 차이점은 우리가 강력 하 게 포유류 세포와 조직에 우리의 경험을 기반으로 CHAPS 용해 버퍼의 사용을 권장. 우리는 또한 세포 펠 릿 및 조직 모두에 대 한 메탄올/클로로포름 단백질 침전 접근을 사용 하 여 제안.
이상적으로는 단백질 추출, 측정, 환원/알킬라이팅 시약 처리 및 메탄올/클로로폼 침전이 모두 같은 날에 수행됩니다. 이 권고에 따라 후속 라벨링에 대 한 더 정확한 단백질 농도 귀 착될 것 이다. 단백질 침전 단계는 탠덤 질량 분광법을 방해하는 시약의 제거에 중요합니다. 강수 단계를 포함하면 TMT26의분해능이 크게 향상됩니다. 요약하자면, TMT 프로토콜의 주요 장점은 다양한 유형의 샘플에 대한 높은 라벨링 효율성, 재현성 및 수집된 신뢰할 수 있는 데이터입니다.
이 TMT 비표적 프로테오믹스 전략의 멀티플렉스 특성이 계속 확장됨에 따라 다양한 분야에서 연구자의 능력을 점진적으로 향상시켜 새로운 발견을 할 것입니다. 특히 생물 의학 분야에서, 우리와 다른 사람들은 질병과 다양한 치료법의 상대적 영향에 대한 새로운 작용 메커니즘을 탐구하는 연구에서이 기술이 점점 더 유익하다고 발견했습니다. 이러한 모든 이유로, 이 강력한 기술은 현대 연구 연구에 사용되는 다른 OMICS 접근법의 레퍼토리를 보완하고 추가 치료 개발을 안내 할 수있는 주요 정보를 제공합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 우리의 견본의 그들의 처리를 위한 UF-ICBR proteomics 시설을 인정하고 싶습니다. 이 작품은 건강 R01 HL136759-01A1 (CAP)의 국립 연구소에 의해 부분적으로 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 1 M Triethylammonium bicarbonate (TEAB), 50 mL | Thermo Fisher | 90114 | Reagent for protein labeling |
| 50% Hydroxylamine, 5 mL | Thermo Fisher | 90115 | Reagent for protein labeling |
| Acetic acid | Sigma | A6283 | Reagent for protein digestion |
| Anhydrous acetonitrile, LC-MS Grade | Thermo Fisher | 51101 | Reagent for protein labeling |
| Benzonaze nuclease | Sigma-Aldrich | E1014 | DNA shearing |
| Bond-Breaker TCEP solution, 5 mL | Thermo Fisher | 77720 | Reagent for protein labeling |
| BSA standard | Thermo | 23209 | Reagent for protein measurement |
| CHAPS | Thermo Fisher | 28300 | Reagent for protein extraction |
| Chloroform | Fisher | BP1145-1 | Reagent for protein precipitation |
| cOmplete, EDTA-free Protease Inhibitor Cocktail Tablet | Roche | 4693132001 | Reagent for protein extraction |
| DC Protein Assay | BioRad | 500-0116 | Reagent for protein measurement |
| Excel | Microsoft Office | Software for data analyses | |
| Heat block | VWR analog | 12621-104 | Equipment for protein digestion incubation |
| HEPES | Sigma | RDD002 | Reagent for protein extraction |
| Methanol | Fisher | A452-4 | Reagent for protein precipitation |
| Pierce Trypsin Protease, MS Grade | Thermo Fisher | 90058 | Reagent for protein digestion |
| Potassium chloride | Sigma | 46436 | Reagent for protein extraction |
| Sigma Plot 14.0 | Sigma Plot 14.0 | Software for data analyses | |
| Sonicator | Fisher Scientific | FB120 | DNA shearing |
| Spectra Max i3x Multi-Mode Detection Platform | Molecular Devices | Plate reader for protein measurement | |
| Thermo Scientific Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher | 23275 | Reagent for protein measurement |
| Thermo Scientific Pierce Quantitative Fluorescent Peptide Assay | Thermo Fisher | 23290 | Reagent for protein measurement |
| Thermo Scientific Proteome Discoverer Software | Thermo Fisher | OPTON-30945 | Software for data analyses |
| TMT 10plex Isobaric Label Reagent Set 0.8 mg, sufficient reagents for one 10plex isobaric experiment | Thermo Fisher | 90110 | Reagent for protein labeling |
| TMT11-131C Label Reagent 5 mg | Thermo Fisher | A34807 | Reagent for protein labeling |
| Water, LC-MS Grade | Thermo Fisher | 51140 | Reagent for protein extraction |
참고문헌
- Graves, P. R., Haystead, T. A. Molecular biologist's guide to proteomics. Microbiology and Molecular Biology Reviews. 66 (1), 39-63 (2002).
- Erdjument-Bromage, H., Huang, F. K., Neubert, T. A. Sample Preparation for Relative Quantitation of Proteins Using Tandem Mass Tags (TMT) and Mass Spectrometry (MS). Methods in Molecular Biology. 1741, 135-149 (2018).
- O'Farrell, P. H. High resolution two-dimensional electrophoresis of proteins. Journal of Biological Chemistry. 250 (10), 4007-4021 (1975).
- Rabilloud, T., Lelong, C. Two-dimensional gel electrophoresis in proteomics: a tutorial. Journal of Proteomics. 74 (10), 1829-1841 (2011).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Molecular & Cellular Proteomics. 1 (5), 376-386 (2002).
- Anderson, N. G., Anderson, N. L. Twenty years of two-dimensional electrophoresis: Past, present and future. Electrophoresis. 17 (3), 443-453 (1996).
- Haynes, P. A., Yates, J. R. Proteome profiling-pitfalls and progress. Yeast. 17 (2), 81-87 (2000).
- Bunai, K., Yamane, K. Effectiveness and limitation of two-dimensional gel electrophoresis in bacterial membrane protein proteomics and perspectives. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences. 815 (1-2), 227-236 (2005).
- Sury, M. D., Chen, J. X., Selbach, M. The SILAC fly allows for accurate protein quantification in vivo. Molecular & Cellular Proteomics. 9 (10), 2173-2183 (2010).
- Zhang, G., Neubert, T. A. Use of stable isotope labeling by amino acids in cell culture (SILAC) for phosphotyrosine protein identification and quantitation. Methods in Molecular Biology. 527, 79-92 (2009).
- Wang, X., et al. SILAC-based quantitative MS approach for real-time recording protein-mediated cell-cell interactions. Scientific Reports. 8 (1), 8441 (2018).
- Thompson, A., et al. Tandem Mass Tags: A Novel Quantification Strategy for Comparative Analysis of Complex Protein Mixtures by MS/MS. Analytical Chemistry. 75, 1895-1904 (2003).
- Cheng, L., Pisitkun, T., Knepper, M. A., Hoffert, J. D. Peptide Labeling Using Isobaric Tagging Reagents for Quantitative Phosphoproteomics. Methods in Molecular Biology. 1355, 53-70 (2016).
- Navarrete-Perea, J., Yu, Q., Gygi, S. P., Paulo, J. A. Streamlined Tandem Mass Tag (SL-TMT) Protocol: An Efficient Strategy for Quantitative (Phospho)proteome Profiling Using Tandem Mass Tag-Synchronous Precursor Selection-MS3. Journal of Proteome Research. 17 (6), 2226-2236 (2018).
- Zecha, J., et al. TMT Labeling for the Masses: A Robust and Cost-efficient, In-solution Labeling Approach. Molecular & Cellular Proteomics. 18 (7), 1468-1478 (2019).
- Bachor, R., Waliczek, M., Stefanowicz, P., Szewczuk, Z. Trends in the Design of New Isobaric Labeling Reagents for Quantitative Proteomics. Molecules. 24 (4), E701 (2019).
- Suzuki-Hatano, S., et al. AAV9-TAZ Gene Replacement Ameliorates Cardiac TMT Proteomic Profiles in a Mouse Model of Barth Syndrome. Molecular Therapy - Methods & Clinical Development. 13, 167-179 (2019).
- Kirshenbaum, N., Michaelevski, I., Sharon, M. Analyzing large protein complexes by structural mass spectrometry. Journal of Visualized Experiments. (40), e1954 (2010).
- Perumal, N., et al. Sample Preparation for Mass-spectrometry-based Proteomics Analysis of Ocular Microvessels. Journal of Visualized Experiments. (144), e59140 (2019).
- Wessel, D., Flügge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Analytical Biochemistry. 138, 141-143 (1984).
- Jensen, L. J., et al. STRING 8--a global view on proteins and their functional interactions in 630 organisms. Nucleic Acids Research. 37, D412-D416 (2009).
- Mi, H., Muruganujan, A., Casagrande, J. T., Thomas, P. D. Large-scale gene function analysis with the PANTHER classification system. Nature Protocols. 8 (8), 1551-1566 (2013).
- Cirillo, E., Parnell, L. D., Evelo, C. T. A Review of Pathway-Based Analysis Tools That Visualize Genetic Variants. Frontiers in Genetics. 8, 174 (2017).
- Plaxton, W. C. Avoiding Proteolysis during the Extraction and Purification of Active Plant Enzymes. Plant and Cell Physiology. 60 (4), 715-724 (2019).
- Ryan, B. J., Henehan, G. T., Walls, D., Loughran, S. T. . Protein Chromatography: Methods and Protocols. , 53-69 (2017).
- Fic, E., Kedracka-Krok, S., Jankowska, U., Pirog, A., Dziedzicka-Wasylewska, M. Comparison of protein precipitation methods for various rat brain structures prior to proteomic analysis. Electrophoresis. 31 (21), 3573-3579 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유