Method Article
고처리량 전기화학발광 7-Plex 분석으로 제1형 당뇨병 및 다발성 자가면역질환 동시 스크리닝
* 이 저자들은 동등하게 기여했습니다
요약
7개의 자가항체 분석을 함께 결합하는 간단한 멀티플렉스 ECL 분석을 모델링합니다. 이 분석은 체강 질병,자가 면역 갑상선 질환 및자가 면역 다선 증후군 1을 포함하여 T1D 및 여러 다른자가 면역 질환을 동시에 스크리닝 할 수 있습니다.
초록
췌도 자가항체(IAbs)는 제1형 당뇨병(T1D) 진단 및 예측에 널리 사용됩니다. 인슐린 (IAA), 글루타메이트 디카 르 복실 라제 -65 (GADA), 인슐린 종 항원 -2 (IA-2A) 및 아연 수송 체 -8 (ZnT8A)에 대한 4 가지 주요 IAb는 질병 예측에서 똑같이 중요합니다. 현재 T1D 진단을받은 환자의 최대 40 %가 다른자가 면역 질환을 앓고 있습니다. 불행하게도, 측정을 위해 단일 자가항체를 사용하는 현재의 스크리닝 방법은 대규모 스크리닝 연구에 힘들고 비효율적입니다. 우리는 최근 이러한 현재 문제를 해결하기 위해 간단한 다중 전기 화학 발광 (ECL) 분석을 개발했습니다. 이 분석은 7개의 자가항체 검사를 모두 하나의 웰로 결합합니다. 각 웰에는 3개의 IAb(IAA, GADA 및 IA-2A), 자가면역 갑상선 질환을 검출하기 위한 갑상선 과산화효소(TPOA) 및 갑상선 글로불린(ThGA)에 대한 자가항체, 체강 질병에 대한 조직 트랜스글루타미나제(TGA)에 대한 자가항체, 자가면역 다선 증후군-1(APS-1)에 대한 인터페론 알파(IFNαA)에 대한 자가항체가 포함됩니다. 이 모든 것이 T1D 및 기타 관련 자가면역 질환을 동시에 선별합니다. 멀티플렉스 ECL 분석은 단일 ECL 분석 플랫폼을 기반으로 하지만 대신 최대 10개의 여러 자가항체 분석을 단일 웰에 결합하는 멀티플렉스 플레이트를 사용합니다. 단일 ECL 분석과의 주요 차이점은 유체상에서 형성된 각 항체-항원 복합체가 멀티플렉스 플레이트의 링커 시스템을 통해 각 웰의 특정 지점으로 제한된다는 것입니다. 본 연구에서 7-Plex ECL 분석은 새로 진단된 T1D 환자와 연령이 일치하는 건강한 대조군의 대규모 코호트를 사용하여 표준 방사성 결합 분석(RBA) 및 단일 ECL 분석에 대해 검증되어 우수한 분석 민감도와 특이도를 제공합니다.
서문
제 1 형 당뇨병 (T1D)은 어린 시절에 가장 흔한 심각한 만성 질환입니다. 현재 미국에서는 약 140 만 명이 T1D를 가지고 있습니다. 놀랍게도 T1D의 발병률은 전 세계적으로 매년 3-5 %로 꾸준히 증가하고 있으며 지난 20 년 동안, 특히 어린 아이들 1,2에서 두 배로 증가했습니다. 혈액 순환에서 췌도 자가항체(IAbs)는 현재 가장 신뢰할 수 있는 바이오마커입니다. IAbs는 임상 T1D가 발생하기 몇 년 전에 나타날 수 있습니다3. 현재 인슐린에 대한자가 항체 (IAA), 글루타메이트 데 카르 복실 라제 -65 (GADA), 인슐린 종 항원 -2 (IA-2A) 및 아연 수송 체 -8 (ZnT8A)을 포함하여 4 가지 주요 IAb가 T1D 진단 및 위험 스크리닝에 널리 사용됩니다. 이 네 가지 IAb는 T1D 개발을 예측하는 데 똑같이 중요합니다. T1D의 분류는 질병 단계 1 4로서 정상적인 포도당 대사를 갖는 임의의4 IAbs 중 ≥2의 존재로서 최근에 재정의되었다.
Diabetes Autoimmunity Study in the Young (DAISY)에서 T1D에 걸릴 위험이있는 어린이 4 명 중 1 명은 섬, 체강, 갑상선 또는 류마티스자가 면역으로 진행될 가능성이 있으며 더 놀랍게도 T1D 진단을받은 환자의 약 40 %가 결국 추가자가 면역 질환을 앓게됩니다 5,6,7 . 자가항체의 동정은 이러한 자가면역 질환의 예측 및 진단에 필수적이며 환자에게 더 나은 임상 치료를 제공해야 합니다. 현재 이러한 다중자가 면역 질환을 선별하는 쉽고 저렴한 방법은 없습니다. 단일 자가항체 측정으로 표준 방사선 결합 분석(RBA)을 사용하는 현재의 스크리닝 방법은 대규모 스크리닝에 힘들고 비효율적입니다.
여기에서는 단일 ECL 분석 플랫폼 8,9,10,11을 사용하여 인증한 새로 개발된 단순 멀티플렉스 ECL 분석에 대해 설명합니다. 멀티플렉스 ECL 분석은 15μL의 혈청만 사용하여 7개의 자가항체 검사를 단일 웰로 결합하고 체강 질병, 자가면역 갑상선 질환 및 APS-1을 포함한 T1D 및 여러 관련 자가면역 질환을 동시에 스크리닝할 수 있습니다. ZnT8A ECL 분석은 당시 개발되지 않았으며 다중 분석에 포함되지 않았습니다. 멀티플렉스 ECL 분석은 T1D 및 다발성 자가면역 질환에 대한 일반 인구 스크리닝에서 높은 처리량을 위한 탁월한 도구를 제공합니다.
프로토콜
연구 프로토콜은 콜로라도 다중 기관 검토위원회의 승인을 받았습니다.
1. 완충액 준비
- 라벨링 완충액(2x PBS, pH 7.9)을 만든다. 400mL의 증류된 탈이온수(DD)를 사용하여 100mL의 10x PBS를 추가합니다. 용액의 pH를 조정하려면 7.9에 도달 할 때까지 NaOH를 첨가하십시오.
- 이전에 생성된 588μL의 라벨링 버퍼에 1mg의 비오틴을 용해시켜 3mM 비오틴을 만듭니다. 150 nmol의 Ru 설포-NHS를 50 μL의 표지 완충액에 용해시켜 3 mM Ru 설포-NHS를 만든다.
- 500mL의 1x PBS를 취하여 5g의 소 혈청 알부민(BSA)을 용액에 첨가하여 항원 완충액(1% BSA)을 만듭니다. 0.5M의 아세트산 용액을 준비하십시오. 트리즈마 염기를 사용하여 1 M 트리스-HCl 완충액을 준비하고 pH를 9.0으로 조정하였다.
- 코팅 완충액(3% 블로커 A)의 경우, 500mL의 1x PBS를 취하고, 15g의 블로커 A를 첨가하고, 5000mL의 1x PBS를 2.5mL의 트윈 20과 혼합하여 세척 완충액(0.05% 트윈 20, PBST)을 준비한다. 500mL의 DD 물과 500mL의 4x 읽기 버퍼 T를 계면활성제와 함께 추가하여 판독 버퍼(계면활성제가 있는 2x 판독 버퍼 T)를 생성합니다.
참고: 분석 간의 일관성을 유지하려면 비오틴과 Ru Sulfo-NHS 용액을 라벨링 절차 직전에 생성하고 향후 사용을 위해 생성 및 저장하지 않는 것이 중요합니다.
2. 각 항원 단백질에 비오틴과 Ru 설포-NHS를 별도로 표지
참고: 보다 효과적인 라벨링 반응을 위해서는 ≥0.5mg/mL의 항원 단백질 농도를 사용하십시오.
- 각 항원 단백질의 몰수와 비오틴 및 Ru 설포-NHS의 몰수를 계산한다. 항원 단백질과 비오틴 또는 Ru Sulfo-NHS의 몰비에 따른 표지 반응을 위해 항원 단백질에 적당량의 비오틴 또는 Ru Sulfo-NHS를 첨가한다.
- 프로 인슐린 단백질과 같이 분자량이 작은 항원 (≤10 kDa)의 경우 1 : 5의 몰비를 사용하십시오 (항원 : 비오틴 및 Ru Sulfo-NHS). GAD 단백질과 같이 분자량이 더 큰 항원(>50kDa)의 경우 1:20의 몰비를 사용하십시오. 중간 분자량 (10-50 kDa)을 갖는 항원의 경우 1 : 5-1 : 20 사이에서 조정 된 몰비를 사용하십시오.
- 비오틴과 Ru Sulfo-NHS 모두에 대해 각 항원 중량을 해당 분자량으로 나누어 각각에 대한 항원 몰수를 얻습니다. 몰수를 농도로 나누어 비오틴의 부피를 구합니다. Ru Sulfo-NHS에 대해 이것을 반복하십시오.
- 단계 2.2에서 결정된 적절한 몰비를 사용하여 항원 단백질을 비오틴과 혼합합니다. 그런 다음 Ru Sulfo-NHS에 대해서도 동일한 작업을 수행하십시오.
참고: 라벨링 반응의 효율성을 위해 버퍼 시스템의 트리스 또는 글리신과 같은 환원 화학 물질은 사이징 스핀 컬럼에 의해 2x PBS 버퍼(pH 7.9)로 교환해야 합니다. 비오틴과 Ru Sulfo-NHS에 대한 라벨링 프로토콜은 동일합니다. - 반응 튜브를 알루미늄 호일로 덮고 실온(RT)에서 1시간 동안 배양합니다. 반응 튜브를 호일로 덮는 이유는 비오틴과 Ru Sulfo-NHS 시약이 모두 빛에 민감하기 때문입니다.
- 반응 튜브가 배양되는 동안 2mL 또는 5mL 스핀 컬럼을 프라이밍합니다(스핀 컬럼의 크기는 컬럼에 업로드된 부피에 따라 결정됨). 스핀 컬럼을 2x PBS 버퍼로 채운 다음 매번 1,000 x g 에서 2분 동안 총 3회 원심분리합니다.
- 반응 튜브가 배양을 마친 후 라벨링 반응을 중지하십시오. 반응을 멈추려면 표지된 항원 단백질을 스핀 컬럼에 한 번 통과시켜 정제합니다. 그런 다음 컬럼을 1,000 x g 에서 2분 동안 원심분리합니다.
- 존재하는 항원 단백질의 양을 최종 부피로 나누어 총 표지된 항원 농도를 계산합니다. 정제된 표지된 항원 단백질을 튜브 당 50 μL의 분취량 및 장기간 사용을 위해 -80°C에서 분취량을 보관한다.
참고: 스핀 컬럼이 항원 단백질을 통과할 때마다 약 90-95%의 보유율이 있다는 점을 인식하는 것이 중요합니다.
3. 분석(바둑판 분석)을 위해 두 개의 표지된 항원에 대한 최상의 농도와 비율을 정의합니다.
참고: 이 7-Plex 분석의 ECL-IAA 분석은 혈청 샘플의 산 처리가 필요하므로 각 항원에 대한 바둑판 분석은 표지된 항원 혼합물과 함께 배양하기 전에 이 단계를 거쳐야 합니다.
- 멀티플렉스 분석을 실행하기 전에 각 항원에 대해 개별적으로 바둑판 분석을 적용하십시오. 3.2-3.6단계에서는 GAD65를 예로 사용합니다.
- 표지된 GAD65 단백질의 희석을 계산합니다. 비오틴화 GAD65의 첫 번째 혼합 용액의 권장 목표 농도는 2000 ng / mL이고 Ru 설포 -NHS 표지 GAD65는 1000 ng / mL입니다. 저장 용액에서 비오티닐화 및 Ru 설포-NHS 표지 GAD65의 농도가 모두 1.0μg/μL인 경우, 작업 용액 560μL에서 비오틴화 GAD65에 필요한 부피는 1.12μL가 되고 700μL의 작업 용액에서 Ru 설포-NHS 표지 GAD65에 필요한 부피는 0.7μL가 됩니다.
- 1.12μL의 비오틴화 GAD65 단백질과 240μL의 스트렙타비딘 접합 링커 1을 하나의 튜브에 혼합하고 160μL의 1% BSA를 혼합합니다. 혼합물을 실온에서 30분 동안 배양한다. 160μL의 정지 용액을 튜브에 첨가하고 혼합물을 실온에서 30분 더 배양합니다.
- 연속 희석을하십시오. 혼합물 280μL를 새 튜브에 넣고 정지액 280μL를 추가하여 1:2 희석액을 만듭니다. 몇 개의 새로운 튜브를 준비하십시오. 이 단계를 반복하여 비오틴 표지된 GAD65 항원에 대해 수평 연속 희석을 실행합니다(이전 간행물12 참조).
- 0.7μL의 Ru 설포-NHS 표지 GAD65(1μg/μL) 단백질을 700μL의 정지 용액과 혼합합니다. 그런 다음 혼합물 350μL를 새 튜브에 넣고 정지 용액 350μL를 추가하여 1:2 희석액을 만듭니다. 몇 개의 새로운 튜브를 준비하고이 단계를 반복하여 Ru Sulfo-NHS 표지 GAD65 항원에 대한 수직 직렬 희석을 실행합니다.
- 두 개의 혈청 샘플을 준비하는데, 하나는 GADA에 대해 매우 양성이고 다른 하나는 GADA에 대해 음성이며 각각 부피가 0.75mL입니다. 15 μL의 양성 혈청을 96-웰 PCR 플레이트의 왼쪽 절반에 있는 모든 웰에 분취한다. 음성 혈청 15μL를 96-웰 PCR 플레이트의 오른쪽 절반에 있는 모든 웰에 분취합니다.
- 각 웰에 0.5M 아세트산 18μL를 넣고 혼합합니다. RT에서 45분 동안 배양합니다. 새로운 96-웰 PCR 플레이트를 준비합니다. 17.5 μL의 비오틴 표지된 항원 및 17.5 μL의 Ru Sulfo-NHS 표지된 항원을 연속 희석에 따라 각각의 웰에 첨가한다 (이전 간행물12 참조).
- 5.2단계 내지 9.1단계에 설명된 나머지 분석 단계를 계속한다.
- 해당 음의 샘플 신호에 대한 높은 양성 샘플의 신호 비율을 결정합니다. 비오틴 표지 항원과 Ru Sulfo-NHS 표지 항원에 대해 가장 높은 농도를 선택하여 양성 대 음성 신호의 비율이 가장 높거나 가장 높은 지점을 확인한다. 이 비율 계산에서는 음성 샘플에서 얻은 낮은 배경 신호를 고려하십시오.
참고 : 바둑판 분석에서 Ru Sulfo-NHS 및 비오틴 표지 항원 단백질의 최적 농도는 다음과 같습니다 : GAD65의 경우 30 ng / mL 및 200 ng / mL, 프로 인슐린의 경우 120 ng / mL 및 120 ng / mL, IA-10의 경우 42 ng / mL 및 2 ng / mL, TG의 경우 80 ng / mL 및 80 ng / mL, TPO의 경우 8 ng / mL 및 16 ng / mL, ThG의 경우 31 ng / mL 및 31 ng / mL, IFNα의 경우 12 ng / mL 및 12 ng / mL입니다.
4. 혼합 링커 결합 항원 용액 만들기
- 바둑판 분석을 기반으로 각 항원에 대한 최적의 농도를 선택하십시오. 비오틴과 Ru Sulfo-NHS 표지 항원을 합리적인 작업 농도로 희석합니다.
- 서로 다른 링커를 각각의 고유하게 비오틴화된 항원 단백질에 결합시킨다. 하나의 96웰 플레이트 분석의 경우, 4μL의 비오티닐화 GAD65, TPO, tTG, ThG, 프로인슐린, IFN-α 및 IA-2 단백질과 240μL의 스트렙타비딘 접합 링커 1, 2, 3, 4, 8, 9 및 10을 별도의 튜브에 혼합합니다(그림 1). 그런 다음 튜브당 156μL의 PBS/1% BSA를 추가합니다. 혼합물을 실온에서 30분 동안 배양한다.
- 각 튜브에 160μL의 정지 용액을 넣고 실온에서 30분 더 배양합니다. 각 튜브에서 링커 결합 항원 400μL를 취하여 7개의 항원을 모두 결합합니다. 1.2mL의 정지 용액을 첨가한 다음 4μL의 Ru 설포-NHS 표지 GAD65, TPO, tTG, ThG, 프로인슐린, IFN-α 및 IA-2 항원을 혼합물에 첨가합니다. 이제 항원 용액을 분석에 사용할 준비가되었습니다.
5. 표지된 항원으로 혈청 샘플 배양
참고: 이 7-Plex 분석의 ECL-IAA 분석에는 혈청 샘플의 산 처리가 필요하므로 각 혈청은 이 7-Plex 분석을 위해 표지된 항원 혼합물과 함께 배양하기 전에 산 처리 단계가 필요합니다.
- 96-웰 PCR 플레이트에 대해 웰당 혈청 15μL를 분취한다. 각 웰에 0.5M 아세트산 18μL를 넣고 혼합합니다. RT에서 45분 동안 배양합니다. 새로운 96-웰 PCR 플레이트를 준비하고 35μL의 항원 용액을 각 웰에 분취합니다.
- 플레이트가 여전히 배양되는 동안, 항원 플레이트의 모든 웰에 1 M Tris pH 9.0 완충액 13 μL를 추가합니다. 트리스 완충액과 항원의 혼합을 제한하기 위해 각 웰의 측면에 완충액을 추가합니다. 배양이 완료된 후, 산 처리된 혈청 25 μL를 취하고, 즉시 항원 플레이트의 모든 웰에 피펫팅한다. 용액 교반 및 PCR 밀봉 호일로 플레이트를 덮어 빛 노출을 피하십시오.
- RT에서 플레이트를 저속으로 설정된 셰이커에 1 시간 동안 놓습니다. 그 후, 플레이트를 4°C에서 보관하고 플레이트를 18-24시간 동안 배양하도록 합니다.
6. 멀티플렉스 플레이트 준비
- 4 ° C 냉장고에서 멀티 플렉스 플레이트를 가져 와서 플레이트가 RT가되도록합니다. 멀티플렉스 플레이트가 RT에 도달하면 각 웰에 150μL의 3% 차단제 A를 추가합니다. 멀티 플렉스 플레이트를 밀봉 호일로 덮으십시오. 플레이트를 4°C 냉장고에서 밤새 배양합니다.
참고: 분석 1일차에는 4단계부터 6단계까지 포함됩니다.
7. 혈청/항원 배양물을 멀티플렉스 플레이트로 옮깁니다.
- 다음날 테이블 위에 종이 타월을 놓고 냉장고에서 인큐베이팅 멀티 플렉스 플레이트를 꺼냅니다. 플레이트에서 모든 버퍼를 비웁니다. 이렇게하려면 접시를 거꾸로 뒤집어 우물에 완충액이 없을 때까지 준비된 종이 타월에 가볍게 두 드리십시오.
- 모든 웰에 PBST 150μL를 추가하여 멀티플렉스 플레이트를 세척합니다. 단계 7.1.에서 언급한 대로 버퍼를 폐기하고 이 단계를 세 번 반복합니다. 30μL의 혈청/항원 배양물을 멀티플렉스 플레이트의 모든 웰에 추가합니다. 빛에 대한 노출을 제한하기 위해 호일로 판을 덮으십시오. 플레이트를 저속으로 설정된 플레이트 셰이커에 놓고 RT에서 1시간 동안 놓습니다.
8. 접시를 씻고 읽기 버퍼를 추가하십시오.
- 플레이트를 거꾸로 잡고 용액을 튕겨서 멀티플렉스 플레이트에서 혈청/항원 배양물을 제거합니다. 150μL의 PBST를 모든 웰에 추가하고 플레이트를 다시 거꾸로 잡고 용액을 튕겨서 플레이트에서 버퍼를 제거합니다. 이 단계를 세 번 반복합니다. 세 번째 세척이 완료된 후 각 웰에 150μL의 판독 버퍼를 추가합니다.
알림: 기포는 플레이트 리더 기계가 플레이트 결과를 정확하게 분석하는 기능을 방해하므로 어떤 대가를 치르더라도 피해야 합니다.
9. 플레이트 읽기 및 데이터 분석
- 플레이트 리더 기계에서 준비된 플레이트를 세고 모든 값을 초당 카운트 (CPS)로 읽습니다.
- 플레이트 리더 기계에서 얻은 항체 수준을 사용하여 다음 방정식으로 분석에 대한 상대 지수를 계산합니다.
인덱스 값 = [CPS (샘플) - CPS (네거티브 표준)] / [CPS (포지티브 표준) - CPS (네거티브 표준)]. - 확립된 컷오프를 사용하여 어떤 항체 결과가 음성 또는 양성인지 확인합니다.
참고: 분석 2일차에는 7단계부터 9단계까지 포함됩니다.
결과
분석 결과를 표 1, 표 2 및 표 3에 나타내었다. 판독값은 동일한 웰 내의 10개 지점의 데이터에서 가져옵니다. 각각의 샘플에 대한 인덱스 값은 분석 프로토콜에 기재된 바와 같이 상응하는 내부 양성 및 음성 대조군에 대해 계산되었다. 불량 중복의 예는 표 1에 나와 있으며 표 3에 최종 인덱스 계산 오류가 발생했습니다. 거짓 양성 또는 거짓 음성 결과를 피하기 위해 모든 원시 계수 값을 확인해야 합니다.
7-멀티플렉스 ECL 분석은 T1D를 가진 1026명의 새로 진단된 환자와 1022명의 연령 및 성별이 일치하는 건강한 대조군 피험자의 대규모 샘플 코호트를 사용하여 검증되었습니다. 1026명의 T1D 환자에 대한 7-Plex ECL 분석으로부터의 자가항체의 수준을 도 2에 도시된 바와 같이 각각의 대응하는 확립된 단일 ECL 분석으로부터의 수준 및 도 3에 도시된 바와 같이 각각의 대응하는 단일 표준 RBA 및 ELISA로부터의 수준과 비교하였다. 분석 특이성은 표 4에 나열된 바와 같이 세 가지 분석 방법(7-Plex ECL, 단일 ECL, RBA 또는 ELISA) 모두에 대해 1022개의 건강한 대조군 중 갑상선 자가항체(95번째 백분위수가 사용된 경우)를 제외한 모든 자가항체 분석에 대해 99번째 백분위수에서 동일하게 설정되었습니다. GADA, IA-2A, IAA, TPOA, Thga, TGA 및 IFNαA의 분석 간 CV는 각각 6.4 %, 4.5 %, 9.1 %, 4.9 %, 5.7 %, 11.3 % 및 5.9 %입니다.
7개의 자가항체 각각에 대한 소수의 불일치 샘플이 각 분석에 대한 컷오프의 경계선 주변에서 발견되었습니다(그림 2 및 그림 3). 11개의 대조군 샘플 (11/1022, 1.1%)은 7-Plex 분석에서만 다중 자가항체 양성이고 각각의 상응하는 단일 분석에서 음성으로 발견되었다. 유사하게, T1D 환자의 9 개 샘플에서 발생했다 (9/1026, 0.9 %). 또한, 단일 ECL 분석과 RBA 모두에서 관찰된 환자 코호트에서 10개의 고양성 TPOA 및 1개의 ThGA가 7-Plex 분석에서 누락되었습니다. 이들 샘플은 추가로 희석되었을 때 7-Plex 분석에서 양성으로 전환되었다. 일반적으로, 단일 ECL 분석 또는 RBA에서 양성의 100%는 표 4에 설명된 것과 동일한 분석 특이성을 갖는 7-Plex ECL 분석에서 다루어졌다.
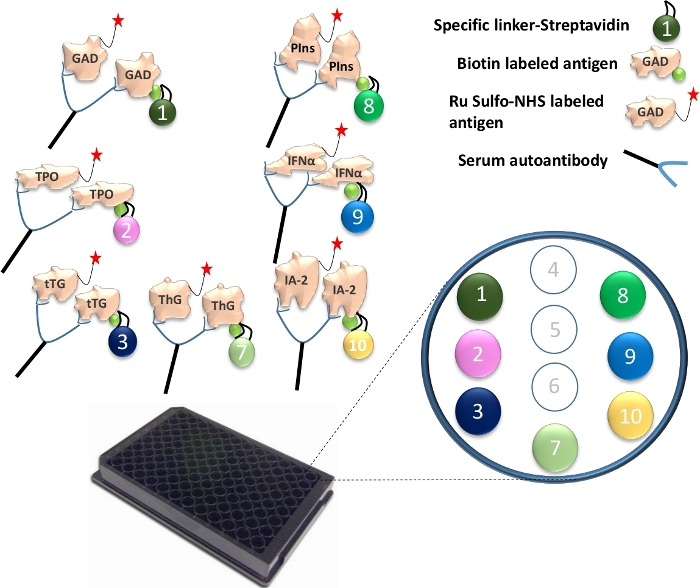
그림 1: 다중 ECL 분석의 그림.
혈청 중의 자가항체는 Ru 설포-NHSged 항원을 비오티닐화 항원에 연결합니다. 이것은 특정 링커와 결합하여 항원-항체-항원-링커의 복합체를 형성합니다. 복합체는 플레이트 상에 포획되고 각각의 특정 링커를 통해 특정 지점으로 구속됩니다. 7개의 상이한 항원 단백질에 대한 특이적으로 결합된 링커 번호가 예시되어 있다. 항체 신호의 검출은 전기 화학 발광을 갖는 Ru Sulfo-NHS 표지 항원을 사용하여 달성된다. 이 그림은 Gu, Y. et al.13에서 가져온 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
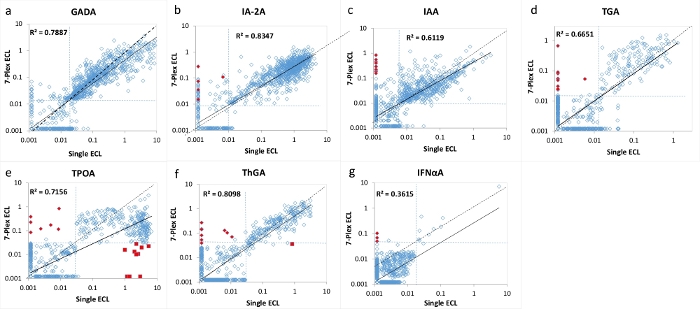
그림 2: 단일 ECL 분석과 7-Plex ECL 분석 간의 T1D 신규 발병 환자 1026명의 7개 자가항체 수준 비교.
패널 a, b, c, d, e, f 및 g는 각각 GADA, IA-2A, IAA, TGA, TPOA, Thga 및 IFNαA에 대한 자가항체 수준의 비교를 나타낸다. 점선은 각 자가항체 분석에 대한 분석 컷오프를 나타냅니다. 컷오프는 단일 및 다중 ECL 분석 모두에 대해 1022 연령 일치 건강한 대조군으로부터 표 4에 나타낸 바와 같이 각 분석에 대해 1022 연령 일치 건강한 대조군의 99번째 백분위수로 설정되었습니다(95번째 백분위수로 설정된 TPOA 및 ThGA 제외). 적색 폐쇄 다이아몬드는 7-Plex ECL 분석에서 '거짓'양성으로 표시되며, 연구 된 코호트의 <1 %가 단일 ECL과 RBA 모두에서 음성으로 검증되었습니다. 빨간색 닫기 사각형은 'prozone'현상으로 인한 7-Plex ECL 분석에서 '거짓'음성으로 표시되며, 주로 연구 된 코호트의 <1 %에서 TPOA 분석에서 발생합니다. 이러한 거짓 긍정 및 거짓 부정 결과는 모두 토론 섹션에서 논의됩니다. 이 그림은 Gu, Y. et al.13에서 가져온 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
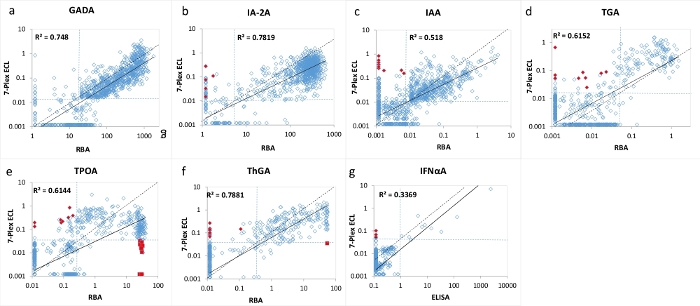
그림 3: RBA(IFNαA에 대한 ELISA)와 7-Plex ECL 분석 사이의 T1D 신규 발병 환자 1026명에서 7개의 자가항체 수준 비교.
패널 a, b, c, d, e, f 및 g는 각각 GADA, IA-2A, IAA, TGA, TPOA, Thga 및 IFNαA에 대한 자가항체 수준의 비교를 제시한다. 점선은 각 자가항체 분석에 대한 분석 컷오프를 나타내며, 표 4에 나타낸 바와 같이, 1022세부터 RBA 및 7-Plex ECL 분석 모두에 대해 동일한 특이성 세트를 일치시킨 건강한 대조군으로부터 나타낸다. 빨간색 닫힌 다이아몬드와 사각형은 7-Plex ECL 분석에 나타나는 '거짓'양성 및 '거짓'음성을 나타내며 그림 2에도 나와 있습니다. 이 그림은 Gu, Y. et al.13에서 가져온 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| A | 5580 | 5674 | 105 | 117 | 125 | 139 | 링커-1 |
| 100 | 108 | 102 | 102 | 3956 | 3745 | 링커-2 | |
| 115 | 124 | 107 | 116 | 113 | 124 | 링커-3 | |
| 67 | 64 | 68 | 61 | 65 | 69 | 링커-4 | |
| 89 | 87 | 98 | 92 | 90 | 80 | 링커-5 | |
| 87 | 71 | 89 | 87 | 61 | 72 | 링커-6 | |
| 94 | 82 | 79 | 85 | 2154 | 2280 | 링커-7 | |
| 75 | 66 | 1628 | 1594 | 81 | 83 | 링커-8 | |
| 98 | 103 | 71 | 84 | 69 | 85 | 링커-9 | |
| 102 | 118 | 93 | 98 | 113 | 99 | 링커-10 | |
| B | 324 | 337 | 147 | 148 | 5426 | 5366 | 링커-1 |
| 101 | 102 | 93 | 88 | 86 | 74 | 링커-2 | |
| 111 | 119 | 119 | 123 | 66 | 72 | 링커-3 | |
| 72 | 65 | 59 | 68 | 74 | 67 | 링커-4 | |
| 81 | 98 | 83 | 92 | 79 | 72 | 링커-5 | |
| 90 | 84 | 93 | 86 | 70 | 76 | 링커-6 | |
| 101 | 105 | 101 | 97 | 956 | 944 | 링커-7 | |
| 82 | 83 | 189 | 204 | 97 | 90 | 링커-8 | |
| 92 | 83 | 78 | 64 | 82 | 78 | 링커-9 | |
| 83 | 79 | 88 | 93 | 4722 | 4965 | 링커-10 | |
| C | 110 | 110 | 87 | 81 | 2114 | 2365 | 링커-1 |
| 5526 | 5680 | 88 | 70 | 86 | 93 | 링커-2 | |
| 114 | 132 | 67 | 71 | 3326 | 3284 | 링커-3 | |
| 64 | 62 | 88 | 74 | 64 | 80 | 링커-4 | |
| 94 | 82 | 86 | 75 | 89 | 76 | 링커-5 | |
| 77 | 87 | 75 | 63 | 70 | 86 | 링커-6 | |
| 77 | 86 | 71 | 84 | 138 | 121 | 링커-7 | |
| 73 | 86 | 80 | 79 | 59 | 73 | 링커-8 | |
| 86 | 74 | 5064 | 4923 | 88 | 86 | 링커-9 | |
| 105 | 113 | 85 | 80 | 124 | 114 | 링커-10 | |
| D | 98 | 88 | 92 | 84 | 136 | 127 | 링커-1 |
| 288 | 291 | 86 | 86 | 558 | 564 | 링커-2 | |
| 109 | 101 | 74 | 73 | 141 | 127 | 링커-3 | |
| 78 | 66 | 66 | 55 | 74 | 66 | 링커-4 | |
| 79 | 83 | 79 | 86 | 96 | 91 | 링커-5 | |
| 83 | 86 | 96 | 89 | 86 | 73 | 링커-6 | |
| 87 | 89 | 77 | 87 | 841 | 855 | 링커-7 | |
| 74 | 72 | 60 | 72 | 90 | 95 | 링커-8 | |
| 68 | 75 | 331 | 328 | 2460 | 2580 | 링커-9 | |
| 86 | 98 | 80 | 75 | 123 | 133 | 링커-10 | |
| E | 101 | 114 | 101 | 106 | 532 | 548 | 링커-1 |
| 101 | 96 | 110 | 104 | 682 | 675 | 링커-2 | |
| 6015 | 5988 | 124 | 126 | 101 | 98 | 링커-3 | |
| 66 | 71 | 82 | 71 | 80 | 62 | 링커-4 | |
| 102 | 97 | 99 | 80 | 83 | 110 | 링커-5 | |
| 82 | 67 | 81 | 80 | 60 | 85 | 링커-6 | |
| 85 | 95 | 52 | 84 | 245 | 221 | 링커-7 | |
| 72 | 78 | 82 | 74 | 486 | 503 | 링커-8 | |
| 77 | 97 | 97 | 77 | 56 | 66 | 링커-9 | |
| 114 | 104 | 5726 | 5814 | 259 | 253 | 링커-10 | |
| F | 119 | 120 | 133 | 118 | 112 | 96 | 링커-1 |
| 101 | 91 | 100 | 95 | 96 | 82 | 링커-2 | |
| 406 | 395 | 111 | 123 | 2127 | 101 | 링커-3 | |
| 72 | 60 | 86 | 72 | 79 | 83 | 링커-4 | |
| 76 | 85 | 96 | 99 | 89 | 103 | 링커-5 | |
| 88 | 78 | 91 | 83 | 89 | 95 | 링커-6 | |
| 104 | 97 | 87 | 102 | 56 | 66 | 링커-7 | |
| 76 | 77 | 79 | 93 | 69 | 75 | 링커-8 | |
| 85 | 71 | 95 | 100 | 83 | 71 | 링커-9 | |
| 131 | 131 | 358 | 364 | 92 | 86 | 링커-10 | |
| G | 90 | 95 | 85 | 82 | 105 | 107 | 링커-1 |
| 99 | 86 | 77 | 76 | 1250 | 1174 | 링커-2 | |
| 119 | 123 | 120 | 118 | 112 | 108 | 링커-3 | |
| 76 | 83 | 77 | 80 | 86 | 76 | 링커-4 | |
| 88 | 86 | 86 | 93 | 107 | 92 | 링커-5 | |
| 73 | 73 | 71 | 82 | 84 | 75 | 링커-6 | |
| 5210 | 5173 | 72 | 69 | 76 | 85 | 링커-7 | |
| 80 | 81 | 79 | 82 | 100 | 101 | 링커-8 | |
| 96 | 97 | 89 | 83 | 65 | 83 | 링커-9 | |
| 98 | 103 | 86 | 88 | 1933 | 1979 | 링커-10 | |
| H | 114 | 124 | 81 | 86 | 299 | 295 | 링커-1 |
| 107 | 92 | 69 | 72 | 4256 | 4388 | 링커-2 | |
| 114 | 123 | 125 | 129 | 501 | 536 | 링커-3 | |
| 77 | 70 | 67 | 64 | 74 | 62 | 링커-4 | |
| 92 | 110 | 81 | 84 | 77 | 71 | 링커-5 | |
| 87 | 79 | 72 | 76 | 83 | 81 | 링커-6 | |
| 328 | 341 | 84 | 80 | 88 | 97 | 링커-7 | |
| 75 | 84 | 75 | 90 | 74 | 83 | 링커-8 | |
| 73 | 79 | 78 | 76 | 84 | 70 | 링커-9 | |
| 113 | 120 | 81 | 76 | 2372 | 2350 | 링커-10 | |
표 1: 7-플렉스 ECL 분석의 분석: 원시 CPS 카운트(플레이트의 왼쪽 절반). 원시 CPS 계수는 분석 플레이트(플레이트의 왼쪽 절반)에서 수집되며 각 샘플은 중복으로 수행됩니다. 플레이트(AH)의 각 행 아래에는 표시된 각 링커 번호에 해당하는 동일한 웰 내의 10개 지점의 데이터를 나타내는 10줄의 판독값이 있습니다. 잘못된 중복의 예는 F-linker 3열 5열 및 6행에서 볼 수 있듯이 회색으로 강조 표시됩니다.
| 표 1A의 행 | 표 1A의 컬럼 | 링커 1 | 링커 2 | 링커 3 | 링커 7 | 링커 8 | 링커 9 | 링커 10 | |
| A | 1-2 | 가다 PC | 5627 | 104 | 120 | 88 | 71 | 101 | 110 |
| B | 1-2 | 가다 로우 PC | 331 | 102 | 115 | 103 | 83 | 88 | 81 |
| C | 1-2 | TPOA PC | 110 | 5603 | 123 | 82 | 80 | 80 | 109 |
| D | 1-2 | TPOA 낮은 PC | 93 | 290 | 105 | 88 | 73 | 72 | 92 |
| E | 1-2 | 떼가씨 | 108 | 99 | 6002 | 90 | 75 | 87 | 109 |
| F | 1-2 | TG 로우 PC | 120 | 96 | 401 | 101 | 77 | 78 | 131 |
| G | 1-2 | 스가(주)씨 | 93 | 93 | 121 | 5192 | 81 | 97 | 101 |
| H | 1-2 | ThGA 낮은 PC | 119 | 100 | 119 | 335 | 80 | 76 | 117 |
| A | 3-4 | 아이에이에이씨 | 111 | 102 | 112 | 82 | 1611 | 78 | 96 |
| B | 3-4 | IAA 낮은 PC | 148 | 91 | 121 | 99 | 197 | 71 | 91 |
| C | 3-4 | 아이피나에이피씨 | 84 | 79 | 69 | 78 | 80 | 4994 | 83 |
| D | 3-4 | IFNaA 낮은 PC | 88 | 86 | 74 | 82 | 66 | 330 | 78 |
| E | 3-4 | IA-2A PC | 104 | 107 | 125 | 68 | 78 | 87 | 5770 |
| F | 3-4 | IA-2A 낮은 PC | 126 | 98 | 117 | 95 | 86 | 98 | 361 |
| G | 3-4 | 노스캐롤라이나 | 84 | 77 | 119 | 71 | 81 | 86 | 87 |
| H | 3-4 | 노스캐롤라이나 | 84 | 71 | 127 | 82 | 78 | 77 | 79 |
| A | 5-6 | 샘플1 | 132 | 3851 | 119 | 2217 | 82 | 77 | 106 |
| B | 5-6 | 샘플2 | 5396 | 80 | 69 | 950 | 94 | 80 | 4844 |
| C | 5-6 | 샘플3 | 2240 | 90 | 3305 | 130 | 66 | 87 | 119 |
| D | 5-6 | 샘플4 | 132 | 561 | 134 | 848 | 93 | 2520 | 128 |
| E | 5-6 | 샘플5 | 540 | 679 | 100 | 233 | 495 | 61 | 256 |
| F | 5-6 | 샘플6 | 104 | 89 | 1114 | 61 | 72 | 77 | 89 |
| G | 5-6 | 샘플7 | 106 | 1212 | 110 | 81 | 101 | 74 | 1957 |
| H | 5-6 | 샘플8 | 297 | 4322 | 519 | 93 | 79 | 77 | 2361 |
표 2: 7-플렉스 ECL 분석의 분석: 표 1 데이터의 배열, 7개의 링커로 표시. 표 1의 데이터는 링커 4 내지 6(사용되지 않음)을 삭제하여 재배열하고, 표 1로부터의 각 중복 판독값으로부터 평균값을 계산하였다. 특정 링커에 의해 억제된 각 자가항체 분석에 해당하는 내부 표준 고양성 및 저양성 대조군의 값은 진한 굵은 글씨로 표시됩니다. PC, 양성 대조군. NC, 정상 제어.
| 갓 인덱스 | TPOA-인덱스 | TGA-인덱스 | ThGA 지수 | IAA-인덱스 | IFNaA-인덱스 | IA-2A-인덱스 | |
| 가다 PC | 1.000 | 0.005 | 0.000 | 0.003 | -0.006 | 0.003 | 0.004 |
| 가다 로우 PC | 0.045 | 0.005 | -0.001 | 0.006 | 0.002 | 0.000 | -0.001 |
| 아이에이에이씨 | 0.005 | 1.000 | 0.001 | 0.002 | -0.001 | -0.001 | 0.004 |
| IAA 낮은 PC | 0.002 | 0.039 | -0.002 | 0.003 | -0.005 | -0.003 | 0.001 |
| IA-2A PC | 0.004 | 0.004 | 1.000 | 0.004 | -0.004 | 0.000 | 0.004 |
| IA-2A 낮은 PC | 0.007 | 0.004 | 0.048 | 0.006 | -0.002 | -0.002 | 0.008 |
| 떼가씨 | 0.002 | 0.003 | 0.000 | 1.000 | 0.000 | 0.002 | 0.002 |
| TG 로우 PC | 0.006 | 0.004 | 0.000 | 0.052 | -0.001 | -0.002 | 0.005 |
| TPOA PC | 0.005 | 0.005 | -0.001 | 0.002 | 1.000 | -0.002 | 0.001 |
| TPOA 낮은 PC | 0.012 | 0.003 | 0.000 | 0.006 | 0.076 | -0.003 | 0.001 |
| 스가(주)씨 | 0.000 | 0.000 | -0.008 | 0.001 | 0.000 | 1.000 | -0.001 |
| ThGA 낮은 PC | 0.001 | 0.002 | -0.008 | 0.002 | -0.009 | 0.050 | -0.002 |
| 아이피나에이피씨 | 0.004 | 0.006 | 0.001 | 0.000 | -0.002 | 0.000 | 1.000 |
| IFNaA 낮은 PC | 0.008 | 0.004 | 0.000 | 0.005 | 0.004 | 0.002 | 0.048 |
| 노스캐롤라이나 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 노스캐롤라이나 | 0.000 | -0.001 | 0.001 | 0.002 | -0.002 | -0.002 | -0.001 |
| 샘플1 | 0.009 | 0.683 | 0.000 | 0.419 | 0.001 | -0.002 | 0.003 |
| 샘플2 | 0.958 | 0.001 | -0.008 | 0.172 | 0.009 | -0.001 | 0.837 |
| 샘플3 | 0.389 | 0.002 | 0.542 | 0.012 | -0.009 | 0.000 | 0.006 |
| 샘플4 | 0.009 | 0.088 | 0.003 | 0.152 | 0.008 | 0.496 | 0.007 |
| 샘플5 | 0.082 | 0.109 | -0.003 | 0.032 | 0.271 | -0.005 | 0.030 |
| 샘플6 | 0.004 | 0.002 | 0.169 | -0.002 | -0.006 | -0.002 | 0.000 |
| 샘플7 | 0.004 | 0.205 | -0.002 | 0.002 | 0.013 | -0.002 | 0.329 |
| 샘플8 | 0.039 | 0.768 | 0.068 | 0.004 | -0.001 | -0.002 | 0.400 |
표 3: 7-plex ECL 분석의 분석: 인덱스 값의 결과. 모든 7개의 자가항체 분석에 대한 각각의 샘플에 대한 인덱스 값을 분석 프로토콜에 설명된 바와 같이 상응하는 내부 양성 및 음성 대조군에 대해 계산하였다. 컷오프 값보다 큰 인덱스 값은 진한 굵게 표시된 긍정적인 결과로 정의되었습니다. sample6의 TGA 인덱스 값은 표 1의 행 F-linker 3-열 5 및 6에 표시된 잘못된 중복으로 인한 오류이므로 회색으로 강조 표시되었습니다.
| 가다 | IA-2A | 증권 시세 표시기 | .TGA | 증권 시세 표시기 | 증권 시세 표시기 | IFNαA* | ||||||||
| 센스 | 사양 | 센스 | 사양 | 센스 | 사양 | 센스 | 사양 | 센스 | 사양 | 센스 | 사양 | 센스 | 사양 | |
| 증권 시세 표시기 | 73.4% | 98.5% | 75.2% | 99.0% | 47.7% | 99.1% | 12.9% | 99.0% | 23.9% | 95.2% | 19.3% | 94.7% | 1.0% | 99.6% |
| 단일 ECL | 71.6% | 99.1% | 73.6% | 99.3% | 48.3% | 99.7% | 16.0% | 98.9% | 26.3% | 94.9% | 20.6% | 95.1% | 0.8% | 99.2% |
| 7-플렉스 ECL | 71.2% | 98.9% | 77.3% | 98.9% | 49.5% | 98.9% | 16.5% | 98.7% | 26.1% | 94.7% | 21.1% | 94.7% | 1.7% | 99.1% |
표 4: 7-plex ECL 분석에서 연령과 성별에 대해 일치하는 1026명의 T1D 환자와 1022명의 대조군 간의 분석 민감도 및 특이도를 해당 단일 ECL 분석 및 RBA 또는 ELISA*와 비교했습니다. 각각의 자가항체에 대해 상이한 검정 (RBA, 단일 ECL 및 7-Plex ECL)을 1022세 및 성별 일치시키는 건강한 대조군을 사용하여 유사한 특이성으로 설정하였다. 연구된 대조군 코호트의 특이성 결과는 TPOA 및 ThGA의 경우 약 95%, 다른 5개의 분석의 경우 99%로 설정되었습니다. *별표는 ELISA에 대한 IFNαA 분석을 표시하고 다른 별표는 RBA입니다.
토론
제 1 형 당뇨병에 대한 수많은 국내 및 국제 임상 시험에서 체강 질병에 대한 췌도자가 항체 및 트랜스 글루타미나 제 (TGA)에 대한자가 항체를 검출하기위한 단일 ECL 분석의 성능이 입증되었습니다 8,9,10,11. 이러한 추적 전반에 걸쳐 이 분석은 기존 '금' 표준 RBA에 대해 평가할 때 자가항원 검출에 대한 민감도와 특이성을 증가시켰습니다. 향상된 질환 특이성은 단일 ECL 분석과 RBA14,15,16,17 사이에서 고친화성 및 고위험 췌도 자가항체를 저위험, 저친화성 신호로부터 구별할 때 볼 수 있습니다. 단일 ECL 분석을 기반으로 새로운 고처리량 다중 ECL 자가항체 분석을 통해 T1D 및 여러 적용 가능한 자가면역 질환을 동시에 스크리닝할 수 있습니다.
멀티플렉스 ECL 분석은 최대 10개의 자가항체 어세이를 하나의 웰로 결합할 수 있는 멀티플렉스 플레이트를 사용합니다. 본 연구를 위해, 7개의 자가항체 분석법이 함께 결합된다. 자가항체는 3개의 IAb(IAA, GADA 및 IA-2A), 2개의 자가면역 갑상선질환 자가항체(TPOA 및 ThGA), 체강 질병 자가항체(TGA) 및 인터페론 알파에 대한 APS-1 자가항체(IFNαA)로 구성됩니다. 분석 메카니즘은, 일반적으로, 일부 변형된 9,10,12,18에 공개된 바와 같은 단일 ECL 분석에 기초한다. 단일 ECL 분석과 다중 ECL 분석의 주요 차이점은 유체상에 형성된 각 항체-항원 복합체가 특정 링커로 제한된다는 것입니다(그림 1). 비오틴 표지된 항원은 스트렙타비딘 컨쥬게이트와 함께 배양되며, 링커는 특정 항원-링커 복합체를 형성하는데 사용된다. 항체-항원 면역 복합체는 환자 혈청과 함께 배양한 후 형성되고 멀티플렉스 플레이트의 각 웰 상의 특이적 링커 시스템을 통해 특정 스팟 상에 포획된다. 동시에 항체에 의해 포획된 Ru 설포-NHS 표지된 항원은 전기화학발광으로 신호를 제공한다. 플레이트 리더 기계는 각 우물에 위치한 스팟 소스에서 최대 10개의 서로 다른 신호를 감지할 수 있습니다. 플레이트 간에 그리고 장기 연구를 수행하는 동안 자가항체 분석을 일관되게 유지하려면 동일한 링커를 사용하는 것이 좋습니다.
멀티플렉스 ECL 분석을 설정하기 전에 각 자가항체에 대한 단일 ECL 분석을 멀티플렉스 플레이트에 각각 최적화하고 일반 ECL 플레이트에서 RBA 및 단일 ECL 분석 모두에 대해 검증해야 합니다. 바둑판 분석을 향상시키기 위해, 멀티플렉스 플레이트 상의 관련 자가항체 분석에, 고양성 환자 및 음성 환자 샘플을 사용하였다. 바둑판 분석이 수행된 후, Ru 설포-NHS 및 비오틴 표지된 항원에 대한 가장 이상적인 농도를 7개의 자가항체 분석 각각에 대해 계산하였다. 다음은 이러한 농도를 보여줍니다 : GAD65의 경우 30 ng / mL 및 200 ng / mL, 프로 인슐린의 경우 120 ng / mL 및 120 ng / mL, IA-10의 경우 42 ng / mL 및 2 ng / mL, TG의 경우 80 ng / mL 및 80 ng / mL, TPO의 경우 8 ng / mL 및 16 ng / mL, ThG의 경우 31 ng / mL 및 31 ng / mL, IFNα13에 대해 각각 12ng/mL 및 12ng/mL입니다. 바둑판 분석으로부터의 일부 항원의 농도는 모든 분석을 함께 결합한 후 실제 다중 분석의 결과에 따라 추가로 조정되어야 할 수도 있다.
IAA가 본 멀티플렉스 ECL 분석에 포함됨에 따라, 이전 연구12에서 보고된 바와 같이, 혈청을 항원과 함께 배양하기 전에 혈청 샘플의 산 처리가 필수적이다. 일반적으로 추가 자가항체가 멀티플렉스 분석에 추가되면 분석 배경이 영향을 받고 웰의 한 지점에서 매우 높은 신호가 누화를 통해 주변 지점의 결과를 방해할 수 있습니다. 따라서, 최대 CPS는 각 자가항체에 대해 20,000 카운트로 제한되거나, 가장 높은 양성 샘플에 대해 더 낮게 제한될 필요가 있다. 우리가 아는 바에 따르면, 관련된 누화의 양을 줄이기 위해 스팟 맵을 설계할 때 카운트 빈도가 높은 스팟에서 배경이 낮은 자가항체를 분리해야 합니다.
높은 양성 및 음성 대조군은 테스트 중인 알려지지 않은 샘플에 대한 정확한 지수를 계산하기 위해 모든 분석에서 내부적으로 사용되었습니다. 분석의 민감도를 정확하게 평가하고 모니터링하기 위해 분석의 상한에 가깝게 설정된 낮은 양성 대조군이 사용되었습니다. 이러한 표준 양성 및 음성 대조군은 장기간 사용을 위해 벌크 및 분취량으로 생성되었으며 분석 간의 일관성을 위해 -20°C 이하에서 보관되었습니다. 품질 보증을 위해 모든 분석에서 샘플을 두 번 실행하고 모든 양성 결과를 다시 실행하여 다음날 새로운 ECL 분석에서 샘플을 실행하여 확인했습니다. 첫 번째 및 두 번째 확인 분석에 불일치가 있는 경우 세 번째 분석이 필요했습니다. 수행된 3개의 분석 중, 2개의 분석의 결과(예를 들어, +, + 또는 -,-)가 일치하여, 샘플의 최종 결과(양성 또는 음성)를 결정하였다.
지난 10년 동안 많은 연구 그룹은 다중 자가항체 분석을 하나의 웰로 결합하여 대규모 집단을 선별하는 멀티플렉스 방법을 활용하는 고처리량 분석을 찾고 있습니다. 다중 자가항체 분석 19,20,21,22를 수행하기 위해 다양한 유형의 기술을 사용하는 몇 가지 연구가 있지만 T1D를 연구할 때 현재 '금' 표준 RBA에 대한 민감도 및 특이도에서 이러한 분석에 대한 비교는 없습니다. 사용되는 이러한 다양한 유형의 플랫폼은 국제 췌도 자가항체 표준화 프로그램(IASP) 워크숍이나 임상 시험에서 대규모 코호트 테스트를 통해 검증되지 않았습니다. 최근 독일의 일반 인구 기반 스크리닝에서, 크로노스에 의해 배포된 고처리량 결합 분석인 3 스크린 ICATM ELISA는 소아 T1D 23의 조기 진단을 달성하기 위해 3개의 IAb, GADA,IA-2A 및 ZnT8A를 검출하기 위한 1차 스크리닝을 위한 도구로 사용되고 있다. 3-스크린 ELISA 분석은 3개의 분리된 웰에서 많은 양의 혈청을 소비하거나 3개의 분석이 모두 혼합된 단일 웰에서 3개의 자가항체를 측정합니다. 3-스크린 ELISA 분석에서 하나의 웰이 양성이면 3개의 자가항체 중 어느 것이 존재하는지 구별할 수 없습니다. 이 분석의 가장 큰 단점은 IAA 측정을 포함 할 수 없다는 것입니다. IASP 워크샵에서 입증 된 바와 같이 ELISA에 의해 수행 된 모든 IAA 결과는 허용 가능한 민감도 및 특이성을 갖지 않습니다24. IAA는 일반적으로 가장 먼저 나타나는 IAb이며 어린 아이들 사이에서 유병률이 높습니다. IAA와 함께 IAb 스크리닝은 어린이에게 필요하며 지역 사회에서 T1D 위험을 평가하기 위해 IAA 없이 이 스크리닝을 수행하는 것은 허용되지 않는 것으로 간주됩니다. 또한 Kronus IAb 키트 분석이 T1D 질환 특이적이고 고위험과 저위험 IAb를 구별할 수 있음을 보여주는 발표된 연구 또는 데이터는 없습니다. 본 연구에서 7-Plex ECL 분석은 T1D13으로 새로 진단된 환자의 대규모 코호트를 사용하여 검증되었습니다. 현재 표준 RBA 및 잘 확립된 단일 ECL 분석과 비교하여 7-Plex 분석은 동일한 분석 특이성으로 100% 양성을 유지할 수 있습니다(표 4). 현재 표준 RBA와 병행하여 4-Plex ECL 분석은 진행중인 대규모 임상 시험 인 어린이의자가 면역 스크리닝 (ASK) 연구에 적용되고 있습니다. 이 시험은 덴버 대도시 지역의 일반 인구의 어린이를 대상으로 T1D 및 체강 질병을 검사합니다. ASK 연구에 사용된 표준 RBA와 비교하여, 멀티플렉스 ECL 분석은 단일 ECL 연구25를 사용한 이전 보고서와 동일한 우수한 민감도 및 더 높은 질병 특이도를 보여주고 있다. 또한, 당사의 4-Plex ECL 분석은 ECL 및 RBA에 대한 해당 4개의 단일 분석에 비해 노동, 비용 및 혈청 부피가 70% 현저하게 감소한 것으로 나타났습니다. 멀티플렉스 ECL 분석을 사용하여 서로 다른 자가항체(최대 10개)를 나타내는 서로 다른 숫자로 각 웰을 맞춤화하여 특정 임상 위치의 요구에 특정한 다양한 자가면역 질환을 테스트할 수 있습니다.
본 연구에서 멀티플렉스 플레이트를 사용하는 멀티플렉스된 ECL 분석에 대해 관찰된 몇 가지 한계가 있다. 항원과 함께 배양된 혈청의 최종 희석은 단일 웰에 결합된 모든 단일 자가항체 분석에 대해 가장 최적의 조건을 산출하도록 조정할 수 없습니다. T1D 환자로부터의 9개의 샘플(9/1026)은 특정 자가항체에 대해 위음성 결과를 갖는 것으로 관찰되었다. 위음성 중 7 개는 TPOA에 대한 것이고 2 개는 7-Plex ECL 분석에서 ThGA에 대한 것이었지만 단일 ECL 분석과 RBA 모두에서 높은 양성 결과가 나타났습니다 (그림 2 및 3). 9 개의 샘플 모두를 추가로 희석 한 후, 그들은 멀티 플렉스 플레이트에서 양성이되었습니다. 이 결과는 우리가 'prozone'현상으로 설명하는 것에 의해 발생합니다. 이 현상으로 인해 높은 항체가가 항원-항체 격자의 형성에 영향을 미치기 때문에 샘플이 위음성 결과를 나타냅니다. 다중 분석을 설정할 때 결합된 자가항체 각각에 대해 매우 높은 역가를 가진 샘플은 항원 배양을 위한 혈청의 선택적 희석을 식별하기 위해 사전 테스트를 실행하는 것이 좋습니다. 별법으로, 각각의 자가항체에 대해 최상의 분석 감도 및 특이성이 달성되는 조합 분석을 형성하기 위해 유사한 최적화된 조건을 갖는 자가항체 분석을 선택해야 한다. 본 연구에서, 건강한 정상 대조군으로부터의 7 개의 샘플 (7/1022)은 7-Plex 분석에서 여러자가 항체에 대해 위양성을 나타 냈지만, 단일 ECL 분석과 RBA (그림 2 및 3)를 실행 한 후,자가 항체는 두 분석 모두에서 음성으로 밝혀졌다. 이러한 작은 샘플 하위 집합에 대해 멀티플렉스 플레이트에서 발생하는 이러한 위양성 결과의 원인은 현재 알려져 있지 않습니다. 멀티플렉스 ECL 분석의 현재 적용의 경우, 모든 양성 샘플은 양성을 확인하기 위해 해당 단일 ECL 분석으로 반복되며, 이는 멀티플렉스 ECL 분석에서 이 위양성 오류를 제거합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 NIH 보조금 DK32083, JDRF 보조금 2-SRA-2015-51-Q-R 및 2-SRA-2018-533-S-B의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 4 °C refrigerator | |||
| –80 °C and -20 °C freezers | |||
| 96-well Plate Shaker | Wallac - Delfi | ||
| 96-well round bottom plate | Fisher | 8408220 | |
| Acetic acid solution | Fisher | ||
| Aluminum foil | |||
| Antigen proteins | |||
| Human GAD65 full length protein | Diamyd | ||
| Human ThG full length protein | BioMart | ||
| Human TPO full length protein | BioMart | ||
| IA-2 intracellular domain protein | BioMart | ||
| IFN-α protein | Abcam | ||
| Proinsulin protein | AmideBio | ||
| tTG protein | DiaRect | ||
| Biotin | Sigma | ||
| Bottle-Top 500 mL , Filter Units | Fisher | 0974064A or B | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| Distilled deionized (DD) water | |||
| HCl | Fisher | ||
| Ice maker | |||
| Ice trays | |||
| MSD Sector | Perkin-Elmer | ||
| Multi-channel pipette | |||
| NaOH | |||
| Paper tower | |||
| PBS | |||
| pH meter | |||
| Pipette-Aid | |||
| Pipettes/tips | |||
| Ru Sulfo-NHS | MSD (R91AN) | ||
| Trizma Base | Fisher | BP152-5 | |
| Tween 20 | Sigma | P-1379 | |
| Uplex Development Kit | MSD | ||
| 96-well UPlex plate | MSD | ||
| Blocker A | MSD | R93AA | |
| Linker-Streptavidin | MSD | ||
| Read buffer | MSD | R92TC | |
| Stop Solution | MSD | ||
| Vortex mixer | |||
| ZeBa Column | Pierce | 89892 |
참고문헌
- Harjutsalo, V., Sjoberg, L., Tuomilehto, J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet. 371 (9626), 1777-1782 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Barker, J. M., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., et al. Additional Autoimmune Disease Found in 33% of Patients at Type 1 Diabetes Onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Netherlands Journal of Medicine. 65 (7), 235-247 (2007).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Gu, Y., Zhao, Z., High, H., Yang, T., Yu, L. Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Journal of Clinical & Cellular Immunology. 8 (6), (2017).
- Gu, Y., et al. Electrochemiluminescence Assays for Human Islet Autoantibodies. Journal of Visualized Experiments. (133), e57227 (2018).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Dongmei, M., A, K. S., Li Zh, K., Michelle, G., Ling, J., Taylor, A. Electrochemiluminescence Assays for Insulin and Glutamic Acid Decarboxylase Autoantibodies Improve Prediction of Type 1 Diabetes Risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Steck, A. K., et al. ECL-IAA and ECL-GADA Can Identify High-Risk Single Autoantibody-Positive Relatives in the TrialNet Pathway to Prevention Study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Fouts, A., et al. Do Electrochemiluminescence Assays Improve Prediction of Time to Type 1 Diabetes in Autoantibody-Positive TrialNet Subjects. Diabetes Care. 39 (10), 1738-1744 (2016).
- Sosenko, J. M., et al. The Use of Electrochemiluminescence Assays to Predict Autoantibody and Glycemic Progression Toward Type 1 Diabetes in Individuals with Single Autoantibodies. Diabetes Technology & Therapeutics. 19 (3), 183-187 (2017).
- Zhao, Z., et al. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. Journal of Immunology Research. 2016, 5 (2016).
- Zhang, B., Kumar, R. B., Dai, H., Feldman, B. J. A plasmonic chip for biomarker discovery and diagnosis of type 1 diabetes. Nature Medicine. 20 (8), 948-953 (2014).
- Tsai, C. T., Robinson, P. V., Spencer, C. A., Bertozzi, C. R. Ultrasensitive Antibody Detection by Agglutination-PCR (ADAP). American Chemical Society Central Science. 2 (3), 139-147 (2016).
- Yim, S. W., et al. Four-color alternating-laser excitation single-molecule fluorescence spectroscopy for next-generation biodetection assays. Clinical chemistry. 58 (4), 707-716 (2012).
- Bale, S. S., et al. A highly sensitive microsphere-based assay for early detection of Type I diabetes. Technology. 02 (03), 200-205 (2014).
- Ziegler, A. G., et al. 3 Screen ELISA for High-Throughput Detection of Beta Cell Autoantibodies in Capillary Blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Schlosser, M., et al. Diabetes Antibody Standardization Program: evaluation of assays for insulin autoantibodies. Diabetologia. 53 (12), 2611-2620 (2010).
- Zhao, Z., et al. A multiplex assay combining insulin, GAD, IA-2 and transglutaminase autoantibodies to facilitate screening for pre-type 1 diabetes and celiac disease. Journal of Immunological Methods. 430, 28-32 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유