Method Article
상처로 인한 다중계를 연구하는 드로소필라 모델
요약
상처 유발 다중계화는 세포가 세포 손실을 보상하기 위해 분할하는 대신 크기로 성장하는 보존된 조직 수리 전략입니다. 여기에 상피 상처 수리에서 ploidy 및 유전 적 조절을 측정하는 모델로 과일 비행을 사용하는 방법에 대한 자세한 프로토콜입니다.
초록
Polyploidy는 유기체 건강과 질병에 미치는 영향이 여전히 제대로 이해되지 않는 빈번한 현상입니다. 세포는 내마모성 또는 세포 융합의 결과인 염색체의 디플로이드 사본 이상을 포함하는 경우 폴리플로이드로 정의됩니다. 조직 수리에서, 상처 유발 폴리플로이드화(WIP)는 과일 파리에서 척추동물에 이르는 보존된 치유 전략으로 밝혀졌다. WIP는 온코겐 성 성장과 유독성 스트레스에 대한 내성을 포함하여 세포 증식에 비해 몇 가지 장점이 있습니다. 문제는 왜 폴리플로이드 세포가 발생하는지, 그리고 이러한 독특한 세포가 어떻게 작동하는지 파악하는 것이 과제였습니다. 제공 된 성인 과일 플라이 상피에서 WIP를 연구하는 상세한 프로토콜은 구멍 상처 후 2 일 이내에 폴리 플로이드 세포가 생성되는 상피. D. 멜라노가스터의 광범위한 유전 적 도구 키트를 활용하여 Myc를 포함하여 WIP를 시작하고 조절하는 데 필요한 유전자가 식별되기 시작했습니다. 이 방법을 사용 하 여 지속적인 된 연구 어떻게 다른 유전 및 생리 변수 섹스를 포함 하 여 공개 할 수 있습니다., 다이어트, 그리고 나이 규제 하 고 WIP의 기능에 영향을.
서문
Drosophila 멜라노가스터는 상피 상처 수리의 세포 및 분자 메커니즘을 연구하는 매력적인 모델 시스템입니다. 포유류에서와 같이, 사용된 조직 복구 기계장치는 조직과 그것의 발달 단계 둘 다에 달려 있습니다. 흉터없는 상처 치유는 상피 앞가장자리에서 actomyosin "지갑 끈"이 형성되는 과일 플라이 배아에서 발생하여 상처가1,,2를원활하게 닫을 수 있게합니다. 애벌레, 푸파, 및 성인 과일 파리에서 배아 후 상처 치유는 세포 외 매트릭스 리모델링, 멜라닌 흉터 형성 및 상피 세포 성장3,,4,,5,,6을초래한다. 상피 세포는 세포 융합및 내발자전거에 의한 크기가 증가하며, 미토시스3,4,,77,8을우회하는 불완전한 세포 주기이다., 결과적으로, 세포 손실은 세포 분열 대신 폴리플로이드 세포 성장에 의해 보상됩니다. 성인 플라이 힌구트, 미드구트 및 여포 상피는 또한 조직 손상 후 세포 손실을 보상하기 위해 폴리플로이드 세포 성장에의존9,,10,,11.
Polyploidy는 식물과 곤충에 있는 유기체 발달의 잘 알려진 양상입니다, 그러나 지난 몇 년 동안 폴리플로이드는 척추동물12에있는 보존된 조직 복구 전략이다는 것을 더 명백해지고 있습니다. 심장을 재생할 수 있는 능력을 가지고 있는 제브라피쉬는 손상된 에피카르듐13을치유하기 위해 폴리플로이드 세포 성장에 의존한다. 폴리플로이디는 또한 급성 부상 후 포유류 간 재생 및 신장 관 상피 수리에 기여14,,15. 이러한 예에서, 폴리플로이드 세포는 내발자전거 또는 내막증을 통한 내분 복제에 의해 생성되며, 이는사이토카네시스(12)의블록으로 인한 이중핵세포를 초래한다. 수수께끼는 상처 수리 중에 polyploid 세포가 발생하는 이유와 polyploidy가 조직 기능에 미치는 영향입니다. 최근 연구는 폴리 플로이디가 치유의 이점이나 단점을 제공하는지의 질문에 대한 새로운 통찰력을 제공했습니다. 제브라피시 에피카듐에서, 폴리플로이디는 상처 치유의 속도를 향상(13). D. 멜라노가스터 힌구트와 포유류 간에서, 폴리플로이드는 온코겐성장(11,,14)에대하여 보호된 것으로 밝혀졌다. 성인 플라이 상피에서, 최근에 폴리플로이드는 물질 독성스트레스(16)의존재에서 상처 수리를 가능하게 한다는 것을 최근에 발견되었다. 내보 복제는 DNA 손상에 내성이 있어 세포 증식이17일손상될 때 상처 치유를 허용한다. 마우스와 제브라피시 하트의 심근세포의 경우, 폴리플로이디는 치유를 느리게 하여 흉터 형성18,,19를강화한다. 따라서 장기 및/또는 세포 유형에 따라 폴리플로이디는 유익하거나 해로운 조직 수리 전략이 될 수 있다. 상처 유발 폴리플로이드화(WIP) 반응의 분석과 결합된 D. 멜라노가스터 유전학의 접근성은 이 상처 치유 전략을 안내하는 분자 및 세포 메커니즘을 해명하기 위한 이상적인 모델 시스템입니다.
여기서, 우리는 성인 D. 멜라노가스터 상피에서 WIP를 분석하기위한 프로토콜을 제시한다. 과일 플라이 부상, 해부, 면역 염색, 마운팅, 이미징 및 재상피성, 세포 융합 및 내분 복제(ploidy)의 분석에 대한 지침이 포함되어 있습니다. 이미징 및 계략 분석은 또한 WIP가 발생하는지 여부를 테스트하기 위해 다른 모델에 적응할 수 있습니다. 핵 DNA 함량이 증가함에 따라 핵 크기가 그에 상응하는 증가가 발생하는 경우가 많다는 점에 유의해야 합니다. 그러나, 핵 크기가 ploidy20에있는 상응하는 변경을 반영하지 않는 생물학에 있는 많은 예가 있습니다. 세포가 종종 상처 부위를 커버하기 위해 퍼지거나 스트레칭하는 상처 환경의 맥락에서 핵 크기를 해석 할 때 더욱 주의를 기울여야합니다. 따라서, ploidy의 유일한 확실한 변화 증거는 이 방법(또는 전체 게놈 시퀀싱과 같은 다른 사람)에 의해 DNA 함량을 측정하는것이다(21). 이 방법은 상처 수리에서 폴리플로이디의 역할과 조절을 연구하는 모델로서 성인 D. 멜라노가스터 복부 상피의 적합성을 증가시킨다.
프로토콜
1. 성인 과일 파리의 준비 및 상처
- 선택의 D. 멜라노가스터 변형을 선택 (즉, 에피 갈4 / UAS 변형, 재료의 표를참조하십시오).
참고: 여기에서, Gal4/UAS 시스템은 UAS의 다운스트림에 인코딩된 유전자 또는 RNAi의 상피 특이적 유전자 발현(epi-Gal4)을 가능하게 하기 위하여 이용됩니다. 이 연구는 형광막 단백질 (UAS-Cd8.mRFP), 미토틱 유도제 (UAS-fzrRNAi,UAS-stg), 및 WIP 억제제 (UAS-E2F1RNAi)를사용합니다. UAS-RacDN). - 새로 동봉된 암컷 과일 파리 2개, 3-5일까지 25°C의 신선한 음식 유리병에 나이를 먹이게 됩니다. 한 병은 부상되지 않은 통제 역할을하고 다른 유리병은 아래에 설명된 대로 부상을 입었습니다. 암컷 파리는 수컷(~5/바이알)으로 유지되어야 합니다.
- 파리를 감기 위해 각각 0.10mm 스테인리스 스틸 핀으로 여러 핀 홀더를 조립합니다. 핀의 날카로운 끝이 밖으로 향하고 있는지 확인합니다. 핀은 플라이에 구멍을 뚫은 후 쉽게 구부리거나 칩을 만들 수 있으며, 연결되거나 손상된 핀을 폐기해야 합니다.
- 세 이에 따른 암컷 과일을 스테레오현미경 아래 CO2-플라이패드에서 마취시키고 페인트 브러시를 사용하여 행에 정렬합니다. 안전 안경을 착용하고 핀 홀더를 한 손에 들고 다른 한 손에는 집게를 사용하여 복부를 향한 비행을 배치하십시오.
- 성인 암컷은 복부 중선 흉골의 양쪽에 있는 테르기테 A4의 상피 흉부 부위 내에서날아간다(도 1A). 이 복부 영역을 천공하면 기계적 처리로 조직 가장자리가 찢어지는 해부 현장에서 최적의 공간을 제공합니다.
- 부상당한 파리를 음식 병병과 나이로 돌려보내 원하는 날 후 부상(dpi)으로 돌아갑니다. 상피 상처 치유는 1 dpi에서 시작하여 3 dpi로 끝납니다. 내분 복제는 EdU 분석 (섹션 4, 그림 2)에이상적입니다 2 dpi에서 피크.
2. 복부 해부를 날아다
참고 : 이 단계 동안 상피의 무결성을 손상시킬 수 있기 때문에 해부 도구로 복부 조직을 만지지 않는 것이 중요합니다.
- 해부에 필요한 모든 재료를 구하십시오: 그레이스의 용액, 집게, 반나의 스프링 가위, 0.10mm 핀, 해부 플레이트, 9개의 유리 해부 접시, 고정 용액(1x PBS의 4% 파라포름알데히드), 1x PBS, 물티슈, 파이펫 및 30μm및 장갑(표참조).
- 파리가 입체 현미경으로 CO2-플라이패드에서 마취하고 상처 흉터의 존재를 확인하여 성공적으로 부상을 입었다는 것을 확인하십시오 (즉, 복부에 멜라닌 반점, 그림 1B참조). 성공적으로 부상하지 않은 실험 그룹에서 어떤 파리를 폐기.
- 해부를 시작하려면 그레이스의 용액으로 9 개의 잘 유리 해부 접시 중 하나를 채웁니다. 한 쌍의 집게를 사용하여 흉부의 등쪽 옆에서 부상당한 암컷의 비행을 파악하고 그레이스의 해결책을 담은 우물에 날아다닌다.
- 흉부를 방출하지 않고 반대쪽 손의 집게를 사용하여, 테르기테 A6 아래 의 등쪽 큐티클을 뚫고 과일 플라이의 후면 끝에서 큐티클을 당깁니다. 내부 장기 (난소와 창 자)는 일반적으로이 단계에서 나올 것입니다. 그렇지 않은 경우, 부드럽게 나머지 장기를 짜내고 빈 우물로 폐기하는 집게와 복부의 등쪽을 밀어.
- 집게를 사용하여 터기테 A2 위의 흉부 접합부에서 전체 복부를 스냅하고 그레이스의 용액의 ~100 μL을 포함하는 빈 우물로 복부를 옮긴다.
- 모든 비행 복부가 해부 될 때까지 단계 2.3-2.5를 반복합니다.
- 풀링, 해부 된 복부를 포함하는 우물에서 그레이스의 용액의 볼륨을 30 μL로 줄입니다.
- 복부를 한 손에 집게로 등쪽 쪽에 복부를 배치한 다음 반나의 봄 가위 의 하단 블레이드를 복강에 삽입하여 복부를 열어 놓습니다. 복부가 완전히 열릴 때까지 등부 미드라인을 따라 잘라서 최대 3컷(도1C, 1D)을필요로 할 수 있다.Figure 1
- 복부 장착 영역당 4개의 0.10mm 핀으로 건조 해부 판을 설치합니다. 각 35mm 해부 플레이트는 최대 7개의 마운팅 영역에 맞을 수 있습니다. 각 장착 영역에 그레이스의 용액의 파이펫 30 μL각 액수에 각 물방울에 필레된 복부 1개를 전달합니다.
- 필레가 있는 복부를 4개의 등갈 모서리에 있는 접시에 고정시다(그림1E). 조직이 복부 조직을 찢거나 과도하게 늘려지지 않고 평평하게 놓여 있는지 확인하십시오.
- 조직을 수정하려면 그레이스의 용액에서 파이펫을 벗기고 고정 된 복부에 수정 용액의 30 μL을 추가합니다.
주의: 파라포름알데히드가 독성이 있기 때문에 수정 용액을 취급하는 동안 장갑을 착용하십시오. - 모든 필레가 있는 복부가 해부판에 고정될 때까지 2.10-2.11 단계를 반복합니다.
- 각 접시의 하단에 테이프 라벨을 놓아 각 컨트롤과 실험 그룹을 표시합니다. 실온(RT)에서 30-60분 동안 샘플을 수정합니다.
- 각 플레이트에 1x PBS의 1.5mL에 파이펫팅하여 수정 솔루션을 씻어. 기관 지침에 따라 적절한 액체 또는 건조 화학 폐기물 용기에 수정 솔루션 및 플라스틱을 폐기하십시오.
- 1x PBS1.5mL로 플레이트 2배를 세척하고 뚜껑이 있는 플라스틱 용기에 1.5mL의 고정 티슈를 보관합니다. 축축한 종이 타월 층을 용기 바닥에 넣고 해부 1주일 이내에 면역스테인을 준비할 때까지 샘플을 4°C에 저장합니다.
3. 면역형광
- 갓 준비 시약 (재료의 표참조): 세척 버퍼 솔루션 (0.3% 트리톤 X 100, 0.3% PbS에서 BSA). 남은 세척 버퍼는 4 °C에서 저장하고 2 일 염색 프로토콜의 기간 동안 사용할 수 있습니다. 항-Grh(1:300Figure 2정화 토끼 안티-그레인헤드8)또는 안티 RFP(1:1,000 토끼 안티-RFP)를 사용하여 항-FasIII(1:50 마우스 항-Fasciclin-III)를 사용하여 분석물당 충분한 1차 항체 용액을 준비한다. 1차 항체 용액은 4°C에서 저장되고 신호가 현저히 감소될 때까지 여러 번 재사용할 수 있다.
- 1x PBS를 피펫하고, 1.5mL의 세척 버퍼를 추가하고, RT에서 궤도 셰이커(80rpm)에 적어도 30분 동안 배양하여 조직을 침투합니다.
- 1차 항체 용액의 1.5mL로 하룻밤 동안 완충제 및 얼룩 조직을 제거하고 4°C에서 궤도 셰이커(80rpm)에 배양합니다. 1 차적인 항체 용액을 수집하고 향후 실험을 위해 4 °C의 튜브에 저장하십시오.
- 먼저 1x PBS로 시료를 빠르게 헹구고 1.5mL의 세척 버퍼로 3배 세척합니다. 각 세척에 대해, 적어도 30 분 동안 궤도 셰이커에 RT에서 샘플을 배양.
- 최종 세척 하는 동안, 보조 항체 용액을 준비: 1:1,000 당나귀 안티 토끼 알렉사 488 또는 568 및 1:1:000 염소 안티 마우스 알렉사 488 또는 568 (또는 선택의 형광) 세척 버퍼.
- 이차 항체 용액의 1.5 mL로 세척 및 염색 조직을 제거하십시오. 알루미늄 호일로 샘플을 덮고 RT의 궤도 셰이커에서 3시간 동안 배양합니다. 또는, 샘플은 궤도 셰이커에 4 °C에서 하룻밤 배양 될 수있다.
- 먼저 이차 항체 용액을 폐기하여 샘플을 세척한 다음 1x PBS로 신속하게 샘플을 헹구고 1.5mL의 세척 버퍼로 세 가지 세척을 합니다. 각 세척에 대해, 적어도 30 분 동안 궤도 셰이커에 RT에서 샘플을 배양.
- DAPI를 세척 버퍼에서 10 μg/mL로 희석하여 DAPI 솔루션을 준비합니다. 마지막 세척 후, 30 분 동안 RT에서 배양 1.5 mL DAPI 용액얼룩 샘플.
- DAPI 용액을 폐기하고 1x PBS의 1.5mL에서 2배의 샘플을 헹구십시오. 얼룩진 조직을 1.5mL의 1x PBS에 저장하고 알루미늄 호일로 덮여 있으며, 4°C에서 커버슬립이 있는 유리 슬라이드에 장착할 준비가 되어 있습니다. 장착 단계는 1주일 이내에 수행해야 합니다.
4. 세포 주기 활동 (EdU 분석)
- dH20에서 EdU 분말을 용해하고 완전히 용해 될 때까지 ~ 15 분 동안 혼합하여 Click-iT 키트 (재료 표참조)에서 10 mM EdU 스톡 솔루션을 구성하십시오. 스톡 용액은 알리인용(튜브당 250 μL)이며 -80°C에 보관할 수 있다.
- 피드는 먼저 dH 2 O. 용액이 흐리고 잠시 소용돌이가 섞일 때까지 건조 효모를 추가하여 EdU 스톡을 dH2O.에서 5mM로 희석하여 EdU를 날아갑니다. 0.5mL 튜브 캡을 잘라 플라이 푸드 바이알의 바닥에 놓습니다. 뚜껑을 음식에 밀어 넣어 안정적입니다.
- 파리를 마취하고 3-5일 된 파리를 바이알로 옮기. 파리를 한 가장자리로 탭하여 캡에 고정되지 않도록 합니다.
- 파이펫 75 μL 의 효모-EdU 용액이 캡에 들어갑니다. 파리는 매일 신선한 효모-EdU 용액을 공급하고 파리가 유리병 바닥에 갇히지 않도록 매일 모자를 쓴 신선한 음식 유리병으로 옮겨야 합니다.
- 파리를 옮기려면 캡으로 새 유리병에 뒤집고, 파리를 잠들게 하고, 파리를 한쪽으로 탭하고, 신선한 효모-EdU 솔루션을 추가합니다.
- 셋째 날에는 파리를 다치게 하고 효모-EdU를 2dpi(그림Figure 44A)에서해부할 때까지 계속 먹이를 주고 있습니다. 해부 및 고정 방법에 대한 프로토콜 섹션 2를 참조하십시오.
- EdU 염색 시약 준비: 세척 버퍼 (0.3% 트리톤 X 100, PBS 0.3% BSA), 퍼메라빌리화 버퍼(1x PBS000000; 블로킹 버퍼(1x PBS의 3% BSA), EdU 분석 키트(재료표 참조)에서시약을 준비하여 제조사가 지시한 1x 반응 버퍼 및 1x 반응 완충제를 포함한다.
- 1 시간 동안 샘플을 세척하고 1.5 mL의 세척 버퍼에 RT에서 혼합하십시오.
- 1.5mL의 투과성 버퍼를 추가하고 샘플을 20분 동안 배양합니다.
참고: 500 μL/plate의 부피를 사용하여 반응 칵테일 솔루션을 해동하고 준비합니다. - 1x PBS로 샘플을 1배 빠르게 세척한 다음 1mL의 블로킹 버퍼로 3배 빠르게 세척합니다.
- 남은 모든 블로킹 버퍼를 피펫하고 플레이트당 500μL의 반응 칵테일 용액을 추가합니다. 조직이 완전히 덮여 있는지 확인하기 위해 소용돌이 플레이트. RT에서 1 시간 동안 어둠 속에서 서랍에 인큐베이션.
- 블로킹 버퍼의 1.5mL로 샘플을 1배 빠르게 세척합니다.
- 1.5mL의 DAPI 용액을 30분 동안 세척 버퍼로 1:5,000에 스테인합니다.
- 1x PBS로 2x를 빠르게 세척하고, 호일로 감싸고, 3일 이내에 샘플을 장착할 때까지 4°C에서 어둠 속에서 보관하십시오.
5. 스테인드 티슈 산
- 유리 슬라이드, 유리 커버립, 선명한 매니큐어, 마운팅 미디어, 집게 쌍 및 물티슈 : 장착에 필요한 모든 재료를 가져옵니다.
- 스테인드 플라이 티슈를 장착하려면 스테레오 현미경 아래의 집게를 사용하여 해부 판에서 복부를 고정해제하십시오. 조직을 유리 커버슬립에 장착 하는 매체의 ~30 μL로 옮기고, 등쪽 측면에 의해 집게로 조직을 부드럽게 잡고, 집게로 복부 부위를 만지지 않도록 주의를 기울입니다.
- 입체 현미경의 밑에 안쪽이 엄호 전표를 향해 아래로 향하고 있도록 복부 조직을 방향을 조정합니다 (즉, 외부 큐티클/강모가 위로 향하고 있습니다). 집게를 사용하여 지향복부를 미디어 액적의 가장자리로 당깁니다. 표면 장력은 조직을 평평하게 유지하는 데 도움이됩니다(그림 1F).
참고: 이 단계에서 컬럼이나 행에서 복부를 구성하는 이미징에 유용합니다. - 유리 슬라이드(예: 제어 또는 실험)에 레이블을 지정하고 슬라이드를 커버슬립에 천천히 가까이 가져와 커버슬립을 선택합니다. 슬라이드를 뒤집고 닦아 서 여분의 장착 미디어를 제거합니다.
- 뚜껑 가장자리를 명확한 매니큐어로 밀봉하고 나머지 모든 실험 그룹에 대해 반복하십시오. 이미지를 이미지할 준비가 될 때까지 슬라이드 를 4°C의 슬라이드 상자에 저장합니다.
6. 이미징 및 처리
- 먼저 공초점 현미경(도 1B),포인트 스캐너 또는 40 x 오일 또는 건조 목표를 가진 구조화 조명 (ApoTome)으로 멜라닌 흉터를 먼저 찾아서 복부 상처 영역을 이미지.
- 각 채널의 노출을 확인하여 신호가 채도 보다 낮도록 합니다. 이미징 설정은 가장 밝은 샘플 그룹을 기반으로 해야 합니다. 이는 DAPI 채널이 DNA 함량을 정확하게 측정하기 위해 선형 범위에 있어야 하기 때문에 ploidy 분석에 특히 중요합니다.
- 슬라이스 사이에 최소 0.50 μm의 최적의 거리를 가진 세 채널 모두에 전체 z 스택 이미지를 가져 가라. 캡처된 이미지를 저장하고 이미지 분석 프로그램 피지(ImageJ라고도 함)에서 파일을 엽니다.
- 각 이미지에 대해 모든 채널에 대한 슬라이스 옵션을 사용하여 z 스택 프로젝션을 만듭니다.
- 핵이 이미지 에 걸쳐 수평으로 줄 지어 있는지 확인하기 위해 필요에 따라 이미지를 회전(그림 3A 및 도 4E).
- 모든 이미지를 상처 부위 또는 부상 제어 센터를 중심으로 300 μm x 300 μm의 직사각형 선택으로 자르는 다. 사각형을 그리고 편집을 선택하여 영역을 식별 | 선택 | 를 지정합니다. 스케일링된 장치가 미크론에 있는지 확인하여 모든 이미지를 분석하는 데 동일한 크기의 상자가 사용되었는지 확인합니다.
7. 내보 복제 (ploidy) 분석
- 피지를 사용하여 Grh 채널 창을 선택하고 이미지를 복제합니다. 그런 다음 임계값 도구를 사용하여 마스크를 만듭니다. 핵을 크게 축소하지 않고 배경을 최소화하기 위해 상단 막대를 슬라이딩하여 임계값을 수동으로 조정합니다(도4D).Figure 4
- Grh 채널내의 핵이 임계값 이미지에서 만지는 경우, 배경과 동일한 색상의 페인트브러시 도구(2픽셀 너비)를 사용하여 핵 사이에 선을 그립니다. 최종 마스크를 생성하려면 완료되면 1x를 적용하려면 클릭하십시오.
- 입자 분석 기능을 사용하여 관심 영역(ROI) 맵을 생성합니다: 배경을 포함하지 않고 대부분의 핵을 포획하기 위해 크기를 5 μm-60 μm로 설정합니다.
- ROI 관리자에서필요에 따라 ROI 맵을 수동으로 조정합니다. 핵이 아닌 모든 선택을 삭제하고 프리핸드 선택 도구로 핵을 요약하고 ROI 관리자(도 4D)에추가하여 식별되지Figure 4않은 목록에 핵을 추가한다.
- DAPI 채널을 선택한 다음 ROI 관리자의 모든 표시를 클릭하여 Grh 채널에서 생성된 ROI 맵을 DAPI 채널에 적용합니다.
- 상피 핵 윤곽선이 ROI 맵에서 무피테리알 핵(예를 들어, 근육 또는 지방에서 핵)과 겹치는 모든 선택을 삭제합니다. 그레인헤드는 상피 핵에만 얼룩을 내지만, DAPI는 모든 핵을 얼룩지게 합니다. 각 설명된 선택 항목에 는 하나의 핵만 포함되어 있는지 확인하고 두 개 이상의 핵으로 모든 선택을 삭제하거나 편집합니다. 편집된 ROI 목록을 저장합니다.
- 피지의 분석 도구를 사용하여 ROI 맵에서 각 상피 핵의 면적및 통합 밀도를 측정합니다. 값을 스프레드시트 프로그램으로 내보냅니다.
- 원형 선택 도구를 사용하여 평균 이미지 배경을 측정합니다. DAPI 이미지의 다른 영역에서 핵과 겹치지 않는 세 개의 원을 그립니다. 각 원의 영역 및 통합 밀도를 스프레드시트 프로그램에 추가하여 배경 이미지 밝기를 설정합니다.
- 먼저 각 배경 통합 밀도 값을 해당 영역으로 나누어 각 이미지의 단위 영역당 평균 배경을 계산합니다. 그런 다음 단위 면적당 평균 배경을 얻기 위해 이미지에 대한 영역 별 세 개의 통합 밀도를 평균화합니다.
- 다음으로, 단위 영역당 평균 배경으로 핵의 영역을 곱하여 각 DAPI 핵의 총 배경을 계산한다. 측정된 각 핵에 대한 정규화된 DAPI 강도는 각 핵의 총 배경을 측정된 통합 밀도로부터 빼서 계산할 수 있다.
- 부상되지 않은 상피 제어에서 정규화된 모든 DAPI 강도 값을 평균합니다. 부상되지 않은 상피 핵은 이전에 2C의 계피 값을 갖는 것으로 계산되었으며 실험조건(8)으로부터상피 핵에서 계피를 계산하는 기준역할을 할 수 있다.
- 각 핵의 정규화된 DAPI 강도를 미조건 상피 대조군(2C)으로부터 정규화된 값으로 나눈 다음 값을 2로 곱하여 정규화된 계략(C-값)과 동일하게 곱하여 각 핵의 계골을 계산합니다.
(핵 통합 밀도 - 배경 핵 통합 밀도)/평균 핵 통합 밀도(미수 된 상피 핵 = 2C) x 2 = 상피 핵 계포 (C) - 도트 플롯으로서 계피 값을 가진 그래프 핵, 히스토그램, 또는 그에 따라 바 그래프로 그룹화 (즉, 2C [0.6-2.9C], 4C [3.0-5.9C], 8C [6.0-12.9C], 16C [13.0-24.9C], 및 >32C [>25.0C][ 그리고 >32C][>25.0C][ 그리고>32C][>25.0C][>25.0C][ 및 gt;32C][>25.0C][>25.0C][ 및 gt;32C][>25.0C][>25.0C]]Figure 3F
결과
상처 유발 폴리플로이이제이션(WIP)을 연구하기 위한 모델로 D. 멜라노가스터를 사용하기 위한 상세한 프로토콜이 제공된다. 이 상처 치유 모델은 포유류 및 WIP의 다른 플라이 모델에 비해 많은 장점을 제공합니다. 폴리플로이디는 곤충 핀과 폴리플로이드 세포를 가진 기계적 천자에 의해 용이하게 유도되었다 짧은 기간 내에 생성되었다(2-3 dpi)(도 1A, 1B)4. 주요 과제는 상피에 대한 동요없이 그대로 복부 조직의 해부입니다. D. 멜라노가스터 상피는 실수로 충돌하거나 날카로운 해부 도구로 긁힌다. 따라서 이 프로토콜의 단계는 사용 및 분석 전에 수행해야 합니다.
첫째, 부상은 화상 진찰에 이상적인 크고 평평한 불투명 조직 영역을 제공하는 복부 여성 복부로 제한되었습니다. 펑크 상처는 복부 중선 흉골의 양쪽에 놓여 있고 tergite (T) 세그먼트 T4-T5(그림 1A-C)사이표적plrite 상피에 가해졌다. 이 상처 배치는 해부에 의해 중단되지 않는 큰 가시 영역을 제공합니다. 도전적인 단계는 복부 스프링 가위 절단 및 고정 단계(도 1D, 1E)를포함한다. 스프링 절단 단계는 조직의 움직임을 줄이기 위해 그레이스용액(~30 μL)의 감소된 부피에서 복부를 절단했을 때 가장 잘 작동했습니다. 등쪽 중형선을 따라 잘 중심적인 컷이 복부판(도1C)에고정할 수 있는 복부 등쪽 플랩에 충분한 영역을 제공해야 하였다. 복부는 과도한 힘없이 네 모서리에 부드럽게 고정해야합니다(그림 1E). 너무 단단한 핀 푸시는 복부 조직을 왜곡하고 심지어 해부 판으로 조직을 밀어 넣을 수 있습니다. 이 경우, 조직을 폐기해야합니다. 복부 조직이 고정되면 면역 형광 얼룩이 완료되고 복부가 이미징을위한 유리 커버 슬립에 장착 될 때까지 해부 판에 남아 있었습니다(도 1F).
상처 치유는 연속상피 시트가 필요하며, 이는 내보 복제 및 세포 융합4,,16에의존한다. 세포-세포 접합을 표지하는 정화 접합 단백질 FasIII는, 어떤 처리 동요가 준비 도중 일어났는지에 대한 지표를 제공했습니다(그림 1G, 1H). 상처 부위를 교란시키는 큰 상처(얼룩지지 않은 부위)를 가진 복부는 버려야 하며 추가 분석에 사용되지 않아야한다(도 1H).
다음 단계는 WIP의 결함에 대해 그대로 샘플을 분석하는 것이었습니다. 이 프로토콜에는 WIP 응답의 상이한 측면을 검출하기 위한 뚜렷한분석(그림 2)이포함되어 있습니다. 상처 수리는 중앙, 크고 다중핵세포가 상처 딱지(도3A)를덮으면 완성되었다.Figure 3 여기서 세포 융합은 FasIII/Grh에 대한 염색및 FasIII 윤곽 영역4에포괄된 Grh+ 상피 핵의 수를 정량화하여 검출되었다. 상피 시트에서 >10 μm의 간격이 관찰되었을 때 상처 폐쇄 또는 상피화의 결함이검출되었다(도 3B,적색 화살표). 이는 예를 들어, WIP가 stg, fzrRNAi의발현을통해 미토틱 사이클의 활성화에 의해 억제되었을 때, 최근 보고된 바와 같이16. 이러한 유전적 상태에서, 상처의 52%는 상처 딱지(도3B, 3C)를통해 연속상피 시트를 형성할 수 없었다.
이 모델에서 상처 수리를 측정하는 또 다른 방법은 UAS-mCD8-ChRFP4 (도 2, 도3D)의에피-갈4 발현으로 상피 막을 시각화하는 것이었다. Figure 3 대조군에서는 상피 상처의 91%가 3dpi로 완전히 닫혔지만, 이전에 보고된 바와 같이, 상피 상처의 92%가 완전히 개방된 상태로 유지되는 원인이 되는 내피복제(E2f1RNAi)및 세포 융합(RacDN)을 차단하여RacDNWIP를억제하였다(그림3D, 3E)8,16.Figure 3 stg의 발현에 의한 미토성 세포 주기의 활성화, fzrRNAi는 또한 상피 상처 폐쇄 결함을 초래했다. 그러나, 상피 세포막을 시각화함으로써, 재상화 결함의 정도를 결정할 수 있었다. WIP돌연변이체(E2f1RNAi,RacDN)플라이 상처는 스트릿, fzrRNAi 상처(그림3D,대시 된 빨간 윤곽)16보다더 개방적이었다.Figure 3 이 멤브레인 상처 치유 분석은 상처 복구 결함의 정도에 대한 자세한 정보를 제공했다. 그 결과, 상피화 결함은 완전히 개방되고 부분적으로 닫히거나(즉, >10 μm 간격) 또는 완전히 닫히거나 완전히 닫히거나(그림3D, 3E)로그룹화될 수 있다.Figure 3
세포 융합 이외에, 상피 세포는 핵 DNA 함량을 두 배로 하는 불완전한 세포 주기인 내보 복제에 의해 크기가 증가합니다. 내분 복제는 세포 주기 활성 및 직접 핵 DNA 계측(도2 및 도 4)에의해 분석되었다. 여기서, 세포 주기 활성은 티미딘 아날로그, EdU(도4A, 4B)의편입에 의해 검출되었다. D. 멜라노가스터 상피 세포는 내피사이클, 개입M 상4,,12없이S와 G 단계 사이에 진동하는 불완전한 세포 주기를 입력하는 것으로 나타났다. 성인 D. 멜라노가스터 다이어트는 부상 전에 EdU+ 음식으로 보충되었고 파리는 2 dpi(그림 4A)에서해부 될 때까지 EdU+ 식단에 유지되었습니다. 그런 다음 제조업체의 클릭-iT 프로토콜을 사용하여 EdU가 검색되었습니다. 이 EdU 분석은 상처에 반응하여 S 상에 진입하기 위해 언제, 언제, 얼마나 많은 핵을 발동했는지를 결정하는 데 사용되었습니다. Gal4/UAS 시스템을 이용하여, 최근 myc의 상피 특이적 발현이 S 상체에 진입하기 위해 상피 세포의 능력을차단(mycRNAi)또는 악화(Myc overexpression)할 수 있음을 발견하였다. 그 결과, Myc는 상해 없이도,16,22까지사후 세포에서 내복제를 유도하기에충분하다는것을 보여주었다.
다음으로, 상피 계포는 핵 DNA 함량을 직접 측정하여 결정되었다. 상피 핵은 상피 특이적 마커, Grh(도4D)에대한 면역형광Figure 4염색에 의해 확인되었다. 피지 이미징 소프트웨어에서 상피 핵은 체계적으로 식별된 다음 Grh 핵 얼룩을 사용하여 임계값을 설정했습니다. 핵은 그 때 분리되고 ROI는 스택 DAPI 이미지의 SUM에 오버레이되었다(도 4D,녹색 화살표). 임의의 중첩핵은 선택된 핵의 통합 밀도를 측정하기 전에 수동으로 삭제하였다(도4D,적색 화살표).Figure 4 이 반자동 방법은 부상과 수리 된 비행 복부 상피8을통해 대부분의 핵의 분포와 계피를 정량화 할 수 있습니다. 최근에 보고된 바와 같이, 상처를 둘러싼 상피 핵은 3dpi(도4E, 4F)16에서3C 이상의 DNA 함량을 가진 44% 폴리플로이드 핵으로 구성되었다. EdU 결과에서 예상대로, myc의 녹다운은 상피 핵의 9%만이 폴리플로이드였으며, Myc의 과발현은 상처 부위 주변의 100% 폴리플로이드 상피 핵을 초래했기 때문에 내분 복제에 있는 중요한 블록을 주도하였다(도4F)16. 상피 핵 크기는 또한 감소 또는 확대 된 핵을 가진 myc 발현에 의해 눈에 띄게 영향을 받았다. 그러나, 핵영역은 세포 스트레칭과 같은 요인이 핵 DNA함량(20)에영향을 미치지 않으면서 핵 크기에 영향을 미칠 수 있기 때문에, 핵영역은 정확한 측정과 생리학적 효과가 아니다.
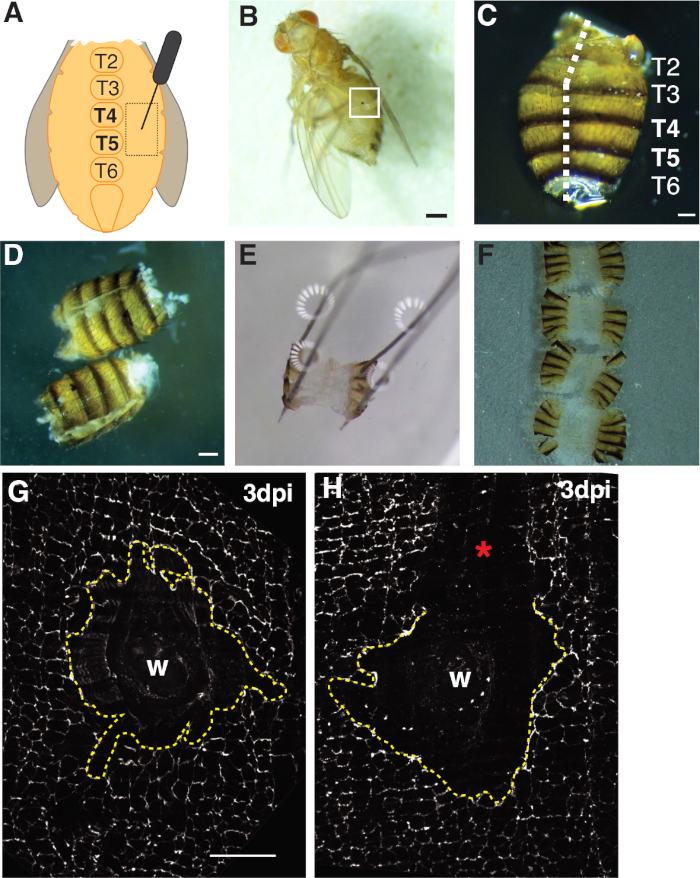
그림 1: 성인 과일은 복부 상처, 해부 및 조직 마운팅을 날아다닌다. (A)성인 복부 상처 분석의 다이어그램. 파리는 tergite 4 (T4)에서 복부의 양쪽에 부상을해야합니다. (B)상처 치유(화이트 박스)로 형성된 멜라닌 딱지가 있는 성인 암컷 과일 플라이 3dpi. 스케일 바 = 50 μm.(C)해부 성인 복부, 등등 보기, 테르기테 라벨. 복부는 등쪽 의 중간선 아래로 필로 (흰색 대시 라인). 스케일 바 = 50 μm.(D)고정하기 전에 해부 및 필렛 성인 복부. 스케일 바 = 50 μm.(E)해부 판에 고정 된 성인 복부. 등쪽 의 복부의 네 모서리 각각에 핀을 배치했다. 조직은 부드럽게 열렸지만 늘어나지 않고 찢어지는 것을 피했습니다. (F)성인 복부를 장착하고 유리 슬라이드를 향해 커버 슬립과 큐티클을 향해 아래로 향하고 복부의 내부와 유리 커버 슬립에 배치되었다. (G)가공 성교및 중앙 싱크티움 (파선 노란색 선)이없는 손상 부위의 FasIII 염색. 스케일 바 = 50 μm.(H)긁힌 상처 영역(*)의 이미지로, 시동을 방해하는 미염색된 FasIII 영역이 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
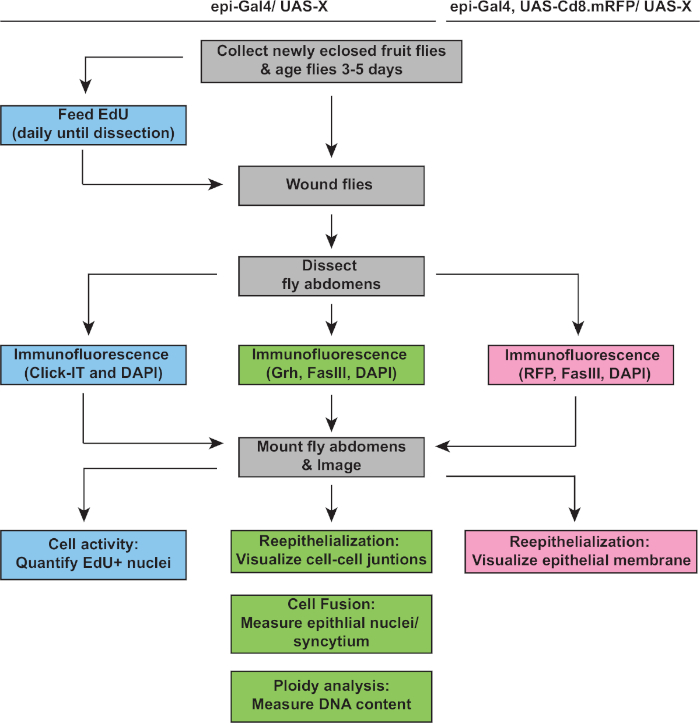
그림 2: WIP 분석 워크플로우. 순서도는 이 연구에서 설명된 세 가지 측정값과 WIP 응답을 감지하고 측정하기 위한 겹치고 뚜렷한 단계를 묘사합니다. EdU 분석법은 세포 주기 활성(블루 박스), ploidy 및 재상피화가 Grh/FasIII 면역스테인링(green box)에 의해 검출되며, 막 RFP의 발현을 통해 상피 상처 폐쇄(pink box)의 정도를 측정할 수 있습니다. 일반적인 단계는 회색 상자에 있고 D. 멜라노가스터 균주 유전자형은 위에 나열되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
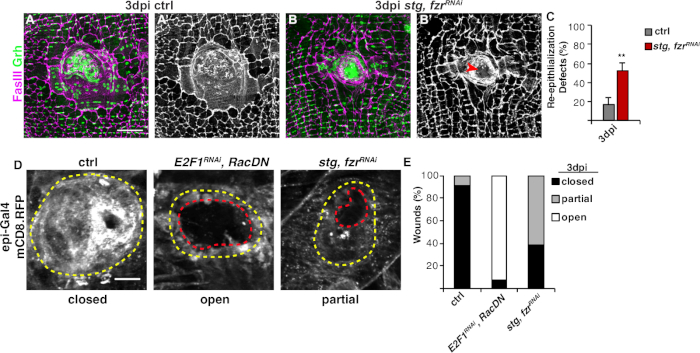
그림 3: WIP 동안 다시 상피화를 감지하는 방법. WIP가 유전적으로 억제되었을 때 다시 상피화는 혼란스러웠습니다. 제어(A)및 스트, fzrRNAi (B)의면역형성 이미지는 3dpi에서. 상피 핵 및 정화 접합은 Grh (녹색) 및 FasIII (마젠타)로 각각 염색되었다. (A'와 B') FasIII 염색만으로는 재상피화가 스티그, fzrRNAi 상피에서 손상되었다는 것을 보여주었습니다. 스케일 바 = 50 μm.(C)재상화 결함의 정량화(%) 에서 3 dpi (회색): 제어 (n = 8), stg, fzrRNAi (n = 6). 오류 막대는 표준 오류를 나타냅니다. 통계적 유의성은 학생의 T-테스트, **P< 0.01을 통해 측정되었다. 상처 수리 중 재상화는 또한 에피-갈4, UAS-mCD8-RFP를 사용하여 RFP를 연결된 멤브레인의 발현에 의해 검출될 수 있었다. (D)제어의 면역 형광 이미지, E2F1RNAi,RacDN,및 stg, fzrRNAi 에서 3 dpi. 스케일 바 = 20 μm. 상처 딱지 (노란색 윤곽선) 및 열린 상피 상처 영역 (빨간색 윤곽선). (E)ctrl (n = 11), E2F1RNAi,RacDN (n = 13) 및 stg, fzrRNAi (n = 13)에서 상처 폐쇄의 정량화. 그렌들러 외16에서적응 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
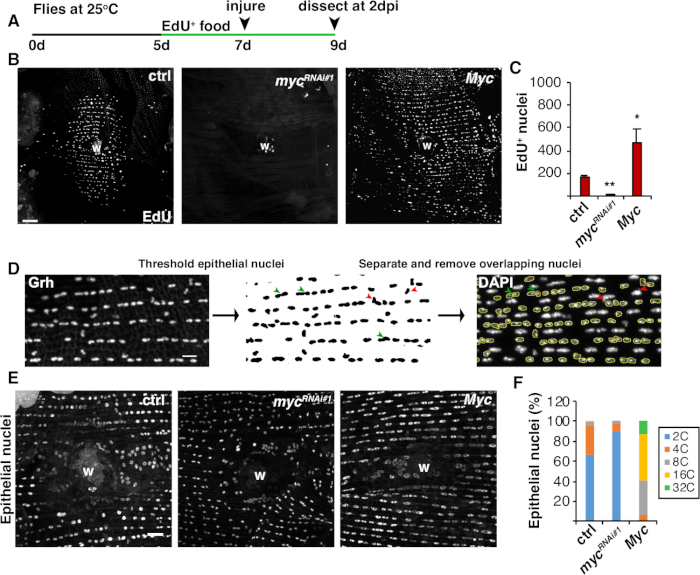
그림 4: WIP 동안 내보 복제를 감지하는 방법입니다. (A)EdU 분석의 타임 라인 : 성인 드로소필라는 부상 2 일 전에 매일 5 mM 효모 - EdU의 75 μL을 공급하고 2 dpi까지 계속했다. (B)2 dpi에서 에피-갈4/UAS 시스템으로 표현된 플라이 균주에서 EdU 라벨의 면역형이미지. 상처 딱지 (W). 스케일 바 = 50 μm.(C)2 dpi에서 비행 당 EdU + 상피 핵의 평균 수 : ctrl (n = 37), mycRNAi #1 (n = 10), 및 Myc (n = 8). 오류 막대는 표준 오류를 나타냅니다. 통계적 유의성은 학생의 T-테스트, *P&05, **P&01을 통해 측정되었다. (D)상피 핵 계략의 검출 및 측정의 회로도. 상피 핵은 피지의 항 Grh 얼룩에 의해 확인되고 문턱을 지었다. 중첩상 상피 핵은 분리되었다 (녹색 화살표 머리) 또는 제거 (빨간 화살촉) 없음피탈리아 핵에 의해 오버레이하는 경우. 해당 DAPI 스테인드 핵 이미지의 통합 밀도 및 핵 영역을 측정했다. (E)상피 핵 크기(Grh)는 3dpi에서 myc 발현에 의해 변경되었다. (F)상피 핵계포 (%) 에서 3 dpi: ctrl (n = 4), mycRNAi #1 (n = 6), 그리고 Myc (n = 3). 그렌들러 외16에서적응 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
제시된 것은 상처 수리16도중 재상피화 및 내보복제를 변경해서 유전자가 WIP를 통제하는 방법을 연구하기 위하여 성인 D. melanogaster 복부 상피를 해부하고 사용하는 방법에 대한 상세한 프로토콜입니다. 이 방법을 사용하여 프로토 온코진 Myc는 최근 WIP의 주요 레귤레이터로 확인되었습니다. Myc는 상피 세포가 사후 부상을 내보복제하기 위해 필요하며, 성인용 플라이 상피 및 액세서리땀샘(16,,22)에서모두 내발성 세포를 내분비하기에 충분하다. 또한 상피 세포를 stg의 발현에 의한 미토세포 주기로 전환하는 것이 발견되었으며, fzrRNAi는 상처 수리에 해롭다. 이 방법을 사용하여 지속적인 연구는 WIP 도중 재상피화 및 내보 복제를 통제하는 데 필요한 그밖 유전자를, polyploidy가 어떻게 polyploidy가 규제되고 각종 조직에 있는 기능에 있는 유사성 그리고 다름을 드러내는 것을 확인할 것입니다.
이 모델및 방법은 기계적 펑크로 폴리플로이디를 쉽게 유도하고4일이내에 폴리플로이드 세포가 생성된다는 사실을 포함하여 독특한 이점을 제공한다. 조직 해부 및 준비 프로토콜은 애벌레 해부 기술(23)을기반으로하지만 성인 비행 복부는 더 단단하고 따라서 쉽게 혼란스럽습니다. 결과적으로,이 프로토콜은 WIP를 연구하기 위해 그대로 조직을 격리하기 위해 연습과 정밀도가 필요합니다. 그러나 일단 해부되면 상피는 명확하게 보이고 쉽게 이미지화되어 상처 치유 과정의 스냅샷을 생성합니다. 이 방법은 성인 비행의 상피 조직, 세포 및 syncytium 크기, 세포 및 개별 핵의 계피에 대한 풍부한 정보를 제공합니다. 라이브 이미징은 불투명한 큐티클로 인해 온전한 과일 비행 내에서 는 아직 가능하지 않지만, 이 프로토콜은 단기 라이브 이미징 연구24를수행하기 위해 D. melanogaster에서 사용되는 현재 사용 가능한 전 생체 권양 조건을 포함하도록 조정할 수 있습니다.
미래에, 이 모형은 관심의 그밖 세포 모형에 있는 Gal4/UAS 시스템으로 유전자 발현을 조절하여 WIP에 세포 세포 간 교차토크 및 그밖 세포 모형의 기여를 연구하기 위하여 이상적일 것입니다. 유사한 질문은 또한 다양한 유전 및 돌연변이 배경을 사용하여 대답할 수 있습니다. 해부 된 성인 플라이 복부에는 지방 체및 이뇨형, 측면 근육 섬유, 감각 뉴런, 기관 및 대식세포와 같은 혈구를 포함하여이 방법을 사용하여 쉽게 시각화 할 수있는 다양한 세포 유형이 포함되어 있습니다. 또한,이 모델은 생리적 변수가 섹스, 식이 요법, 감염, 나이 및 환경 스트레스를 포함하여 WIP에 미치는 영향을 조사하는 것을 허용할 것입니다. 프로토콜은 더 큰 크기로 인해 성인 여성 비행을 사용하는 동안, WIP는 또한 남성 과일 비행에서 발생 (Gjelsvik및 Losick, 게시되지 않음). 폴리플로이드 세포는 포유류 간, 뇌, 눈 및 심장12에서노화 및 노화 관련 질병 중에 발생하는 것으로 밝혀졌다. 과일 비행 모델은 인간 질병 관련 유전자가 높게 보존되기 때문에 연구원이 생리및 질병 맥락에서 polyploidization를 공부하는 것을 가능하게 할 것입니다.
공개
없음.
감사의 말
보스턴 대학에서, 우리는 인프라 및 지원을위한 보스턴 대학 이미징 코어에서 이미징 및 브렛 저드슨에 대한 자신의 실험실의 카메라와 입체 현미경 설정을 사용하여 박사 에릭 포크에게 감사드립니다. 우리는 또한 플라이 커뮤니티 자원에 감사하고 싶습니다: 블루밍턴 드로소필라 주식 센터 (NIH P40OD018537), 비엔나 드로소필라 자원 센터, 하버드 의과 대학의 TRiP 센터 (NIH / NIGMS R01-GM01-GM084947) 이 연구에 사용되는 형질 형 주식을 제공하기위한. 마우스 FasIII 항체는 NIH의 NICHD에 의해 지원되는 발달 연구 Hybridoma 은행에서 얻어지고 아이오와 대학, 생물학의 부, 아이오와 시티, IA에서 유지되었습니다. 이 간행물에서 보고된 연구는 상 번호 R35GM124691의 밑에 건강의 국가 학회의 일반 의학 과학의 국가 학회에 의해 지원되었습니다. 이 내용은 전적으로 저자의 책임이며 반드시 국립 보건원의 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
참고문헌
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239 (2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251 (2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125 (2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327 (2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344 (2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005 (2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013 (2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111 (2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유