JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포칼슘 측정 및 칼슘 이미징 연구를 위한 뇌 모세관 과구 배양
요약
뇌 모세관 pericytes는 혈액-뇌 장벽 속성 및 혈류의 조절에 필수적인 선수. 이 프로토콜은 뇌 모세관 pericytes가 세포 유형에 대하여 특징지어지고 형광 프로브를 가진 세포내 칼슘 신호의 조사를 위해 적용되는 방법을 설명합니다.
초록
Pericytes는 신경 혈관 단위 (NVU)로 알려져 있는 구조물에 있는 내피 세포 및 성상체 끝피트와 연관됩니다. 뇌 모세관 회낭 기능은 완전히 알려져 있지 않다. Pericytes는 모세관 발달, 내피 장벽 압박감 및 trancytosis 활동의 규제, 모세관 톤의 조절 및 특정 뇌 병리에 중요한 역할을 하는 경우에 관여하기 위하여 건의되었습니다.
Pericytes는 뇌 빈맥의 과정을 시각화하는 데 어려움뿐만 아니라 NVU의 다른 세포와 가까운 근접성으로 인해 손상되지 않은 뇌에서 조사하기가 어렵습니다. 본 프로토콜은 1 차적인 소 두뇌 모세관 pericytes의 격리 그리고 문화를 위한 방법 및 두뇌 신호 및 병리학에 관련되었던 작용제의 효력이 조사될 수 있는 칼슘 화상 진찰 연구 결과에 있는 그들의 다음 사용을 기술합니다. 피질 모세관 단편은 배양 플라스크의 바닥에 부착할 수 있으며, 6일 후에 내피 세포와 회낭이 모세관 단편에서 자생하였다. 내피 세포는 부드러운 트립시화에 의해 제거되고 pericytes는 통과하기 전에 5 추가 일 동안 배양됩니다.
분리된 pericytes는 96웰 배양 판에서 씨를 뿌리고 칼슘 표시기 염료(Fura-2 아세톡시메틸(AM)로 적재되어 플레이트 판독기 설정에서 세포내 칼슘 수치를 측정할 수 있습니다. 또는, pericytes는 커버립에 시드되고 세포 챔버에 장착됩니다. 칼슘 표시기 (Cal-520 AM)로 적재 한 후, 칼슘 라이브 이미징은 488 nm의 내분 파장 및 510-520 nm의 방출 파장에서 공초점 현미경 검사를 사용하여 수행 할 수 있습니다.
여기에 설명된 방법은 1차 뇌 모세관 pericytes로부터 최초의 세포내 칼슘 측정을 얻기 위해 사용되어 왔으며, 이는 pericytes가 ATP를 통해 자극되고 체외에서 수축할 수 있음을 보여줍니다.
서문
뇌 모세관 과다구는 내피 세포 및 성상 세포와 함께 NVU1,2,3을구성한다. 모세 혈관의 구조적 기초를 형성하는 내피 세포는 직경 5-8 μm의 긴 원통형 튜브를 형성합니다. 내피 세포는 산발적으로 pericytes로 덮여 있으며 성상세포에서 돌출로 둘러싸여 있습니다. 성상 세포 끝피트.
뇌 모세 혈관에 위치한 혈액 뇌 장벽 (BBB)은 뇌와 혈액 사이의 영양소, 가스 및 폐기물의 교환을위한 주요 사이트입니다. BBB는 또한 내인성 및 외인성 신경 독소로부터 두뇌를 보호하고 많은 수의 약물 화합물의 납품을 위한 장벽 역할을 합니다. 장벽 기능은 중추 신경계 (CNS) 의약품을 개발하는 제약 회사를위한 초점 영역뿐만 아니라 장애물입니다. 이것은 문화4에서NVU의 세포를 조사하는 데 큰 관심을 불러 일으켰습니다. 뇌 성상세포와 내피 세포는 여러 연구에서 배양되고 특징지어지지만, 백혈구 배양을 위한 연구와 프로토콜은 희소합니다.
이전에 발표된 프로토콜은 면역파닝5,고혈당 및 저혈당 미디어6,형광 활성화 세포 분류7,밀도 그라데이션 원심 분리8등과 같은 다양한 접근법을 사용하여 어느 정도 뇌 모세관 백혈구 배양의 생성을 기술했다. 이러한 방법은 pericytes의 배양을 얻기에 충분해 보이지만, 일부는 시간이 많이 걸리고 비용이 많이 들고 얻은 pericytes는 pericytes9를구별할 수 있는 문화 구절의 수로 인해 이상적이지 않을 수 있습니다. 더욱이, 체외 신호 연구에서 배양 pericytes의 잠재력은 지금까지 상당히 미개척 되었습니다.
본 연구는 고립된 소 뇌 모세혈관으로부터의 회낭 배양 의 생성과 중요한 세포내 두 번째 메신저인 세포내 칼슘의 변화에 대한 측정 및 이미징 연구를 위한 후속 설정에 초점을 맞추고 있습니다. 우리는 피질 회색 물질에서 모세 혈관의 격리 (세부 사항은 Helms외. 10참조) 및 내피 또는 신경교 세포에 오염없이 순수한 단일 문화에서 pericytes의 격리 및 문화를 간단히 설명합니다. 그런 다음 96웰 플레이트에서 회낭을 파종하고 칼슘 프로브 Fura-2 AM에 대한 적재 프로토콜을 제공합니다. 마지막으로, 우리는 pericytes가 현미경 배양 챔버에 있는 실시간 공초점 화상 진찰에서 어떻게 이용될 수 있는지 보여주고 이것을 위한 프로토콜을 기술합니다.
프로토콜
1. 세포 배양을 위한 완충제 및 솔루션 준비
- 4°C에서 하룻밤 사이에 50mL의 PBS에서 인간 태반으로부터 콜라겐 IV 5 mg을 용해시켜 콜라겐 스톡 솔루션을 준비한다. 주식 용액을 5mL 부분으로 알리쿼트하고 -20 °C에 보관하십시오.
- 하룻밤 동안 멸균 수의 5 mL에 섬유 네틴 5 mg을 용해하여 섬유 네틴 재고 용액을 준비합니다. -20°C에서 500 μL의 알리쿼트에 섬유네틴 주식을 저장합니다. 해동시, 50mL의 최종 부피에 PBS를 추가하여 작업 용액을 준비하고 4°C로 저장하십시오.
- Dulbecco의 수정 된 이글 매체 (DMEM) 완전한 매체를 준비 하여 50 mL의 태아 소 혈청 (FBS), MEM 비 필수 아미노산의 5 mL 및 5 mL 페니실린 / 연쇄 상 류 신 황 산염 (0.1 g/L 연쇄상 구균 황 산 및 100,000 U/L penill)
- PBS에서 헤파린 나트륨 염을 용해시켜 5 mg/mL 헤파린 스톡 솔루션을 준비하고 멸균을 위해 0.2 μm 필터를 통과합니다. 스톡 용액을 4°C로 저장합니다.
- 사용 직전에 성장 매체(GM)를 준비합니다. T75-플라스크 당 DMEM-comp 및 250 μL의 헤파린 스톡 용액을 혼합합니다.
2. 신선한 소 뇌에서 모세 혈관의 격리
참고: 소 뇌 모세 혈관은 이전에 설명된 대로 분리되고 배양됩니다(Helms외. 10).
- 도살장에서 12개월 이상 된 송아지에서 뇌를 수집하고 얼음 위에 있는 실험실로 직접 데려다 준다.
- 수막을 제거하고 메스를 사용하여 뇌에서 모든 회색 물질을 수집합니다. 뇌와 회색 물질을 회색으로 덮는 필름으로 수막을 식별합니다.
- 덜벡코의 수정된 이글 매체(DMEM)에서 회색 물질을 균질화하기 위해 40mL 투주 티슈 그라인더를 사용합니다. 티슈 그라인더 1/5의 슬림한 부분을 회색 물질 현탁액으로 채우고 슬림한 부분이 채워질 때까지 DMEM을 추가합니다.
- 160 μm 나일론 그물 필터를 통해 호모게네이트의 여과에 의해 모세 혈관을 자유 세포와 작은 조직 조각에서 분리합니다. DMEM-comp로 필터를 플러시합니다. 모세 혈관을 검색하고 서스펜션을 50mL 원심 분리 튜브로 풀을 냅니다.
- DMEM-comp에서 모세 혈관을 다시 중단하고 DNase I (170 U/mL), 콜라게나제 타입 III(200 U/mL) 및 트립신(90 U/mL)의 효소 혼합을 추가합니다. 모세 혈관의 소화를 위해 37 °C 수조에 1 h의 현탁액을 둡니다.
- 200 μm 메쉬 필터를 통해 서스펜션을 실행하고 10 % 디메틸 설산화물 (DMSO)로 FBS에서 재연. 모세혈관을 하룻밤 동안 동결하여 -80°C에서 장기간 보관한 다음날 액체 질소로 이동합니다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다.
3. 소 모세 혈관의 종과 배양
- 0일차: 콜라겐 IV 재고0.7mL과 PBS 6.3mL를 혼합합니다. T75-플라스크에 용액을 추가하고 실온 (RT)에서 2 시간 동안 플라스크를 남기거나 4 ° C에서 하룻밤 둡니다.
- 플라스크에서 콜라겐 용액을 제거하고 PBS로 세 번 세척하십시오.
- 섬유네틴 작업 용액 7mL를 추가하고 RT에서 30 분 동안 플라스크를 둡니다. 그런 다음, 섬유네틴 용액을 제거하고 모세혈관을 바로 시드한다.
- 대기 시간 30 분 동안 37 °C 수조에서 모세 혈관 1 병을 해동하십시오.
- 모세혈관이 해동되면, DMEM-comp30mL및 원심분리기30mL로 즉시 500xg및 RT에서 5분 동안 원심분리튜브로 이송하여 튜브에서 DMEM-comp를 제거하고 10mL의 신선한 DMEM-comp로 모세관 펠릿을 다시 중단한다.
- 코팅된 T75-플라스크로 10mL 서스펜션을 옮기고 모세혈관을 플라스크의 바닥에 부착하여 37°C 인큐베이터에서 4-6h로 10%CO2로이수한다.
참고: 세포 성장률은 종래의 5% CO2보다는 10% CO2에서더 높다. - 4-6 h의 인큐베이션 후 가벼운 현미경으로 플라스크를 검사합니다. 모세 혈관의 분수는 이제 플라스크의 바닥에 부착되어야한다(그림 1,일 0).
- GM을 준비하고 모세 혈관에서 매우 신중 DMEN-comp 매체를 흡인하고 갓 만든 GM의 10 mL로 대체.
- 2일차: 모세 혈관에서 GM을 제거하고 갓 만든 GM의 10 mL로 대체. 모세 혈관에서 세포 아웃은이 시점에서 빛 현미경에서 볼 수 있어야합니다(그림 1,일 2-3).
4. 소 뇌 모세 혈관에서 기본 pericytes의 격리
-
4일차: 가벼운 현미경으로 모세 혈관을 검사합니다.
참고: 플라스크는 이제 약 60-70% 컨실수있어야 적절한 양의 pericytes(그림1,4)를 제공해야 합니다. 그렇지 않은 경우; GM을 신선한 매체10mL로 교체하고 인큐베이터에 플라스크를 하루 더 남겨 둡니다. - 매체를 흡인하고 PBS에서 세포를 부드럽게 씻으십시오.
- 내피 세포를 위해 해동 된 트립신-EDTA 2 mL을 추가하고 1-3 분 동안 인큐베이터에 플라스크를 둡니다. 플라스크를 자주 꺼내이 기간 동안 현미경으로 관찰하십시오.
참고: 내피 세포는 플라스크에서 반올림하고 분리해야 합니다. pericytes는 "유령"-형태학을 가진 세포로 표시되어야 하고 아직도 플라스크의 표면에 붙어 있어야 합니다. 이것은 까다롭고 중요한 단계입니다. 대부분의 내피 세포를 제거하여 회막 단배의 오염을 피하는 것이 필수적이지만 장기간트립시화는 또한 pericytes를 분리할 수 있습니다. 트립시화 시간은 때때로 약간 다를 수 있으며, 따라서 치료 중에 현미경으로 플라스크를 자주 관찰하는 것이 가장 중요합니다. - 내피 세포가 반올림하기 시작했을 때 플라스크를 부드럽게 탭하여 느슨한 내피 세포를 분리합니다.
- 트립시니화를 중지하려면 플라스크에 DMEM-comp 10 mL을 추가합니다. 내피 세포를 제거하기 위해 배지로 플라스크를 조심스럽게 몇 번 플러시하십시오. 플라스크에서 내피 세포 서스펜션을 흡인시합니다. 내피 세포는 이제 다른 목적을 위해 사용될 수 있다.
- 플라스크에 DMEM-comp 10mL를 추가합니다. 백혈구가 여전히 존재하고 바닥에 부착되어 있는지 확인하기 위해 가벼운 현미경 아래에 보십시오. 플라스크를 인큐베이터에 다시 넣어 백혈구가 풍부한 문화가 성장할 수 있도록 합니다.
참고: 다음 날 동안 문화를 관찰하는 것이 중요합니다. 또 다른 트립신 처리를 성장하는 내피 세포의 공정한 양이 아직도 있는 경우에 수행될 수 있다. - DMEM-comp의 변화와 함께 pericyte 단일 문화가 성장하도록 합니다. 매 2일마다 매체. 광 현미경하에서 세포의 성장을 확인합니다(도1,5-8).
5. 1차 소 회량의 단일문화의 생성 및 보관
-
8-9일차: 가벼운 현미경의 밑에 모세혈관 검사
참고 : pericytes는 이제 70-80 %에 도달하고 플라스크의 섬에서 성장해야합니다(그림 1,9 일). 백혈구의 결합이 70 % 미만인 경우 세포가 다른 날을 위해 성장할 수 있게합니다. pericytes는 내피 세포가 하는 것처럼 완전한 단층을 형성하지 않습니다. - DMEM-comp를 흡인하고 PBS의 7mL로 pericytes를 세척합니다.
- 플라스크에 트립신-EDTA 2mL을 넣고 인큐베이터에 2-3분 간 둡니다. 플라스크를 가벼운 현미경 아래에 자주 놓아 회고가 플라스크에서 반올림하고 분리할 때 관찰합니다. 회낭이 반올림되기 시작하면 플라스크를 부드럽게 탭하여 세포를 분리할 수 있습니다.
- 펄어즙이 반올림하기 시작했을 때 플라스크를 부드럽게 탭하여 세포를 분리합니다.
- 트립시화 공정을 중지하기 위해 플라스크에 DMEM-comp 10 mL을 추가합니다. 플라스크를 매체로 몇 번 플러시하여 마지막 pericytes를 분리합니다.
- 12mL 셀 서스펜션을 50mL 원심분리 튜브로 옮기고 DMEM-comp로 최대 30mL까지 채웁니다.
- 500 x g에서 5 분 동안 세포 현탁액을 원심 분리하고 RT. DMEM-comp를 흡인시합니다. 조심스럽게 세포 펠릿을 건드리지 않고. 10% DMSO로 FBS의 3mL에서 세포 펠릿을 다시 중단합니다.
- 세포 현탁액을 극저온으로 옮기; 각각 1mL를 추가하므로 T75 플라스크 당 총 3 개의 바이알이 있습니다. 하룻밤 -80 °C에서 pericytes를 동결하고 장기 저장을 위해 다음 날 액체 질소로 이동합니다.
참고: 세포는 생존 율의 나중에 추정을 위해 동결하기 전에 계산될 수 있습니다. 프로토콜은 여기에서 일시 중지할 수 있습니다.
6. 실험을 위한 백혈구 단일문화 설정
- 3.1-3.4항에 언급된 것과 동일한 절차를 사용하여 콜라겐 IV 및 fibronectin으로 T75-플라스크를 코팅합니다.
- 플라스크는 섬유네신으로 코팅되는 동안, 37 °C 수조에서 회리세포의 한 유리병을 해동.
- 현재 해동된 회분리체를 극저온에서 30mL의 DMEM-comp로 원심분리 튜브로 옮긴다. 500 x g,RT에서 5 분 동안 세포 현탁액을 원심 분리합니다.
- 조심스럽게 배지를 흡인하여 세포 펠릿을 튜브 바닥에 둡시합니다. 10mL DMEM-comp에서 펠릿을 다시 중단합니다.
- 셀 서스펜션을 코팅된 플라스크로 수집하고 전송합니다. 10% CO2에서37°C 인큐베이터에서 자라도록 회리세포로 플라스크를 둡니다.
- 매 2일마다 신선한 DMEM-comp 10mL로 매체를 새로 고칩니다.
참고: 5일간의 성장 후, 회백세포는 약 80%의 합류에 도달해야 합니다. 합류도가 적으면 세포를 하루 이틀 동안 자랍니다. 세포는 이제 추가 실험을 위해 시드를 받을 준비가 되어 있어야 합니다.
7. 코팅 된 96 웰 플레이트에 회낭의 파종
- 3.1 단계에서 설명된 바와 같이 콜라겐 IV를 희석시다. 96웰 플레이트에 각각 100 μL을 추가하고 RT에서 2시간 또는 4°C에서 하룻밤 동안 배양합니다.
- 용액을 흡인하고 PBS로 우물을 세 번 씻으세요.
- 각 우물에 희석 된 섬유 네틴 100 μL을 추가하고 30 분 동안 RT에서 배양하십시오. 섬유네틴 용액을 제거하고 즉시 플레이트를 사용하십시오.
참고: 회낭 처리가 얼마나 잘 증가하고 있는지에 따라 두 개의 플레이트를 시드할 수 있는 충분한 셀이 있어야 합니다. - 인큐베이터에서 pericytes를 꺼내 매체를 흡인하십시오. PBS로 셀을 씻으시면 됩니다.
- 2mL의 트립신-EDTA를 pericytes에 추가하고 5.3-5.6 단계와 동일한 절차를 따르십시오.
- 매체를 흡인시키고, 세포 펠릿을 해치지 않고 신선한 DMEM-comp의 1mL에서 펠릿을 다시 중단한다.
- 셀 서스펜션의 12 μL을 꺼내 계산 챔버에 추가합니다. 광 현미경에서, 3x3 그리드의 적어도 3을 계산하고 그리드 당 평균 셀 수를 사용합니다.
- 아래 방정식을 사용하여 96웰 플레이트에서 각 웰에 첨가해야 하는 셀 서스펜션의 부피를 잘 10.000개의 세포에 첨가해야 합니다.
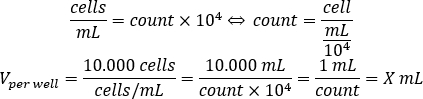
- DMEM-comp와 각 웰에 셀 서스펜션의 계산된 볼륨을 추가하여 최종 부피 200 μL에 도달합니다.
- 96웰 플레이트를 37°C 인큐베이터에 10% CO2로놓습니다. 2 일 후에 매체의 변경으로 4 일 동안 성장하는 세포를 둡니다.
8. Ca2+이미징을 위한 버퍼 및 솔루션 준비
- 오토클레이브 커버슬립 셀 챔버 및 커버립.
- 분석 버퍼: 10mHEPES의 최종 농도에 대 한 HBSS 버퍼의 500 mL에 HEPES의 1.19 g를 추가 합니다. pH를 7.4로 조정합니다.
- 20% (w/v) 플로론 F127 + 1% (v/v) 폴리에톡시레이트 피마자 오일 스톡 용액을 유리 바이알에서 무수성 DMSO 2.5mL에 0.5 g의 플로론 F127 용액을 용해시한다. 약 30분 동안 40°C로 가열하거나 용해및 소용돌이가 될 때까지 가열합니다. 폴리에톡시산 피마자 오일 25μL을 넣고 RT에 보관하십시오. 동결하지 마십시오.
- 무수DMSO의 500 μL에서 1 mg을 용해하여 2m Fura-2 AM 재고를 준비하십시오. 20 μL의 알리쿼트에 저장 -20 °C빛으로부터 보호.
- 5 μM 후라-2 AM 로딩 용액을 20 μL의 20% 플로론 F-127 + 1% 폴리에톡시산 피마자 오일 스톡 용액을 2m Fura-2 AM 알리쿼트의 20 μL과 혼합하여 준비하십시오. 분석 버퍼와 소용돌이의 500 μL을 추가합니다. 8mL의 최종 볼륨에 분석 버퍼를 추가합니다. 용액은 사용하기 직전에 준비하고 빛으로부터 보호해야 합니다.
- 무수DMSO의 226.7 μL에서 1 mg을 용해하여 오전 4m Cal-520 AM을 준비하십시오. 20 μL의 알리쿼트에 저장 -20 °C빛으로부터 보호.
- 20 μM Cal-520 AM 로딩 용액20 μL F-127 + 1% 폴리에톡시레이트 피마자 오일 스톡 용액을 20 μL 4 mM Cal-520 알리쿼트와 혼합하여 20 μM Cal-520 AM 로딩 솔루션을 준비합니다. 분석 버퍼와 소용돌이의 500 μL을 추가합니다. 4mL의 최종 볼륨에 분석 버퍼를 추가합니다. 용액은 사용하기 직전에 준비하고 빛으로부터 보호해야 합니다.
9. 플레이트 리더 셋업에서 후라-2 AM 칼슘 표시기 염료로 pericytes를 적재
참고: 실험이 시작되기 전에 모든 솔루션은 RT에 있어야 합니다.
- 인큐베이터의 세포로 96웰 플레이트를 꺼내 우물에서 배지를 흡인하십시오. 분석 버퍼로 셀을 두 번 씻으시하십시오.
- 각 우물에 100 μL의 적재 용액을 추가하고 사진 표백을 피하기 위해 주석호일로 접시를 감쌉니까. RT에서 30 rpm 흔들기와 45 분 동안 인큐베이션.
참고: 내부 구획을 적재할 수 있으므로 37°C에서 Fura-2 AM을 로드하지 마십시오. 버퍼를 로드하는 대신 셀과 함께 우물을 분석 버퍼에 남겨두는 것을 기억하십시오. 이들은 배경 형광을 측정하는 데 사용되는 "공백"입니다. - 적재 버퍼를 흡인하고 분석 버퍼로 셀을 두 번 세척합니다. 신선한 분석 버퍼 의 100 μL을 추가하고 RT에서 30 분 동안 배양세포를 둡니다; 이를 통해 AM-ester의 지속적인 분열이 가능하여 세포 내부에 후라-2 AM을 포획할 수 있습니다.
- Ca2+이미징 이전에 버퍼를 세척하고 100 μL의 신선한 분석 버퍼로 교체하십시오.
10. 플레이트 리더 셋업에서 회고물의 음플레이트 형광 판독
- 플레이트 판독기의 온도를 37°C로 설정하고 셀이 있는 96웰 플레이트를 샘플 플레이트 위치로 옮기. 시약 플레이트 위치에 고뇌제로 시약 판을 놓습니다.
- 모든 우물에서 후라-2 AM의 동일한 로딩을 보장하기 위해 셀의 부하를 측정하는 것으로 시작합니다.
- 340 nm/380 nm에서 발광 형광 파장과 510 nm에서 방출 파장으로 측정을 수행합니다. 시약 플레이트에서 각각 의약 판에서 150 μL/s 속도로 50 μL의 고뇌스트를 샘플 플레이트 위치에 있는 셀과 잘 추가합니다.
- 데이터를 저장하고 추가 분석을 위해 xlsx 파일로 내보냅니다. 도 2는 배경 형광이 빼는 시간이 지남에 따라 두 개의 여기 파장 사이의 비율로 측정된 세포색 Ca2+-response를 나타낸다.
참고: 플레이트 리더는 "셀 트레이"와 "샘플 트레이"와 통합 피페터 시스템을 위한 공간이 있는 듀얼 마이크로플레이트 판독기가 되어야 합니다.
11. 살아있는 화상 진찰을 위한 코팅된 세포 실에서 pericytes의 종자
참고: 커버립은 또한 배양 우물의 바닥에 배치될 수 있고, 위에서 설명한 대로 pericytes로 코팅및 씨를 뿌린 다음 실험 전에 챔버에 장착될 수 있다.
- 커버슬립을 셀 챔버에 장착하고 누출을 피하기 위해 단단히 만듭니다.
- 3.1 단계에서 설명된 바와 같이 콜라겐 IV를 희석시다. 각 세포 챔버에 500 μL을 추가하고 RT에서 2 시간 또는 4 °C에서 하룻밤 동안 배양합니다.
- 콜라겐 용액을 흡인하고 PBS의 500 μL로 챔버를 세 번 세척합니다.
- 각 우물에 희석 된 섬유 네틴 500 μL을 추가하고 30 분 동안 RT에서 배양하십시오. fibronectin 용액을 제거하고 그 후 바로 세포 챔버를 사용합니다.
- 그 동안, 코수 페리 사이클로 플라스크를 꺼내 PBS의 7 mL로 씻어.
- 2mL의 트립신-EDTA를 pericytes에 추가하고 5.3-5.6 단계와 동일한 절차를 따르십시오.
- 8.6-8.7 단계와 동일한 단계를 수행하여 진행합니다.
- 아래 방정식을 사용하여 챔버당 90.000 개의 세포를 시드하기 위해 각 챔버에 추가해야하는 셀 서스펜션의 양을 계산하십시오.
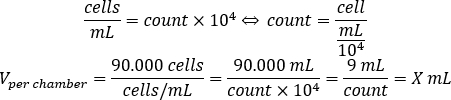
- DMEM-comp와 각 챔버에 셀 서스펜션의 계산된 부피를 추가하여 500 μL의 최종 부피에 도달합니다.
- 인큐베이터에 세포 챔버를 37°C, 10% CO2로놓습니다. 세포가 6일 동안 (또는 컨할 때까지) 자라도록 둡니다.
참고: 퍼사이클은 플라스틱에 비해 유리 슬라이드에서 느리게 자랍니다. 더 많은 성장이 필요합니다.
12. 라이브 이미징을 위한 Cal-520 AM 칼슘 표시기 염료로 pericytes를 적재
참고: 실험이 시작되기 전에 모든 솔루션은 RT에 있어야 합니다.
- 20 μM Cal-520 AM 적재 버퍼 준비: 20 μL Cal-520 알리쿼트와 20 μL Cal-520 알리쿼트와 20% 플로론 F-127 + 1% 폴리에톡시레이트 피마자 오일 스톡 용액의 20 μL Cal-520 을 혼합합니다. 500개의 μL 분석 버퍼와 소용돌이를 추가합니다. 4mL의 최종 볼륨에 분석 버퍼를 추가합니다. 용액은 사용하기 직전에 준비하고 빛으로부터 보호해야 합니다.
참고: 오전 520시에 Cal-520이 포함된 솔루션을 광 노출로부터 보호합니다. - 인큐베이터에서 세포 챔버를 꺼내 배지를 흡인하십시오. 분석 버퍼로 셀을 두 번 씻으시하십시오.
- 각 챔버에 500 μL의 적재 버퍼를 추가하고 45분 동안 RT에서 배양합니다.
- 로딩 버퍼를 흡인하고 분석 버퍼로 셀을 두 번 세척합니다.
- 각 챔버에 500 μL의 신선한 분석 버퍼를 추가하고 RT에서 30 분 동안 배양하여 AM-ester의 분열을 허용합니다.
- 버퍼를 500 μL의 신선한 분석 버퍼로 교체한 후 공초점 현미경에서 라이브 이미징을 수행합니다.
13. 셀룰러 Ca2 +수준의 라이브 이미징
참고: 다양한 현미경 유형이 이미징에 사용될 수 있습니다. 직립 또는 반전된 종래의 형광 현미경뿐만 아니라 적절한 흥분 원(488 nm) 및 배출 필터(510-520 nm)를 이용한 직립 또는 반전된 공초점 레이저 스캐닝 현미경을 사용할 수 있다. 목표는 형광에 적합해야하며 높은 품질과 높은 수치 조리개 (NA)가 있어야합니다.
- 세포의 교란을 피하기 위해 가능한 한 부드러운 공초점 현미경의 단계에 세포 챔버를 마운트.
- 488nm의 난초, 515nm에서 방출, 5초 간격의 순차적 이미지 수집, XY 이미지 크기 512 x 512 픽셀을 선택하고 기준칼슘 신호를 측정하기 위해 2분 동안 측정합니다.
- 파이펫을 사용하여 셀 챔버에 100m ATP의 3 μL을 추가하고 순차적 이미지 수집을 계속합니다. 첨가를 천천히 부드럽게 수행하여 준비를 방해하지 않고 세포를 초점에서 벗어나게 하십시오.
- 변경 정도를 관찰하고 더 이상 형태학적 변화가 지적되지 않고 약 18분 동안 필요에 따라 시간 간격을 증가시다(그림3).
- 시간 경과 이미지를 저장하고 추가 분석을 위해 TIFF 및/또는 AVI 파일로 내보냅니다.
참고: 1-2 96웰 플레이트와 여러 개의 커버립에서 파종에 충분한 세포를 제공해야 하며, 이는 두 가지 유형의 칼슘 측정에 대해 세포를 준비할 수 있습니다.
결과
소 뇌 모세 혈관신선한 두뇌 조직에서 격리 되었고 도 1 모세 혈관 종자 및 세포 배분 및 백혈구의 후속 정화를 선물. 모세혈관은 1일째에 플라스크에 완전히 부착되어 있으며, 2일째내피발아가 눈에 띄게되었다(도 1,2일). 4일 후, 세포 외성장은 매우 특이하며(도1,일 4a) 내피 세포는 기술된 프로토콜에 따라...
토론
이 연구에서는, 우리는 소 두뇌에서 1 차적인 pericytes를 격리하는 방법을 제시했습니다. 설명된 프로토콜은 그렇지 않으면 접근할 수 없는 세포 유형의 배양을 허용합니다. 이후에 얻은 세포 배양은 세포 형태학 및 단백질발현(12)에기초한 내피 세포 및 신경교 세포를 가진 거의 또는 전혀 오염없이 거의 또는 전혀 오염되지 않은 pericytes의 거의 균질한 집단이었다. 또한, 우리는 의...
공개
저자는 경쟁 적인 재정적 이익을 선언하지 않습니다.
감사의 말
저자는 뇌 장벽과 약물 전달에 룬드벡 재단 연구 이니셔티브에서 자금을 인정하고자 (RIBBDD) 사이먼 Hougners 가족 재단.
자료
| Name | Company | Catalog Number | Comments |
| ATP | Tocris | 3245 | |
| Cal-520 AM | AAT Bioquest | 21130 | |
| Cell incubator | Thermo Fisher | ||
| Centrifuge | Thermo Fisher | Heraeus Multifuge 3SR+ | Standard large volume centrifuge for spinning down cells |
| Collagen IV | Sigma Aldrich | C5533 | |
| Confocal laser scanning microscope | Carl Zeiss | Zeiss LSM 510 | Inverted microscope |
| Counting chamber | FastRead | 102 | |
| Coverslip cell chamber | Airekacells | SC15022 | |
| Cremophor EL | Sigma Aldrich | C5135 | Formerly known as Kolliphor EL |
| DMSO | Sigma Aldrich | 471267 | |
| Dulbecco's Modified Eagles Medium | Sigma Aldrich | D0819 | |
| Fetal bovine serum (FBS) | PAA/GE Healthcare | A15-101 | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Fura-2 AM | Thermo Fisher | F1201 | |
| Glass coverslips 22x22 mm | VWR International | 631-0123 | |
| HBSS | Gibco | 14065-049 | |
| Heparin | Sigma Aldrich | H3149 | |
| HEPES | AppliChem Panreac | A1069 | |
| Light microscope | Olympus | Olympus CK2 | Upright light microscope with phase contrast |
| MEM nonessential amino acids | Sigma Aldrich | M7145 | |
| Microplate Reader | BMG LabTech | NOVOstar | |
| PBS | Sigma Aldrich | D8537 | Phosphate-buffered saline |
| penicillin G sodium/streptomycin sulfate | Sigma Aldrich | P0781 | |
| Pluronic F127 | Sigma Aldrich | P2443 | |
| Trypsin-EDTA | Sigma Aldrich | T4299 | |
| T-75 flask | Sigma Aldrich | CLS3972 | |
| 96-well plate | Corning incorporated | 3603 |
참고문헌
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, Physiological, and Pathological Perspectives, Problems, and Promises. Developmental Cell. 21 (2), 193-215 (2011).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Mathiisen, T. M., Lehre, K. P., Danbolt, N. C., Ottersen, O. P. The Perivascular Astroglial Sheath Provides a Complete Covering of the Brain Microvessels: An Electron Microscopic 3D Reconstruction. Glia. 58 (9), 1094-1103 (2010).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Zhou, L., Sohet, F., Daneman, R. Purification of Pericytes from Rodent Optic Nerve by Immunopanning. Cold Spring Harbor Protocols. , 608-617 (2014).
- Liu, G. H., et al. Isolation, Purification, and Cultivation of Primary Retinal Microvascular Pericytes: A Novel Model Using Rats. Microcirculation. 21 (6), 478-489 (2014).
- Nayak, R. C., Herman, I. M. Bovine retinal microvascular pericytes: isolation, propagation, and identification. Methods In Molecular Medicine. 46, 247-263 (2001).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology-Heart and Circulatory Physiology. 302 (1), H69-H84 (2012).
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Helms, H. C., Brodin, B., Milner, R. Methods in Molecular Biology. Cerebral Angiogenesis: Methods and Protocols. 1135, 365-382 (2014).
- Abbracchio, M. P., Burnstock, G., Verkhratsky, A., Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in Neurosciences. 32 (1), 19-29 (2009).
- Cai, C., et al. Stimulation-induced rises in cerebral blood flow and local capillary vasoconstriction depend on conducted vascular responses in brain capillaries. PNAS. , (2018).
- Tigges, U., Welser-Alves, J. V., Boroujerdi, A., Milner, R. A novel and simple method for culturing pericytes from mouse brain. Microvascular Research. 84 (1), 74-80 (2012).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant Outgrowth, Propagation and Characterization of Human Pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Orlidge, A., Damore, P. A. Cell specific effects of glycosaminoglycans on the attachment and proliferation of vascular wall components. Microvascular Research. 31 (1), 41-53 (1986).
- Rhinehart, K., Zhang, Z., Pallone, T. L. Ca2+ signaling and membrane potential in descending vasa recta pericytes and endothelia. American Journal of Physiology-Renal Physiology. 283, F852-F860 (2002).
- Bintig, W., et al. Purine receptors and Ca2+ signalling in the human blood-brain barrier endothelial cell line hCMEC/D3. Purinergic Signalling. 8 (1), 71-80 (2012).
- Neuhaus, A. A., Couch, Y., Sutherland, B. A., Buchan, A. M. Novel method to study pericyte contractility and responses to ischaemia in vitro using electrical impedance. Journal of Cerebral Blood Flow and Metabolism. 37 (6), 2013-2024 (2017).
- Kamouchi, M., et al. Calcium influx pathways in rat CNS pericytes. Molecular Brain Research. 126 (2), 114-120 (2004).
- Das, A., et al. ATP Causes Retinal Pericytes to Contract In vitro. Experimental Eye Research. 46, 349-362 (1988).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유