Method Article
신경변성과 관련하여 성인 Drosophila에서 시냅스 퇴성을 시각화
요약
이 절차의 목표는 Drosophila melanogaster를사용하여 신경 퇴행성 질환 모델에서 DLM 신경 근육 접합 (NMJs)의 구조적 무결성을 평가하기 위해 등쪽 세로 근육 (DLM) 조직을 해부하는 것입니다.
초록
Drosophila는 신경 퇴행성 질환과 관련된 시냅스 구조 및 기능을 평가하기위한 유용한 모델역할을합니다. 많은 작업이 드로소필라 애벌레의 신경 근육 접합 (NMJs)에 초점을 맞추고 있지만 성인 Drosophila의 시냅스 무결성을 평가하는 것은 훨씬 덜 주의를 기울였습니다. 여기서 우리는 비행 능력에 필요한 등쪽 세로 근육 (DlM)의 해부에 대한 간단한 방법을 제공합니다. 행동 판독으로 비행 뿐만 아니라, 이 해부는 DM 시냅스와 근육 조직 모두 시냅스 마커 또는 관심있는 단백질에 대한 형광 표지 항체를 사용하여 구조적 분석에 순종할 수 있게 한다. 이 프로토콜은 대부분의 신경 퇴행성 질환의 진보적이고 연령 의존적 특성을 모델링하기 위해 노화 중 성인 Drosophila에서 시냅스의 구조적 무결성을 평가할 수 있게 합니다.
서문
시냅스 기능 장애는 대부분의 주요 신경 퇴행성 질환1,2,3,,4,,,,5,,6의초기 알려진 특징 중 하나입니다. 그러나 이러한 구조적 및 기능적 손상이 질병 진행의 후반 단계에 어떻게 관련되는지에 대해서는 거의 알려져 하지 않습니다. 드로소필라는 애벌레 NMJs,7,8,89를사용하여 시냅스의 성장과 발전을 이해하는 데 유용한 모델 시스템으로 입증되었습니다. 그러나, 세 번째 애벌레 인스타 단계는 진보적 인, 연령 의존 신경 변성을 공부에 자신의 유틸리티를 제한, 며칠 지속. 애벌레 NMJs를 평가하기,위한 대안은10,,,11,,12,,13,14,15,,16에필요한 도르살 경도 근육(DlM)에 형성된 시냅스와 같은 성인 드로소필라의시냅스 구조를 검사하는 것이다. 이러한 삼자 시냅스는 포유류 시냅스17과유사한 방식으로 구조적으로 조직되어 신경 퇴행성 질환의 모델을 평가하기 위한 독특한 이점을 제공한다.
여기에서 우리는 신경 변성의 Drosophila 모형에 있는 성인 NMJs의 구조적인 무결성을 분석하기 위한 간단한 방법을 기술합니다. 이전 DLM 해부 방법 및 연구는 다양한 응용 프로그램에 대한 근육 조직을 보존하는 중요성을 강조했다18,,19,,20,,21,,22, 23.,23 우리의 프로토콜은 신경 퇴행성 질환을 조사하기 위해 신경 조직과 근육 조직을 모두 보존하는 포괄적 인 방법을 제공합니다. 이 질병을 공부의 또 다른 주요 구성 요소는 나이 종속 방식으로 신경 손실을 이해하는 기능. 이전 작품은 DLM NMJ가 초기 성인11,12,,14,,15,,16,24로변신하는 동안 어떻게 형성되는지에 대한비판적이고심층적인 이해를 제공한다., 우리의 프로토콜은 노화와 신경 퇴행성 질환의 연령 의존적 방식으로 DLM NMJs를 조사하기 위해이 작업을 기반으로하는 방법을 수립합니다.
프로토콜
1. 형질전환 파리의 세대
- 이 실험을 위해 형질전환 파리를 생성하려면, UAS-TDP-43M337V 26 (그림 1A)의OK371-Gal425 처녀 암컷 파리와 수컷을 수집하여 패드에 CO2로 파리를 마취하여 정렬하십시오.
- 마취된 파리를 십자가에 대한 표준 드로소필라 미디어로 바이알로 정렬합니다. 다음 세대가 출현할 수 있도록 25°C에 표시된 바이알을 배치합니다.
참고: 자손이 나타나기 전에 바이알에서 성인을 지우면 적절한 유전자형을 보장하십시오. - 자손이 나타나면, 형질 전환파리를 바이알로 모으고 섹스별로 정렬하여 실험 조건에 대한 노화를 시작하십시오.
- 파리가 수집되면 파리가 21일까지 2일마다 신선한 음식으로 이동합니다.
2. 해부 준비
- 해부를 준비하기 위해 실리콘 엘라스토머로 코팅된 10cm 해부 접시인 실온 인산염 완충식식염수(1x PBS)를 획득하고, 직선 가장자리 해부 가위, 무딘 해부 집게 한 세트, P200 파이펫 및 파이펫 팁, 2.0 mL 마이크로 센테심분리기 튜브, 표준 사무실 가위, 70 % 에탄올, 6cm 페트리 접시, 32 % 포름알데히드가 1x PBS로 4 %로 희석됩니다.
- 각 유전자형 또는 조건에 대한 라벨 튜브와 각 튜브에 1x PBS(객실 온도) 및 150 μL의 150 μL을 각 튜브에 추가합니다. 4% 포름알데히드 고정을 준비할 때 장갑과 안전 안경을 착용하십시오.
- CO2로 바이알에서 직접 6\u201210 파리를 마취하고 70%의 에탄올이 있는 6cm 페트리 요리로 날아갑니다. 시편이 완전히 침수되도록 페인트 브러시를 사용하여 에탄올로 날아갑니다. 이렇게 하면 외부 표식에 오일 층이 제거됩니다.
3. 흉부 격리 및 고정
- 각 시편을 해부하기 전에 실리콘 엘라스토머로 코팅된 해부 접시에 약 7\u201210 mL의 1x PBS를 추가합니다. 이 부피는 조직 샘플이 완전히 침수되었는지 확인해야합니다.
- 무딘 집게를 사용하여 날개 나 다리를 잡고 70 % 에탄올에서 해부 접시에 하나의 비행을 전송합니다.
- 해부 현미경의 밑에 해부 접시에 견본을 집중합니다. 다음으로 샘플을 1x PBS로 잠그고 무딘 듀몬트 #5 미세 한 집게를 사용하여 날개를 조심스럽게 제거합니다.
- Vannas 직선 가장자리 스프링 해부 가위를 사용하여 큐티클의 복부 측에 작은 절개를 만들어 다리를 제거합니다. 3.8 단계에서, 이 절개는 포름알데히드가 조직을 관통할 수 있게 합니다.
- 한 손에 가위를 가지고 다른 한편으로는 집게를 잡고 비행 복부 측면을 위로 배치합니다. 무딘 집게로 표본을 제자리에 붙들고 있는 동안 해부 가위로 머리와 복부를 제거합니다.
- 3.2단계에서 변형된 파이펫 팁을 사용하여 격리된 흉부를 표지된 튜브로 옮킨다.
참고: 파이펫을 40 μL로 설정하여 고정에 1x PBS를 추가하지 않도록 합니다. - 각 시편에 대해 위의 3.2\u20123.6 단계를 반복합니다.
- 실온에서 30분 동안 샘플을 수정합니다.
- 파스퇴르 파이펫을 사용하여 수정 을 제거하고 연기 후드 아래 적절한 폐기물 용기에 버리십시오. 파스퇴르 파이펫을 사용하여 각각 1.5mL의 1x PBS로 샘플을 세 번 헹구습니다. 750 μL만 사용하여 네 번째 헹구기를 완료하고 조직을 1x PBS에 둡니다.
참고: 이 시점에서, 조직 견본은 다음 단계로 진행하기 전에 3 일까지 4°C에 남아 있습니다.
4. 플래시 동결 및 흉부 양단
- 양면을 시작하기 전에, 적절한 저온 보호 장갑과 안전 안경을 착용 액체 질소와 드와르 플라스크를 채웁니다. 블레이드 브레이커, 깃털 블레이드, 미세 한 쌍의 미세 집게, 얼음, 얼음 차가운 1x PBS 및 극저온 핀셋을 가져옵니다.
- 1x PBS 얼음을 차갑게 유지하기 위해 얼음 양동이를 준비합니다.
- 블레이드 브레이커를 사용하여 깃털 블레이드를 비스듬히 잡고 작은 조각을 분해하기 위해 블레이드를 구부립니다. 그런 다음 블레이드 브레이커는 작은 메스로 사용하기 위해 블레이드를 제자리에 잠글 수 있습니다.
참고: 모든 그룹에 대해 하나의 블레이드가 지속되어야 합니다. 블레이드가 부러지거나 둔해지면 전환합니다. - P200에 깨끗한 파이펫 팁을 추가하고 팁의th 1/5을 제거하여 샘플을 운반합니다.
- 각 그룹에 대한 새로운 미세 원심 분리기 튜브를 준비하고 각 튜브에 1x PBS의 200 μL을 추가합니다. 이 두 번째 튜브는 최종 DLM 준비를 수집하는 데 사용됩니다.
- 파스퇴르 파이펫을 사용하여 튜브에서 1x PBS를 모두 제거합니다.
- 적절한 보호 장비를 착용하고, 극저온 핀셋으로 10 초 동안 액체 질소 플라스크에 튜브를 침수하십시오.
참고: 튜브가 폭발하지 않도록 튜브를 단단히 닫아야 합니다. - 액체 질소에서 튜브를 제거하고 파스퇴르 파이펫으로 샘플에 약 300 μL의 얼음 차가운 1x PBS를 추가합니다. 샘플을 얼음 위에 보관하십시오.
- 실리콘 엘라스토머로 코팅된 10cm 해부 접시에 얼음처럼 차가운 1x PBS를 넣고 수정된 200 μL 파이펫으로 첫 번째 흉부를 분배합니다.
- 흉부 복부 면을 위로 놓습니다. 한편으로 는 흉부를 배치하기 위해 지루한 한 쌍의 집게를 사용하고 다른 한편으로는 흉부 신경절의 일부를 제거하여 흉부 신경절의 일부를 제거하여 흉부 의 중간선을 노출시합니다.
- 흉부의 미드라인을 가이드로 사용하여 흉부 의 1/3rd를 블레이드로 얕게 잘라냅니다.
- 흉부에서 블레이드를 제거하고 무딘 집게로 45 ° 각도로 흉부를 배치합니다. 블레이드를 다시 삽입하고 흉부의 중간선을 똑바로 잘라냅니다. 이로 인해 두 개의 헴미토레이스가 발생합니다.
- 한 번에 하나의 hemithorax를 가지고 DLM 근육 섬유 F(도 1B)에서 과잉 조직을 제거, 가장 복부 섬유. 블레이드를 사용하여 DlM을 손상시키지 않고 과도한 조직을 제거하기 위해 하나 또는 두 개의 컷을 조심스럽게 만듭니다.
- 일단 고립되면, 1x PBS로 올바른 튜브에 hemithorax를 전송합니다.
- 반복 단계 4.6\u20124.14 까지 10 해부 된 hemithoraces 는 그룹당 만들어집니다.
5. 구조적 염색
- 흉부 샘플을 양분 한 후, 조직을 차단 버퍼 (0.1 % 정상 염소 혈청1x PBS, pH 7.4에서 0.2 % 트리톤 X-100)에 조직을 배치하고 비 특이적 염색을 방지합니다. 파스퇴르 파이펫을 사용하여 초과 1x PBS를 제거하고 각 튜브에 1.5mL의 블로킹 버퍼를 추가합니다. 4°C에서 최소 1h의 조직을 차단합니다.
- 1:200 및 Phalloidin-647의 희석시 1:200 및 Phalloidin-647의 희석시, 각각 1:1000의 희석으로 형광공 항체, 고추냉이 과산화제(488)를 사용하여 구조적 염색을 위한 샘플을 준비하여 운동 신경 및 근육을 염색하는 버퍼를 차단한다. 튜브 당 150 μL을 가질 만큼 충분한 얼룩을 만듭니다. 얼룩이 얼룩될 때까지 호일로 덮여 있거나 어두운 상자에 얼룩을 보관하십시오.
- 차단 후 유리 파스퇴르 파이펫으로 과도한 차단 버퍼를 제거합니다.
- 구조적 얼룩을 분배하기 전에 얼룩을 피하십시오. 각 튜브에 얼룩 150 μL을 추가합니다. 샘플을 실온에서 회전기의 어두운 상자에 2 시간 동안 놓습니다.
- 얼룩을 제거하고 어두운 상자에 회전기에 5 분 동안 0.3 % 트리톤 X-100와 방 온도 1 x PBS의 1.5 mL에서 조직을 네 번 세척합니다. 이제 샘플이 슬라이드에 장착할 준비가 되었습니다.
6. 장착 조직
- PBST에서 샘플을 세척 한 후, 염색을위한 조직을 장착하기 위해 현미경 슬라이드를 준비합니다. 유리 커버 슬립, P200 파이펫, 200 μL 파이펫 팁, 가위, 클리어 보강재, 직선 가장자리 집게, 페이드 형광 장착 매체, 매니큐어 및 슬라이드를 덮는 어두운 상자를 포함한 추가 공급을 준비합니다.
- 슬라이드에 레이블을 지정하여 샘플을 식별하고 김스 와이프로 슬라이드를 청소하여 얼룩이 없는지 확인합니다.
- 헴토락 샘플이 커버 슬립에 의해 손상되지 않도록 하려면 보강 라벨을 사용하여 "브리지"를 구축하십시오. 보강 라벨 1개를 반으로 자르고 각 반쪽을 약 15mm 간격으로 놓습니다. 이 거리는 커버 슬립의 너비보다 작아야 합니다. 이 단계를 네 번 반복하여 5개의 레이블이 높은 "브리지"를 완료합니다.
- P200 파이펫을 가져 와서 팁의1/5를 잘라서 팁을 수정하여 샘플을 슬라이드로 옮길 수 있습니다. 샘플은 브리지 중앙의 슬라이드로 옮겨져야 합니다.
- 랩 의 가장자리를 닦아 초과 PBST를 제거합니다. 집게를 사용하여 모든 샘플이 근육 측면을 위로 향하고 큐티클 측면을 아래로 향하도록 DlM을 정렬합니다.
- 표준 P200 파이펫 팁을 사용하여 70 μL의 장착 미디어를 슬라이드에 적용하여 기포를 피하십시오. 외부에서 중앙으로 시작하여 보강대 내부의 원형 패턴으로 미디어를 분배합니다.
- 보강대 위에 덮개 미끄러짐을 놓습니다.
- 매니큐어를 사용하여 커버슬립 의 둘레 에지를 코팅합니다. 조직의 완전한 인감을 형성하기 위해 관대하게 발라주세요.
- 어두운 평평한 표면에 슬라이드를 놓고 10 분 이상 건조하고 사진 표백 또는 형광 손실을 방지 할 수 있습니다. 슬라이드는 이제 즉시 이미징에 사용되거나 나중에 볼 수 있도록 -20°C의 슬라이드 폴더에 저장할 수 있습니다.
7. 대안: 1 차적인 항체로 염색
참고: 이 섹션은 선택 사항이며 원하는 경우 섹션 4와 5 사이에 직접 사용해야 합니다.
- 1 차적인 항체를 가진 조직을 얼룩지게 하기 위하여는, 적어도 1 h를 위한 완충을 막는 조직에 잠급니다.
- 차단 버퍼에 적절한 희석으로 1 차 항체를 준비합니다. 최소한, 그룹당 150 μL을 가질 수 있는 충분한 항체 혼합물을 준비한다. 샘플은 여전히 유지됩니다. 사용할 준비가 될 때까지 4 °C에 보관하십시오.
- 파스퇴르 파이펫으로 과도한 차단 버퍼를 제거합니다. 1차 항체를 간략하게 소용돌이치며 각 군에 150 μL의 항체 혼합물을 추가하고 밤새 4°C에 샘플을 배치한다.
- 다음 날에는 1 차 적인 항체를 제거하고 회전기에서 각각 5 분 동안 PBST로 조직을 4 번 씻으시다.
- 블로킹 버퍼에서 보조 얼룩을 준비합니다. 이차 얼룩을 샘플에 추가한 다음 회전기의 어두운 상자에 2h의 실온을 유지합니다.
참고: 이차 염색에는 HRP 및 프할로이드인도 포함될 수 있습니다. - 2h 인큐베이션 후, PBST로 5분 동안 이차 얼룩 세척 조직을 4회 제거하고 장착을 진행한다.
결과
43 kDa 돌연변이체(TDP-43M337V)의인간 타르 결합 단백질을 발현하는 형질전환 파리의 생성은 회로도(도1A)로표현된다. 이것은 드로소필라27에서바이너리 Gal4/UAS 시스템의 적용을 보여줍니다. 일러스트는 6개의 근육 섬유를 가진 hemithorax, A\u2012F가 가장 큰 등쪽 섬유 A에서 가장 복부 F(그림 1B),11,12로가는 것을 묘사합니다. 시냅스 무결성을 평가하기 위해 NMJ는 HRP 및 Phalloidin(그림 1C\u2012E)으로염색되었습니다. TDP-43M337V 돌연변이체(도1F)의모터 뉴런은 21일까지 HRP 염색이 거의 또는 전혀 없으며 WT(오리건-R)는 그대로 유지됩니다(도1C). 근육 염색에 눈에 띄는 차이가 없습니다(그림 1D, G). TDP-43M337V 돌연변이체에서 관찰된 총 형태학의 변화는 성인 DLM 모델을 사용하여 근위축성 측삭 경화증(ALS)의 신경 퇴행성 질환 모델에서 시냅스 무결성이 어떻게 연루될 수 있는지를 보여줍니다. 구조 염색 외에도 DLM NMJ를 염색하면 사전 시냅틱(그림 2A\u2012R)및 사후 시냅틱(그림2Figure 2S\u2012X)마커를 사용하여 시냅스 무결성평가를 제공할 수 있다. 함께, 이러한 결과 어떻게 이 해부 프로토콜 신경 퇴행 성 질환에 DLM 조직을 공부에 적용 될 수 있습니다.
이 해분의 한 가지 주요 측면은 양단을 쉽게 하기 위해 조직을 동결플래시하는 액체 질소의 적용입니다. 액체 질소의 유용성은 WT에서 근육 조직이 손상이나 닉 섬유가없는 액체 질소로 비행(그림 3A\u2012C)에서입증됩니다. 액체 질소가 없으면 조직은 해부하기가 더 어려울 수 있습니다. 예를 들어, 이러한 프로토콜에 따라 액체 질소 플래시 동결 단계를 건너뛰면 손상된 뉴런(도3D)또는 손상된 근육섬유(도3E)와같은 해부 도구로부터 조직이 손상되기 쉽도록 할 수 있다. 액체 질소의 적용은 시편의 유전자형(도 3C 및 3F)에관계없이Figure 3DLM 조직과 함께 작업할 때 발생할 수 있는 조직 손상을 방지하는 데 도움이 된다.
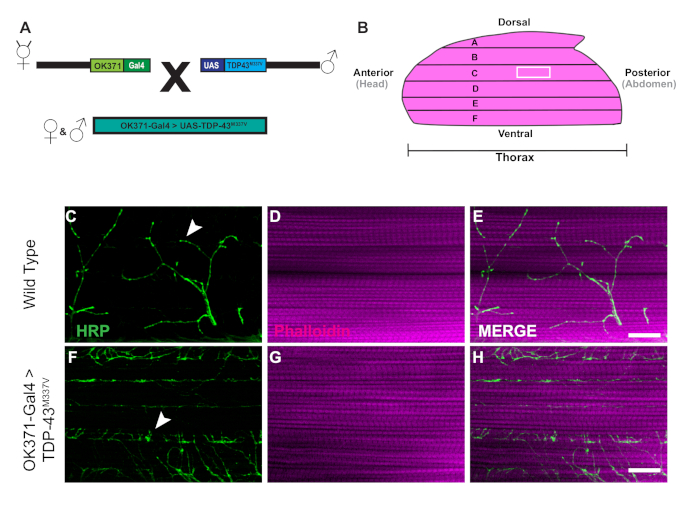
그림 1: ALS의 드로소필라 모델에서 DLM 시냅스의 점진적 인 기형. (A)43 kDa(TDP-43)의 인간 돌연변이 형태의 타르 결합 단백질을 발현하는 ALS 형질전환 파리의 생성이 회로도에 나타난다. (B)일러스트는 성인 드로소필라에서헴미톨락스의 모양과 방향을 묘사한다. 프로토콜을 사용하여, 우리는 HRP (녹색) 및 Phalloidin (마젠타)를 가진 근육 조직을 가진 모터 뉴런의 구조적인 얼룩을 통해 DLM NMJ 시냅스의 시냅스 무결성의 점진적인 손실을 관찰할 수 있습니다. 우리의 모델은 WT(그림1C\u2012E)근육 섬유 C에 비해 모터 뉴런에서 인간 TDP-43M337V의 돌연변이를 표현하는 성인 파리의 생성을 통해 ALS의 성인 모델에서 시냅스 무결성의 손실을 묘사한다. 화살표는 WT 시냅스(그림1C)의예와 시냅스 무결성 손실의 예를 강조합니다.F‒H 63배 배율에서 배율 막대 =20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
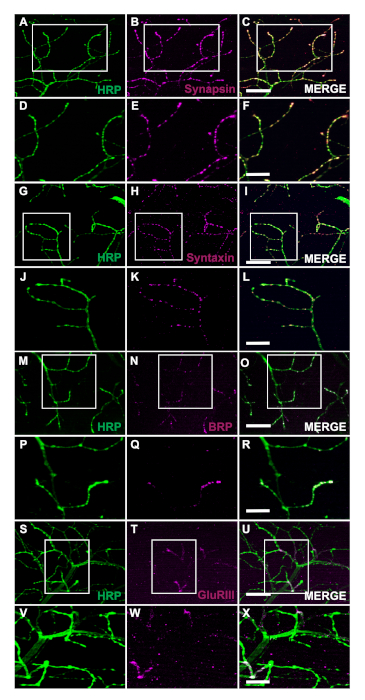
그림 2: 성인 NMJs에서 사전 시냅스 마커를 사용하여 시냅스 무결성 평가. 시냅스 무결성은 또한 근육 섬유 C에서 14 일 된 WT 파리의 사전 시냅틱 및 포스트 냅틱 마커를 사용하여 평가 될 수 있습니다. 사전 시냅스 마커 시냅신(B), 구문신(H), 브루치파일럿(BRP)(N)는HRP(A,A G, M)와공동 염색된다.BH 염색은 사전 시냅스단자(C, I, O)에이러한 마커의 국소화를 묘사한다. 더 높은 배율에서, 이미지는 보다 상세하게 시냅신(E), 구문신(K), 및 BRP(Q)의 국소화를 보다 자세하게 DQKE 설명한다(도F, L,및 R). 우리는 또한 HRP(S)와공동 염색 포스트 냅틱 마커 글루타민체 수용체 III (GluRIII)(T)를보여줍니다. 공동 염색은 이러한마커(U)의유용성을 입증한다. 더 높은 배율에서 대표적인 이미지는글루르III(W)및 HRP(V)의 국소화(X)를 각각 포스트내피근육 조직 및 사전 시냅스 단자로 예시한다.XV 패널 A\u2012C, G-I, M\u2012O, S\u2012U에 대한 스케일 바는 63배 배율에서 20 μm을 나타냅니다. 패널 D\u2012F, 2J-2L, 2P-2R 및 2V-2X용 스케일 바는 63배율에서 10μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
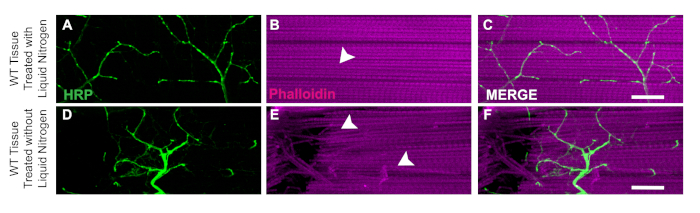
그림 3: DLM 해부용 액체 질소의 유용성. DLM 해부용 액체 질소의 유용성을 입증하기 위해, 우리는 근육 섬유 C에서 액체 질소의 유동질소유무에 관계없이 21WT 파리의 날을 비교하는 것을 보여준다. 액체 질소로, Phalloidin(B)는그대로 남아 있으며 HRP 염색(A, C)을손상시키지 않습니다. 액체 질소가 없으면 근육 조직이 끈적거려서이중분(E)및 HRP염색(D, F)이기술적 오류로 인해 손상됩니다. 백색 화살은 액체 질소(B)및 손상된 근육 조직(E)으로근육 손상이없는 영역을 보여줍니다. 스케일 바 = 63배 배율에서 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜에 설명된 방법을 사용하여, 우리는 DLM 조직의 해부에 대한 간단한 접근을 제공하고 성인 Drosophila의 구조적 염색 및 시냅스 마커를 통해 시냅스 무결성을 평가하기 위해 이것이 어떻게 적용될 수 있는지 보여줍니다. DLM 조직을 해부할 수 있도록 하는 프로토콜의 한 가지 중요한 단계는 액체 질소로 플래시 동결입니다. 이 단계없이, 조직은 덜 단단하고 도 3에서관찰된 대로 정확하게 절단하기 가 더 어렵다. 이 프로토콜은 이전 해부 방법을 기반으로 운동 뉴런과 근육조직(18,,19,20,,,21,,22,23)의23보존을 허용한다. 이 프로토콜의 한 가지 제한은 양단의 중간선을 줄일 때 흉부당 두 개의 깨끗한 준비를 얻기어려울 수 있다는 것입니다. 플라이당 하나 이상의 헴피토락을 보장하는 한 가지 방법은 흉부 의 한 쪽으로 의도적으로 잘라 내어 하나의 깨끗한 준비를 할 수 있습니다. 이 수정을 통해 블레이드 브레이커로 샘플을 정리하기 위해 절단에서 추가 과잉 조직을 제거해야 할 수도 있습니다. 이 기술에 새로운 사람들을 위해, 지속적인 연습으로, 양분의 정확도가 증가 할 것이다.
여기에 설명된 방법은 연구원이 수명 내내 언제든지 성인 DLM NMJ의 구조적 무결성을 쉽게 평가할 수 있게 합니다. 이 프로토콜의 주요 장점은 시냅스 마커를 사용하여 신경 퇴행성 질환 모델의 시냅스 무결성에 액세스 하는 기능. 이 응용 프로그램은 구조적 염색(그림 1C\u2012H)을통해 총 형태학의 변화를 시각화하는 데 도움이 될 수 있음을 보여줍니다. 또한 시냅틱 무결성은시냅신(28)을 포함하되 이에 국한되지 않는 사전 시냅스 마커의 염색으로 평가할 수있다(그림 2A\u2012F),Syntaxin29 (그림 2G\u2012L)및 BRP30(그림 2M\u2012R). 포스트냅스 근육 조직은 또한 조미료 수용체 III 하위 단위항체(31)를 사용하여 평가될 수있다(도 2S\u2012X),이 프로토콜의 유용성을 입증한다.
연구원은 또한 포괄적인 질병의 다양한와 관련 되 었던 시 냅 스의 구조적 무결성을 검사 하는 기능 데이터를 보완 하기 위해이 해부 방법을 활용할 수 있습니다. 이들 시냅스는 또한 전기생리학적 기록32,,33,,34 및 비행분석(10)을통한 기능적 분석을 허용한다. 이 프로토콜은 또한 많은 응용 프로그램 및 분석에 대한 조직에 대한 액세스의 용이성을 제공 할 수 있습니다. 향후 연구는 예를 들어 이 프로토콜을 사용하여시냅스 15,,16의밀도 및 수의 정량화를 통해 시냅스 변화를 정량화할 수 있다. 여기에 설명된 프로토콜은 특히 운동 뉴런의 시냅스 무결성을 검사하지만, 근육 세포 손실을 평가하기 위한 보완 프로토콜은 TUNEL 염색35를사용하여 이 해부로 수행될 수 있다. 신경 손실을 검사하기 위해 흉부 신경절36의 해부는 TUNEL 염색과 함께 사용될 수 있습니다. 우리는 여기에서 기술된 해부는 신경 퇴행성 질병뿐만 아니라 나이 관련 병리를 평가하는 미래 연구 결과에 더 많은 응용프로그램이 있을 것이라는 점을 기대합니다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
이 작품은 D.T.B에 건강의 국가 학회 (R01 NS110727)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 32% Formaldehyde | Electron Microscopy Sciences | 15714 | Tissue preservation |
| Alexa Fluor 568 goat anti mouse | Fisher Scientific | A11031 | Labels primary antibodies. Used at 1:200 concentration. |
| Alexa Fluor 568 goat anti rabbit | Fisher Scientific | A11036 | Labels primary antibodies. Used at 1:200 concentration. |
| anti- Bruchpilot (BRP) antibody | Developmental Studies Hybridoma Bank | NC82 | Stains the active zones in presynaptic neurons. Used at 1:25 concentration. |
| anti-GluRIII antibody | Gift from Aaron DiAntonio | N/A | Labels glutamate receptor subunits. Used at 1:1000 concentration. |
| anti-Synapsin antibody | Developmental Studies Hybridoma Bank | 3C11 | Labels the synaptic protein synapsin. Used at 1:50 concentration. |
| anti-Syntaxin antibody | Developmental Studies Hybridoma Bank | 8C3 | labels the synaptic protein syntaxin. Used at 1:10 concentration. |
| BenchRocker | Genesee Scientific | 31-302 | Rotating samples during staining |
| Blade Breaker | Fine Science Tools | 10053-09 | Used for holding feather blade |
| cover slips | Fisher Scientific | 12548A | For mounting tissue |
| cryogenic gloves | VWR | 97008-198 | protect hands from liquid nitrogen |
| cryogenic tweezers | VWR | 82027-432 | Hold 2.0 mL tube in liquid nitrogen |
| dewar flask-1900 mL | Thomas Scientific | 5028M54 | Hold liquid nitrogen |
| Feather Blades | Electron Microscopy Sciences | 72002-01 | Scalpel Blades |
| Fine Forecps x 2 | Fine Science Tools | 11252-20 | One fine pair for Clearing midline of thorax. The other pair can be dulled using a sharpening stone. |
| FITC-conjugated anti HRP | Jackson Laboratories | 123-545-021 | Stains Motor Neurons. Used at 1:100 concentration |
| freezer box (Black) | Fisher Scientific | 14100F | Protects samples from light |
| glass pasteur pipettes | VWR | 14637-010 | Used to transfer samples |
| glass slides | Fisher Scientific | 12550143 | For mounting tissue |
| mounting media (vectashield) anti-fade | VWR | 101098-042 | Mounting media retains fluorescent signaling |
| nail polish | Electron Microscopy Sciences | 72180 | Seals microscope slides |
| normal goat serum | Fisher Scientific | PCN5000 | Prevents non-specific binding of antibodies |
| paint brush | Genesee Scientific | 59-204 | Transferring flies |
| PBS | Fisher Scientific | 10-010-023 | Saline solution for dissecting and staining |
| Phalloidin 647 | Abcam | AB176759 | Stains F-Actin in muscle Tissue. Used at 1:1000 concentration |
| plastic petri dish (100 mm) | VWR | 25373-100 | Dissection dish |
| reinforcement labels | W.B. Mason | AVE05722 | Provides support for glass coverslip over the mounted tissue |
| sharpening block | Grainger | 1RDF5 | Keeping fine forceps sharp and also dulling separate pair |
| slide folder | VWR | 10126-326 | Sample storage |
| standard office scissors | W.B. Mason | ACM40618 | Cutting reinforcement labels |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | Coating for dissection dish |
| Triton-X-100 | Electron Microscopy Sciences | 22140 | Helps to permeabilize tissue |
| Vannas Disssection Sissors | Fine Science Tools | 1500-00 | Ued for removing fly legs and making an incision on thorax |
참고문헌
- Casas, C., Manzano, R., Vaz, R., Osta, R., Brites, D. Synaptic failure: focus in an integrative view of ALS. Brain Plasticity. 1, 159-175 (2016).
- Lodato, M. A., et al. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 359, 555-559 (2018).
- López-Erauskin, J., et al. ALS/FTD-linked mutation in FUS suppresses intra-axonal protein synthesis and drives disease without nuclear loss-of-function of FUS. Neuron. 100, 816-830 (2018).
- Munsie, L., et al. Retromer-dependent neurotransmitter receptor trafficking to synapses is altered by the Parkinson's disease VPS35 mutation p. D620N. Human Molecular Genetics. 24, 1691-1703 (2015).
- Oddo, S., et al. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Aβ and synaptic dysfunction. Neuron. 39, 409-421 (2003).
- Selkoe, D. J. Alzheimer's disease is a synaptic failure. Science. 298, 789-791 (2002).
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Current Opinion in Neurobiology. 17, 35-42 (2007).
- Jan, L., Jan, Y. Properties of the larval neuromuscular junction in Drosophila melanogaster. The Journal of Physiology. 262, 189-214 (1976).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Babcock, D. T., Ganetzky, B. An improved method for accurate and rapid measurement of flight performance in Drosophila. Journal of Visualized Experiments. , e51223 (2014).
- Fernandes, J., Bate, M., Vijayraghavan, K. Development of the indirect flight muscles of Drosophila. Development. 113, 67-77 (1991).
- Fernandes, J., VijayRaghavan, K. The development of indirect flight muscle innervation in Drosophila melanogaster. Development. 118, 215-227 (1993).
- Fernandes, J. J., Keshishian, H. Patterning the dorsal longitudinal flight muscles (DLM) of Drosophila: insights from the ablation of larval scaffolds. Development. 122, 3755-3763 (1996).
- Fernandes, J. J., Keshishian, H. Nerve-muscle interactions during flight muscle development in Drosophila. Development. 125, 1769-1779 (1998).
- Hebbar, S., Fernandes, J. J. Pruning of motor neuron branches establishes the DLM innervation pattern in Drosophila. Journal of Neurobiology. 60, 499-516 (2004).
- Hebbar, S., Fernandes, J. J. A role for Fas II in the stabilization of motor neuron branches during pruning in Drosophila. Developmental Biolology. 285, 185-199 (2005).
- Danjo, R., Kawasaki, F., Ordway, R. W. A tripartite synapse model in Drosophila. PloS One. 6, (2011).
- Hunt, L. C., Demontis, F. Whole-mount immunostaining of Drosophila skeletal muscle. Nature Protocols. 8, 2496-2501 (2013).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of Visualized Experiments. , e2438 (2010).
- Llamusi, B., et al. BSF and TBPH are mislocalized in the muscle sarcomere of a Drosophila myotonic dystrophy model. Disease Models & Mechanisms. 6, 184-196 (2013).
- Pantoja, M., Fischer, K. A., Ieronimakis, N., Reyes, M., Ruohola-Baker, H. Genetic elevation of sphingosine 1-phosphate suppresses dystrophic muscle phenotypes in Drosophila. Development. 140, 136-146 (2013).
- Schnorrer, F., et al. Systematic genetic analysis of muscle morphogenesis and function in Drosophila. Nature. 464, 287-291 (2010).
- Viswanathan, M. C., Blice-Baum, A. C., Schmidt, W., Foster, D. B., Cammarato, A. Pseudo-acetylation of K326 and K328 of actin disrupts Drosophila melanogaster indirect flight muscle structure and performance. Frontiers in Physiology. 6, 116 (2015).
- Hebbar, S., Fernandes, J. J. Glial remodeling during metamorphosis influences the stabilization of motor neuron branches in Drosophila. Developmental Biology. 340, 344-354 (2010).
- Mahr, A., Aberle, H. The expression pattern of the Drosophila vesicular glutamate transporter: a marker protein for motoneurons and glutamatergic centers in the brain. Gene Expression Patterns. 6, 299-309 (2006).
- Ritson, G. P., et al. TDP-43 mediates degeneration in a novel Drosophila model of disease caused by mutations in VCP/p97. Journal of Neuroscience. 30, 7729-7739 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Klagges, B. R., et al. Invertebrate synapsins: a single gene codes for several isoforms in Drosophila. Journal of Neuroscience. 16, 3154-3165 (1996).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proceedings of the National Academy of Sciences of the United States of America. 79, 7929-7933 (1982).
- Wagh, D. A., et al. a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron. 49, 833-844 (2006).
- Marrus, S. B., DiAntonio, A. Preferential localization of glutamate receptors opposite sites of high presynaptic release. Current Biology. 14, 924-931 (2004).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological recordings from the giant fiber pathway of D. melanogaster. Journal of Visualized Experiments. , e2412 (2011).
- Maccioni, R., et al. Standardized phytotherapic extracts rescue anomalous locomotion and electrophysiological responses of TDP-43 Drosophila melanogaster model of ALS. Scientific Reports. 8, 16002 (2018).
- Siddiqi, O., Benzer, S. Neurophysiological defects in temperature-sensitive paralytic mutants of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 73, 3253-3257 (1976).
- Wang, Z. H., Clark, C., Geisbrecht, E. R. Drosophila clueless is involved in Parkin-dependent mitophagy by promoting VCP-mediated Marf degradation. Human Molecular Genetics. 25, 1946-1964 (2016).
- O'Sullivan, A., et al. Multifunctional Wing Motor Control of Song and Flight. Current Biology. 28, 2705-2717 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유