Method Article
로봇 미세 주입을 사용하여 뇌 조각의 단일 신경 줄기 세포 및 뉴런 조작
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 단일 신경 줄기 세포와 뇌 슬라이스의 뉴런으로 미세 주입을위한 로봇 플랫폼의 사용을 보여줍니다. 이 기술은 다재다능하며 높은 공간 해상도로 조직에서 세포를 추적하는 방법을 제공합니다.
초록
발달 신경생물학의 핵심 질문은 신경 줄기와 전구 세포가 뇌를 형성하는 방법입니다. 이 질문에 대답하기 위해, 하나는 라벨을 해야합니다, 조작, 시간이 지남에 따라 높은 해상도로 뇌 조직의 단일 세포를 따라. 이 작업은 뇌조직의 복잡성으로 인해 매우 어렵습니다. 우리는 최근에 단일 세포로 용액의 펨토리터 볼륨을 제공하기 위해 현미경에서 획득 한 이미지를 활용하여 뇌 조직에 미세 주입 바늘을 안내하는 로봇을 개발했습니다. 로봇 수술은 수동 미세 주입보다 크기가 큰 전체 수율을 증가시키고 살아있는 조직에서 단일 세포의 정확한 라벨링 및 유연한 조작을 가능하게합니다. 이를 통해 단일 organotypic 슬라이스 내에서 수백 개의 세포를 마이크로 주입할 수 있습니다. 이 문서는 뇌 조직 조각에 신경 전구 세포와 뉴런의 자동화 된 미세 주입에 대 한 미세 주입 로봇의 사용을 보여줍니다. 더 넓게, 그것은 파이펫에 의해 도달 할 수있는 표면을 특징으로하는 모든 상피 조직에 사용할 수 있습니다. 일단 설정되면, 마이크로 주입 로봇은 분당 15 개 이상의 미세 주입을 실행할 수 있습니다. 그 처리량과 사차성 때문에 미세 주입 로봇은 조직적인 두뇌 조각에 있는 단세포 분석을 수행하기 위한 생명 공학, 생명 공학 및 생물 물리학에 사용되는 광범위하게 간단한 고성능 세포 조작 기술을 만들 것입니다.
서문
이 프로토콜은 특히 단일 신경 줄기 세포 및 뉴런에 초점을 맞추고 뇌 조직 조각에서 단일 세포를 대상으로 조작하기 위해 로봇을 사용하는 것을 설명합니다. 로봇은 발달 신경생물학의 중심적인 질문을 해결하기 위하여 개발되었다, 즉 신경 줄기및 전구 세포가 뇌형태발생에기여하는 방법1,2,3,4,5. 이 질문에 대답하기 위하여는, 단 하나 신경 줄기 세포를 표지하고 추적하고 조직 morphogenesis와 단하나 세포 행동을 상관관계를 시간이 지남에 따라 그들의 계보 진행을 따라야 합니다. 이것은 다른 방법으로 달성될 수 있습니다, 예를 들어, 자궁에서 뇌 조직을 전포하거나 지방성 다이를 사용하여 단일 세포를 표시하여. 비록 강력하지만, 이러한 방법은 정확한 단일 세포 분해능(전기포기) 및/또는 세포내 공간(lipophilic 염료)을 조작할 가능성이 부족합니다. 단일 세포로의 미세 주입은 이 도전6,7,8을극복하기 위해 개발되었다. 미세 주입 하는 동안, 파이펫 은 시약의 펨토리터 볼륨을 마이크로 주입 하는 압력 하에 그대로 조직 내에서 단일 세포에 간단 하 게 삽입9. 앞서 조직조직에서 단일 신경줄기세포를 마이크로주입하기 위한 수동절차를 설명하였다(도1A)10,11. 신경 줄기 세포로의 미세 주입은 다른 관심 분자와 함께 형광 염료를 포함하는 용액을 주입하기 위해 단일 신경 줄기 세포에 삽입되는 마이크로 파이펫의 사용에 의존합니다. 신경 줄기 세포의 선택적 표적화는 심실 표면(또는 심실, 도 1A에서만화 참조)을 통해 개발 중인 텔뇌스팔론에 접근하여 달성되며, 이는 apical 전구체의 정혈혈막에 의해 형성된다(도 1A의만화). 이 과정은 실험자가 주입하고자 하는 각 세포에 대해 반복되어야 합니다. 또한, 미세 주입의 성공은 조직에서 마이크로 피펫 주입의 깊이와 지속 시간의 정밀한 제어에 의존한다. 따라서, 독특한 장점에도 불구하고, 수동 미세 분사는 매우 지루하고 합리적인 처리량과 수율에서 수행하기 위해 상당한 연습이 필요, 이 기술은 확장 가능한 방식으로 사용하기 어렵게 만들기. 이러한 한계를 극복하기 위해 최근에는 단일 세포로 마이크로 주입을 자동으로 수행할 수 있는 이미지 유도 로봇 인 자동 주입기12 (또는 미세 주입 로봇)를 개발했습니다.
미세 주입 로봇은 미세 주입을 위해 조직 내의 3D 공간에서 특정 위치를 정확하게 표적으로 하는 현미경 이미징 및 컴퓨터 비전 알고리즘을사용합니다(그림 1B). 미세 주입 로봇은 기존 미세 주입 설정을 비교적 간단하게 수정하여 생성할 수 있습니다. 미세 주입 로봇의 전체 회로도는 도 1C에표시됩니다. 파이펫은 3축 조작기에 부착된 파이펫 홀더에 장착됩니다. 현미경 카메라는 조직과 미세 주입 바늘의 이미지를 획득하는 데 사용됩니다. 사용자 지정 압력 조절 시스템은 파이펫 내부의 압력을 제어하는 데 사용되며 프로그래밍 가능한 마이크로 조작기는 마이크로인젝터 파이펫의 위치를 제어하는 데 사용됩니다. 조직 및 미세 주입 파이펫의 카메라 이미지는 미세 주입 파이펫 팁의 공간 위치와 미세 주입이 수행되어야하는 위치를 결정하는 데 사용됩니다. 그런 다음 소프트웨어는 조직 내에서 파이펫을 이동하는 데 필요한 궤적을 계산합니다. 모든 하드웨어는 이전에 개발한 소프트웨어에 의해 제어됩니다. 모든 소프트웨어는 코딩 언어(예: 파이썬 및 아두이노)로 작성되며 지침과 함께 https://github.com/bsbrl/Autoinjector 다운로드할 수 있습니다. 그래픽 사용자 인터페이스(GUI)를 통해 사용자는 조직과 마이크로피펫을 이미지화하고 미세 주입궤적을 사용자 지정할 수 있습니다. 우리의 시스템은 밝은 필드와 에피 형광 필터가 장착 된 반전 된 현미경에 상대적으로 간단한 수정을 사용하여 설립 될 수있다.
첫째, 우리는 미세 주입을위한 뇌 조직 조각을 준비하는 방법에 대한 지침을 제공합니다. 그런 다음 프로토콜은 미세 주입 전에 수행해야 하는 파이펫 모션 교정과 같은 예비 단계 뒤에 미세 주입 로봇을 시작하는 것을 보여줍니다. 그 다음에는 사출 매개 변수를 정의합니다. 그 후, 사용자는 미세 주입 로봇에 의해 사용되는 궤적을 정의하고 사출 절차를 시작할 수 있다. 미세 주입 조직(이 경우 뇌 조직 조각)은 실험 설계10,11에따라 상이한 기간 동안 배양에 보관될 수 있다. 조직은 주입된 세포및 그들의 자손의 정체성 그리고 운명을 따르고 연구하기 위하여 처리될 수 있습니다. 대안적으로, 마이크로인 주사 세포는 살아있는 화상 진찰을 사용하여 따를 수 있습니다. 이 프로토콜의 범위 내에서, 우리는 마우스 E14.5 등쪽 텔뇌스팔론의 조직화 조각에서 자동으로 미세 주입 신경 전구 세포를 로봇의 사용을 보여줍니다. 로봇은 마우스 텔뇌스팔론뿐만 아니라 인간 태아 텔렌스팔론(12)에서 신생아 뉴런으로 미세주입할 수 있다.
요약하면, 우리는 조직에서 단일 세포를 따르고 조작하는 데 사용할 수있는 로봇 플랫폼을 설명합니다. 플랫폼은 압력을 사용 하 고, 따라서, 주입 하는 화합물의 화학 적 특성에 관해서는 매우 다재 다능. 또한, 줄기 세포 이외의 표적 세포에 적응할 수 있다. 우리는 우리의 시스템이 다른 모델 시스템에 쉽게 적응할 수 있기를 기대합니다.
프로토콜
모든 동물 연구는 독일 동물 복지 법규에 따라 수행되었으며, 필요한 허가는 독일 드레스덴의 동물 실험을위한 지역 윤리위원회 (Tierversuchskommission, Landesdirektion 드레스덴)에서 획득되었습니다. Organotypic 슬라이스는 E14.5 또는 E16.5 C57BL/6 마우스 배아 텔렌스팔론(Janvier Labs)에서 제조되었다.
1. 소프트웨어 설치
- https://github.com/bsbrl/Autoinjector 소프트웨어를 설치하려면 지침을 따르십시오.
2. 시약 및 파이펫 준비
- 아가로즈: 각각 200mL 유리병에 각각 200mL 의 세포 배양급 PBS100mL에서 넓은 범위 아가로즈 3g과 3g저융점 아가로즈를 별도로 용해시켜 3% 아가로즈를 준비한다. 실온에서 최대 3개월 동안 보관하십시오.
- 티로데 솔루션: 중탄산나트륨1g과 티로데의 소금(전체 병의 함량 사용) 13mL의 1M HEPES를 증류수 1L에 녹입니다. pH를 7.4로 조정합니다. 0.2 μm 병 상단 필터를 통해 용액을 필터링합니다.
- 슬라이스 배양 배지 (SCM): 쥐 혈청 10mL, 2mM 글루타민 1mL, 1mL 페니실린-스트렙토마이신(100x), N-2 보충제 1mL(100x), B27 보충제 2mL(50x), HEPES(PH 7.3) 중형1mL을 첨가한다. 15mL 튜브에 SCM의 알리 쿼트 5 mL. -20 °C에 보관하십시오.
- CO2-독립미세 주입 매체(CIMM): 증류수 200mL에서 분말을 용해시킴으로써 5배 DMEM 변형 저혈당 용액(페놀 레드 제외)을 준비한다. 0.2 μm 병 상단 필터를 통해 용액을 필터링합니다(DMEM 분말의 경우 전체 병의 함량을 사용). CIMM 100mL를 준비하려면 5배 DMEM 수정용액 20mL, HEPES 버퍼 1mL, N2 보충제 1mL(100x), B27 보충제 2mL(50x), 페니실린-스트렙토마이신 1mL(100x), 2m+1mL, 2m+1mL, 2m+1mL를 혼합한다. 용액을 4°C로 저장합니다.
- 재구성 버퍼: 262mM NaHCO3,0.05 N NaOH, 증류수 200m HEPES를 용해하여 재구성 버퍼를 준비합니다. 병 상단 0.22 μm 필터 시스템을 통해 여과하여 용액을 멸균 유리 병에 멸균하십시오. Aliquot 500 μL 재구성 버퍼를 밀폐 된 미세 원심 분리 튜브로 합니다. 4 °C에 보관하십시오.
- 미세 주입 염료 스톡: RNase 무료 증류수(최종 농도 10 μg/μL)에서 형광으로 표시된 Dextran을 용해하십시오. 5 μL 알리쿼트를 준비하고 사용할 때까지 -20 °C에 보관하십시오.
- 마이크로 피펫 풀러를 사용하여 보로실리케이트 유리 모세혈관(외경 1.2mm, 내부 직경 0.94mm)에서 미세 주입 파이펫을 당깁니다. 피펫을 먼지로부터 보호합니다. 파이펫을 2 - 3 일 이상 보관하지 마십시오. 이 실험의 경우, 당기는 매개 변수는 HEAT: 램프 온도 +1 – 5; 풀: 100; 벨: 110; 델: 100. HEAT 및 VEL은 파이펫의 가장 모양과 크기에 영향을 주는 매개 변수입니다.
참고: 최적의 미세 주입 파이펫은 미세 주입 중 세포 손상을 피하기 위해 길고 유연한 팁을 가지고 있습니다.
3. 티슈 슬라이스 준비
- 뇌 조직 해부 전에 전자 레인지를 사용하여 3 % 넓은 범위의 아가로즈를 녹입니다. 아가로즈를 포함하기 전에 37°C에서 수조에 보관하여 고성화시키지 마십시오. 파이펫이 먼지로부터 보호되는지 확인합니다. 파이펫을 2 - 3 일 이상 보관하지 마십시오.
- SCM의 알리쿼트와 따뜻한 10 ~12mL CIMM 및 20mL의 티로드 용액을 수조를 사용하여 37°C로 해동한다.
- 형광 추적기(Dextran-3000 또는 Dextran-10000-알렉사 컨쥬게이트; 최종 농도 5 – 10 μg/μL)를 다른 화학 물질과 혼합하여 주입한다. 4°C에서 30분 동안 16, 000 x g의 미세 주입 용액원심분리. 상체를 수집하고 새로운 튜브로 전송합니다. 사용 전까지 미세 주입 용액을 얼음에 보관하십시오.
- E13.5 – E16.5 마우스 배아의 머리를 사용하여 텔렌세팔론의 조직 조각을 준비하십시오. 피부를 제거하고 포셉을 사용하여 두개골을 열고 중간선을 따라 움직입니다. 열린 두개골에서 배아 뇌를 해부하고 뇌의 복부 측면에서 시작하는 뇌 조직을 덮는 수막을 제거합니다. 37°C 가열 블록에 Tyrode의 용액에 해부된 전체 뇌를 남겨주세요.
참고: 3.4에 설명된 모든 해부 단계는 미리 따뜻해진 Tyrode의 솔루션에서 수행해야 합니다. - 용융 된 아가로즈를 일회용 포함 금형에 붓습니다. 아가로즈가 38 ~39°C로 냉각되면, 파저 파이펫을 사용하여 뇌(최대 4개)를 조심스럽게 이송한다. 이 단계에 는 항상 잘라내기 팁을 사용하십시오.
- 주걱이나 두몬트 #1 집게를 사용하여 조직을 중심으로 아가로즈를 저어줍니다. 실온에서 아가로즈를 고성화시키십시오. 아가로즈가 고화되면 조직을 둘러싼 과잉 아가로즈를 다듬습니다.
- 버퍼 트레이를 PBS로 채웁니다. 트레이에 수직인 조직의 로스트로-코달 축으로 뇌를 방향을 지정합니다(후각 전구의 랜드마크로 사용되어 뇌의 가장 많은 부분을 나타냅니다). 진동을 사용하여 250 μm 슬라이스를 잘라냅니다.
- 3.5cm 페트리 접시에 미리 조립된 미디어 2mL로 채웁니다. 플라스틱 파스퇴르 파이펫을 사용하여 슬라이스(10-15)를 이 요리로 옮습니다. 작업이 완료되면 Petri 접시를 슬라이스와 함께 슬라이스 배양 인큐베이터로 전환합니다. 사용 전까지 40% O 2/5% CO2/55% N2를 함유한 가습대기에서 37°C에서 슬라이스를 유지한다.
4. 미세 주입
- 컴퓨터, 현미경, 현미경 카메라, 조작기, 압력 장비 및 압력 센서를 켭니다. GitHub에서 다운로드한 기본 폴더에서"launchapp.py"라는파일을 클릭하여 응용 프로그램을 로드하고 팝업 화면에서 장치 설정을 지정합니다(설치 지침은 1.1단계 참조).
- 파이펫을 솔루션에 잠기전에 원치 않는 막힘을 방지하기 위해 바깥쪽 압력을 만듭니다. 파이펫에 압력을 가하려면 보상 압력 막대를 24 ~45%로 밀어 놓은 값을 클릭합니다. 다음으로, 압력 센서에 표시된 대로 기계적 압력 밸브 노브를 1 - 2 PSI (69 - 138 mbar)로 전환하여 충분한 압력으로 압력을 조정합니다.
- 미리 데워진 CIMM 2mL가 포함된 3.5cm 페트리 접시에 슬라이스를 옮기습니다. 조각을 페트리 접시 의 중앙에 마이크로 주입하도록 놓습니다. 페트리 접시를 예열된(37°C) 미세 분사 단계로 옮는다.
- 마이크로 주입 용액의 1.4 -1.6 μL (3.3 단계에서)로 긴 팁 플라스틱 파이펫을 사용하여 마이크로 주입 파이펫을 적재합니다. 피펫 홀더에 마이크로 주입 파이펫을 삽입합니다.
- 현미경에 가장 낮은 배율을 사용하여 슬라이스를 초점으로 가져와 마이크로 파이프를 이 시야(FOV)로 안내하여 슬라이스 대상과 동일한 평면에 초점을 맞춥니다. 현미경의 출력을 카메라로 전환하여 응용 프로그램에서 FOV를 확인합니다.
- 인터페이스 왼쪽 상단의 배율 버튼을 클릭하여 장치 교정을 시작합니다. 창은 배율을 선택하라는 메시지가 표시됩니다. 렌즈가 설정된 배율 10배율 또는 배율을 선택하고(예: 4배, 10배, 20배, 40x)를 누르고 확인을누릅니다. 이 소프트웨어는 내부 목표 렌즈가 10배(가장 일반적인 객관적인 렌즈 배율)라고 가정합니다.
- 현미경의 미세 측정 휠을 사용하여 파이펫 팁을 다시 초점을 맞추고 커서로 파이펫 팁을 클릭합니다. 다음으로, 1.1 단계 버튼을 누르고 팝업 창에서 확인을 누릅니다. 파이펫은 Y 방향으로 이동합니다. 파이펫 끝을 클릭하고 1.2 단계 버튼을 누릅니다. 마지막으로 파이펫 앵글 박스에 45를 입력하고 설정 각도를누릅니다.
- 자동 미세 주입 제어 판넬에 원하는 매개 변수를 입력합니다. 정량적 선조로 미세 주입을 위해 사출 거리를 20 - 40 μm및 깊이를 10 - 15 μm로 설정합니다. 뉴런내의 경우 기저측에서 30~40μm의 사출 거리를 설정하고, 대상에 따라 깊이를 10~30 μm로 설정한다. 항상 속도를 100 %로 설정합니다. 설정 값을 클릭합니다.
참고: 접근 거리는 파이펫이 다음 사출 거리로 이동하기 전에 조직에서 끌어내는 거리이며, 깊이는 미세 주입이 가는 조직내 깊이이며, 간격은 순차적 주사 사이의 선을 따라 거리이며, 속도는 μm/s의 파이펫 속도이다. - 그리기 가장자리 버튼을 클릭하고 팝업 창에서 원하는 궤적을 따라 커서를 드래그하여 주입 궤적을 정의합니다. 미세 주입 전구 줄기 세포를 위해, 텔뇌팔론 표면의 복부 면은 도 2A에도시된 바와 같이 표적화된다. 파이펫을 선의 시작 부분에 가져오고 파이펫 끝을 클릭합니다. 궤적을 클릭하여 마이크로 주입을 시작합니다. 대상 주입의 모든 평면에 대 한이 단계를 반복 (일반적으로 에 대 한 수행 3 – 4 비행기 와 4 0 – 75 비행기 당 주사).
5. 면역형광을 위한 조직 배양 및 조직 슬라이스 처리
- 콜라겐 혼합물(1.5 mg/mL)을 준비: 튜브에 매트릭스 용액의 1.25mL, 증류수 0.5mL, 5배 DMEM-F12 용액0.5mL 및 0.25 mL의 재구성 버퍼를 추가한다. 사용할 때까지 얼음위에 보관하십시오.
- 슬라이스 배양 배양 챔버에서 마이크로 주입 된 조각을 포함하는 페트리 접시를 얻고 콜라겐 혼합물에 조각을 담그다.
- 콜라겐 혼합물 200 ~300 μL과 함께 슬라이스를 35mm 유리 바닥 접시의 14mm 웰로 옮킨다. 슬라이스가 매우 적은 콜라겐으로 덮여 있는지 확인합니다. 이 설정은 영양소와 산소 섭취에 대한 최적의 조건을 허용합니다.
- 두 쌍의 집게를 사용하여 슬라이스 사이에 충분한 공간이 있는지 확인하면서 슬라이스를 방향을 지정합니다. 페트리 접시를 37°C에서 5분 동안 배양하여 가열 블록을 사용하여 콜라겐이 고화되도록 합니다. 이번에는 슬라이스 배양의 t = 0으로 고려하십시오.
- 페트리 접시를 슬라이스 배양 인큐베이터로 다시 이동하여 40분 간 추가로 이동합니다. 그런 다음 미리 따뜻해지는 SCM의 2mL를 추가합니다. 슬라이스는 원하는 시점까지 배양에 보관됩니다.
- 슬라이스 배양 배양기에서 슬라이스를 꺼내 SCM을 흡인합니다. 콜라겐 에베디드 슬라이스를 1x PBS로 세척합니다. 4% (wt/vol) 파라포름알데히드(120mM 인산염 완충제, pH 7.4)를 넣고 30분 동안 RT에서 조직을 둡니다. 그런 다음 4 °C로 이동하여 하룻밤 고정을 허용합니다.
- 다음 날 파라포름알데히드 솔루션을 흡인하고 1배 의 PBS 세차스를 수행합니다. 콜라겐에서 슬라이스를 제거하려면 두 쌍의 집게를 사용하여 스테레오 현미경으로 조각을 부드럽게 추출합니다.
- 마이크로 웨이브를 사용하여 마이크로 주입 된 조각을 처리하기 위해 3 % (wt / vol) 낮은 융점 아가로즈를 녹입니다. 용융 된 아가로즈를 일회용 포함 금형에 붓고 약 38 - 39 ° C로 식힙니다.
- 5.7 단계에서 플라스틱 파스퇴르 파이펫을 사용하여 낮은 녹는 아가로즈를 함유한 이 몰드로 티슈 슬라이스를 전달합니다. 슬라이스의 피알 면이 위로 올라가고 심실 표면이 아래로 향하도록 합니다. 필요한 경우 그에 따라 지향. 아가로즈를 RT로 식히고 굳어지게 하십시오.
- 슬라이스를 둘러싼 여분의 아가로즈를 다듬습니다. 아가로즈 블록을 오리엔팅하여 절단 표면이 진동의 절단 블레이드와 평행하도록 합니다. 진동을 사용하여 50 μm 두께의 단면을 잘라냅니다.
- 1x PBS로 24개의 웰 디쉬를 채웁니다. 미세 한 팁 페인트 브러시를 사용하여이 접시에 섹션을 전송합니다. 표준 프로토콜에 따라 면역 형광을 수행합니다.
결과
미세 주입은 살아있는 조직에서 단일 신경 줄기 세포와 자손을 추적하고 조작하고 생리 적 환경에서 의 혈통 진행을 따르는 목적을 제공합니다. 이 문서에서는 마우스 텔레세팔론의 조직화 조각을 대상으로 미세 주입 로봇의 사용을 입증했습니다. 도 2는 성공적으로 주입된 전구 세포의 대표적인 이미지를 나타내며 도 3은 주입된 신생아 뉴런을 도시한다. Dextran Alexa-488 (또는 Alexa-A555) 염료를 주입하면 세포가 완전히 염료로 채워진 것처럼 보입니다. apical 전구체(도 2)공초점 화상 진찰은 높은 공간 해상도로 세포 형태, 정점 및 기저 부착의 존재 -또는 부재-및 형태학적 문의를 마커 발현과 결합할 수 있게 한다. 이러한 기준을 결합함으로써, 사용자는 마이크로 주입 된 세포와 그들의 자손에 특정 세포 운명을 할당 할 수 있습니다. 신경 주입에 관해서는, 사용자는 형태 형점원지및 축축의 구조 및 특징을 포함하여 신경 형태를 재구성할 수 있다. 자동 미세 주입은 수동 미세 주입(도 2B)에비해 상당히 높은 처리량을 제공 할 수 있습니다. 또한, EdU 라벨링은 세포 생존능력이 자동화(그림2C)에의해 영향을 받지 않는다는 것을 확인한다. 배양에서 organotypic 슬라이스를 유지하면 미세 주입 된 세포의 계보 진행을 가능하게합니다 (도 2D에서4 - 24h를 보여 주어). 미세 주입 용액에 유전 물질 (DNA, mRNA, CRISPR-Cas9 가이드) 또는 재조합 단백질이 포함되어 있는 경우, 이것은 혈통 진행이 조작에 의해 영향을 받는지 그리고 방법을 연구할 수 있습니다.
조직에서 단일 신경 줄기 세포로 의 미세 주입은 우수한 단일 세포 해상도를 제공하고 그 이유로 신경 줄기 세포 진행 및 운명 전환의 세포 생물학을 해부하는 데 사용되었습니다(도 3A). 미세 주입은 화학 물질의 복잡한 혼합물의 전달을 허용합니다. 우리는 이전에 갭 접합 불투과성형광염(12)과갭 접합 투과성 혼합하여 신경 전조 세포에서 접합 결합을 연구하기 위해이 기능을 사용했다. 우리는 신생아 뉴런에서 접합 커플링을 연구하여 이전 작업을 확장, Dextran-A555와 함께 루시퍼 옐로우를 주입하여(그림 3B). 도 3B에도시된 바와 같이, 신생아 피라미드 뉴런의 비율은 인접한 뉴런에 갭 접합을 통해 결합된다. 이 관찰은 미숙한 뉴런이 갭-접합13,14를통해 통신한다는생각과일치한다. 더욱이, 표적뉴런은 미세주입 로봇의 사용이 발달하는 포유류 뇌의 여러 세포 유형으로 일반화될 수 있음을 보여준다. 이 실험적인 설치는 단백질 단백질 상호 작용을 방해하기 위하여 특정 올리고펩티드를 전달해서, 예를 들면 조직에 있는 신경세포의 세포 생물학을 해부하는 것이 유용할 것입니다.
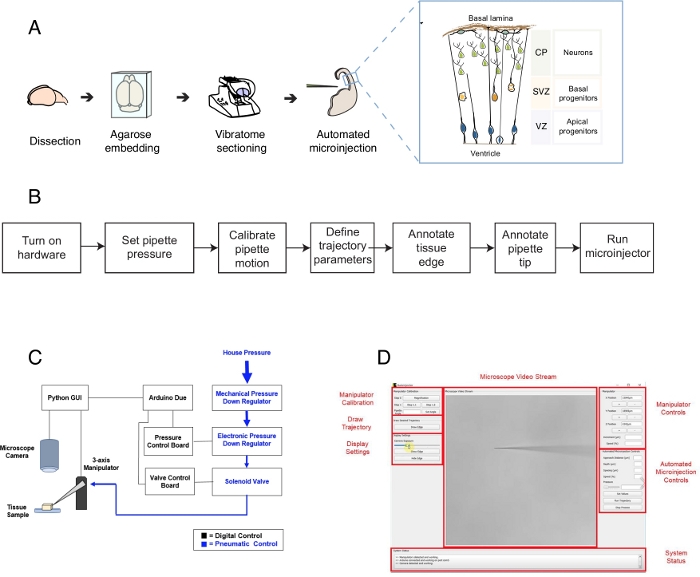
그림 1: 자동화된 미세 주입 설정 및 프로토콜. (A)미세 주입 로봇을 이용한 조직 제제 및 자동화된 미세 주입을 위한 전반적인 프로토콜. 오른쪽 삽입: 이 프로토콜에서 미세 주입을 목표로 하는 마우스 텔렌스팔론의 만화 회로도. (B)자동 미세 주입 단계의 흐름차트. (C)미세 주입 로봇 하드웨어의 회로도. (D)마이크로주입 로봇을 제어하고 작동하는 데 사용되는 소프트웨어의 그래픽 사용자 인터페이스(GUI). 이 그림은 심판12에서적용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
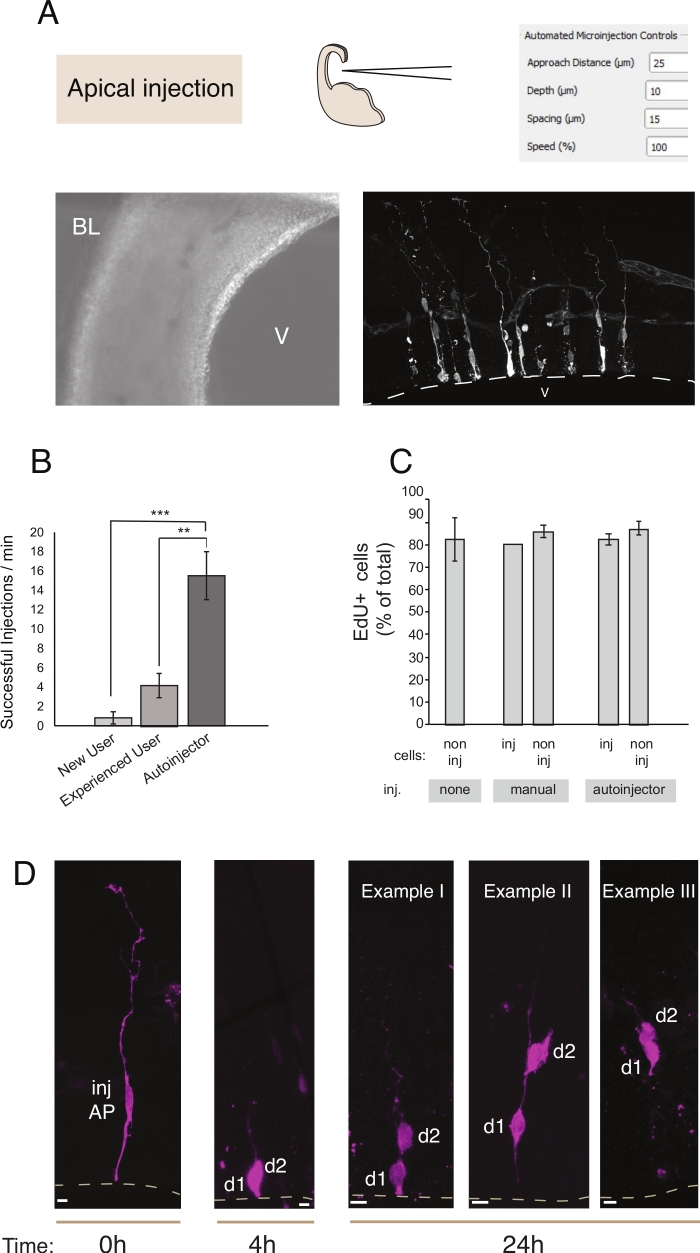
그림 2: 프로비틱 선조로 의 로봇 미세 주입. 공면(apical 주입)을 통해 apical 전구체(AP)를 표적으로 하는 미세 주입 로봇을 사용할 때 회로도 및 예상 된 결과. (A)맨 위 행. 왼쪽: 프로세스의 회로도. 오른쪽: 표준 주입에 대한 관련 매개 변수가 있는 GUI. 맨 아래 행입니다. 왼쪽: 사출 시술 중에 촬영한 상 대비 이미지(V: 심실; BL: 기저 라미나). 오른쪽: 마이크로 주입 된 AP를 보여주는 대표적인 결과. 대선은 심실(V)을 나타냅니다. 스케일 바: 10 μm.(B)수동 미세 주입 시스템에 초보자 사용자를위한 분당 성공적인 주사, 수동 미세 주입 시스템에 경험이 풍부한 사용자, 및 미세 주입 로봇. (C)EdU는 마이크로 주입 된 세포와 주입 된 영역에서 비 주입 된 세포에 통합한다. 마우스 E14.5 도르살 텔뇌팔론의 Organotypic 슬라이스는 (i) 주입되지 않았거나 (ii) Dextran-A488 (수동 및 자동 인젝터용)을 사용하여 수동 또는 자동화 된 미세 분사 (주입 된 슬라이스)를 받았다. 슬라이스는 24 시간 동안 EdU의 존재에 문화에서 보관된 다음 DAPI 및 EdU에 고정되고 얼룩졌습니다. 주입된 부위에 주입및 비주입된 세포는 EdU 양성을 위해 득점하였다. (D)미세 주입 로봇 리니지 추적의 사용. 형광염(Dx3-A555, 마젠타)은 단일 신경 줄기 세포(t= 0h)로 주입된다. 형광염은 미토시스 동안 딸 세포(d1, d2)로 분할된다. 이를 통해 주입된 셀(t = 4h 및 24h)의 자손에 따라 시간이 지남에 따라 계보 진행을 드러냅니다. t = 24 h의 경우, 우리는 자손의 몇 가지 예를 보여줍니다 찾을 것으로 예상. 스케일 바: 10 μm. B와 C의 그래프는 참조에서 가져온 것입니다.12이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
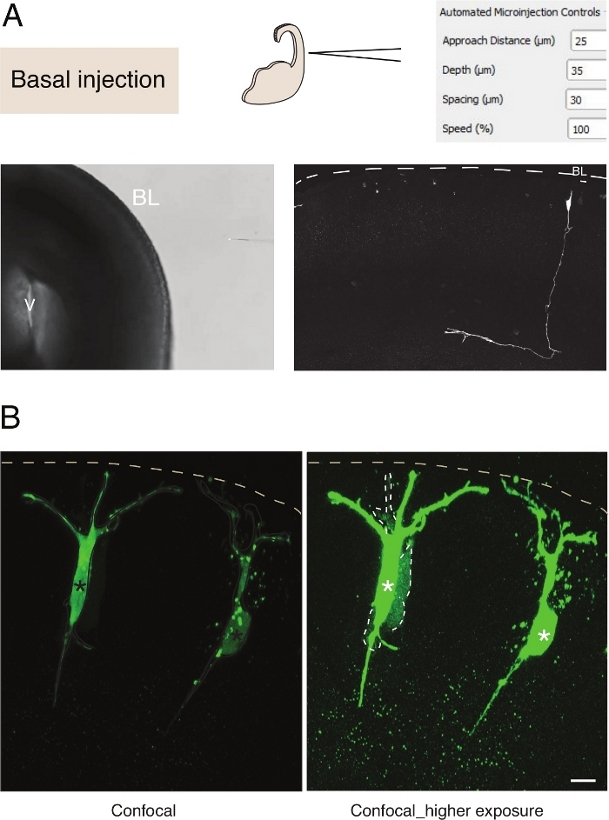
그림 3: 뉴런에 로봇 미세 주입. 기저 표면(기저 주입)을 통해 피라미드 뉴런(N)을 표적으로 삼기 위해 미세 주입 로봇을 사용할 때 회로도 및 예상 된 결과. (A)맨 위 행. 왼쪽: 프로세스의 회로도. 오른쪽: 기초 주입에 대 한 관련 매개 변수와 GUI. 맨 아래 행입니다. 왼쪽: 사출 시술 중에 촬영한 상 대비 이미지(V: 심실; BL: 기저 라미나). 오른쪽: 마이크로인주사 N. 대시 라인을 나타내는 대표적인 결과는 기저 라미나(BL)를 나타낸다. 스케일 바: 10 μm.(b)조직에서 갭 접합 통신을 연구하기 위해 자동 인젝터의 사용. 피라미드 뉴런은 두 개의 염료를 포함하는 용액을 주입했다: 갭 접합 불투과성 Dx-A555 (표시되지 않음) 및 갭 접합 루시퍼 옐로우 (녹색). Dx-A555는 표적 셀(별표)에 국한되어 있으며, LY는 표적 셀(dashed lines)에 갭 접합을 통해 연결된 셀로 확산된다. 왼쪽 패널: 노출이 낮고 마이크로 주입된 세포만 보입니다. 오른쪽 패널: 높은 노출은 주입된 세포뿐만 아니라 결합된 세포(파선)의 시각화를 허용합니다. 스케일 바: 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일: 미세 주입 중에 발생하는 몇 가지 일반적인 오류를 해결하는 문제. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
조직에서 단일 신경 줄기 세포로의 미세 주입은 우수한 단일 세포 분해능을 제공하며 그 이유로 신경 줄기 세포 진행 및 운명 전환의 세포 생물학을 해부하는 데 사용되었습니다(도 2;도 2 ; 참조도 10,11,12). 자동화된 미세 주입 절차는 배아 마우스와 인간 두뇌 조직 둘 다에 있는 세포의 그밖 모형에 수행될 수 있습니다. 텔뇌스팔론의 기저 표면을 표적으로 하여 신생아 뉴런의 미세 주입의 대표적인 결과는 도 3에도시된다.
여기에 확립 된 원리는 배아 마우스 뇌와 인간의 두뇌에 있는 몇몇 다른 세포 모형을 표적으로 하기 위하여 적용될 수 있습니다. 우리는 이전에 마이크로 주입 로봇이 마우스 뒤이어뇌 및 텔뇌스팔론 및 인간 개발neocortex(12)에서마우스 뒤뇌 및 텔뇌스팔론 및 신생아 뉴런의 단일 전구 세포를 표적으로 하는 데 사용될 수 있음을 보여주었다. 주사 절차의 최상의 결과를 얻으려면 주사를 시작하기 전에 모든 단계를 최적화해야합니다. 뇌조직(그림 1)으로부터실행 가능하고 잘 보존된 조직 조각의 제조를 신중하게 고려하고 최적화하는 것이 중요하다. 도 1에도시된 해부 및 슬라이스 절차에서 빠르게 하는 것이 중요합니다. AP를 대상으로 하는 정형 사출의 경우, 하나는 정립 표면의 이상적인 방향을 보여주는 조각을 선택해야 합니다. AP 주입의 경우 이상적인 방향은 페트리 접시 의 바닥에 수직인 어포형 표면입니다. 다른 방향은 또한 허용 될 것 이다, 그러나, 페트리 접시에 수직 적당 한 표면 주입에 대 한 넓은 표면 적을 제공, 따라서 주입의 성공을 증가. 뉴런에 주입하기 위해 슬라이스의 방향은 거의 또는 전혀 효과가 없습니다.
주입할 슬라이스를 선택하면 슬라이스당 사출 시술이 약 5분 정도 걸립니다. 하나는 살아있는 조직과 함께 작동 고려, 그것은 매우 주사 절차를 가속화 하는 것이 좋습니다. 이를 위해 조직이 준비되기 전에GUI(도 1D)를통해 주입을 위한 모든 매개 변수를 설정하여 불필요한 대기 시간을 줄이는 것이 좋습니다. 문제 해결의 경우 보충 파일을 참조하십시오.
장기 슬라이스 배양의 경우, 자동화된 미세 주입 절차 후단계는 세포의 건강에 영향을 미치고 실험에 영향을 줄 수 있다. 따라서 품질 관리 테스트를 실행하고 슬라이스 배양 조건을 최적화하는 것이 좋습니다. 슬라이스 및 주입 시술 후 세포 생존가능성을 평가하기 위해 배양 시 EdU 라벨링을 수행하고 배양에서 피노트 핵(세포 세포에 대한 프록시)의 수를 정량화하고조직(12)을주입하였다. 이러한 정량화는 조직 생존가능성에 대한 미세주입의 유의한 영향을 밝히지않았다(도 2C). 실험실에서 조직 슬라이스 및 미세 주입 파이프라인을 설정하면서 유사한 품질 관리를 실행하는 것이 좋습니다.
수동 미세 주입에 비해, 미세 주입 로봇은 몇 가지 장점을 제공합니다. 첫째, 사용자에 대한 학습 곡선은 수동 주입에 비해 덜 가파르다 : 새로운 사용자는 세션의 제한된 수 후 높은 숙련도에 도달합니다, 일반적으로 1 또는 2. 둘째, 수동 미세 주입의 경우, 비교 능력훈련의 달이 필요합니다. 사출 절차는 빠르고 효율적입니다(그림 2B). 우리는 이러한 매개 변수를 정량화하고 마이크로 주입 로봇이 주입 성공 (성공적인 주사 / 총 주사 수의 %)에 대하여 숙련 된 수동 사용자를 능가하고 단위 시간 당 주사의 총 수12에발견했다. 이로 인해 숙련된 사용자에 비해 미세 주입 로봇에 대한 사출 효율(성공적인 주사/분의 %)이 전체적으로 300% 증가합니다. 미세 주입 로봇을 초보자 사용자와 비교할 때 효율성이 더욱 높아졌고 700%에 도달했습니다. 마지막으로, 미세 주입 로봇은 모든 공간 매개 변수를 체계적으로 탐색하도록 쉽게 프로그래밍 할 수 있습니다. 이는 새로운 세포 나 조직을 대상으로 미세 주입 로봇을 적응할 때 특히 유리하며, 다른 공간 해상도를 요구하는 목적으로 미세 주입 로봇을 사용할 때 특히 유리합니다.
미세 주입 로봇을 구축하려면 기존의 에피 형광현미경(12)에최소한의 변화가 필요합니다. 우리는 이전에 https://github.com/bsbrl/Autoinjector이 적응에 대한 지침을 제공했습니다. 하드웨어가 설정되면 이 프로토콜은 자동화된 미세 주입을 성공적으로 수행하기 위한 주요 방법론 세부 정보를 제공합니다. 전체적으로, 미세 주입 로봇은 15.52 + 2.48 주사/분의 성공적인 주입 율을 가지고 있으며, 이는 경험이 부족한 사용자 (1.09 ± 0.67 주사 /분)보다 15 배 더 크고전문 사용자 (4.95 ± 1.05 주사/분)보다 3 배 더 큽니다. 성공적인 주입 비율에 있는 이 개선은 조직 생존을 보존하기 위하여 필수적인 시간의 짧은 양에 더 많은 세포를 주입하는 초보자와 전문가 사용자 둘 다 힘을 실어줍니다. 또한, 마이크로주입 로봇은 사용자 정의가능하며 궤적, 주사의 깊이, 주사 수, 주사 사이의 간격은 모두 GUI를 사용하여 조정할 수 있다. 이러한 기능을 통해 미세 주입 로봇을 이전에 힘든 실험을 최적화하고 이전에 는 이전보다 더 높은 수율을 요구하는 근본적으로 새로운 실험을 탐색하는 도구로 사용할 수 있습니다.
우리가 여기에서 기술한 미세 주입 절차의 주요 한계는 조직 조각의 준비, 광범위한 최적화를 필요로 하는 중요한 단계와 관련이 있습니다. 또한, 마이크로오분사는 유리 파이펫에 의해 접근할 수 있는 표면의 존재에 의존한다. 이 기능은 현재 설정을 사용하여 미세 주입을 통해 표적으로 할 수 있는 조직 및 조직 위치의 모형을 제한합니다.
미세 주입 로봇은 현재 밝은 필드 이미징을 사용하고 체외 뇌 슬라이스 준비에 사용되었습니다. 미래에, 미세 주입 로봇은 분자 또는 염료 태깅을 위한 생체 내에서 표적화의 특이성을 높이기 위하여 2-광자 화상 진찰과 결합될 수 있었습니다. 이러한 노력은 이미 단일 세포 전기생리학 15,16에대해 이루어졌다. 현재 장치는 미세 주입 절차의 수동 관찰이 필요합니다. 향후 버전에는 막힌 미세 주입 파이펫17을 청소하거나 멀티플렉스, 완전 자율 미세 분사용 유체 처리 로봇18의 통합을 위한 전략이 포함될 수 있습니다. 이러한 장치는 크기의 순서에 의해 미세 주입의 규모를 증가시킬 수 있습니다. 다중 미세 주입파이펫(19)의 병렬 제어를 위한 알고리즘을 적용하면 동일한 실험 내에서 수십 개의 염료 및 분자 시약을 동일한 세포로 멀티플렉스로 전달할 수 있습니다. 이것은 조직에 있는 분자 검열을 위한 새로운 도로를 열 가능성이 있습니다.
미세 주입 로봇은 DNA 또는 RNA 바코드를 사용하여 기능적으로 확인된 세포를 태그하는 데 사용될 수 있습니다. 이것은 차례차례로 단세포 RNA 순서분석 (scRNAseq) 및 전자 현미경 검사법과 같은 그밖 단하나 세포 분석 기술과 결합될 수 있었습니다. 우리의 예비 결과는 MICROin주입 세포 및 그들의 자손이 FACS 분류 (Taverna, 미공개 결과)에 선행된 조직 해리를 사용하여 복구되고 격리될 수 있다는 것을 보여줍니다. 그런 다음 FACS 정렬 된 셀은 scRNAseq에 사용할 수 있습니다. 더욱이, 예비 결과는 미세 주입 로봇의 단일 세포 분해능기능이 전자 현미경 분석과 병용하여 높은 공간 해상도에서 조직에서 신경 줄기 세포에 세포 생물학을 탐구하는 데 사용될 수 있음을 보여준다(타베르나 및 윌쉬-브룬닝거, 미공개 결과). 이러한 데이터는 미세 주입 로봇이 조직 내 및 더 넓은 의미에서 조직의 세포 정체성 및 행동의 다중 모달 분석을 위한 코르타이트 광 및 전자 현미경 검사법을 위한 도구로 사용될 수 있음을 시사한다.
미세 주입은 압력의 사용에 의존하고 하나는 높은 분자 복잡성주입 용액을 감당할 수 있습니다 (예를 들어, 전체 전사). 미세 주입의이 기능은 리간드 게이트 수용체를 분리하고 복제하기 위해 과거에 악용되었습니다20. 이 라인을 따라, 미세 주입 로봇 모델링 및 세포 수준에서 다중 genic 특성을 공부에 사용할 수 있습니다. 서브 풀링 전략과 결합된 미세 주입 로봇은 특정 특성/세포 행동을 구동하는 최소 유전자 집합을 식별하는 플랫폼으로사용될 수도 있습니다. 지금까지, 미세주입 로봇은 mRNA, DNA 또는 재조합 단백질10,21,22의전달을 통해 세포의 생화학을 조작하는 데 사용되어 왔다. 당사는 세포내 공간의 생물물리학을 조사하는 미세주입 로봇의 적용을 예견하고, 예를 들어 세포내 공간의 생물물리학적 특성을 감지 및/또는 조작할 수 있는 나노물질 또는 나노기계를 전달함으로써.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 노미스 재단 (ET)을 인정하고 싶습니다. SBK는 기계 공학 부, 과학 공학 대학, 미네소타 대학, 미네소타 고등 교육학과, 국립 보건원 (NIH) 1R21NS103098-01, 1R01NS1111028, 1R34NS1111654, 1R21NS1111111118R에서 자금을 인정합니다. GS는 국립과학재단 대학원 연구 펠로우십과 NSF IGERT 교육 보조금의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
참고문헌
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유