Method Article
연속 결정학 실험을 위한 Endothiapepsin 결정의 성장 최적화
요약
이 기사의 목적은 시청자에게 대규모 단일 단백질 결정을 성장시키기 위한 소량의 증기 확산 프로토콜을 직렬 결정학을 위한 대용량 배치 미세 결정화 방법으로 변환하는 방법에 대한 확실한 이해를 제공하는 것입니다.
초록
여기서는 싱크로트론과 XFEL 모두에서 연속 결정학 실험에 적합한 대용량(> 100μL)의 미세 결정질 슬러리를 쉽게 생성할 수 있는 프로토콜이 제시됩니다. 이 방법은 단백질 결정상 다이어그램에 대한 이해와 그 지식을 활용할 수 있는 방법을 기반으로 합니다. 이 방법은 (1) 결정 형태 최적화, (2) 배치로의 전환 및 (3) 스케일링의 세 단계로 나뉩니다. 1단계는 큐브와 같은 형태로 나타나는 잘 회절되는 단결정을 찾는 것입니다. 2단계에서 1단계 조건은 결정 성장 시간에 의해 최적화됩니다. 이 전략은 증기 확산에 의해 성장된 결정을 배치로 변환할 수 있습니다. 약 24시간 이내에 결정 성장이 발생할 수 있게 되면 단백질과 침전제 혼합물의 형태도를 플롯하여 스케일링 전략의 기초로 사용할 수 있습니다(3단계). 결정을 일괄적으로 성장시킬 수 있는 경우 스케일링을 시도할 수 있으며 부피가 증가함에 따라 결정 크기와 농도가 최적화됩니다. 엔도티아펩신은 이 프로토콜의 시연 단백질로 사용되었습니다. 제시된 결정 중 일부는 엔도티아펩신과 관련이 있습니다. 그러나 그들이 적용된 방식이 다른 사람들이 자신의 프로젝트에 적응할 수 있도록 이 절차에 대한 사고 방식에 영감을 주기를 바랍니다.
서문
실온(RT) 고분자 결정학은 구조 생물학 커뮤니티에서 다시 인기를 얻고 있습니다. X선 자유 전자 레이저(XFEL) 광원의 개발은 RT 샘플 전달 접근법 1,2,3,4의 개발에 박차를 가했으며, 이러한 방법은 현재 싱크로트론(5,6,7,8)에 적용되었습니다. RT 방법은 펌프 프로브 실험 구조 9,10,11,12의 가능성을 열어줄 뿐만 아니라 단백질 13,14,15,16,17 내에서 대체 구조적 상태를 촉진한다는 증거도 있습니다.
그러나 1990년대 후반에 극저온 방식이 RT 접근 방식보다 주목을 받은 주된 이유는 영하의 결정 온도18에 의한 방사선 손상의 둔화였습니다. Cryo-methods19는 단일 단백질 결정으로부터 완전한 데이터 세트의 수집을 허용하기 시작했다. XFEL 및 싱크로트론의 최신 RT 방법은 신속한(> 100Hz) 결정 전달 전략 1,2,3,4의 개발로 단결정 방사선 손상 문제를 해결했습니다. 이러한 방법을 사용하면 개별적으로 노출된 수천 개의 결정에서 완전한 데이터 세트를 수집할 수 있습니다. 따라서 이러한 RT 전달 접근법은 균질한 미세 결정(> 100μL의 < 50μm 결정)을 포함하는 대량의 용액을 생산해야 합니다. 그러나 극저온 방법은 단결정만 필요로 하는 경향이 있기 때문에 이러한 미세 결정질 슬러리를 만드는 방법은 현재 단백질 결정학 실험실에서 보편화되지 않았습니다.
일련의 결정학 샘플에 대한 미세 결정화 최적화 절차의 일부를 수행하는 방법에 대한 문헌의 예가 있습니다. 여기서 막 단백질과 가용성 단백질을 구별해야 합니다. 지질 입방상(LCP)에 대해 모노올레인(또는 일부 다른 지질)에서 성장한 미세막 단백질 결정의 성장을 최적화하기 위한 프로토콜이 잘 설명되었습니다20,21,22. 그러나, 비-LCP 조건에서 성장한 막 단백질을 포함하는 가용성 단백질의 미세결정화를 위한 방법은 일반적으로 결여되어 있다. 이전의 연구들은 미세 결정 스크리닝(micro-crystal screening)23,24, 핵형성강화(enhancement nucleation)24, 자유 계면 확산(free-interface diffusion)25을 이용한 스케일링(scaling)과 같은 과정의 특정 부분에 초점을 맞추었지만, 완전한 방법은 아니었다.
그러나, 완전한 프로토콜을 제공하려고 시도하는 방법이 최근에 기술되었다(26 ). 단백질 결정학의 여러 측면과 마찬가지로 새로운 것은 아닙니다. 제안 된 아이디어 중 많은 부분이 이미 Rayment (2002) 27에 의해 설명되었습니다. 이 방법은 결정학자에게 증기 확산을 사용하여 성장한 단일 결정에서 수천 개의 미세 결정을 성장시키는 배치 방법론으로 변환하는 방법을 보여주는 것을 목표로 합니다. 이 방법은 모든 단백질 데이터 뱅크(PDB) 증착의 95%가 증기 확산 플레이트에서 성장한 결정에서 나오기 때문에 일반적인 출발점으로 증기 확산에 초점을 맞춥니다26. 그러나, 증기 확산은 미세-결정화(26)를 위한 이상적인 방법이 아니므로, 증기 확산을 배치 결정화로 전환시키는 방법론이 설명된다. 결정을 일괄적으로 성장시킬 수 있게 되면 경로를 더 큰 볼륨으로 확장하는 것이 더 실용적이 됩니다. 단백질 결정화의 모호함을 감안할 때 저자는 이 방법이 안전하지 않다고 강조할 것입니다. 그러나 프로토콜은 적어도 단백질의 '결정화 공간'에 대한 통찰력을 제공해야 합니다.
이 방법은 단백질 결정화 단계 다이어그램과 해당 다이어그램에 대한 이해가 미세 결정화 최적화 중에 가이드 역할을 할 수 있는 방법에 의존합니다. 단백질 위상 다이어그램은 일반적으로 x축과 y축에 각각 침전제 및 단백질 농도가 있는 x/y 플롯으로 표시됩니다(그림 1A). 순수한 물 지점(왼쪽 하단 모서리 - 그림 1A)에서 용해도 라인에 도달할 때까지 단백질과 침전제의 농도가 증가합니다. 용해도 선은 과포화 지점을 표시합니다(보라색 선 - 그림 1A). 단백질이 과포화되면 용액은 열역학적으로 불안정해지고 '단백질이 풍부한' 용액과 안정적인 포화 용액의 두 단계로 분리되기 시작합니다. 이러한 분리는 용해도 선을 넘어 어디에서나 발생할 수 있으며 그 동역학은 단백질의 특성과 용액의 성분에 따라 달라집니다.
단백질과 침전제 농도가 너무 높으면 단백질이 용액에서 불안정하게 분해되어 비정질 침전물이 생성됩니다(분홍색 영역 - 그림 1A). 그러나, 정렬된 상 분리는 핵형성 영역에서 발생할 수 있으며[자세한 설명은 Garcia-Ruiz (2003)28 참조] 결정 핵은 형성되는 경향이 있다(녹색 영역 - 그림 1A). 핵 형성 및 성장은 용액에서 단백질을 제거하고 용해도 라인에 도달할 때까지 성장이 계속될 수 있는 준안정 영역으로 방울을 이동시킵니다[자세한 논의는 McPherson and Kuznetsov (2014)29 참조]. 이 다이어그램은, 대다수의 결정화 조건들에 대해, 총체적인 과잉 단순화(30)이다. 그러나 이것에도 불구하고, 다이어그램의 매핑을 통해 용해도 선과 핵 형성 동역학을 결정할 수 있기 때문에 다이어그램은 여전히 미세 결정학자에게 큰 유용합니다.
미세 결정을 생성하는 측면에서 결정화 중 최적화해야 하는 두 가지 요소는 결정의 수(Xn)와 평균, 가장 긴 치수(Xs)입니다. Xn 은 핵형성 사건의 수 (n)에 비례할 것이다 (식 1).
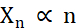 식 1
식 1
Xs는 용해도선 위의 유리 단백질 농도(Ps)를Xn으로 나눈 값에 비례한다(식 2).
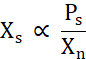 식 2
식 2
완벽한 상황에서, 모든 핵 형성 사건은 가능한 결정을 생성 할 것이고, 이들 결정들 각각은 용액에서 이용 가능한 단백질에 동등하게 접근 할 것이다. 도 2 는Xn 과Xs 사이의 관계에 대한 이상적인 시나리오로부터의 그래픽 표현이다. 실제적으로, 결정학자가Xn 및Xs 에 대해 갖는 주요 제어는 핵 형성의 양에 영향을 미치거나 종자 결정의 첨가에 의한 것입니다. 미세 결정학자는 적절한 결정 농도와 결정 크기가 모두 생성될 수 있도록Xn 을 증가시키는 방법을 판단해야 합니다.
대부분의 결정화 기술에는 '과도기'가 필요합니다(그림 1B). 예를 들어, 증기 확산 실험에서 단백질과 침전제 용액을 혼합할 때 방울이 웰 용액과 평형을 이루면서 각각의 농도가 변경됩니다. 이러한 변화가 결정화 성향이 증가하는 핵 형성 영역으로 점진적으로 전환되기를 희망합니다. 결정이 핵을 형성하고 성장하기 시작하면 용액에 있는 단백질의 양이 감소하기 시작하여 추가 핵 형성 가능성이 감소합니다. 핵형성의 궁극적인 양은 단백질 및 상태에 따라 다르며, 또한 핵형성 영역으로의 침투 깊이에 따라 달라집니다. 과도기적 단계를 필요로 하는 방법들의 제한된 핵형성 영역 침투를 감안할 때, 핵형성의 수준은 궁극적으로 준안정-핵형성 영역 경계에서의 핵형성 속도로 제한될 것이다.
미세 결정학자의 핵형성 수준을 향상시킬 수 있는 것이 중요하기 때문에 배치 결정화 방법론으로 이동하는 것이 중요합니다. 배치는 전체 핵형성 영역을 더 잘 활용할 수 있습니다(그림 1C). 배치 방법에서 아이디어는 단백질과 침전제를 함께 혼합하여 성분 농도의 변화 없이 과포화 용액이 생성되도록 하는 것입니다. 핵 형성은 혼합 즉시 가능해야 합니다. 따라서 배치 방법은 전체 핵 형성 영역에 이론적으로 도달 할 수 있습니다. 이어서, 준안정-핵형성 경계를 넘어서는 핵형성 동역학의 임의의 증가가 이용될 수 있다.
기저 수준의 결정 핵형성이 큰Xn을 생성하기에 충분하지 않은 경우, 마이크로시딩 방법을 사용할 수 있습니다. 미세-시딩에서, 미리 성장된 결정은 새로운 결정 성장을 위한 스캐폴드로서 작용할 수 있는 결정질 단편의 슬러리를 생성하기 위해 분해된다31,32. 마이크로 시딩은 결정 핵 형성을 증가시킬 필요 없이Xn을 증가시키는 방법으로서 일련의 결정학적 샘플 준비에 널리 사용되어 왔습니다(그림 1C).
증기 확산에서 배치로의 전환은 실험 시작점을 비과포화 또는 준안정 영역에서 핵 형성 영역으로 이동하는 것으로 위상 다이어그램에서 시각화할 수 있습니다. 이는 단백질 및/또는 침전제 농도 및/또는 방울 내 둘의 비율을 증가시키고(그림 1D) 어떤 조건에서 빠르게 나타나는 결정을 생성하는지 관찰함으로써 수행할 수 있습니다(< 24시간)26. 완전한 증기 확산 방울 평형은 며칠 또는 몇 주가 걸릴 수 있다33. 따라서 빠르게 나타나는 결정을 나타내는 조건을 찾으면 마이크로 배치34,35,36,37과 같은 대체 결정화 스크리닝 형식으로 이동하지 않고도 배치 조건을 찾을 수 있습니다.
핵 형성 영역이 발견되면 배치 조건이 발견되고 형태소도(여기서는 대략적인 위상 다이어그램)를 생성할 수 있습니다. 형태소도는 시드 배치 또는 직선 배치 프로토콜을 사용할지 여부를 고려할 때 매우 유용합니다. Xn을 단백질 및 침전제 농도의 함수로서 플롯함으로써, 핵형성 동역학의 평가가 이루어질 수 있다26. X n이 전체 핵 형성 영역에 걸쳐 낮게 유지되는 경우, 시드 배치는 Xn을 결정 성장을 제한하기에 충분히 크게 만드는 것이 필요할 수 있습니다. 이 평가는 더 큰 용량(> 100μL)으로 확장하는 프로세스의 첫 번째 단계입니다.
이 방법은 표준 증기 확산 결정화 장비를 사용하여 대부분의 결정화 실험실에서 수행 할 수 있도록 설계되었습니다. 장비를 사용할 수 있는 경우 이 프로세스의 많은 부분을 용이하게 하는 기술을 설명하는 많은 연구도 수행되었습니다. 여기에는 동적 광 산란(DLS)25,27, 비선형 이미징 20,24,25, 분말 회절 20,24,27 및 전자 현미경 26이 포함되지만 이에 국한되지는 않습니다[좋은 검토를 위해 Cheng et al. (2020)40].
이 연구의 목적은 소량(< 500nL) 증기 확산 결정화에서 대용량(> 100μL) 배치 결정화로 전환하는 방법의 시각적 시연을 제공하는 것입니다. Cryphonectria parasitica 의 엔도티아펩신은 이 번역을 시연하기 위한 예제 시스템으로 사용되었습니다. 실험의 유형 및 미세 결정이 필요한 샘플 전달 방법은 이상적인Xs 출력(26)에 영향을 미칠 것이다. 밀리초 시간 분해능(41 ) 또는 기체-역학적 가상 노즐(42)을 필요로 하는 혼합 실험의 경우, < 5 μm의 최종Xs 가 바람직할 수 있다. 이 경우 목표는 광자 활성화 펌프 프로브 실험을 위해 고정 표적 전달 접근법을 사용하여 약 1.5Å로 회절되는 단백질 결정을 생성하는 것이었습니다.
엔도티아펩신을 사용한 이러한 일련의 결정학 실험의 샘플 요구 사항을 설명하기 위해, 표 1 은 가설 실험의 실험 파라미터를 나타낸다. 샘플 정보는 아래에 설명된 프로토콜을 기반으로 합니다. 적중률 및 데이터 수집 요구 사항에 대한 일부 보수적인 추정치를 감안할 때 50mg은 전체 실험에 대한 총 샘플 소비량 추정치입니다.
그림 3 은 초기 소량 증기 확산 결정화에서 대규모 배치에 이르는 전체 최적화 프로세스의 흐름도를 보여줍니다. 대부분의 직렬 결정학 프로젝트의 경우, 이 프로토콜은 표적 단백질이 이미 결정화되었기 때문에 2단계: '배치로 전환'에서 시작됩니다. 그러나 1단계는 완전성과 독자들에게 그 중요성을 상기시키기 위해 포함되었습니다. 잘 회절되는 단일, 큰 결정을 발생시키는 조건을 찾는 것이 미세 결정 최적화를 위한 가장 좋은 출발점입니다. 2단계에서, 이 조건은 증기 확산에서 배치로 최적화될 수 있으며, 핵 형성 및 준안정 영역의 형태 그램이 플롯될 수 있습니다. 이 작업이 완료되면 3단계에서 배치 조건을 더 큰 볼륨으로 확장할 수 있습니다. 순서도가 끝날 때까지 결정학자는 엔도티아펩신에 대한 반복 가능한 대용량(> 100μL), 미세 결정화, 배치 프로토콜을 생성하게 됩니다. 이 방법은 관심있는 특정 단백질에 적용될 수 있습니다.
프로토콜
참고: 모든 96웰 좌식 드롭 결정화 실험은 2 또는 3 드롭 플레이트를 사용하여 설정되었습니다. 액체 처리 로봇과 결정화 이미저/호텔을 사용하여 모든 96웰 스크린의 준비 및 모니터링을 용이하게 했습니다. 결정화 실험을 위한 모든 시약 농도는 혼합 전에 시작 농도로 제공됩니다.
1. 결정 형태 최적화
참고: 단계 1.1.1. 및 1.1.6. 엔도티아펩신 결정화 조건이 어떻게 발견되었는지, 그리고 이러한 조건이 잘 회절하는 단일 결정을 생성하는 단일 조건을 찾기 위해 어떻게 최적화되었는지 설명하십시오.
- 희소 행렬 최적화
- 신선한 엔도티아펩신 용액을 준비합니다.
참고: 엔도티아펩신은 Superan 600으로 조달될 때 저장 용액에서 완충액을 옮겨 농축해야 합니다.- 4 °C에서 0.1 M Na 아세테이트 pH 4.6의 3 L를 준비한다.
- 투석 튜브 20cm를 자르고 완충액으로 간단히 세척합니다. 클립을 사용하여 튜브의 한쪽 끝을 밀봉하고 엔도티아펩신 용액 50mL를 튜브에 넣은 다음 다른 쪽 끝을 밀봉합니다.
- 용액을 4°C에서 최소 4시간(또는 하룻밤) 동안 1L의 Na 아세테이트 완충액에 투석합니다. 저장 완충액의 구성 요소로 인해 투석 백의 용액은 이제 약 100mL가 됩니다.
- 엔도티아펩신이 들어 있는 투석 백을 4°C, 0.1 M Na 아세테이트 pH 4.6의 신선한 리터에 옮긴다. 이 단계를 한 번 더 반복하여 원래 버퍼가 Na 아세테이트에 대해 2000배 희석되도록 합니다.
- 엔도티아펩신은 이제 약 10mg/mL가 될 것입니다. 10kDa 원심 농축기와 원심분리기를 사용하여 100mg/mL로 농축합니다.
- 엔도티아펩신 용액을 50μL 분취량의 액체 질소로 급속 냉각하고 -80°C에서 보관합니다.
- PACT Premier 96웰 희소 매트릭스 스크린을 준비합니다.
- 액체 처리 로봇을 사용하여 100nL의 70mg/mL 엔도티아펩신과 100nL의 웰 용액을 웰당 단일 서브 웰에 분주합니다. 결정화 완충액을 첨가할 때 단백질과 well 용액을 3회 혼합한다.
- 플레이트를 밀봉하고 20°C에서 28일 동안 방치하여 첫 주 동안 매일 이미지를 촬영한 다음 그 후 4주 동안 매주 이미지를 촬영합니다.
- 희소 행렬 분석
- 단일 엔도티아펩신 결정을 생성하는 히트를 식별합니다. PACT 스크리닝으로부터,MgCl2 를 함유하는 조건은 바늘 클러스터가 아닌 싱글톤으로 성장하였다.
- 희소 행렬 최적화
- 단계 1.1.3.1에서 확인된MgCl2 함유 조건으로부터, 상이한 웰 성분을 무작위로 조합하고 변화시키는 96-웰 스크린을 생성한다.
- 액체 처리 로봇을 사용하여 100nL의 70mg/mL 엔도티아펩신과 100nL의 웰 용액을 웰당 단일 서브 웰에 분주합니다. 결정화 완충액을 첨가할 때 단백질과 well 용액을 3회 혼합한다.
- 플레이트를 밀봉하고 20°C에서 28일 동안 방치하여 첫 주 동안 매일 이미지를 촬영한 다음 그 후 4주 동안 매주 이미지를 촬영합니다.
- 최적화 분석
- 적절한 스프레드시트 소프트웨어를 사용하여 결정 품질 및 침전 수준, 결정 없음(0)에서 이상(5) 및 낮음(0)에서 높음(5)을 각각 기준으로 결정을 생성하는 결정화 조건의 순위를 매깁니다. 결정 품질과 관련하여 광범위한 기준은 상자와 같은 형태를 가진 단결정입니다.
- 결정화 조건 내용과 결정량 및 침전 수준 간의 Pearson 상관 분석을 수행합니다.
- 이러한 데이터를 히트 맵으로 플로팅합니다. 선호하는 결과와 상관 관계가 있는 구성 요소 및 조건을 찾습니다.
- 회절 분석.
- 단계 1.1.5에서 확인된 조건에서 성장한 결정이 X선 회절 실험을 수행하여 연속 결정학에 적합한지 확인합니다.
- 식별된 각 조건의 엔도티아펩신 결정 샘플을 100K 또는 293K에서 데이터 수집이 가능한 지지대에 로드하고 X선 회절 실험을 수행합니다. 극저온 상태에서 작업하는 경우 극저온 보호제로 25% 에틸렌 글리콜을 사용하십시오.
- 적절한 소프트웨어 제품군을 통해 이러한 데이터를 처리합니다. 엔도티아펩신 결정은 1.5Å 이상으로 회절되어야 합니다. 쌍둥이 결정은 직렬 결정학적 데이터 처리를 상당히 복잡하게 만들 수 있으므로 쌍둥이를 확인하십시오.
- 결정이 싱글톤이고 1.5Å로 회절된 경우 2단계로 진행합니다. 그렇지 않은 경우 1.1.2단계로 돌아가서 더 많은 희소 매트릭스 스크린을 시도하여 유망한 조건을 식별합니다. 1.1.5단계에서 수행된 분석 후. 및 1.1.6., 25%(w/v) PEG 6,000, 0.1M Tris-HCl pH 7.0 및 0.15MMgCl2 의 결정화 조건이 대략적인 이상형으로 발견되어야 합니다.
- 신선한 엔도티아펩신 용액을 준비합니다.
2. 배치로 전환
- 형태소 실험
- 마이크로 결정 종자 스톡을 만듭니다.
알림: 종자를 만들 때 작업을 위해 특별히 자란 결정으로 씨앗을 만드는 것이 가장 좋습니다. 이는 재현성에 큰 도움이 됩니다. 2.1.1.1 단계에서 2.1.1.11 단계까지 제시된 다른 아이디어는 항상 표준 수의 우물에서 자란 결정 (여기서는 5 개)을 사용하고 동결-해동 사이클을 무효화하기 위해 만들어진 스톡을 분취하는 것입니다.- 결정화 완충액: 25%(w/v) PEG 6,000, 0.1M Tris-HCl pH 7.0 및 0.15MMgCl2를 포함하는 웰로 96-웰 결정화 플레이트를 준비합니다.
- 액체 처리 로봇을 사용하여 해동된 70mg/mL 엔도티아펩신 200nL와 웰 용액 200nL를 웰당 단일 서브 웰에 분주합니다. 결정화 완충액을 첨가할 때 단백질과 well 용액을 3회 혼합한다.
- 플레이트를 밀봉하고 24 시간 동안 그대로 두십시오.
- 1.5mL 원심분리기 튜브에 250μL의 결정화 완충액과 10-15mm 유리 비드를 채웁니다. 원심분리기 튜브를 얼음 위에 두어 5-10분 동안 식힙니다.
- 결정이있는 5 개의 웰을 선택하고 메스로 웰을 열고 피펫 팁을 사용하여 웰의 결정을 분쇄하십시오.
- 얼음 원심분리기 튜브에서 완충액 1μL를 흡인하고 분쇄된 결정 슬러리를 균질화하는 데 사용합니다. 균질해지면 전체 슬러리를 흡인하고 냉각된 원심분리기 튜브에 수집합니다.
- 5개의 서브웰 각각에 대해 2.1.2.6단계를 반복한다.
- 완충액이 들어 있는 원심분리기 튜브를 1000rpm에서 30초 동안 풀링한 슬러리 및 비드를 소용돌이칩니다.
- 원심분리기 튜브를 얼음에 30초 동안 되돌립니다.
- 2.1.2.8단계와 2.1.2.9단계를 두 번 더 반복합니다.
- 이제 종자 스톡이 준비되었으며 10μL 배치로 분주하여 -20°C에서 보관할 수 있습니다.
- 형태소 실험을 수행합니다.
- 2-드롭 96웰 그리드 스크린을 준비합니다. PEG 6,000의 농도를 플레이트 컬럼을 따라 5 내지 40%(w/v)로 변화시키고, 완충액 및 염을 각각 0.1 M Tris-HCl pH 7.0 및 0.15 MMgCl2로 유지한다.
- 0.1M Na 아세테이트 pH 4.6에서 엔도티아펩신을 8단계에 걸쳐 100에서 12.5mg/mL로 순차적으로 희석하여 준비합니다. 다른 농도의 엔도티아펩신이 플레이트의 각 행에 사용됩니다.
- 액체 처리 로봇을 사용하여 150nL의 엔도티아펩신을 서브웰 1과 2에 모두 분배합니다. 서브 웰 1에서 웰 용액 150nL를 분주합니다. 서브 웰 2에서, 해동된 종자 스톡 50 nL와 웰 용액 100 nL를 다중 흡인하고, 그 후 둘 다 단백질 용액에 분배한다. 결정화 완충액의 첨가시 용액을 3회 혼합한다.
- 플레이트를 밀봉하고 20°C에서 방치하여 0, 3, 6, 12, 18, 24시간마다 이미지를 촬영한 다음 첫 주에는 매일, 다음 주에는 매주 촬영합니다. 자동 이미징이 불가능한 경우 1일차의 시간별 이미징에 대해 걱정하지 마십시오.
- 마이크로 결정 종자 스톡을 만듭니다.
- 형태소 분석
- 24시간 후에 촬영한 이미지를 보고 각 웰에 존재하는 결정의 수를 추정하고 이러한 추정치를 제공된 "형태소 분석기 생성기" 워크시트에 기록합니다. 이러한 추정치가 정확할 필요는 없습니다. 존재하는 경우 수천 개의 미세 결정을 개별적으로 계수하는 것은 실용적이지 않거나 필요하지 않습니다. 주로 전체 플레이트에 걸쳐 추정치가 일관되도록 노력하십시오.
참고: 24시간 규칙은 Beale et al . (2019)26. 증기 확산 결정화 조건은 평형을 이루는 데 며칠 또는 몇 주가 걸릴 수 있습니다. 빠르게 나타나는 결정은 드롭 성분의 점진적인 평형보다는 배치 공정을 통해 성장했을 가능성이 더 큽니다. 따라서 24시간 기준은 다소 임의적이며 배치와 증기 확산 실험 사이의 정확한 차단 시간은 조건의 특정 혼합물에 따라 달라집니다[Beale et al. (2019) 자세한 내용은 26 ]. - 표시된 상자에 엔도티아펩신과 PEG 6,000의 시작 농도를 입력합니다.
- 워크시트는 각각 x 축과 y 축에 침전제와 단백질 농도가 있는 기존 위상 다이어그램 형식으로 결과를 자동으로 표시합니다. 시드된 방울에서만 결정을 생성하는 우물 조건은 다이어그램의 준안정 영역(투명한 파란색)을 나타내는 반면, 시드된 방울과 시드되지 않은 방울 모두에 결정이 있는 조건은 핵 형성 영역(녹색 단색)을 나타냅니다.
참고: 이상적으로는 대부분의 핵형성 영역이 다이어그램에 있어야 합니다(즉, 다이어그램 하단에 일부 투명한 웰이 있고 일부 침전물은 높은 단백질 및 침전물 농도에서 볼 수 있어야 함). 그렇지 않은 경우 실험을 반복하되 단백질 및/또는 침전제 농도를 높입니다(가능한 경우). - 24시간 이내에 수정이 나타나면 2.3.1단계로 진행합니다. 그렇지 않은 경우 2.4단계로 진행하고 배치에 대한 최적화를 계속합니다.
- 24시간 후에 촬영한 이미지를 보고 각 웰에 존재하는 결정의 수를 추정하고 이러한 추정치를 제공된 "형태소 분석기 생성기" 워크시트에 기록합니다. 이러한 추정치가 정확할 필요는 없습니다. 존재하는 경우 수천 개의 미세 결정을 개별적으로 계수하는 것은 실용적이지 않거나 필요하지 않습니다. 주로 전체 플레이트에 걸쳐 추정치가 일관되도록 노력하십시오.
- 결정 분석
- 1단계의 끝에서 말했듯이 다음 단계로 이동하기 전에 이러한 결정이 원하는 형태와 회절 품질을 갖는지 확인하십시오. 형태와 관련하여, 결정은 관찰 가능하게 꼬이지 않고 바늘 공 모양 또는 부채꼴 구조가 아닌 단일체로 형성됩니까? 회절과 관련하여 가능하면 결정에서 회절 데이터를 수집하십시오. 이러한 결정이 회절되지 않으면 더 큰 부피로 성장한 결정이 회절될 가능성이 거의 없습니다.
- 모르포그램 실험에서 얻은 엔도티아펩신 결정 샘플을 100K 또는 293K에서 데이터 수집이 가능한 지지대에 로드하고 X선 회절 실험을 수행합니다. 극저온 상태에서 작업하는 경우 극저온 보호제로 25% 에틸렌 글리콜을 사용하십시오.
- 적절한 소프트웨어 제품군을 통해 이러한 데이터를 처리합니다. 엔도티아펩신 결정은 1.5Å 이상으로 회절되어야 합니다. 결정 샘플에서 세포 크기, 총 관찰 횟수 및 모자이크를 관찰합니다. 이러한 측정은 회절 결정의 균질성에 대한 표시를 제공합니다.
- 결정 형태 및 회절 품질이 충분하면 3단계로 진행합니다.
- 결정 성장 시간을 최적화합니다.
참고: 형태도 분석(2.2단계)은 결정화 시작점(즉, 침전제와 단백질 용액이 혼합되었을 때 방울이 위치한 위상 다이어그램의 영역)을 나타냅니다. 준안정 영역의 강하가 용해도 선 아래에 있습니까? 배치 결정화는 핵 형성 영역에서 시작됩니다(그림 1C). 이 단계의 목표는 이 시작점을 용해도 선 또는 준안정 영역 아래에서 핵 형성 영역으로 이동하는 것입니다(그림 1D). 시드된 경우 단계 2.2에서 떨어집니다. 결정을 빠르게 생성했으며, 이는 방울 혼합물이 이미 준안정 영역에 있음을 나타내는 것이며, 그렇지 않은 경우 방울이 과포화되지 않았을 가능성이 높습니다.- 결정 성장 시간 최적화.
- 단계 2.1.3에서와 동일한 스크린을 사용하여, 3-드롭 플레이트에서 96-웰 증기확산 결정화 실험을 준비하였다.
- y축에서 엔도티아펩신의 시작 단백질 농도를 증가시킵니다(즉, 엔도티아펩신의 경우 단백질을 더 농축, 아마도 120mg/mL).
- 2.1.3.2 단계에서와 같이 플레이트의 각 행에 순차적으로 더 낮은 단백질 농도가 포함되도록 연속 희석을 수행합니다.
- 접시에 있는 세 방울 각각에 다른 방울 비율을 사용합니다: 1:1, 1:2 및 2:1, 단백질:침전제.
- 첫날 0, 3, 6, 12, 18, 24시에 플레이트를 보거나 이미지화한 다음 첫 주에는 매일, 다음 주에는 매주 4시를 표시하거나 이미지화합니다. 자동 이미징이 불가능한 경우 1일차의 시간별 이미징에 대해 걱정하지 마십시오.
- 가장 빠르게 나타나는 결정을 생성하는 방울을 식별하고 24시간 이내에 결정 성장이 발생할 때까지 반복되는 최적화의 시작점으로 만듭니다.
- 빠르게 나타나는 결정 상태가 확인되면 2.1단계로 돌아가 형태소를 스케일링을 시작하기 위한 서곡으로 반복하십시오.
- 결정 성장 시간 최적화.
3. 스케일링
- 순위 조정 경로. 이 단계에서는 단일 크기 조정 경로를 결정할 필요가 없으며 옵션을 식별하고 순위를 지정하여 차례로 탐색할 수 있습니다. 스케일링 절차 동안 배치 혼합물의 부피가 증가함에 따라 핵 형성 속도와 결정 크기 범위에 변화가 발생합니다. 그러나 이는 스케일링된 부피가 증가함에 따라 구성 요소 농도를 신중하게 조정하여 극복할 수 있습니다.
참고: 3.1.1단계와 3.1.2단계에서는 형태소도에서 배치 또는 시드 배치 프로토콜이 더 적합한지 식별하는 방법을 설명합니다.- 스트레이트 배치 프로토콜
- 핵 형성 영역의 Xn은 단백질 및/또는 침전제 농도에 비례합니까? 즉, Xn은 침전제 및/또는 단백질 농도의 함수로 증가합니까? -예? 단계 3.1.1.2로 이동합니다. 아니요? 3.1.2단계로 이동합니다.
- 필요한 크기의 결정을 생성하는 조건을 찾아 3.2단계로 이동합니다.
- 시드 배치 프로토콜
- Xn 은 핵 형성 영역을 가로질러 평평합니까? 즉, Xn 은 침전제 및/또는 단백질 농도의 함수로서 증가하지 않는다.
- 필요한 크기의 결정을 생성하는 시드 조건을 찾고 3.2단계로 이동합니다. 모든 크리스탈이 너무 크면 단계 3.1.2.3으로 이동합니다.
- 형태소 실험 (2.1 단계)을 반복하되 이번에는 파종 된 우물에 사용 된 종자 스톡의 농도를 높입니다. 종자 스톡은 생성에 더 많은 결정을 사용하여 증가시킬 수 있습니다. 예를 들어, 2.1.1.5단계에서 5개의 웰 대신 10개의 웰을 사용합니다.
- 처음 0, 3, 6, 12, 18, 24시간 동안 플레이트를 보거나 이미지화합니다.
- 시드-드롭에서Xn 은 증가하고, X는 감소했어야 한다. 더 작은 결정이 필요한 경우 이 주기를 반복한 다음 시드 배치 프로토콜을 따릅니다.
- 스트레이트 배치 프로토콜
- 점진적 확장
- 96웰 플레이트에서 스케일링. 엔도티아펩신 형태도에서 결정화 조건 0.1M Tris-HCl pH 7.0, 0.15MMgCl2 및 30%(w/v) PEG 6,000을 사용하는 직선 배치 방법을 스케일링을 위해 초기에 선택했습니다. 100mg/mL 엔도티아펩신을 결정화 완충액과 1:1 비율로 혼합했습니다.
- 100μL의 0.1M Tris-HCl pH 7.0, 0.15MMgCl2 및 30%(w/v) PEG 6,000을 사용하여 2웰 96웰 좌식 드롭 플레이트에 2-3웰을 준비합니다.
- 갓 해동된 100mg/mL 엔도티아펩신 용액을 사용하여 웰당 단백질 0.5μL와 침전제 0.5μL를 분주하고 밀봉하여 20°C에서 보관합니다.
- 처음 0, 3, 6, 12, 18, 24시간 동안 플레이트를 보거나 이미지화합니다. X,s, X n 범위의 변경 사항을 확인합니다.
- 변경이 발생한 경우 3.2.1.1 단계부터 3.2.1.2 단계까지 반복하되 단백질, 침전제 및/또는 종자 농도를 높이거나 낮추어 Xs 및 Xn 범위의 변경 사항을 복원합니다.
- Xs 및Xn의 범위가 허용될 때, 단계 3.2.2로 진행한다.
- 24웰 행잉 드롭 플레이트에서 스케일링
- 우물 가장자리에 진공 그리스를 바르고 24웰 걸이 드롭 플레이트의 단일 웰을 준비합니다.
- 0.5mL의 0.1M Tris-HCl pH 7.0, 0.15M MgCl2 및 30%(w/v) PEG 6,000을 준비하고 기름칠 된 웰을 채 웁니다.
- 갓 해동된 엔도티아펩신 용액을 사용하여 1μL의 단백질을 유리 커버슬립 표면에 피펫팅합니다. 결정화 완충액 1 μL를 단백질 적하액에 피펫팅하고 피펫을 사용하여 혼합합니다.
- 처음 0, 3, 6, 12, 24시간 동안 플레이트를 보거나 이미지화합니다. X,s, X n 범위의 변경 사항을 확인합니다.
- 변경이 발생한 경우 3.2.2.1 단계부터 3.2.2.4 단계까지 반복하되 단백질, 침전제 및/또는 종자 농도를 높이거나 낮추어 Xs 및 Xn 범위의 변경 사항을 복원합니다.
- Xs 및Xn의 범위가 허용되는 경우/경우 단계 3.2.2.7로 진행합니다.
- 3.2.2.1 - 3.2.2.5 단계를 반복하여 실험의 총 부피를 10 μL로 점진적으로 늘립니다.
- 10μL 이상의 부피로 한 번 3.2.3단계에서 원심분리기 튜브로 진행합니다.
- 원심분리기 튜브의 스케일링
참고: 엔도티아펩신 배치 조건의 개선은 주로 200μL 부피 지점에서 발생했습니다(결과, 스케일링 참조). 이 공정은 0.1M Tris-HCl pH 7.0, 0.15MMgCl2 및 30%(w/v) PEG 6,000의 결정화 조건으로 시작되었습니다. 그러나 PEG 농도는 궁극적으로 40%(w/v)로 변경되었습니다. 종자는 또한 Xn을 제어하기 위해 필요했고, 결정이 너무 커지는 것을 방지하기 위해, 결정 성장은 담금질되어야했다. 3.2.3.1 - 3.2.3.7 단계에서는 조건 최적화 프로세스를 자세히 설명합니다. 3.2.4 단계. 최종 배치 프로토콜을 설명할 수 있습니다.- 1 mL 결정화 완충액을 준비합니다: 0.1 M Tris-HCl pH 7.0, 0.15 MMgCl2 및 30%(w/v) PEG 6,000.
- 갓 해동된 100mg/mL 엔도티아펩신을 사용하여 1.5mL 원심분리기 튜브에 단백질 25μL를 추가합니다.
- 결정화 완충액과 단백질 용액을 피펫 팁으로 1:1 비율로 완전히 혼합합니다. 튜브를 20°C에서 높은 교반으로 리볼버/로테이터에 넣습니다.
- 정기적으로(5, 10, 30, 60분, 2, 5, 10, 24시간) 2.5μL 분취량을 복용하고 혈구계에서 관찰합니다. Xn 및 Xs 범위를 기록합니다.
- 변경이 발생한 경우 3.2.3.1단계를 반복합니다. 3.2.3.4로. 그러나 단백질, 침전제 및/또는 종자 농도를 증가시키거나 감소시켜 Xs 및 Xn 범위의 변화를 복원합니다.
- Xs 및 Xn의 범위가 허용되면 단계 3.2.3.7로 진행합니다.
- 3.2.2.1단계부터 3.2.2.5단계까지 반복하여 필요에 따라 실험의 총 부피를 200μL 이상으로 점진적으로 늘립니다.
- 최종 시드 배치 프로토콜
- 종자를 준비하십시오.
- 결정화 완충액 2mL를 준비합니다: 0.1M Tris-HCl pH 7.0, 0.15MMgCl2 및 40%(w/v) PEG 6,000.
- 갓 해동된 100mg/mL 엔도티아펩신을 사용하여 1.5mL 원심분리기 튜브에 단백질 100μL를 추가합니다.
- 결정화 완충액과 단백질 용액을 피펫 팁으로 1:1 비율로 완전히 혼합합니다. 튜브를 20°C에서 24시간 동안 고교반하여 50μm 결정이 자랄 수 있도록 리볼버/로테이터에 넣습니다.
- 50μm 결정 슬러리에 10-15개의 1mm 유리 비드를 추가합니다.
- 슬러리와 비드가 들어 있는 원심분리 튜브를 1000rpm에서 30초 동안 와동시킵니다.
- 원심분리기 튜브를 얼음에 30초 동안 되돌립니다.
- 3.2.4.1.5단계와 3.2.4.1.6단계를 10번 더 반복합니다.
- 이것은 이제 200 μL의 1x 종자 스톡입니다. 결정화 완충액 1.8mL를 첨가하여 종자 스톡을 10배 희석합니다. 10x 종자 스톡을 50μL 배치로 분취하여 -20°C에서 보관합니다.
- 시드된 일괄 처리 프로토콜입니다.
- 결정화 완충액 준비: 0.1M Tris-HCl pH 7.0, 0.15MMgCl2 및 40%(w/v) PEG 6,000.
- 원심분리기 튜브에서 100μL의 결정화 완충액과 50μL의 갓 해동된 10x 시드 스톡을 혼합합니다.
- 갓 해동된 100mg/mL 엔도티아펩신을 사용하여 150μL의 단백질을 1.5mL 원심분리기 튜브에 추가합니다.
- 결정화 완충액/종자 혼합물을 피펫 팁으로 엔도티아펩신 용액과 완전히 혼합하고 튜브를 20°C에서 높은 교반으로 리볼버/로테이터에 넣습니다.
- 규칙적인 2.5μL 분취량을 취하여 결정화를 모니터링하고 혈구계에서 결정을 확인합니다. Xn 및 Xs 범위를 기록합니다.
- 약 80분 후, 결정이 15μm의 Xs에 도달하면 0.05M Na 아세테이트 pH 4.6, 0.05MTris-HCl pH 7.0, 0.075MMgCl2 및 20%(w/v) PEG 6,000(엔도티아펩신 완충액과 결정화 완충액으로 구성된 용액, 1:1 혼합).
- 결정을 20°C에서 보관한다.
- 프로토콜이 의도한 실험에 대해 허용 가능한 결정 크기 범위와 수를 생성했습니까? 예 - 완료- 아니요 - 3.1단계로 돌아갑니다. 을 클릭하고 대체 크기 조정 옵션을 시도합니다. 예를 들어, 다른 단백질:침전제 비율이 가능하거나 이전에 수행되지 않은 경우 종자를 추가할 수 있습니다. 이 모든 것이 소진되면 1단계에서 새로운 조건을 찾아야 할 수도 있습니다.
- 종자를 준비하십시오.
- 96웰 플레이트에서 스케일링. 엔도티아펩신 형태도에서 결정화 조건 0.1M Tris-HCl pH 7.0, 0.15MMgCl2 및 30%(w/v) PEG 6,000을 사용하는 직선 배치 방법을 스케일링을 위해 초기에 선택했습니다. 100mg/mL 엔도티아펩신을 결정화 완충액과 1:1 비율로 혼합했습니다.
결과
결정 형태 최적화
결정 형태를 최적화하는 1단계는 독자에게 그 중요성을 상기시키기 위해 포함되었습니다. 회절이 잘 안되는 바늘 공에서 완벽한 미세 결정을 만드는 것이 가능할 수 있습니다. 그러나 저자는 두 가지를 별도로 최적화하는 것이 더 낫다고 제안합니다. 먼저 증기 확산을 통해 잘 회절되는 단결정을 생성하는 조건을 찾은 다음 두 단계를 함께 결합하지 않고 이러한 조건을 배치로 변환합니다. 이 단계에서 고도의 핵 형성 조건을 발견하는 것은 필요하지 않습니다. 형태 및 회절 품질이 주요 목표입니다.
엔도티아펩신의 미세결정화를 시작하기 전에, PDB로부터 증착된 구조 결정화 조건의 분석이 수행되었다. 결정화 조건 및 대략적인 프로토콜은 엔토티아펩신의 48개 증착 중 47개에 대해 얻을 수 있었습니다. 이들은 대체로 모두 Moews and Bunn(1970)46에 의해 수행된 엔도티아펩신의 첫 번째 결정화에 기초했습니다. 이러한 조건의 유사성과 '고전적인' 기원을 감안할 때, 더 다양한 결정화 조건을 탐색하기 위해 96웰, 증기 확산, 희소 매트릭스 스크린이 수행되었습니다. 엔도티아펩신을 70mg/mL로 농축하고 100nL의 단백질과 100nL의 웰 용액을 혼합하여 20°C에서 96웰 좌식 드롭 플레이트에서 PACT 희소 매트릭스 스크리닝47 을 수행했습니다. 36시간 후 이 실험의 모든 조건은 결정을 생성했습니다. 그러나 결정 형태학을 분석한 결과 일부 조건이 미세 결정화 최적화에 더 적합할 수 있음을 알 수 있습니다.
도 4A 는 대다수의 플레이트에서 관찰된 것들의 대체로 대표되는 PACT 스크린으로부터의 하락을 보여준다. 언뜻 보기에 이러한 결정이 미세 결정화를 위해 더 최적화할 가치가 있다고 생각하고 싶을 수 있습니다. 결정은 크고 상당한 핵 형성이 있는 것으로 보입니다. 그러나 전반적인 결정 형태는 이상적이지 않습니다. 첫째, 결정은 단일 핵 형성 지점에서 여러 결정이 성장하는 것처럼 보이기 때문에 관찰할 수 있는 싱글톤이 아닙니다. 둘째, 결정 크기는 주로 단일 축에서 발생하는 성장과 매우 비대칭적입니다. 이러한 결정은 이론적으로 X선 빔에 전달될 때 우선적으로 정렬될 가능성이 더 높습니다. 두 특성 모두 직렬 결정학 데이터의 수집 및 처리 중에 문제를 나타냅니다.
그러나, 도 4B는MgCl2의 존재 하에서 성장한 엔도티아펩신 결정을 보여준다. 이 형태는 MgCl 2 를 포함하는 모든 조건에서 일관되었으므로 그 형태가 MgCl2 로 인한 것임을 시사했습니다. MgCl2 조건은 궁극적인 연속 실험을 위한 더 나은 표적을 나타내는 더 많은 단일 상자형 결정을 생성했습니다.
PACT 스크리닝 내에는MgCl2를 포함하는 4가지 조건이 있었습니다. 엔도티아펩신 결정화에 대한 이러한 조건의 모든 상이한 성분의 영향을 더 잘 이해하기 위해, 무작위 최적화가 수행되었다. 다양한 농도 및 pH에서 완충액과 침전제의 무작위 조합을 포함하는 스크린이 생성되었습니다. MgCl2 농도 또한 변화시키고, 그 후 생성된 방울은 이들의 시각적 결정 품질 및 침전 수준 측면에서 0 내지 5(0은 결정 또는 침전이 없음)로부터 임의로 등급을 매겼다.
도 5A는 강수 수준과 결정 품질 사이의 피어슨 상관 분석으로부터의 결과의 히트맵을 도시하고, 스크린 변수들 (이 실험으로부터의 방울의 예는 도 5B, C 및 D에 도시되어 있다). 결과는 용액의 pH가 침전 수준과 높은 상관 관계가 있음을 나타내며 알칼리성 완충액은 더 많은 침전을 초래합니다. MgCl2 농도는 pH 및 침전제 농도와 마찬가지로 침전 수준과 약간 상관관계가 있었으며 결정 품질도 상관관계가 있었다.
이러한 결과를 바탕으로 0.1M Tris-HCl pH 7.0, 0.15MMgCl2, 20%(w/v) PEG 6,000에서 성장한 결정을 프로토콜의 다음 단계인 배치로 전환하기로 결정했습니다. 결정의 형태는 허용 가능했으며 이러한 결정의 X선 회절 및 데이터 품질 메트릭을 분석한 결과 Mg2+ 의 존재 안팎에서 성장한 결정 간에 유의미한 차이가 없음을 시사했습니다(그림 9).
배치로 전환
많은 연속 결정학 미세 결정화 최적화의 경우 2단계가 시작점이 됩니다. 관심 단백질은 이미 극저온 결정학을 위해 결정화되었으며 결정화 프로토콜은 이제 미세 결정 슬러리를 생성하기 위해 변형이 필요합니다. 이 프로토콜은 증기 확산이 PDB 항목 26의 95%에서 사용되는 결정화 방법이기 때문에 배치로의 변환을 수행하기 위해96웰 증기 확산 플레이트만 사용했습니다. 프로토콜은 마이크로 배치34,35,37로 이동하는 것을 피했는데, 이 전환이 여전히 유사한 최적화를 초래할 수 있기 때문입니다. 그렇다고 해서 이 프로토콜이 증기 확산판에서만 수행될 수 있다는 것은 아닙니다. 제시된 모든 단계는 이것이 원래의 결정화 방법이라면 마이크로 배치에서도 작동합니다.
선택한 조건에서 엔도티아펩신의 결정화를 평가하기 위해 형태소 또는 대략적인 위상 다이어그램이 생성되었습니다. 형태소 실험의 목적은 세 가지입니다. 첫째, 형태소 분석의 분석은 3단계 - 스케일링에서 스케일링 경로를 평가할 때 매우 유용합니다. 둘째, 형태소도는 최적화 도구 역할을 하여 배치[즉, 빠르게 나타나는 결정(< 24시간)]를 통해 결정을 생성하는 증기 확산 조건을 발견하는 데 도움이 됩니다. 셋째, 결정이 빠르게 나타나지 않은 경우 시드 된 방울을 분석하면 결정학자에게 위상 다이어그램에서 현재 상태의 대략적인 위치에 대한 아이디어를 제공 할 수 있습니다. 예를 들어, 시드된 조건은 결정을 제공하지만 시드되지 않은 조건은 결정을 제공하지 않는 경우 해당 조건은 준안정 영역에 있을 가능성이 높습니다.
엔도티아펩신의 형태소 실험은 0.1M Tris-HCl pH 7.0, 0.15MMgCl2, 20%(w/v) PEG 6,000 조건을 기준으로 수행되었습니다. 단백질 및 PEG 농도는 각각 100 내지 12.5 mg/mL 및 5 내지 40% (w/v)로 다양하였다. 방울을 분석하고 제공된 워크시트를 사용하여 결과를 표시했습니다(그림 6A).
또한 결정 형태 최적화 단계에서 이 조건과 이러한 단백질 농도에서 엔도티아펩신 결정 성장이 24시간 이내에 결정이 성장한다는 것이 이미 분명했습니다. 이는 결정화가 증기 확산 구동 공정이 아닌 배치를 통해 발생하고 있음을 나타냅니다. 따라서 이러한 조건에서 성장한 결정은 더 큰 부피로 스케일링하는 데 적합했습니다.
24시간 후에 시드되지 않은 방울에서 결정이 보이지 않았다면 결정화는 여전히 전이에 의존했을 가능성이 높으며(그림 1B) 따라서 배치가 아닙니다. 이 경우 형태소 실험 결과가 여전히 중요합니다. 그것들은 위상 다이어그램에서 결정화의 가능한 시작점과 그에 따른 후속 최적화가 어떻게 진행되어야 하는지를 나타냅니다. 씨를 뿌린 방울을보십시오. 씨앗은 핵 형성에 관계없이 준안정 영역에서 결정 성장을 허용합니다. 예를 들어, 결정이 시드된 방울에서 24시간 이내에 나타나지만 시드되지 않은 방울에서는 나타나지 않는 경우, 이는 준안정 영역의 일부가 관찰될 수 있음을 나타냅니다. 파종된 방울 또는 파종되지 않은 방울에서 결정이 관찰되지 않으면 모든 웰은 불포화 상태로 유지됩니다.
스케일링
형태소도(그림 6A)를 보면 여러 가지 관찰이 이루어질 수 있습니다. 핵형성의 양은 단백질과 침전제 농도 모두에 의해 영향을 받는 것으로 나타났다. 또한 단백질 침전으로 이어지는 방울의 경계가 매우 명확했으며, 방울에는 아무것도 포함하지 않거나 결정 또는 침전물이 포함되어 있습니다(그림 6B). 종자의 첨가(도 6D)는 또한 종자가 없는 방울과 비교하였을 때Xn 을 크게 증가시켰다(도 6C). 이러한 모든 결과를 종합하여 30%(w/v) PEG 6,000 및 100mg/mL 엔도티아펩신에서 배치 및 시드 배치 프로토콜을 모두 확장하기로 결정했습니다.
초기 테스트 스케일링은 24웰 행잉 드롭 플레이트에서 수행되었습니다. 결정화 거동의 변화를 관찰할 수 있도록 적하 부피가 점진적으로 증가했습니다(그림 7). 알 수 있는 바와 같이, 시드되지 않은 방울과 시드된 방울 모두에서 결정 성장이 일어났습니다. 씨를 뿌리지 않은 모든 방울은 다양한 결정 크기로 성장했지만 주로 큰 결정 (100-200 μm - 가장 긴 치수)을 성장했습니다. 그러나 시드 된 방울은 더 작은 결정 (5 - 50 μm - 가장 긴 치수)을 생성했습니다. 이러한 초기 테스트는 종자가 Xs를 감소시키는 데 필요하지만 이 조건이 더 큰 부피에 적합해야 함을 시사했습니다.
부피가 200 μL로 증가되었을 때, 결정화 부피는 결정 성장 동안 연속적으로 교반되었다. 이러한 교반의 주된 이유는 결정화 용액이 균질하게 유지되고 성장하는 결정이 튜브의 바닥이나 측면에 침전되지 않도록 하기 위함이었습니다. 결정의 침전은 매우 크고 작은 결정을 모두 가진 이질적인 결정 집단으로 이어질 수 있습니다. 결정화 용액을 교반하는 것은 또한 핵형성을 촉진할 수 있다(44,45).
불행하게도, 씨를 뿌리지 않은 30%(w/v) PEG 6,000은 결정을 생성하지 않았으므로 PEG 농도는 35%(w/v)로 증가했습니다. 이 증가는 결정화를 현저하게 개선하여 최종 Xn 및 Xs 범위가 각각 3.6 ±1.2 x 10 6 결정·mL-1 및 42 ± 4.1 μm였습니다(그림 8A 및 B - 검정색). 상당한 개선과 허용 가능한 결정 농도에도 불구하고 최종 결정이 계획된 실험에 비해 너무 커서 추가 최적화가 수행되었습니다. 최종 결정의 크기를 줄이기 위해 두 가지 방법이 모색되었습니다 (그림 1E) : 최종 결정 성장을 제한하기 위해 단백질 농도를 낮추고 (그림 8A 및 B - 핫 핑크), 핵 형성을 시도하고 증가시키기 위해 PEG 농도를 증가시킵니다 (그림 8A 및 B - 녹색).
불행하게도 단백질 농도의 감소는 또한Xn을 극적으로 감소시켰고, 이는 궁극적으로 훨씬 더 큰 결정을 생성했습니다. PEG 농도를 40%로 증가시키면 각각 3.1 ± 0.7 x 106 결정·mL-1 및 39 ± 2.3μm의 최종Xn 및 Xs 범위가 생성되었습니다. 이들은 35%와 크게 다르지 않았지만, 최종 결정 크기가 감소되었기 때문에, 이 조건은 추가적인 최적화와 함께 계속되었다.
Xn을 증가시키기 위해, 종자를 첨가하였다. 이것은Xn(1.1 ± 1.8 x 108 결정·mL-1)을 극적으로 증가시키고 더 작은Xs(4.2 ± 4.0 μm)로 이어집니다(그림 8A 및 B - 보라색 점선). 이 결정은 일부 연속 결정학 실험에 매우 적합하지만 너무 작은 것으로 간주되어 첨가 된 종자의 농도가 변경되었습니다.
그러나 추가된 종자 스톡의 이러한 조정은 안정적으로 반복하기 어려운 것으로 판명되었습니다. 따라서 담금질이 시도되었습니다. 시드 스톡을 첨가한 후, 결정 크기를 모니터링하고, 일단 적절한 결정 크기(약 10 - 20 μm)가 달성되면, 배치 결정화를 담금질하였다(도 8C 및 D). 소냉은 미세 결정화와 관련하여 Kupitz et al. (2014)25. 단백질 용액이 궁극적으로 낭비되기 때문에 이상적인 방법은 아닐지 모르지만26), 결정 성장을 제어하기 어려웠기 때문에 이 기술은 이러한 상황에서 매우 유용했습니다. 담금질의 기본 개념은 결정화 혼합물을 용해도 선 바로 위의 지점으로 빠르게 되돌리는 것입니다(그림 1F). 용액이 용해도 라인으로 돌아오면 용액은 안정적인 포화 용액으로 돌아가고 더 이상의 결정 성장이 발생하지 않습니다.
결정화 반응을 담금질하려는 시도는 위험하지 않습니다. 담금질 용액을 너무 많이 첨가하면 용액의 단백질이 너무 희석되어 용해도 선이 통과 할 수 있습니다. 이 경우 용액이 과포화되고 결정이 용해되기 시작합니다. 이를 방지하기 위해, 형태그램 결과에 기초하여 필요한 담금질 용액의 양을 추정할 수 있다. 담금질 시점에서 단백질 용액의 농도를 취하십시오. 용해도 라인에서의 단백질 농도와 용액 중의 단백질 농도를 비교함으로써, 필요한 희석의 추정이 이루어질 수 있다.
40%(w/v) PEG 6,000, 10 x 희석 종자 실험의 담금질 버전은 각각 2.6 ± 3.1 x 106 결정·mL-1 및 15 ± 3.9 μm의 최종 결정 농도 및 크기 범위를 제공했습니다.
전체 공정에 걸쳐 엔도티아펩신 결정의 테스트 X선 데이터 수집은 10 x 30μm 초점, 12.4keV의 에너지가 80% 감쇠된 극저온 조건을 사용하여 스위스 광원 PXII 빔라인에서 수집되었습니다. 데이터는 다이얼을 사용하여 처리되었으며 그림 9 는 CC1/2의 비교를 보여줍니다. 최적화 과정에서 CC1/2 의 극적인 변화는 관찰되지 않았습니다.
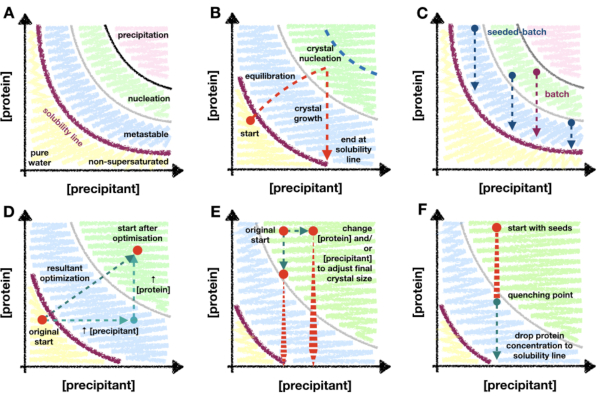
그림 1: 전이 및 배치 결정화와 위상 다이어그램에 매핑된 스케일링 방법에 대한 개요. A . 아니요. 전형적인 단백질 결정화 단계 다이어그램의 영역과 한계. 침전물 및 단백질 농도는 각각 x 축과 y 축에 표시되며, 순수 지점이 원점에 있습니다. 보라색 선은 단백질 과포화 경계를 나타내고 준안정, 핵형성 및 침전 영역은 각각 파란색, 녹색 및 분홍색으로 표시됩니다. 비. 증기 확산과 같은 '전이 단계' 결정화 방법의 핵 형성 영역 침투 한계의 예. 이 이론적 실험에서 강하 침전제 및 단백질 농도는 용해도 선 바로 아래에서 시작되며 아직 과포화되지 않았습니다. 방울이 평형을 이루는 동안, 방울 성분 농도가 증가하여 방울이 과포화 상태가 되고 핵 형성 영역으로 계속 이동하거나 전이됩니다. 결정 핵 형성시 용액의 단백질 농도가 떨어지기 시작합니다. 결정이 성장함에 따라 농도는 마침내 용해도 라인에서 멈출 때까지 계속 떨어집니다. 파란색 점선은 핵 형성 영역으로의 전환의 이론적 한계를 표시합니다. 핵 형성이 시작되자마자 단백질 농도가 떨어지고 더 이상의 침투를 방지합니다. 씨. 배치 및 시드 배치 결정화 궤적의 예. 배치에서 단백질과 침전제의 혼합은 결정 성장이 발생할 수 있도록 핵 형성 영역 내에 과포화 용액을 생성해야 합니다. 시드 배치에서는 마이크로 시드의 추가로 인해 핵 형성 영역에 있을 필요가 없으므로 준안정 영역의 위치도 탐색할 수 있습니다. 디. 증기 확산에서 배치까지 B 에 표시된 결정화 실험의 가상 최적화. 원래의 증기 확산 시작점은 결과 최적화 벡터를 통해 새로운 시작 위치로 전환되었습니다. 핵 형성 영역 내부. 결과 벡터는 단백질과 침전제 농도의 증가라는 두 가지 최적화의 산물입니다. E . 아니요. 최종 X, n 및Xs를 조정하기 위해 배치 조건을 조정할 때의 최적화를 예로 들 수 있습니다. 에프. 결정화 완충액을 첨가하여 결정화 실험을 급냉한다. 담금질이 준안정 영역에서 단백질 농도를 빼앗지 않아 단백질 과포화점 아래로 떨어지지 않는 것이 중요합니다. 그렇지 않으면 결정이 용액으로 다시 용해되기 시작합니다. 비. 및 C . Beale et al. (2019)26 저자의 허가를 받아. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
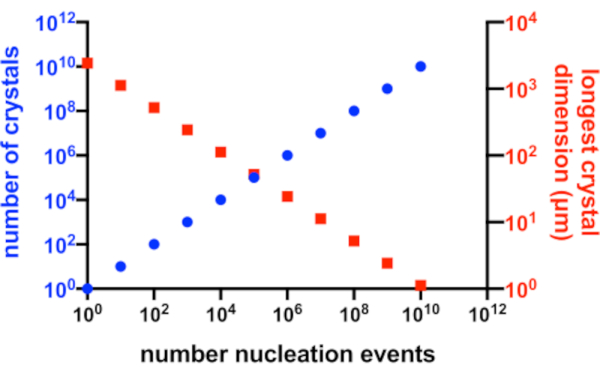
그림 2: Xn 증가 및 Xs 감소. 결정화 실험에서 생성된 결정의 수와 평균 최장 차원 사이의 이상적인 관계입니다. 이 그래프를 만들기 위해 가상의 10kDa 모델 단백질의 결정화가 사용되었습니다. 단백질은 10mg/mL의 농도로 결정화되어 49x50x51 Å 크기의 P2 1 2 1 2 1결정을 생성했습니다. 모든 핵 형성 사건은 결정을 산출하는 것으로 가정되었습니다. 결정 성장은 모든 면에서 균질한 것으로 가정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
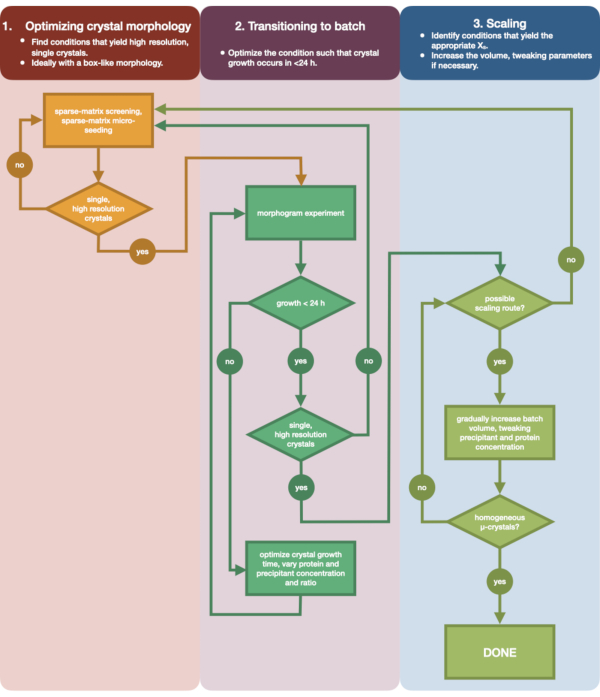
그림 3: 소량(<500 nL) 증기 확산 실험에서 성장한 결정을 대용량(> 100 μL) 배치 실험으로 최적화하는 단계를 보여주는 순서도. 결정 최적화는 세 단계로 나뉩니다 : (1) 결정 형태 최적화. (2) 배치로 전환. (3) 스케일링. 1단계에서는 미세 결정화에 적합한 결정을 식별하는 것이 중요합니다. 일부 단백질은 결정화 조건에 관계없이 단결정 형태로만 존재합니다. 그러나 단일의 정육면체와 같은 결정을 생성하거나 인간이 가능한 한 이에 가까운 조건을 찾는 것이 좋습니다. 가설적으로나 일화적으로나 단일한 정육면체와 같은 결정은 일반적으로 일련의 결정학 실험에서 더 나은 결과를 얻을 수 있습니다. 결정 형태가 선택되고 회절이 확인되면 결정화 실험을 증기 확산에서 배치로 이동해야 합니다(2단계). 여기서 결정은 핵 형성 시간에 따라 최적화되어야 합니다. 목표는 빠르게 나타나는 결정(> 24시간)을 생성하는 조건을 찾는 것인데, 이러한 조건은 핵 형성 영역에 즉시 도달할 가능성이 높기 때문에 배치됩니다. 핵 형성 영역의 조건이 발견되면 형태소법을 만들 수 있습니다. 형태도는 핵 형성 영역의 대부분을 매핑하고 3단계에 대해 식별된 잠재적 확장 경로를 허용합니다. 식별된 배치 조건의 부피는 >100 μL의 최종 부피를 산출하기 위해 크기를 점진적으로 또는 빠르게 조정할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: PACT 희소 매트릭스 스크린에서 엔도티아펩신 결정화 조건 분석. A. 및 B.는 각각 PACT 스크린으로부터 웰 A4 및 C10의 24시간 후의 사진이다. 결정화 버퍼 성분은 그림에 강조 표시되어 있습니다. SPG 완충액은 숙신산, 인산이수소나트륨, 글리신을 2:7:7 몰비로 혼합한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
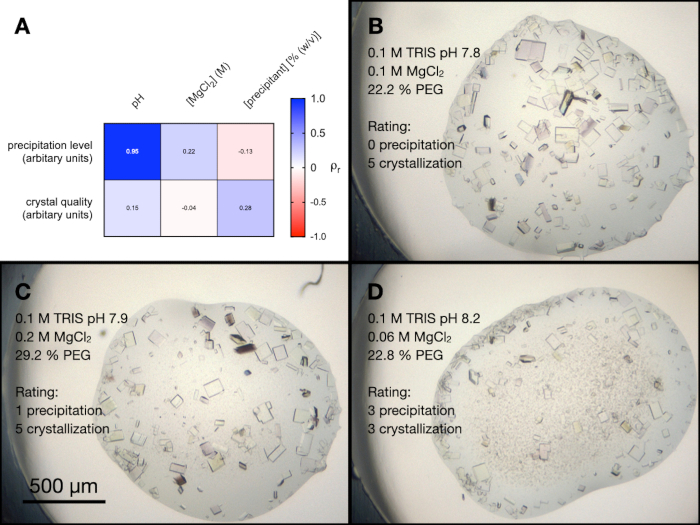
도 5: PACTMgCl2 조건으로부터의 엔도티아펩신 결정화 최적화의 분석. A. 아니요. 버퍼 pH,MgCl2 농도, 침전제 농도와 침전 수준 및 결정 품질 간의 Pearson 상관 분석 결과의 히트 맵입니다. 강수량 수준과 결정 품질은 모두 24시간 후에 0-5(0은 결정 또는 침전이 없음)의 척도로 임의로 평가되었습니다. 및 D. 3개의 상이한 방울에서의 결정화 및 침전의 예를 보여준다. 결정화 조건과 침전 수준 및 결정 품질에 대한 평가도 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
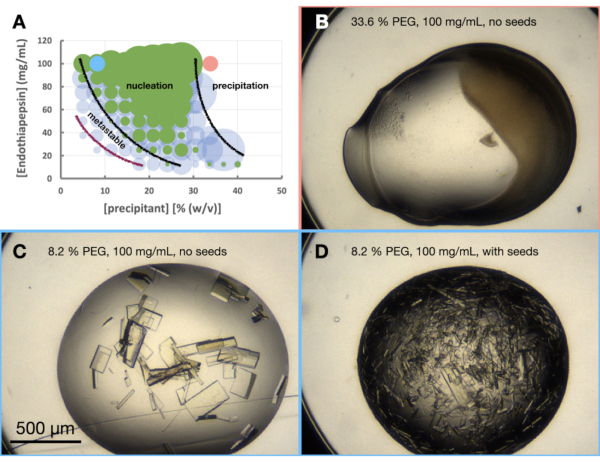
도 6: 0.1 M Tris-HCl pH 7.0, 0.15 MMgCl2 및 PEG 6,000에서 결정화되었을 때의 엔도티아펩신 형태도. A. 아니요. 제공된 "phase-diagram-generator" 스프레드시트에서 생성된 형태소도입니다. 각 방울의 상대적인 결정 수는 원의 크기로 표시되며 방울 1(단백질 및 침전제)과 방울 2(단백질, 침전제 및 종자)의 결과는 각각 녹색과 파란색으로 강조 표시됩니다. x축과 y축에 있는 단백질 및 침전제 농도의 값은 각각 최종 부피가 아닌 각각의 미리 혼합된 값을 나타냅니다. 그 결과를 바탕으로 각각 핵형성 영역과 준안정 영역의 경계를 나타내기 위해 검은색 선과 보라색 선이 그려졌습니다. B.씨. D. 실험의 몇 가지 예제 결과를 보여줍니다. A.에 표시된 빨간색과 파란색 점은 B.와 C 의 위치를 나타냅니다.및 D., 각각. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 24웰 행잉 드롭 플레이트에서 엔도티아펩신의 초기 스케일링 시험. 동일한 단백질 및 침전제 농도가 모든 트레일에 사용되었습니다: 0.1M Na 아세테이트 pH 4.6 및 0.1M Tris-HCl pH 7.0, 0.15MMgCl2 및 30%(w/v) PEG 6,000에서 각각 100mg/mL 엔도티아펩신. 표시된 모든 이미지는 24시간 후에 촬영되었으며 최종 드롭 볼륨은 각 이미지에 레이블이 지정됩니다. 왼쪽 패널(A, D, G)은 단백질과 침전제의 1:1 혼합, 중간 패널(B, E, H)은 종자, 침전제, 단백질의 1:2:3 혼합, 오른쪽 패널(C, F, I)은 중간 패널의 확대 이미지입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
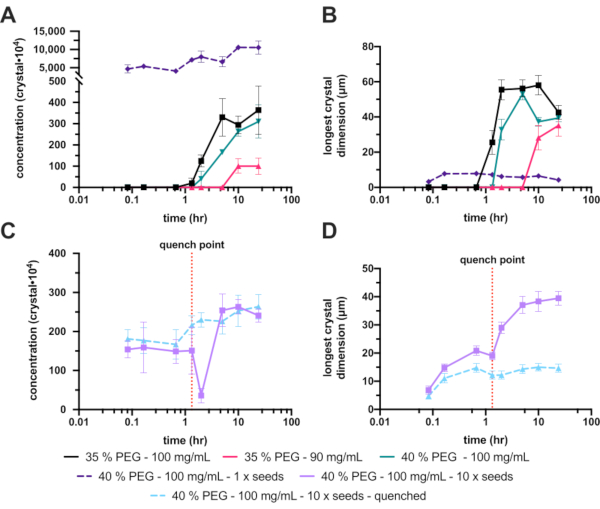
도 8: 200-300 μL 부피의 엔도티아펩신 미세결정화 분석. A. 및 C.는 실험 시간에 걸쳐Xn이 어떻게 변화하였는지를 보여준다. 비. D. X s (가장 긴 치수)가 시간이 지남에 따라 어떻게 변했는지 보여줍니다. 실험 결과는 명확성을 위해 분리되었습니다. C.와 D.의 빨간색 점선은 담금질이 수행된 지점을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
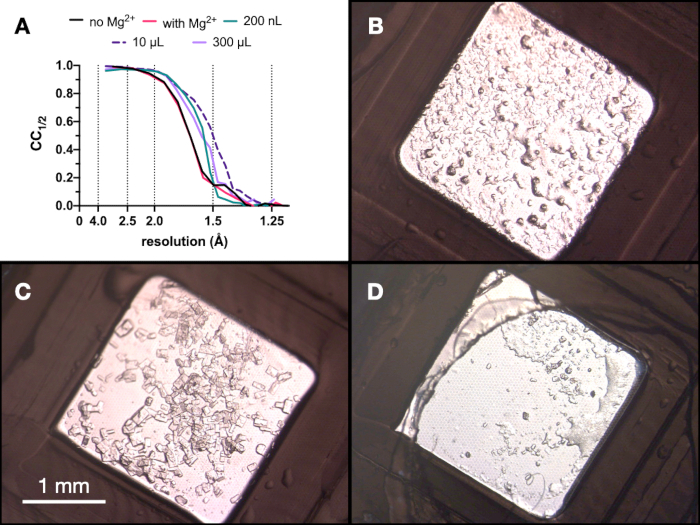
그림 9: 회절 품질을 평가하기 위한 미세 결정화 공정의 각 단계에서 얻은 결정의 CC1/2 결과 및 이미지. A. 아니요. 성장된 결정에서 수집된 데이터에서 분리능에 대해 플롯된 CC 1/2: Mg 유무에 관계없이 - 200nL 부피, 10μL 부피 및 최종 300μL 부피에서 1단계 최적화의 일부입니다. BC와 D.는 각각 200 nL, 10 μL 및 300 μL 부피의 결정을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 단백질 정보 | |
| 단백질 | 엔도티아펩신 |
| 분자량 (kDa) | 33.8 |
| 스페이스 그룹 | P12 11 |
| ᅡ, ᅡ, ᅡ (ᅡ) | 45.2, 73.3, 52.7 |
| α, β, ɣ (°) | 90.0, 109.2, 90.0 |
| 고정 대상 매개 변수 | |
| 칩당 로드된 부피(μL) | 150 |
| 칩당 Aperatures | 25,600 |
| 필요한 결정 농도(결정/mL) | 500,000 |
| 샘플 정보 | |
| 200 μL의 시료를 만드는 데 사용되는 단백질 질량(mg) | 10 |
| 크리스탈 최장 치수 (μm) | 15 |
| 결정 농도(crystals/mL) | 2,500,000 |
| 실험 변수 | |
| 필요한 시점 수 | 5 |
| 시점당 필요한 이미지 수 | 50,000 |
| 적중률(통합 패턴/수집된 이미지) | 0.3 |
| 시점당 필요한 고정 목표값(반올림) | 7 |
| 샘플 요구 사항 | |
| 시점당 필요한 시료량(μL) | 1,050 |
| 실험에 필요한 총 시료량(mL) | 5.25 |
| 필요한 단백질의 총 질량(mg) | 52.5 |
표 1: 샘플 요구 사항의 예amp고정 타겟을 사용하여 수행된 가상의 광학 펌프-프로브 실험에 대한 요구 사항. 이 이론적 실험에 사용된 단백질은 엔도티아펩신(endothiapepsin)이었다. 고정 표적 매개변수는 Ebrahim et al. (2019)48 및 Davy et al. (2019)49. 샘플 정보는 이 비디오 기사에 보고된 프로토콜에서 가져왔으며 실험 변수는 실제 경험을 기반으로 한 보수적인 추정치였습니다. 다음 샘플 요구 사항은 이전 가정을 고려하여 이후에 계산되었습니다.
토론
제시된 방법은 희소 매트릭스 96웰 스크린에서 성장한 큰 결정(≥ 100μm 가장 긴 치수)에서 배치를 통해 원심분리기 튜브(300μL 부피)에서 성장한 미세 결정까지 엔도티아펩신의 결정화를 최적화하는 방법을 보여줍니다. 이 프로토콜의 이면에 있는 아이디어는 엔도티아펩신을 최적화하기 위해 취한 단계가 다른 단백질에도 사용될 수 있다는 것입니다. 궁극적으로, XFEL 및 싱크로트론에서 연속 결정학 실험을 위해 대량(>100μL)의 미세 결정(10-20μm)을 생성하는 문제에 답합니다.
이 프로토콜은 대용량 미세 결정화 작업을 (1) 결정 형태 최적화, (2) 배치로의 전환 및 (3) 스케일링의 세 단계로 나눕니다. 1단계에서는 단백질이 생성할 수 있는 결정 형태의 범위를 증기 확산판에서 탐색해야 합니다. 필요한 분해능으로 회절하는 단일 상자형 결정을 생성하는 조건이 목표가 되어야 합니다. 2단계에서 선택한 조건을 증기 확산에서 배치로 변환할 수 있습니다. 여기서, 최적화 기준은 결정 성장 시간 및 24시간 이내에 단백질 결정을 발생시키는 조건을 찾는 것이다. 형태소도는 또한 실험자에게 용해도 선과 핵 형성 영역 경계의 위치에 대한 아이디어를 제공할 수 있습니다. 이 형태소도는 3단계, 스케일링에서 매우 유용합니다. 형태도는 핵 형성만으로도Xn 을 증가시키고Xs를 감소시킬 수 있는지 여부를 나타냅니다. 실험의 부피가 증가함에 따라,Xn 및Xs 는 스케일링 성공의 핵심 기준으로서 연속적으로 평가될 수 있다.
엔도티아펩신의 경우, 1단계에서는 엔도티아펩신에 대해 이전에 알려지지 않은 결정 형태가 무엇인지 발굴했습니다. 이 형태는 이전에 보고된 것과 동일한 공간군을 가졌지만 중요한 것은 직렬 결정학의 경우 더 상자와 같은 모양이었습니다. 단결정은 또한 다른 조건에서 생성된 팬과 달리 단일 핵 형성 지점에서 성장하는 것처럼 보였습니다(그림 4). 선택된 조건에 대해, 단계 2는 < 24 h에서 결정 성장이 발생함에 따라 이미 부분적으로 만족되었다. 형태소도는 3단계에서 스케일링할 때 직선 또는 시드 배치 프로토콜이 모두 성공할 수 있음을 나타냅니다. 직선 배치의 초기 스케일링은 각각 3.6 ± 1.2 x 106 결정·mL-1 및 42 ± 4.1μm의 Xn 및 Xs 범위를 갖는 결정을 생성하는 조건을 생성했습니다. 이러한 결정은 일부 연속 결정학 실험에 적합하지만 너무 큰 것으로 간주되었습니다. 따라서 추가 최적화가 수행되었습니다. 최종 프로토콜은 각각 3.1 x 106 결정·mL-1 및 15 ± 3.9μm의 농도 및 크기 범위를 가진 결정을 생성했습니다. 이것은 계획된 실험에 이상적이었습니다.
이 방법은 증기 확산 플레이트에서 성장한 '용해성' 단백질 결정을 배치로 변환하는 데 중점을 둡니다. 이렇게 초점을 맞추는 이유는 대부분의 가용성 단백질 결정이 증기 확산을 통해 성장하기 때문이다26. 그러나 제시된 개념은 마이크로 배치와 같은 다른 방법을 사용하여 성장한 가용성 단백질 결정에도 적용될 수 있습니다. 이 개념은 LCP에서 성장한 막 단백질 결정에도 적용할 수 있습니다. 이것 역시 배치 결정화 과정이기 때문입니다.
프로토콜의 주요 측면은 증기 확산 플레이트에서 성장한 결정의 조건을 일괄적으로 성장할 수 있도록 변환하는 과정입니다. 이 변환을 위해 이 방법은 Beale et al. (2019)26. 증기 확산 플레이트에서도 배치 공정을 통해 성장한 결정은 빠르게 형성됩니다(< 24시간). 이 기준은 증기 확산 낙하 평형 속도를 기반으로 한 근사치이며 PEG 기반 침전제 조건에 가장 적합합니다. 그러나, 결정화 조건은 평형 시간에 영향을 미칠 매우 다양한 화합물을 함유할 것이다. 염 기반 결정화 조건(예: 고농축 염화암모늄)의 평형은 1-2일 내에 발생할 수 있습니다. 따라서 24시간 기준은 염분 기반 조건에서는 사실이 아닐 수 있습니다. 염-기반 조건들은 또한 이 프로토콜에 제시된 원형에 부합하지 않을 수 있는 더 복잡한 위상 다이어그램들(26, 30)을 가질 수 있다. 더 큰 볼륨으로 스케일링하는 것이 불가능한 것으로 판명되면 소금 기반 조건에 대한 시간 기준을 12시간 또는 6시간으로 줄여야 할 수 있습니다.
이 방법의 또 다른 한계는 명백한 복잡성입니다. 엔도티아펩신의 미세 결정화를 최적화하기 위해 따랐던 프로토콜은 실제로 희소 매트릭스 스크린에서 원래 조건을 상대적으로 거의 변경하지 않았습니다. PACT 스크린에서 관찰된 첫 번째 히트는 0.1 HEPES pH 7.0, 0.2 MMgCl2 및 20%(w/v) PEG 6,000이었다. 최종 스케일링된 결정화 완충액은 0.1 Tris-HCl pH 7.0, 0.15 MMgCl2 및 40%(w/v) PEG 6,000이었다. 또한 HEPES에서 Tris-HCl 및 MgCl2 농도로의 완충액 변화가 공정의 성공에 거의 기여하지 않았을 가능성이 매우 높습니다. PEG 6,000 농도의 증가를 유일한 최적화로 남겨두고 아주 간단하게 달성할 수 있었습니다.
그러나 이 평가는 너무 단순합니다. 스케일링 중에 발생하는 문제(즉, 종자 사용 및 담금질)를 할인할 뿐만 아니라 이 단백질이 간단하다는 것이 입증되었기 때문에 다음 단백질도 입증될 것이라는 보장이 없다는 사실도 할인합니다. 프로토콜에서 권고된 단계는 단백질 결정화 부피의 스케일링을 최적화하는 것이 매우 단백질 비용이 많이 들 수 있기 때문에 고안되었습니다. 제시된 7번의 엔도티아펩신 스케일링 시험에서 100mg의 단백질이 소비되었습니다. 틀림없이 이러한 단계 중 일부는 이 프로토콜에 비추어 그 결과를 보여주기 위해 수행되었습니다. 그럼에도 불구하고 단백질 100mg과 실험 중에 소비되는 단백질에 대해 잠재적으로 50mg을 추가로 섭취하는 경우(표 1)는 시간이나 비용에 상당한 투자가 될 수 있습니다.
다행스럽게도 이 대량의 필수 샘플이 모든 단백질에 걸쳐 어디에나 있다는 것은 분명하지 않습니다. 엔도티아펩신은 용해성이 높았기 때문에 과포화에 도달하기 위해 큰 단백질 농도가 필요했습니다. 다른 경우(현재 최적화 중) 과포화는 10 또는 5mg/mL에서 도달할 수 있습니다. 이러한 변수는 단백질에 따라 다르며 나타날 때 수용해야 합니다.
이 방법의 다른 한계로는 스크린 및 플레이트 생성을 위한 액체 처리 로봇과 필요할 때 플레이트를 자동으로 이미지화하는 이미저와 같은 복잡한 장비에 대한 의존도가 있습니다. 이러한 장비 중 일부의 필요성을 제한하기 위해 대체 루틴이 제공되었지만 프로토콜이 없으면 따르는 데 더 많은 시간이 소요됩니다. 이 프로토콜은 또한 최적화된 결정의 회절 테스트를 제안합니다. 싱크로트론에 정기적으로 접근할 수 없는 결정학자의 경우 이러한 테스트는 어려울 수 있습니다. 모든 단계에서 제어가 필요한 것은 아니지만 적중이 식별되고 사전 및 사후에 이러한 테스트를 수행하는 것이 좋습니다. 안타깝게도 XFEL에서 회절하지 않는 결정은 드문 일이 아닙니다. 이를 감안할 때 결정 회절에 대한 가정에 대해 주의를 기울이는 것이 좋습니다.
궁극적으로, 여기에 제시된 이 프로토콜과 결과는 일련의 결정학 실험을 위한 샘플 생산에 어려움을 겪고 있는 사람들에게 가이드, 아이디어 및 예를 제공할 것입니다. 바라건대, 직렬 결정학이 추가로 개발됨에 따라 기술의 샘플 요구가 줄어들어 이와 같은 프로토콜의 필요성이 줄어들 것입니다. 그러나 이 경우에도 여기에 제시된 전략은 단백질의 결정화 공간을 탐색하려는 사람들에게 여전히 유용할 것입니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 프로젝트는 Marie Skłodowska-Curie 보조금 계약 No 701647에 따라 유럽 연합의 Horizon 2020 연구 및 혁신 프로그램으로부터 자금을 받았습니다. Swiss Light Source beamline X10SA-PXII의 빔라인 과학자들의 도움과 지원에 깊은 감사를 드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Swissci 96-well 2-Drop plates | Molecular Dimensions | MD11-002 | 96-well 2-drop crystallisation plate |
| Swissci 96-well 3-Drop plates | Molecular Dimensions | MD11-003 | 96-well 3-drop crystallisation plate |
| mosquito LCP liquid handling robot | sptlabtech | mosquito LCP | Crystallisation robot |
| ClearVue Sheets | Molecular Dimensions | MD6-015 | 96-well crystallization plate seals |
| Safe-Tube 1.5 mL | Eppendorf | 30120086 | 1.5 mL centrifuge tubes |
| Scaple | Swan and Morton | No. 3 scalple and No. 3 handle | Scalple for cutting open plate seals |
| MS 3 Vortex | IKA | 3319000 | Vortex for mixing solution and making seed stocks |
| 24-well XRL Plate | Molecular Dimensions | MD3-11 | 24-well hanging-drop plates |
| Tube revolver/rotator | Thermo Fischer Scientific | 88881001 | Tube revolver for mixing solution during scaling |
| Eppendorf Research plus pipettes | Eppendorf | Range of manual pipettes, 0.5-10, 1-20, 10-100, 100-1000 µL | |
| Eppendorf pipette tips | Eppendorf | Range of tip sizes for manual pipettes | |
| Suparen 600 | Prochem AG | Suparen 600 | Endothiapepsin solution |
| Sodium Acetate | Sigma-Aldrich | 241245-1KG | Sodium Acetate |
| Tris | Merck | 8382T014 | Tris |
| Magnesium Chloride | Sigma-Aldrich | M2670-1kg | Magnesium Chloride |
| PEG 6,000 | Sigma-Aldrich | 81255-1kg | PEG 6,000 |
| Ethelyene glycol | Sigma-Aldrich | 324558-1L | Ethelyene glycol for cyro-protecting the crystals |
| PACT Premier HT screen | Molecular Dimensions | MD1-36 | PACT Premier 96-well crystal screen |
| DOW CORNING high vacuum grease | Molecular Dimensions | MD6-02 | Grease for sealing 24-well plates |
| Hirschmann 22 x 22 mm glaser cover slides | Hirschmann | 8000104 | Cover slides for sealing 24-well sitting drop plates |
| Crystal pins | PSI | Manufactured inhouse | Thin-film supports for micro-crystals. |
| 1-1.3 mm SiLibeads Type S | Faust | 6239547 | Glass beads for making mico-seed stocks |
| Macbook Pro | Apple | Macbook Pro | Computer for performing data analysis |
| CCP4 software suite | CCP4 | Diffraction pattern data processing software | |
| Excel | Microsoft | Microsoft Office | Plotting tool for phase diagram |
| Hausser Scientific Bright-Line counting chamber | Thermo Fischer Scientific | 02-671-51B | Tool to calculate crystal concentration |
| PACT Premier | Molecular Dimensions | MD1-29-ECO | Sparse-matrix crystallization screen |
| Rock Imager | Formulatrix | Rock Imager | Temperature controlled crystal plate storage and imager |
| Rock MakerWeb | Formulatrix | Rock MakerWeb | Crystal plate creation and image storage stoftware |
| Formulator | Formulatrix | Formulator | 96-well crystal screen creation liquid handling robot |
| Leica MZ16 Microscope | Leica | Leica MZ16 | Light microscope |
| LAS V4.6 | Leica | LAS V4.6 | Software for Leica microscopes |
| Spectra/Por 3.5 kDa dialysis tubing | Spectrumlabs | Spectra/Por 3 Dialysis Membrane | 3.5 kDa dialysis membrane |
| Dialysis tubing closures | Spectrumlabs | Spectra/Por 3 Duniversal Closures | Clips to seal the dialysis tubing ends |
| Amicon 10 kDa centrifugal concentrator | Merck-Millipore | Amicon Ultra-15 10 kDa centrifugal concentrator | 10 kDa centrifugal filter |
| 5810 R swing bucket centrifuge | Eppendorf | 5810 R Centrifuge | Swing bucket centrifuge |
참고문헌
- DePonte, D. P., et al. Gas dynamic virtual nozzle for generation of microscopic droplet streams. Journal of Physics D: Applied Physics. 41 (19), 195505 (2008).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Scientific Reports. 4 (1), 6026 (2014).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature Communications. 5 (1), 1-6 (2014).
- Roessler, C. G. G., et al. Acoustic Injectors for Drop-On-Demand Serial Femtosecond Crystallography. Structure. 24 (4), 631-640 (2016).
- Sherrell, D. A., et al. A modular and compact portable mini-endstation for high-precision, high-speed fixed target serial crystallography at FEL and synchrotron sources. Journal of Synchrotron Radiation. 22 (6), 1372-1378 (2015).
- Roedig, P., et al. A micro-patterned silicon chip as sample holder for macromolecular crystallography experiments with minimal background scattering. Scientific Reports. 5 (1), 1-11 (2015).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Nango, E., et al. A three-dimensionalmovie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Halle, B. Biomolecular cryocrystallography: structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Fraser, J. S., et al. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Fenwick, R. B., van den Bedem, H., Fraser, J. S., Wright, P. E. Integrated description of protein dynamics from room-temperature X-ray crystallography and NMR. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 445-454 (2014).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. Elife. 4, (2015).
- Thomaston, J. L., et al. XFEL structures of the influenza M2 proton channel: Room temperature water networks and insights into proton conduction. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 13357-13362 (2017).
- Haas, D. J., Rossmann, M. G. Crystallographic studies on lactate dehydrogenase at -75 °C. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26 (7), 998-1004 (1970).
- Hope, H. Cryocrystallography of biological macromolecules: a generally applicable method. Acta Crystallographica Section B Structural Science. 44 (1), 22-26 (1988).
- Wu, W., et al. Batch crystallization of rhodopsin for structural dynamics using an X-ray free-electron laser. Acta Crystallographica Section:F Structural Biology Communications. 71 (7), 856-860 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and delivery of protein microcrystals in lipidic cubic phase for serial femtosecond crystallography. Journal of Visualized Experiments. (115), e54463 (2016).
- Andersson, R., et al. Well-based crystallization of lipidic cubic phase microcrystals for serial X-ray crystallography experiments. Acta Crystallographica Section D: Structural Biology. 75 (10), 937-946 (2019).
- Luft, J. R., et al. The detection and subsequent volume optimization of biological nanocrystals. Structural Dynamics. 2 (4), 041710 (2015).
- Lee, D. B., et al. Supersaturation-controlled microcrystallization and visualization analysis for serial femtosecond crystallography. Scientific Reports. 8 (1), 1-10 (2018).
- Kupitz, C., et al. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1647), 20130316 (2014).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Rayment, I. Small-scale batch crystallization of proteins revisited: An underutilized way to grow large protein crystals. Structure. 10 (2), 147-151 (2002).
- García-Ruiz, J. M. Nucleation of protein crystals. Journal of Structural Biology. 142 (1), 22-31 (2003).
- McPherson, A., Kuznetsov, Y. G. Mechanisms, kinetics, impurities and defects: Consequences in macromolecular crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (4), 384-403 (2014).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta crystallographica. Section F, Structural biology communications. 71, 247-260 (2015).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D Biological Crystallography. 55 (5), 988-993 (1999).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta crystallographica. Section D, Biological crystallography. 60 (3), 601-605 (2004).
- Forsythe, E. L., Maxwell, D. L., Pusey, M. Vapor diffusion, nucleation rates and the reservoir to crystallization volume ratio. Acta Crystallographica Section D Biological Crystallography. 58 (10), 1601-1605 (2002).
- Chayen, N. E., Shaw Stewart, P. D., Maeder, D. L., Blow, D. M. IUCr An automated system for micro-batch protein crystallization and screening. Journal of Applied Crystallography. 23 (4), 297-302 (1990).
- Chayen, N. E., Shaw Stewart, P. D., Blow, D. M. Microbatch crystallization under oil - a new technique allowing many small-volume crystallization trials. Journal of Crystal Growth. 122 (1-4), 176-180 (1992).
- Chayen, N. E. Comparative studies of protein crystallization by vapour-diffusion and microbatch techniques. Acta Crystallographica Section D: Biological Crystallography. 54 (1), 8-15 (1998).
- D'Arcy, A., Mac Sweeney, A., Stihle, M., Haber, A. The advantages of using a modified microbatch method for rapid screening of protein crystallization conditions. Acta Crystallographica - Section D Biological Crystallography. 59 (2), 396-399 (2003).
- Darmanin, C., et al. Protein crystal screening and characterization for serial femtosecond nanocrystallography. Scientific Reports. 6, 25345 (2016).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2247-2252 (2017).
- Cheng, R. K. Y. Towards an optimal sample delivery method for serial crystallography at XFEL. Crystals. 10 (3), 215 (2020).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. 2013, 1-10 (2013).
- Oberthuer, D., et al. Double-flow focused liquid injector for efficient serial femtosecond crystallography. Scientific Reports. 7 (1), 44628 (2017).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- Yaoi, M., et al. Effect of stirring method on protein crystallization. Japanese Journal of Applied Physics, Part 2: Letters. 43 (10), 1318 (2004).
- Castro, F., Ferreira, A., Teixeira, J. J., Rocha, F. Influence of Mixing Intensity on Lysozyme Crystallization in a Meso Oscillatory Flow Reactor. Crystal Growth & Design. 18 (10), 5940-5946 (2018).
- Moews, P. C., Bunn, C. W. An X-ray crystallographic study of the rennin-like enzyme of Endothia parasitica. Journal of Molecular Biology. 54 (2), 395-397 (1970).
- Newman, J., et al. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta crystallographica. Section D, Biological. 61, 1426-1431 (2005).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D Structural Biology. 75, 151-159 (2019).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유