Method Article
인간 심장 병리학을 연구하기 위하여 체외 생체 공학심장 조직에서와 같이 심장 스페로이드
요약
이 프로토콜은 매달려 방울에 세포를 공동 배양하여 3D 심장 스페로이드 (CSs)를 제조하는 것을 목표로합니다. 콜라겐 임베디드 CS는 심부전을 모델링하기 위해 생리적 농도에서 독소루비신(DOX, 심독성 제) 으로 치료됩니다. DOX 처리된 CS를 사용하여 시험에서 시험은 심부전 환자를 위한 새로운 치료를 확인하기 위하여 이용될 수 있습니다.
초록
심장 조직 공학에 있는 몇몇 진보에도 불구하고, 극복하기 위하여 중요한 도전의 한은 생물 공학한 심장 조직 내의 산소와 양분을 제공하기 위하여 복잡성의 몇몇 수준을 포함하는 완전 기능적인 혈관 네트워크의 생성남아 있습니다. 우리의 실험실은 "심장 스페로이드" 또는 "CS"로 알려진 인간의 심장의 입체 체외 모델을 개발했습니다. 이것은 인간 적인 심혼의 전형적인 생화학, 생리학 및 약리학 특징을 제시하고 심장 심근세포, 내피 세포 및 섬유아세포와 같은 그것의 3개의 중요한 세포 모형을 공동 배양하여 생성됩니다. 인간 유도만능 줄기 세포 유래 심근세포(hiPSC-CM 또는 iCM)는 인간 심장 섬유아세포(HCF)와 인간 관상 동맥 내피세포(HCAEC)와 함께 생체내에서 발견되는 것과 3~4일 동안 매달려 있는 내피세포(HCAEC)와 함께 생체내에서 발견되는 것과 근사한 비율로 공동 배양된다. 심장 트로포닌 T, CD31 및 vimentin에 대하여 항체로 염색된 CS의 공초점 분석은 (심장 심구세포를 위한 마커, 내피 세포 및 섬유아세포, 각각) CS가 인간 심혼에서 찾아낸 네이티브를 닮은 복잡한 내피 세포 네트워크를 제시한다는 것을 보여줍니다. 이는 이러한 공초점 이미지의 3D 렌더링 분석에 의해 확인됩니다. CS는 또한 콜라겐 모형 IV, 라미닌 및 fibronectin와 같은 인간 심혼의 전형적인 세포외 매트릭스 (ECM) 단백질을 제시합니다. 마지막으로, CS는 ICM만 포함하는 CS에 비해 인간의 심장의 전형적인 하나에 가까운 동기화 수축으로 측정된 수축 활성을 제시한다. 독소루비신(DOX, 백혈병, 림프종 및 유방암 치료에 사용되는 DOX)과 같은 심독성 항암제로 치료할 때, DOX 처리 된 CS의 생존가능성은 HCFS에서 DOX의 하류 표적인 내피성 질산화물 시놉시스의 10 μM 유전 및 화학 적 억제로 현저히 감소됩니다. 이러한 독특한 특징을 감안할 때, CS는 현재 심장 생화학, 병리 생리학 및 약리학을 연구하기 위하여 시험관 내 모형으로 이용됩니다.
서문
심장은 제한된 재생 능력을 가지고 있으며 심혈관 질환 (CVD)은 조직 공학 및 줄기 세포 기술의 최근 발전에도 불구하고 전 세계적으로 사망의 주요 원인으로 남아있다 1. 손상된 심장을 복구하거나 심장이 실패하는 것을 방지하기 위하여 분자 및 세포 접근을 포함하는 새로운 치료에 대한 필요는 심장병2,3,4때문에 손해를 입는 환자를 위한 중요한 현재 임상 필요의 한개입니다. 심장 조직 공학의 주요 목표는 혈관 네트워크 및 생리 수축기능4,5,6을포함하여 인간의 심장의 전형적인 분자, 세포 및 세포 외 특징을 제시하는 3차원 (3D) 심장 조직을 제조하는 것입니다.
생체 공학 및 생체 내 및 생체 내 응용 에 대한 인간의 심장을 모방하는 기능적 인 인간 심장 조직을 제조하기 위해, 엔지니어링 심장 조직 (EHTs), 세포 시트 및 스페로이드 배양7,8을포함하여 여러 가지 접근 방식을 조사했다. 그러나, 이러한 조직은 인간의 심장의 전형적인 최적의 3D 미세 환경을 재구성하는 데 실패하고 CVD 환자에 대한 그들의 잠재적 사용은 벤치에서 침대 옆7로직접 번역 할 수 없다. 이는 생체 내 심장 조직의 복잡한 생물학, 형태학 및 생리학을 재구성하지 않기 때문이다9. 심장 조직 공학의 주요 과제 중 하나는 직경 200 μm보다 큰 조직이 중간2,10에서세포 사멸을 일으키므로 생체 공학 심장 조직 내의 계층적 혈관 네트워크의 개발을 포함한다. 인간 심장 조직에서 제대로 형성된 혈관 망은 심장세포(11)에혈액, 산소 및 영양소를 공급하는 데 중요한 역할을 한다. 배아 발달 중, 관상 동맥 모세혈관 및 동맥은 내피 전구 세포로부터 혈관 신생(de novo 혈관 형성) 및 혈관 신생(기존 혈관의 생성)을 통해 형성된다8,12. 심장 섬유아세포는 또한 최적의 세포외 매트릭스(ECM) 및 성장조성물(13,14)을제공함으로써 적절한 혈관 네트워크형성에중요한 역할을 한다.
생체 공학 심장 조직의 3D 혈관 네트워크는 동종 세포 상호 작용, 이성동맥 세포 상호 작용, 분비 된 용해성 단백질 및 세포를 통한 세포의 상호 작용과 같은 산소 및 영양 분과 및 파라크리안 신호를 생성하여 세포 생존 및 기능을 제어합니다3,10,15,16,17,18. 이는 조직의 중간에 세포사멸을방지하고 생체 공학심장조직(16,18,19)에서세포 생존력 과 생리적 기능을 촉진한다.
줄기 세포로부터의 스페로이드 배양은 최근 인간심장(20)의체외 모델로서 탐구되었다. 시험관 내 심장 미세 환경을 더욱 개선하기 위해 심장 심근세포, 내피 세포 및 섬유아세포와 같은 인간의 심장에서 발견되는 모든 주요 세포 유형의 사용을 포함시켰습니다. 스페로이드 배양은 세포가 성장하고 기능하기 위해 필요한 3D 구조 적 지원을 제시하고 혈관망(14,20,21,22)를바이오엔지니어링하는 데 사용될 수 있다. 이러한 맥락에서, 우리의 실험실은 인간 심장14에서찾아낸 비율로 심장 심근세포, 내피 세포 및 섬유아세포를 공동 배양하여 인간 심장 스페로이드 (CSs)를 개발했습니다. 본 모델은 쥐 심실 심장 세포 스페로이드 모델의 팽창으로, 심장섬유증(21)을모델링하는 데 사용되는 매달려 있는 낙하 배양에서 심장 세포를 공동 배양하여 생성된다. 인간 CS는 백혈병, 림프종 및 유방암을 치료하는 데 사용되는 항암제인 독소루비신(DOX)을 치료하여 독성 작용제로 사용될 수 있으며, 이는 심장 섬유증 및 심부전(HF)을 유발하는 것으로 잘 알려져 있으며,이는 14년후에도 그 소침에 따라 17년도 된다.
이 원고에서, 우리는 매달려 드롭 문화에서 인간 유도 만능 줄기 세포 파생 심장 근막세포 (hiPSC-CM 또는 iCM), 인간 심장 섬유 아세포 (HCFs) 및 인간 관상 동맥 내피 세포 (HCAEC)를 공동 배양하여 인간 적인 CS를 생성하는 방법을 설명합니다. 시험관 내 테스트를 위해 CS를 사용하고 이미지하기 위해 콜라겐 젤에 내장되어 있습니다. 내피 세포에 대한 마커인 CD31에 대한 항체로 염색된 CSs의 공초점 분석은 이들 세포가 생체 내에서 관찰된 것과 유사한 네트워크를 형성하는 것으로 나타났다. HF를 유도하고 잠재적으로 그것을 취급하거나 방지할 수 있는 새로운 에이전트를 시험하기 위하여, CSs는 10 μM DOX로 취급되었습니다 (약을 수신하는 암 환자의 혈류에서 찾아낸 농도). 칼신-AM과 에티듐 호모디머 (각각 살아있는 세포와 죽은 세포를 염색)로 염색할 때 DOX 처리 된 CS는 약물을받지 못한 CS에 비해 생존율이 현저한 감소를 제시합니다. 또한 CS는 1~3Hz 사이의 필드 잠재적 자극을 사용하여 진행될 때 균일한 수축 활성을 제시합니다.
프로토콜
참고: 이 프로토콜에 사용되는 hiPSC-CM은 시판됩니다. 필요한 경우 이 작업을 시작하기 전에 제도적 인적 윤리위원회의 승인을 구하십시오.
1. 인간 심장 섬유세포 및 내피 세포 배양 도금 및 성장
- HCC와 HCAE를 함유한 해동 극빙은 37°C의 수조에서 1분 동안 해동합니다.
- 멸균 라미나르 플로우 바이오 세이프티 캐비닛 클래스 2하에서 극저온을 이동합니다.
- 1000 μL 파이펫 팁을 사용하여 극저온으로부터 1mL의 세포 현탁액을 수집하고 HCF를 위한 인간 심장 섬유아세포 배지 7mL및 HCAEC를 위한 인간 메소 엔도 성장 매체의 7mL를 포함하는 15mL 튜브에 추가한다.
참고: 각 극저온으로부터 대부분의 세포를 수집하기 위해 동일한 15mL 튜브에서 배양 배지 1mL로 두 번 헹구십시오. - 셀 서스펜션을 부드럽게 혼합합니다.
- 10mL 세로지컬 파이펫을 사용하여 T75 배양 플라스크를 분리하기 위해 셀 서스펜션을 이송한다.
- 37°C에서 5% CO2로세포를 배양한다.
- 18h 후, 배양 플라스크에서 배지를 흡인하고 멸균 인산완충식염(PBS)으로 한 번 헹구어 동결 배지 및 죽은 세포를 제거한다.
- PBS를 각 배양물 플라스크에 7mL의 적절한 배양 배지로 교체하고 37°C에서 배양한다.
- 세포 확장 및 생존 가능성을 정기적으로 검사하고 세포가 80-90 %의 합류에 도달 할 때까지 매일 미디어를 교체하십시오.
2. iCM 문화 도금 및 성장
- 37°C에서 40 μg/mL을 함유한 PBS 2mL을 함유한 T25 배양 플라스크 2개, 최소 4시간 동안 5%CO2를 배양한다.
- 4시간 후, iMC가 함유된 극저온 1개를 모아 37°C의 수조에 4분 간 배치한다.
- 멸균 라미나르 플로우 바이오세이프 캐비닛 클래스 2하에서 극저온을 이동한다.
- iCM을 극저온에서 멸균 50mL 원심분리기 튜브로 부드럽게 1mL 파이펫 팁을 사용하여 전달합니다.
- 빈 iCM 극저온을 1mL의 실온 도금 매체로 헹구어 잔류 세포를 복구합니다. iCM 세포 현탁액을 포함하는 50mL 원심분리기 튜브로 90초 이상 극저온 낙하-구도에서 도금 매체 린스 1mL를 전송한다.
참고: 배지를 추가하여 용액을 완전히 혼합하고 해동 된 세포의 삼투충격을 줄이면서 튜브를 부드럽게 소용돌이치십시오. - 50mL 원심분리기 튜브에 8mL의 실온 도금 매체를 천천히 추가합니다. 처음 1 mL 드롭와이즈를 30 -60 s 이상 추가합니다. 그런 다음 다음 30s에 나머지 볼륨을 추가합니다. 도금 매체를 추가하면서 원심분리기 튜브를 부드럽게 소용돌이시다. 50mL 원심분리기 튜브의 내용을 2-3번 반전시켜 부드럽게 섞는다(격렬한 흔들림이나 소용돌이 방지).
- 즉시 혈류계를 사용하여 세포 계수를 수행하고 실행 가능한 세포 밀도 (세포 /mL에서)를 결정합니다.
- FN 프리 코팅 T25 플라스크를 가지고 플라스크를 건조시키지 않고 FN-PBS 솔루션을 흡인하십시오. 이를 통해 iCM의 파종 부피(8mL 실온 도금 매체에서1.6 x 10 6 실행 가능한 ICM)를 추가합니다.
- 배양 iC는 인큐베이터에서 48h에서 37°C, 5% CO2에대한 .
- 사용 전날 4°C에서 하룻밤 동안 유지 보수 매체를 해동하십시오.
- 37°C 수조에서 유지 보수 매체를 평형화하고 즉시 사용하십시오.
- 2 일 후, 생체 안전 캐비닛 에서 iCM T25 플라스크를 이동합니다.
- 도금 매체를 5회 위아래로 부드럽게 배관하여 죽은 세포와 이물질을 부드럽게 씻어냅니다.
- 도금 매체를 흡인하고 미리 데워진 유지 보수 매체의 8mL로 교체하십시오. T25 플라스크를 인큐베이터에 다시 놓습니다. 매일 유지 관리 매체를 교체하고 정기적으로 컨플루엔트를 검사합니다.
3. 셀 격리 및 계수
- 먼저 첫 번째 HCAEC 및 HCC를 수집한 다음 3.2-3.12 단계를 수행하여 iCCM을 수집합니다.
- ICM 유지 보수 매체 10mL, 인간 심장 섬유아세포 중형 5mL, 메소 엔도 성장 매체의 5mL를 혼합하여 CS 배양 배지를 준비한다.
- HCF및 HCAEC를 포함하는 각 조직 플라스크에서 배양 배지를 제거하고 T75 플라스크에 대한 5mL PBS로 한 번 헹구세요. PBS를 제거합니다.
- 각 T75 플라스크에 0.25% 트립신 EDTA 용액 5mL을 추가하고 37°C에서 5분 동안 배양하고 5%CO2를배양한다.
- 일단 세포가 분리되면, 배양 배지의 5mL로 트립신 EDTA 용액을 즉시 중화시한다.
- 세포 현탁액을 15mL 튜브 및 원심분리기 세포로 4분 동안 300 x g로 전달합니다.
- 각 튜브에서 상체를 조심스럽게 제거합니다. 각 셀 펠릿에 CS 배지 1mL을 넣고 다시 중단합니다. 트리판 블루와 혈종계를 사용하여 얼음과 카운트 셀에 튜브를 유지합니다.
- ICM을 함유한 조직 플라스크에서 유지 보수 매체를 제거하고 PBS 3mL로 한 번 헹구습니다.
- 각 T75 플라스크에 0.25% 트립신 EDTA 용액 1mL을 추가하고 37°C, 5% CO2에서배양한다. 분리될 때까지 매 분마다 셀을 확인합니다.
- 일단 세포가 분리되면, 배양 배지의 4mL로 트립신 EDTA 용액을 즉시 중화시한다.
- 셀 서스펜션을 15mL 튜브로 옮기고 원심분리기는 300 x g에서 5분 동안 전달합니다.
- 각 튜브에서 상체를 조심스럽게 제거합니다. 세포 펠릿에 배양 배지 1mL을 넣고 다시 중단합니다. 트리판 블루와 혈종계를 사용하여 얼음과 카운트 셀에 튜브를 유지합니다.
4.CS 세대 와 성장
- ICM, HCF 및 HCAEC를 2:1:1 비율로 혼합하여 CS 배지 20μL를 포함하는 매달려 있는 낙하 배양당 10,000iC, 5,000HC 및 5,000HCAEC를 도금합니다. 총 CS 수에 대한 최종 볼륨에 맞게 조정합니다.
- 384웰 HDC 플레이트의 각 웰에 세포 현탁액의 파이펫 20 μL은 수동으로 또는 자동화된 액체 처리를 위해 로봇 멀티채널 파이펫을 사용한다.
- 37°C에서 CS를 건조시키는 것을 방지하기 위해 매달려 있는 드롭 플레이트 주변채널의 각 측면에 멸균 PBS의 파이펫 1.5mL.
- 완전히 형성된 스페로이드가 대부분의 우물에서 관찰될 때까지 매일 CS의 형성을 검사합니다. CS가 형성될 때까지 매일 각각 7.5 μL의 CS 배지를 각각 잘 추가합니다.
콜라겐 젤에 5.CS 포함
- 1mL 파이펫 팁으로 CS를 수집합니다.
참고: 수집 중에 젤이 내장된 손상을 방지하기 위해 멸균 날카로운 표면(메스 또는 가위)을 사용하기 전에 피펫 끝을 가장자리에서 약 0.2cm 정도 잘라야 합니다. - CS 서스펜션을 얼음 위에 50mL 튜브로 수집합니다.
- 300 x g에서 5 분 동안 튜브를 원심 분리합니다.
참고: 획득한 펠릿은 사용 전까지 얼음 위에 보관해야 합니다. - 3:7 비율로 쥐 꼬리 콜라겐과 CS 배지를 사용하여 얼음에 콜라겐 젤 용액(96웰 플레이트 30개의 100μL/well)을 준비합니다.
- CS가 포함된 튜브에서 상체를 제거합니다.
- 콜라겐 젤 용액 내에서 펠릿 CS를 섞는다.
- CS 콜라겐 젤 현탁액에 수산화 나트륨 5m의 1 μL/mL을 넣고 부드럽게 섞습니다.
- CS 콜라겐 젤의 100 μL을 투명한 평평한 바닥 96에 옮기고 37°C에서 30분 동안 배양합니다.
6. DOX 처리 된 CS의 생존 력 및 독성 측정
- 30 분 후 인큐베이터에서 96 웰 플레이트를 수집
- 10 μM DOX를 준비하십시오(CSs14에서세포 사멸을 위한 이전에 확립된 프로토콜에 기초).
참고: CS에서 HF로부터 보호할 수 있는 다른 에이전트를 잠재적으로 테스트하려면 DOX + 에이전트 A, B 등이 포함된 솔루션을 생성합니다. - DOX 및/또는 다른 에이전트를 포함하는 100μL의 솔루션을 각 우물에 추가합니다. 제어 문화권에는 DOX가 없는 미디어가 포함됩니다.
- 37 °C에서 18 h, 5 % CO2에대한 인큐베이션 플레이트.
- 다음 날, 라이브 /데드 염색 시약 재고 솔루션을 수집하고 생물 안전 캐비닛에 어둠 속에서 얼음에 해동 할 수 있습니다.
- Hoechst 얼룩, 에디듐 호모디머 4 μM 및 2 μM calcein-AM을 포함하는 용액을 준비하십시오.
- Hoechst 얼룩, 칼신-AM/에디듐 호모디머 용액 100 μL을 각 우물에 넣습니다.
- 에디듐 호모이머에 대한 645 nm와 칼신-AM에 대한 530 nm에서 각각 멀티 모드 마이크로 플레이트 판독기를 사용하여 각 우물로 형광을 측정합니다.
- 형광 측정을 그래프패드 PRISM(또는 통계 분석을 위한 동등한 소프트웨어)로 전송합니다.
- 데이터 분석 및 통계에 대한 그래프패드 프리즘 소프트웨어를 사용합니다.
- 품질 관리를 위해, 칼신-AM 및 에디듐 호모이머와 함께 핵 염색에 대한 상피 현미경으로 확인하십시오.
7.CS 수축 기능 평가
- 5.8 단계에서 준비된 마이크로 플레이트를 수집합니다.
- 비디오 기반 에지 감지, 형광 지원 인터페이스 및 MyoPacer 필드 자극기를 위해 IonOptix 소프트웨어가 포함된 컴퓨터를 켭니다.
- 티슈 홀더 플랫폼에 새로운 커버 슬립을 놓고 전극으로 수조를 조립합니다.
- 가장자리에서 0.5mm 를 잘라 1 mL 파이펫 팁을 사용하여 콜라겐 젤에서 CS를 부드럽게 수집하고 매 튜브로 전송합니다. CSs의 건조를 방지하기 위해 CS에 미디어를 추가합니다.
- IonOptix 소프트웨어를 사용하여 CS의 왼쪽과 오른쪽에 피크를 설정하여 분석할 CS를 선택합니다.
- 컴퓨터 기반 모션 분석기를 사용하여 CS 가장자리의 움직임을 추적합니다.
참고: 일반적으로 수축은 셀 단축%또는 분수 단축으로 측정됩니다. 이 경우, 우리는 % 스페로이드 단축을 측정했다. - 컴퓨터에서 임계값과 가장자리 옵션을 조정하는 피크를 모두 안정화합니다.
- 근시 필드 자극기를 사용하여 다양한 주파수(0.3, 0.6, 1, 2 및 3Hz) 및 전압(1, 2, 3 및 5V)에 CS를 노출합니다.
- DOX 처리 및 처리되지 않은 CS의 CS 길이 변경으로 스페로이드 단축을 기록합니다.
8. CS의 현미경 검사: 고정 및 면역 라벨링
- 30분 후 96개의 웰 플레이트를 수집하고(5.8단계에서 준비된 대로) 실온에서 1시간 동안 4% 파라포름알데히드(PFA)로 CS를 수정합니다.
- PFA를 제거하고 0.01% 나트륨 아지드(PBSA)를 함유한 PBS로 세 번 헹구는 다.
- PBSA를 제거합니다.
- 0.02% 트리톤-X-100을 함유한 PBSA 200 μL을 쉐이커에 30분 동안 각 웰에 추가합니다.
참고: 이 단계는 더 나은 항체 침투를 위해 CS를 permeabilize합니다. - 실온에서 60분 동안 PBSA 용액에 3% 소 세럼 알부민200 μL을 추가합니다.
참고: 이 단계는 CS에서 특이하지 않은 항체 결합을 차단합니다. - 차단 용액에서 희석된 CD31에 대하여 1차 마우스 항인간 항체의 10 μg/mL를 포함하는 용액을 준비한다.
- 각 웰에 100 μL의 100 μL을 추가하고 셰이커에 4 °C에서 하룻밤 동안 배양합니다.
- 흔들판의 실온에서 20분 동안 PBSA로 플레이트를 세 번 헹구습니다.
- 정지용 액액에서 희석된 Cy3-컨쥬게이드 이차 당나귀 항체의 Hoechst DNA 얼룩 및 10 μg/mL을 포함하는 용액을 준비한다.
- 각 우물에 Hoechst 얼룩을 포함하는 이차 항체 용액의 100 μL을 추가하고 셰이커에 4 °C에서 하룻밤 동안 배양하십시오.
참고: 이 시점부터 알루미늄 호일로 접시를 덮습니다. - 흔들판의 실온에서 PBSA로 20분 동안 플레이트를 세 번 헹구습니다.
- 각 우물에 100 μL의 Ctctashield 장착 매체를 추가합니다.
- 레이저 스캐닝 공초점 현미경에서 이미지 CS. 이미지J 소프트웨어를 사용하여 Z 축을 따라 광학 단면을 수행하고 이미지를 단일 초점 평면으로 축소합니다.
결과
본 원고에 기재된 프로토콜은 기존 모델에 비해 세포 생존력 및 기능이 향상된 생체 공학 심장 조직 내에서 복잡한 심장 내피 세포 네트워크를 개발하는 대체 접근법을나타낸다(도 1). CSs 내의 생체 내 심장 미세 환경에서 3D의 회수는 암 환자의 혈류량에서 발견되는 농도에서 DOX에 대한 반응을 촉진시켰다(5 와 10 μM 사이, 도 2). DOX 처리 된 CSs는 24 시간(그림 2)내의 제어 (NO DOX) CS와 비교하여 세포 생존가능성이 통계적으로 유의한 감소를 제시했으며, 이는 약물치료 후 17년 후에도 인간 암 환자에서 관찰되는 독성 효과이다.
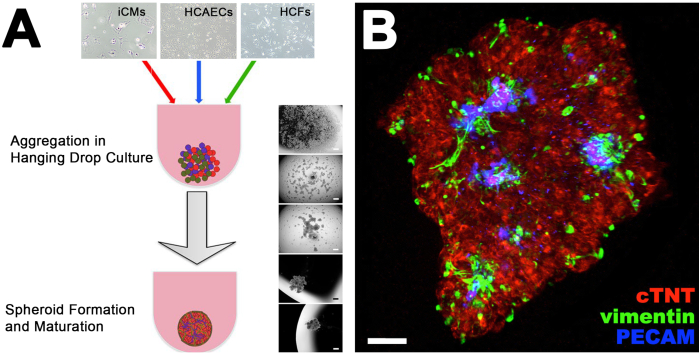
그림 1. CS 형성 및 혈관 분석. (A)교수형 방울에 iCCM, HCAEC 및 HCCS의 공동 배양으로부터 CS의 형성을 위한 단계를 보여주는 프로토콜. 오른쪽에 있는 브라이트필드 이미지는 매달려 있는 방울에 있는 단하나 세포에서 진보적인 스페로이드 형성을 보여줍니다. (B)심장 트로포닌 T (cTNT), PECAM 및 바이멘틴, 염색 심장 심근세포, 내피 세포 및 섬유 아세포에 대한 항체로 염색 된 CS의 공초점 이미지의 붕괴 Z 스택은 각각. 이 그림은14에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
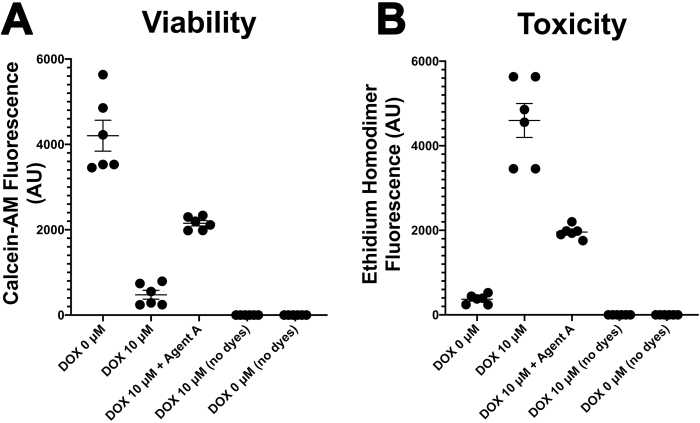
그림 2. CS의 생존력과 독성. 칼세인-AM(A)및 에티듐 호모디머(B) 형광의 통계적 분석은 어느 한 매체(DOX 0 μM) 또는 독소루비신(10 μM)의 존재에서 처리된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
발달, 적절한 혈관 네트워크 형성은 인간의심장(10,12, 23, 24,25, 25,26)을포함하는 기능적 조직의 생성에 매우 중요하다. 3D 조직의 적절한 혈관화를 고려하여 산소, 성장 인자, 신호 분자 및 영양소의 교환을 허용하고, 200 μm6,10,12,24,25,26, 27,27, 27, 28보다두꺼운 조직 내에서 세포 괴사의 발달을방지할수있다. 현재 혈관 망을 제시하는 시험관 3D 심장 모델에서 사용할 수 있는 것은 주로 모세혈관 크기의, 무질서한 혈관 네트워크를 제시하고 생체 내에서 관찰된 계층적 복합 분진 혈관이 부족하여 생체6,8,29에서관찰된다. 본 원고에 기재된 복잡한 심내피세포 망을 개발하기 위한 대안접근법은 기존 모델에 비해 향상된 세포 생존력과 기능을 제시한다(도1)14,22. 시험관 내 CSs의 분자, 세포 및 세포 외 구성 요소14,22를포함하여 생체 내 마이크로 환경을 더 잘 재구성하여 인간의 심장을 모델링합니다. 매달려 방울에서 줄기 세포 유래 세포에서 CS 생성은 정의 된 조건에서 자신의 배양을 허용 (예를 들어, 세포 유형 및 비율, 적절한 조직 형성). CS 내의 HCF 및 HCAEC와 함께 iCM의 공동 배양은 환자의 혈류량14에서발견되는 농도에서 약물에 대한 수축 기능 및 반응을 포함하여 심장 병리학을 조절하는 분자 및 세포 횡단 을 정의합니다. 이러한 독특한 특징으로 인해, CS는 심근 경색및심부전(21)의심한 결과인 심근 섬유증을 모델링하는 데 활용되었다. 우리의 이전 연구는 내피 세포와 섬유아세포 모두의 존재가 인간 심장에서 혈관 미세 환경의 회수에 매우 중요한 방법을 보여 주었다, 라민과 같은 섬유 아세포 유래 ECM 단백질의 최적의 증착을 허용, 섬유 넥신과 콜라겐 유형 IV, 개발 endothelial 세포 네트워크의 근접에 국소화14,21.
DOX는 치료 후 17년 후에도 암 환자에서 심부전을 일으킬 수 있는 잘 알려진 심장독성약물이다 30. 그럼에도 불구하고, 소아 환자및 유방암에서 백혈병과 림프종의 치료를 위한 선택의 약물로 남아있다 30. CSs에서 DOX 치료는 심장 심근세포, 내피 세포 및섬유아세포(14)에서 독성을 조절하는 메커니즘을 연구하고 HF 유도 심장섬유증(21)을모델링하기 위해 시험관 내에서 심부전(HF)을 모델링하는 데 사용되어왔다. 세포 생존가능성은 24시간 이내에 DOX 처리된 CSs에서 암 환자의 혈류에서 발견되는 농도에서 약물에 노출되었을 때(5와 10 μM 사이)14(도 2)에서통계적으로 감소하였다. 우리의 실험실에서 이전 연구는 또한 이 신호 통로의 유전 및 화학 억제제 둘 다를 사용하여 내피 성 산화 질소 synthase (eNOS)를 통해 심장 내피 세포와 섬유 아세포 모두에 DOX의 독성 효과를 입증14. 유전(NOS3 shRNA) 및 화학(N5-(1-이미노에틸)-L-오르니틴, 디하이드로클로라이드 또는 L-NIO) 길항제의 사용은 DOX의 다운스트림 표적으로서 eNOS 신호 경로의 길항제로서 심장 내피 세포와 섬유아세포14모두에서독성 효과를 방지하였다.
CSs 내의 수축 활동은 또한 필드 잠재적 자극에 노출될 때 심장 세포의 전기 적 결합 덕분에 측정되었습니다. 우리는 제어 매체 (DOX 0 μM)로 배양 된 CS가 건강한 인간의 심장과 비교하여 1 및 3 Hz 내에서 필드 자극에 의해 진행 될 수있는 박동 속도로 자발적으로 균질적으로 수축한다는 것을 발견했습니다. 한편, DOX 처리 된 CS는 계약 할 수 없기 때문에 전기 자극을 따르지 않습니다. 칼신-AM 및 에티듐 호모디머를 사용하여 세포 생존력 과 독성의 측정과 함께, CS 수축 기능에 대한 이 기능적 분석은 현재 다른 모델과 달성할 수 없는 체외에서 인간의 심장의 전형적인 복잡한 시나리오의 평가를 가능하게 합니다. 동일한 시스템을 사용하여 단일 심장 세포의 수축 활성 측정과 비교하여, 우리는 CSs에서 sarcomere를 시각화하고 측정할 수 없습니다. 따라서, 우리는 시간이 지남에 따라 % 스페로이드 단축의 측정으로 제한됩니다, 우리가 우리의 실험실 내에서 개발했다 분석. 우리는 세포의 수를 제어할 때, 우리는 각 CS에서 공동 배양하고 따라서 각 CS의 크기, 우리는 실제로 균일 한 수축 기능을 제시 유사한 크기의 CS를 활용. 그러나 다양한 크기의 CS를 생성한 경우에도 수축 활동은 변경되지 않았습니다.
또한 CS의 다세포 특성으로 인해 이온 옵틱스 시스템의 커버슬립 하단에 국소화할 수 있을 정도로 무거워진다고 보고하는 것도 중요합니다. CS가 특정 위치에 스스로 앉아 있다는 사실에 기초하여, 우리는 대부분의 실험실에서 일반적으로 단일 심장 세포로 수행되는 것과는 반대로, 덮개를 고수할 필요가 없습니다.
심장 트로포닌 T, CD31/PECAM 및 PECAM에 대한 항체로 얼룩진 CSs의 현미경 분석은 내피 세포네트워크(도 1,blue)의 형성을 보여주었다. CS의 내부 부분에서 괴사를 완전히 배제하기 위해, 칼신-AM/에디듐 호모디머 스테인드 CSs의 공초점 분석에 의해 실험실에서 세포 생존가능성에 대한 공간 평가가 수행되었다(데이터는도시되지 않음). 그러나, 생체 제작 분야의 향후 발전은 생체 내에서 인간의 심장의 전형적인 다른 복잡한 특징을 더 잘 재구성하기 위해, 현재 기존 모델에서 사용할 수 없다는 것을 인정하는 것이 중요합니다. 이들은 포함합니다: i) 성인 심근세포의 전형적인 수축 기능; ii) 혈류및 혈압력; iii) 파라크리인 신호; iv) 면역 반응, 이는 이 및 다른 체외 심장 모델을 개선하는 데 중요 할 것이다6. 다른 어떤 모형이든 건강한 조직 또는 질병 상태의 주요 특징을 회수하는 것을 목표로 하기 때문에, 이 원고에 기술된 CS의 생성 그리고 사용을 위한 프로토콜은 이 접근을 사용하여 완전하지 않을 지도 모르다 특정 한 질문을 해결하는 연구원을 돕는 것을 목표로 합니다. 예를 들어, CS의 생성을 위한 환자 유래 세포의 잠재적인 사용은 개인화된 약에 대한 공구를 제공할 것이고, 현재 심장 혈관 연구를 위한 일반적으로 이용 가능한 고처리량 assays를 사용하여 사용할 수 없습니다.
결론적으로, 우리는 심장 세포를 사용하여 인간의 심장 미세 환경을 더 잘 재구성하는 간단한 방법을 시연했습니다. 심장 스페로이드는 심장 세포의 단층 배양에 비해 인간의 심장에 존재하는 것을 더 잘 재구성하는 내피 세포 네트워크를 제시합니다. 그들의 독특한 기능을 감안할 때, 그들은 심장 혈관 연구를 위한 시험관 내 테스트를 위한 고급 공구를 나타냅니다. 환자 유래 세포를 이용한 미래 연구는 심혈관 질환을 예방하고 더 잘 치료하는 맞춤형 의학 및 새로운 치료법을 위한 옵션을 제공할 수 있습니다.
공개
없음
감사의 말
녹화 및 비디오 편집에 대한 Nat Johnston에 특별한 감사.
푸남 샤르마는 유니PRS와 UNRS 중앙 및 교부학교 (UNRSCC5050) 장학금뉴캐슬 대학의 지원을 받았습니다. 카민 이방인은 UTS 종자 자금, 성인 줄기 세포 연구를위한 시드니 그랜트의 가톨릭 대교구와 시드니 의과 대학 재단 심장 흉부 수술 연구 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A1933 | |
| Donkey anti-mouse Secondary Antibodies | Jackson Immunological Research Labs, Inc. | 715-165-150 | Cyanine Cy3-conjugated secondary antibody |
| Doxorubicin hydrochloride | Sigma-Aldrich | D1515 | |
| Fibronectin | Sigma-Aldrich | F1141-1MG | From Bovine Plasma |
| Human cardiac fibroblasts (HCFs) | Cell Applications, Inc., San Diego, CA, USA | 306AK-05a | 5x10^5 Cells (Adult), Medium & Subculture Reagents |
| Human coronary artery endothelial cells (HCAECs) | Cell Applications, Inc., San Diego, CA, USA | 300K-05a | 5x10^5 Cells (Adult), Medium & Subculture Reagents |
| Human iPSC-derived cardiomyocytes (iCMs) | Fujifilm Cellular Dynamics, Inc. | R1057 | iCell Cardiomyocytes Kit, 01434 |
| HCF Growth medium | Cell Applications, Inc., San Diego, CA, USA | 316-500 | |
| Human MesoEndo Cell Growth Medium | Cell Applications, Inc., San Diego, CA, USA | 212-500 | |
| LIVE/DEAD Viability/Cytotoxicity Kit | Invitrogen, Carlsbad, CA, USA | L3224 | |
| Maintenance Medium (iCells) | Fujifilm Cellular Dynamics, Inc. | R1057 | iCell Cardiomyocytes Kit, 01434 |
| Mouse Monoclonal anti-human CD31/PECAM | BD Pharmingen, San Diego, CA, USA | 566177 | |
| NucBlue Live ReadyProbe Reagent (Hoechst 33342) | Invitrogen, Carlsbad, CA, USA | R37605 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate-Buffered Saline | Sigma-Aldrich | D8537 | |
| Plating Medium (iCells) | Fujifilm Cellular Dynamics, Inc. | R1057 | iCell Cardiomyocytes Kit, 01434 |
| Rat Tail Collagen | Sigma-Aldrich | C3867 | |
| Sodium Azide | Sigma-Aldrich | S2002 | |
| Trypsin–EDTA, 0.25% | Gibco, Thermofisher Scientific | 25200072 | |
| Trypan Blue Solution, 0.4% | Gibco, Thermofisher Scientific | 15250061 | |
| Triton-X 100 | Sigma-Aldrich | X100 | |
| Tissue culture flasks (T25) | Thermofisher Scientific | 156367 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Corning, New York, USA | 3603 | |
| 384-Well Hanging Drop Plate | 3D Biomatrix, Ann Arbor, MI, USA | HDP1385 |
참고문헌
- Dzobo, K., et al. Advances in Regenerative Medicine and Tissue Engineering: Innovation and Transformation of Medicine. Stem Cells International. 2018, 2495848 (2018).
- Pecha, S., Eschenhagen, T., Reichenspurner, H. Myocardial tissue engineering for cardiac repair. The Journal of Heart and Lung Transplantation. 35 (3), 294-298 (2016).
- Sekiya, S., Shimizu, T. Introduction of vasculature in engineered three-dimensional tissue. Inflammation and Regeneration. 37, 25 (2017).
- Rodrigues, I. C. P., Kaasi, A., Maciel Filho, R., Jardini, A. L., Gabriel, L. P. Cardiac tissue engineering: current state-of-the-art materials, cells and tissue formation. Einstein. 16 (3), 4538 (2018).
- Pena, B., et al. Injectable Hydrogels for Cardiac Tissue Engineering. Macromolecular Bioscience. 18 (6), 1800079 (2018).
- Roche, C. D., Brereton, R. J. L., Ashton, A. W., Jackson, C., Gentile, C. Current challenges in three-dimensional bioprinting heart tissues for cardiac surgery. European Journal of Cardio-Thoracic Surgery. , (2020).
- Fleischer, S., Feiner, R., Dvir, T. Cardiac tissue engineering: from matrix design to the engineering of bionic hearts. Regenerative Medicine. 12 (3), 275-284 (2017).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From Arteries to Capillaries: Approaches to Engineering Human Vasculature. Advanced Functional Materials. (1910811), 23 (2020).
- O'Donnell, B. T., Ives, C. J., Mohiuddin, O. A., Bunnell, B. A. Beyond the Present Constraints That Prevent a Wide Spread of Tissue Engineering and Regenerative Medicine Approaches. Frontiers in Bioengineering and Biotechnology. 7, 95 (2019).
- Gentile, C. Filling the Gaps between the In Vivo and In Vitro Microenvironment: Engineering of Spheroids for Stem Cell Technology. Current Stem Cell Research & Therarpy. 11 (8), 652-665 (2016).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Gentile, C., Muise-Helmericks, R. C., Drake, C. J. VEGF-mediated phosphorylation of eNOS regulates angioblast and embryonic endothelial cell proliferation. Developmental Biology. 373 (1), 163-175 (2013).
- Sweeney, M., Foldes, G. It Takes Two: Endothelial-Perivascular Cell Cross-Talk in Vascular Development and Disease. Frontiers in Cardiovascular Medicine. 5, 154 (2018).
- Polonchuk, L., et al. Cardiac spheroids as promising in vitro models to study the human heart microenvironment. Scientific Reports. 7 (1), 7005 (2017).
- Zhang, J., Zhu, W., Radisic, M., Vunjak-Novakovic, G. Can We Engineer a Human Cardiac Patch for Therapy. Circulation Research. 123 (2), 244-265 (2018).
- Langhans, S. A. Three-Dimensional in Vitro Cell Culture Models in Drug Discovery and Drug Repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Sarker, M. D., Naghieh, S., Sharma, N. K., Chen, X. 3D biofabrication of vascular networks for tissue regeneration: A report on recent advances. Journal of Pharmaceutical Analysis. 8 (5), 277-296 (2018).
- Zamani, M., Karaca, E., Huang, N. F. Multicellular Interactions in 3D Engineered Myocardial Tissue. Frontiers in Cardiovascular Medicine. 5, 147 (2018).
- Grounds, M. D. Obstacles and challenges for tissue engineering and regenerative medicine: Australian nuances. Clinical and Experimental Pharmacology and Physiology. 45 (4), 390-400 (2018).
- Campbell, M., Reis, R. L., et al. . Encyclopedia of Tissue Engineering and Regenerative Medicine. , 387-393 (2019).
- Figtree, G. A., Bubb, K. J., Tang, O., Kizana, E., Gentile, C. Vascularized Cardiac Spheroids as Novel 3D in vitro Models to Study Cardiac Fibrosis. Cells Tissues Organs. 204 (3-4), 191-198 (2017).
- Campbell, M., Chabria, M., Figtree, G. A., Polonchuk, L., Gentile, C. Stem Cell-Derived Cardiac Spheroids as 3D In Vitro Models of the Human Heart Microenvironment. Methods in Molecular Biology. 2002, 51-59 (2019).
- Pagliari, S., et al. A multistep procedure to prepare pre-vascularized cardiac tissue constructs using adult stem sells, dynamic cell cultures, and porous scaffolds. Frontiers in Physiology. 5, 210 (2014).
- Gentile, C., et al. VEGF-mediated fusion in the generation of uniluminal vascular spheroids. Developmental Dynamics. 237 (10), 2918-2925 (2008).
- Visconti, R. P., et al. Towards organ printing: engineering an intra-organ branched vascular tree. Expert Opinion on Biological Therapy. 10 (3), 409-420 (2010).
- Fleming, P. A., et al. Fusion of uniluminal vascular spheroids: a model for assembly of blood vessels. Developmental Dynamics. 239 (2), 398-406 (2010).
- Traore, M. A., George, S. C. Tissue Engineering the Vascular Tree. Tissue Engineering Part B: Reviews. 23 (6), 505-514 (2017).
- Sakaguchi, K., Shimizu, T., Okano, T. Construction of three-dimensional vascularized cardiac tissue with cell sheet engineering. Journal of Controlled Release. 205, 83-88 (2015).
- Chen, F. M., Liu, X. Advancing biomaterials of human origin for tissue engineering. Progress in Polymer Science. 53, 86-168 (2016).
- Kalyanaraman, B. Teaching the basics of the mechanism of doxorubicin-induced cardiotoxicity: Have we been barking up the wrong tree. Redox Biology. 29, 101394 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유