Method Article
투명화, 면역염색, 컨포칼 및 광시트 형광 현미경을 통한 HIV 감염 조직의 면역 세포 집단의 3D 시각화
요약
면역형광 현미경 검사와 결합된 조직 투명화를 통해 온전한 조직 내의 면역 세포 집단 및 바이러스 단백질을 공간적으로 시각화하고 정량화할 수 있습니다. 컨포칼 및 광시트 형광 현미경 검사로 투명화된 조직을 광학 절편화하면 복잡한 조직 환경의 3D 모델을 생성하고 HIV 감염 중에 나타나는 공간적 이질성을 나타낼 수 있습니다.
초록
후천성 면역 결핍 증후군(AIDS)의 원인 병원체인 인체 면역결핍 바이러스(HIV)는 전 세계적으로 약 4천만 명이 감염되었으며 널리 접근할 수 있는 치료법이 없는 주요 글로벌 보건 문제입니다. 집중적인 노력에도 불구하고 감염 중 및 치료에 대한 반응으로 조직 내 바이러스와 숙주 세포의 상호 작용에 대한 자세한 이해는 여전히 불완전합니다. 이러한 한계를 해결하기 위해 수성 조직 투명화 기술인 CUBIC(Clear, Unobstructed Brain/Body Imaging Cocktails and Computational analysis) 및 CLARITY(Clear Lipid-exchanged Acrylamide-hybridized Rigid Imaging/Immunostaining/in situ-hybridization-compatible Tissue hYdrogel)를 적용하여 컨포칼 및 광시트 형광 현미경을 사용하여 동물 모델 및 인간의 HIV 감염 조직에서 복잡한 바이러스 숙주-세포 상호 작용을 시각화합니다. 온전한 조직의 광학 절편 및 이미지 분석을 통해 전체 조직에 포함된 공간 정보를 신속하게 재구성하고 감염 중 면역 세포 집단을 정량화할 수 있습니다. 이러한 방법은 대부분의 조직 공급원과 전염병 및 암을 포함한 다양한 생물학적 질문에 적용할 수 있습니다.
서문
최근 생물학 연구에서 정량적 공간 조직 이미징에 대한 필요성이 증가함에 따라 단일 세포 해상도로 온전한 조직의 더 큰 볼륨(mm3cm 3) 이미지를 생성하기 위한 조직 제거 기술이 등장했습니다. 조직에는 고유하게 정의된 구조, 구성 및 기능을 가진 생체 분자의 복잡한 조직이 포함됩니다. 안타깝게도 조직에 존재하는 많은 생체 분자(예: 지질 및 발색단)는 광학 현미경을 통해 이미지화할 때 빛을 산란, 흡수 또는 방출하여 대용량 이미징을 어렵게 만듭니다. 또한 조직은 종종 표준 이미징 솔루션 및 광학 렌즈와 일치하지 않는 굴절률을 나타내어 이미징 중에 광학 왜곡을 초래합니다. 광학 현미경으로 많은 양의 조직을 이미징하기 위한 최적의 접근 방식에는 조직의 굴절률, 이미징 솔루션 및 대물렌즈를 일치시키는 동시에 처리 중에 온전한 조직의 생물학적 특징을 방해하지 않고 조직 깊숙이 빛이 침투할 수 있도록 하는 것이 포함되어야 합니다. 불투명한 조직 샘플의 제거를 통해 조직과 이미징 솔루션 간의 굴절률 차이를 줄이려는 초기 시도는 1800년대 후반 독일의 해부학자 Werner Spalteholz에 의해 수행되었습니다1. 이 조직 투명화 기술에는 조직 샘플을 손상시킬 수 있는 가혹한 화학 용매가 포함되었지만, 그럼에도 불구하고 온전한 조직에 대한 최초의 보고된 대용량 이미징을 대표했습니다. 이미지 캡처 및 분석을 위한 컴퓨팅 성능과 결합된 현대의 광학 현미경 방법은 최근 단일 세포 해상도로 크고 손상되지 않은 조직 샘플을 이미징하는 방법으로 조직 투명화를 다시 유행시켰습니다. 지난 20년 동안 유기 기반 및 수성 기술을 포함한 수십 가지의 첨단 조직 세척 기술이 등장했으며, 각 기술은 특정 응용 분야에 대한 강점과 약점을 가지고 있습니다.
3D 조직 이미징은 세포 배양에서 재현할 수 없는 더 복잡한 생물학적 상호 작용을 조사할 수 있습니다. 예를 들어, 세포 신호 패턴(cell signaling pattern)2, 뚜렷한 세포 유형3의 공간 분포, 뇌 연결성(brain connectivity)4 은 이전에 전체 조직/장기 이미징 방법을 사용하여 정량적 방식으로 매핑되었습니다. 여기에는 활성 감염 중에 온전한 HIV 감염 림프 조직 내에서 뚜렷한 HIV 표적 세포 집단을 제거, 면역 염색 및 시각화하기 위한 수성 조직 세척 프로토콜의 적용이 설명되어 있습니다. HIV는 체내에서 주로 CD4+ T세포를 감염시키며, 이 세포의 게놈 사본을 감염된 숙주 세포의 유전체에 통합합니다. 그 후 바이러스는 감염된 숙주 세포 기전을 장악하여 스스로를 복제함으로써 바이러스가 퍼져나가고, 숙주 세포가 죽임을 당하고, 면역 기능 장애를 일으키고, 장기적으로 에이즈로 진행된다. 조직과 세포 배양에서 감염된 T세포의 행동은 현저히 다르다는 점에 유의하는 것이 중요합니다. HIV와 함께 배양된 배양된 CD4+ T 세포는 수십 개의 핵5을 포함할 수 있는 대규모 HIV 유도 세포융합을 생성할 수 있으며, 3D 세포외 기질(ECM) 하이드로겔 또는 HIV에 감염된 인간화 마우스(hu-mice)의 조직 샘플에서 배양된 1차 CD4+ T 세포를 사용한 유사한 실험은 일반적으로 2-5개의 핵6과 세포융합을 생성합니다. HIV에 감염된 개인 내에서 바이러스의 국소 세포 간 전파 및 전신 전파를 이해하는 것은 훨씬 더 복잡할 수 있으며, 조직에서 혈관으로, 그리고 새로운 조직으로 바이러스를 운반하는 여러 감염 세포 유형에 의한 바이러스의 운반과 관련되어 있으며, 여기서 자유 바이러스와 바이러스 생성 세포는 많은 수의 감수성 림프구에 접근할 수 있습니다7. 이러한 시나리오는 현재 세포 배양 시스템에서 재현할 수 없으며, 동물 모델과 인간의 조직은 면역 체계가 기능하는 복잡한 유기체의 맥락에서 바이러스 발병 기전을 이해하는 데 중요한 자원으로 남아 있습니다.
현재의 항레트로바이러스 요법(ART)은 HIV 복제를 억제하고 질병이 AIDS로 진행되는 것을 막음으로써 HIV(PWH) 환자의 기대 수명과 질을 크게 향상시킵니다. 불행히도 ART는 레트로바이러스 게놈 삽입을 포함하는 잠복 감염 면역 세포 중 잠잠하고 바이러스를 활발하게 생성하지 않는 면역 세포를 제거하지 못합니다. ART를 투여받은 대부분의 개인의 혈액에서는 바이러스가 검출되지 않지만, ART가 중단되고 질병 진행이 계속되면 바이러스 부하가 빠르게 반등합니다8. 감염된 세포의 잠복 저장고에 의해 유발되는 HIV 감염의 지속적인 특성은 HIV 치료법을 확립하는 데 큰 장애물입니다. HIV의 조직 저장소는 여전히 잘 알려져 있지 않으며, 바이러스 발병 기전을 완전히 규명하고 바이러스를 활발하게 생성하지 않는 잠복 감염 세포를 효과적으로 제거하는 새로운 치료법을 평가하기 위해 ART 전, 도중 및 후에 림프 조직의 이러한 저장소에 대한 더 깊은 이해를 확립하는 것이 중요합니다.
여기서, 이전에 채택된 두 가지 수성 조직 투명화 프로토콜인 CUBIC3 및 CLARITY9는 인간화 면역 체계를 가진 HIV에 감염된 마우스(hu-mice), SIV/SHIV에 감염된 비인간 영장류(NHP) 및 HIV에 감염된 인간의 수많은 온전한 림프 조직 내 면역 세포 집단을 이미지화하는 데 적용되었습니다. 이러한 프로토콜은 이미징의 목표(더 높은 해상도 대 더 큰 부피) 및 사용 가능한 기기에 따라 컨포칼 및 광시트 형광 현미경 모두에 적용할 수 있습니다. 광학 현미경 검사로는 개별 비리온을 분석할 수 없지만 면역 형광을 사용하면 바이러스와 바이러스 생성 세포가 포함된 조직 영역을 식별할 수 있으며 더 높은 해상도의 방법으로 추가 분석할 수 있습니다. 여기에 제시된 방법은 감염 중 서로 다른 조건에서 특정 세포 유형 간의 공간적 관계를 정량화하기 위해 신체의 거의 모든 조직을 단일 세포 해상도로 시각화하도록 조정할 수 있으며 감염성 질환 또는 암 연구를 위해 관련성이 높은 인간 환자 샘플로 쉽게 변환할 수 있습니다.
프로토콜
모든 동물 실험은 승인된 기관 동물 관리 프로토콜에 따라 수행되었습니다. 모든 인체 조직은 승인된 제도적 인간 연구 윤리 지침에 따라 획득되었습니다.
1. 조직 수확 및 고정 (CUBIC 및 CLARITY와 동일)
- 앞서 설명한 대로 림프 조직을 확인하고 해부한다10.
- 해부 가위와 핀셋으로 안전하게 가능한 경우 검시 후 몇 분 이내에 림프 조직을 절제합니다.
- 조직 샘플을 광학 현미경(LM), 전자 현미경(EM) 또는 면역-EM을 위해 조직 샘플을 적절하게 보존하기 위해 0.1M 소듐 카코딜레이트 트리하이드레이트에 8% 파라포름알데히드(PFA), 5% 자당이 포함된 갓 만든 얼음처럼 차가운 고정 완충액에 넣습니다. 또는 0.1M PBS에서 4% PFA로 LM용 샘플을 고정합니다. 바이러스가 완전히 비활성화되도록 제거 프로세스를 시작하기 전에 밤새 샘플을 수정하십시오.
주의: 파라포름알데히드는 피부 접촉 및 흡입에 의해 독성이 있으며 가연성 고체이기도 합니다. 조심스럽게 다루고 가연성 보관 캐비닛에 보관하십시오. 소듐 카코딜레이트 트리하이드레이트는 삼키거나 흡입하면 독성이 있습니다. - 투명화 과정을 시작하기 전에 조직의 참조 이미지를 촬영합니다.
참고: LM 샘플은 이러한 조건에서 최소 1년 동안 보관할 수 있습니다. 내인성 형광 단백질을 발현하는 샘플로 작업하려면 후속 단계에서 항상 샘플을 어두운 곳에 보관하십시오.
2. CUBIC 티슈 클리어링
- 림프 조직 샘플을 멸균 0.1M PBS로 3회 헹굽니다.
참고: PFA가 포함된 액체는 기관 지침에 따라 폐기하십시오. - 림프 조직 샘플을 37°C에서 3일 동안 부드럽게 흔들어 CUBIC Reagent-1( 재료 표 참조)에 담그십시오. 정기적인 참조 이미지를 촬영하여 시간 경과에 따른 탈색 과정을 모니터링합니다.
- Reagent-1을 추가로 3-4일 동안 담그거나 조직 탈색이 완료될 때까지 교체하십시오. 세척에 필요한 시간은 부피와 조직의 유형에 따라 다릅니다. 조직 탈색 과정을 가속화하려면 CUBIC Reagent-1을 매일 새로 고치고 더 많은 양을 사용하십시오.
- 림프 조직 샘플을 0.1M PBS로 실온에서 30분 동안 부드럽게 흔들어 3회 세척합니다.
- 림프 조직 샘플을 37°C에서 2-7일 동안 또는 완전한 투명도가 달성될 때까지 부드럽게 흔들어 CUBIC Reagent-2( 재료 표 참조)에 담그십시오. 샘플이 완전한 투명도를 얻지 못하면 투명화가 더 이상 진행되지 않을 때까지 2.2-2.5 단계를 반복합니다. 정기적인 참조 이미지를 촬영하여 시간 경과에 따른 지우기 프로세스를 모니터링합니다.
- 림프 조직 샘플을 0.1M PBS로 실온에서 30분 동안 부드럽게 흔들어 3회 세척합니다.
- 샘플을 어두운 곳에서 0.01% 부피/부피(V/V) 아지드화나트륨과 함께 CUBIC 시약-2에 보관합니다( 재료 표 참조).
참고: 샘플은 이 방법을 사용하여 최소 6개월 동안 보관할 수 있습니다.
주의: 아지드화나트륨은 독성이 강하며 심각한 흡입 위험을 초래합니다. 5% 아지드화나트륨 이하의 희석 용액을 구입하는 것이 좋습니다.
3. 입방 샘플의 차단 및 면역 염색
- 림프 조직 샘플을 0.1M PBS로 실온에서 각각 30분 동안 부드럽게 흔들어 3회 세척합니다.
- 컨포칼 현미경을 사용하여 이미징하려면 조직 슬라이서 매트릭스를 사용하여 조직을 ~0.5-1mm 두께의 조각으로 자릅니다. 광시트 형광 현미경(LSFM)을 수행하려면 전체 조직 영역을 차단합니다.
- 5mL의 CUBIC 차단 용액으로 4°C에서 밤새 흔들어 샘플을 차단합니다( 재료 표 참조). NHP 또는 인간 샘플로 작업할 때는 안티-휴먼 FcR을 사용하십시오. 마우스 샘플로 작업할 때는 차단 용액에 안티 마우스 FcR을 사용하십시오.
- 5mL의 1차 항체( 재료 표 참조)가 포함된 샘플을 실온에서 3일 동안 진탕하여 차단 용액(종 특이적 FcR 없음)에 염색합니다(선택 사항: 응집된 항체 추가를 줄이기 위해 사용 전 5분 동안 농축된 항체 스톡을 2,300 x g 에서 원심분리).
- 염색된 샘플을 실온에서 최소 5시간의 시간 동안 흔들면서 세척 용액 완충액을 최소 5회 이상 교환합니다( 재료 표 참조).
- 2차 항체( 재료 표 참조)가 포함된 샘플을 실온에서 3일 동안 진탕하여 차단 용액(종 특이적 FcR 없음)에 염색합니다(선택 사항: 항체 응집을 최소화하기 위해 사용 전 5분 동안 2,300 x g 에서 항체를 원심분리).
- 염색된 샘플을 실온에서 세척액으로 총 5시간 이상 흔들어 5회 세척합니다.
- 각 조직 샘플에 5mL의 DAPI 염색 용액( 재료 표 참조)으로 샘플을 염색하고 실온에서 10분 동안 배양합니다. 나중에 이미징할 수 있도록 샘플을 4°C의 어두운 곳에서 DAPI 염색 용액에 그대로 둡니다.
- 림프 조직 샘플을 세척액으로 실온에서 3회 흔들어 각각 30분 동안 흔듭니다.
- 시료를 장착하기 전에 염색된 시료를 CUBIC Reagent-2에 실온에서 밤새 담근다.
4. CLARITY 티슈 클리어링
- 림프 조직 샘플을 멸균 0.1M PBS로 3회 헹구고 실온에서 각각 15분 동안 흔들어 PFA를 제거합니다.
- 조직 샘플을 갓 만든 아크릴아마이드 용액 15mL에 넣고 4°C에서 부드러운 교반으로 밤새 배양합니다( 재료 표 참조).
주의: 중합되지 않은 아크릴아마이드는 강력한 신경독이며 피부를 통해 쉽게 흡수됩니다. 피부와의 접촉을 피하고 접촉이 발생하면 즉시 헹굽니다. - 조직 샘플을 실온으로 예열합니다.
- 선택 사항: 질소를 아크릴아미드 용액에 1분 동안 버블링하여 조직 샘플을 제거합니다. 독성 중합되지 않은 아크릴아미드(~1-2 거품/초)가 튀지 않도록 낮은 유속을 사용하도록 주의하십시오.
- 조직 샘플을 37°C 수조에 1-3시간 동안 넣어 중합하고 15분마다 뒤집습니다. 점성 액체, 혼합 중 Schleren 라인의 출현 또는 조직 주위에 투명한 캡슐 형성으로 표시된 바와 같이 눈에 띄는 중합이 감지되는 즉시 샘플을 제거하십시오.
참고: 아크릴아미드 용액의 완전한 중합이 발생하면 샘플에서 과도한 하이드로겔을 잘라내고 프로토콜을 계속합니다. - 조직 샘플을 멸균 0.1 M PBS로 실온에서 30분 동안 3회 3회 세척하고 부드럽게 흔들어 아크릴아미드 용액을 제거합니다.
- 조직 샘플을 37°C에서 0.1M PBS의 8% SDS 15mL에 넣고 2-5+ 일 동안 부드럽게 흔들어 투명하게 합니다. 8% SDS 용액을 주기적으로 새로 고치고 필요한 경우 최대 50mL의 용액을 사용하여 세척 속도를 높입니다. 샘플이 시각적으로 투명하거나 더 이상 진행되지 않는 경우 세척 프로세스를 중지합니다. 정기적인 참조 이미지를 촬영하여 시간 경과에 따른 지우기 프로세스를 모니터링합니다.
- 조직 샘플을 멸균 0.1M PBS로 실온에서 1일 동안 5회 부드럽게 흔들어 세척합니다.
- 내인성 형광을 이미지화할 준비가 될 때까지 샘플을 0.1M PBS(장기 보관을 위한 0.01% 부피/부피(v/v) NaN3 추가)에 임시로 보관하십시오.
- 조직을 5mL의 이미징 매체 RI-2에 넣습니다( 재료 표 참조). 면역염색 전에 투명화 과정의 완전성을 확인하기 위해 어두운 곳에서 실온에서 밤새 배양합니다. 조직 투명도를 모니터링하기 위해 참조 이미지를 촬영합니다.
5. CLARITY 시료의 차단 및 면역 염색
참고: 이러한 단계는 CUBIC 투명화 조직의 차단 및 면역 염색과 유사하지만 차단, 세척 및 염색 용액에 대해 다른 제형을 사용합니다.
- 림프 조직 샘플을 0.1M PBS로 30분 동안 3회 3회 세척하고 매번 실온에서 부드럽게 흔들어 세척합니다.
- 컨포칼 현미경을 사용하여 이미지를 만들려면 0.5mm 조직 슬라이서와 매트릭스를 사용하여 조직을 ~0.5-1mm 두께의 조각으로 자릅니다. LSFM을 수행하려면 전체 조직 샘플을 차단합니다.
- 5mL의 CLARITY 차단 용액( 재료 표 참조)으로 샘플을 4°C에서 밤새 흔들어 차단합니다.
- 1차 항체 5mL( 재료 표 참조)를 차단 용액(종 특이적 FcR 없음)에 넣고 실온에서 3일 동안 진탕하여 염색합니다(선택 사항: 항체 응집을 최소화하기 위해 사용 전 5분 동안 2,300 x g 에서 항체를 원심분리).
- 염색된 샘플을 총 5시간 이상 흔들면서 실온에서 세척 용액으로 5회 세척합니다( 재료 표 참조).
- 2차 항체 5mL와 함께 샘플을 밀봉 용액(종 특이적 FcR 없음)에 넣고 실온에서 3일 동안 진탕하여 염색합니다(선택 사항: 항체 응집을 최소화하기 위해 사용 전 5분 동안 2,300 x g에서 항체를 원심분리). 전체 프로토콜 길이를 단축하려면 형광단과 접합된 1차 항체를 사용하여 2차 항체로 배양할 필요성을 없애십시오.
- 염색된 샘플을 총 5시간 이상 흔들면서 실온에서 세척액으로 5회 세척합니다.
- 각 조직 샘플에 5mL의 DAPI 염색 용액( 재료 표 참조)으로 샘플을 염색하고 실온에서 10분 동안 배양합니다. 나중에 이미징할 수 있도록 샘플을 DAPI 염색 용액의 어두운 곳에서 4°C로 유지합니다.
- 림프 조직 샘플을 세척액으로 실온에서 3회 3회 흔들면서 매번 30분 동안 흔듭니다.
- 조직을 5mL의 이미징 매체 RI-2(R.I. = 1.46)에 넣고 시료 장착 전에 어두운 곳에서 실온에서 밤새 배양합니다(프로토콜 단계 6 및 7 참조).
6. 컨포칼 현미경 검사를 위한 투명화된 조직 샘플의 장착 및 이미징
- 접착 실리콘 아이솔레이터의 보호층 한쪽 면을 떼어냅니다.
- 현미경 커버 유리(22mm x 40mm, 두께 0.25mm)를 실리콘 아이솔레이터의 벗겨진 면에 붙여서 샘플을 위한 방수 공간을 만듭니다.
- 접착 실리콘 아이솔레이터의 보호층 반대쪽을 떼어냅니다.
- 이미징용 샘플을 실리콘 아이솔레이터 중앙에 놓고 액체 표면이 아이솔레이터의 가장자리만큼 높아질 때까지 CUBIC Reagent-2 또는 Imaging Media RI-2를 적절하게 추가합니다.
- 실리콘 아이솔레이터 내부에 기포가 갇히는 것을 최소화하려면 EM 집게를 사용하여 두 번째 커버 유리를 한쪽에서 아래로 정렬하고 부드럽게 겹쳐 놓습니다. 여분의 액체를 닦아내십시오. 접착제를 밀봉하기 위해 집게 뒷면을 사용하여 샘플 웰 주위의 커버 유리를 부드럽게 누릅니다. 장착된 샘플을 어두운 곳에 수평으로 보관하십시오.
참고: 샘플은 장착 후 몇 주에서 몇 달까지 이미지화할 수 있습니다. 그러나 이미징 품질은 일반적으로 시간이 지남에 따라 저하됩니다. - 장착된 슬라이드를 현미경 스테이지에 놓고 s를 찾습니다.amp백색광과 더 낮은 배율 대물렌즈(2-10x)를 사용하여 le.
- 선택한 개별 형광단을 기반으로 형광 획득 프로파일을 설정합니다.
참고: 별도의 형광단 채널을 개별적으로 획득하는 것이 좋습니다. 그 결과 획득 시간이 길어지지만 스펙트럼 중첩 및 비특이적 형광 신호의 획득이 줄어듭니다. 일반적인 형광단 프로파일에는 DAPI(450nm), Alexa488, Alexa594 및 Alexa647(또는 관련 조합)이 포함될 수 있어 이미지 획득 중 스펙트럼 중복을 최소화할 수 있습니다. - 관심 영역을 이미지화하기 위해 적절한 배율 목표를 선택합니다. 단일 세포 해상도로 더 큰 부피 또는 전체 조직 이미징에는 저배율 대물렌즈(2-10x)를 사용하고, 투명화된 조직에서 세포 내 세부 사항을 고해상도로 시각화하려면 더 높은 배율 대물렌즈(20-63x)를 사용합니다. 대물렌즈, 이미징 매체 및 조직의 굴절률을 가능한 한 가깝게 일치시켜 이미지 획득 중 광학 왜곡의 도입을 최소화합니다.
- Z-stack 획득을 위한 단계 크기를 선택합니다. 저배율 대물렌즈(2-10x)의 경우, ~3-5 μm의 단계 크기를 선택하여 3D 모델링을 위해 여러 연속 Z-슬라이스의 개별 세포에서 형광을 검출하는 동시에 총 획득 시간과 전체 파일 크기를 줄일 수 있습니다. 더 높은 배율 대물렌즈(20-63x)의 경우 ~1μm 이하의 단계 크기를 선택하여 개별 Z-슬라이스 간의 세포 내 정보 손실을 최소화합니다.
- 시야를 확대/축소하여 가능한 한 비어 있는 영역을 최소화하여 X 및 Y 차원에서 이미지화할 조직의 전체 영역을 시각화합니다. 이미지화할 전체 관심 영역을 포함하는 상위 및 하위 Z-stage 획득 좌표를 설정합니다.
- Z 스택 이미지를 획득합니다. 이미지 분석 소프트웨어를 사용하여 후처리할 수 있도록 파일을 저장하고 내보냅니다. 특정 소프트웨어 제품군의 경우 파일을 특정 파일 형식(예: .tiff, .ome-tiff, .jpeg 등)으로 변환합니다. 현미경 이미지 획득 소프트웨어 또는 이미지 분석 프리웨어(예: ImageJ/Fiji)를 사용하여 변환을 수행합니다.
7. LSFM 챔버 또는 큐벳에 샘플을 장착하고 이미징합니다.
- 사용된 특정 프로토콜에 따라 이미징 챔버를 CUBIC Reagent-2 또는 RI-2로 채웁니다. 액체를 옮기는 동안 거품이 형성되지 않도록 하십시오. 피펫으로 여분의 거품을 제거하십시오.
- 샘플을 이미징 챔버에 담그고 샘플의 이동을 제한합니다.
참고: 사용된 특정 현미경에 따라 샘플을 아가로스에 삽입하거나, 후크 또는 고슴도치 어댑터에 샘플을 매달거나, 샘플 홀더를 3D 프린팅하거나, 접착제로 샘플을 플라스틱 접시에 부착하는 것이 포함될 수 있습니다. - 이미징 솔루션에 대물렌즈를 배치하고 샘플에 초점을 맞춥니다. 장착된 샘플을 이미징 챔버에 몇 시간 또는 밤새 그대로 두어 큐벳의 용액과 조직이 완전히 평형을 이룰 수 있도록 합니다.
- 관심 영역의 Z-스택을 획득합니다(이미지 획득은 6.7-6.11단계 참조).
참고: 이 접근 방식은 단일 세포 해상도로1cm3 이상의 조직 부피를 이미징할 수 있습니다.
8. Imaris 이미지 분석 소프트웨어를 사용한 표면 재구성 및 세포 정량화
참고: 이 단계는 Imaris 이미지 분석 소프트웨어에만 해당되지만 다른 소프트웨어 제품군(예: ImageJ/Fiji, Aivia, Arivis, Amira 등)을 사용하여 유사한 이미지 처리 단계를 수행할 수 있습니다.
- Imaris 파일 변환기를 사용하여 Z 스택 이미지 파일을 기본 Imaris 형식 .ims로 변환합니다. 이렇게 하면 파일 변환 속도가 더 빨라지는 동시에 변환 오류와 열렸을 때 잠재적인 소프트웨어 문제를 최소화할 수 있습니다.
참고: 일부 최신 LSFM에서는 사용자가 파일을 .ims 형식으로 직접 저장할 수 있습니다. - 분석할 .ims 파일을 Imaris 소프트웨어의 아레나 영역으로 드래그합니다. Display Adjustment 패널에서 각 색상 채널의 대비 또는 강도를 조정합니다. 왼쪽 위에 있는 Add New Surfaces 아이콘을 클릭합니다.
- 다음: 소스 채널(오른쪽을 가리키는 화살표가 있는 파란색 아이콘)을 클릭합니다. 구성할 표면의 소스 채널을 선택합니다. 다른 매개변수는 변경하지 마십시오.
- Next: Threshold(오른쪽을 가리키는 화살표가 있는 파란색 아이콘)를 클릭합니다.
- 임계값(절대 강도)을 조정하려면 임계값 선을 왼쪽 또는 오른쪽으로 드래그합니다. Split Touching Objects 를 활성화하고 평균 셀 지름(미크론)을 시스템의 분할 표준으로 입력하여 각 개별 표면의 원점으로 많은 점을 생성합니다.
- 너무 작거나 너무 밝은 형광 신호는 잠재적인 염색 또는 현미경 아티팩트를 나타낼 수 있으므로 포함하지 마십시오. 허용 가능한 크기와 형광 강도를 가진 점만 포함하려면 그에 따라 평균 세포 직경을 변경합니다.
참고: 평균 세포 직경은 특정 조직 또는 세포 유형에 따라 다르지만 일반적으로 5-15μm 사이에 있습니다.
- 너무 작거나 너무 밝은 형광 신호는 잠재적인 염색 또는 현미경 아티팩트를 나타낼 수 있으므로 포함하지 마십시오. 허용 가능한 크기와 형광 강도를 가진 점만 포함하려면 그에 따라 평균 세포 직경을 변경합니다.
- Next: Classify Surfaces(오른쪽을 가리키는 화살표가 표시된 파란색 아이콘)를 클릭합니다. 임계값 선을 왼쪽 또는 오른쪽으로 끌어 포함할 표면을 조정합니다. 표면이 원시 형광 신호와 정확히 근사한지 확인하는 동시에 개별 세포에서 형광 신호를 분리합니다.
- Finish: Execute All Creation Steps and Terminate the Wizard(오른쪽을 가리키는 두 개의 화살표가 있는 녹색 아이콘)를 클릭합니다. 표면은 공식적으로 건설되었습니다.
- 왼쪽 패널에서 Statistics라고 표시된 여섯 번째 아이콘을 클릭하면 셀 수, 이 경우 분석된 특정 색상 채널에 대한 표면 수를 확인할 수 있습니다.
- Number of Disconnected Components per Time Point, Number of Surfaces per Time Point, Total Number of Disconnected Component 및 Total Number of Surfaces의 4개 변수가 해당 색상 채널의 셀 수인 동일한 숫자를 갖는지 확인합니다.
결과
조직 투명화는 조직 구조를 유지하면서 조직에서 불투명한 생체 분자를 추출하기 위해 보존된 조직을 화학 칵테일로 처리하는 것을 포함합니다. 이러한 조직 투명화 솔루션은 조직의 굴절률을 주변 이미징 매체와 일치시켜 광학 왜곡을 최소화하고, 조직 내 깊은 곳의 신호 대 잡음비를 향상시키며, 배경 자가형광을 최소화합니다. 컨포칼 및 광시트 형광 현미경으로 면역형광 염색 및 이미징 전에 보존된 HIV/SIV 감염 휴마우스, 비인간 영장류 및 인간 조직 샘플을 투명화하기 위해 광학 조직 투명화를 위한 두 가지 수성 프로토콜인 CUBIC3 및 CLARITY9를 사용했습니다.
CUBIC 프로토콜의 경우, 고정 조직을 PBS로 세척하여 고정제를 제거하고 헴과 같은 발색단을 용리하는 아미노알코올의 염기성 완충 용액인 CUBIC Reagent-1에 침지하여 조직의 탈색 및 탈lipidation을 수행했습니다(그림 1, 상단). CUBIC Reagent-1 처리 3일 후 더 작은 조직 부피(~mm3)는 탈색될 수 있지만, 더 큰 조직 부피(~cm3) 또는 헴이 많은 조직(예: 간, 비장 또는 심장)은 더 긴 배양 시간과 용액 부피(>1개월 및 ~50mL)가 필요하며 2-3일마다 용액을 자주 교체해야 합니다. 탈색 후, 조직을 세척하고 조직의 굴절률과 일치하고 빛의 투과율을 증가시키는 약 1.48-1.49의 굴절률을 갖는 자당 함유 용액인 CUBIC Reagent-2에 넣었습니다. 투명화된 조직은 면역염색되어 컨포칼 또는 광시트 현미경으로 이미징하기 전에 CUBIC Reagent-2 용액에 장착되었습니다. CUBIC 투명화 절차의 효과는 다양한 크기와 농도의 발색단의 여러 hu-mouse 및 NHP 조직에 대해 이미지화되었습니다(그림 2). 광학적 투명화는 조직을 육안으로 눈에 띄게 투명하게 만들어 격자 선과 종이 시트의 텍스트를 조직 "통해" 볼 수 있도록 했습니다. 비장, 간, 골수 및 심장과 같은 발색단이 풍부한 조직은 완전히 탈색되지 않을 수 있지만 면역 염색 및 이미징에는 여전히 적합합니다(그림 2 및 그림 5).
CLARITY 프로토콜의 경우, 고정 조직을 PBS로 세척하여 고정제를 제거한 다음 열 개시제를 사용하여 40% 아크릴아미드 용액에서 4°C에서 밤새 배양하여 샘플의 단백질과 아크릴아미드의 단량체 사이에 공유 결합을 형성했습니다(그림 1, 하단). 다음 날, 조직을 실온으로 평형을 이룬 후 37°C 수조에서 예열한 후 아크릴아미드 중합을 시작하고 샘플을 하이드로겔에 빠르게 넣었습니다. 샘플을 불투명한 지질을 제거하기 위해 2-5일 동안 8% SDS 용액으로 처리했습니다. 형광 염색 직전, 샘플을 90% 비이온 밀도 구배 배지를 함유하는 CLARITY(이미징 매체 RI-2)용 굴절률 정합 용액(RIMS)에 담궈냈습니다. 다량의 헴을 함유하는 조직의 경우, 탈색 단계 9,11,12의 말단에 탈색 단계를 추가할 수 있습니다. CUBIC과 CLARITY 투명화의 진행은 동일한 인간 비장 샘플의 다른 섹션에서 비교되었습니다(그림 3). CLARITY 투명화는 용액을 감싸는 가시적인 폴리아크릴아미드 겔을 생성하며, 추가 탈색 단계를 추가하지 않는 한 일반적으로 CUBIC 투명화에 비해 탈색이 감소합니다 9,12.
그 후, 두 프로토콜 모두에서 투명하고 손상되지 않은 조직을 면역 염색하여 특정 면역 세포 집단을 검출했습니다. 샘플을 세척하고, 비특이적 항체 결합을 줄이기 위해 α-FcR-함유 시약으로 차단하고, 형광단에 직접 접합된 1차 항체를 사용할 때 3일 동안 염색했습니다. 대안적으로, 샘플을 접합되지 않은 1차 항체로 3일 동안 염색한 후 형광단에 접합된 2차 항체로 추가로 3일 동안 염색했습니다. 조직을 다시 세척한 다음 핵 시각화를 위해 4°C에서 밤새 DAPI 염색으로 배양했습니다. 샘플을 세척하고 CUBIC Reagent-2에서 24-36시간 동안 또는 Imaging Media RI-2(CLARITY)에서 밤새 어둠 속에서 배양했습니다. 컨포칼 현미경 검사의 경우, 이미징 전에 적절한 RIMS의 현미경 슬라이드에 조직을 장착했습니다(그림 4). 광시트 형광 현미경법(LSFM)의 경우, 이미징 전 밤새 이미징 큐벳에 샘플을 RIMS로 완전히 담갔습니다.
온전한 림프 조직, 투명화 된 림프 조직 및 면역 염색 조직의 컨포칼 현미경을 통해 핵, 면역 세포 마커 및 HIV/SIV CA(캡시드) 단백질을 포함한 여러 형광 신호를 동시에 시각화할 수 있었습니다(그림 5). 바이러스 생산 세포는 면역 세포 마커와 HIV 단백질의 형광 공동 국소화에 의해 측정되었습니다. HIV에 감염된 사람의 비장을 투명하게 염색하고 염색한 결과, HIV p24와 함께 국소화된 여러 CD3+ T-세포가 밝혀졌는데, 이는 온전한 조직 영역 내에 바이러스 생성 세포가 존재함을 나타냅니다(그림 5A-D). 투명화 및 면역염색된 SHIV에 감염된 NHP 림프절은 수많은 바이러스 생성 세포가 있는 영역(그림 5F) 외에도 바이러스가 검출되지 않은 조직 영역(그림 5E)에서 CD3+ T 세포 및 CD68+ 대식세포의 분포를 보여주었습니다. 이러한 결과는 다양한 조직 출처에서 바이러스를 생산하는 세포가 주어진 시야 내에서 다른 세포와 구별될 수 있고 복잡한 조직 환경 내에서 드문 생물학적 사건을 감지할 수 있음을 보여주었습니다.
컨포칼 현미경을 사용한 투명화된 조직의 광학 절편을 적용하여 Z 스택 및 3D 표면 모델을 생성했으며, 이를 통해 HIV 감염 중에 나타나는 세포 이질성을 밝혔습니다(그림 6). Z-스택은 Imaris 소프트웨어 제품군을 사용하여 Z-투영 이미지로 재결합되었으며(그림 6A) 전체 조직 부피에 걸쳐 CD3+ T 세포 및 HIV 캡시드 단백질(p24) 형광을 명확하게 시각화하기 위해 DAPI 핵 채널을 제거했습니다(그림 6B). Z-프로젝션 형광은 Imaris 소프트웨어로 자동으로 분할되어 전체 Z-스택에서 형광 신호의 공간 시각화 및 정량화를 위해 재구성된 3D 표면 모델을 생성했습니다(그림 6C). 3D 표면 모델을 분석한 결과 546개의 CD3+ T 세포와 218개의 세포가 HIV p24를 생성하는 것으로 밝혀졌습니다. 누적적으로, 투명하고 HIV에 감염된 림프 조직에서 면역 형광을 Z-스택으로 획득하여 조직 내 세포 구성의 3D 모델을 생성하고 조직 부피 내 면역 세포 집단을 자동으로 정량화할 수 있었습니다.
온전한 림프 조직, 투명화 된 림프 조직 및 면역 염색 조직의 LSFM을 통해 림프 조직에서 면역 세포 및 바이러스 생성 세포 분포에 대한 더 큰 부피의 면역 형광(IF) 이미징이 가능했습니다(그림 7). HIV에 감염된 hu-mouse에서 hCD3+ T 세포 및 HIV p24에 대한 결장 조직의 면역 염색 결과, 감염의 증거 없이 넓은 조직 영역에 분산된 바이러스 생산 세포의 병소가 밝혀졌습니다(그림 7A). 바이러스 생산 세포의 병소를 확대 관찰한 결과, 여러 개의 바이러스 생산 세포가 잠재적인 표적 세포에 근접해 있는 것이 드러났습니다(그림 7B). 조직 자가형광(적색 연무)을 사용하여 전체 조직 구조를 시각화하는 동시에 자가형광(빨간색 타원형)보다 더 밝게 염색된 조직 내의 특정 면역 세포 집단을 구별했습니다. 전체 LSFM Z-stack 볼륨의 3D 모델은 온전한 조직 영역 내에서 바이러스 생산 세포의 병소의 공간적 분포를 보여주었으며 전체 조직 구조와 관련된 바이러스 생산 위치를 매핑할 수 있었습니다(그림 7C). 놀랍게도, 바이러스를 생산하는 세포의 병소는 종종 바이러스 생산의 증거가 없는 넓은 조직 영역에 산재되어 있었습니다. 이러한 결과를 통해 서로 다른 조직 내에서, 그리고 서로 다른 감염 시간 또는 다른 치료에 대한 반응에서 바이러스 분포 및 감염된 세포 밀도의 매개변수를 정량화할 수 있습니다.
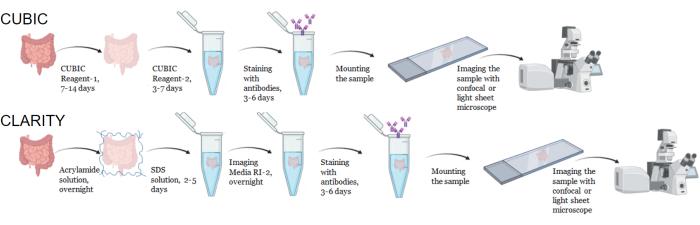
그림 1: 일반적인 CUBIC 및 CLARITY 조직 투명화, 면역염색 및 이미징의 워크플로우. CUBIC(위) 및 CLARITY(아래) 세척 시간은 조직의 크기와 유형에 따라 크게 달라질 수 있습니다. CLARITY 투명화의 경우, 면역염색 전에 굴절률 일치 배지를 사용한 추가 배양 단계를 통해 조직이 투명한지 확인해야 합니다. 면역염색은 일반적으로 1차 항체가 형광단과 접합될 때 3일이 걸리고, 형광 2차 항체가 필요한 경우 6일이 걸립니다. 샘플은 컨포칼 또는 LSFM으로 이미지화할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
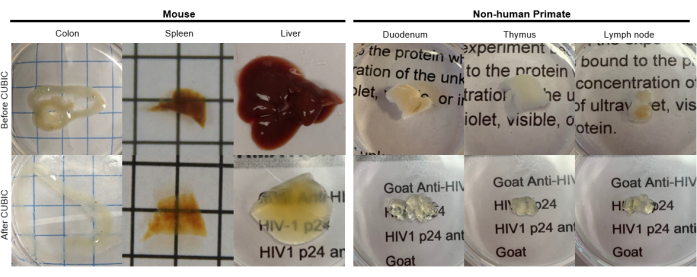
그림 2: CUBIC hu-mouse 및 NHP 조직 샘플의 투명화. 조직 샘플의 헴과 지질의 밀도가 다르기 때문에 각 조직 유형을 투명화하는 데 필요한 시간이 다릅니다. 예를 들어, 결장과 십이지장은 일반적으로 비교적 짧은 기간(~7일)이 필요한 반면, 비장과 간은 투명해지는 데 더 오래 걸릴 수 있습니다(~30일). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
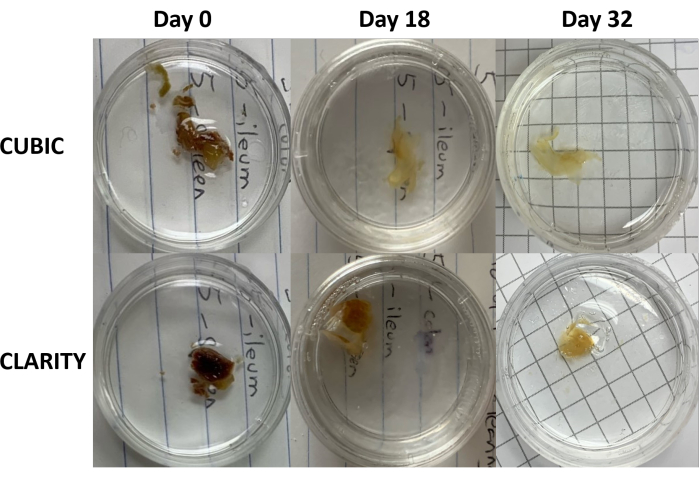
그림 3: 인간 샘플에 대한 조직 투명화 방법의 종단 비교. CUBIC(상단 패널) 및 CLARITY(하단 패널)는 항레트로바이러스 요법을 받은 HIV 감염자로부터 비장을 제거했습니다. 두 방법 모두 면역 염색 및 이미징을 위해 32일째까지 조직을 적절하게 제거했습니다. CUBIC 방법의 탈색 단계는 비장 샘플 내에 포함된 헴의 존재로 인한 자가형광을 눈에 띄게 감소시킵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
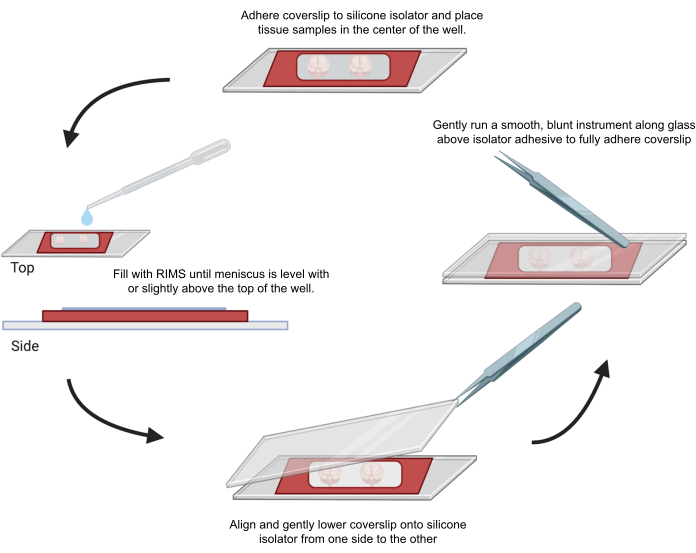
그림 4: 컨포칼 현미경 검사를 위한 시료 장착. 샘플은 접착제 0.5-1mm 실리콘 절연체로 분리된 커버슬립 사이에 장착되었습니다. 실리콘 아이솔레이터를 첫 번째 커버슬립에 부착하고 조직을 웰 중앙(상단)에 배치했습니다. 우물은 반월판이 우물 상단과 수평이 되거나 약간 위가 될 때까지 RIMS로 채워졌습니다(왼쪽). 두 번째 커버슬립은 기포(하단)를 피하면서 한쪽에서 다른 쪽으로 조심스럽게 제자리로 내려갔습니다. 커버슬립은 우물 둘레에 뭉툭한 기구를 부드럽게 실행하여 실리콘 절연체에 완전히 부착되었습니다(오른쪽). 샘플은 표준 컨포칼 현미경에서 이미지화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
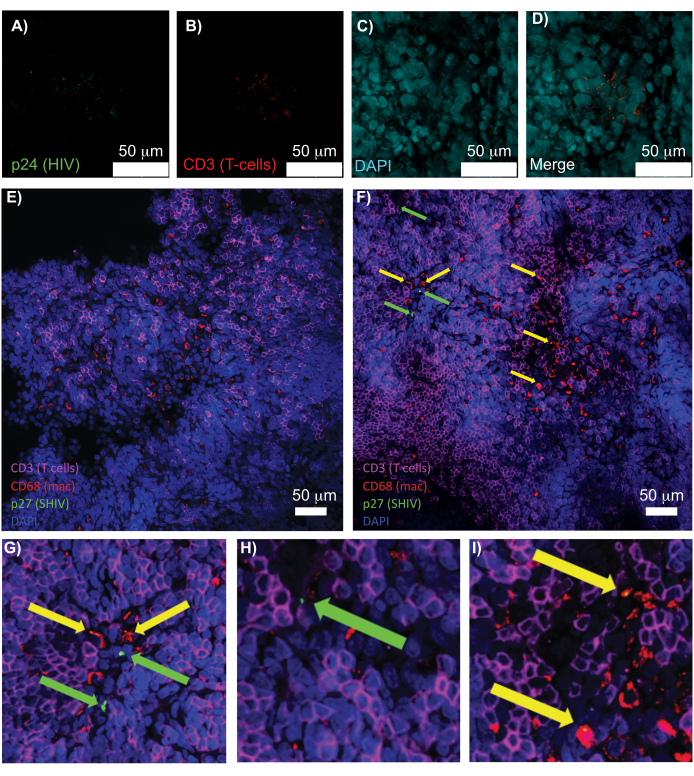
그림 5: 투명하고 손상되지 않은 인간 비장과 NHP 림프절의 컨포칼 현미경 검사. (A-D) 투명화된 HIV-감염된 인체 조직을 HIV-1 p24(녹색), hCD3+ T 세포(빨간색) 및 핵(청록색)으로 염색했습니다. (E) CD3+ T세포(마젠타색), CD68+ 대식세포(mac/red), SHIV p27(녹색) 및 핵(파란색)에 대해 면역 염색된 감염 후 8주 후에 SHIV에 감염된 NHP의 CUBIC의 투명화된 림프절의 컨포칼 Z-슬라이스. 시야각에는 T 세포, 대식세포 및 기타 세포 유형이 포함되어 있지만 SHIV가 세포를 생성한다는 증거는 없습니다(녹색). F) CD3+ T 세포(녹색 화살표) 및 CD68+ 대식세포(노란색 화살표)를 생성하는 바이러스의 존재와 함께 세포 밀도 및 수의 차이를 보여주는 동일한 림프절의 인접 영역의 컨포칼 Z-슬라이스. (지아이) (F)에서 선택한 p27 염색 영역의 확대 보기. 스케일 바는 50μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
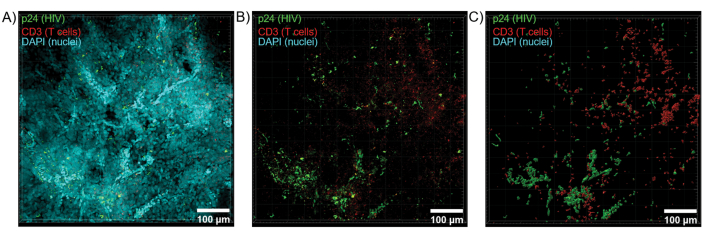
그림 6: HIV에 감염된 인간 비장의 Z-스택 부피 및 3D 재구성 표면. (A) HIV-1 p24(녹색), hCD3+ T 세포(빨간색) 및 핵(청록색)으로 염색된 HIV에 감염된 인간 비장 조직의 600μm x 600μm x 100μm Z 스택의 Z 투영 이미지. (B) 핵 DAPI 염색이 없는 동일한 Z-투영 이미지. (C) 전체 Z-stack 볼륨에서 CD3(빨간색) 및 p24(녹색) 형광의 재구성된 3D 표면 모델. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
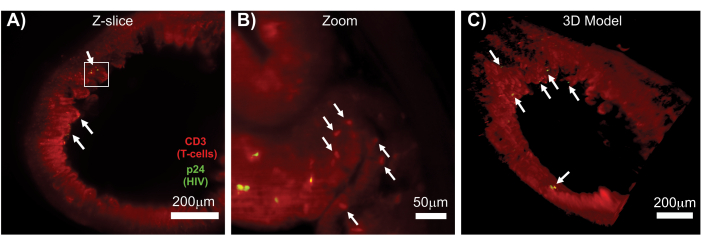
그림 7: CD3+ T 세포(빨간색) 및 HIV p24(녹색)에 대해 면역 염색된 HIV에 감염된 hu-mouse의 결장 (A) Z-슬라이스(1,000 μm x 1,000 μm) HIV 감염 조직 표면 부피의 LSFM 및 3D 재구성. 흐릿한 붉은 안개는 조직 자가형광을 나타내고 뚜렷한 빨간색 반점은 T 세포를 나타냅니다. 융모는 주변부에서 볼 수 있으며, 중앙 내강을 가리키며, 바이러스가 없는 넓은 영역에 분산되어 있는 활성 바이러스 생산의 여러 병소(흰색 화살표)가 있습니다. 상자는 패널 B의 대략적인 관심 영역을 나타냅니다. (B) 감염되지 않은 T 세포(빨간색)에 근접하여 hCD3+ T 세포(노란색)를 생산하는 개별 바이러스를 보여주는 확대된 조직 영역. 이미지를 회전시키고 근처의 Z-슬라이스로 변경하여 하나의 단일 Z-평면에서 p24 양성 세포의 초점을 표시했습니다. 배경의 빨간색 자가형광은 특정 hCD3+ T 세포 염색(빨간색 반점, 흰색 화살표) 외에도 일반적인 조직 구조를 보여줍니다. (C) 장의 뚜렷한 위치에서 HIV 감염의 병소(노란색)를 보여주기 위해 회전된 Imaris 소프트웨어로 생성된 전체 부피(1,000μm x 1,000μm x 200μm)의 3D 표면 모델. 흰색 화살표는 볼륨 내의 개별 초점을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
관심 림프 조직은 사후 신속하게 수집해야 하며, 염색 및 이미징에 부정적인 영향을 미칠 수 있는 조직 괴사(어두운 조직 또는 검은색 조직)를 방지하기 위해 즉시 사전 냉각된 고정 완충액에 넣어야 합니다. 원하는 조직을 채취한 후 즉시 조직을 얼음처럼 차가운 4%-8% 파라포름알데히드(PFA)에 밤새 담가 고정하면 샘플과 관련된 잠재적인 병원체도 비활성화됩니다. 4% PFA는 LM 시료를 고정하는 데 최적인 반면, 8% PFA는 LM과 EM 모두의 조직을 적절하게 보존할 수 있습니다. 이러한 절차를 따르고 어두운 곳에서 4°C의 고정제에 샘플을 보관하면 몇 년 동안 LM 이미징을 위한 조직을 효과적으로 보존할 수 있습니다. 한 가지 주의할 점은 고정제에 장기간 보관하면 염색 인공물, 특히 관심 단백질에 대한 인접 단백질의 가교결합으로 인해 발생하는 항원 마스킹이 발생할 수 있으며, 이는 항원결정기에 대한 염색 항체의 접근성을 차단할 수 있다는 것입니다13,14. 조직에 내인성으로 발현된 형광 단백질이 포함되어 있는 경우, 전체 프로토콜에서 가능한 한 조직이 빛에 노출되지 않도록 조치를 취하십시오. 일반적으로 내인성 형광 단백질은 고정 후 6-12개월 동안 형광을 유지하지만 개별 조직 샘플은 더 길거나 더 짧은 기간 동안 변할 수 있습니다. 단백질 분해로 인해 내인성 형광이 손실되는 경우, 관심 단백질에 특이적인 1차 항체를 사용하여 형광 단백질을 검출할 수 있습니다. 관류는 정화하기 전에 조직을 빠르게 고정하는 또 다른 옵션입니다12; 그러나 HIV와 같은 병원체를 다룰 때의 우려로 인해 가능한 한 안전하게 샘플을 준비하기 위해 조직 부검 후 얼음처럼 차가운 고정제에 담그는 경로를 선택했습니다.
설명된 수성 세척 프로토콜의 한 가지 장점은 일반적으로 유기 기반 프로토콜보다 약하며, 이는 때때로 간과 같이 더 취약한 조직을 손상시킬 수 있다는 것입니다. 수성 세척 프로토콜은 일반적으로 유기 기반 세척 프로토콜에 비해 완전한 시료 세척(몇 주 대 며칠)을 달성하는 데 더 오랜 시간이 걸립니다. CLARITY 및 CUBIC 프로토콜은 설치류 내의 모든 기관을 동시에 제거하기 위해 관류를 사용하여 보다 빠르게 수행할 수 있습니다11,12; 그러나 이것은 NHP와 인간 부검에서 실현 가능한 옵션이 아니었습니다. CLARITY로 처리된 샘플은 약간의 부피 팽창을 보이는 경향이 있는 반면, CUBIC은 샘플 부피에 대한 영향이 감소된 것으로 나타났습니다9. 일반적으로 더 빠르지만, 많은 유기 기반 조직 제거 프로토콜은 조직이 수축15을 겪게 하여 림프절 및 비장과 같은 세포 밀도가 높은 조직 내에서 단일 세포 또는 세포 내 세부 사항을 관찰하는 것을 더 어렵게 만들 수 있습니다. 투명화에 의해 유도된 확장은 이미징의 해상도를 효과적으로 증가시켜 조직의 원래 크기에서는 관찰하기 어려운 측면을 더 쉽게 관찰할 수 있도록 합니다. 또는 조직 수축으로 인해 샘플의 전체 크기를 효과적으로 줄일 수 있으며, 이를 통해 절개 없이 전체 장기 이미징을 수행할 수 있습니다. CLARITY와 CUBIC 프로토콜의 이점은 조직에서 내인성으로 발현된 형광 단백질의 형광을 보존하는 동시에 면역 형광 염색에 순응하는 상태를 유지한다는 것입니다11,12. 면역염색은 수성 또는 유기 조직 투명화 방법을 사용하여 수행할 수 있습니다. 그러나 개인적인 경험에 따르면 유기 기반 프로토콜에 비해 수성 프로토콜을 사용한 항체 호환성의 비율이 더 높은 것으로 나타났습니다. 연구자들은 이미징된 조직 및 해결된 생물학적 질문(예: 전체 장기 이미징 대 특정 관심 영역 이미징)을 기반으로 사용할 조직 제거 방법을 고려해야 합니다. 모든 대용량 이미징 질문에 대해 강력한 턴키 분석을 가능하게 하는 보편적인 조직 투명화 기법은 없으며, 사용 가능한 방법은 생물학적 응용 분야에 따라 뚜렷한 장점과 단점을 나타냅니다.
항체 염색을 수행할 때 여러 측면을 고려해야 합니다. CLARITY 샘플은 아크릴아미드 하이드로겔에 내장되어 있기 때문에 배양에 더 오랜 시간이 필요한 경향이 있습니다12. 항체 배양에 필요한 시간은 각 샘플의 부피와 두께에 따라 다릅니다. 여기에 설명된 대부분의 샘플은 두께가 ~2-3mm였으며 조직 전체를 완전히 염색하는 데 3일이 걸렸습니다. 목표가 쥐의 뇌 전체를 영상화하는 것이라면 항체 배양 시간은 1주일 이상이 걸릴 수 있습니다12. 면역형광 이미징을 위한 수성 조직 세척 방법과 유기 조직 세척 방법 중 하나를 선택하는 것은 항체 호환성에 달려 있을 수 있습니다. 일반적으로 CUBIC 또는 CLARITY의 경우 배양된 세포 및 조직에서 작동하는 항체의 적중률은 ~70%입니다. 수성 조직 투명화 방법을 사용하든 유기 조직 투명화 방법을 사용하든 관계없이 사용된 특정 방법에 대한 모든 항체의 호환성과 효과를 평가해야 합니다. 이 프로토콜 섹션에서 볼 수 있듯이 CUBIC 및 CLARITY 처리된 샘플에 대한 면역 염색은 투명화가 완료된 후에 발생합니다. 반대로, 이 단계는 일부 유기 기반 프로토콜에 대한 청산 절차 전에 발생하며 그 후 사후 수정이 수행됩니다.
조직이 굴절률과 일치하는 이미징 매체에 완전히 몰입하는 것이 매우 중요합니다. 그렇게 하지 않으면 이미징하는 동안 구면 수차가 발생하고 이미지 획득 중에 캡처된 빛이 왜곡됩니다. 공초점 및 LSFM용 샘플을 장착할 때 이미징 매체에서 모든 기포를 제거할 때 기포가 샘플로 오거나 샘플에서 멀어지는 빛의 경로를 방해할 수 있으므로 주의하여 제거해야 합니다. 기포는 최종 시료 장착 전에 피펫으로 수동으로 제거할 수 있습니다. 컨포칼 현미경으로 더 두꺼운 샘플을 이미징하기 위해 0.5mm 두께보다 큰 조직을 수용할 수 있도록 여러 개의 실리콘 스페이서를 서로 겹쳐 놓을 수 있습니다. 한 가지 권장 사항은 추가 샘플 이동 없이 현미경에 장착한 상태에서 몇 시간에서 밤새 RIMS의 모든 조직을 평형화하는 것입니다. 조직과 이미징 매체의 완전한 평형은 이미징 중에 수차를 생성할 수 있는 일치하지 않는 굴절률과 용액의 혼합을 방지합니다. 투명화된 조직 샘플을 장착할 때 모든 현미경에서 모든 샘플을 이미지화할 수 있는 단일 턴키 장착 방법이 없다는 점을 기억하는 것이 중요합니다. 이 프로토콜은 한 가지 상황에서 최적으로 작동한 시료 장착 옵션에 대해 설명하지만, 사용된 개별 현미경과 해결된 생물학적 질문에 따라 시료 장착을 위한 다양한 접근 방식이 있습니다. 이러한 접근 방식에는 아가로스에 샘플을 삽입하거나, 후크 또는 굴절률 일치 플라스틱 라인에 샘플을 매달거나, 고슴도치 어댑터를 사용하거나, 샘플 홀더를 3D 프린팅하거나, 접착제로 샘플을 플라스틱 접시에 부착하는 것이 포함되지만 이에 국한되지 않습니다.
컨포칼 현미경은 조직 부피 ~1mm, 3-1cm3를 이미징하는 데 잘 작동할 수 있습니다. 컨포칼 현미경의 경우 2-10x 대물렌즈를 사용하여 초기에 관심 영역을 찾고 단일 세포 해상도로 더 큰 부피 또는 전체 조직 Z 스택을 획득합니다. 20-63x 대물렌즈로 전환하여 세포 내 정보와 함께 특정 관심 영역의 고해상도 이미지를 획득합니다. CUBIC 및 CLARITY 투명체 조직 이미징을 위한 이상적인 대물렌즈는 조직 및 이미징 솔루션의 굴절률과 정확하게 일치하는 CLARITY/Scale 전용 대물렌즈입니다. 이러한 유형의 대물렌즈를 사용할 수 없는 경우, 공기 대물렌즈보다는 글리세롤 또는 오일 이멀젼 대물렌즈(예: LD LCI Plan-Apochromat 25 x 0.8 NA Imm Corr DIC M27 multi-immersion objective: working distance = 0.57 mm)로 샘플을 이미징하는 것이 가장 좋습니다. 이렇게 하면 이미지 캡처 중 일치하지 않는 굴절률로 인한 광학 왜곡 도입을 최소화할 수 있습니다. 20-25x 대물렌즈는 복잡한 조직 환경에서 개별 세포의 염색 세부 정보를 얻는 것과 더 큰 볼륨의 이미지 획득 사이의 균형을 맞출 수 있습니다. 중요한 것은 대부분의 컨포칼 현미경에는 이미징 볼륨의 3D 타일링이 가능한 모듈이 포함되어 있다는 것입니다. 이러한 유형의 이미지 획득은 이상적으로 서브 셀룰라 정보를 포함하는 더 큰 볼륨의 Z 스택을 생성할 수 있습니다.
LSFM 이미징을 통해 많은 양의 조직(>1cm3) 및 전체 장기의 맥락에서 특정 세포 집단의 3D 시각화를 수행할 수 있습니다. 지난 10년 동안 LSFM과 결합된 조직 청소는 주로 설치류 내의 뇌 연결성을 이해하는 데 중점을 두었습니다. 그러나 보다 최근의 응용 분야에는 종양 전이성 풍경시각화 16, 해부학적 구획 내 세포 분포 9,17 및 병원체 분산18 이 포함됩니다. 배양된 세포와 비교했을 때, 조직 내 대부분의 생물학적 사건은 불균일하며, LSFM은 이러한 사건의 공간 조직 이질성(예: 바이러스 복제, 면역 신호, 세포 분포 등)을 시각화하고 정량화하는 데 특히 능숙할 수 있습니다.
컨포칼 또는 LSFM을 통해 획득한 3D 데이터 세트는 다양한 이미지 분석 플랫폼으로 후처리할 수 있습니다. Imaris 소프트웨어 제품군은 표면 구성, 3D 애니메이션 생성 및 셀 정량화에 사용할 수 있습니다. 그러나 효율적인 이미지 후처리 및 분석을 가능하게 하는 수많은 이미지 분석 시스템이 있습니다. ImageJ/Fiji 프리웨어19 는 대부분의 실험실에서 사용할 수 있는 매력적인 대체 이미지 처리 플랫폼이지만 모든 형태의 이미지 분석 및 시각화에 탁월한 만능 분석 소프트웨어는 없습니다. 많은 이미지 분석 소프트웨어 제품군은 공유 사용 시설을 통해 사용할 수 없는 경우 엄청나게 비쌀 수 있습니다. 마지막으로, LSFM 또는 대형 타일 컨포칼 3D 데이터 세트의 중요한 측면은 데이터 관리입니다. 이러한 이미징 플랫폼은 데이터 시각화 및 정량화를 위해 고급 컴퓨터 워크스테이션이 필요한 대용량 파일(>1Tb)을 생성할 수 있습니다. 궁극적으로, 이 이미징 워크플로우는 전체 조직 내에서 공간적으로 구별되는 세포 집단의 획득 및 정량화를 간소화할 수 있으며 대부분의 조직 소스 및 생물학적 시스템에 광범위하게 적용할 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
일리노이 대학교 어바나-샴페인 게놈 생물학 연구소(University of Illinois at Urbana-Champaign Institute for Genomic Biology) 핵심 시설에서 컨포칼 및 광시트 형광 현미경을 사용해 주셔서 감사합니다. I147821, DA051915, AI131385 및 P30 AI036214 보조금으로 자금을 지원받은 인체 조직 샘플에 대한 "The Last Gift" 코호트의 놀라운 사람들에게 감사드립니다. SHIV에 감염된 NHP 조직 샘플에 대해 Nancy Haigwood와 Ann Hessell에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Acrylamide Solution (in 0.1 M PBS, 40 mL in total) | |||
| 40% Acrylamide: 4 mL | Bio-Rad | 1610144 | |
| VA-044 Thermal Initiator: 0.1g | Fujifilm | 011-19365 | |
| CLARITY Blocking solution (in 0.1 M PBS, 5 mL in total) | |||
| Fetal bovine serum (FBS): 200 µL | Atlas Biologicals | F-0500-D | |
| Rat anti-human or anti-mouse FcR: 50 µL | Miltenyi | 130-092-575(mouse)/130-059-901(human) | |
| Sodium azide (from stock solution): 5 µL | Sigma | 71289-50G | |
| Tween-20: 5 µL | Fisher Scientific | BP337-500 | |
| CLARITY wash solution (in 0.1M PBS, 50 mL in total) | |||
| Sodium azide (from stock solution): 50 µL | Sigma | 71289-50G | |
| Tween-20: 50 µL | Fisher Scientific | BP337-500 | |
| CUBIC Blocking solution (in 0.1M PBS, 5 mL in total) | |||
| Fetal bovine serum (FBS): 200 µL | Atlas Biologicals | F-0500-D | |
| Rat anti-human or anti-mouse FcR: 50 µL | Miltenyi | 130-092-575(mouse)/130-059-901(human) | |
| Sodium azide (from stock solution): 5 µL | Sigma | 71289-50G | |
| Triton X-100: 5 µL | VWR | M143-1L | |
| CUBIC Reagent-1 (in 0.1M PBS, 50 mL in total) | |||
| N, N, N’, N’-tetrakis (2-hydroxypropyl) ethylenediamine: 12.5 g | Aldrich | 122262 | |
| Triton X-100: 7.5 g | VWR | M143-1L | |
| Urea: 12.5 g | Fisher chemical | U15-500 | |
| CUBIC Reagent-2 (in 0.1M PBS, 50 mL in total) | |||
| Sucrose: 25 g | Sigma | S1888-500G | |
| Sodium azide (in powder form): 10 g | Sigma | 71289-50G | |
| Sodium azide stock solution (in DI H2O, 50 mL in total) | Sigma | 71289-50G | |
| Triethanolamine: 5 g | Sigma | 90270-500mL | |
| Triton X-100: 50 µL | VWR | M143-1L | |
| Urea: 12.5 g | Fisher chemical | U15-500 | |
| CUBIC wash solution (in 0.1M PBS, 50 mL in total) | |||
| Sodium azide (from stock solution): 50 µL | Sigma | 71289-50G | |
| Triton X-100: 50 µL | VWR | M143-1L | |
| DAPI staining solution (0.5 µg/mL) | |||
| DAPI stock solution: 1 µL | |||
| Wash solution: 10 mL | |||
| DAPI stock solution (5 mg/mL) | |||
| DAPI powder: 5 mg | Sigma-Aldrich | D9542-1MG | |
| DMSO (100%): 1 mL | ThermoFisher | D12345 | |
| Imaging Media RI-2 (in dH2O) | |||
| 90% Histodenz | Sigma | D2158-100G | |
| 0.01% Sodium azide | Sigma | 71289-50G | |
| 0.02 Sodium Phosphate Buffer, pH 7.5 | Sigma-Aldrich | S9638-250G | |
| 0.1% Tween-20 | Fisher Scientific | BP337-500 | |
| Primary antibodies (in blocking solution without rat anti-mouse FcR, 2 mL in total) | |||
| Goat anti-HIV p24: 10 µL (1:200) | Creative Diagnostics | DPATB-H81692 | |
| Mouse anti-human CD68: 10 µL(1:200) | Dako | M0876 | |
| Rabbit anti-human CD3: 10 µL (1:200) | Dako | A0452 | |
| 8% SDS Solution (in 0.1 M PBS, 50 mL in total) | |||
| SDS powder: 4 g | Sigma-Aldrich | L3771-500G | |
| Secondary antibodies (in blocking solution without rat anti-mouse FcR, 2 mL in total) | |||
| Donkey anti-goat conjugated with AlexaFluor647: 2 µL | Invitrogen | A21447 | |
| Donkey anti-mouse conjugated with AlexaFluor594: 2 µL | Invitrogen | A21203 | |
| Donkey anti-rabbit conjugated with AlexaFluor488: 2 µL | Invitrogen | A21206 |
참고문헌
- Spalteholz, W., Barker, L. F., Mall, F. P. Hand-Atlas of Human Anatomy. , J.B. Lippincott Co. Philadelphia. Second edition in English (1907).
- Jacob, T., Gray, J. W., Troxell, M., Vu, T. Q. Multiplexed imaging reveals heterogeneity of PI3K/MAPK network signaling in breast lesions of known PIK3CA genotype. Breast Cancer Research and Treatment. 159 (3), 575-583 (2016).
- Kieffer, C., Ladinsky, M. S., Ninh, A., Galimidi, R. P., Bjorkman, P. J. Longitudinal imaging of HIV-1 spread in humanized mice with parallel 3d immunofluorescence and electron tomography. eLife. 6, 23282(2017).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
- Compton, A. A., Schwartz, O. They might be giants: Does syncytium formation sink or spread HIV infection. PLoS Pathogens. 13 (2), 2-8 (2017).
- Symeonides, M., et al. HIV-1-induced small T cell syncytia can transfer virus particles to target cells through transient contacts. Viruses. 7 (12), 6590-6603 (2015).
- Sharova, N., Swingler, C., Sharkey, M., Stevenson, M. Macrophages archive HIV-1 virions for dissemination in trans. The EMBO Journal. 24 (13), 2481-2489 (2005).
- Colby, D. J., et al. Rapid HIV RNA rebound after antiretroviral treatment interruption in persons durably suppressed in Fiebig I acute HIV infection. Nature Medicine. 24 (7), 923-926 (2018).
- Ladinsky, M. S., et al. Mechanisms of virus dissemination in bone marrow of HIV-1-infected humanized BLT mice. eLife. 8, 46916(2019).
- Buettner, M., Bode, U. Lymph node dissection--understanding the immunological function of lymph nodes. Clinical and Experimental Immunology. 169 (3), 205-212 (2012).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10, 1860-1896 (2015).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Sompuram, S. R., Vani, K., Bogen, S. A. A molecular model of antigen retrieval using a peptide array. American Journal of Clinical Pathology. 125 (1), 91-98 (2006).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. The journal of histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 65 (1), 5-20 (2017).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the PEGASOS method. Cell Research. 28 (8), 803-818 (2018).
- Guldner, I. H., et al. An Integrative platform for three-dimensional quantitative analysis of spatially heterogeneous metastasis landscapes. Scientific Reports. 6, 24201(2016).
- Muntifering, M., et al. Clearing for deep tissue imaging. Current Protocols in Cytometry. 86 (1), 38(2018).
- DePas, W. H., et al. Exposing the three-dimensional biogeography and metabolic states of pathogens in cystic fibrosis sputum via hydrogel embedding, clearing, and rRNA labeling. mBio. 7 (5), 00796(2018).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image. Nature Methods. 9 (7), 676-682 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유