JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐의 부분 이종화 힌드래그 이식 모델
* 이 저자들은 동등하게 기여했습니다
요약
이 논문은 쥐에 있는 부분이성 골균 플랩 이식 프로토콜 및 중간 후속에 있는 그것의 잠재적인 결과를 제시합니다.
초록
혈관 화 복합 동종 이식 (VCA)는 복잡한 조직 결함 후 자가 외과 가능성없이 환자를위한 가장 진보 된 재건 옵션을 나타냅니다. 얼굴과 손 이식은 환자의 삶을 변화시켰으며, 새로운 미적 및 기능성 사회 기관을 제공합니다. 유망한 결과에도 불구하고 VCA는 평생 면역 억제 및 전염성 합병증으로 인해 여전히 실적이 저조합니다. 쥐는 면역 학적 경로 와 접목 거부 메커니즘을 조사 하는 생체 내 연구에 대 한 이상적인 동물 모델. 쥐는 또한 관류 및 냉동 보존 연구를 포함하여 새로운 복합 조직 이식 보존 기술에 널리 사용됩니다. 쥐에서 VCA에 사용 되는 모델 재현 해야 합니다., 신뢰할 수 있는, 낮은 수술 후 이환율과 사망률. 이종성 사지 이식 절차는 이 기준을 충족하고 치열 하 사지 이식 보다 수행 하기 쉽습니다. 설치류 미세 수술 모델을 마스터하려면 미세 수술 및 동물 관리에 대한 견고한 경험이 필요합니다. 본명에서 쥐에서 부분 이종요법 골염 플랩 이식의 신뢰할 수 있고 재현 가능한 모델을 보고, 수술 후 결과, 잠재적인 합병증의 예방 수단.
서문
지난 2년간 VCA는 얼굴1,상반두 절단2,음경3및 기타 복잡한 조직 결함4,5를포함하여 심각한 손상을 입은 환자를 위한 혁신적인 치료법으로 진화해 왔다. 그러나, 평생 면역 억제의 결과는 아직도 이 복잡한 재건 수술의 더 넓은 적용을 방해합니다. 기본 연구는 거부 방지 전략을 개선하는 데 중요합니다. VCA 보존 시간을 늘리는 것은 이식 물류를 개선하고 기증자 풀을 늘리는 데도 필수적입니다 (VCA 기증자는 피부 톤, 해부학 크기, 성별을 포함한 견고한 장기 기증자보다 더 많은 기준을 충족해야하므로). 이러한 맥락에서, 쥐 사지 이식은 동종 이식6,7,신규 내성 유도 프로토콜8,보존 연구9,10,11의면역 거부에 대한 연구에서 널리 사용된다. 따라서 이러한 VCA 모델은 VCA 번역 연구를 마스터하는 핵심 요소입니다.
골연액은8,12,13,14에서VCA를 연구하는 신뢰할 수 있는 모델로 문헌에서 기술되었다. 직교 전지 이식은 이식 기능의 장기 평가를 허용하지만, 수술 후 사망률 및 사망률14와관련된 시간이 많이 소요되는 절차이다. 대조적으로, 이성애 사지 이식 모형은 비 기능적이지만, VCA에 재현가능한 연구를 가능하게 합니다. 수술 후 결과는 쥐 VCA 이식 연구의 시작 전에 안정적으로 예상될 수 있습니다. 이 연구는 3 주 간의 후속 기간 동안 수술 및 수술 후 발생할 수있는 빈번한 가능한 결과와 합병증을 포함하는 쥐의 부분 이성토성 골다움증 플랩 이식 모델을보고합니다.
프로토콜
모든 동물은 실험실 동물의 관리 및 사용에 대한 NIH 가이드에 따라 인도적 치료를 받았습니다. 기관 동물 관리 및 사용 위원회 (IACUC 프로토콜 2017N000184) 및 동물 관리 및 사용 검토 사무실 (ACURO)는 모든 동물 프로토콜을 승인했습니다. 근친 남성 루이스 쥐 (250-400 g) 모든 실험에 사용 되었다.
1. 수술
- 루이스 쥐를 이소플루란 흡입을 사용하여 마취한다. 유도 챔버에서 5% 이소플루란으로 마취를 유도하고 호흡 콘을 통해 1.5-3%의 이소플루란 흡입으로 마취를 유지한다.
- 생존 시술에 수술 전에 눈 윤활유를 적용하십시오. 수술 부위를 면도하고, 탈필 크림, 스크럽, 무균 커튼으로 커튼으로 치료합니다.
- 절개 전과 시술 중에 정기적으로 발가락 핀치 테스트를 통해 총 마취를 확인하십시오. 전체 절차 전반에 걸쳐 심장과 호흡 속도를 모니터링합니다. 모든 수술의 경우 멸균 기기, 소모품, 커튼 및 장갑을 사용하여 멸균 상태를 유지하십시오. 프로시저에 사용되는 계측기 목록은 재료 표를 참조하십시오.
2. 기증자 오른쪽 부분 뒷다리 조달
- 다리의 단면 세 번째에서 발목 위의 피부의 할례 절개를 합니다.
- 양극성 집게를 사용하여 포라이트 동맥의 사페누스 동맥과 말단 가지를 골격화하고 소생시킵니다. 위장골혈증, 솔레우스, 티비알리스 전방, 이두근 이두근이 노출될 때까지 이두근을 잘라냅니다.
- 오른쪽 잉게날 주름에 2.5cm 절개를 합니다. 잉게날 지방 패드를 해부하고 대퇴 혈관을 노출하기 위해 그것을 철회. 잉게인인대와 클램핑 포스프를 파악하여 잉게날 지방 패드를 disinal을 잡습니다.
참고: 잉구인 지방 패드는 부분 사지의 수확에 포함되어 있습니다. - 대퇴 혈관을 해부, 머피 가지를 개별화 (깊은 근육 담보 지점은 일반적으로 인기구 인대와 상복부 지점 사이의 중간에 위치), 8-0으로 ligate 나일론 넥타이.
- 27.5 G 바늘을 사용하여 음경 등쪽 정맥에 주입된 100 IU/kg 헤파린으로 기증자 쥐를 헤파리니즈합니다.
- 엉덩이 주위의 피부 절개를 완료합니다.
- 양극성 집게를 사용하여 이두근 여성스러움과 글루테우스 피상화 근육을 소작합니다. 중대퇴골 길이의 상시 신경을 코터리화하고 잘라냅니다. 대퇴골문장의 수준에서 대퇴골을 근접적으로 노출한다.
참고: 애드덕터와 사분면 근육은 조달에서 제외됩니다. 지명된 페디클이 유지됩니다. - 잉게인인의 수준에서 8/0 나일론 넥타이와 Ligate 대퇴골 혈관. 24 G 혈관 카테터를 삽입할 수 있도록 합자 바로 아래 대퇴 동맥에 동맥 절제술을 수행하고 팽창시키세요.
- 대퇴골의 전방을 드러내며 페디클 아래에 남은 근육을 cauterize하고 잘라냅니다.
- 골 커터를 사용하여 경골과 대퇴골을 각각 근접및 disismly(중간 길이)로 자른다.
- 부분 힌드레다리를 헤파린 식염수(100 IU/mL)로 2mL로 플러시하여 명확한 정맥 유출을 얻습니다. 미생물이송(그림 1)까지멸균 거즈에 얼음에 보관하십시오.
- 동물은 전신 마취하에 있는 동안, 동물이 생명의 흔적을 보이지 때까지 산기화에 의해 안락사를 수행 (호흡 움직임과 심장 박동없음).

그림 1: 쥐 부분 뒷다리 수확. 24 G 협심증은 대퇴 동맥에 삽입되어 이성균 미생물 혈관 전달을 준비합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 받는 사람 수술
- 절개하기 전에 목 뒤쪽을 면도하고 buprenorphine 0.01-0.05 mg/kg을 피하로 투여하십시오. 가열 패드에 쥐를 척추 위치에 놓습니다.
- 오른쪽 잉구인 주름에 2.5cm 절개를 합니다. 잉게인 지방 패드를 해부하고 대퇴 혈관을 노출하기 위해 그것을 기울입니다. 후크를 사용하여 인내 인대와 클램핑 포스프를 철회하여 잉게날 지방 패드를 disinal지방 패드를 더 이상 유지합니다.
- 대퇴선박을 해부하고, 머피 가지를 개별화하고, 8/0 나일론 넥타이로 리게이트를 한다.
- 8/0 나일론 넥타이를 사용하여 상복부 선박 위에 두 선박을 분리합니다. 근사 클램프를 근교로 배치하고 혈관 끝을 팽창시; 헤파린 식염수로 헹구는 다.
- 엉덩이 위의 왼쪽 측면에 절개를하고, 잉게날 주름에 피하 터널피 포켓을 만듭니다.
참고: 절개는 동물이 정상적인 뒷다리 동작을 유지하도록 엉덩이의 운동 범위 이상으로 만들어집니다. 또한, 접목 삽입과 미세 혈관 전달 부위 사이의 분리 된 다리를 유지하면 접목의 더 나은 고정을 할 수 있습니다(도 2). - 미세 혈관 전달을 위한 피하 터널을 통해 부분 사지및 잉게인 지방 패드의 근접 부분을 놓습니다. 10/0 나일론 봉합사를 사용하여 정맥 및 동맥 해부학을 수행합니다. 근사 클램프를 모두 제거하고 사지의 부활을 관찰합니다. 각 해부학의 가관성을 평가하기 위해 두 선박에 "착유 테스트"를 수행합니다.
참고: 정맥 해부학에 8~9개의 봉합사가 필요하며, 동맥 해부학의 경우 평균 6봉합사가 필요합니다. - 이식된 사지의 내측에 세로 피부 절개를 하고 이식편을 삽입합니다. 이식편의 과도한 피부를 제거하고, 흡수성 4/0 봉합사를 사용하여 별도의 봉합사및 실행 봉합사로 상처를 닫습니다.
- 이식된 사지의 잉구지방 패드와 두 개의 분리된 흡수성 봉합사를 사용하여 수용자를 함께 봉합하고, 미세혈관 해부학의 마지막 검진 후 맨 끝에 있는 잉구 주름을 닫는다.
참고: 인구이날 지방 패드는 해부학 위에 지방의 보호 층을 추가하고 이식편과 페디클의 고정 된 위치를 보장하기 위해 단단히 봉합됩니다. 세심한 폐쇄는 상처 치유에 더 좋습니다. 또한 상처에서 잔류 출혈을 방지하고 자기 절단의 위험을 감소시다. - 양변 출혈의 양에 따라 식염수 1-3mL로 유체 손실을 피하로 보상합니다.
- 동물의 목에 엘리자베스 칼라를 놓고 피부에 2 개의 느슨한 봉합사를 바르고 올바른 위치에 유지합니다.
- 이소플루란 흡입을 중지하고, 완전히 의식하고 외래할 때까지 온난화 패드에 동물을 지속적으로 모니터링합니다.
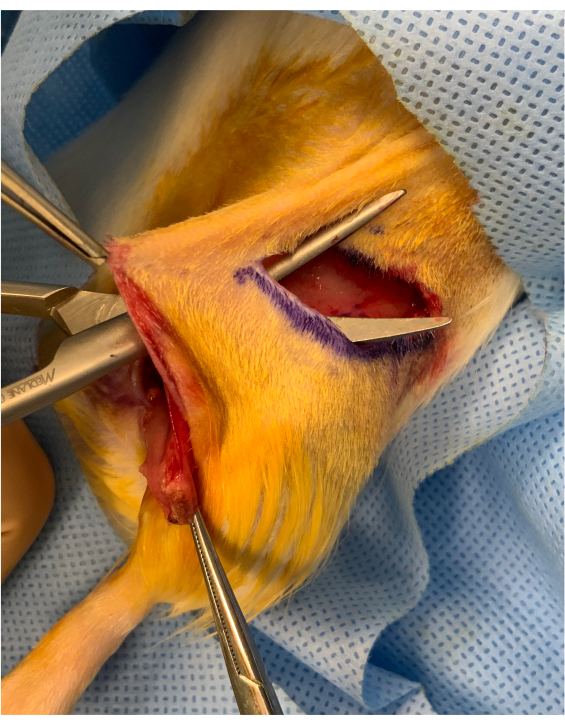
그림 2: 골조의 발병 전에 perioperative 이미지. 약 1cm의 잇수다리는 잉게날 주름 절개와 엉덩이 위의 이식편 의 삽입 사이에 보존된다. 접목은 교량 아래에 배치되어 미세 혈관 전달을 위해 안정적으로 유지됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 수술 후 치료
- 동물을 72시간 동안 매일 두 번 모니터링한 다음 수술 후 날(POD) 7일까지 매일 한 번, 일주일에 두 번 모니터링합니다.
참고: 모니터링은 동물 및 이식 상태(창백한 눈은 동물 통증, 비정상적인 이식 색상/온도의 지표로서 추가 유체, 포르피린 염색이 필요할 수 있음)에 맞게 조정되어야 하며, 수의사와 추가 주의를 기울여야 합니다. 단일 하우징은 접목에 손상을 피하기 위해 전체 연구 기간 동안 받는 쥐에 필요합니다. - IACUC 지침에 따라 부프레노르핀 및/또는 비스테로이드 항염증제 약물의 피하 주사로 진통을 수행하십시오.
- 접목을 평가하고 동일한 장치를 사용하여 사진과 함께 매일 신체 검사를 수행합니다.
참고: 이식편 피부에 제모 크림을 사용하면 이식의 피부 색을 더 잘 평가하는 데 도움이 됩니다.
결과
이 단일 연산자 연구에서, 30 개의 시너지 이종 부분 사지 이식이 수행되었다. 성공은 VCA 실패 또는 안락사를 요구하는 합병증의 부재로 수술 후 21일에 정의되었습니다. 접목의 정상적인 진화는 도 3로표현된다. 수령인의 부분 사지 조달 및 이식 개시에 대한 평균 기간은 각각 35 분과 105 분이었습니다. 평균 허혈 시간은 105 분이었다. 후속 기간 동안, 합병증의 두 가지 유형이 ...
토론
설치류의 정형소 사지 이식 모델은 문헌(15,16,17)에기재되어 있다. 그러나, 그들은 신경 수리가 필요, 근육 재부착, 그리고 대퇴골의 완벽한 골합성, 이는 매우 어려운 단계가 될 수 있습니다. 이러한 모델은 또한 설치류14에서더 높은 이환율 및 사망률과 연관되며, 특히 이식된 뒷다리의 정상적인 기능회복이 ?...
공개
저자는 공개가 없습니다.
감사의 말
이 작품은 상 No. 아래 의회 지시 의학 연구 프로그램을 통해 보건 담당 국방부 차관실에 의해 지원되었다. W81XWH-17-1-0680. 의견, 해석, 결론 및 권고사항은 저자의 의견이며 반드시 국방부의 승인을 받지는 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
참고문헌
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유