Method Article
진핵 세포에서 번역 단지의 신속한 생체 내 고정 및 격리
* 이 저자들은 동등하게 기여했습니다
요약
우리는 살아있는 효모와 포유류 세포에서 포름알데히드가 교차하는 번역 (단백질 생합성) 복합체를 급속하게 안정화시키는 기술을 제시합니다. 접근은 과도 중간및 동적 RNA:단백질 상호 작용을 해부할 수 있습니다. 교차 연결된 복합체는 심층 시퀀싱 기반 프로파일링 방법, 현미경 검사법 및 질량 분석법과 같은 여러 다운스트림 응용 분야에서 사용할 수 있습니다.
초록
메신저 (m)RNA의 빠른 재배포 및 mRNA 번역의 변경을 포함하는 급속한 반응은 세포의 지속적인 동종 성 조정에 관련됩니다. 이러한 조정은 변동하는 영양소 및 염도 수준, 온도 및 다양한 화학 및 방사선 응력 중에 진핵 세포 생존가능성과 '손상 제어'에 매우 중요합니다. RNA 수준의 반응의 매우 역동적인 특성과 많은 RNA:RNA 및 RNA:단백질 중간체의 불안정성으로 인해 세포질 RNA 상태의 의미 있는 스냅샷을 얻는 것은 제한된 수의 방법으로만 가능하다. 전사 전체, RNA-seq 기반 리보솜 프로파일링 형 실험은 번역 제어를 위한 가장 유익한 데이터 소스 중 하나입니다. 그러나, 균일한 RNA및 RNA:단백질 중간 안정화의 부재는 특히 빠르게 진행되는 세포 반응 통로에서 다른 편견으로 이끌어 낼 수 있습니다. 이 문서에서는 RNA 및 RNA:단백질 중간 안정화를 돕기 위해 서로 다른 투과성의 진핵 세포에 적용되는 신속한 고정의 상세한 프로토콜을 제공합니다. 우리는 또한 리보소말 및 폴리 (ribo) somal 분획을 가진 그들의 공동 침전에 기초한 안정된 RNA:단백질 복합체의 격리의 예를 제공합니다. 분리된 안정화 된 물질은 번역 복합 프로파일 시퀀싱 (TCP-seq) 접근 방식 및 그 유도체와 같은 리보솜 프로파일링 유형 실험의 일부로 나중에 사용할 수 있습니다. TCP-seq 스타일의 방법의 다목적성은 이제 다양한 유기체 및 세포 유형의 응용 프로그램에 의해 입증되었다. 안정화된 복합체는 또한 다른 폴리(ribo) somal 분획으로 분리되고 크로스링크 반전의 용이성 으로 인해 RNA 시퀀싱을 실시하는 전자 현미경 을 사용하여 추가적으로 친화및 이미지화될 수 있다. 따라서, 스냅 냉각 및 포름알데히드 고정에 기초한 방법은, 퇴적계 기반 또는 다른 유형의 RNA:단백질 복합 농축에 선행되고, 살아있는 세포에서 급속한 RNA:단백질 복합역학의 미세한 세부사항을 조사하는 데 특히 관심이 있을 수 있다.
서문
살아있는 유기체는 항상성을 유지하고 생존을 보장하기 위해 신속한 반응을 필요로하는 수명 전반에 걸쳐 동적 내 세포 및 세포 외 변화의 대상이됩니다. 환경 적응을 허용하기 위하여는, 진핵 세포는 유전자 발현 통제를 통해 그들의 물질 대사를 조정합니다. 유전자 발현 조절은 전사 및/또는 번역 중에 가해질 수 있다; 일반적으로 더 빠르게 발생 하는 번역응답으로1,2,3,4. 예를 들어, 번역 변화는 일반적으로 응력 발병 의 1-30 분 이내에 발생하며, 전사 수준 변경은 스트레스 노출3,4,5후에 몇 시간을 따릅니다. 번역 출력에 대한 변경은 세포질에서 메신저 (m) RNA 분자의 지속적인 가용성으로 인해 더 빠르게 달성된다. 반대로, 전사 수준에서 새로운 mRNA 분자는 합성되어야 하며, 진핵에서 처리 및 핵으로부터 내보내져 응답 시간2,4,6,7,8에광범위한 지연을 발생시켜야 한다.
스트레스에 대한 급성 번역 반응은 일반적으로 세포 생존에 필요한 단백질의 선택적 업 규제와 함께 번역 출력의 전반적인 감소를 특징으로합니다.1,3,4,9. 단백질 생산량을 줄이는 것은 공정의 높은 에너지 비용으로 인해 매우 중요하다고 생각됩니다.3,7. 선택적 억제 및 업 규제를 용이하게 하기 위해 다양한 복잡한 규제 메커니즘에 의해 번역 응답이 제공됩니다. 규정은 번역의 모든 단계에 걸쳐 가해질 수 있습니다: 개시, 신장, 폴리펩티드 생합성 의 종결 및 리보소말 재활용10,11,12,13개시 단계에서 가장 강하게 전시되고 있으나5,7,9,10,13. 개시 시, 진핵 개시 인자(eIF)의 도움을 받는 작은 리보소말 하위 유닛(SSU)은 시작 코돈이 인식될 때까지 mRNA의 5'번역되지 않은 영역(UTR)에 결합하고 스캔합니다.2,5,6,8,11,12,13. 규제 메커니즘은 종종 부착, 스캔 및 코돈 인식에 영향을 미치는 eI를 대상으로 합니다. 예를 들어, 개시 인자 eIF2, 개시자 Met-tRNA의 모집에 도움이 되는 필수 번역 요소iMet SSU에, 종종 스트레스 조건하에서 진핵생물을 대상으로4,6,11. 효모에서, 이 요인의 인산화는 영양 박탈과 삼투압 스트레스하에서 유도될 수 있습니다1,4,11,14,15및 포유류 세포에서 아미노산 기아, 내피 망막 (ER) 스트레스, UV 스트레스, 바이러스 감염 및 변경 된 산소 수준에서이 반응을 유발할 수 있습니다.8,9,11. 특정 mRNA 번역의 급속한 강화 조절은 저산소증에 대한 포유류 세포 반응에서 분명하게 드러나며, 이는 저산소유도인자(HIFs) 생합성의 글로벌 신속한 번역 억제 및 선택적 업 조절을 나타낸다. HIF는 전사 요인이며, DNA 전사 수준에서 장기 세포 재프로그래밍을 유도합니다.8,9,16. 열 응력 하에서 효모에서 유사한 반응이 관찰되었으며, 열 충격 단백질(HSP)의 빠른 번역 발현과 지연된 전사 수준 반응이 뒤따릅니다.17,18. 영양 부족과 열 쇼크 외에도 효모의 번역 반응은 다양한 산소하에서 연구되었습니다.8,19, 명도5인산염, 황20,21 및 질소22,23 수준. 이 연구는 효모의 산업 사용에 대 한 광범위 한 의미를 가지고, 베이킹 및 발효 등24,25. 번역 반응은 또한 산화 스트레스 같이 세포내 응력이 특징인 신경 퇴행성 질환 및 심장 병과 같은 질병의 이해를 증진시키는 데 도움이 될 수 있습니다. 전반적으로, 번역 반응은 유전자 발현 통제에 필수적이고 진핵 생물에 있는 긴장 조건의 넓은 범위에 급속한 적응을 촉진합니다.
번역 응답을 공부하려면 번역 환경의 최소 왜곡된 스냅숏을 제공하는 방법이 필요합니다. 다각성 프로파일링은 mRNA를 통한 번역 연구에 사용되는 고전적인 접근법으로, 자당 그라데이션(26,27)을통해 극심분리를 통해 mRNA의 폴리(ribo) 소량 분획을 분리하는 것을 포함한다. 이러한 접근법은 개별 mRNA(역전사 및 폴리머라제 연쇄 반응, RT-PCR26)와같은 검출 방법 또는 전 세계적으로 고처리량 기술(마이크로어레이 또는 RNA-seq28,29)에대한 번역 수준을 탐구하는 데 사용될 수 있다. 보다 진화된 접근법은 리보솜 프로파일링으로, 게놈 전체 척도에서 mRNA 분자를 따라 리보솜을 길쭉하게 하는 위치뿐만 아니라, 주요 및 대체 시작 부위의 전사 및 활용을 통한 번역 효율의 추론을 가능하게 한다30,31. 리보솜 프로파일링은 리보솜 존재에 의해 보호되는 mRNA 단편의 격리 및 시퀀싱을 포함한다. 리보솜 프로파일링은 저산소 스트레스, 열 충격 및 산화응력 31, 32를포함한 여러 조건에 걸쳐 번역 역학에 대한 상당한 통찰력을제공했습니다. 이 기술은 효모 및 포유류 세포를 포함한 다중 소스 물질 유형에 적응되었습니다.
다각형 및 리보솜 프로파일링은 번역 연구의 기능을 확장하는 데 기본적이었지만, 번역 과정에는 이러한 방법으로 캡처하기 어려운 다양한 번역 중간체 및 복합체가포함됩니다(11,13). 번역 복합체가 특정 번역 억제제(항생제)를 첨가하여 생체내에서 안정화되기 때문에, 특정 리보솜 분포 유물로 이어지는, 또는 세포 용해시(항생제) 또는 특이하지 않은(높은 염또는 마그네슘 이온)의 박탈로 이어지는 빠른 반응 유형을 연구할 수 있는 능력의 부족에서 비롯된 추가적인 제한, 33중년의 부족또는 덜 안정된33중년의박탈로 이어지는 34,35.
포름알데히드는 크로마티신 면역 침전(ChIP) 및 교차 연결 면역 침전(CLIP) 연구와 같은 핵산 및 단백질을 교차 연결하는 데 널리 사용된다. 그것의 작은 크기와 우수한 세포 투과성을 허용 하는 빠른 생체 내 작용(36). 신속한 포름알데히드 교차연결을 기반으로, 리보솜 프로파일 시퀀싱(TCP-seq)10,36,37,38,39,40으로리보솜 프로파일링 접근법이 확장되었다. 효모에서 처음 개발된 TCP-seq는 스캐닝 또는 종료 후 SSU 단지 및 다중 리보소말구성(37,38,41,42)을포함한 모든 번역 중간체를 캡처할 수 있습니다. 이 방법은번역억제제와포름알데히드 크로스링크의 조합접근법을 사용하여 번역의 체포를 용이하게 하는 여러 연구에서 활용되고 있다. 기술의 추가 변형 버전인 선택적 TCP-seq39는최근 교차 형 복합체의 면역 정화를 포함하도록 채택되어 TCP-seq 응용 프로그램의 범위를 넓혀왔다. 포름알데히드 교차 링크의 신속하고 효율적이며 가역적 특성은 이러한 접근 방식을 일시적인 mRNA:번역 복잡한 상호 작용, 특히 매우 역동적인 번역 수준의 응답 경로의 맥락에서 연구하는 데 적합합니다.
여기서 우리는 포괄적 인 번역 복잡한 안정화 및 격리를 목적으로 생체 내 포름알데히드 교차 링크의 과정을 자세히 설명합니다. 효모 및 포유류 세포에 대해 미묘한 별도의 프로토콜을제공합니다(도 1). 면역블로팅(western-blotting), 면역 보조 정제(또는 '면역침전')를 이용한 공동 정제 단백질 인자 검출과 같은 크로스링크 안정화물질(도 1)의후속 사용에 대한 사례를 추가로 간략하게 설명합니다. IP) 및 관심의 특정 요인을 포함하는 번역 복합체의 농축, 전자 현미경 검사및 RNA 시퀀싱.
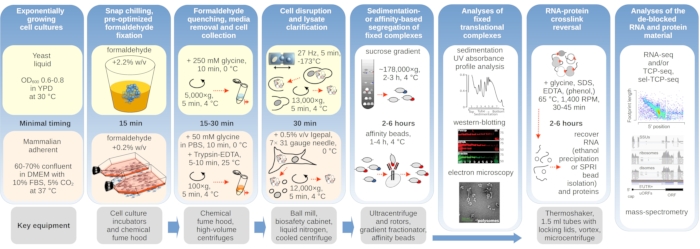
그림 1: 일반적인 실험 설정에 대한 개요를 설명하는 회로도. 번역 복합체의 생체 내 포름알데히드 안정화의 주요 단계는 필요한 주요 계측에 대한 정보로 보완되는 순서도로 묘사됩니다. 교차 링크 된 물질의 잠재적다운 스트림 응용 프로그램은 성공적으로 사용되었지만 RNA의 SPRI 비드 정제, RNA 염기서열 분석 및 질량 분석과 같은이 프로토콜에서 직접 다루지 않은 예를 포함하여 설명됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 효모 세포 프로토콜
- 효모 세포 배양 및 고정
참고: 셀 고정 및 수확은수정과 함께 10,38에서조정됩니다.- 설정 1 L 효모 세포 배양 (야생 형 (WT) BY4741은 600 nm (OD600)에서0.05 AU 이하의 시작 광학 밀도를 가진 궤도 셰이커에서 (효모 추출물의 1 % w /v) 펩톤 2% w/v, 덱스트로스(포도당)의 2%w/v, 40 mg/L의 아데닌 황산염(YPD)이 원하는 조건하에서 사용됨(30°C)이 사용된다. 실험).
- 효모 세포의 액체 현탁액 배양을 펠레팅하기 위한 호환 가능한 로터 및 원심분리기 병으로 미리 접제 원심분리기를 설치합니다. 포도당 기아 실험의 경우, 600nm(OD600)에서0.6-0.8 AU의 광학 밀도가 도달하면 세포에 도달할 수 있으며, 30°C에서 짧은 원심분리, 1분 동안 5,000xg에 도달한다.
참고: 성장하는 세포의 OD기록을 유지하고 지수 성장 단계가 관심있는 경우 OD600이 0.6-0.8 AU에 도달할 때까지 세포가 성장하도록 합니다. - 펠릿을 즉시 따뜻한(30°C) YP 배지에 재연하여 포도당을 첨가하지 않거나 낮게 함유하고(0.25% w/v)를 첨가하고 궤도 셰이커 인큐베이터에서 30°C에서 10분 동안 배양한다.
참고: 미디어 구성은 후속 교차 연결 효율성에 영향을 줄 수 있습니다. 이 프로토콜은 YPD만 사용하여 테스트되었습니다. 기아 실험을 수행할 때 타이밍을 준수하고 절차 간의 지연을 최소화하는 것이 중요합니다. - 세포가 준비되면, 깨끗한 분쇄 물 얼음 250g이 들어있는 비커가있는 연기 후드 내부에 얼음 상자를 설정하십시오. 후드 내부에 25mL 스트리펫과 갓 구입한 메탄올 안정화 37%를 v 포름알데히드 솔루션에 액세스할 수 있도록 하십시오. 분쇄 된 물 얼음의 25 % w / v를 포함하는 비커에 1 L 문화를 붓습니다.
참고: 달리 명시되지 않는 한 세포가 얼어 붙을 때까지 모든 후속 작업 전반에 걸쳐 세포를 얼음 위에 보관하십시오. - 포름알데히드 용액의 37%를 37%로 넣고 최종 농도2.2%를 v로 추가하고 얼음이 녹을 때까지 혼합물을 강렬하게 저어줍니다.
- 얼음이 녹으면 타이머를 10분 동안 설정합니다.
참고: 재현 가능한 고정 결과를 달성하기 위해 권장 되는 타이밍 및 온도 처방을 준수 합니다. - 10분 동안 배양한 후, 미리 냉각된 원심분리기 병으로 배양을 옮기고 세포를 원심분리에 의해 5분 동안 5,000 x g로 전달한다. 이 스핀이 켜지는 동안 50mL 튜브를 미리 식히고 새로 준비된 버퍼 A(글리신을 함유하여 남은 포름알데히드를 중화)에 보관합니다.
참고: 제공된 테이블을 참조하여 정확한 버퍼 컴포지션에 대해 대합니다. - 원심분리 후 원심분리관을 얼음 위에 놓고 펠릿 쪽을 얼음과 접촉합니다. 튜브를 연기 후드에 넣고 상체를 포름알데히드 폐기물 용기에 넣습니다.
- 25mL 스트립을 사용하여 모든 튜브에서 모든 튜브에서 셀 펠릿을 20mL의 버퍼 A로 다시 중단하고 50mL 튜브로 이송합니다.
참고: 이 세척은 되돌릴 수 없는 교차 연결을 피하는 데 중요하며 완충제 추가는 세포의 수확시간에서 20분의 시간을 초과해서는 안 됩니다. - 버퍼 A로 최대 40mL의 부피를 만들고 4°C에서 원심분리, 5,000 x g에서 5분 동안 세척된 셀을 수집합니다.
- 상체를 버리고 글리신을 함유하지 않는 버퍼 A1의 40mL에서 세포 펠릿을 회수하여 글리신 오염을 제거한다.
- 펠릿 세포는 4°C에서 원심분리, 5분 동안 5,000 x g로 다시 원심분리에 의해 세포를 다시 합니다.
- 버퍼 A1을 한 번 더 반복합니다. 상체를 버리고 세포 펠릿을 얼음 위에 놓습니다. 펠릿으로 튜브의 무게를 측정합니다 (젖은 세포 질량은 세포 배양의 1 L 당 ~ 1 g이어야한다).
- 효모 세포 중단 및 사이토솔 수집
- 액체 질소가 있는 알루미늄 호일로 늘어선 폴리스티렌 폼 박스를 약 3cm 깊이로 채웁니다. 상자에 50mL 튜브를 똑바로 놓습니다.
- 10s용 파이펫팅 및 소용돌이로 완충 A2의 550 μL에서 펠릿(~1g 젖은 세포 질량)을 다시 중단합니다. RNase 억제제의 40 U/μL의 10 μL을 다시 10초 동안 첨가합니다.
주의: 액체 질소를 취급할 때 열 절연 장갑과 같은 적절한 보호 장비를 착용하십시오. 액체 질소를 보관하는 데 사용되는 용기가 누출되지 않고 내부튜브 랙이 떠 다니거나 옆으로 떨어지지 않도록 하십시오. 산소 고갈을 피하기 위해 통풍이 잘 되는 지역에서 작업하십시오. - 1mL 파이펫을 사용하여, 액체 질소를 포함하는 50 mL 튜브에 세포 현탁액을 드립.
참고: 물방울의 응집을 피하기 위해 물방울을 천천히 조심스럽게 수행해야 합니다. 새 물방울을 도입하기 전에 물방울이 얼어 붙는지 확인합니다. - 냉동 셀 현탁액을 가진 50mL 튜브를 실온으로 옮기고 액체 질소가 완전히 증발할 때까지 기다립니다. 캡으로 튜브를 밀봉하고 셀 펠릿을 -80 °C에 저장하거나 즉시 더 진행하십시오.
주의: 액체 질소가 튜브를 밀봉하기 전에 완전히 증발되었는지 확인합니다. 밀봉된 튜브에 남은 액체 질소는 위험한 압력 축적을 일으킬 수 있습니다. - 다음 단계를 준비하기 위해, 드라이 아이스에 1.5 mL 뉴클레아제 없는 튜브와 10mL 스테인레스 스틸 연삭 항아리를 미리 식히십시오.
- 냉동 셀 서스펜션 액적을 깨끗하고 멸균된 주걱을 사용하여 항아리에 옮기습니다.
주의: 분쇄 항아리가 단단히 밀봉되어 있는지 확인하십시오. - 연삭 항아리를 액체 질소에 1분 동안 담그면 액체 상이 접합 아래에 남아 있습니다. 1 분 동안 교반에 대한 27 Hz에서 냉동 믹서 밀을 설정합니다.
참고: 시료가 처리를 위해 하나의 캐니스터만 필요한 경우에도 항상 분쇄 캐니스터와 동일한 모델 중 하나의 균형을 유지합니다. - 믹서 밀에서 밀봉 된 연삭 항아리를 27 Hz에서 1 분 동안 교반하십시오.
- 이전과 같이 액체 질소로 분쇄 항아리를 다시 냉각하고 믹서 밀에서 1 분 동안 27 Hz에서 흔들어줍니다.
- 1.5 mL 뉴클레아제 없는 튜브와 함께 드라이 아이스가 들어 있는 얼음 상자에 항아리를 옮길 수 있습니다. 작은 강철 주걱을 사용하여 결과 분말 샘플을 ~100 mg 의 알리쿼트튜브로 옮기고 튜브를 -80 °C에 저장합니다.
참고: 다성 침전 프로파일 분석, 시토솔을 번역 및 비번역 된 분수로 분리하고, RNase 소화시 SSU, 리보솜 및 디오이분획으로 번역 된 분획을 추가로 분리하는 실험 당 샘플의 ~600 mg을 사용하는 것이 좋습니다.
- 시토솔의 비번역 분수로부터 고정(poly) 리보소말 복합체의 분리
참고: 이전에 설정된 절차10,38일반적으로 (poly) 리보솜과의 공동 침전을 기반으로 번역 된 RNA를 풍부하게하기 위해 다음과 같은. 번역된 및 비번역된 사이토솔 분획을 분리하는 보다 세련된 접근법이 여기에 도입되어 물질을 침전시키고 나중에 재용해 할 필요가 없습니다.- 2.5mL 선형 10%-20%w/v 자당 그라데이션을 완충 B로 준비하여 얇은 벽 초원심분리기 튜브(5mL, 13 x 51mm)에서 동결 해동법(43)을 사용합니다.
참고: 동결 해동 방법은 서로 의 상단에 선형 회귀 농도와 완충 된 자당 층의 순차적 추가 및 동결에 의해 수행됩니다. 자세한 내용은 보충 표 1을 참조하십시오. - 연속 50% w/v 자당 쿠션을 만들려면, 선형 그라데이션에 해빙 및 안정화시, 완충 B의 50% 자당 0.5mL을 완충 B의 50% 자당을 19 G x 1.5" 바늘 또는 유사한/적합한 치수의 유리 모세관을 사용하여 튜브 의 바닥에 직접 분배합니다. 분배하기 전에, 조심스럽게 천천히 미리 형성 된 자당 그라데이션의 상단에서 아래로 바늘이나 모세관의 끝을 운전, 어떤 방해를 피하기, 튜브 바닥에 도달 할 때까지.
참고: 버퍼 B 준비에 대한 지침은 보충 표 1을 참조하십시오. - 상단 부분을 제거하거나 버퍼 B에서 자당 10w/v를 더 겹쳐서 그라데이션의 균형을 맞추고 얼음을 차갑게 유지하거나 4°C로 유지합니다.
참고: 아래50% 자당 층을 가진 불연속 그라데이션은 튜브 벽에 침전하지 않고 더 높은 침전율을 가진 물질을 수집하는 데 필요합니다. - 실온에서 냉동 셀 분말 시료의 ~100 mg을 해동하고 즉시 얼음 위에 놓습니다. 파이펫팅을 통해 150 μL의 버퍼 A2에 섞고, RNase 억제제1U/μL에 추가하고, 10s에 대해 과도한 발포 및 기체 상과 혼합하지 않도록 하여 혼합합니다.
참고: 달리 명시되지 않는 한 재질을 얼음 위에 보관하면서 모든 작업을 계속합니다. - 4°C에서 튜브를 원심분리하여 세포 이물질을 원심분리하여 5분 동안 13,000 x g를 원심분리하고 새로운 1.5mL 저단백질 결합 튜브에서 명확한 수퍼나티(~150 μL)를 회수합니다.
- 결과 정제 혼합물을 1.3.3 단계에서 불연속 자당 그라데이션 튜브에 적재하고 신중하게 균형을 맞추십시오.
- 4°C에서 중간 크기의 스윙 버킷 로터에서 튜브를 초음파 심분리하고 평균 g-force 287,980 x g(k-factor 49)를 1시간 30분 동안 사용합니다.
참고: 이러한 조건은 미리 최적화되어 있다(포스트 초센심분리방향 UV 흡광도 추적 분석 사용) SSUs 및 LS(큰 리보소말 서브유닛) 부분을 상부(10%-20% 자당) 부분에 유지하면서 바닥(폴리)을 농축하는 동안(폴리)-20% 자당 분획(폴리)을 농축하는 동안(폴리)를 유지하였다. - 19 G x 1.5" 바늘이 장착된 새로운 멸균 1 mL 주사기를 사용하여 번역된 사이토솔 분획을 수집합니다. 튜브의 바닥을 볼 수 있도록 안정적인 랙에 5mL 그라데이션을 배치합니다.
- 튜브 의 상단에서, 그라데이션의 바닥에 바로 바늘을 붙이고 (튜브를 구멍을 뚫지 않고) 부드럽게, 어떤 거품을 만들지 않고, 번역 된 RNA 풀을 포함하는 바닥 용액의 정확히 0.5 mL을 그립니다.
참고: 이 단계가 차가운 방에서 수행되고 튜브가 단단히 고정되어 있는지 확인합니다. 그라데이션의 교란을 피하기 위해 전체 0.5mL를 단일 업스트로크 모션으로 그리는 것이 좋습니다. - 극심분리성 시 자당 그라데이션의 흡수도 판독에 의한 결과 혼합물에서 SSU, LSU 및 라이터 분획의 (poly) 리보소말 의 존재 및 고갈을 확인한다.
- 10kDa 컷오프 재생 셀룰로오스 멤브레인을 가진 마이크로 농도 장치에서 초침화를 사용하여 수집된 번역된 RNA 풀을 이전 단계에서 100 μL로 농축한다.
참고: 0.5mL의 완충제 1로 마이크로 농도 장치의 멤브레인을 미리 세척하고(그림 2a참조) 및 제조업체에서 권장하는 스핀조건(g)을사용합니다. - 또한 버퍼 1로 이전 단계에서 재료를 5배(400 μL 추가)하고 200 μL로 다시 농축하여 자당의 부분 제거뿐만 아니라 더 작은 부피를 허용한다.
참고: 결과 혼합물을 최대 6개월 동안 -80°C에 저장하고 TCP-seq 라이브러리 시공의 '총 번역 RNA' RNA-seq 라이브러리 시공 또는 RNase 소화 단계의 입력 재료로 사용하는 것이 좋습니다. '번역되지 않은' 사이토솔 분획은 유사한 절차를 사용하여 그라데이션의 상단에서 회수하고 -80°C에 저장될 수 있다.
- 2.5mL 선형 10%-20%w/v 자당 그라데이션을 완충 B로 준비하여 얇은 벽 초원심분리기 튜브(5mL, 13 x 51mm)에서 동결 해동법(43)을 사용합니다.
- 고정(poly) 리보솜 복합체의 RNase 소화 및 소화된 물질의 분리를 작은 리보솜 하위 단위(SSU), 모노리보솜(리보솜, RS), 디리보솜(disomes, DS) 분획으로 분리
참고: 절차는 일반적으로 이전에 설명한 접근 방식을 따릅니다.10,38그러나 수정된 그라데이션 유형, 분리 시간, 가속 및 RNase 소화 조건이 사용되어 세 개의 격리된 분획 모두에 걸쳐 최상의 해상도를 달성합니다.- 신중하게 균형 잡힌 12.5 mL 선형 10%-40% w/v 자당 그라데이션13 mL 얇은 벽 폴리 프로필렌 튜브, 14 x 89 mm, 동결 해동법(43)을 사용하여 1.3.1 단계및 그 안에 주의하십시오.
- 실온에서 해동하고 즉시 얼음에 샘플을 전송하거나 단계 1.3.12에서 농축 및 자당 고갈 된 번역 된 사이토솔 분획을.
참고: 달리 명시되지 않는 한 얼음에 대한 모든 절차를 계속하십시오. - 번역된 사이토솔 분획을 23°C에서 30분 동안 분획의 1OD260 단위당 대장균 RNase I의 4.5 U에서 혼합하여 소화한다. RNase I를 0.25 U/μL로 유도하여 RNase I를 비활성화하여 RNase I를 비활성화할 수 있는 RNase 억제제를 즉시 추가하고 혼합합니다.
참고: RNase I. Derive AU260을 사용하여 AU260을 억제할 수 있는 RNase 억제제(260nm의 흡광도는 μL에서 lysate의 1cm 광학 경로 x 부피에 해당하는 광학 밀도 단위로 표준화) / 1,000을 사용합니다. - 즉시 샘플을 얼음으로 옮기습니다.
주의: 소화의 권장 조건을 준수 하 고 신중 하 게 추가 된 RNase I의 양을 측정 하는 것이 중요 하다. 여기서 언급된 RNase I 장치는 37°C에서 30분 에서 마우스 간 RNA로부터 산 수용성 물질의 1 μg를 생성하는 데 필요한 효소의 양으로 정의됩니다. 효소 육주가 너무 농축되어 있는 경우, 매우 적은 양의 용액을 피하려면 완충제 1로 희석하는 것이 좋습니다. - 반응 혼합물을 1.4.1 단계에서 10%-v 자당 그라데이션에 로드합니다.
참고: 그라데이션당 150-300 μL 범위의 최종 볼륨을 사용합니다. 각 정화에는 최소 2개의 그라데이션이 필요합니다. 재료의 다른 입력 볼륨(낮은 AU260,10-11 AU260),DS및 상대적으로 높은 AU260,13-14 AU260,SSU 또는 RS용)을 사용하여 최적의 분리를 달성한다. - 3시간 30분 동안 평균 g-force 178,305 x g(k-factor 143.9)로 4°C에서 중간 부피 스윙 버킷 로터에서 튜브를 초원심분리합니다.
주의: 예비 저울 튜브가 필요한 경우 질량 및 질량 분포를 샘플 함유 튜브와 균등화합니다. 균일한 자당 농도가 있는 튜브가 아닌 시료 오버레이에 해당하는 버퍼의 양으로 오버레이된 예비 자당 그라데이션을 사용합니다. - 0.2 μm 여과 중추적 용액(예를 들어, 여기에 사용되는 대로 탈온화된 물에 60% 자당)을 기위 펌프에 채우는 것을 포함하여 초원심분리 스핀 이완료 되기 최소 30분 전에 그라데이션 분수장치를 설정한다.
참고: 탈이온화된 물을 사용하여 분수기의 선과 튜브를 오염시키고, 그 다음으로 탈온화된 물, 탈온화된 물, 그리고 마지막으로 80% 에탄올이 실행 전후에 탈온화된 물 용액에 의해 뒤따릅니다. - 흡수성 판독 기준을 먼저 분해된 물로 채우고 제조업체의 권장 사항에 따라 광학을 제로화한 다음 샘플 튜브와 동일한 버퍼로 만든 14 x 89mm 자당 그라데이션을 사용하여 기준선 시프트를 보정합니다(예: 버퍼 1).
참고: 동일한 변위 속도를 사용하여 1.5mL/min과 같은 샘플 판독을 조정할 수 있습니다. - 먼저 검출기의 광학 경로를 입력하고 분획 수집기 출력에 처음 나타나는 솔루션 사이의 시간을 정확하게 계산하여 변위 시스템 데드 볼륨을 측정합니다.
참고: 권장 속도 1.5mL/min의 분획은 실온에서 수행될 수 있습니다. 수집된 분획을 얼음 위에 즉시 옮기는 것이 좋습니다. - 샘플의 예상 퇴적물 위치 및 흡광도 프로파일을 기반으로 254nmMMMMm, 1.5mL/분 변위 속도 및 인라인 분수 검출에서 라이브 흡광도 판독을 사용하여 분획을 수행합니다. 이전에 측정한 대로 죽은 부피에 해당하는 시간 지연으로 컬렉터 튜브 스위칭을 사용합니다.
- SSU, RS 및 DS 복합체의 위치 및 이동성에 대응하는 분획을 분리하고 새로운 저단백질 결합 1.5 mL 마이크로센트심립후지 튜브로 수집; 격리된 분획을 얼음 에 즉시 옮기고 더 멀리 처리되지 않으면 얼수 있습니다.
참고: 수집된 분획을 드라이 아이스 또는 액체 질소로 즉시 플래시 동결하고 -80°C 이하로 최대 6개월 동안 저장하는 것이 좋습니다.
- RNA-seq 라이브러리를 구축하기 위해 RNA의 리보소말 복합체 및 분리의 분리
- 교차링크를 차단/반전시키고 관련 단백질로부터 RNA를 분리하기 위해, 전체 자당 그라데이션 분획의 약 절반을 새로운 저핵산 결합 뉴클레아제 1.5 mL 마이크로센트심분리기 튜브(튜브당 350 μL)로 뚜껑/잠금 장치로 이송한다.
- 100% 정지 용액40μL(10% SDS w/v 및 100m EDTA), 25°C(10mMMMM) 1.6 μL(10mMMM) 및 데이온 핵제40m의 최종 수량에 대한 1.6 μL을 보충한다.
- 튜브의 내용을 파이펫팅하여 혼합하고 실온에서 튜브를 옮기십시오.
- 산성 페놀:클로로폼:이소아밀 알코올 125:24:1 (pH 4.0-5.0) 혼합물을 각 튜브에 동일한 부피를 첨가한다. 최대 속도로 설정된 소용돌이 믹서를 사용하여 2 분 동안 혼합물을 격렬하게 흔들어줍니다.
주의: 페놀과 클로로폼은 부식성이 있고 독성이 있습니다. 액체와의 물리적 접촉을 피하고 통풍이 잘되는 지역이나 연기 후드 아래에서 작동하십시오. 페놀 또는 클로로폼으로 작업할 때 장갑, 실험실 코트 및 보호 고글 또는 얼굴 보호막을 항상 사용하십시오. - 튜브를 열셰이커에 놓고 65°C, 1,400rpm에서 30분 동안 계속 흔들어 줍니다.
- 실온에서 10 분 동안 12,000 x g에서 혼합물을 원심 분리하여 위상 응집을 용이하게합니다.
- 상부 수성 상위를 수집하고 신선한 저핵산 결합 1.5 mL 튜브로 옮기.
참고: 교차 오염을 방지하려면 수성 단계를 완전히 복구하려고 시도하지 마십시오. 합리적인 회수 부피는 300-350 μL입니다. - 수집된 수성 상에 3M 아세테이트(25°C에서 pH 5), 글리코겐 20μg(5 μg/μL 스톡 사용) 및 절대 에탄올 2.5부로 수중 상량을 보충한다. 튜브를 1분 동안 소용돌이로 만들어 용액을 조심스럽게 섞는다.
- RNA를 2시간 이상 -20°C에서 배양하여 RNA를 침전시한다(하룻밤 권장).
- 튜브를 실온으로 데우고 소용돌이에 섞습니다.
참고: 튜브의 사전 온난화와 실온에서의 후속 원심 분리는 소금과 페놀 의 공동 강수량 및 이월을 줄이는 데 도움이 됩니다. 이러한 조건은 설명된 대로 수행되고 충분히 순수한 에탄올을 사용하는 경우 RNA 수집의 물질적 손실 또는 비효율성을 초래해서는 안 됩니다. - 펠릿 RNA는 실온에서 30 분 동안 12,000 x g에서 튜브를 원심분리하여 침전시합니다.
- 상체를 버리고 80 % v / v 에탄올로 펠릿을 두 번 세척하여 실온에서 10 분 동안 12,000 x g에서 원심 분리로 매번 수집합니다.
- RNA 펠릿을 튜브 뚜껑을 열고 열린 튜브를 45°C로 10분 동안 설정된 드라이 블록 히터에 배치하여 건조시. 결과 말린 펠릿을 1x HE 버퍼의 20 μL로 녹입니다.
- UV 흡광도 스펙트럼 측정을 사용하여 결과 RNA 농도를 추정한다.
참고: RNA 단편 길이 및 총 량은 자동화된 형광 계 모세관 겔 전기포광 장치와 같은 데니어링 젤-전기포광을 사용하여 더욱 평가될 수 있다.
- 선택적 SSU 농축의 태그된 eIF 및 서부 블롯 분석에 의한 SSUs의 선택적 공동 면역정화
참고: 1.4.11 단계에서 소화 및 퇴적물 분리SSU 분획의 ~15 AU(260nm)를 사용하여 자기 IgG 비드를 사용하여 친화성 정화를 수행한다. SSU 분획의 ~5%를 입력 컨트롤(입력 분획, I)으로 저장합니다. eIF4A 태그(TIF1-TAP; 탠덤 친화성 정화 태그) 효모 균주가 사용되어 안티TAP 항체를 사용하여 TAP 태그에 대한 프로빙을 통해 eIF4A를 검출할 수 있게 하였다.- 자기 IgG 구슬 현탁액의 100 μL (1 mg의 비드 1 mg은 용사 또는 분수의 각 15 AU (260 nm)에 대해 사용되었으며 새로운 저단백질 결합 1.5 mL 튜브; 마그네틱 랙을 사용하여 구슬을 수집하고 흡인합니다.
- 마그네틱 랙을 사용하여 파이프팅 및 수집을 통해 순차적인 리서스펜션을 사용하여 1mL의 버퍼 1로 마그네틱 구슬을 두 번 세척합니다.
- 세탁 후, 수집 및 구슬을 데리고, 자기 랙에 보관합니다.
- SSU 분획을 세척된 구슬에 추가하고 ~20 rpm에 설정된 사이클로믹서에서 4°C에서 회전하여 4h의 혼합물을 배양한다.
- 4°C에서 마그네틱 랙을 사용하여 구슬을 수집하고 상체(플로우-스루 분획, FT)를 저장합니다.
- 4mM DTT로 완충 1로 4°C에서 구슬을 두 번 세척하고, 매번 사이클로믹서에서 10분 간 회전하고 마그네틱 랙의 구슬을 수집하고 디캔딩합니다. 세하(W1 및 W2 분수)를 저장합니다.
- 서부 블로팅과 같은 분석 적용의 경우, PH 8.5~1x 및 DTT를 2mM로 하는 LDS(리튬 도데실 황산염) 폴리아크릴젤 전기포레시스(PAGE) 샘플 버퍼를 첨가하여 하발된 물질을 분해 및 감소 조건하에서 엘테한다.
- 혼합물을 95°C에서 열블록에서 5분 동안 가열하여 용출을 마무리합니다.
- 마그네틱 랙을 사용하여 구슬을 수집하고 신선한 저단백질 결합 1.5mL 마이크로센트심리분리기 튜브에서 변성 용출(E 분수)을 회수한다.
- 이전 단계에서 E 분획을 사용하여 데니칼 황산나트륨(SDS) PAGE를 즉시 실행하거나 E 분획을 -20°C에 저장한다.
참고: 후속 응용 프로그램에 대한 TAP 태그가 풍부한 번역 단지의 사전 복제 컬렉션은 담배 에칭 바이러스(TEV) 프로테아제를 사용하는 대체 용출 방식을 사용합니다. 자세한 내용은 보충 표 1을 참조하십시오. - 희석FT, W1 및 W2 분획을 농축하려면 3배의 얼음 차가운 아세톤을 추가하여 재료를 침전시합니다. 샘플-아세톤 믹스를 -20°C에서 3시간 동안 배양한다.
- 펠릿은 4°C에서 10분 동안 13,000 x g에서 튜브를 원심분리하여 침전을 유발합니다.
- 상수와 공기를 폐기하고 30 분 동안 실온에서 열린 튜브의 펠릿을 건조시십시오.
- 2mM DTT로 보충된 1x LDS 적재 버퍼의 7 μL에 펠릿을 용해하십시오. 샘플을 95°C로 설정된 열 블록에서 5분 동안 가열합니다.
- 모든 I, FT, W1, W2 및 E 샘플을 아크릴아미드 그라데이션, 비스 트리스 폴리아크릴아미드 데니징 젤의 4%-12%w/v에 로드합니다. 단백질 마커(10-250 kDa)가 잘 해결되고 납 염료가 젤의 바닥에 도달할 때까지 80V에서 완충제를 실행하는 1x MES SDS(2-[N-mopholino]에탄설포닉산, 나트륨 도데킬 황산)을 사용하여 젤을 실행한다.
참고: WCL(전체 셀 리사테)(2-10 μg)의 직렬 희석을 대조군으로 젤에 적재하는 것이 좋습니다. 분수 물질에 걸쳐 젤의 유사한 로딩을 달성하기 위해 여러 시도가 걸릴 수 있습니다. - 서쪽 블로팅 장비 제조업체가 권장하는 콜드룸에서 100V에서 1h의 습식 이송 방법으로 젤의 단백질 함량을 폴리비닐리덴 디플루오라이드(PVDF) 멤브레인에 전달한다.
- 상온에서 1시간 동안 적절한 차단 버퍼(인산염 완충식식린 기반)를 사용하여 멤브레인을 차단합니다.
- 항체 희석에 대한 제조업체의 지침에 따라, 태그된 eIF4A 단백질, 안티파반1p 항체 또는 항-β 액틴 항체(또는 기타 바람직한 표적)를 검출하기 위한 항TAP 항체로 멤브레인을 프로브하여 멤브레인 버퍼(PBS)-희석 항체(1:1,000 희석제)를 통해 멤브레인의 하룻밤 에 배양함으로써
참고: 1:1,000 항체 희석은 좋은 출발점입니다. - 1x 인산염 완충식 식염수로 멤브레인을 세 번 세척하고, 각각 10분 동안 0.2% v/v 트위엔 20(PBST)을 세척한다.
- 1 시간 동안 실온에서 사이클로믹서에서 배양하여 제조업체의 지시에 따라 형광으로 표시된 이차 항체로 멤브레인을 조사하십시오.
참고: 1:20,000 항체 희석은 좋은 출발점입니다. - 1x PBST로 멤브레인을 각각 10분 동안 세 번 씻으시다. 바이온화된 물로 멤브레인을 간략하게 헹구고 절대 메탄올로 헹구습니다. 제조업체의 지침에 따라 형광 이미징 시스템에서 멤브레인을 건조하고 시각화합니다.
참고: 다른 단백질에 대한 염색은 상이한 형광 채널(eIF4A-TAP 대 β 액틴 쌍과 같이)과 일치하는 염료를 사용하여 동일한 멤브레인을 순차적으로 염색하거나 염색하거나 각 항체를 반복적으로 프로빙하고 각 조각을 각각의 항체로 개별적으로 프로빙함으로써 달성될 수 있다.
2. 포유류 세포 프로토콜
- 포유류 세포 배양 및 고정
- 2 T-175 플라스크에서 HEK293 세포를 덜벡코의 수정된 이글 배지에서 60%-70%로, 10% v/v 태아 보빈 세럼은 37°C, 5% v/v 이산화탄소로 성장시킨다.
참고: 전체 미디어는 L-글루타민, 페놀 레드 및 중탄산나트륨을 함유하고 있지만 HEPES 또는 피루바테 나트륨을 함유한 500mL의 상업적으로 구입한 DMEM에 상업용 FBS 55mL를 첨가하여 만들어집니다. T-175 플라스크당 셀 카운트는 70%의 합류에 1.7-2.0 x 107의범위에 있어야 한다. - 원하는 고정 시간 전에 적어도 3 시간, T-175 플라스크의 미디어를 정밀하게 30mL의 미리 따뜻하게 된 완전한 매체로 대체하고 셀 인큐베이터의 플라스크를 교체한다.
참고: 셀 분리를 방지하기 위해 새 용지가 플라스크의 반대쪽에 피펫되어 셀 단층으로 피프트되어 있는지 확인합니다. 최소한의 가스와 온도 균형 장애를 도입하여 가능한 한 빨리 미디어 교환을 수행하려고 시도합니다. - 세포 용지가 교체되면 고정에 필요한 버퍼 및 화학 물질을 준비하십시오. DPBS 의 500mL 병에 2.5M 글리신 재고의 10.2 mL을 추가하여 50mM 글리신으로 DPBCo의 인산염 버퍼-살린(DPBS)을 준비하십시오.
- 비멸 조건에서 사용할 단계 2.1.1과 0.25 % 트립신-EDTA의 100 mL 알리쿼트와 같이 10 % FBS로 보충 된 DMEM 병을 준비하십시오. 염화칼슘(CaCl2)과염화마그네슘(MgCl2)으로미리 제조된 상업용 DPBS를 추가 로 공급한다.
참고: 용액은 최대 2주 동안 4°C로 저장할 수 있습니다. - T-175 플라스크가 균일하게 상단에 맞게 준비된 버퍼와 함께 연기 후드에 보관할 수 있도록 분쇄된 물 얼음으로 가장자리에 얼음 상자를 준비합니다.
참고: 환경 변화에 대한 번역의 신속한 반응으로 인해 인큐베이터에서 셀 플라스크를 제거하고 포름알데히드 솔루션을 추가하는 모든 타이밍을 최소화해야 합니다. - 세포를 식히려면 인큐베이터에서 T-175 플라스크를 제거하고 얼음에 단단히 눌러 최대 표면 접촉을 보장합니다. 화학 연기 후드 내부에는 플라스크를 옆으로 기울여 미디어가 세포 반대쪽에서 수집되도록 합니다. 파이펫 168 μL 37% w/v 포름알데히드를 풀로 직접 입력된 매체로 직접 넣습니다(최종 농도0.2%w/v). 플라스크를 앞뒤로 부드럽게 흔들어 서 플라스크를 밀착하고 얼음 위에 재배치하여 수평이 되고 세포가 균등하게 덮여 있는지 확인합니다.
주의: 포름알데히드는 잠재적인 장기 부작용과 호흡기 및 피부 모두에 자극성 물질인 유해한 물질입니다. 그것은 단지 적절한 화학 연기 후드에서 처리해야합니다. 포름알데히드 용기는 연기 후드 밖에서 항상 밀봉해야합니다.
참고: 포름알데히드가 플라스크 벽이 아닌 세포 매체에 직접 첨가되었는지 확인합니다. 2.1.6 단계는 1 분 미만이 소요됩니다. - 플라스크를 얼음 에 배양하여 10분 더 보간합니다. 세포 반대의 플라스크 측면을 통해 적절한 폐기물 용기에 미디어를 부어 넣습니다.
- 탈피, 칼슘과 마그네슘 이온없이 덜벡코의 인산염 완충 식염수의 30 mL의 파이펫과 추가로 포함 50 mMM 글리신, 부드럽게 세포 반대쪽에. 플라스크를 흔들어 섞는다. 플라스크를 수평 위치로 되돌리고 얼음에 10분 더 배양합니다.
- 세포 반대의 플라스크 측을 통해 용액을 붓고 표준 0.25% w/v 트립신-EDTA 용액의 7mL을 부드럽게 추가하여 세포를 분리하고 재보펜합니다. 실온에서 플라스크를 5-10분 동안 배양합니다.
참고: 트립신-EDTA 솔루션이 모든 셀을 균등하게 커버하도록 보장합니다. 주기적인 부드러운 기울기와 흔들림을 사용하여 세포 분리를 촉진합니다. - 플라스크를 수직으로 재배치하고 스트리펫을 사용하여 플라스크 벽에서 남은 세포를 부드럽게 세척하여 분리 된 세포를 수집합니다. 서스펜션을 얼음 위에 세팅된 50mL 튜브로 옮킨다.
참고: 고정 된 세포는 더 깨지기 쉬워질 수 있습니다. 플라스크 벽에서 세포를 분리하는 데 필요한 것보다 강렬하거나 더 많은 파이펫을 피펫하지 마십시오. - 수집된 셀 서스펜션을 20mL의 완전한 미디어(10% FBS가 있는 비멸얼음-차가운 미디어)로 즉시 보완하고 튜브를 부드럽게 뒤집어 섞습니다.
참고: 전체 세포 배양 배지(10% FBS 포함)가 트립신을 중화하여 세포막및 세포 붕괴에 대한 추가 손상을 방지합니다. - 5 분 및 4 °C에 대한 100 x g에서 튜브를 원심 분리하여 세포를 펠렛. 셀 펠릿은 명확하게 표시되어야 합니다.
- 미디어를 부어 부드럽게 Ca2 +,Mg 2+,글리신없이 얼음 차가운 DPBS의 10 mL에서 세포 펠릿을 다시 중단합니다.
- 2.1.12 단계를 반복합니다.
- 세척 버퍼를 붓고 부드럽게 얼음에 글리신없이, Ca2 +,Mg2 +,얼음에, 얼음 차가운 DPBS의 800 μL에 셀 펠릿을 다시 중단합니다. 재중단된 세포를 새로운 저단백질 결합 1.5 mL 마이크로센심분리기 튜브로 전달한다.
- 3 분 및 4 °C에 대한 100 x g에서 튜브를 원심 분리합니다. 1mL 피펫을 사용하여 상체를 조심스럽게 폐기하십시오. 이 단계에서, 세포 펠릿은 -80°C에서 동결되거나 세포 용해 단계로 진행할 수 있다.
참고: 냉동 세포 펠릿은 -80°C에서 최대 1년까지 보관할 수 있습니다. 우리는 세포 펠릿 동결 후속 용해를 용이하게하고 장기 저장이 계획되지 않은 경우에도 동결을 권장한다는 것을 발견했다.
- 2 T-175 플라스크에서 HEK293 세포를 덜벡코의 수정된 이글 배지에서 60%-70%로, 10% v/v 태아 보빈 세럼은 37°C, 5% v/v 이산화탄소로 성장시킨다.
- 포유류 세포 중단 및 사이토솔 수집
- 생물 안전 캐비닛에, nonionic, 비덴토 세제및 40 U/μL RNase 억제제의 7 μL을 기반으로 용해 버퍼의 300 μL을 추가합니다. 1 mL 팁을 사용하여 파이펫팅으로 잘 섞습니다.
- 조심스럽게 1-3 mL 주사기에 25 G 바늘을 부착하고 격렬하게 혼합물을 피펫, 적어도 일곱 느린 위쪽으로 섭취와 빠른 하향 배기 스트로크를 사용하여.
- 주사기와 바늘을 날카로운 쓰레기통에 버리고 31 G 바늘이 장착된 0.3 mL 주사기를 사용하여 절차를 반복하십시오.
- 주사기와 바늘을 날카로운 쓰레기통에 버리십시오. 4°C에서 튜브를 원심분리하고, 12,000 x g에서 5분 동안 세포 이물질을 펠렛합니다.
- 새로운 저단백질 결합 1.5 mL 마이크로센심분리기 튜브로 상피체를 전달한다. 둘 다, 세포 파편(제어 목적)과 그 결과 -80°C에서 세포 용액을 명확히 한다.
참고: 2개의 T-175 플라스크가 결합되고 권장볼륨이 뒤따를 때 lysate 범위는 25-30 AU260 사이입니다. 용액및 세포 파편은 -80°C에서 최대 1년까지 보관할 수 있다.
- 시토솔의 비번역 분수로부터 고정(poly) 리보소말 복합체의 분리
- 선형 15%-45% w/v 자당 그라데이션을 13mL 박벽 폴리프로필렌 튜브, 14 x 89mm, 효모 프로토콜의 1.3.1 단계에서 설명한 대로 동결 해동 방법을 사용하지만 버퍼2(도 2a)를사용한다.
참고: 분획 전날 밤 4°C의 차가운 방에서 하룻밤 동안 그라데이션을 해동합니다. - 이전 단계에서 셀 용해의 150-250(최대 300)의 μL을 균형 잡힌 그라데이션에 로드합니다. 나머지 용액을 -80 °C에 저장하고 제어 목적으로 사용합니다.
참고: 여기에 다각형, 리보소말 및 '무료' SSU 분획으로 침전 기반 분리의 예가 제공됩니다. 다른 방법은 제공된 보충 표 1을 참조하십시오. - 4°C에서 중간 부피 스윙 버킷 로터에서 튜브를 초원심분리하고, 평균 g-force 178,305 x g(k-factor 143.9)에서 1시간 45분 동안 튜브를 분리한다.
- 스핀 완료 하기 전에 30 분, 설정 하 고 효 모 프로토콜 단계 1.4.7-1.4.9에 설명 된 대로 그라데이션 분획기를 기준.
- 효모 프로토콜 단계 1.4.10-1.4.11에 설명된 바와 같이 일반적으로 그라데이션을 분수한다.
참고: 이 단계는 다각형, 리보소말 및 '무료' SSU 분획을 분리합니다. 다각형 분획은 다각형 프로파일링 실험에서 사용될 수 있다. - 수집된 분획을 얼음 위에 즉시 옮기고 더 이상 처리되지 않으면 최대 6개월까지 -80°C에 보관하십시오.
참고: 분획 수집관 변경이 온라인 분수 식별 및 분리와 동기화되는 경우 최대 800μL 분획(1.5mL/분당 분수 당 32분의 수집 시간)을 사용하는 것이 좋습니다. 인라인 흡광도 판독을 사용하지 않고 분획이 수행되는 경우 250-500 μL 분획(분수당 10-20분당 분수 당 1.5mL/분)을 사용하는 것이 좋습니다. 분리 후, 분획은 면역 정화, 전자 현미경 검사법, 소법 페이지 및 서부 블로팅을 즉시 사용하거나 후속 RNA 및/또는 프로테오믹스 분석을 위한 교차 링크 반전을 실시할 수 있다.
- 선형 15%-45% w/v 자당 그라데이션을 13mL 박벽 폴리프로필렌 튜브, 14 x 89mm, 효모 프로토콜의 1.3.1 단계에서 설명한 대로 동결 해동 방법을 사용하지만 버퍼2(도 2a)를사용한다.
결과
번역 복합체는 침전 특성이 평가되는 초원심 분리 중에 특히 중요한 버퍼의 이온 조성에 민감합니다. 따라서 우리는 그라데이션 전반에 걸쳐 번역 복합체 및 별도의 리보솜 서브유닛(SSU, LSU), 단종(RS) 및 다낭체를 해결하는 데 가장 적합한 조건을 선택하기 위해 지상 비고정 효모 재료에서 추출한 명확한 리사테를 사용하여 여러 가지 침전 버퍼를 테스트했습니다. 모든 버퍼는 25m HEPES-KOH pH 7.6 및 2mM DTT를 포함하는 코어 조성물을 기반으로 하였다. KCl, MgCl2,CaCl2및 EDTA의 농도는 버퍼(도2a)에걸쳐 더욱 수정되었으며, 이러한 구성 요소는 그라데이션 로딩 전 및 그라데이션 주조 전에 자당 그라데이션 버퍼에 첨가되었다.
버퍼 1 및 2잘 해결된 번역 복합체에서 잘 해결된 번역 복합체가 얻어졌다. 버퍼 1은 작은 리보소말 서브유닛(SSUs)(도2a)의다소 더 나은 분리를 초래하였다. MgCl2의 생략 및 EDTA(버퍼 3,4)의 첨가는 대부분의 폴리올어 및 부분분해(도 2a)에대해 높은 침전 특성의 손실을 야기하였다. 2.5mCaCl2를 첨가하면 다소 균일한 다각성 피크가 발생했지만, 완충제 1 과2에비해 이 경우 다각형 물질의 전체 양이 감소하였다. 따라서 버퍼 1을 선택한 작업 버퍼로 선택했습니다.
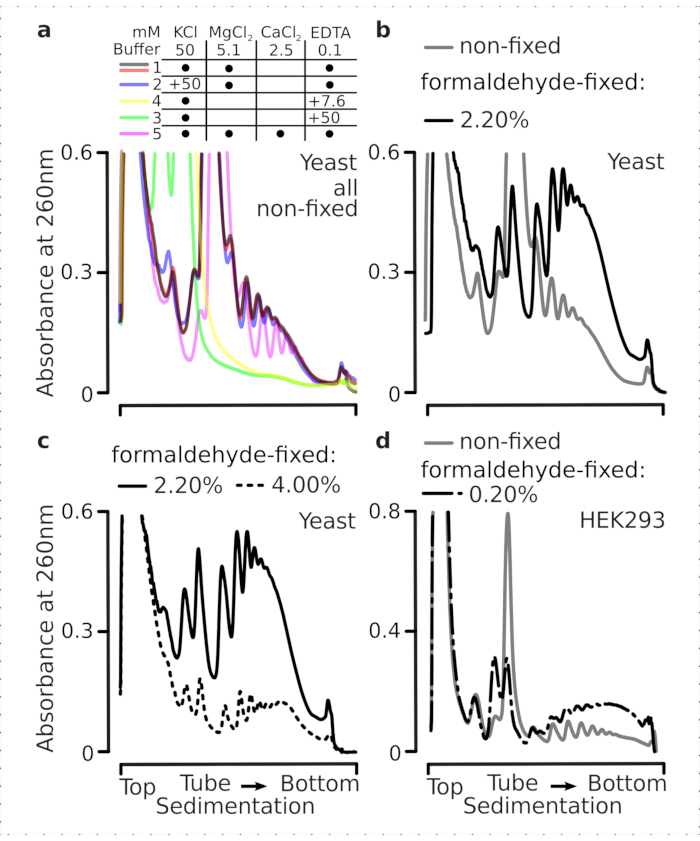
그림 2: 고정의 안정화 효과에 대한 번역 복합 추출 및 평가를 위한 버퍼 조건입니다. 총 효모 세포 용액에 대해 260 nm에서 수집된 UV 흡광도 프로파일이 10%-40%w/v 자당 그라데이션으로 분리되어 있다. (a)비고정 효모 세포로부터 추출된 물질의 퇴적에 대한 모노 및 이원식 염 및 마그네슘 이온 격리의 효과. 빨간색과 회색 선은 일반적인 복제를 나타냅니다. (b,c) 비고정(회색선), 2.2%(블랙 라인), 포름알데히드 고정 효모 세포의 4.4%(블랙 점선)에서 유래한 용액의 비교. (d)동일한 고정 셀(gray line)의 물질과 비교하여 HEK 293T 세포의 포름알데히드 고정(black dashed-and-dotted line)의 최적화된 0.2%w/v에 의해 폴리좀의 안정화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
우리는 다음으로 다른 포름알데히드 농도로 고정하여 다각형 안정화효과를 확인했습니다. 그렇지 않으면 동일한 세포 재료, 버퍼, 세포 처리 및 타이밍 접근법을 사용하여, 우리는 포름알데히드의 2.2 %와 4 % w /v로 고정 된 비 고정 세포 및 세포에서 추출 된 물질을 비교하였다(도 2b,c). 포름알데히드의 2.2%w/v가 폴리올어를 잘 보존하는 동안 폴리올어를 잘 보존하는 반면 폴리좀비율을 판단할 수 있는 것으로나타났다(도 2b),포름알데히드의 4%w/v에 비해 리보솜 물질의 전체 수율을 감소시키지 않았으며, 이는 과다 수정(그림2c)의명확한 징후를 보였다.
포유류 세포로부터 유래된 물질의 경우, 세제 기반 추출에 요구되는 더 큰 용해 완충-세포 부피 비율로 인해, 완충제2(도 2a)가사용되었다. 이것은 자당 그라데이션(도 2d)에서퇴적시 잘 해결 된 번역 복합체를 생산했다. 특히, 포름알데히드의 훨씬 낮은 농도가 0.2% w/v로 사용되었고, 높은 농도로 인해 상당한 다각형 및 리보소말 물질 손실(데이터가 표시되지 않음). 효모 세포와 함께 얻은 결과와 유사하게, 크로스링크 안정화 물질은 폴리좀 및 더 높은 다형성 대 단종 비율(도 2d)의 더 나은 보존을입증하였다.
다음으로 선택된 포름알데히드 고정 조건이 교차 연결의 결과로 다각체 분획 내에서 능동적으로 변환된 mRNA를 안정화할 수 있을 만큼 효율적인지, 개선된 다각체 수율은 효소 기능 및 번역 연신의 단지 결과만이 아니라는 것을 시험하였다. 우리는 EDTA와 높은 단원염 (KCl)을 사용하여 다낭성 및 리보솜을 불안정하게했습니다. 이러한 시약은 명확히 된 효모 세포 lysates에 첨가되었으며, 버퍼 1 조성물의 상단에 있는 모든 후속 완충제 및 자당 그라데이션에 각각 포함되었다.
실제로, 15mM EDTA는 고정된세포(도 3a)로부터유래된 다각형 분획에 대한 낮은 불안정 효과를 나타내며, 교차 연결된 복합체가 더 견고하다는 것을 확인하였다. EDTA의 불안정한 효과는 포름알데히드의 농도를 증가시킴으로써 다소 극복할 수 있으며, 포름알데히드 고정 세포의 4%w/v로부터 물질이 더 잘 전개되는 것을 저항하게된다(도 3a). 그러나 EDTA 농도가 50mM로 증가하면 고정 및 비고정 조건 하에서 대부분의 번역 복합체가 불안정해지면서 재료의 느린 퇴적물 및 잘 모양의봉우리(그림 3b)의부재로부터 추론될 수 있다. 이는 mRNA로부터다각체 성분의 완전한 해리가 아니라 구조의 부분적 전개와 압축의 전반적인 손실에 의해 설명될 수 있다. 이 경우에도 교차 연결 물질은 더 빠른 침전(도3b)을입증하였다.
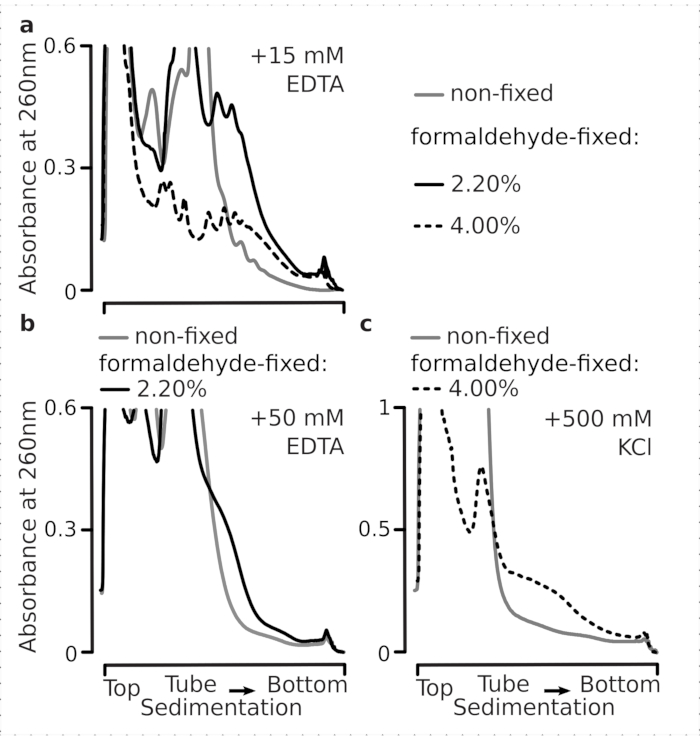
그림 3: 폴리좀의 안정성에 생체 효모 포름알데히드 고정의 효과. 버퍼 1(텍스트 및 그림 2a참조) 모든 실험에서 사용되었습니다. 그림 2 범례에 설명된 데이터 형식 및 플롯입니다. (a)비고정(회색선), 2.2%(블랙 라인) 및 4%(블랙 점선)로부터 유래된 폴리좀의 안정성에 대한 15m M EDTA를 세포용액에 첨가한 비교(검정선) 및 포름알데히드 고정 셀의 4%(블랙 점선). (b)(a)와동일하지만, 50mM EDTA의 첨가및 포름알데히드 고정 셀의 4%w/v를 제외한다. (c)(a)와동일하지만, 500 mM KCl의 첨가및 포름알데히드 고정 셀의 2.2 %w /v를 제외한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
EDTA 효과와 유사하게, 500 mM KCl에서, 우리는 포름알데히드 고정(도 3c)의4 % w / v와 안정성의 주요 개선을 발견했다. 이 경우에 소형성의 명백한 손실은 또한 RNA에서 그들의 완전한 해리 보다는 리보소말 복합체의 성분의 부분 분리에 의해 설명될 수 있습니다. 전반적으로, 포름알데히드 고정 세포에서 파생된 폴리올어는 이러한 복합체 내에서 추가적인 공유 결합을 형성하는 것과 일치하여 전개 및 구조적 불안정에 대한 더 높은 저항성을 입증했습니다.
성장 조건을 자극하는 도중, mRNA는 polyribosomes, 또는 polysomes로 알려져 있는 구조물을 형성하는 동일 mRNA 분자에 다중 리보솜의 축적의 결과로 급속하게 개시될 수 있습니다. 다각형은 자당 그라데이션에서 초원심분리에 의해 분리될 수 있으며, 그 곳에서 순서에 따라 퇴적물(mRNA에 동시에 부착된 리보솜의 수). 번역이 억제되면 리보솜은 곧 다른 번역에 참여하지 못하여 폴리좀의 '부분적) '분해'가 발생하며, 이는 모노좀4,26의다각형을 향한 모달 시프트로 나타낸다.
다편 주문 분포 수준에서 시각화할 수 있는 번역 반응의 모델은 포도당 기아에 의해 제공될 수 있다. 포도당 고갈은 효모1,3,40에가장 극적이고 빠른 번역 억제 효과 중 하나를 유도한다. 이전 연구는 포도당 고갈의 1 분 이내에 입증, 다형성의 손실, 단종의 축적 및 번역 개시의 억제4발생할 수 있습니다. 포도당 재보충의 5 분 이내, 번역은 폴리좀3,4의명백한 증가와 함께 신속하게 복원된다. 또한 세포가 포도당을 함유하는 미디어에 0.5% (w/v) 이하의 세포가 노출되었을 때 번역이 억제된 것으로 관찰되었으며, 포도당 수준에서 0.6% (w/v) 이상의 효과가 보이지 않았다.
따라서 우리는 우리의 고정 조건이 다당대 단조로운 비율에 의해 평가될 수 있기 때문에 포도당 응력 반응의 역학 내의 번역다름의 보존에 적합한지 결정하기를 원했습니다. 우리는 높은 포도당 (2.00 % w /v 추가)에 중간 기하급수적 단계에서 자란 세포에서 물질을 비교하고 10 분 동안 미디어로 옮겨진 물질과 비교하여 (0.00% 또는 0.25 % w /v, 각각) 포도당. 고정은 대조군에서 병렬로 포름알데히드의 2.2 %w /v를 사용하여 수행되었습니다 (비 굶주림; 동일한 표준 매체와 빠른 미디어 교체 2% w / v 추가 포도당, 10 분 및 고정에 대한 인큐베이션 다음) 10 분 굶주림 (동일한 미디어와 빠른 미디어 교체하지만 낮은 0.25 w / V 또는 추가 포도당, 없음 10 분 동안 배양하고 고정) 세포가 뒤따릅니다.
이전 연구 결과와 일치, 우리는 효 모 세포 포도 당 기아 스트레스에 번역을 크게 억제 관찰(그림 4a). 둘 다, 아니 추가 및 낮은 포도 당 조건 유도 다각성 분해, 약간 하지만 분명히 더 많은 폴리좀 낮은 추가 포도 당의 경우에 유지. 따라서, 효모 포도당 제거 반응은 올온 또는 올-오프 타입이 아닐 수 있고 점차적으로 조정된다. 포름알데히드 교차연결의 안정화 작용에 대한 기대를 긍정, 고정 된 세포에서 다각체 물질은 틀림없이 응답의 높은 동적 범위를 보존, 굶주림과 비 굶주림 세포 사이의 높은 구별을 입증했다(도 4b). 흥미롭게도, 고정된 세포로부터의 물질의 경우, 포도당 농도가 낮을 수록 비고정세포(도4a)에비해 포도당 조건이 첨가되지 않은 상태에서 훨씬 더 잘 분화되는 특정 다각체 풍부를 초래하였다. 이는 번역 응답 과 같은 매우 역동적인 공정의 평형에서 비교적 분및 일시적인 차이를 보존하고 캡처하는 포름알데히드 고정 접근법의 적합성을 나타내는 강력한 지표입니다.

그림 4: 포도당 기아시 효모 번역의 급격한 변화를 포착합니다. 버퍼 1(텍스트 및 그림 2a참조) 모든 실험에서 사용되었습니다. 그림 2 범례에 설명된 데이터 형식 및 플롯입니다. (a)비 굶주린 (회색 선), 제한된 포도당 굶주림 (0.25 % w / v 10 분; 갈색 라인에 대한 포도당을 추가) 및 포도당 고갈 (10 분 동안 추가 된 포도당 없음; 적색 선) 비 고정 효모 세포에서 얻은 세포 용액. (b)(a)와동일하지만, 2.2% w/v 포름알데히드 고정 셀. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
자당 그라데이션 침전('다각성 프로파일링')을 이용하여 mRNA를 능동적으로 번역하는 것과 관련된 리보솜에 의한 번역 상태를 모니터링하는 것은 널리 적용되는기술(26,27,28)이다. 정량적 마이크로어레이 분석과 함께 최근에는 높은 처리량시퀀싱(28,44)과함께, 다각형 프로파일링은 리보솜 관련 mRNAs 전사에 대한 정보를 제공한다. 여러 가지 가정으로, 그것은 전통적으로 단백질 생합성 연구의 분야에서 다각체 존재는 각 mRNAs의 번역에 적극적인 참여의 표시는 주장 되었습니다. 추가 결론은 종종 (항상는 아니지만) 정당화되며, 더 많은 리보솜이 주어진 길이 (다각형의 순서가 높을수록) mRNA가 번역에 관여하는 것이 더 적극적으로 존재한다는 것을 정당화합니다. 따라서, 다각체 분획을 나머지 물질로부터 분리하는 것은 적극적으로 번역된 RNA를 분리하는 관점에서 유용할 수 있다. 발자국 프로파일링 접근법 내에서, 특히 TCP-seq10,38,39는 코돈 복합체에서 유래한 해방된 SSUs의 분리된 인구를 생성하고, 코돈 복합체를 시작하고 중지하는, 완전한 단종 또는 다묘와 함께 코취를 조정하지 않는 리보솜 하위 유닛을 제거하는 데 추가적으로 통찰력이 있을 수 있다.
따라서 우리는 mRNA의 '능동번역' 풀에서 벗어나 무료 SSUs(mRNA가 부착된 mRNA 없이 단일 SSU 또는 SSUs에 묶여 있음)와 같은 '번역되지 않은' mpRNPs의 분리를 채택했습니다. 이를 달성하기 위해, 우리는 하나 (모노) 또는 여러 리보솜 (polysomes)과의 상호 작용에 관여하는 mRNA가 적극적으로 번역 될 수 있다고 가정했다. 이러한 단지는 높은 침전 계수에 의해 다른 복합체와 분리 될 수 있습니다. 우리는 또한 튜브 벽에 물질을 직접 펠릿하는 대신 자당 쿠션 (자당 의 50 % w / v)으로 mRNA의 '적극적으로 번역된' 풀을 분리할 것을 제안했습니다. 쿠션 내의 빠른 침전 단지의 원심분리를 통해 흡광도 프로파일 판독을 사용하여 분리를 모니터링하고 펠릿 화 및재수용화(10,38)에비해 수용성, 비응적 및 비변성 물질의 높은 출력을 달성할 수 있었다.
전반적으로, 개별 SSUs, 리보솜, 디좀 및 잠재적으로 압축된 다각형을 더 높은 순서로 정화하기 위해, 고정된 정제된 용액은 2단 초원심분리공정(그림 5)을실시하였다. 첫 번째 자당 그라데이션에서, 초원심분리는 그라데이션의 상부(10%-20%w/v/v/v)의 그라데이션 부분에서 분리된 무료 SSUs와 LsUs를 초래한 반면, 하나의 완전한 리보솜과 관련된 다각성 및 mRNA를 포함한 교차 연결 번역 풀은 바닥에 농축하였다(50% w/v)의그라데이션 ). 번역된 mRNA 풀을 포함하는 자당층의 50%w/v는 그 다음에 RNase I로 소화된 그 RNA를 농축하고, 두 번째 자당 그라데이션 극심분리를 거쳐 별도의 SSU, LSU, RS, RNase 내성 디솜(DS) 및 고차 핵제성 폴리소어(5b)의 경미한 분획을 얻었다. 전염 전자 현미경으로 소변 아세테이트 및 이미징을 사용한 음의 염색은 각 침전 단계에서 격리된 복합체의 정체를 확인하였다(도5).

도 5: 번역되지 않은 RNA로부터 번역된 총 RNA 분획의 분리( a,c)회로도(왼쪽) 및 각 대표 결과(오른쪽; 도 2 전설에 기재된 데이터 유형 및 플롯)의(a)자유 수소를 포함한 비번역 된 세포솔 분획의 첫 번째 불연속 자당 그라데이션 분리 및 변환된 mRNA를 포함하는 분해된 암RNA 및 변환된 mRNA풀레이션을 포함한다. (c)SSU, LSU, 리보소말(RS) 및 핵아제성 이단(DS) 분획으로의 제2선형 자당 그라데이션을 통해 RNase I 소화 및 초원심분리에 의해 번역된 mRNA 풀로부터 해방된 개별 리보소말 복합체의 분리. 고(15 AU260)및 저(8 AU260)양이 부족하여 경질된 소화물질이 포함되어 사소한 분획이 관심을 가질 때 초원심분리 하중을 증가시켜 가능성을 입증하였다. 고차 핵제 내성 폴리섬도 식별할 수 있다(예를 들어, 제공된 예에서 삼각체). (b,d) 표지로 각각(a,c)에서우라일 아세테이트 대조 분획의 대표적인 TEM 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
일시적인 리보솜 관련 단백질(특히 eIF)의 유지를 위한 고정 요법의 적합성을 확인하기 위해, 우리는 리보솜에 동적으로 결합된 음순 eIF인 eIF4A의 공동 퇴적물을 테스트했습니다. 우리는 eIF4A 탠덤 친화성 정화(TAP)를 이용한 효모 균주(TIF1-TAP)를 이용하고, 고정된 대 고정세포로부터 유래된 물질에서 eIF4A의 존재를 항TAP 항체를 사용하여, SDS-PAGE를 사용하여 추가RNA 결합 대조군으로 파브1p의 풍부에 비하여 서식배팅(6도)을 이용하여 조사하였다.
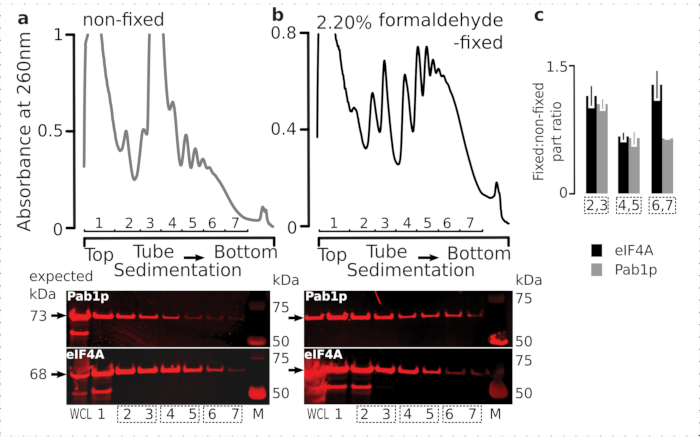
도 6: 생체 포름알데히드 고정시 번역 복합체에서 과도 단백질의 안정화. (a,b)(상단 플롯)전체 세포 용액 (WCL)(a)비 고정 및(b)2.2% 포름알데히드 고정 eIF4A-TAP 효모 세포는 초점리유동에 의해 분리되고 2.2% 포름알데히드-TAP 효모 세포가 극성 유립에 의해 분리되고 2전설에 설명된 바와 같이 시각화되었다. (하단플롯) 해당 그라데이션(상단 플롯)에서 분석된 물질의 분리 시 각각의 자당 그라데이션 분획의 웨스턴 블롯 이미징 및 WCL을 대조군으로 한다. (c)고정 및 비고정 재료의 분획에서 eIF4A 또는 Pab1p 풍부 사이의 평균 비율. eIF4A(블랙 바) 및 Pab1p(회색 막대)의 상대적 비율(모든 2-7 분수의 신호로 정규화됨)은 2,3(SSU, LSU), 4,5(RS, 라이트 폴리올어), 6,7(중다형) 데이터(a,b) (하단 플롯)의 데이터에서 계산되었다. 오류 막대는 복제로 처리되는 풀이 된 분수(점선 상자)를 사용하면 평균값의 비율의 표준 편차를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
세포내 의 높은 풍부와 일치, 우리는 전체 세포 용해 (WCL)와 비 고정 된 세포에서 파생 된 느린 침전 분획에서 두 단백질모두에서 신호의 높은 강도를 관찰(도 6a,하단 패널). 우리는 또한 고정 된 세포에서 파생 된 WCL에서 이러한 단백질의 상당한 양을 검출하고 교차 연결 된 물질 추출 및 예기치 않은 손실의 부재의 효율성을 안심(도 6b,하단 패널). 그러나, 고정된 세포로부터의 물질은 Pab1p(도6c)에비해 더 빠른 침전리보 분획에서 eIF4A의 상대적 존재가 높은 것으로 나타났습니다. 이 결과는 eIF4A가 포름알데히드 크로스링크 재료의 폴리올름과 더 단단히 연관되어 있음을 시사한다.
리보소피 분획에서 eIF4A의 존재에 교차연결하는 긍정적이고 구체적인 안정화 효과를 확인한 결과, eIF4A 태그(TIF1-TAP) 효모 균주에서 고정된 재료를 사용하여 자기 IgG 비드와의 친화정화에 의한 eIF4A 함유 복합체를 포획하고 풍부하게 하였다. 친화력이 풍부한 WCL이 있습니다. 자당 그라데이션(예: 효모 프로토콜의 섹션 1.3)을 통해 첫 번째 퇴적후의 무료 SSU 및 다각형(번역된 mRNA 풀) 분획과 번역된 풀의 분해 시 두 번째 퇴적물에서 SSU, LSU 및 RS 분획(예: RNaseI.7)을 가진 개별 복합체로 분해하여 ). LSU 분획을 제외한 모든 경우, 원천물질(입력, I)에 β 액틴의 존재에 비해 정제된 분획(eluate, E)에서 eIF4A의 선택적 농축을 관찰할 수 있었다(입력, I)(도 7).
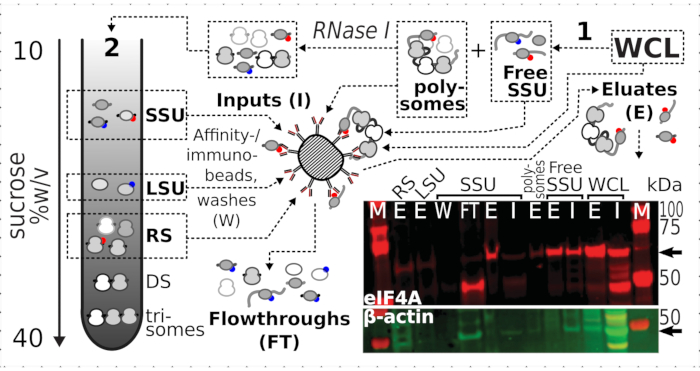
도 7: 일시적인 연관된 eIF4A에 의한 생체 내 포름알데히드 안정화 번역 복합체의 선택적 면역정화. 회로도는 eIF4A-TAP 효모 세포의 비분분별 정제 된 WCL을 포함하여 상이한 번역 복합체 및 eIF4A 에피토프의 근원을 보여줍니다. 무료 SSUs 및 번역 된 RNA 풀 (polysomes) 첫 번째 초원심 분리에서 분리; SSU, LSU 및 RS 분획은 RNase I 소화에 의해 번역된 RNA로부터 해방되고 제2 초원심심분리를 사용하여 분리된다(텍스트 참조). 웨스턴 블롯 이미지는 동시에 염색된 β 액틴 컨트롤의 풍부에 비해 분획이 풍부한 eIF4A 풍부의 시각화를 제공합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
포름알데히드 고정은 생체 분자10,36,45,46,47, 47,48의생체 내 빠른 생체 내 교차 연결을 달성하는 편리하고 인기있는 방법입니다. 다른 잠재적 인 생체 분자 목표에 비해, 번역 복합체의 성공적인 캡처는 세포 또는 다른 물질의 스냅 냉각 동안 즉각적인 고정을 필요로한다. 지연되지 않은 안정화없이, 다른 번역 관련 프로세스가 계속 될 가능성이있다, 멀리 vivo 상태에서 흔들리지 에서 복잡한 분포를 이동(49). 번역적 체포 및 리보소말 복합 안정화의 다른 방법에 비해, 세포막을 가로지르는 포름알데히드 작용의 신속성과 교차링크의 무차별적 특성은 그들의 네이티브 분산 상태에 가까운 번역 복합 중급자의 최대 다양성의 보존을약속한다 50.
여기에 제시된 접근법은 효모와 포유류 세포 모두에서 확립되고 최적화되었으며, 방법은 이제 전체 척추동물(예를 들어, 제브라피시 배아)과 같은 보다 다양한 생물학적 물질(예를 들어)10,38, 39,49,51,52와 같은 보다 다양한 생물학적 물질에 걸쳐 사용하기 위해 다른 집단에 의해파생되었습니다. . 이러한 작품은 전체적으로 접근의 다양성과 광범위한 적용성을 확신하지만, 번역 복합체의 빠른 포름알데히드는 최적화 및 조정의 필요성으로 인해 새로운 유형의 생물학적 물질로 전이하기가 다소 어렵다고 간주 할 수 있습니다.
방법의 성공에 가장 중요한 요구 사항은 포름알데히드의 농도와 세포 수집 및 중단 기술의 재최적화입니다. 덜 투과성, 작고 둥근 효모 세포는 고정 된 세포의 포름알데히드 농도와 물리적 중단을 훨씬 더 높은 (적어도, 10 배)를 필요로한다. 대조적으로, 배양에서 크고 평평해진 포유동물 세포는 쉽게 과고할 수 있고 고정시 부드러운 취급이 필요하며, 고정된 복합체의 추출은 세제를 사용하여 막 중단으로 화학적으로 수행될 수 있다. 교차 연결이 부족하면 덜 안정적이거나 더 단명한 중간자가 나중에 상태로 해리되거나 누출될 수 있습니다. 지나치게 교차하는 것은 리보소말 분획을 분리하고 연구하는 능력에 부정적인 영향을 미칠 수 있으며 무거운 복합체의 더 깊은 고갈과 같은 선택적 편견을 만들 수 있습니다. 우리의 관측에서, 사용된 부착된 인간 세포의 모형과 같은 사소한 변경조차, 복구된 교차 연결 복합체의 수율에 영향을 미칠 수 있고 교차 연결 식이요법의 재최적화를 요구할 수 있습니다. 또한 식물 세포와 같이 실질적으로 다른 투과성 특성을 가진 세포가 고정조건(52)의추가적인 광범위한 최적화가 필요할 것으로 예상할 수 있다. 그러나 접근 방식과 완전히 호환되지 않는 생물학적 물질의 유형을 상상하기는 어렵습니다.
포유류 고정 프로토콜에 관련된 한 가지 고려 사항은 입력으로 사용되는 세포 물질의 밀도 와 양입니다. 세포 번역 역학에 대한 외부 영향을 피하기 위해 적어도 2 일 동안 다시 파종또는 기타 방해없이 세포가 지속적으로 성장하는 것이 좋습니다. 대부분의 세포 유형에 적용 가능하지만, 대부분의 부착 셀은 지속적으로 70% 이하의 합류 수준을 달성하여 번역률에 부정적이고 예측할 수 없는 주요 접촉 억제 효과가 없음을 보장합니다.
무차별 반응성에서 비롯된 포름알데히드 고정의 또 다른 흥미롭고 잠재적으로 편리할 수 있는 특징은 혼합 분류학 시스템의 번역 복합체에 대한 안정화 효과입니다. 세균성, 그리고 더욱 이렇게 미토콘드리아의 번역 복합체, 엽록소 및 다른 세포내 기생충, 악명 높게 특정 번역 억제제로 표적으로 하기 어려웠습니다. 대조적으로, TCP-seq 데이터에서, 미토레미터메에 매핑하는 발자국은 데이터38,39,50에서쉽게 관찰할 수 있다. 흥미로운 후속 개발은 토양, 물 또는 창자 샘플과 같은 전체 마이크로 커뮤니티에서 번역을 조사하는 접근 방식을 사용하는 것일 수 있으며, 신뢰할 수있는 빠른 번역 체포 및 다른 수단과의 복잡한 안정화가 문제가 될 수 있습니다.
또한 가장 복잡한 물질(예: 단단 및/또는 부피가 큰 조직)의 경우 세포 붕괴 및 물질 균질화 시 즉시 포름알데히드 안정화의 사용을 막을 수 있는 것은 없다는 점을 언급해야 합니다. 이러한 접근법은 이미 특정 소분자억제제(33,53,54,55)로번역 복합체를 안정화할 때 세포 입력 지연을 제거하기 위해 사용된다. 포름알데히드 고정이 전통적으로 전자 현미경 검사법45,56,57,58과같은 응용 분야에서 전 생체 내/시험관 내 샘플 안정화에 대한 우수한 결과로 사용되어 왔다는 점을 감안할 때, 특히 철저하게 고정된 세포로부터 의 번역 복합체의 가난한 추출과 관련된 경우, 특히 이러한 경우에 더 적은 부정적인 효과를 기대할 수 있다.
우리의 연구 결과는 eIF4A를 포함하는 것과 같은 높게 일시적인 복합체를 안정시키기 위하여 급속한 포름알데히드 고정의 유용성을 확인합니다. 포유류와 는 달리 효모 eIF4A는 캡 결합 복합 eIF4F와 훨씬 더 약하게 연관되어 있으며, 그 결과 일반적으로 번역 복합체가 일반적으로 발생한다는 점은 주목할 만하다. eIF4A는 일반적으로효모29, 59,60,61,62, 62,63에서리보소말 물질의 광범위한 정화 중에 손실된다. 그러나 생체 내 고정 효모 재료에서는그 존재가 예상되는 모든 번역 단지에서 eIF4A의 신뢰할 수있는 농축을 달성 할 수 있습니다. 이전에 발표된 Sel-TCP-seq 데이터는 리보솜과 더 강하게 연관되는 eIF2 및 eIF3의 농축을 입증하였다(뿐만 아니라 일시적인 공동 번역 단백질 복합 조립을 밝혀내고 있음)39. 따라서, 상기 방법은 번역 복합체의 두 가지, 강하고 약한 부착 성분의 검출에 적합하다.
요약하자면, 번역 개시 단계에서 발생하는 변화에 주로 통찰력을 얻고 mRNA를 통해 리보소말 분포를 최소화하는 데 유용한 접근 방식을 제시했습니다. 중요한 것은, 이 접근법은 eIF4A와 같은 번역 복합체의 비교적 비열하고 역동적인 구성 요소의 안정화에 적합하며, 필요한 최적화를 광범위하게 받을 수 있다. 우리는 또한 번역의 급속한 동적 변화의 시나리오에서 포름알데히드 고정의 유용성에 대한 증거를 제공하고, 환경 변화 또는 스트레스 조건에 빠르게 진행되는 세포 반응과 같은 조사 영역을 열어.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 작품은 호주 연구 위원회 디스커버리 프로젝트 보조금 (DP180100111에서 T.P. 및 N.E.S), 국립 보건 및 의학 연구 위원회 조사원 보조금 (GNT11175388에서 N.E.S.) 및 연구 펠로우십 (APP1135928에서 T.P.에)에 의해 지원되었습니다. 저자는 고급 현미경 검사법의 센터에서 현미경 호주의 시설을 인정, 호주 국립 대학, 대학과 연방 정부에 의해 투자되는 시설.
자료
| Name | Company | Catalog Number | Comments |
| Yeast extract | Merck, Sigma-Aldrich | 70161 | |
| Peptone | Merck, Sigma-Aldrich | 70178 | |
| D-Glucose (Dextrose) | Merck, Sigma-Aldrich | 49139 | |
| Adenine sulphate | Amresco | 0607-50G | |
| Formaldehyde solution | Merck Sigma-Aldrich | F11635-500ML | ACS reagent, 37 wt. % in H2O, contains 10-15% Methanol as stabiliser (to prevent polymerisation) |
| RNaseOUT™ Recombinant Ribonuclease Inhibitor | Invitrogen™ byThermo Fischer Scientific | 10777019 | |
| cOmplete™, EDTA-free Protease Inhibitor Cocktail | COEDTAF-RO Roche by Merck | 11873580001 | |
| Magnesium chloride solution | (Merck/Sigma-Aldrich) | M1028 | |
| Ethylenediaminetetraacetic acid solution | (Merck/Sigma-Aldrich) | E7889 | |
| Ambion™ RNase I, cloned, 100 U/µL | Ambion | AM2294 | |
| SUPERase•In™ RNase Inhibitor (20 U/μL) | Invitrogen™ by Thermo Fisher Scientific | AM2694 | |
| Acidic phenol:chlorophorm:isoamyl alcohol 125:24:1 (pH 4.0-5.0) | (Merck/Sigma-Aldrich) | P1944-100ML | |
| Dynabeads™ Goat Anti-Mouse IgG | Invitrogen™ by Thermo Fisher Scientific) | 11033 | |
| Sodium Acetate (3 M), pH 5.5 | Invitrogen™ by Thermo Fisher Scientific) | AM9740 | |
| Glycogen (5 mg/ml) | Invitrogen™ by Thermo Fisher Scientific) | AM9510 | |
| Ethyl alcohol, Pure | Merck; Sigma Aldrich | E7023 | |
| Amersham™ Hybond® P Western blotting membranes, PVDF | Merck | GE10600023 | PVDF membrane for western blotting |
| Bolt™ 4 to 12%, Bis-Tris, 1.0 mm, Mini Protein Gel | Invitrogen™ by ThermoFischer Sientific | NW04120BOX | Protein gel |
| 4X Bolt™ LDS Sample Buffer | Invitrogen™ by ThermoFischer Sientific | B0007 | LDS sample loading buffer |
| Precision Plus Protein™ Kaleidoscope™ Prestained Protein Standards | BioRad | 1610375 | Protein ladder |
| 20X Bolt™ MES SDS Running Buffer | ThermoFischer Scientific | B0002 | PAGE runninjg buffer |
| Intercept® (PBS) Blocking Buffer | LI-COR | 927-70001 | Odyssey Blcoking buffer (PBS) |
| IRDye® 800CW Goat anti-Mouse IgG Secondary Antibody | LI-COR | 92632210 | |
| IRDye® 800CW Goat anti-Rabbit IgG Secondary Antibody | LI-COR | 92632211 | |
| TAP Tag Polyclonal Antibody | Invitrogen™ by ThermoFischer Sientific | CAB1001 | |
| Anti-beta Actin antibody | Abcam | ab8227 | |
| Sucrose | (Merck/Sigma-Aldrich) | 84097 | BioUltra, for molecular biology, ≥99.5% (HPLC) |
| DL-Dithiothreitol solution | (Merck/Sigma-Aldrich) | 43816 | BioUltra, for molecular biology, ~1 M in H2O |
| Terumo Syringe 1CC/mL | Terumo Syringe | 878499 | |
| Potassium chloride | (Merck/Sigma-Aldrich) | 60128 | |
| HEPES | (Merck/Sigma-Aldrich) | H3375 | |
| Dulbecco's Modified Eagle's Medium - high glucose | Sigma Aldrich | D5796 | |
| Fetal Bovine Serum | Sigma Aldrich | 12003C | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 | |
| Dulbecco's Phosphate Buffered Saline with Calcium and magnesium | Sigma-Aldrich | D8662 | |
| Glycine | Sigma-Aldrich | G7126 | |
| Tris hydrochloride | Merck/Sigma-Aldrich | 10812846001 | |
| Sodium dodecyl sulfate | Merck/Sigma-Aldrich | 436143 | |
| IGEPAL CA-630 | Merck/Sigma-Aldrich | I3021 | |
| Rnasin Ribonuclease Inhibitor | Promega | N2111 | |
| Stainless steel grinding jar | Retsch | 02.462.0059 | |
| MM400 mixer mill | Retsch | 20.745.0001 | |
| Gradient Fractionator | Brandel | BRN-BR-188 | |
| Thermomixer R | Eppendorf | Z605271 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| 0.5-ml microcentrifuge tubes with locking devices | Eppendorf Safe-Lock | 30121023 | |
| Mini Gel Tank | (Thermo Fisher Scientific) | A25977 | PAGE running tank |
| 5 mL, Open-Top Thinwall Ultra-Clear Tube, 13 x 51mm | Beckman-Coulter | 344057 | |
| 13.2 mL, Certified Free Open-Top Thinwall Polypropylene, 14 x 89mm - 50Pk | Beckman-Coulter | 331372 | |
| Amicon Ultra-0.5 ultrafiltration devices | Merck | UFC5030 | Ultracel-30 regenerated cellulose membrane, 0.5 mL sample volume |
| Thermo Sorvall Evolution RC Floor Super Speed Centrifuge | Cambridge Scientific | 15566 | |
| Beckman Coulter Optima L-90K | GMI | 8043-30-1191 | |
| Nunc EasYFlask 175cm2 | Thermofisher Scientific | 159910 | |
| Falcon 50 mL Conical Centrifuge Tubes | Thermofisher Scientific | 14-432-22 | |
| 25 mL Serological Pipette | Sigma-Aldrich | SIAL1250 | |
| 10 mL Serological Pipette | Sigma-Aldrich | SIAL1100 | |
| DNA lobind tubes | Eppendorf | 30108051 | |
| Cold Centrifuge 5810 R | Eppendorf | EP022628188 | for 50 mL tubes |
| Orbital Shaking Incubator | Ratek | OM11 | |
| Frezco 17 Microcentrifuge | Thermofisher Scientific | 75002402 | |
| Eppendorf DNA lo-bind tubes | Merck/Sigma-Aldrich | EP0030108051 | |
| Eppendorf® Protein LoBind tubes | Merck/Sigma-Aldrich | EP0030108116 | |
| SW 41 Ti Swinging bucket rotor | Beckman-Coulter | 331362 | |
| Heracell™ 150i CO2 Incubator, 150 L | Thermofisher Scientific | 51026282 | |
| 0,3 mL ultra-fine II short insulin syringe | BD Medical | 328822 | |
| 3 mL syringe with Luer Lok tip | BD Medical | 302113 | |
| 25 G x 16 mm Hypodermic Needle | Terumo | TUAN2516R1 |
참고문헌
- Janapala, Y., Preiss, T., Shirokikh, N. E. Control of translation at the initiation phase during glucose starvation in yeast. International Journal of Molecular Sciences. 20 (16), 4043 (2019).
- Masvidal, L., Hulea, L., Furic, L., Topisirovic, I., Larsson, O. mTOR-sensitive translation: Cleared fog reveals more trees. RNA Biology. 14 (10), 1299-1305 (2017).
- Ashe, M. P., De Long, S. K., Sachs, A. B. Glucose depletion rapidly inhibits translation initiation in yeast. Molecular Biology of the Cell. 11 (3), 833-848 (2000).
- Crawford, R. A., Pavitt, G. D. Translational regulation in response to stress in Saccharomyces cerevisiae. Yeast. 36 (1), 5-21 (2019).
- Melamed, D., Pnueli, L., Arava, Y. Yeast translational response to high salinity: global analysis reveals regulation at multiple levels. RNA. 14 (7), 1337-1351 (2008).
- Hershey, J. W., Sonenberg, N., Mathews, M. B. Principles of translational control: An overview. Cold Spring Harbor Perspectives in Biology. 4 (12), 011528 (2012).
- Mata, J., Marguerat, S., Bähler, J. Post-transcriptional control of gene expression: a genome-wide perspective. Trends in Biochemical Sciences. 30 (9), 506-514 (2005).
- Spriggs, K. A., Bushell, M., Willis, A. E. Translational regulation of gene expression during conditions of cell stress. Molecular Cell. 40 (2), 228-237 (2010).
- Liu, B., Qian, S. B. Translational reprogramming in cellular stress response. Wiley Interdisciplinary Reviews RNA. 5 (3), 301-315 (2014).
- Archer, S. K., Shirokikh, N. E., Beilharz, T. H., Preiss, T. Dynamics of ribosome scanning and recycling revealed by translation complex profiling. Nature. 535 (7613), 570-574 (2016).
- Hinnebusch, A. G., Ivanov, I. P., Sonenberg, N. Translational control by 5'-untranslated regions of eukaryotic mRNAs. Science. 352 (6292), 1413-1416 (2016).
- Dever, T. E., Green, R. The elongation, termination, and recycling phases of translation in eukaryotes. Cold Spring Harbor Perspectives in Biology. 4 (7), 013706 (2012).
- Shirokikh, N. E., Preiss, T. Translation initiation by cap-dependent ribosome recruitment: Recent insights and open questions. Wiley Interdisciplinary Reviews RNA. 9 (4), 1473 (2018).
- Jiménez-Díaz, A., Remacha, M., Ballesta, J. P., Berlanga, J. J. Phosphorylation of initiation factor eIF2 in response to stress conditions is mediated by acidic ribosomal P1/P2 proteins in Saccharomyces cerevisiae. PLoS One. 8 (12), 84219 (2013).
- Sonenberg, N., Hinnebusch, A. G. Regulation of translation initiation in eukaryotes: mechanisms and biological targets. Cell. 136 (4), 731-745 (2009).
- Majmundar, A. J., Wong, W. J., Simon, M. C. Hypoxia-inducible factors and the response to hypoxic stress. Molecular Cell. 40 (2), 294-309 (2010).
- Barraza, C. E., et al. The role of PKA in the translational response to heat stress in Saccharomyces cerevisiae. PLoS One. 12 (10), 0185416 (2017).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: Life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Jamar, N. H., Kritsiligkou, P., Grant, C. M. The non-stop decay mRNA surveillance pathway is required for oxidative stress tolerance. Nucleic Acids Research. 45 (11), 6881-6893 (2017).
- Chen, Z., et al. The complete pathway for thiosulfate utilization in Saccharomyces cerevisiae. Applied and Environmental Microbiology. 84 (22), (2018).
- Marzluf, G. A. Molecular genetics of sulfur assimilation in filamentous fungi and yeast. Annual Review of Microbiology. 51, 73-96 (1997).
- Miller, D., Brandt, N., Gresham, D. Systematic identification of factors mediating accelerated mRNA degradation in response to changes in environmental nitrogen. PLoS Genetics. 14 (5), 1007406 (2018).
- Zhang, W., Du, G., Zhou, J., Chen, J. Regulation of sensing, transportation, and catabolism of nitrogen sources in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 82 (1), (2018).
- Tokpohozin, S. E., Fischer, S., Becker, T. Selection of a new Saccharomyces yeast to enhance relevant sorghum beer aroma components, higher alcohols, and esters. Food Microbiology. 83, 181-186 (2019).
- Walker, G. M., Stewart, G. G. Saccharomyces cerevisiae in the production of fermented beverages. Beverages. 2 (4), 30 (2016).
- Chassé, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), 15 (2017).
- Jin, H. Y., Xiao, C. An integrated polysome profiling and ribosome profiling method to investigate in vivo translatome. Methods in Molecular Biology. 1712, 1-18 (2018).
- Arava, Y., et al. Genome-wide analysis of mRNA translation profiles in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3889-3894 (2003).
- Lackner, D. H., et al. A network of multiple regulatory layers shapes gene expression in fission yeast. Molecular Cell. 26 (1), 145-155 (2007).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-Wide Analysis in Vivo of Translation with Nucleotide Resolution Using Ribosome Profiling. Science. 324 (5924), 218-223 (2009).
- Ingolia, N. T., Hussmann, J. A., Weissman, J. S. Ribosome Profiling: Global Views of Translation. Cold Spring Harbor Perspectives in Biology. 11 (5), (2019).
- Gerashchenko, M. V., Lobanov, A. V., Gladyshev, V. N. Genome-wide ribosome profiling reveals complex translational regulation in response to oxidative stress. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17394-17399 (2012).
- Hussmann, J. A., Patchett, S., Johnson, A., Sawyer, S., Press, W. H. Understanding biases in ribosome profiling experiments reveals signatures of translation dynamics in yeast. Proceedings of the National Academy of Sciences Genetics. 11 (12), 1005732 (2015).
- Santos, D. A., Shi, L., Tu, B. P., Weissman, J. S. Cycloheximide can distort measurements of mRNA levels and translation efficiency. Nucleic Acids Research. 47 (10), 4974-4985 (2019).
- Schneider-Poetsch, T., et al. Inhibition of eukaryotic translation elongation by cycloheximide and lactimidomycin. Nature Chemical Biology. 6 (3), 209-217 (2010).
- Hoffman, E. A., Frey, B. L., Smith, L. M., Auble, D. T. Formaldehyde crosslinking: A tool for the study of chromatin complexes. Journal of Biological Chemistry. 290 (44), 26404-26411 (2015).
- Kage, U., Powell, J. J., Gardiner, D. M., Kazan, K. Ribosome profiling in plants: What is not lost in translation. Journal of Experimental Botany. 71 (18), 5323-5332 (2020).
- Shirokikh, N. E., Archer, S. K., Beilharz, T. H., Powell, D., Preiss, T. Translation complex profile sequencing to study the in vivo dynamics of mRNA-ribosome interactions during translation initiation, elongation and termination. Nature Protocols. 12 (4), 697-731 (2017).
- Wagner, S., et al. Selective translation complex profiling reveals staged initiation and co-translational assembly of initiation factor complexes. Molecular Cell. 79 (4), 546-560 (2020).
- Zlotorynski, E. Profiling ribosome dynamics. Nature Reviews Molecular Cell Biology. 17 (9), 535-535 (2016).
- Sen, N. D., Gupta, N., S, K. A., Preiss, T., Lorsch, J. R., Hinnebusch, A. G. Functional interplay between DEAD-box RNA helicases Ded1 and Dbp1 in preinitiation complex attachment and scanning on structured mRNAs in vivo. Nucleic Acids Research. 47 (16), 8785-8806 (2019).
- Zhao, J., Qin, B., Nikolay, R., Spahn, C. M. T., Zhang, G. Translatomics: The global view of translation. International Journal of Molecular Sciences. 20 (1), 20010212 (2019).
- Luthe, D. S. A simple technique for the preparation and storage of sucrose gradients. Analytical Biochemistry. 135 (1), 230-232 (1983).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: A revolutionary tool for transcriptomics. Nature Review Genetics. 10 (1), 57-63 (2009).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation. Trends in Biochemical Sciences. 25 (3), 99-104 (2000).
- Schmiedeberg, L., Skene, P., Deaton, A., Bird, A. A Temporal Threshold for Formaldehyde Crosslinking and Fixation. PLoS One. 4 (2), 4636 (2009).
- Solomon, M. J., Varshavsky, A. Formaldehyde-mediated DNA-protein crosslinking: A probe for in vivo chromatin structures. Proceedings of the National Academy of Sciences. 82 (19), 6470-6474 (1985).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping proteinDNA interactions in vivo with formaldehyde: Evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Bohlen, J., Fenzl, K., Kramer, G., Bukau, B., Teleman, A. A. Selective 40S footprinting reveals cap-tethered ribosome scanning in human cells. Molecular Cell. 79 (4), 561-574 (2020).
- Shirokikh, N. E. Translation complex stabilization on messenger RNA and footprint profiling to study the RNA responses and dynamics of protein biosynthesis in the cells. Critical Reviews in Biochemistry and Molecular Biology. , (2021).
- Giess, A., et al. Profiling of small ribosomal subunits reveals modes and regulation of translation initiation. Cell Reports. 31 (3), 107534 (2020).
- Firmino, A. A. P., et al. Separation and paired proteome profiling of plant chloroplast and cytoplasmic ribosomes. Plants (Basel). 9 (7), (2020).
- Gerashchenko, M. V., Gladyshev, V. N. Translation inhibitors cause abnormalities in ribosome profiling experiments. Nucleic Acids Research. 42 (17), 134 (2014).
- Santos, D. A., Shi, L., Tu, B. P., Weissman, J. S. Cycloheximide can distort measurements of mRNA levels and translation efficiency. Nucleic Acids Research. 47 (10), 4974-4985 (2019).
- Schneider-Poetsch, T., et al. Inhibition of eukaryotic translation elongation by cycloheximide and lactimidomycin. Nature Chemical Biology. 6 (3), 209-217 (2010).
- Plénat, F., et al. Formaldehyde fixation in the third millennium. Annales De Pathologie. 21 (1), 29-47 (2001).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Wang, N. S., Minassian, H. The formaldehyde-fixed and paraffin-embedded tissues for diagnostic transmission electron microscopy: A retrospective and prospective study. Human Pathology. 18 (7), 715-727 (1987).
- Grifo, J. A., et al. Characterization of eukaryotic initiation factor 4A, a protein involved in ATP-dependent binding of globin mRNA. Journal of Biological Chemistry. 257 (9), 5246-5252 (1982).
- Li, Y. Commonly used tag combinations for tandem affinity purification. Biotechnology and Applied Biochemistry. 55 (2), 73-83 (2010).
- Blum, S., et al. ATP hydrolysis by initiation factor 4A is required for translation initiation in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 89 (16), 7664-7668 (1992).
- Merrick, W. C. eIF4F: A Retrospective. Journal of Biological Chemistry. 290 (40), 24091-24099 (2015).
- Rogers, G. W., Komar, A. A., Merrick, W. C. eIF4A: The godfather of the DEAD box helicases. Progress in Nucleic Acid Research and Molecular Biology. 72, 307-331 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유