JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
살아있는 식물 세포에서 Förster 공명 에너지 전송 측정
요약
생체 내 Förster 공명 에너지 전송 측정을 위한 표준 공초점 레이저 스캐닝 현미경을 설정하고 데이터 평가를 위한 프로토콜이 제공됩니다.
초록
감미화 된 방출 기반 Förster 공명 에너지 전송 (FRET) 실험은 쉽게 수행되지만 미세한 설정에 의존합니다. 공초점 레이저 스캐닝 현미경은 생물학자를위한 주력이되었다. 상용 시스템은 레이저 전력 조정 및 검출기 감도에서 높은 유연성을 제공하며 종종 다른 검출기를 결합하여 완벽한 이미지를 얻을 수 있습니다. 그러나 이러한 유연성으로 인해 다양한 실험 및 설정에서 강도 기반 데이터를 비교하는 것은 종종 불가능합니다. 생물학자 친화적 인 절차는 장점이며 레이저 및 검출기 설정을 간단하고 신뢰할 수있는 조정할 수 있습니다.
더욱이, 살아있는 세포에 있는 FRET 실험은 단백질 발현 및 기증자 수용자 비율에 있는 가변성에 의해 영향을 받기 때문에, 단백질 발현 수준은 데이터 평가를 위해 고려되어야 합니다. 여기에 설명된 단백질 발현 및 레이저 강도 및 검출기 설정 조정을 위한 루틴을 포함하여 안정적이고 재현 가능한 FRET 측정을 위한 간단한 프로토콜이 있습니다. 데이터 평가는 알려진 FRET 효율의 불소 융합으로 교정에 의해 수행됩니다. 단순성을 향상시키기 위해, 교정 요인은 세포에서 그리고 재조합 형광 단백질을 측정해서 얻어진 비교되었습니다.
서문
Förster 공명 에너지 전송 (((F)RET)는 전형적으로 형광 분광법에 의해 관찰되지만, 공정 자체는 형광류 사이에서 발생하는 것으로 제한되지 않는다. 기본 이폴-이폴 커플링은 단순히 발광 기증자 분자와 빛을 흡수하는 수용자가 필요합니다. 이는 정규화된 기증자 방출 및 수용자 흡광도 스펙트럼의 필수 스펙트럼 중첩 일체형 J로부터 유래된다. 그러나 RET는 형광과 경쟁하기 때문에, 에너지 전달은 형광 방출의 변경에 의해 측정될 수 있게 됩니다: RET는 기증자의 담금질 및 감안기 방출을 유도합니다.
형광소 기반 RET는 생물 발광 공명 에너지 전달 (BRET)에서 분리하기 위해 형광 공명 에너지 전송 (FRET)이라고합니다. RET는 0.5-10 nm2 의 범위에서 널리 퍼져 있는 기증자와 수용자 사이의 거리에 크게 의존하며, 따라서 단백질과 그 복합체의 치수와 동일한 범위에서. 둘째, RET는 이폴-이폴 방향 카파 제곱에 의존한다. 단백질 에 바인딩된 형광의 회전적 자유가 분자량과 느린 회전 이완으로 인해 소홀히 할 수 있다는 사실과 결합된 RET는 형태 적 변화의 분석을 허용합니다3.
소위 Förster 반경은 스펙트럼 중첩 일체형과 겹침의 파장 범위를 기반으로하므로 적색 광 흡수 크로모포레스는 청광 흡수 염료보다 Förster radii가 더 길어집니다. FRET 측정의 동적 범위는 R0과 1.× 5 × R0으로 제한되기 때문에 FRET 쌍 ECFP-EYFP는 4.9 nm4의 R0으로 인해 2.5-7.3 nm의 동적 범위를 가지고 있습니다.
불소화의 밝기는 어금니 멸종 계수와 양자 수율의 제품에 의해 제공됩니다. FRET 측정의 경우 거의 유사한 밝기의 형광을 선택하는 것이 유리합니다. 이것은 기증자 담금질 및 감질된 수용자 방출의 탐지를 향상시킵니다. 또한 현미경 시스템의 교정을 선호합니다. 자주 사용되는 FRET 쌍의 시안 및 형광 단백질을 살펴보면 시안 형광 단백질의 낮은 밝기가 명백해집니다(그림 1A).
그러나 수용자의 수명은 기증자의 수명보다 낮아야 하며, 에너지 전달을 위한 수용자의 가용성을 보장해야 합니다. 수락자의 수명이 기증자의 수명을 초과하는 경우, 기증자가 다시 흥분할 때 수락자는 여전히 흥분 상태에있을 수 있습니다. mTurquoise와 같은 고급 시안 형광 단백질은 수명이 연장되어 FRET의 증가 확률에 기여합니다(그림1B). FRET의 확률은 또한 수용자의 어금니 소멸 계수에 따라 달라집니다.
프로토콜
참고: 다음 프로토콜의 경우 이전에 설명된 바와 같이 프토플라스트의 일시적인 과도 전환이 수행되었습니다12. 아래에 간단한 설명이 제공됩니다.
1. 프토플라스트의 일시적인 전환
- 아라비도시스 탈리아나 에코타입 컬럼비아의 건강한 잎 ~4 g을 1mm 슬라이스로 자르고 효소 용액 20mL로 옮기십시오 (1.5 % 셀룰라아제; 0.4% 마메로지메; 0.1% 소 세럼 알부민 분수 V; 0.4 M 매니톨; 20 mM KCl; 20 mM 2-(N-morpholino)에탄설포닉산(MES), pH 5.7; 10mM CaCl2).
- 잎 조각을 진공 침수한 다음 실온에서 2 시간 동안 교반되는 배양이 뒤따릅니다. 100 × g에서 3 분 동안 원심 분리에 의해 세포를 수확하십시오.
- W5 솔루션(154m NaCl; 125m CaCl2; 5mM KCl; 2mM MES, pH 5.7)으로 프토플라스트를 세척하고 MMG 솔루션(0.4M Mannitol; 15m M MgCl2; 4mM MES, pH 5.7)으로 재보선합니다.
- 폴리에틸레네글리콜(PEG) 4000의 존재시 삼투성 쇼크에 의한 8웰 슬라이드에서 트랜스페션을 수행한다. 프토플라스트 서스펜션의 20 μL을 플라스미드 DNA 5μL(5 μg/μL) 및 PEG 용액 25μL(0.2M 매니톨, 0.1 M CaCl2, 40% PEG 4000)과 혼합합니다.
- 삼투압 조건의 부드러운 재조정에 의해 삼투압 쇼크를 반전.
참고 : 관심샘플 외에도 기증자와 수락자의 표현만으로도 기증자와 수용자의 스펙트럼 출혈을 각각 결정해야 합니다. 기증자와 수용자의 융합 단백질은 교정 목적으로도 표현되어야 합니다. 형광 단백질 발현은 콜리플라워 모자이크 바이러스 35S 프로모터(pCaMV35S)의 통제하에 있었다. 모든 측정에 대해, 두 개의 공초점 레이저 스캐닝 현미경 (LSM1 및 LSM2)이 사용되었다. LSM1에는 FRET 측정을 위해 기증자 신호가 GaAsP 검출기에 의해 감지되었으며 FRET 및 수용자 방출은 광증으로 기록되었습니다. LSM2에는 기증자, FRET 및 수용자 방출의 검출에 사용되었던 두 개의 광증증이 있습니다.
2. 레이저 조정
참고: 여기서, 아르곤 이온 레이저의 458nm 및 514 nm 라인은 향상된 시안 형광 단백질 (ECFP)-및 향상된 노란 형광 단백질 (EYFP) 표지 단백질 사이 FRET 분석을 위해 적용되었습니다. 재현 가능한 데이터 수집의 경우 두 줄이 비슷한 강도로 조정되었습니다. 이는 전송 광승화 또는 반사 모드에 의해 달성되었다.
- 전송 광증으로 레이저 조정
- 조정을 위해 빈 우물을 사용합니다.
- 라인 스캐닝 모드와 히스토그램 뷰를 선택합니다.
- 레이저 강도를 최소한으로 줄이고 검출기 게인을 감지 가능한 배경 소음으로 조정합니다.
- 0.5%의 단계로 레이저 강도를 높이고 해당 신호를 기록합니다.
- 두 레이저 라인에 대한 루틴을 적용합니다.
- 반사 모드로 레이저 조정
- 조정을 위해 빈 우물을 사용합니다.
- 리플렉션 필터를 적용하고, 사용 가능한 경우 반사 모드를 켭타리모드로 전환합니다.
- 검출기 파장 범위가 레이저의 파장을 커버해야 합니다.
- 라인 스캐닝 모드와 히스토그램 뷰를 선택합니다.
- 레이저 강도를 최소한으로 줄이고 검출기 게인을 감지 가능한 배경 소음으로 조정합니다.
- 목표를 가장 낮은 위치로 이동합니다.
- 커버슬립의 반사가 표시될 때까지 목표를 위로 이동합니다.
- 0.5%의 단계로 레이저 강도를 높이고 해당 신호를 기록합니다.
- 두 레이저 라인에 대한 루틴을 적용합니다.
- 데이터 평가
- 데이터를 타부레이트하고 신호 강도로 데이터를 정렬합니다.
- 상대 레이저 전력에 대한 신호 강도를 플롯합니다.
- 유사한 신호 강도를 초래하는 레이저 강도를 선택합니다.
3. 광증의 조정
참고: 레이저 조정 후, 광증증은 유사한 감도를 얻기 위해 개별 이득으로 조정되었습니다. 이 교정은 관심의 파장 범위의 중심에있는 514 nm 레이저 라인으로 수행되었다.
- 조정을 위해 빈 우물을 사용합니다.
- 리플렉션 필터를 적용하고 사용 가능한 경우 반사 모드로 전환합니다.
- 검출기 파장 범위가 레이저(514nm)의 파장을 커버해야 합니다.
- 라인 스캐닝 모드와 히스토그램 뷰를 선택합니다.
- 검출기 게인을 최대값의 절반으로 줄이고 레이저 강도를 감지 가능한 배경 소음으로 조정합니다.
- 목표를 가장 낮은 위치로 이동합니다.
- 커버슬립의 반사가 표시될 때까지 목표를 위로 이동합니다.
- 50~ 100V 단계로 검출기 게인을 늘리고 해당 신호를 기록합니다.
- 두 검출기모두에 대해 3.1~ 3.8단계를 적용합니다.
- 데이터 평가
- 각 검출기에 대한 검출기 게인에 대한 강도를 플롯합니다.
- 개별 검출기 이득을 선택하여 유사한 감도를 얻습니다.
4. FRET 이미지 수집
참고: 이미지 수집 을 설정하기 위한 관심 샘플부터 시작합니다.
- FRET 쌍 ECFP/EYFP에 대한 이중 이분해성 미러 MBS 458/514와 같은 적절한 필터/이색 거울을 선택합니다. 모든 채널에 동일한 이차 미러를 사용하여 라인별 스캐닝을 활성화합니다. 살아있는 세포의 화상 진찰을 위한 물 침수 목표를 선택하십시오. 12비트 또는 16비트 스캐닝과 적당한 스캐닝 속도를 선택합니다.
- ECFP/EYFP의 경우 기증자 검출을 위한 검출 범위, 바람직하게는 470-510 nm 및 530-600 nm의 수용자/FRET 검출을 정의한다. 445nm 또는 440 nm 다이오드 레이저를 사용하는 경우 450 nm에서 510nm를 검출 범위로 사용하십시오. 아쿠스토 광학 빔 스플리터(AOBS)의 경우 원치 않는 수용자 감지를 방지하기 위해 450~500nm 범위에서 기증자 검출을 정의한다.
- 3.10.2에 따라 검출기 설정을 적용합니다.
- 2.3.2에 따라 레이저 설정을 적용합니다. 필요한 경우 얻어진 레이저 파워 테이블에 기초하여 레이저 강도를 수정합니다. 신호 대 잡음 비율이 검출기의 전체 동적 범위(12비트 스캐닝의 경우 0에서 4095사이의 강도)를 커버해야 합니다.
- 레이저 강도를 유지하고 검출기는 일정하게 얻을 수 있습니다. 핀홀 직경을 미세 조정에 사용합니다.
참고: 핀홀 직경의 변화는 공간 해상도에 영향을 미칩니다. - 측정을 수행합니다(20개 이상의 셀의 이미지를 가져 가라).
5. 크로스토크 수정 결정
참고: 기증자 또는 수용자만 표현하는 세포는 각각 기증자 스펙트럼 출혈(DSBT) 및 수용자 스펙트럼 출혈(ASBT)을 결정해야 합니다. 섹션 4에 설명된 동일한 설정을 유지합니다.
- 기증자 불소호를 표현하는 세포로 FRET 측정을 수행합니다.
- 수용자 불소호를 발현하는 세포로 FRET 측정을 수행합니다.
6. 비밀러 외.13에 따른 측정 의 교정
참고: 알려진 FRET 효율의 기증자 수용자 융합을 표현하는 세포가 필요합니다. 여기서, 0.46의 FRET 효율을 가진 ECFP-5 aa-EYFP 융합이 사용되었습니다4. 섹션 4에 설명된 동일한 설정을 유지합니다.
- 기증자 수용자 융합을 표현하는 세포로 FRET 측정 수행
7. 데이터 평가
- 각 프로파일에 두 개의 셀이 하나 이하의 셀을 포함하지 않도록 셀의 선 프로파일을 가져옵니다. 프로필을 텍스트 파일로 저장합니다.
- 데이터 섹션의 텍스트 파일 가져오기 옵션을 사용하여 텍스트 파일을 스프레드시트로 가져옵니다.
- Max 함수를 적용하여 최대 값을 읽어보십시오.
- 표에 획득한 값을 나열하고, 기증자 배출 ID, FRET 배출 IF, 수용자 방출 IA 및 최소 4개의 데이터 세트에 대한 각각의 컬럼이 있습니다: 기증자 전용, 수락자 만, 기증자 수용자 융합 및 측정.
참고: 기증자의 흥분은 또한 수용자의 직접적인 흥분을 초래하고 α 값에 의해 설명되는 ASBT를 일으키는 원인이 됩니다. - 방정식(1)을 사용하여 허용자 전용 데이터 집합을 사용하여 ASBT α 값을 계산합니다.
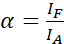 (1)
(1)
참고: 다음 방정식에서 모든 α 값의 중앙값을 사용합니다. 기증자는 수용자의 감응 방출과 방출 크로스토크를 초래하는 광범위한 방출 스펙트럼을 보여줍니다. 이 DSBT는 β 값에 의해 제공됩니다. - 방정식(2)을 사용하여 기증자 전용 데이터 집합을 사용하여 기증자 스펙트럼 출혈 β 값을 계산합니다.
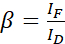 (2)
(2)
참고: 다음 방정식의 모든 β 값의 중앙값을 사용합니다. 교정 계수는 ξ FRET 유래 기증자의 선형 관계를 설명하고 수용자의 민감 방출을 민감화합니다. 다음 방정식에서 7.5 및 7.6의 중앙값을 사용합니다. - 기증자-수용자 융합 데이터 집합과 수학식(3)을 사용하여 FRET 효율 E(0.46)를 사용하여 ξ 교정 계수를 계산합니다.
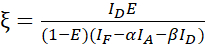 (3)
(3)
참고: 다음 방정식의 모든 ξ 값의 중앙값을 사용합니다. - 수학식(4) 및 (5)를 사용하여 관심 있는 단백질 쌍의 FRET 효율성을 계산합니다.
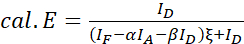 (4)
(4)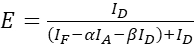 (5)
(5) - 표현력 및/또는 기부자 수용률의 효과를 추정합니다: FRET 효율성에 대하여 ID, IF 및 IA 의 합을 플롯합니다. 선형 회귀를 수행합니다. 그래프가 가파르고 R2 가 높을수록 발현 레벨의 영향이 높거나 기증자와 수용자의 차이가 더 크다.
결과
공초점 레이저 스캐닝 현미경의 조정
레이저 조정은 레이저 강도가 증가함에 따라 방출의 선형 증가를 드러냈다(그림 2 및 표 1). 아르곤 이온 레이저에 대 한 예상 대로, 514 nm 라인의 방출 458 nm 라인의 방출 보다 훨씬 높은 458 nm 라인의 방출, 가파른 경사에 의해 입증. 후속 실험의 경우, 레이저 전력은 각각 4.5%와 6.5%로 514nm 라인과 458nm 라인에 선택...
토론
기증자 담금질 및 민감 감응수용자 방출은 FRET의 기증자 또는 수용자 기반 계산을 허용하는 선형 관계가 특징입니다. 선형의 해당 요소는 상호 값4인 G 계수(기증자를 수락자)또는 xi(기증자에 대한 수락자)라고 합니다. 형광 현미경 검사법에 의한 형광 단백질 사이의 FRET를 측정하려면 형광 단백질의 광범위한 흡수 및 방출 스펙트럼으로 인해 DSBT 및 ASBT에 대한 교정이 종종 필요?...
공개
우리는 모든 저자가 이해 관계의 모든 충돌을 공개하고 경쟁 금융 이익이 없는지 확인합니다.
감사의 말
실험은 생물학 학부의 빛 현미경 기술 플랫폼 (LiMiTec)에서 수행되었다, 빌레펠트 대학. 이 작품은 빌레펠트 대학에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
참고문헌
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유