Method Article
리자테 기반 세포 없는 시스템에서 대사산물 프로파일링을 위한 굴절률 또는 질량 분광 검출에 결합된 액체 크로마토그래피
요약
프로토콜은 복잡한 lysate 기반 세포 없는 시스템에서 대사 반응을 연구하기 위한 굴절 지수 또는 질량 분광 검출에 결합된 고성능 액체 크로마토그래피 방법을 설명합니다.
초록
표적 생합성을 위한 세포 대사를 엔지니어링하려면 엔지니어가 세포의 생존 요구 사항을 중심으로 작업할 때 광범위한 설계-빌드-테스트-학습(DBTL) 주기가 필요할 수 있습니다. 또는 셀 프리 환경에서 DBTL 주기를 수행하면 이 프로세스를 가속화하고 호스트 호환성에 대한 우려를 완화할 수 있습니다. 세포 없는 신진 대사 공학(CFME)에 대한 유망한 접근법은 신진대사활성 원유 세포 추출물을 바이오 제조플랫폼으로 활용하고 수정된 단백질과 경로를 빠르게 발견하고 프로토타이핑하는 데 활용합니다. 이러한 기능을 실현하고 CFME 성능을 최적화하려면 lysate 기반 셀 프리 플랫폼의 메타볼로메를 특성화하는 방법이 필요합니다. 즉, 분석 도구는 표적 대사산물 변환의 개선을 모니터링하고 용액 대사를 조작할 때 대사산물 플럭스로의 변경을 해명하기 위해 필요합니다. 여기서, 대장균 S30 용액에서 대사산물 생산 및 플럭스를 특성화하기 위해 광학 또는 질량 분광 검출과 결합된 고성능 액체 크로마토그래피(HPLC)를 이용한 대사산물 분석이 적용되었다. 구체적으로, 본 보고서는 굴절률 검출(RID)을 사용하여 HPLC 분석을 위한 CFME 분석에서 샘플의 제조를 설명하여 저비용 기판(즉, 포도당)을 다양한 고부가가치 제품으로 변환하는 과정에서 중앙 대사 중기 및 부산물의 생성을 정량화한다. CFME 반응에서 대사 산물 변환의 분석은 특정 대사 산물 수율을 특성화하고 시작 재료로부터 대사 플럭스를 반사하는 강력한 도구인 질량 분석법(MS/MS)과 결합된 반전 상 액체 크로마토그래피를 통해 13C표지된 포도당으로 공급되는 분석도 제시된다. 전부, CFME lysate 신진 대사에 이러한 분석 방법을 적용하면 더 빠르거나 새로운 신진 대사 엔지니어링 작업을 실행하기위한 대체 플랫폼으로 이러한 시스템의 발전을 가능하게.
서문
화학 생산을 위한 엔지니어링 미생물의 한계는 경쟁세포 생존 기능이 없는 시험관내에서 생화학반응을 재구성함으로써 해결될 수있다. 더욱이, 개방반응 환경(즉, 세포막의 부재)은 조작에 더 순종하며 살아있는 세포에 비해 모니터링하기 쉽다. 세포없는 대사 공학 (CFME)의 이 기본 개념은 지금까지 미생물 세포 공장에서 제시된 것보다 더 높은 크기의 생산 메트릭으로 수소 및 단테르펜과 같은 귀중한 화학 물질을 합성하는 대사 경로의 재구성에 의해 우아하게 입증되었습니다1,2,3 . 그러나 전체 경로를 정화하는 방법은 현재 시간과 비용에 의해 제한됩니다. 대안적으로, 세포없는 대사 시스템은 전체 통로 재구성에 비해 신속하고 저렴한 방법을 통해 조세포 추출물로부터 유래 될 수있다4. 세포 추출물에 유지되는 중앙 대사는 24h5,6이상에 대한 중앙 대사 전구체를 생성하기 위해 완충 된 솔루션에서 에너지 기판 (예를 들어, 포도당 및 효소 공동 요소) 및 소금으로 보충 될 수 있습니다. 용액 계 CFME 반응에 외인성 효소를 첨가하면포도당의보다 복잡한 생체 변환을 하이 티터4,6,7에서더 가치 있는 화학물질로 변환할 수 있습니다. 수율은 세포와 같은 대사 복잡성으로 인해 이러한 시스템에서 손상되는 경향이 있지만, 더 높은 수율 변환을 위해 lysate 프로테옴을 큐레이터하는 독특한 방법은7,8개발되고있다.
용액 기반 세포 없는 시스템에서 대사 변환을 수행의 용이성 또는 생체2,9에서이러한 설계를 구축하고 테스트하기 전에 높은 처리량으로 새로운 경로를 프로토타이핑하는 이러한 우수한 플랫폼을 만든다. 응용 프로그램에 대 한, 신진 대사 변환을 모니터링 하거나 lysates에 신진 대사 플럭스에 전반적인 변화를 관찰 하는 도구는 CFME의 발전에 필수적인. 고성능 액체 크로마토그래피(HPLC)는 CFME 반응의 화학 성분을 고해상도로 분리하는 데 사용될 수 있으며 대사산물 정량화5,10에대한 광학 또는 질량 분광 검출기에 결합될 수 있다. HPLC의 기본 원리는 용매(즉, 모바일 상)에 용해되고 컬럼을 통해 펌핑된 해석물이 특정 컬럼 패킹 재료(즉, 고정상)11과상호 작용한다는 것이다. 그들의 화학 적 특성에 따라, 이러한 분석을 전시 하는 그들은 결국 고정 된 단계에서 발레 하 고 검출기에 이동 단계에 의해 수행 되기 전에 다양 한 보존 시간을 전시. 이 보고서는 RID 및 MS/MS 검출을 활용하는 HPLC 기반 방법을 통해 대장균 용액 계 CFME 반응의 준비 및 분석을 자세히 설명합니다.
굴절률 검출(HPLC-RID)에 결합된 HPLC는 중앙 대사 전구체 및 최종 제품을 신속하게 식별할 수 있는 일반적으로 접근할 수 있는 방법입니다. 간단히, RID는 어떻게 해석이 모바일12상에의해 빛의 편향을 바꾸는지 측정한다. 그런 다음 샘플의 표적 별채에 대응하는 RID 신호는 표준 솔루션의 RID 신호와 비교하여 정량화될 수 있습니다. CFME 응용 프로그램에서, 이러한 검출 모드는 크기 배제 및 리간드 교환 메커니즘, 또는 이온 중재 된 파티션 크로마토그래피5,6,8,13의조합을 기반으로 화합물을 분리하는 HPLC 열과 가장 일반적으로 사용되었습니다. 이 특정 기술은 포도당과 같은 설탕 기판의 소비뿐만 아니라 용액계 CFME 반응8에서간결, 젖산, 포르메이트, 아세테이트 및 에탄올과 같은 발효 제품의 형성을 신속하게 정량화하는 데 사용됩니다. HPLC를 통해 이러한 화합물의 농도 변화를 기록하는 것은 조세포 추출물의 잠재력을 해명하여 중앙 대사 전구체를 풀로 하고, 리자6,8,14의포도당에서 포도당에서 복잡한 대사 변환 동안 발효 경로를 통해 통로 플럭스가 어떻게 리디렉션되는지 이해하는 데 유용하다. 대장균 세포 추출물의 정액 CFME 연구는 발효 화합물이 포도당 이화작용의 최종 제품으로 축적되고 외인성효소6,15를과발현하는 용액의 원치 않는 부산물로서도 발생한다는 것을 확인한다. 발효 대사가 당화 반응8을유지하기 위해 공동인자(즉, NAD(P)H 및 ATP)의 레독스 등가물을 재생하는 데 필요한 역할을 한다는 것이 좋습니다. 따라서 발효 제품을 분리하도록 설계된 HPLC 기반 광학 검출 방법은 다양한 lysate 기반 CFME 작업을 실행할 때 유용하고 일반적으로 적용되는 도구입니다.
CFME는 탄수화물, 유기산 또는 알코올4가아닌 신진 대사 최종 제품을 축적하기 위해 구현될 수 있다. 합성되는 만큼 빠르게 소비되는 중급자의 측정도 바람직한10일수있다. HPLC-RID는 비용과 난이도면에서 액세스할 수 있지만, 이 방법은 보존 시간에 따라 대사 산물만 구별하는 능력에 의해 제한됩니다. 액체 크로마토그래피가 MS/MS 검출(LC-MS/MS)16에결합될 때 더 넓은 범위의 대사산물을 분석할 수 있다. 이 방법에 의해, 이동 상에서 의 별과는 각 분자의 질량 및 전하 특성에 따라 이온화 되고 분화된다. 대사 산물의 질량 투-충전(m/z) 비율과 열의 보존 시간을 모두 지식으로 대부분의 대사 중급자 및 고해상도16을가진 최종 제품의 분리를 용이하게 한다. 이러한 검출 기술은 또한 나노 액체 크로마토그래피와 결합될 수 있으며, 이는 유량과 시료 주입 량을 훨씬 더 낮게 제공하여 복잡한 용해배경(17)에서소분자를 보다 민감하게 검출할 수 있다. LC-MS/MS는 통합 된 레이블이 aalytes의 m / z 값18에변화를 부여하기 때문에 동위원소 라벨링과 함께 추가로 적용 할 수 있습니다. 13C6-포도당 기판으로 보충된 CFME반응에서 추출된 타임포인트 측정은 따라서 보충 된 포도당에서 특별히 파생된 최종 또는 부산물을 결정할 수 있다. 이 동위원소 추적 방법은 아직 CFME 연구에서 일반적으로 적용되지 않지만, 특히 이러한 반응에서 염반작용(즉, 아세테이트 및 글루타메이트)이 이차기판으로촉매되기 때문에 lysate 기반 CFME 시스템의 대사 전환을 이해하는 강력한 도구이다. 이 기술을 활용하면 lysates에서 포도당 대사의 포괄적 인 그림을 그릴 수 있으며, 오늘날까지완전히 이해되지는 않습니다. 여기서, 프로토콜은 나노전기분무분무소(nano ESI) MS/MS에 결합된 나노액체 크로마토그래피를 위한 방법을 상세히 설명하여 포도당 대사의 가능한 모델을 심문하는 데 사용될 수 있으며, 특히 대장균 리자츠(도1)에서. 이 모델은 풍부한 미디어5,6,8,14에서자란 균주에서 유래한 대장균 리세이트에서 활성 중인 발효 경로 및 펜토제 인산염 경로의 보고를 기반으로 한다. 이 기술은 또한 아미노산 생산을 조사하는 데 사용되며, 현재 는 용해에서 포도당에서 아미노산 의 해부학에 대한 현재 지식이 방향족 아미노산7의 합성과 같은 몇 가지 예로제한됩니다. 이러한 경로(즉, 유기산, 설탕 인산염 및 아미노산)에서 최종 제품 및 중간체의 대부분 극성 특성을 감안할 때 역단계 액체 크로마토그래피가 여기에 활용되었습니다. 이 기술은 극성 고정 단계에서 용출하여 극성 화합물을 분리합니다. 이러한 화합물은 적어도 하나의 음의 기본 충전으로 분석물의 검출을 허용하고 따라서 산성 화합물을 검출하는 데 유용 부정적인 이온 모드에서 나노 ESI에 의해 이온화되었다. 이 기술은 포도당 유래 13C 통합 대사 산물을 분석하기 위해 여기에서 사용되며 lysates에서 포도당 대사를 이해하기 위한 LC-MS/MS의 유용성을 보여줍니다.
프로토콜
1. HPLC-RID 정량화에 대한 CFME 반응의 시작, 중지 및 처리 시간 과정.
- 해동은 이전에 준비 된 대장균 리자및 얼음에 반응 성분의 나머지 부분을 준비.
참고: 여기에서 보고된 리스는 2xYPTG(1.8% 포도당) 매체에서 중간 로그 단계로 자란 대장균 BL21DE3-Star로부터 유래되었다.- 적절한 양의 필터 멸균(0.20 μm 모공 필터) S30 버퍼(빙하 아세트산으로 pH 8.2로 조정된 1M Tris-OAc, 1.4 M Mg(OAc)2및 6M KOAc)를 준비한다.
- S30 완충제에서 포도당, 글루타민염, ATP, 코엔자임 A, NAD+, 비스 트리스 완충제 및 디칼륨 인산염을 함유한 에너지 믹스를 준비한다. CFME 반응을 준비하는 데 사용되는 원하는 반응 부피의 최종 농도는 100mM 포도당, 18m 마그네슘 글루타민, 15m 암모늄 글루타메이트, 195mM 칼륨 글루타민, 1mM ATP, 0.2 mM 코엔자임 A, 1mM NAD+150mM MM+ 150mMM Bis-phos, 150mMM Bis-phos, 150mMMM Bis-phos, 150mMMBis-phos.
- 구성 요소를 1.5 mL 마이크로 센심 분리기 튜브에 결합하여 총 lysate 단백질 4.5 mg /mL로 최종 반응을 준비하십시오. 여기서 CFME 반응은 시정점당 삼중에서 50 μL의 최종 부피로 제조되었다. 각각의 기간에 대해 37°C에서 반응을 배양한다.
참고: 빨리 일하고 포도당과 글루타민염을 가진 조기 신진 대사 반응을 방지하기 위하여 반응 혼합의 최종 성분으로 lysate를 추가하십시오. 최소한의 포도당 소비는 얼음에 배양되는 반응 혼합이 얼마나 오래 에 따라 발생할 수 있습니다. - 반응을 종료하고 HPLC-RID 분석을 위한 샘플을 처리합니다.
- 적절한 시간 지점에서 삼중 반응을 종료하려면 각 시료의 최종 반응 부피(즉, 50 μL의 50 μL에 50 μL)에 동일한 부피를 50 μL에 50μL을 추가합니다. 각 샘플을 반응 부피(예: 100 μL)에서 멸균물로 희석합니다.
- 시간 0을 다시 수주하려면, 반응 성분의 나머지 부분을 추가하기 전에 총 최종 반응 부피(즉, 50 μL)와 동일한 부피를 5% 트리클로로아세트산과 혼합한다. 이 산성화 단계는 포도당을 현저하게 대사하기 전에 효소를 침전시합니다.
- 5 분 동안 11,600 x g에서 벤치 탑 미세 원심 분리기의 샘플과 원심분리기를 소용돌이시키고 유기 마취제를 포함하는 초너질을 세척 튜브로 옮긴다. HPLC 분석이 다른 날에 수행될 경우 샘플을 -20°C로 저장합니다. 다음 단계로 진행하기 전에 얼음에 저장된 샘플을 해동하십시오.
- 0.22 μm 모공 필터로 각 상체를 필터링합니다. 주사기의 대안으로 원심분리기 튜브 필터를 사용하고 1분 동안 16,300 x g의 주체원분리기를 사용합니다.
- 각 여과물을 깨끗한 HPLC 유리 유리 바이알로 옮기습니다. HPLC 자동 샘플러 트레이에 바이알을 로드합니다.
- 표준 곡선 생성을 위해 샘플을 준비합니다.
- CFME 반응에서 포도당의 시작 농도보다 높은 평수량으로 S30 완충액에 용해된 모든 표적 멸문의 스톡 용액을 준비한다. 여기서, 150 μM 포도당, 간결, 젖산, 포르메이트, 아세테이트 및 에탄올로 구성된 스톡 용액이 제조되었다. 스톡 용액에서 1:1(v/v) 직렬 희석을 수행하여 0 μM에서 주식 농도(즉, 150 μM)에 이르는 최종 농도를 가진 triplicate 50 μL 솔루션을 얻습니다.
- 각 용액을 50 μL의 5% 트리클로로아세산과 100 μL의 멸균물로 희석합니다. 반복 단계 1.3.4-1.3.5.
참고: 각 샘플 배치를 사용하여 표준 곡선 생성을 위한 솔루션을 실행하여 대사산물 농도의 정확한 정량화를 보장합니다.
2. 대사 산물 검출을 위한 HPLC 시스템 준비.
- 연기 후드 아래에서 탈이온화 및 필터 멸균 수에서 멸균 된 5m 황산 용액을 준비하십시오. 98% HPLC 급 황산 용액의 ~550 μL을 2L의 물에 추가하여 5mM 황산을 준비합니다.
주의: 황산은 유해 화학 물질이며, 적절한 실험실 PPE가 있는 연기 후드 아래에서 작업하면 흡입, 피부 접촉 및 눈 접촉을 방지합니다. 농축 황산은 물과 격렬하게 반응하며, 다른 방법이 아닌 물에 직접 첨가해야 합니다. 직사광선에서 멀리 떨어진 시원하고 건조한 지역에 보관하고 실험실에서 정한 적절한 폐기물 처리 조치를 따르십시오. - HPLC 기기 옆에 있는 수조에 5mM 의 황산 2L 병을 보관하십시오. 수조를 35°C로 설정합니다. 용매 병에 용매 필터가 있는 튜브를 놓고 펌프 모듈에 맞춰 다른 쪽 끝을 드가세르 모듈에 부착합니다.
참고: 열을 설치하기 전에 새로 준비된 용매로 시스템을 제거하는 것은 기기 취급에 좋은 계기처리 방법입니다. - HPLC 계측기를 RID 모듈에 맞춰 HPLC 열로 장착합니다. 기둥 온도 조절기를 사용할 수없는 경우 35 °C 수조에 열을 배치합니다.
- 시스템 컴퓨터에 설치된 크로마토그래피 데이터 시스템(CDS) 소프트웨어에서 35°C에서 분석을 위해 RID 모듈을 준비합니다.
- 보기 메뉴에서 메서드를 선택하고 컨트롤 뷰를 실행합니다. 펌프 모듈 > 메서드를 마우스 오른쪽 버튼으로 클릭합니다. 유량을 0.55mL/min-1로 설정하고 On 버튼을 선택하여 펌프를 시작합니다.
참고: HPLC에 장착되기 전에 열이 저장 중인 경우 제조업체의 지침에 따라 열을 상량화한 후 유속을 0.55mL/min-1로 증가시면 됩니다. - RID 모듈 > 방법에 해당하는 패널을 마우스 오른쪽 버튼으로 클릭합니다. RI 검출기 모듈의 온도를 35°C로 설정하고 RI 검출기 모듈의 워밍업을 시작하려면 On을 선택합니다.
- 패널 RID 모듈 > 컨트롤을 마우스 오른쪽 버튼으로 클릭합니다. 이 설정 전에 다른 용매가 RI 검출기를 통해 흐르는 경우 신선한 용매를 사용할 때 퍼지 참조 셀의 경우 최소 15분 또는 1h 이상 을 선택합니다. 켜기 버튼을 클릭합니다.
참고: 펌프와 RI 검출기를 켜서 온라인 플롯에서 안정적인 기준선을 달성합니다. 이것은 실험실에 있는 온도 변동에 의해 영향을 받고 4 시간 이상 걸릴 수 있습니다. 샘플을 로드하기 전에 시스템을 밤새 켜십시오.
- 보기 메뉴에서 메서드를 선택하고 컨트롤 뷰를 실행합니다. 펌프 모듈 > 메서드를 마우스 오른쪽 버튼으로 클릭합니다. 유량을 0.55mL/min-1로 설정하고 On 버튼을 선택하여 펌프를 시작합니다.
3. CDS에서 유기 발효 제품의 동위 권면 HPLC 분리를위한 방법을 만듭니다.
- 메뉴 표시줄에서 메서드 > 새 메서드를 선택합니다. [MethodName].M 메서드를 저장하기 > 메서드 > > 를 선택합니다.
- 바이너리 펌프 탭 내에서 흐름을 0.55mL/min-1로 설정합니다. 용매하에서펌프 모듈의 용매 입력에 해당하는 문자를 선택하고 동위 용출을 위해 100 %로 설정합니다. 압력 제한을 0 및 400 막대로 설정하고 30분 동안 중지 시간으로 입력합니다.
- 샘플러 탭 내에서 사출 볼륨을 50 μL로 설정합니다. 도취 속도, 배출 속도 및그리기 위치를 200 μL/min-1,200 μL·min-1 및 -0.5mm로 설정합니다.
- RID 탭 내에서 광학 단위 온도를 35°C로 설정합니다. 신호에서신호 에 대한 획득을 선택하고 피크 폭에대한 >0.2 분. 중지 시간에대해 펌프/인젝터 옵션을 선택합니다.
- RID 탭 내에서 고급으로 아날로그 출력을 5% 제로 오프셋과 감쇠용 500,000 nRIU로 설정합니다. 분석 전에 신호 극성에 대한 양수 옵션과 자동 0에 대한 온 옵션을 선택합니다.
- 메서드 > 저장 메서드를 선택 하 여 메서드를 저장 합니다. 메서드 > 로드 메서드 [MethodName]> 선택하 여 메서드를 로드합니다. M.
4. 데이터 수집을 위한 HPLC-RID 시스템을 자동 샘플링하고 시작하기 위한 시퀀스 테이블 만들기.
- 메뉴 표시줄에서 새 시퀀스 템플릿을 > 시퀀스를 선택합니다. 시퀀스 > [sequenceTemplateName]로 시퀀스 템플릿을 저장합니다. S.
- 시퀀스 > 시퀀스 테이블을 선택합니다. 자동 샘플러 트레이에 대한 배열에 따라 'n' 바이알에 해당하는 'n' 행을 부은 다음 바이알 및 샘플 이름 아래에 각각 바이알 위치 및 샘플 이름을입력합니다. 메서드 이름 드롭다운 메뉴에서 3단계에서 생성된 메서드를 선택하고 각 행에 대해 Inj/Vial(바이알당 주입)으로 50 μL을 입력합니다.
- 시퀀스 템플릿 > 시퀀스 템플릿저장템플릿을 선택하여 시퀀스 템플릿을 적용하고 저장하고 저장합니다. 시퀀스 템플릿이 [sequenceTemplateName]> > 로드 시퀀스 템플릿을 선택하여 로드되었는지 확인합니다. S.
- 온라인 플롯에서 안정적인 기준선을 달성한 후, 패널 RID 모듈 > 제어 > 리디드 검출기를 통해 용매 흐름을 낭비하도록 유도합니다. 데이터 수집을 시작하려면 메뉴 표시줄에서 시퀀스를 선택하고 시퀀스 > 실행합니다.
5. 사후 데이터 추출 및 분석.
- 보기 메뉴에서 데이터 분석 보기를 선택합니다. 화면 왼쪽에 있는 파일 목록에서 시퀀스 파일 이름을 찾습니다. 화면의 중앙 패널에서 신호 보기 선택 > RID 신호로 이동하여 샘플 크로마토그램을 봅니다.
- 화면의 상단 패널에서 고농도 표준 샘플에 해당하는 행을 선택합니다. 표시된 크로마토그램의 대상 단량값의 보존 시간을 기록합니다. 표적 문체에 대응하는 피크는 포도당, 간결한, 젖산, 포르메이트, 아세테이트 및 에탄올(보충도 1)으로보존 시간 축을 따라 배치된다.
참고: 크로마토그램의 첫 번째 큰 피크는 트리클로로아세트산에 해당합니다. RI 단위는 모든 표준 곡선 샘플에서 일관성을 유지해야 합니다. 각 화합물을 별도의 샘플로 실행하여 각 대상 별분의 보존 시간을 검증합니다. - 표준 및 반응 샘플의 크로마토그램에서 각 표적 별별에 대한 피크 영역을 추출합니다.
- 관심 있는 피크가 소프트웨어에 의해 잘 통합되어 있는지 분별하십시오. 각 피크의 베이스로 빨간색 선을 그려 곡선 아래에 정확하게 통합된 영역을 얻습니다. 자동 통합이 실패하면(예: 빨간색 선이 비뚤어진 경우), 통합 도구 세트에서 수동 통합 단추를 선택하고 피크 베이스를 수동으로 그려 피크 영역을 통합합니다.
참고: 한 샘플의 대상 아닐바이트에 대해 수동 통합을 수행해야 하는 경우 일관되게 유지하고 모든 샘플에서 동일한 아닐바이트를 수동으로 통합합니다. - 제대로 통합된 피크를 클릭하여 공통 도구 집합에서 커서 도구를 선택합니다. 선택한 피크의 피크 영역과 해당 보존 시간은 화면 하단 패널의 테이블 행으로 강조 표시됩니다.
- 피크 영역을 내보내려면 파일 > 내보내기 > 통합 결과를 선택합니다.
- 관심 있는 피크가 소프트웨어에 의해 잘 통합되어 있는지 분별하십시오. 각 피크의 베이스로 빨간색 선을 그려 곡선 아래에 정확하게 통합된 영역을 얻습니다. 자동 통합이 실패하면(예: 빨간색 선이 비뚤어진 경우), 통합 도구 세트에서 수동 통합 단추를 선택하고 피크 베이스를 수동으로 그려 피크 영역을 통합합니다.
- 표준 곡선을 사용하여 대상 단량 체농도를 정량화합니다.
- 스프레드시트에서 피크 영역 값과 알려진 샘플 농도를 플롯합니다. 플롯된 데이터를 마우스 오른쪽 버튼으로 클릭하고, 차트에 표시 방정식을 > 추세선 > 형식 추세선을 추가합니다.
- 별도의 스프레드시트에서 표준 곡선 추세선의 방정식을 사용하여 각 샘플의 모든 별분별에 대해 피크 영역 값을 농도로 변환합니다. 데이터 시각화를 위한 트리클리세이트 에서 평균 피크 영역과 표준 오류 값을 계산합니다.
6. LC-MS/MS 정량화에 대한 CFME 반응을 추적하는 동위원소 동위원소 의 시작, 중지 및 처리 시간 과정.
- 1.1-1.2에 설명된 대로 얼음에 시간 포인트당(시간 0 제외)을 설정합니다. 그러나, 포도당 대신, 반응에 100 mMM 13C6-포도당의최종 농도를 사용한다. 1시간, 2시간, 3시간 동안 37°C에서 반응을 배양한다.
- 종료하려면 액체 질소에 반응을 동결하고 -80 °C에 저장합니다. 당일 분석을 위해 이 저장소 단계를 건너뜁니다.
참고: 트리클로로아세트산은 LC-MS/MS를 통해 일부 중앙 탄소 대사산물을 검출할 때 산으로부터의 간섭으로 인한 반응을 중지하는 데 사용되지 않았다. 대신, 포름산(step 6.3)을 함유한 추출 용매는 포름산질량이 보고된 MS/MS 방법의 검출 한계 이하이기 때문에 대사 단백질을 침전시키는 데 사용되었다. - 추출 용매의 50mL를 준비합니다. 아세토닐릴 20mL, 메탄올 20mL, 물 10mL(모든 LC-MS 등급)를 50mL 원심분리기 튜브에 결합하여 0.199mL의 포름산용액을 만들어 냅니다. 추출 시 용매를 4°C로 냉각시키고 사용하지 않을 때는 용매를 -20°C로 저장합니다.
- LC-MS/MS 분석을 위한 샘플 처리
- 분석 당일, 파이펫은 각 시료에 대한 추출 용매(즉, 50 μL)의 동등한 부피이다. 시료가 동결된 경우, 포도당 대사의 재활성화를 방지하기 위해 샘플이 완전히 해동하기 전에 추출 용매를 추가합니다. 얼음의 모든 샘플 처리 단계를 수행합니다.
- 시간 제로를 재구성하기 위해, 파이펫 추출 용매의 최종 부피 (즉, 50 μL)는 반응에서 원하는 최종 농도에 대한 적절한 양의 용액 (즉, 50 μL 반응 볼륨에서 4.5 mg /mL)에 대한 적절한 양의 용액에 피펫합니다. 나머지 반응 구성 요소를 1.2 단계에서와 같이 추가합니다. 이 산성화 단계는 포도당을 현저하게 대사하기 전에 효소를 침전시합니다.
- 부드러운 흔들림으로 30분 동안 얼음에 추출 용매로 샘플을 배양한 다음, 샘플을 4°C에서 15분 동안 21,000 x g에서 원심분리하여 침전된 단백질과 분리합니다. 상체의 50 μL을 자동 샘플러 바이알로 옮기고 바이알을 4°C 자동 샘플러 내의 트레이에 로드합니다. 향후 분석을 위해 나머지 상체를 -20°C에 저장합니다.
7. LC-MS/MS 분석을 위한 LC 시스템 설정.
- 950mL의 물과 50mL의 아세테이트 77.08 mg을 완전히 용해하여 용매 A 1L을 준비하십시오. 아세토닐릴 650mL, 물 300mL, 이소프로판놀 50mL, 77.08 mg의 암모늄 아세테이트로 용매 B 1L을 준비합니다. 모든 용매가 LC-MS 등급인지 확인합니다.
- 용매 A와 B가 포함된 용매 병을 펌프 모듈에 연결합니다. 용매의 장비 중에 발생할 수 있는 공기 오염을 LC 시스템으로 제거/제한하기 위해 높은 유량으로 시스템을 제거/제한합니다.
- C18 반전 단계컬럼(30cm 열 길이, 75 μm 내경, 5 μm 입자 직경)을 시스템에 장착합니다. 100% 용매 B를 흐르고 천천히 솔벤트 A를 100%로 흘려 LC-MS 시스템에 컬럼을 조건부한다.
참고: 칼럼 팁은 마이크로피펫 풀러를 사용하여 사내에서 준비되었으며 압력 세포와 헬륨으로 포장되었습니다.
8. 푸리에 변환 및 이온 트랩 질량 분광계에 연결된 LC 시스템에 대한 LC-MS/MS 데이터 수집 및 해석 소프트웨어에 대한 방법을 만듭니다.
- Tune Plus 소프트웨어를 열어 MS 메서드에 대한 조정 파일을 편집합니다.
- 메뉴 모음의 파일에서 미리 설치된 음수 모드 조정 파일을 엽니다.
- 메뉴 표시줄에서 스캔 모드를 선택한 다음 스캔 창 정의를 선택합니다. 이온 트랩과 FT 모두에 대해 MSn의 현미경 시간 설정을 1로 설정합니다.
- 나노 ESI 소스에 대한 설정으로 이동하고 4 kV에 스프레이 전압을 설정합니다. 허용 가능한 전기 스프레이가 생성될 때까지 이를 조절합니다. 전형적으로, 허용 가능한 전기 스프레이는 2-5 kV의 범위 내에서 달성될 수 있다.
- 조정 파일을 저장합니다.
- 계측기의 데이터 수집 및 해석 소프트웨어의 설치 마법사를 사용하여 새로운 LC 방법을 생성합니다. 열려 있는 로드맵 > 시퀀스 설정 > 마법사. 이러한 메서드는 열 히터의 사용을 필요로 하지 않으므로 임시 제어 단계를 건너뜁니다.
- 흐름 그라데이션 펌프 옵션에서 다중 스텝을선택합니다. 다음 창에서 7줄을 삽입하고 각 행의 유량속도를 0.1mL·min-1로 설정합니다. 각 행에 대한 다음 매개 변수입력: 0-3분부터 100% 용매 A를 전달합니다. 3-9분에서, 100% 용매 A에서 20% 용매 B까지 그라데이션을 도입; 9-19 분에서, 20% 용매 B에서 100% 용매 B로 새로운 그라데이션을 도입; 19-27 분에서, 100 % 용매 B에서 유지; 27-28분에서 그라데이션을 100% 용매 A로 다시 설정합니다. 28-44분부터 100% 용매 A.에서 보유하여 후속 실행에 대한 컬럼의 헹구기 및 재조건은 LC가 사용되지 않을 때 용매를 보존하기 위해 실행이 완료되면 0.03mL/min-1로 유량을 낮추는 최종 단계를 포함한다.
- 샘플러 옵션에 대한 기본 설정을 적용하여 펌프 압력을 획득 옵션으로 > 기본 획득 시간을 사용하고 기본 펌프 압력 옵션을 사용합니다.
- 악기 설정 창의 사이드바에서 Orbitrap Velos Pro MS 아이콘을 선택하여 MS/MS 메서드를 만듭니다.
- 데이터 종속 MS/MS를 > 새 메서드를 클릭합니다. LC 실행 길이(예: 44분)까지 획득 시간을 설정하고, 세그먼트를 1로 설정하고 이벤트를 11로 스캔합니다. 파일 조정의 경우 8.1 단계에서 편집된 파일을 선택합니다.
참고: 첫 번째 이벤트는 포리에 변환 MS(FTMS)를 사용하여 MS1 전구체 스캔입니다. 다음 10개의 이벤트는 MS2 조각화를 위한 각 전구체 스캔에서 가장 강렬하고 고유한 이온 10개를 선택하는 MS2 스캔이 됩니다. - 이벤트 1의 경우 스캔 설명에서 분석기를 FTMS로 설정하고 극성에서 음수로 설정합니다. MSn 설정에서 30,000의 해상도와 35 V. 세트 스캔 범위의 정규화 된 충돌 에너지를 첫 번째 질량은 50m/ z, 마지막 질량은 1800 m/z로 사용하여 작은 분자를 캡처합니다.
- 이벤트 2에서 11까지의 경우 스캔 설명에서 분석기를 이온 트랩으로 설정합니다. 종속 검사를 선택하고 전역 > 동적 제외를 > 설정을 클릭하고 사용 설정을 선택합니다. 30회 반복 지속시간과 120s 제외 기간을 설정하여 근접에서 반복 스캔을 제거합니다.
- 이벤트 설정을 스캔하고 모든 MS2 이벤트(2~11)에 대해 검색 이벤트에서 1로 결정된 질량을 설정합니다. 상위 10 개의 가장 강렬한 이온을 스캔하려면 각 MS2 스캔 이벤트를 설정하여 1st에서 10th까지 n th 가장 강렬한 이온을감지하십시오. 따라서 이벤트 2를 설정하여1을 nth 가장 강렬한 이온, 이벤트 3로 감지하여 2 등을 감지합니다.
- 설정 창을 닫고 [Method_Name].meth로 저장 > 파일로 이동합니다.
참고: LC 계측기 및 질량 분광계의 일반적인 사용, 유지 보수 및 교정은 제조업체에서 제공하는 작동 지침 및 매뉴얼을 참조하십시오.
- 데이터 종속 MS/MS를 > 새 메서드를 클릭합니다. LC 실행 길이(예: 44분)까지 획득 시간을 설정하고, 세그먼트를 1로 설정하고 이벤트를 11로 스캔합니다. 파일 조정의 경우 8.1 단계에서 편집된 파일을 선택합니다.
9. 실행 시퀀스를 설정하고 LC-MS/MS 실행을 시작합니다.
- LC-MS/MS 시스템의 데이터 수집 및 해석 소프트웨어를 사용하여 실행 시퀀스를 설정합니다. Roadmap > 시퀀스 설정내에서 테이블을 마우스 오른쪽 으로 클릭하여 샘플만큼 많은 행을 삽입합니다. 각 행에 대해 Inj Vol을 5 μL로 설정하고 위치를 자동 샘플러 트레이의 각 위치로 설정합니다. 파일 이름을 샘플 이름으로 입력하고 실행 결과에 원하는 파일 경로를 설정합니다.
참고: 솔벤트 A를 포함하는 빈 바이알은 시퀀스의 시작과 각 트리플리케이트 샘플 세트(각 시간 점 집합) 사이에서 실행하여 열을 헹구수 있습니다. - 실행을 시작하려면 시퀀스의 모든 파일 이름을 강조 표시합니다. 메뉴 표시줄에서 실행 시퀀스를 > 확인을 >.
10. MZmine 2.53에 대한 임시 주석을 통합하고 검색합니다.
- MZmine을 열고 9.1 단계에서 '.raw' 출력 파일을 가져옵니다. 메뉴 표시줄에서 원시 데이터 가져오기> 원시 데이터 메서드를 선택합니다. 샘플에 해당하는 파일을 선택합니다.
- MS1과 MS2 스캔을 구별하는 피크 목록을 구성합니다. 메뉴 표시줄에서 원시 데이터 메서드는 기능 감지 > MS/MS 피크리스트 빌더를 >. 관련 설정에는 0.01로 설정된 m/z 창과 실행 길이로 설정된 시간 창이 포함됩니다. 설정 필터에서 음수를 극성으로 선택하고 스펙트럼 유형으로 센트로이드를 선택합니다.
- 메뉴 표시줄에서 기능 목록 메서드> 기능 감지 > 피크 익스텐더로 이동합니다. m/z 허용 오차를 0.005m/z 또는 10 ppm 및 최소 높이를 1E3로 설정합니다. 이 단계는 완전히 살이 된 봉우리를 만듭니다.
- 중복 된 피크를 제거합니다. > 필터링을 > 기능 목록 메서드로 돌아가서 중복 피크 필터 >를 필터링합니다. 관련 설정에는 0.005 m/z 또는 10 ppm으로 설정된 m/z 공차 및 RT 공차가 5분으로 설정됩니다.
- 유사한 데이터 파일(예: 트리플리케이트 반응)에서 피크를 정렬하려면 유지 시간 보정> 정규화 > 기능 목록 메서드로돌아갑니다. 삼중 샘플을 함께 처리하고 공백을 남겨두어야 합니다. 관련 설정으로는 0.005m/z 또는 10 ppm으로 설정된 m/z 공차, RT 공차 3분(분)으로 설정된 RT 공차, 최소 표준 강도가 1E3로 설정된 경우가 포함됩니다.
- 모든 파일의 피크를 m/z로 정렬하고 선형 > 선형 을 > 기능 목록 메서드에서 보존 시간을 > RANSAC 선형기입니다. m/z 허용 오차를 0.005 m/z 또는 10 ppm으로 설정하고, 수정 후 RT 공차 및 RT 공차는 각각 44분과 39분으로, RANSAC 반복은 0으로, 최소 포인트 수는 10%, 임계값값을 1로 설정합니다. 동일한 충전 상태가 필요한옵션을 선택합니다.
- 피처 목록 메서드의 이전 단계에서 손실되었을 수 있는 데이터 포인트에 대해 수정> 갭 채우기 > 피크 파인더. 관련 설정으로는 강도 허용 오차가 50%, m/z 허용 오차가 0.005m/z 또는 10 ppm으로 설정되고 RT 공차는 3분으로 설정됩니다. RT 수정을 활성화합니다.
11. 13C 라벨 포도당 유래 대사 산물의 음수 모드 질량을 계산하고 필터링 된 데이터에서 이러한 분석물의 m /z 특징을 검색합니다.
- 표적 수색을 위해 포도당 대사에서 13C 표지 대사 산물의 질량을 계산합니다.
- 화합물의 분자 포뮬러 및 각요소(20)의단화질량에서 각 표적 화합물의 단열질량을 계산한다.
- 단리소피토픽 질량으로부터 1 양성자(1.007276 Da)의 질량을 빼서 화합물의 음성 모드 질량[M-H]을 계산한다. 이것은 분자가 이온화 도중 수소 이온의 박탈된 후에 음성 모드 MS 검출에 의해 검출된 질량입니다.
- 음의 모드 질량에서, 13C 통합 대사 산물의 질량을 계산합니다. 여기서, 포도당 유래 13C라벨을 최대로 통합하는 동위 원소 폴로지의 질량이 계산되었다.
- 13 C 라벨 대사 산물의 계산 된 질량을 사용하여 MZmine 결과에서 m / z 기능을 검색하고 송신하십시오. 가능한 각 적중에 대해 다음 방정식을 사용하여 질량 오류(ppm)를 계산합니다.
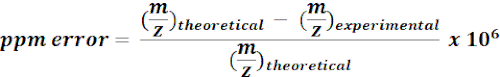
참고: <15 ppm 질량 오차가 있는 실험m/z 값은 현재 분석에서 푸티니티 주석으로 간주되었다. - 품질 브라우저에서 푸티에주석의 스펙트럼을 수동으로 확인하여 주석을 확인합니다.
- 오픈 로드맵 > 퀄리티 브라우저. 도구 모음에서 원시 파일을 열어 각 샘플의 원시 MS 데이터를 가져옵니다.
- 질량 스펙트럼(하단 패널)을 보려면 총 이온 크로마토그램(상단 패널)에 원하는 보존 시간 범위(즉, 푸티제 음표에 해당)에서 선을 그립니다. 스펙트럼을 마우스 오른쪽 단추로 클릭하고 대상 분석물의 m/z를 포괄하는 다양한 질량을 입력합니다. 푸티먼트 주석에 노이즈(보충도 2)보다높은 뚜렷한 피크 신호가 있는지 확인합니다.
- 각 시간 지점에 대한 생물학적 복제에 걸쳐 평균 피크 영역과 양성 주석의 표준 오류를 계산합니다. 포도당 대사의 추세를 관찰하기 위해 데이터(즉, 바 그래프)를 시각화합니다.
결과
포도당으로부터 의 일반적인 발효 제품의 용액 계 세포 무첨가 합성을 정량화하기 위해, 2xYPTG 미디어에서 자란 균주에서 유래한 용액은 1차 탄소원으로 100 μM 포도당을 공급하였다8. 단백질 산성화에 의해 24시간 동안 반응이 멈췄다. 피루바테, 간결, 젖산, 포르메이트, 아세테이트, 에탄올을 함유한 여과된 슈퍼나탕은 RID 모듈이 장착된 HPLC 시스템의 오토샘플러 모듈에 적재되었다. 발효 최종 제품 및 포도당의 여과 혼합물을 1.17 μM, 2.34 μM, 4.69 μM, 9.38 μM, 18.75 μM, 37.50 μM, 75 μM 및 S30 완충제의 150 μM 농도가 계측 기준으로 계측기로 적재했다. Aalytes는 HPLC 열에서 RID로 이약적으로 출화되었습니다. 1 에서 150 μM 범위 내에서 포도당, 간결, 젖산, 포르메이트, 아세테이트 및 에탄올의 피크는 RID에 의해 해결될 수 있었다. 포도당피크 영역은 시간 과정 및 표준 곡선 샘플에 대한 RID 데이터로부터의 수동 통합에 의해 도출되었다. 간결한, 젖산, 포르메이트, 아세테이트 및 에탄올을 위한 추출된 피크 영역은 자동으로 통합된 신호에서 채취되었다. 모든 표준 곡선(피크 영역 대 알려진 농도)은R2 값이 >0.99이며 여기에 사용되는 농도 범위에 걸쳐 선형이었다.
모든 표적 점액에 대한 몰 농도는 각각의 표준 곡선에서 계산되었다. 포도당은 반응의 첫 3 시간 내에서 소비되었고 주로 젖산(도 2A,B)으로발효되었다. 에탄올 축적또한 반응의 첫 3시간 내에서 크게 발생했으며 그 이후에 중단하였다(도2C). 3시간 후 상당한 포도당 소비를 가진 상당한 젖산 및 에탄올 생산의 관찰은 유산과 에탄올 생산 경로가 글리코리시스를 통해 지속적인 포도당 소비에 필요한 글리코리스틱 NADH로부터 1개의 그물 몰 NAD+의 재생을 허용하기 때문에 전례가 없는 것이아니었다(그림 1). 따라서 젖산 및 에탄올은 lysate 기반 세포 없는 포도당 대사의 주요 발효 최종 제품으로 간주될 수 있다. 아세테이트는 처음에 S30 완충제의 성분으로서 반응에 존재했으며, 포도당 소비가 느려졌을 때 6h 후에 신진대사로 인해 예기치 않게 축적되었다(도2D). 이 결과는 아세테이트 발효가 반드시 초기 시간 점에 있는 급속한 당계 플럭스를 가능하게 하지 않는다는 것을 건의합니다. 한편, 포르마트와 간결한 것은 사소한 발효제품(그림 2E,F)으로합성되었다. 전부, 이 방법은 대장균 S30 리자테에서 당기질 고갈 및 발효 제품 형성의 절대적인 정량화를 가능하게 하였다.
MS 검출은 프로필 리자트 포도당 대사에 구체적으로 적용되었다. 2xYPTG 미디어에서 자란 균주에서 유래한 용액은 탄소원으로 13C6-포도당을공급받았다. CFME 반응은 0시간, 1시간, 2시간, 3시간 동안 트리플리케이트로 실행되었다. 각 시점의 샘플은 역상 컬럼을 장착한 LC 시스템에 로드되었고 푸리에 변환 및 이온 트랩 질량 분광기에 결합되었습니다. 음의 이온 모드 스펙트럼은 유기산, 설탕 인산염 및 아미노산을 분석하기 위해 얻어서 가공하였다. 중앙 탄소 대사에 속하는 13개의 C 라벨 종의 계산 된 이론질량은 특히 포도당 유래 화합물을 식별하기 위해 검색되었다. E. coli CFME에서 활성 경로의 활용 된 소스 균주 재배 조건 및 이전 보고서에 기초하여, 리자테 프로테오메는 글리코리성 발효로 포도당을 공급하는 대사 네트워크를 포함하는 것으로 가정된다, 펜토제 인산염 경로, 아마도 아미노산 anabolism 5,6,7,8,14 (그림 1) . 따라서, 이러한 경로의 구성원으로 검색이 좁혀졌으며, 그 중 포도당 유래 13C 라벨을 통합한 16개의 대사산물은 명백하게 인장되었다(보충표1).
13 C6-포도당은글리코리시즘을 통해 관찰가능한 소비되었으며, 글리코리스틱 중간 풍요량의 변동에 의해 입증된 바와 같이(도3A-E). HPLC-RID 데이터와 일치하여, 포도당은 13C3-젖산으로 축적되고 또한 반응의 첫 3 시간 내에서 13C3-간결하게발효되었다(도4A,B). 13C 3-succinate 이소톨로그 형성은 리자이트 포도당대사(도 1)의제안된 모델을 지원하며, 여기서 간결한 것은 3탄소 인지질(PEP) 분자의 카복틸화에 의해 생성될 가능성이 높으며 TCA 사이클에 대한 2탄소 아세틸-CoA 분자의 진입로부터 가아니라. TCA 주기의 활성화는 이전 CFME 연구에서 가정되었지만, TCA의 다른 13C 라벨 중간체는 여기에서검출되지않았다8,19,21. 13 C3-아스파르타트 합성은 그러나 첫 번째 h 내에서 발생하였고, 펩이 직접 옥살로아테이트(도1, 도 6C)로변환된다는 생각을 강화하여 소비되었다. 데이터는 포도당이 풍부한 매체 (2xYPTG)에 발효 성장 도중 수확한 근원 긴장에서 lysate proteome의 반사입니다. 이것은 더 산화 TCA 분기(그림 1)를형성 간결한 생산 양식에 참여하지 않는 TCA 효소의 나머지 부분을 의미할 것이다. 그러나 이 경로의 대사 산물은 염반소로서 CFME 반응에 첨가된 고농도글루타민이 이 분기의 진행을 막기 때문에 검출되지 않았다.
HPLC-RID 데이터는 3h 의 반응 기간 내에 13C 2-아세테이트 검출의 부족에 의해 추가적으로 보완되어 최대 3h(도2B)까지포도당에서 아세테이트의 축적을 시사합니다. 그러나, 아세틸-인산염(아세틸-P)의 직접적인 전구체는 아세틸-코아로부터 아세테이트 합성을 위한 Pta-AckA 통로의 Pta 암이 활성화되어 있음을시사한다(도 4C,D). AckA 촉매 탈포일화 13C 2-아세틸-P ~ 13C2-아세테이트는반응에 사용되는 S30 버퍼의 주요 성분인 아세테이트로 인해 이 기간 내에 발생하지 않을 가능성이 있다(도1, 도 2B).
13C6-포도당유래 탄을 당인산염 6-인산코놀락톤(6PGL), 6-인포글루코네이트(6PG), 리불로오스-5-인산염(Ru5P), 및 세도헤플루로오스-7-인산염(S7P)에 통합하였다( 그림5). 이러한 결과는 용해 포도당 대사에 있는 펜토제 인산염 통로의 참여를 확인하고 프로테오믹 연구에 의해 이전에 제안된 13C 9-티로신 합성을 공급하고, 또한 13C5-히스티딘생산에 대한 선구자를 제공하면서(도 6A,B)7. 표기 엘라닌과 트립토판은 여기에서 관찰되지 않았으며, 필수 아미노산의 대부분은 아니었다. 그러나 아미노산 anabolism은 영양 에 굶주린 조건 또는 고정 된 단계7,22에서자란 세포에서 파생 된 용재에서 농축 될 가능성이 있기 때문에 이것은 완전히 놀라운 일이 아니다. 더욱이, 지금까지의 데이터는 글리코분해와 발효의 중간체가 최종 반응을 재생하는 공동 인자 재생쪽으로 유입된다는 것을 시사합니다. 글리세랄데히드-3-인산염, 피루바테 및 아세틸-코아(즉, 글리신, 시스테인, 세린, 알라닌, 발린, 류신 및 라이신)에서 유래한 많은 아미노산의 합성을 배제해야 한다(도 1). 언급했듯이, 13C3-아스파르타테는 첫 번째 시간 내에 생산되었지만, 아스파르타테 는 13C통합 아미노산(즉, 스루닌, 이솔루신, 메티오닌 및 아스파라진)은 포도당 유래 아스파르타테가 발효에 참여하기 때문에 관찰되지 않았을 가능성이 있다(그림1, 그림 6C). 마지막으로, 글루타민산염에서 유래한 글루타민산과 아미노산을 향한 플루스는 반응 환경에서 높은 수준의 글루타민에 의해 방해되었을 수있다(도 1).
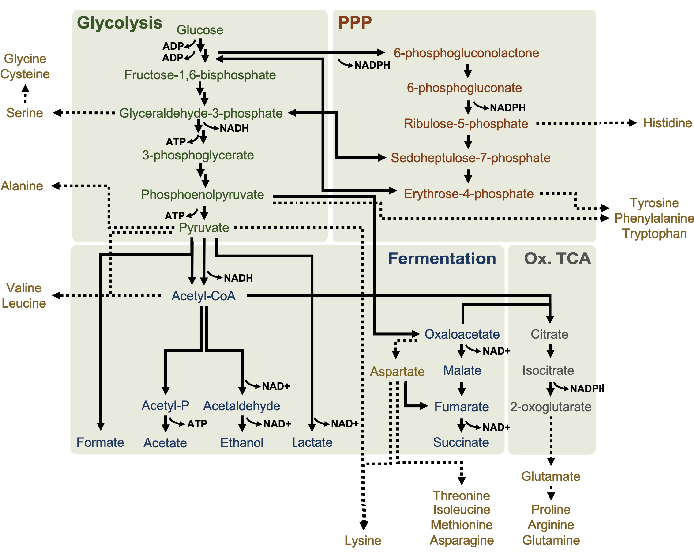
도 1: 대장균 BL21DE3-Star로부터 유래한 용액의 퍼티디드 대사 모델은 높은 포도당 농도에서 기하급수적으로 증가한다. 글리코리시스(녹색), 펜토제 인산염 통로(다크 오렌지), 아세틸-코아의 발효 경로(blue)의 중간 및 최종 제품은 용해계 CFME에서 보고되었다. 간결한 발효의 존재는 산화 TCA 분기 (회색)의 활성화를 의미한다. 아미노산 anabolism (금) lysates에서 잘 정의 되지 않은 하 고 여기에서 조사. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
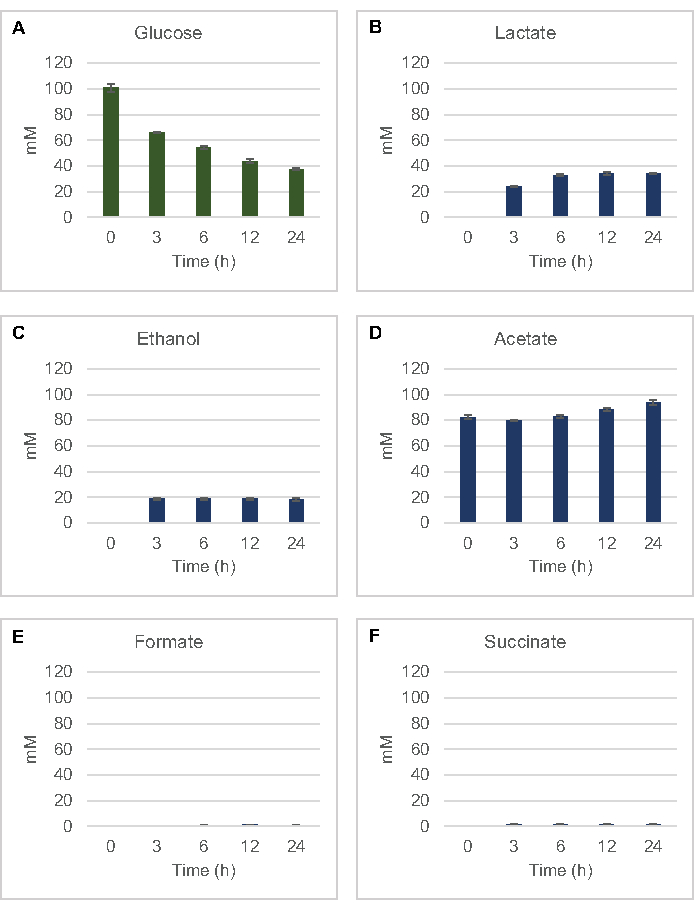
그림 2: 대장균 조취추출물로 제조된 CFME 반응에서 포도당 소비 및 발효 최종 생성물 합성을 위한 HPLC-RID 데이터는 (A) 포도당 소비 및(B)젖산,(C)에탄올,(D)아세테이트,(E)포메이트,(F)CFME 반응에서 의자생산을 모니터링하였다. 표준 곡선으로 정량화된 평균 mM 농도 및 오류 막대(SE)가 표시됩니다(n = 3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
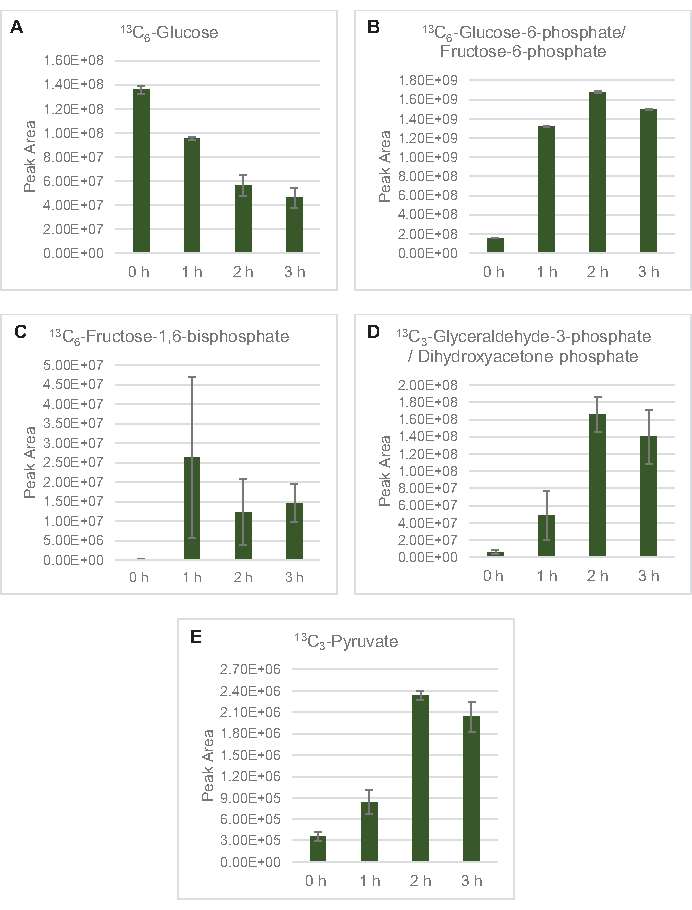
그림 3: 대장균 리세테 CFME에서 13C6-포도당및 13C 라벨 글리코리틱 중급제의 타임 코스 동향. (A) 13 C6-포도당의상대적 풍부,(B) 13C6-포도당-6-인산염/과당-6-인산염,(C) 13C6-과당-1,6-비스포스페이트,(D) 13C 3-글리세랄데히드-3-인산염/디하이드록시아세이세톤 인산염, 13C(13C3-글리세랄데히드/디하이드하이드아이세이세톤) -3시간 이상 CFME 반응에서 피루바테. mzMINE 소프트웨어에서 추출한 원시 피크 영역은 양음 부음(n = 3)에 대한 평균 및 오류 막대(SE)를 계산하는 데 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 대장균 리자테 CFME에서 13C6-포도당발효에서 중간 및 최종 제품의 타임 코스 동향. (A) 13C 3-젖산,(B) 13C3-수치네이트,(C)13 C2-아세틸-인산염,(D) 13C2-아세틸-코아의상대적 풍부도 3h 이상의 CFME 반응. mzMINE 소프트웨어에서 추출한 원시 피크 영역은 양음 부음(n = 3)에 대한 평균 및 오류 막대(SE)를 계산하는 데 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
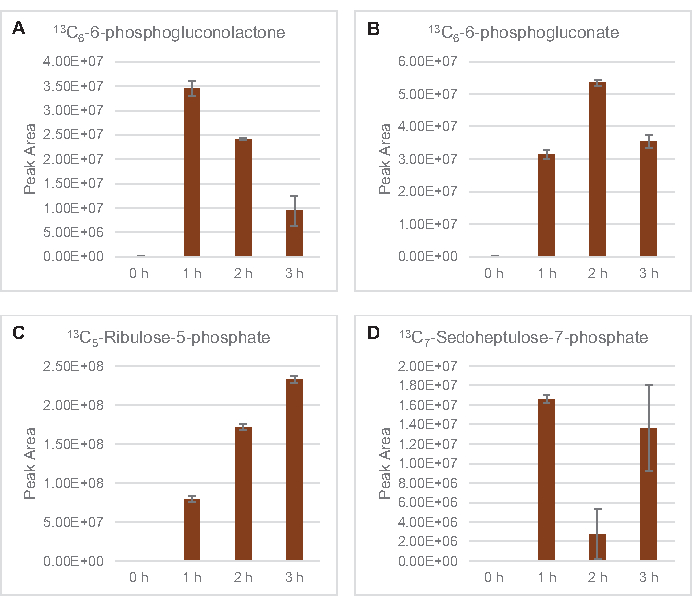
그림 5: 대장균 리세테 CFME에서 13C6-포도당유래 펜토제 인산염 경로 중간체의 시간 과정 동향. (A) 13C6-6-인포글루코놀락톤,(B) 13C6-6-인산글루코네이트,(C) 13C 5-리불로오스-5-인산염,(D) 13C7-세도헤플라스-7-인산염의상대적 풍부. mzMINE 소프트웨어에서 추출한 원시 피크 영역은 양음 부음(n = 3)에 대한 평균 및 오류 막대(SE)를 계산하는 데 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
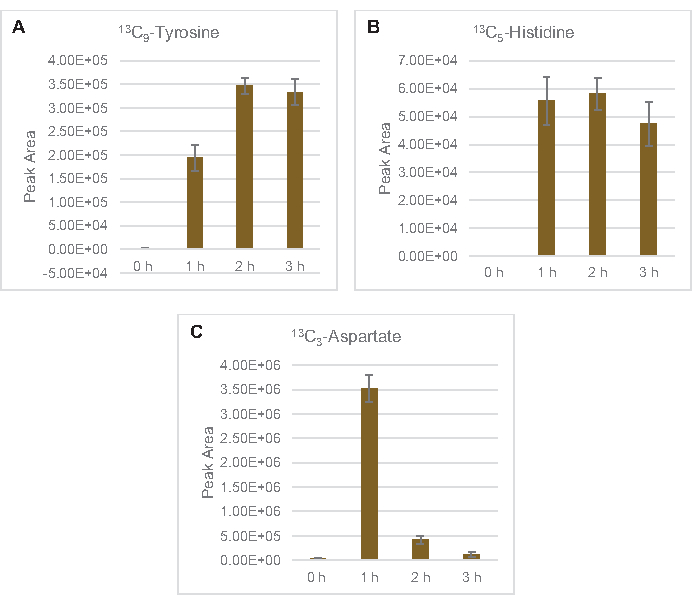
도 6: 대장균 리자테 CFME에서 13C6-포도당유래 아미노산을 검출한 시간 과정 동향. (A) 13C 9-티로신,(B) 13C5-히스티딘,(C) 13C3-3h이상 아파르타트의 상대적 풍부함. mzMINE 소프트웨어에서 추출한 원시 피크 영역은 양음 부음(n = 3)에 대한 평균 및 오류 막대(SE)를 계산하는 데 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충도 1: 대표적인 HPLC-RID 크로마토그램은 24시간 동안 37°C에서 배양된 CFME 반응에서 주요 발효 제품에 대한 피크를 보여 주는 것을 보여 주는 다. 포도당, 간결, 젖산, 포메이트, 아세테이트 및 에탄올 피크는 5mM 황산 용매가 있는 동위 원소 용출 중 HPLC 컬럼에서 의 보존 시간에 의해 충분히 구별됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충도 2: 13C 표지 대사산물, 구체적으로 (A) 젖산, (B) 포도당, (C) 6-인포글루코네이트(6PG)에 대한 대표적인 질량 스펙트럼은 37°C에서 1시간 동안 배양된 CFME 반응에서 이 파일을 다운로드해 주세요.
보충 표 1: 검출 된 13C 라벨 대사 산물 목록, 보존 시간 (MZmine을 사용하여 샘플에 걸쳐 정렬), 이론적으로 완전히 13C 라벨 음수 모드 m / z 값, 감지 된 기능의 m / z 값, 계산 된 질량 오류. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
설명된 HPLC-RID 접근법은 시간이 지남에 따라 주요 유기산 및 알코올 제품으로 설탕 기판 소비량과 후속 변환을 성공적으로 정량화하는 데 사용할 수 있습니다. 또한 이 프로토콜은 단일 모바일 단계를 사용하여 간단한 동면 방법을 채택하고 최소한의 샘플 준비가 필요하며 간단한 표적 다운스트림 분석을 허용합니다. HPLC-RID 방법으로 측정된 Aalytes는 보존 시간, 따라서 선택한 컬럼 수지와의 상호 작용에 의해서만 구별됩니다. 여기에서 이용된 HPLC 컬럼은 크기 배제 및 리간드 교환(즉, 이온 중재된 분할 크로마토그래피)을 결합하여 탄수화물, 유기산 및 알코올을 분리하도록 특별히 설계되었습니다. 따라서, 상기 상기 방법은, 탄수화물 기판의 보다 표적화된 분석에 유용하고, 포도당 발효 경로의 선택 단산물은 주로 용이성 기반 바이오변환8,15,21을용이하게 하고 활력을 불어넣을 것으로 예상된다. 그러나, 이 프로토콜세포 추출물에서 다른 신진 대사 경로의 활성화에 대 한 계정 되지 않습니다. 다른 크로마토그래피 분리 기술(즉, 수성 성작용 크로마토그래피), 그라데이션 용출 방법, 더 복잡한 시료 제제(즉, 파생), 및 다른 광학 검출기(예: 자외선 또는 증발광 산란 검출기)를 사용하는 파이프라인은 아미노산 및 가산염 과같은 다른 대사산물을 검출하는 데 사용될 수있다. . 또는 LC-MS/MS를 사용하여 용해 대사를 연구하는 글로벌 접근 방식을 취할 수 있습니다.
설명된 LC-MS/MS 방법은 광범위한 대사산물을 측정하고 식별하기 위한 단일 워크플로우입니다. LC-MS/MS는 고해상도16을가진 유지 시간 및 m/z 비율로 대사 산물을 구별하는 민감도 및 능력 때문에 메타볼로메 프로파일링을 위한 최첨단 분석 도구이다. 중앙 탄소 대사 경로 와 아미노산 분석에 초점을 맞추고, 음성 모드 MS/MS는 특히 극성 유기산, 설탕 인산염 및 아미노산을 검출하기 위해 구현되었다. 나노 액체 크로마토그래피 기술과 결합된 이 방법은 복잡한 용해배경(17)에서소분자를 검출하는 데 높은 민감도를 제공한다. 그러나, 설명된 LC-MS/MS 프로토콜의 제한은 50m/z의 검출 한계이며, 이는 포도당 대사의 주요 제품인 에탄올의 측정을 배제하고, 상세한 HPLC-RID 방법에 의해 쉽게 정량화되는 상근제입니다. LC-MS/MS에 비해 HPLC-RID는 비용과 난이도 면에서 상대적 접근성의 추가적인 이점을 가지고 있습니다. 후자의 관점에서, 여기에 설명된 LC-MS/MS 방법을 트러블슈팅하려면 질량 분석에 대한 어느 정도의 전문지식이 필요할 수 있습니다. 그럼에도 불구하고 MS 검출은 복잡한 용액 대사망(18)을통해 보충기판에서 탄소 이동을 이해하는 훌륭한 기술인 메타볼로메에서 표기된 동위원소를 추가로 구별할 수 있기 때문에 RID에 비해 유일하게 매력적인 응용 분야입니다. 이러한 접근법은 13 C 6-포도당으로반응을 보완하고 다운스트림 13C 통합 대사 산물의 상대적 풍부 값을 분석하여 여기에 적용되었다. 분석은 액티브하고 비활성 통로의 정의를 허용하고, 이전에 보고된 가정을 지원하고 lysates에 있는 신진 대사 플럭스에 관하여 새로운 통찰력을 제공했습니다. 특정 분석을 위해 메서드 내에서 수정할 수도 있습니다. 예를 들어, 13C표지 표적 화합물의 표준 용액은 시간이 지남에 따라 포도당 유래 분자의 절대 정량적 측정을 달성하고 플럭스 분포에 대한 결론을 내리기 위해 샘플과 함께 분석될 수 있습니다. 양전하 화합물을 더 잘 감지하면 양수 모드 감지를 위해 조정된 .meth 파일로 시퀀스를 실행하여 현재 워크플로 내에서 활성화할 수도 있습니다.
두 가지 설명된 방법 모두에서 분석 샘플링이 편리하게 자동화되어 높은 재현성을 보장합니다. 또한 적절한 계측기 취급 관행과 유지 보수가 관찰되는 한 원활한 분석 실행을 기대할 수 있습니다. 이러한 도구를 사용하여 CFME 반응을 분석할 때 샘플링의 업스트림 및 다운스트림을 보다 중요하게 고려해야 합니다. 샘플 준비 중에 시간 과정 컨트롤이 시간 제로를 대표하는 것이 중요합니다. 여기서, 단백질은 신진 대사 반응을 중단하기 위하여 산성화에 의해 lysates에서 침전되었습니다. 시간 제로 샘플의 경우, 산용매는 포도당을 포함하는 반응 혼합을 추가하기 전에 용액과 결합되었다. 트리클로로아세트산을 가진 산성화는 HPLC-RID데이터(그림 2)에도시된 바와 같이 포도당이 시간 제로에서 대사되지 않도록 효과적으로 보장하였다. 보고된 LC-MS/MS 분석에서 포도당 대사를 담금질하는 유사한 절차가 수행되었지만, 13C-표지대사산물은 이후 시점에서 추출된 샘플에 비해 상당히 낮은 풍부값임에도 불구하고 시간 제로 샘플에서 검출되었다. 더욱이, 이러한 관측은 글리코리시스의 중간체로 제한되었다. 데이터는 반응이 매우 민감한 방법에 의해 검출되는 추출 용매를 가진 산성화 후에 당화 활성의 어느 정도를 유지한다는 것을 건의합니다. 그러나 이 활동의 범위는 정량화되어야 합니다. 이전 연구는 산성 추출 용매가 중간 혈당 반응을 충분히 담금질하지 않을 수 있지만 상당한 포도당 소비를 중지 할 수 있다고보고10. 이 여기에 사용 되는 시스템에서 더 조사 될 남아 있는 동안, 시간 제로 와 이후 시간 점 샘플 사이 상대적인 풍부 한 값에 있는 급격한 변화는 포도 당 물질 대사에 있는 동향으로 해석될 수 있습니다. 그러나 대체 담금질 방법을 탐구하는 것은 특히 대사중급제(10)의절대수량을 얻기 위해 유사한 응용 분야에서 권장된다. 또한 다운스트림 소프트웨어 분석 중 의 모범 사례도 준수해야 합니다. RID 신호에서 피크 영역을 수동으로 통합하여 사람의 오류를 줄일 때 일관성이 필수적입니다. 수동으로 통합된 피크 영역이 샘플의 대사산물 농도를 정량화하는 데 사용될 때마다 표준의 피크 영역에도 수동 통합을 적용해야 합니다. 대상 LC-MS/MS 분석 전반에 걸쳐 MS 품질 브라우저를 사용하여 수동 피크 검사를 통해 MZmine 분석의 잠정 주석을 검증해야 하며, m/z 기능은 계산된 질량 오류가 허용되는 경우에만 주석을 달아야 합니다. 여기서 이러한 분석은 동위원소 검색을 위한 포괄적이고 강력한 소프트웨어가 아직 확립되지 않았기 때문에 제한된 대상 집합에 대해 수동으로 수행되었습니다. 그러나, 13C 표지된 대사산물을 검색하기 위한 이러한 자동화된 방법은 현재 등장하고 있으며 중앙 탄소대사(25)를넘어 용재 프로파일링과 같은 더 복잡한 분석도 간소화할 것이다.
고급 액체 크로마토그래피는 복잡한 대사혼합물(11)에서소분자를 분리하기 위한 견고하고 널리 적용되는 방법입니다. 설명된 방법은 이 분리 기술을 굴절지수 또는 질량 분광 검출과 결합하여 lysate-based CFME 반응에서 대사산물 변환을 성공적으로 분석합니다. HPLC-RID 및 LC-MS/MS는 활성 리자트 대사 프로파일링을 위한 개별적으로 강력한 도구이며, 상호 보완성은 각 기술의 고유한 한계를 해결하기 위해 더욱 활용될 수 있습니다. 보고된 방법은 용액 대사를 이해하고, 표적 대사산물 변환의 개선을 모니터링하고, 용액 대사대사를 조작할 때 대사산물 플럭스로의 변경을 해명하는 데 활용할 수 있기 때문에 CFME의 적용 및 개발을 가능하게 한다.
공개
저자는 그들이 경쟁 금융 이익이나 이해 관계의 다른 충돌이 알려져 있지 않다고 선언합니다.
감사의 말
이 연구는 유전체 과학 프로그램, 미국 에너지부, 과학, 생물학 및 환경 연구실이 식물 미생물 인터페이스 과학 초점 영역 (http://pmi.ornl.gov)의 일환으로 후원했습니다. 오크 리지 국립 연구소는 UT-Battelle에 의해 관리됩니다, LLC, 계약에 따라 미국 에너지부에 대한 DE-AC05-00OR22725. 이 원고는 미국 에너지부와 계약 DE-AC05-00OR22725에 따라 UT-Battelle, LLC에 의해 작성되었습니다. 미국 정부는 출판 기사를 수락함으로써 미국 정부가 이 원고의 출판 양식을 게시하거나 재현하거나 다른 사람이 미국 정부의 목적을 위해 그렇게 할 수 있도록 독점, 지불, 돌이킬 수없는 전 세계 라이센스를 보유하고 있음을 인정합니다. 에너지부는 DOE 공공 접근 계획 (http://energy.gov/downloads/doe-public-access-plan)에 따라 연방 정부가 후원하는 연구의 이러한 결과에 대한 대중의 접근을 제공 할 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
참고문헌
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유