Method Article
광학 핀셋을 사용하여 감금된 세포 전 역학의 직접 힘 측정
요약
여기서, 우리는 광학 트랩에 의한 직접 힘 측정을 통해 3차원 감금에서 격리된 배아 제브라피쉬 세포의 세포내 기계적 특성을 조사하는 프로토콜을 제시한다.
초록
다세포 유기체의 발달 도중, 단 하나 기름지게 한 세포는 분할하고 다양한 기능을 가진 다중 조직을 초래합니다. 조직 형태 발생은 세포 외 기계적 특성의 변화를 초래하는 단일 세포 수준에서 분자 및 구조적 변화와 함께 진행됩니다. 결과적으로 동일한 셀 내에서도 다른 세포기관과 구획은 기계적 스트레스에 다르게 저항합니다. 그리고 메카노트랜스덕션 경로는 기계적 특성을 적극적으로 조절할 수 있습니다. 따라서 조직 틈새 시장의 미세 환경에 적응하는 세포의 능력은 부분적으로 기계적 스트레스를 감지하고 반응할 수있는 능력 때문입니다. 우리는 최근에 핵 변형과 포지셔닝이 세포가 물리적 인 3D 환경을 측정할 수 있게 하고 세포 모양의 변화를 해독하기 위해 proprioception의 감각으로 세포를 부여하는 새로운 메카노센성 패러다임을 제안했습니다. 이 문서에서는, 우리는 신봉세포 및 기계적으로 제한된 세포에 예시된 살아있는 세포 안쪽에 세포 핵을 형성하는 힘 및 물질적 특성을 측정하는 새로운 방법을 설명합니다. 측정은 세포 내부의 광학 트랩으로 비침습적으로 수행 될 수 있으며, 힘은 빛 모멘텀의 교정없는 검출을 통해 직접 접근 할 수 있습니다. 이를 통해 핵의 역학을 세포 표면 변형과 독립적으로 측정하고 외식 및 중식 메카노트랜스듀션 경로의 해부를 허용할 수 있습니다. 중요한 것은, 포획 실험은 세포골격, 칼슘 이온 또는 핵 형태학의 형광 화상 진찰을 사용하여 세포 반응 및 세포 역학을 조사하기 위하여 광학 현미경 검사법과 결합될 수 있습니다. 제시된 방법은 강제 측정을 위한 상용 솔루션과 호환되며, 미토콘드리아, 스트레스 섬유 및 내구와 같은 다른 세포전구의 역학을 쉽게 조사하기 위해 쉽게 확장할 수 있습니다.
서문
조직 형태 발생은 생화학적 신호와 물리적 힘이 현시적으로 조정되는 복잡한 과정입니다. 개발 배아에서 생화학 신호 인자의 그라데이션은 운명 사양을 지시하고 올바른 조직 패터닝1,2을 보장합니다. 동시에 본질적이고 외적인 힘은 배아의 건축을 구축하는 데 역할을한다3,4. 이 맥락에서 세포 피질 역학의 영향은 광범위하게 공부했습니다5,6. 형태 발생 시 메카노 화학 공정 간의 엄격한 상호 연결은 조직 미세 환경에서 기계적 힘을 감지하고 반응하기 위해 단일 세포의 특성에 의존합니다. 세포는, 그로 기계적 신호를 세포 거동, 세포 운명 및 세포 역학을 제어하는 특정 신호 경로로 기계적 정보를 변환하는 힘에 민감한 세포 및 분자 원소의 존재를 통해 디코딩한다.
발달 과정의 특징은 세포가 다세포 구조를 구축하기 위해 그룹으로 조직한다는 것입니다. 이와 같이, 단 하나 세포는 거의 재배열하고 혼자 이동하지만 그들은 supracellular 마이그레이션등 집단 행동을 표시하는 단단한 사회토프에 연관된다7, (un) 방해 전환8,9 또는 배반구 제10. 세포 안팎에서 생성된 기계적 힘은 집단 세포 역학을 지시하는 중요한 단서역할을 한다7,11. 그러나 세포가 조직 시트 또는 좁은 조직 틈새 시장 사이그들의 방법을 짜내는 전구 세포와 같은 혼자 움직일 때조차, 3차원 환경을 탐색할 때 광대한 이소성 기계력을 경험합니다. 세포에 이러한 기계적 스트레스는 세포 행동에 깊은 결과를 가지고12,13. 조밀한 3D 조직 환경 내에서 이동 하는 동안 수동 또는 활성 기계적 요소로 주요 메카노 트랜스유도 원소14,15로 핵에 수렴 하는 몇 가지 메커니즘을 조사 되었습니다15,16.
우리는 최근에 탄성 세포 내 메카노 게이지12로 핵을 사용하여 모양 변형을 측정하기 위하여 세포를 장비하는 기계장치를 제안했습니다. 핵은 세포에서 가장 큰 세포기관인 세포가 기계적 스트레칭, 감금 또는 삼투압하에서 형성을 편광, 이동 또는 변경할 때 큰 변형을 겪습니다16,17,18,19. 우리는 핵의 세포 내 포지셔닝과 함께 핵 봉투가 세포 변형의 크기와 유형에 대한 정보를 세포에 제공한다는 것을 발견했습니다 (예 : 세포 압축 대 세포 팽윤). 핵의 스트레칭은 내부 핵막 (INM)의 전개와 관련이 있으며, 이는 INM에서 칼슘 의존cPLA2 (세포 성 인지질A) 리파제 활성을 촉진하고 아라치도니아산 (AA)의 방출 과 세포 피질에서 myosin II의 신속한 활성화와 관련이 있습니다. 이것은 피질 수축의 임계값 이상 증가한 세포 수축 및 아모에보이드 세포 이동으로 이끌어 냅니다6. 세포 변형에 대한 기계적 반응은 1분 이내에 발생하며 감금 시 가역되며, 이는 핵이 기계적 응력 조건 하에서 적응세포 거동을 조절하는 세포 프로트리오셉션에 대한 스트레인 게이지역할을 한다는 것을 시사한다. 이 메카노감성 통로는 다능성 및 계보 전념 세포12모두에서 제브라피시 배아로부터 유래된 전구줄기 세포에서 활성화되어 있으며 상이한 종 및 세포주에서 보존된다20.
세포-메카노센서로서의 핵특성 외에도 핵구조와 역학은 개발 중 및 세포 운명 사양에 대한 대응으로 본질적으로 조절되며, 따라서 세포 메카노-감도22,23을 튜닝한다. 그 결과는 변주에서 철새로의 전환과 그 반대의 경우도 마찬가지인 핵 준수의 변화일 수 있습니다.
세포 핵 역학을 측정하는 몇 가지 기술이 적용되었습니다, 원자력 현미경 과 같은 24,25, 마이크로 파이펫 포부 26,27, 미세 유체 기술28, 마이크로 니들29. 그러나, 이러한 기술의 대부분은 전체 세포가 변형되어야 한다는 점에서 침략적이며, 핵 자체의 기계적 특성 및 힘 의존 반응의 측정을 제한한다. 세포 표면과 메카노감감성 세포 피질30의 동시 변형을 우회하기 위해, 분리된 핵은 다양한 문맥31,32에서 연구되었다. 그러나 핵 고립은 기계적 핵 특성의 변화와 그 규정(참조24 및 공개되지 않은 관측)과 관련이 있다는 것을 배제할 수 없습니다.
광학 핀셋(OT)은 세포 기계에서 과다한 실험을 허용한 다목적 기술로 분자 기계가 화학 물질을 기계적 에너지로 변환하는 방법에 대한 우리의 이해에 중요한 역할을 해왔습니다. 광학 핀셋은 단단히 초점을 맞춘 레이저 빔을 사용하여 주변 매체33보다 굴절률이 높은 유전체 입자에 광학력을 발휘합니다. 이러한 힘은 수백 개의 피코-뉴턴의 순서일 수 있으며 레이저 트랩 초점 내에서 입자를 효과적으로 감금하여 갇힌 입자를 3차원으로 조작할 수 있습니다. 빛의 사용은 측정이 살아있는 세포 내부에서 비침습적으로 수행 될 수 있다는 점에서 중요한 장점이 있습니다. 광학 조작은 레이저 빔의 트랩 초점으로 더욱 제한됩니다. 따라서, 조작은 주변 세포막을 자극하지 않고 수행될 수 있으며 이온 채널의 힘에 의존하는 활성화와 같은 플라즈마 멤브레인에서 액틴 피질 또는 메카노감성 공정을 교란시키지 않는다.
광학 트위저 접근법의 난이도는 근접 분할 정리 또는 정의된 스토크스-드래그 력의 사용에 기초하여 간접력 보정에 의존하는 고전적인 접근 방식을 사용하여 마이크로스피어에 적용된 힘을 정밀하게 판단하여 레이저 전력 의존탈출력35를 측정하는 것이다. 이러한 방법은 체외 실험에서 구현하는 것이 간단하지만 일반적으로 셀룰러 환경으로 변환할 수 없습니다. 모멘텀 보존의 첫 번째 원칙에서 파생 된 직접 힘 보정에 의존하는 분야에 몇 가지 전략이 도입되었습니다36,37. 다른 힘 분광법 접근법과 달리, 힘 측정은 임의로 모양의 갇힌 입자38,39와 빛 모멘텀의 로컬 교환에서 추론된다38,39. 실험용 셋업에서는 광학력으로 인한 광모멘텀의 변화는 시투 트랩 보정40,41,42,43의 필요 없이 직접 측정됩니다. 따라서, 세포 내부 또는 조직 내와 같은 점성 환경에서 측정이 가능해지고, 힘은 pN 수준으로 쉽게 정량화될 수 있다.
이 프로토콜에서는 세포내 세포기관 이나 구조를 기계적으로 조작하고 광학 트위저 설정으로 기계적 특성을 정량적으로 평가하는 분석방법을 설명합니다. 이 설정은 회전 디스크 형광 현미경으로 통합되어 세포 거동 또는 세포 내 역학의 병렬 이미징을 가능하게 합니다. 분석법은 핵과 같은 특정 세포 구획의 기계적 특성의 특성화를 동시에 연구하면서 변형 자체의 결과로 분자 신호 경로의 가능한 메카노반응 및 활성화를 가능하게 합니다. 더욱이, 세포 내에 주입된 마이크로비드의 광학 트래핑은 폴리스티렌 비드(n=1.59)의 굴절률(n=1.59)의 상당히 높은 굴절률 덕분에 들여쓰기력의 증가를 허용한다444 핵의 본질굴절성 대조444 에 비해 세포질(n~1.38). 제시된 전략은 그밖 세포내 구조 및 세포기관의 연구 결과, 뿐만 아니라 액티브 한 미세 학을 관련시키는 그밖 접근, 동시에 동일/상이한 세포 체형 구조물을 탐구하기 위하여 다중 광학 트랩의 사용 및 살아있는 태아에 있는 세포 역학을 표적으로 하는 측정에 쉽게 적응될 수 있습니다.
프로토콜
사용된 모든 프로토콜은 기관 동물 관리 및 사용 윤리위원회(PRBB-IACUEC)의 승인을 받았으며 국가 및 유럽 규정에 따라 구현되었습니다. 모든 실험은 3R의 원칙에 따라 수행되었다. 제브라피쉬(다니오 리리오)는 이전에 설명한 대로 유지되었다.
1. 격리된 1차 배아 제브라피시 전구 줄기세포 준비
- 마이크로피펫 및 아가로즈 제제
참고: 완전한 제브라피시 배아 미세 주입 프로토콜은 참조45를 참조하십시오.- 마이크로 피펫 풀러로 1.0mm 유리 모세관을 당겨 두 개의 바늘45를 얻습니다. 사용하지 않은 바늘을 플레이도우 쿠션에 부착한 150mm 페트리 접시또는 내부 아웃 실험실 테이프 링에 보관하여 운송 중 얇은 팁을 손상으로부터 보호합니다.
- 10초표준 주방/실험실 전자레인지에서 E3(5mM NaCl, 0.17mM KCl, 0.33m CaCl2, 0.33 mM MgSO4)에서 1% 초순수 아가로즈를 녹여보시다. 아가로즈가 녹을 때까지 짧은 시간(몇 초) 동안 믹스를 반복해서 가열합니다.
- 아가로즈가 완전히 녹으면 잠시 식힌 다음 10cm 페트리 접시에 붓습니다. 기포의 모양을 피하기 위해 아가로즈 의 상단에 삼각형 미세 주입 금형 ( 재료의 표 참조)를 천천히 추가합니다. 금형을 밀어 서 아가로즈 표면에 유지 되도록 하지 마십시오.
- 아가로즈가 완전히 고화되면 아가로즈의 파손을 피하기 위해 부드러운 힘을 발휘하여 삼각형 금형을 매우 천천히 제거하십시오. 플레이트는 2-4 주 동안 4 ° C에서 거꾸로 저장할 수 있습니다.
- 미세 주입 하기 전에 30 분, 냉장고에서 접시를 가지고 실온에서 안정 할 수 있도록 28 °C에 예열 된 E3를 추가합니다.
- 사출 혼합 준비
- 주사 혼합물을 준비하려면 RNase 프리 워터에서 1:5 비율로 1 μm 마이크로비드 (폴리스티렌, 비 형광)를 희석하십시오.
- mRNA는 원하는 농도에서 형광 마커 또는 재조합 유전자 구조 및/또는 모폴리노의 공동 주입의 발현을 위해 mRNA를 준비한다.
참고: 마이크로비드의 공동 주입을 위한 전형적인 주사 혼합물과 배아당 100pg의 mRNA를 라벨로 표시하고, 예를 들어, H2A-mCherry를 가진 핵은: 비드 의 1 μL + mRNA의 1 μL (재고 농도는 1 μg/μL) + RNA 자유 수의 2.5 μL + 페놀 레드의 0.5 μL (스톡 솔루션 0.5%, 페놀 레드는 필수가 아님; 주입된 드롭의 더 나은 시각적화를 위해 사용되지만 비주입 라벨의 더 나은 시각적화를 위해 사용된다. 낙하는 숙련된 실험자의 경우도 볼 수 있습니다). RNA 주사는 또한 주입된 태아를 선택하는 것이 유용할 수 있다. 형광 성 마이크로비드는 비형광 대신에 주입되어 시각화할 수 있습니다.
- 미세 주입 바늘 로딩 및 교정
- 시간 게이트 옵션을 사용하여 마이크로 인젝터를 켭니다. 이 설정은 사출 볼륨을 적절하게 보정하는 것이 매우 중요합니다. 약 500 ms에서 게이팅 시간을 설정합니다.
- 마이크로 로더 파이펫을 사용하여 주사 혼합물의 3 μL을 바늘에 적재합니다.
- 바늘을 미세 조작기에 삽입하고 단단히 밀봉하십시오. 마이크로 조작기가 좋은 위치에 있는지 확인하고 주사 판의 x-y 방향으로 이동할 수있는 충분한 자유가 있는지 확인하십시오.
- 마이크로미터 슬라이드(5mm/100 부단)를 사용하여 낙하 크기를 측정하고, 위에 미네랄 오일 한 방울을 넣고, 사출 믹스한방울을 미네랄 오일에 직접 배출한다.
- 날카로운 뾰족한 팁을 생성하기 위해 가파른 각도에서 날카로운 집게로 바늘을 자르세요. 주입된 재료의 0.5nL에 해당하는 낙하 크기를 0.1mm로 조정합니다.
참고: 바늘을 절단하면 이 부피가 초과되면 새로운 바늘로 교정 절차를 다시 수행하는 것이 좋습니다. 마이크로인젝터의 게이팅 시간은 낙하 부피에 맞게 약간 조절될 수 있다; 그러나 짧은 게이팅 시간은 큰 바늘 직경에 해당하며, 이는 잠재적으로 배아를 손상시합니다.
- 1 세포 단계에서 제브라피시 배아의 미세 주입
- 제1 세포 분열이 발생하기 전에 1세포(zygote) 단계 배아로 직접 비드 혼합물을 미세 주입하기 위해 수정 직후 제브라피시 배아를 수집한다.
참고: 이것은 실험이 수행되는 나중에 발달 단계에서 세포 당 적어도 하나의 마이크로 스피어와 미세 구체의 미세 구체와 미세 구체의 적절한 분포와 절연 된 blastomeres의 높은 충분한 수율을 보장 (blastula-gastrula 단계). 셀 내에 두 구가 있는 경우 들여쓰기 실험을 수행할 수 있지만 구슬이 없는 셀은 제외해야 합니다(구체가 없는 들여쓰기가 가능하더라도). AB 야생형 균주는 이 프로토콜에 사용되었지만, 다른 균주(예: TL)를 사용할 수 있다. - 도 1A에 도시된 바와 같이, 플라스틱 파스퇴르 파이펫을 사용하여 전동 삼각형 모양의 1% 아가로즈 몰드에 1세포 단계 배아(zygote)를 놓습니다.
- 배아가 떠다니는 것을 피하기 위해 동일한 파이펫으로 여분의 배지를 제거하십시오. 브러쉬를 통해 배아를 삼각형 금형에 부드럽게 밀어 넣습니다. 올바른 방향을 용이하게 하기 위해 배아 사이에 약간의 공간을 유지하십시오(그림 1B).
- 배아가 측면 방향으로 향할 수 있도록 브러쉬와 부드럽게 정렬하고, zygote의 한 세포가 그림 1B에 나타난 것처럼 명확하게 볼 수 있습니다. 미세 주입에 대한 이상적인 방향은 배아의 한 세포가 바늘 방향(배아의 동물 극 을 통한 주사)에 직면할 때 또는 노른자 세포(배아의 식물극 을 통한 주입)를 마주하고 있을 때 , 도 1C에 도시된 바와 같이 도달한다.
- 한 손으로 접시를 잡고 다른 손으로 미세 조작기 컨트롤러를 사용하여 바늘 팁을 배치합니다. 배아쪽으로 바늘 끝을 낮춥습니다.
- 초리온을 관통하고 스테레오 현미경을 통해 절차를 모니터링하는 동안 바늘로 1 세포 배아를 입력합니다. 바늘의 올바른 배치를 보장하고, 주입 후, 도 1C에 도시된 바와 같이 주입된 낙하의 정확한 위치를 확인한다.
- 모든 배아에 대해 반복하십시오 : 바늘을 위로 이동하고 다음 배아가 중심이 될 때까지 배아로 접시를 밀어 내고 바늘을 낮추고 주입하십시오.
- 배아의 전체 세트를 주입하면, 일부 E3를 플러시하여 아가로즈 금형 / 페트리 접시에서 배아를 제거하고 플라스틱 파스퇴르 파이펫을 사용하여 새로운 페트리 접시에 넣어. 미세 주입 절차 동안 배아에서 건조하지 않도록 주사 판에 충분한 매체를 배치하는 것이 좋습니다.
- 원하는 배아 수가 주입될 때까지 절차를 반복하십시오. 배아는 구슬의 최대적이고 균일한 확산을 보장하기 위해 한 세포 단계에 있어야합니다.
참고: 이 절차는 초기 blastula 태아에 대 한 최적화 하 고 가능성이 다른 개발 단계를 조사 하는 경우 최적화 될 필요가. - 주입된 배아는 1차 세포 배양을 위한 프로토콜을 진행하기 전에 약 4시간 동안 또는 원하는 단계(도 1D)까지 인큐베이터 내부에 주입된 배아를 배치한다.
참고: 선택적으로, 배아가 생존을 보장하고 독성 유물을 배제하기 위해 블라술라 단계(또는 원하는 측정 시점)를 넘어 개발하도록 합니다. 애벌레 단계에서, 0.75% 아가로즈에 트리카인과 마취 유충을 탑재하고 다양한 조직에서 미세 구체의 분포를 이미지. 스톡 용액을 만들기 위해, 혼합: 400 증류수의 97.9 mL에서 트리카인 분말의 400 mg, 1 M TRIS 베이스 (pH 9)의 약 2.1 mL, pH 7에 적응. 이 용액은 4 °C에서 저장할 수 있습니다. 마취제로 트리카인을 사용하려면 계란 매체 (또는 원하는 매체)의 100 mL에서 4.2 mL의 스톡 용액을 희석하십시오. 이 경우 E3가 사용되었습니다. 자세한 내용은 참조46 을 참조하십시오.
- 제1 세포 분열이 발생하기 전에 1세포(zygote) 단계 배아로 직접 비드 혼합물을 미세 주입하기 위해 수정 직후 제브라피시 배아를 수집한다.
2. 단세포 준비 및 염색
- 플라스틱 파스퇴르 파이펫을 사용하여 구 단계 배아 (4 hpf, 시간 후 수정)를 유리 접시에 놓습니다. 주입된 구슬의 신호에 대해 양성 배아를 선택하고 mRNA 주입시 형광 단백질을 표현한다. 몇몇 태아는 높은 비드 클러스터링을 보여줄 수 있고 제외될 수 있습니다.
- 수동으로 집게를 사용하여 배아를 비반향. 유리 파스퇴르 파이펫을 사용하여 약 10-15개의 배아를 1.5mL 반응 용기로 이송합니다.
참고: 배아가 비반향을 당하면 플라스틱에 부착하고 유리 제품을 사용해야 합니다. 유리 판의 대안으로, 1 % 아가로즈의 얇은 층플라스틱 페트리 접시를 사용할 수 있습니다. 수동 비반향은 세포 표면 단백질에 대한 프로테오리틱 손상과 기계적 세포 및 조직 특성의 잠재적 변화를 방지하기 위해 효소 Pronase 치료보다 선호되어야하며, 연장된 회복 시간을 방지합니다47.
- 수동으로 집게를 사용하여 배아를 비반향. 유리 파스퇴르 파이펫을 사용하여 약 10-15개의 배아를 1.5mL 반응 용기로 이송합니다.
- E3 미디어를 제거하고 사전 따뜻하게 된 CO2 독립적 인 조직 배양 배지 (DMEM-F12; L-글루타민 및 15 mM HEPES를 사용하여 중탄산 나트륨및 페놀 레드10 단위 페니실린과 10 mg / L 연쇄 절제술)를 추가하십시오.
참고: 현미경 인큐베이터를 사용하지 않는 한 CO2 의존 매체를 사용하지 마십시오. 예를 들어, 탄산완충식 조건에서 RPMI를 사용하면 미디어 pH의 변화가 발생하고 세포 생존에 영향을 줄 수 있다. 또 다른 주요 측면은 혈청이 포함된 문화 매체를 피하는 것입니다. 혈청은 전구 줄기 세포6에서 세포 수축및 운동성을 조절할 수 있는 로/록 통로의 강력한 활성제인 리소포스파티딕산(LPA)을 함유할 수 있다. 매체의 삼투성은 핵 형태 또는 역학을 방해할 수 있는 삼투압 문제를 피하기 위하여 300mOsm에서 유지되어야 합니다12. - 튜브를 부드럽게 흔들어 세포를 수동으로 분리합니다. 튜브의 내용이 눈에 보이는 큰 덩어리없이 탁탁이되도록하십시오. 세포의 손상과 손실을 최소화하기 위해 기포의 형성을 피하십시오.
- 원심 분리기 200 x g 에서 3 분 동안. 펠릿은 명확하게 표시되어야 합니다.
- 상체를 제거하고 아래에 설명된 단계 중 하나를 따릅니다.
- 염색이 필요하지 않은 경우 DMEM의 500 μL을 추가합니다. 200 μL 파이펫으로 부드럽게 재연하여 펠릿에 액체 제트를 노타게 합니다. 세포에 과도한 전단력을 발휘하지 마십시오. 발포는 세포의 손상을 나타냅니다.
- Hoechst와 같은 DNA 염료로 핵을 라벨링하기 위해, 최종 농도의 1 μg/mL을 얻기 위해 DMEM의 1,000 μL에 DNA-Hoechst(스톡 2 mg/mL)의 0.5 μL을 혼합한다. 이 염색 용액의 500 μL을 세포에 추가하고 부드럽게 다시 중단합니다. 어둠 속에서 7 분 동안 배양하십시오.
- 형광 화학 칼슘 지표 Calbryte-520으로 세포를 염색하려면 Calbryte-520을 DMEM의 5 μM 농도에 추가합니다. 어둠 속에서 20 분 동안 배양하십시오.
참고: 2.5.2 및 2.5.3 단계에 표시된 프로토콜은 이러한 특정 제품에 최적화되었습니다. 제조업체가 지시한 프로토콜을 사용하여 다른 염색을 수행할 수 있습니다.
- 2.4단계와 동일한 설정을 사용하여 원심분리기; 상체를 제거하고, 세포를 부드럽게 재축 (클러스터의 형성을 피하기 위해) DMEM의 50 μL에서 현탁액 또는 감금셀에 대한 DMEM의 20 μL.
3. 폴리디메틸실록산(PDMS) 간격을 이용한 광학 트래핑 챔버 준비
참고: 광 운동량 검출을 기반으로 한 광학 력 측정은 광학 트랩40에서 나오는 모든 빛을 포착해야 합니다. 변이성 교정 계수 α (pN/V)의 견고성을 위해 광학 력 센서의 후면 초점 평면(BFP)의 광 분포는 광자 모멘텀에 대한 정확한 대응을 부담해야 합니다. 이렇게 하면 수집 렌즈의 표면에서 트랩핑 평면까지의 거리가 광학 트래핑 챔버의 최대 높이인 약 2mm까지의 거리를 결정합니다.
- #1.5 유리 바닥 접시의 PDMS 스핀 코팅.
참고: 다음 레시피는 약 40가지 요리에 제공됩니다. 결과 마이크로 챔버는 실험이 일시 중단 또는 제한된 세포에 실시되어야 하는지 여부에 따라 다른 높이를 갖습니다(그림 1D).- 염기 폴리머 PDMS의 9mL및 PDMS 경화제 1mL을 50mL 원문 튜브에 혼합한다. 양화제의 적절한 분포를 보장하기 위해 두 제품을 적극적으로 혼합합니다.
- 진공 펌프를 사용하여 거품을 피하기 위해 혼합물을 탈가스. 진공 병에 원물 튜브를 소개하고 챔버를 대피. 혼합물에 거품이 없을 때까지 기다립니다.
참고: 진공을 천천히 열어 PDMS가 매관에서 발포및 유출되는 것을 방지합니다. - 스핀 코터 척 (그림 2A)에 유리 바닥 접시를 놓습니다. 긁히거나 지문이 아닌 접시를 더럽히지 않도록 부드럽게 하십시오. 알루미늄 호일로 PDMS 누출로부터 스핀 코터 박스를 보호하십시오.
- 서스펜션의 세포에 대한 실험을 위한 OT 챔버의 경우, 바닥 접시의 중앙에 약 250 μL의 PDMS 혼합물을 넣고 750 rpm에서 1분 동안 회전합니다. PDMS 층의 높이는 약 50 μm입니다.
- 제한된 세포에 대한 실험을 위한 OT 챔버의 경우, PDMS(약 50 μL)의 작은 방울을 추가하고 5분 동안 4,000rpm에서 회전합니다. PDMS 층의 높이는 약 10 μm입니다. 다른 PDMS 두께를 얻는 방법에 대한 자세한 프로토콜은 참조48을 참조하십시오.
- PDMS 코팅 유리 바닥 접시를 70°C에서 1시간 동안 치료합니다.
- 1 x 1cm 정사각형을 메스로 PDMS 층에 자르고 핀셋으로 벗깁니다(그림 2C). 제한된 세포의 경우, 이소프로판올로 PDMS 파편을 씻으라.
- 서스펜션에 가볍게 부착된 세포를 가진 실험을 위한 챔버 코팅
- 0.5 mg/mL에 콩카나베일 A(ConA)의 100μL을 추가하여 사각형 캐비티의 전체 표면을 덮고 30분 동안 배양하게 하십시오.
참고: ConA는 세포 표면 설탕에 결합하고 커버 글래스 표면에 개별 세포를 결합하는 렉틴입니다. - ConA 드롭을 제거하고 ConA 처리 표면을 긁지 않고 DMEM 배지로 표면을 조심스럽게 헹요.
- 이전에 준비된 샘플(2.6단계)의 30μL을 우물에 넣고 부드럽게 다시 일시 중단하여 셀 클러스터를 제거합니다.
- PDMS 림 위에 22 x 22mm #1.5 커버 글래스를 부드럽게 배치하여 캐비티를 닫습니다(갑작스럽게 떨어지는 것을 피하고 가능한 경우 집게를 사용하십시오, 그림 2B, C).
참고: 커버슬립 두께는 상단 유리 커버에 작동합니다(수집 렌즈의 작동 거리는 2mm).
- 0.5 mg/mL에 콩카나베일 A(ConA)의 100μL을 추가하여 사각형 캐비티의 전체 표면을 덮고 30분 동안 배양하게 하십시오.
- 감금 된 세포와 실험을위한 챔버 준비
- 셀(2.6단계)을 포함하는 용액의 10μL 방울을 정사각형 캐비티(그림 2B)에 넣습니다.
- 매우 부드럽게, 22 x 22mm 커버 유리로 샘플을 샌드위치하여 낙하가 전체 영역에 퍼지고 거품이 관찰되지 않습니다. 다시 말하지만, 도 2C에 도시된 바와 같이 집게를 사용하여 커버 유리가 갑자기 떨어지는 것을 방지하는 것이 편리하다.
4. OT 챔버 간격에 대한 대체 옵션
참고: 미세 제작 워크샵이나 스핀 코터를 사용할 수 없는 경우 이러한 단계를 따를 수 있습니다.
- 현탁액에 있는 세포를 가진 실험을 위한 챔버 준비
참고: 스핀 코터를 사용할 수 없는 경우, 스페이서를 일반 양면 스카치 테이프(높이 약 100μm)를 사용하여 스페이서를 만들 수 있습니다.- 중앙에 약 10cm x 10cm 평방 홀 (PDMS, 그림 2B와 동일한 치수)로 양면 스카치 테이프 조각을 잘라.
- 테이프의 보호 층 중 하나를 벗겨내고 테이프의 발견된 면을 #1.5 H 유리 바닥 접시의 중앙에 놓습니다. 기포를 피하면서 유리에 부착된 모든 표면을 부드럽게 누른 다음 테이프의 나머지 보호 층을 벗겨냅니다.
- 3.2 단계의 지침을 따르십시오.
- 감금 된 세포와 실험을위한 챔버 준비
참고: 세포를 정확하게 제한하기 위해 알려진 직경을 가진 단일 분산 미세 입자를 두 개의 커버 안경 사이의 스페이서로 사용할 수 있습니다.- 104 구슬/μL 농도에서 중단된 셀에 10 μm 폴리스티렌 구슬을 추가합니다.
- 22 x 60mm 커버 글래스에 셀과 구슬이 들어 있는 10μL 방울을 넣습니다.
- 매우 부드럽게, 다른 22 x 60mm 커버 유리와 샘플을 샌드위치 드롭 전체 영역에 확산 하고 거품이 관찰되지 않습니다. 상부 커버 유리를 부드럽게 배치하려면 (갑자기 떨어지는 것을 피하십시오), 집게를 사용하는 것이 편리합니다.
- 시료가 건조할 수 있으므로 신속하게 준비하는 것이 좋습니다.
5. 세포 내 측정을 위한 광학 트랩 설정
참고: 다음 단계는 아쿠스토 광학 편향(AOD) 및 광 모멘텀 변화의 직접 검출을 기반으로 하는 광학 력 센서를 기반으로 하는 광학 미세 조작 모듈을 포함하는 상용 광학 핀셋 플랫폼에 최적화되어 있습니다(그림 2, 참조12,40,49). 설정의 세부 사항 및 광학 구성 요소는 그림 2F에서 찾을 수 있습니다. 광학 트위저 조작 중 힘 유도 변형을 관찰하기 위해, Nipkow 회전 디스크 공초점 현미경은 이중 색 형광 이미징을 위한 반전 된 현미경의 왼쪽 포트에 결합된다. 일반성이 부족하지 않으면 광 운동량 감지에 기반한 직접 력 측정기능이 장착된 동적 OT 시스템에 적용할 수 있습니다. 생체 내 응용 프로그램50을 위한 홈빌드 광학 그라데이션 트랩을 구성하는 데 는 상세한 단계별 절차가 제공됩니다. AOD 변조를 기반으로 하는 사람들은 여러 트랩과 빠른 측정51,52로 최종 실험을 통해 두드러지않습니다. 문학36,39,40,53에 존재하는 빛 운동량 기반 기기를 구성하는 여러 프로토콜을 채택하고, 다른 이미징 양식(차동 간섭 대비, 와이드필드 형광 등)을 사용할 수 있다.
- 광학 핀셋 스타트업
- 출력 전력 안정성을 최적화하려면 실험 전에 최소 30분 이상 상당히 높은 전력(예: 3W)으로 레이저를 켭니다.
- 광학 미세 조작 및 힘 측정 장치의 전자 모듈을 켭니다.
참고: 모든 레이저 안전 조치를 적용하고 기관 위원회가 승인한 장비만 사용합니다. 레이저가 켜지면 광학 현미경의 안구를 사용하지 마십시오. 승인된 IR 보호 고글(950-1080 nm 범위의 OD7)을 항상 사용하고, 에피플루오렌스 포트 2의 셔터로 IR 레이저 광을 차단하고, 5.3단계 후 광학 력 센서 정렬을 완료할 때까지 광학 트래핑 소프트웨어를 실행하지 않는다. 일반적으로, 백 리플렉션이 레이저에 손상을 일으킬 수 있으므로 반사성이 높은 샘플을 사용하지 마십시오. - 광학 미세 조작 모듈의 입구에서 회전하는 HWP(도 2F)로 트랩 파워를 제어합니다.
참고: 이 프로토콜에 사용되는 상용 광학 미세 조작 모듈에는 이미 이 기능이 통합되어 있습니다. 홈빌드 광학 트래핑 시스템의 경우 이 도구를 통합하여 더 높고 안정적인 레이저 파워를 사용할 수 있도록 전원 제어를 위해 이 도구를 통합합니다.
- 빈 마이크로 챔버를 사용하여 교정
- 양면 스카치 테이프에 1 x 1cm 정사각형을 자르고 1mm 두께의 현미경 슬라이드에 부착합니다.
- 정사각형에 물을 넣고 #1.5 커버 글래스(22 x 22mm)로 상단에서 닫습니다. 예를 들어, 30-40 μL의 약간 더 높은 물을 추가하는 것은 덮여 있는 챔버 내부의 거품을 피하는 것이 좋습니다. 물이 흘러 나오는 경우 교정 챔버를 부드럽게 닦아냅니다.
- 광학 력 센서의 정렬
- 60x/1.2 물 침수 목표에 물방울을 넣습니다. 목표에 직면 #1.5 커버 유리와 함께 무대에 교정 챔버를 배치합니다. 셀 샘플이 결국 될 낮은 표면에 초점을 맞춥니다.
- 샘플을 덮는 상부 유리 슬라이드 위에 침지 오일 방울을 추가합니다(그림 2D). 힘 센서 장치의 수집 렌즈를 오일 액적에 닿을 때까지 조심스럽게 낮춥다.
참고: 물방울은 트랩에서 나오는 레이저 빛을 수집하는 전체 렌즈를 덮을 수 있도록 충분히 커야 합니다. 일반적으로 200 μL은 전체 표면을 커버하고 안정적인 침수 접접촉을 제공하기에 충분합니다. 보수적이고 샘플에 누출 될 수 있으므로 과충진을 피하십시오. - 광학 력 센서 정렬에 대한 제조업체의 프로토콜에 따라, OT(AUX, 그림 2F)를 배치하는 데 사용되는 보조 카메라의 샘플 평면 이미지를 살펴본다. 매우 부드럽게, 필드 정지 (FS, 도 2F-G)가 샘플 평면에 접합 나타날 때까지 광학 힘 센서를 낮춥니다. 이를 통해 광 모멘텀 변경40의 시료 불변 감지에서 적절한 직접 력 측정을 보장합니다.
참고: FS를 충분히 닫아 이미지가 뷰 필드(FOV)보다 작아지므로 볼 수 있습니다. 광학 력 센서의 수집 렌즈를 시료에 대고 밀어 붙이지 마십시오. 광학 력 센서의 수직 위치는 정의된 수치 조리개(NA)를 가진 광 원추에 대해 BFP의 트래핑 광 분포의 분석에서 결정할 수 있다. - 오일 액적에 기포가 없는지 확인하십시오. 이는 힘 측정에 직접적인 영향을 줄 수 있습니다. 기포를 확인하려면 버트랜드 렌즈(BL, 도 2G)를 제자리에 놓고 접피스를 통한 이미징 경로를 관찰합니다. 먼지나 기포가 보이거나 더 많은 오일이 필요한 경우(그림 S1A)가 필요한 경우, 무연 렌즈 조직으로 렌즈와 챔버를 청소하고 5.3.2 및 5.3.3 단계에서 절차를 반복합니다. 도 면 S1B에는 방해가 되지 않는 광학 경로가 묘사됩니다.
- 광학 력 센서 의 홀더에 배치 된 측면 나사를 사용하여 FS를 FOV에 집중합니다. 정확도를 위해 보조 카메라(AUX, 그림 2F)에서 볼 수 있는 FOV를 거의 채울 수 있도록 FS를 엽니다.
6. 광학 트위저 최적화
참고: 직접 힘 측정은 갇힌 입자에 가해지는 힘에서 발생하는 광 모멘텀의 변화에전적으로 의존하므로 간접적인 방법과 달리 트랩 강성을 각 실험 전에 보정할 필요가 없습니다. 변압/힘 계수(α; pN/V, reference41)의 계측기별 변환은 제조업체에 의해 보정되므로 실험 불변입니다. 그러나 레이저 스팟은 70 μm x 70 μm 의 면적을 조작하기 때문에 6.2-6.5 단계는 최적의 트래핑 및 전력 안정성을 보장하는 데 중요합니다. 다음 단계는 제조업체 소프트웨어에 제공되므로 OT가 반자동 방식으로 작업 영역에 최적화됩니다.
- 카메라 AUX용 OT 소프트웨어 및 인수 소프트웨어를 실행합니다.
- 1단계: 광학 핀셋 구동 소프트웨어의 시스템 교정 하위 메뉴에서 전자 오프셋 단계: 전자 오프셋 단계를 클릭하여 초기 전압 기준선을 뺍니다.
- OT 작업 영역을 가로질러 트랩 전력을 평평하게 수행하려면 HWP를 그에 따라 회전하여 트랩 전력을 최대절반으로 설정합니다. 레이저 출력을 변경하여 트랩 전원을 변경하지 마십시오, 하지만 회전 HWP (도 2F). 2단계를 클릭합니다: 전원 은 트랩 전원 병합을 위한 자동화된 루틴을 시작합니다.
참고: 이것은 OT 작업 영역(그림 S1D)에 걸쳐 트랩 전력의 변형을 보상하기 위한 중요한 단계입니다. 성공적인 루틴은 IT 작업 영역 전반에 걸쳐 트랩 전력 변동을 2%로 줄이며 2분 후에 수렴됩니다. - 트랩 위치 보정을 수행하려면 IR 필터를 제거하여 레이저의 빛이 카메라에 표시되도록 합니다. 마이크로 챔버의 하부 표면에 초점을 맞춘 이미지 평면을 설정하여 IR 스팟을 찾습니다. 카메라 AUX 획득 소프트웨어에서 이미지 평면(목표 위치)과 히스토그램 콘트라스트를 튜닝하여 가능한 가장 작은 IR 스팟을 획득합니다. 필요한 경우 HWP(그림 2F)를 회전하여 광학 트랩의 전력을 줄입니다. 3단계를 클릭합니다: 자동 루틴 또는 트랩 위치 보정을 시작하는 위치.
참고: 이 루틴을 사용하면 카메라 AUX의 OT 위치 좌표를 AOD 스티어링 각도에 정확하게 대응할 수 있습니다. 성공적인 루틴은 몇 초 만에 각도 대 위치 매핑을 생성합니다. - 초기 모멘텀 보상
참고: 시료를 가로지르는 광학 트랩의 움직임은 BFP(도S1E, F)에서 광 운동량 분포의 변화를 일으킵니다. 이는 6.3단계에서와 같이 트랩 전력이 평평해졌음에도 불구하고 작업 영역을 통해 레이저 위치와 관련된 강제 독립적인 신호 변화로 이어집니다. 결과는 각 실험 전에 수정해야 하는 위치(광학적으로 갇힌 비드에 작용하는 실제 힘과 무관)로 인한 힘 기준선의 변화이다.- HWP(그림 2F)를 회전하여 실험에 사용될 트랩 전력을 설정합니다.
- 도구 하위 메뉴에서 전역 오프셋 옵션을 클릭합니다. 이렇게 하면 초기 모멘텀 기준을 수정하는 광학 핀셋 소프트웨어의 오프셋 취소 도우미가 열립니다.
- 오프셋 | 클릭하십시오. 위치 변형 초기 모멘텀을 보정합니다.
참고: 지속적인 주 동안 광학 경로에 수정이 적용되지 않으면 트랩 전원 병합(단계 6.3) 및 위치(6.4 단계) 맵이 변체상태로 유지됩니다. 따라서 레이저 트랩 경로에 영향을 미치거나 새로운 트랩 파워 평탄식 루틴을 수행할 수 있는 광학 요소(이색 거울, 필터 등)의 동일한 조합을 사용하는 것이 좋습니다. 초기 모멘텀 보상(6.5단계)과 관련하여, OT 플랫폼의 제조업체는 모든 새로운 트래핑 전력 및 실험 세션에 대해 변경해야 하는 즉석 교정을 제공합니다. 단계 6.3 및 6.4 단계는 5.2 단계에 설명된 빈 교정 슬라이드에서 수행해야 합니다. 셀 또는 다른 물체를 포함하는 샘플에서 6.5 단계는 OT 작업 영역에서 빛이 산란될 수 있는 물체가 없는 방식으로 수행되어야 합니다.
- 선택적으로, 마이크로스피어를 트랩하고 힘 신호를 기록하는 동안 알려진 속도로 트랩을 이동합니다. 예를 들어, 삼각형 진동을 수행하기 위해 트랩을 설정: 기록된 힘 신호는 제곱 신호가 될 것이다.
참고: 비드에서 작용하는 드래그 포스에 따라 힘 값은 속도에 따라 선형적으로 증가해야 합니다. 이 테스트는 힘 측정이 올바르게 수행되고 있는 긍정적인 제어 역할을 합니다38. 대안적으로, 광학력 센서는 전력 스펙트럼 분석35로부터 광학 포획 강성, θ[pN/μm], 및 위치 보정 계수,β [μm/V]를 획득하는 데 사용될 수 있다. 올바른 정렬에서 제조업체에서 제공하는 변이체 교정 계수는 α =θ,β [pN/V]입니다.- 제조업체 소프트웨어의 측정 값 하위 메뉴에서 플롯 1을 클릭하여 실시간 힘 읽기를 시작합니다. 이렇게 하면 현재 광학 트래핑 력과 전력을 판독할 수 있습니다.
- 도구 하위 메뉴에서 진동 매개 변수 대화 상자를 엽니다. 각각 모양 및 유형 선택기 링에 삼각형 공간 파형 모양을 설정합니다. 예를 들어, 10 μm의 진폭과 3Hz의 주파수를 설정합니다. 이것은 직경 1 μm38의 마이크로비드에 약 1 pN의 점성이 귀착될 것입니다.
- 카메라의 AUX 창에서 마이크로비드를 마우스 오른쪽 단추로 클릭하고 진동 시작을 선택합니다. 힘 판독은 ±1 pN에서 고원과 사각형 힘 신호가 될 것입니다.
- 마이크로비드를 마우스 오른쪽 버튼으로 클릭하고 진동 중지를 선택합니다.
7. 회전 디스크 공초점 현미경 검사
- 회전 디스크 공초점 현미경 및 액세서리 장비, 통합 레이저 엔진 및 획득 카메라를 켭니다.
- 이미징 소프트웨어를 시작합니다.
- 세포 혈장 막을 위한 핵 및 GFP의 Hoechst 염색을 위한 화상 진찰 채널을 설정합니다.
- 405 nm 및 488 nm 흥분 레이저 라인을 활성화합니다.
- 샘플에 여기를 반영하고 방출된 빛이 카메라에 전달될 수 있도록 다중 대역 이분해를 추가합니다.
- 500 nm 길이의 패스 가장자리 이삭미러로 형광 방출을 분할합니다.
- 두 개의 획득 카메라 앞에서 DAPI/BFP(~445nm) 및 GFP(~521nm) 배출 필터를 사용합니다. 그림 2F,G를 참조하십시오.
- 노출 시간을 각 채널에 대해 100ms로 설정합니다.
- 샘플 평면에서 5mW의 전력을 얻기 위해 레이저 방출을 설정합니다. 전원을 측정하려면 상업용 파워 미터를 사용합니다.
- 이미징 프로토콜을 설정합니다. Hoechst 채널에서 GFP 채널로 스펙트럼 출혈을 방지하려면 두 염료를 순차적으로 이미지화해야 합니다.
참고: 광학 트랩의 AOD와 카메라 수집 사이에 하드웨어 동기화가 있는 경우 트리거 극성이 올바르게 설정되었는지 확인합니다. 의심스러운 경우 시설 관리자 또는 현미경 제조업체에 문의하십시오.
8. 핵 들여쓰기 실험 수행
참고: 항상 소프트웨어를 사용하여 광학 트랩을 끄고 피광 포트 2-힘 센서 모듈을 들어 올리고 샘플을 변경할 때 피불화 포트 2에서 셔터를 닫습니다. 그렇지 않은 경우 광학 요소와 실험자가 심각한 손상을 입을 수 있습니다. 렌즈를 스테이지/배양 접시에 부딪히지 않도록 세포를 찾고 있을 때 렌즈 홀더와 하단 접시 가장자리 사이의 측면 거리에 주의하십시오(그림 2).
- 현미경에 샘플을 놓고이 프로토콜의 단계 5.3을 따르십시오.
- 회전HWP(도 2F)를 사용하여, 조사된 핵 또는 세포내 구조의 강성이 알려지지 않은 경우 트랩 전력을 시동값으로 200mW로 설정한다. 6.5단계를 통해 초기 모멘텀 기준선을 보정하기 위해 OT 작업 영역(현미경 단계를 사용하여)을 세포가 없는 곳으로 변환합니다.
참고: 세포 전형 구조의 강성에 따라 트랩 전력 값을 더 낮거나 더 높은 값으로 조정하여 유사한 들여쓰기 깊이를 얻어야 합니다. - 현미경 단계 소프트웨어 컨트롤러를 사용하여, 전송 된 밝은 필드 현미경 검사법을 통해 하나 또는 두 개의 구슬이있는 세포를 찾습니다 (그림 3A).
- 트랩 궤적을 정의합니다.
- 도구 하위 메뉴에서 궤적 대화 상자를 열고 궤도 유형 선택기 링에서 변위를 선택합니다.
- 숫자 시트에 각 후속 궤도 단계의 변위와 시간을 적는다. 다음은 두 가지 예입니다.
- 스트레스 이완 실험을 위해 그림 3B에 도시된 것처럼 사다리꼴 부하를 프로그래밍합니다. 표 S1에서는 이동 거리 5μm로 2개의 사다리꼴 들여쓰기가 적용되었습니다. 5 μm/s의 속도; 철회 전 대기 시간: 10s.
- 핵에 연연하지 않고 삼각형 루틴을 얻기 위해 일정한 속도로 반복적인 들여쓰기 실험을 위해, 궤적 진폭, 예를 들어, 5 μm, 및 단계의 시간( 예를 들어, 2s의 속도 2/s)을 설정한다. 표 S2에서는 동일한 속도로 8회 적용됩니다.
참고: 이러한 값은 각 세포 유형 및 실험에 대해 결정되어야 하지만, 사다리꼴 루틴의 다음 매개 변수는 여기에 제시된 실험에서 가장 중요한 역학을 포착합니다. 대기 시간은 핵이 들여쓰기 후에 완전한 응력 이완을 보여주기에 충분해야 합니다
- 마이크로스피어 트래핑
- 현미경 단계 소프트웨어 컨트롤러와 함께 구단 위에 이미지 평면을 약간 설정합니다.
- OTs 소프트웨어를 사용하여 트랩을 활성화하고 카메라 AUX 이미징 창에서 비드를 클릭합니다(다음 단계 6.4). 광학 트랩에 의한 비드의 성공적인 감금은 비드의 움직임을 강력하게 감소시다.
- 비드를 세포질을 가로질러 클릭앤드래그하여 핵 봉투에서 ~2 μm의 거리에 놓습니다(그림 3A). 구드 들여쓰기가 핵멤브레인에 수직이 되도록 궤도가 설정되어 있는지 확인하십시오.
- 선택적으로, 트랩을 기준으로 비드의 위치 측정에 필요한 경우, 트랩 강성을 결정하기 위해 비드를 가로 질러 트랩을 스캔, k [pN/μm]54, 이에 의해 Δxbead = -F/k(토론 참조). 이 프로토콜에 사용되는 광학 미세 조작 모듈에는 이러한 목적을 위해 기본 제공 루틴이 있습니다.
- 도구 하위 메뉴에서 파티클 스캔 대화 상자를 엽니다.
- 스캔할 트랩과 검색 방법으로 고주파를 선택합니다. 비드 스캐닝 측정을 위해 들여쓰기 궤적의 방향(x 또는 y)을 선택합니다.
- 트랩링 강성을 측정하면 창이 나타납니다. 그래프에서 두 커서를 드래그하여 F = -kx에 해당하는 선형 트래핑 영역을 선택합니다. 선택한 데이터 부분에 대한 선형 맞춤이 자동으로 새로 고쳐집니다.
참고: 중간 셀 인터페이스에서 광 운동량 편향이 힘 측정의 적합성에 영향을 미치기 때문에 구슬의 초기 위치를 세포 막(~5 μm)에서 멀리 설정합니다. 핵이 세포막에 너무 가까이 있는 경우, 반대 부위에서 핵을 들여주려고 한다. 가능하지 않은 경우 셀을 폐기하십시오.
- 이미징 소프트웨어의 획득 버튼을 클릭하여 이미지 수집을 시작합니다.
- 데이터 | 클릭하여 트랩 위치 및 강제 측정 데이터 저장 을 시작합니다. 실시간 힘 읽기 창에서 저장 (단계와 같이 열다. 6.6.1).
참고: 광학 트랩에는 카메라의 타이밍 출력에 연결할 수 있는 트리거 입력이 장착되어 있습니다. 따라서, 이미지 및 힘 데이터는 하드웨어 동기화되고 전자는 수집 하는 동안 이미지의 프레임의 수와 트랩 주기를 매핑할 수 있다. - 구드를 마우스 오른쪽 단추로 클릭하고 시작 궤적을 선택하여 이전에 로드된 궤적을 시작합니다.
- 궤도가 끝나고 시스템이 안정될 때까지 기다립니다.
- 트랩 힘 측정 데이터 저장을 중지합니다. 데이터 저장 대화 상자가 나타납니다.
참고: 데이터 저장소를 최적화하려면 이 대화 상자(10, 100 또는 1000)에서 소멸 매개 변수를 선택하여 데이터를 소멸시킬 수 있습니다. - 이미지 수집을 중지하고 사용자가 선택한 후처리 소프트웨어에서 결과를 플롯합니다.
- 루틴 중에 마이크로피어가 손실되고 핵을 들여쓰기할 수 없는 경우(그림 S2), 측정을 폐기하고 전력을 증가시면. 6.5 단계를 반복해야 합니다. 우리의 손에, 루틴의 적어도 95 %는 성공적으로 함정에서 구슬을 잃지 않고 완료됩니다.
결과
트랩 구슬의 미세 주입:
1세포 제브라피시 배아에 주입된 미세구는 형태 발생 시 전체 동물 모자에 퍼집니다. 더 명확한 시각화를 위해, 우리는 적색 형광 마이크로비드로 주사 프로토콜을 반복하고 다른 발달 단계에서 우리의 공초점 현미경으로 볼륨 이미지를 취했습니다. 도 4A-D에서, 주입된 비드는 5 hfp에서 생체내에서 전구줄기 세포의 세포질에서 시각화된다. 나중에, 마이크로스피어는 24hpf(그림 4E)에서 전체 배아에 퍼지는 것으로 나타났다. 정상적으로 개발된 두 단계에서 배아는 생존율이 대조군 비주입 또는 모의 주입 배아와 비교하였다(그림 S3 참조). 이것은 비옥 주입 제브라피시의 흔들리지 않는 생존을 보고하는 그밖 연구 결과와 일치합니다 5 일 후에 수정55.
우리의 회전 디스크 공초점 현미경은 다중 채널 형광 현미경과 호환됩니다. 그림 5A에서, 우리는 세포질에 있는 하나 또는 2개의 구슬을 가진 고립된 줄기 세포를 보여줍니다. 다중 형광 라벨은 세포의 상이한 양상을 조사하기 위해 사용될 수 있다(도 5B). 핵 형태는 Hoechst 염료로 또는 H2A:mCherry mRNA 발현을 사용하여 추적할 수 있으며, 내부 핵막은 Lap2b-eGFP12로 분석될 수 있다. 세포내 칼슘 수치뿐만 아니라 actomyosin 피질의 역학은 My12.1:eGFP 형질전환 라인56 및 Calbryte-520 배양으로 각각 관찰될 수 있습니다. 여기에 설명된 프로토콜은 접착제 기판(나중에 현탁액이라고 함)과 기계적 감금에 고정된 야생형 세포의 세포 핵 역학을 비교하는 것을 목표로 합니다. 10 μm 높이의 마이크로 챔버에 국한된 분리된 줄기 세포는 내부 핵막(INM)의 부분전개와 actomyosin 수축의 후속 증가를 나타냈다. 도 5C에서, 세포질에 하나 또는 두 개의 구슬을 가진 제한된 세포가 표시됩니다. 성공적인 감금은 핵의 넓은 단면을 가진 평평하고 확장된 세포를 통해 볼 수 있을 것입니다. 핵막은 제한된 세포에서 더 전개되고 현탁액의 세포에 비해 부드럽게 나타납니다 (도 5C).
강제 시간 및 강제 변형 분석
얻어진 결과의 분석은 강하게 조사된 견본 및 관심의 질문에 달려 있고 따라서 여기에서 일반화될 수 없습니다. 예를 들어 들여쓰기 측정을 분석하는 일반적인 방법은 수정된 Hertz 모델을 힘 들여쓰기 데이터에 맞게 조정하여 Young의 계수를 추출하는 것입니다57. 그러나, 이러한 치료에 대한 가정은 신중하게 평가되어야하며 항상 제대로 정당화되지 않을 수 있습니다 (예 : 조사 된 구조는 동위, 균질, 선형 탄성 및 들여쓰기가 비드 반경보다 작습니다). 따라서 조사된 구조의 기계적 거동을 다른 실험 시나리오 에서 비교할 수 있도록 하는 독립적인 측정 모델만 고려합니다.
시작점으로, 특정 들여쓰기 깊이에서 힘 변위 곡선의 경사를 측정하는 것은 핵의 모델 독립적 인 구조적 강성58 의 측정을 제공한다. 그런 다음 이 값을 여러 샘플에서 수집하고 다양한 실험 설정과 샘플 혼란 사이에서 비교할 수 있습니다.
들여쓰기 측정
다음 라인에서, 우리는 감금에 세포 변형 동안 세포 핵의 기계적 반응에 초점을 맞춥니다. 이 프로토콜의 8단계에서의 실험은 일반적으로 약 2-3 μm의 들여쓰기 깊이를 위해 최대 200 pN의 강제 피크로 이어집니다. 그러나, 이러한 값은 세포 유형 및 실험 조건에 따라 크게 다를 수 있으며, 부드러운 핵으로 주어진 들여쓰기에 대한 낮은 힘으로 이어질 수 있다. 따라서 세포 핵의 정확한 기계적 특성화를 위해 무력과 함께 핵 변형을 정확하게 측정하는 데 필요합니다. 이 섹션에서는 대표적인 힘 들여쓰기 측정에서 세포 핵 강성을 얻을 것입니다.
도 6에서, 우리는 일시 중단되고 제한된 세포에서 핵의 황실 및 근위 면의 변형을 보여줍니다. 풍부한 기계적 동작을 관찰할 수 있습니다. 접착제 기판에 전형적인 일시 중단 된 세포에서, 핵은 강하게 비드에 의해 들여쓰기되었다, 뿐만 아니라 반복 추진 이벤트에 따라 약간 변위. 우리는 Hoechst 염색 세포 핵의 형광 화상 진찰에서 얻은 kymographs를 분석하여 핵에 비드 들여쓰기를 측정했습니다. Kymographs는 쉽게 들여쓰기 방향을 따라 피지의 멀티 키모그래프 플러그인을 사용하여 계산되었다 (그림 6A, B) 그리고 추가 처리를 위해 Matlab (버전 2021, Mathworks)로 가져. 스텝 함수는 들여쓰기 루틴의 궤적을 따라 핵의 한계 가장자리를 추적하는 것을 목표로 원시 강도 프로파일에 장착되었다. 볼 수 있듯이, 그것은 모양의 핵 변화에 대한 정확한 정보를 부담 (그림 6 및 그림 S2). 다음 이중 시그노이드 곡선을 단계 함수의 분석 버전으로 사용했습니다.
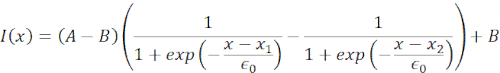 (방정식 1)
(방정식 1)
여기서, x1 및 x2는 핵의 단층 및 근위 가장자리를 나타내고, A와 B는 이미지의 블루 채널(Hoechst 염료)의 최대 및 배경 회색 값입니다(그림 6B). 가장자리 너비(e0 = 0.25 mm)를 고려했습니다. 들여쓰기된 근근 핵 에지(x2)가 마이크로스피어-핵 접촉 후 광학 트랩 루틴에 의해 적용된 궤적을 따랐지만, 반대, 단면 에지(x1)는 세포질(도 6D)과 같은 점탄성 물질에 대해 예상대로 이완역학을 표시한다. 대조적으로, 10 μm 높은 마이크로챔버에 수감된 세포의 핵은 세포 내의 들여쓰기시 핵의 그러한 전좌 거동을 나타내지 않는다(도 6B,D). 도 6D에 도시된 핵의 후면 가장자리는 근접 측에서 밀어내는 비드에 의해 변경되지 않은 상태로 유지되며, 세포 수축및 들여쓰기 력에 대한 마찰작용으로 인해 더 강한 힘으로 인해 발생할 가능성이 큽으로써 대부분 이다. 올바른 변형 깊이를 얻기 위해 변위 x1은 들여쓰기 측정값 x2: Δx = x2 - x1에서 차감되었다(도 6D 참조).
강제 데이터 분석
핵 변형을 유발하는 힘은 광학적으로 갇힌 미생물(도 7A)에서 유래된 광운동량의 변화로부터 측정되었다. 사다리꼴 궤적(8.4.3단계, 도 7B)을 적용한 힘은 처음에 트랩이 움직이지 않고 안정된 상태 값으로 완화될 때까지 선형적으로 증가하였다. 이러한 동작은 손실 및 저장 모툴이를 나타내는 점탄성 물질을 나타냈다. 들여쓰기 이벤트 직후, 힘은 최고 값인 Fp에 도달했고, 그 다음에 스트레스 완화(그림 7C):.
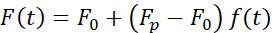 (방정식 2)
(방정식 2)
여기서 F0은 탄성 성분및 f(t)에 대한 저장된 힘이 다치지 없는 이완 기능이다. 이 동작을 세 가지 방법으로 분석했습니다.
1. 기하급수적 응력 이완이 있는 표준 선형 고체, 즉 f(t) = e-t/θ, 도 7C 인셋에서 schematically 표현되는 것을 고려한다.
2. 일반적인 이중 지수 부패를 사용하였습니다.
F(t) = A + B1e-t/θ1 + B2e-t/θ2.
3. 권력법을 사용하후 기하급수적 부패59:
f(t) = t-pe-t/θ, 도 7C에 장착.
모델 1에 대한 적합성은 간단하게 수행할 수 있지만 모델 2및 3에 대한 초기 추측(θ1, θ2) 및 (p, θ)를 각각 추정하는 것이 좋습니다. 이는 각각 로그산학 대 선형(도 7D, 왼쪽) 및 로개심 대 로개반스믹(도 7D, 오른쪽) 저울의 데이터에 선을 피팅하여 수행할 수 있습니다. 표 S3는 그림 7에서 분석된 예제의 결과를 요약합니다. 다음 섹션에서는 세포 핵 역학의 특성화를 위한 권력법과 기하수법의 조합을 고려할 것입니다.
강제 변위 관계
마찬가지로, 설명된 실험 설정은 여러 들여쓰기 이벤트의 강제 변위 관계를 얻는 데 사용될 수 있다. 삼각형 루틴(단계 8.4.4, 도 8A)을 수행함으로써 힘을 변형에 공감하고 힘 들여쓰기 곡선을 플롯할 수 있다. 비드가 핵과 접촉하면 평평한 기준선이 경사면을 원활하게 변경한 도 8B에 모범적인 결과가 나타난다. 시끄러운 데이터의 실제 접점을 식별하는 것은 어려운 일이며 접촉 영역이 탄성 모델에 적합한지 여부를 확인하기 위해 주의를 기울여야합니다60. 이러한 특정 실험에서, 후속 들여쓰기가 더 깊은 접점을 가진 곡선을 초래한다는 것을 알 수 있었고, 이는 비드 후퇴 후 너무 느린 핵 형상 회수 및 핵 점성탄성 물질 특성에 의해 정의된 히스테리 사이클의 변화를 나타낸다(도 8C). 따라서 연구원은 이러한 일이 발생하는지 알고 분석 파이프라인에 통합하거나 이 효과가 측정을 수정하지 않도록 후속 측정 횟수를 제한해야 합니다.
현탁액 및 10 μm 이하 감금의 세포에 있는 핵 역학
전술한 접근법은 접착제 기판 및 제한된 세포에 중단된 세포에서 핵 응력 이완의 역학을 분석하기 위해 사용되었다. 우리의 결과는 감금이 예상 면적(그림 9A)의 확장에 기인하지만 핵 강성의 사소한 변화(그림 9B)를 초래한다는 것을 보여줍니다. 우리는 θ = 6.08 ± 1.1 (밀폐되지 않은) 및 θ = 4.00 ± 0.6 s (감금)로 유사한 이완을 측정했으며, 이는 빠른 점성 탄성 발산을 나타내고 핵의 탄성 계측에 해당하는 저장된 힘 값을 나타냅니다. 들여쓰기 루틴에서 상이한 초기 조건에 의해 생성될 수 있는 실험적 변화를 고려하기 위해, 측정된 저장된 힘은 들여쓰기 깊이 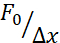 로 정규화되었다. 이 매개 변수는 핵 강성을 설명하고 특정 들여쓰기에 필요한 힘 또는 응력을 설명합니다. 우리는 감금 및 제한되지 않은 세포에서 유사한 강성을 얻었습니다 :
로 정규화되었다. 이 매개 변수는 핵 강성을 설명하고 특정 들여쓰기에 필요한 힘 또는 응력을 설명합니다. 우리는 감금 및 제한되지 않은 세포에서 유사한 강성을 얻었습니다 : 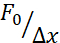 = 각각 20.1 ± 12.6 pN / μm 및
= 각각 20.1 ± 12.6 pN / μm 및  = 24.6 ± 13.6 pN / μm (평균 ± 표준 편차).
= 24.6 ± 13.6 pN / μm (평균 ± 표준 편차).

도 1: 1세포(zygote) 단계에서 제브라피시 배아의 미세 주입. (A) 주사 플레이트: 삼각형 모양 의 주입 플레이트가 주입에 사용된다. 플레이트는 E3 (계란의 매체)에서 1 % 초순수 아가로즈로 만들어집니다. 위쪽 뷰와 측면 뷰가 오른쪽에 표시됩니다. (B) 배아 포지셔닝: 브러시를 사용하여 배아를 부드럽게 방향을 지정하고 1세포가 바늘로 명확하게 보이고 쉽게 접근할 수 있도록 오리엔드. 우리는 스케치에 표시된 것처럼 바늘의 반대편에 위치한 세포로 배아를 방향을 지정하는 것이 좋습니다. (C) 1세포 단계 배아내 주사 절차: 태아와 단일 세포를 둘러싼 초리온을 바늘로 관통한다. 바늘의 끝이 세포 안쪽에 있고 주입하는 압력을 풀어 놓는지 확인하십시오. (D) 배아를 28-31°C에서 배양하여 블래발라(sphere) 단계(4hpf)까지 발전할 때까지 배아를 배양한다. 세포 격리 프로토콜 및 세포 염색(step 2)을 수행하고 해당 기판 표면 코팅(step 3)과 결합된 현탁액 및/또는 감금에서 분리된 세포로 광학 포획 챔버를 준비한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 광학 트위저 장치의 제조. (A) 유리 바닥 접시에 정의된 높이를 가진 PDMS의 스핀 코팅 층. 원심력으로 인해 PDMS 드롭이 균등하게 확산됩니다. (B) PDMS 층에서 샘플 챔버의 준비. 1: 메스로 사각형을 자르고, 2: 콩카보딘 A(ConA),세척 및 종자 세포로 내부를 잘 코팅합니다. 3: 유리 슬라이드 또는 커버 슬립으로 뚜껑을 덮어 우물을 밀봉합니다. (C) 메스로 절단하고 집게로 PDMS를 잘 제거하는 사각형의 그림. (D) 트랩 챔버 위에 광학 힘 센서의 수집 렌즈를 장착. 침지 오일 한 방울은 수집 렌즈와 상부 유리 커버 사이의 침지 매체역할을 합니다. 스케일을 가지지 않는 회로도. 샘플 접시의 유리 커버를 만지지 않도록 수집 렌즈를 낮추면서 주의하십시오. (E) 샘플과 접촉하는 힘 검출 장치의 그림입니다. (F) 실험 셋업의 회로도. 광학 마이크로조작 모듈은 연속 파레이저 빔(5W, λ = 1064 nm)을 사용하여 하프 웨이브 플레이트(HWP) 및 편광 빔 스플리터(BS)를 통해 전력 제어를 합니다. AODs 한 쌍으로 변조 된 후, 그것은 반전 된 현미경의 상부 상피 형광 포트에 결합됩니다. 레이저 빔은 950 nm 짧은 패스 이색 거울 (IR-DM)에 의해 반사되어 형광 흥분 흥분 및 방출의 전송을 허용합니다. 트래핑 레이저는 현미경 (상부 포탑)의 후방, 피광 포트로 안내됩니다. 오트는 물에 침수하는 객관적인 렌즈(60x, NA = 1.2)의 초점 평면에서 생성됩니다. 광학 력 센서는 현미경 포탑에 의해 복종되고 높은 NA, 오일 침지 렌즈로 O에서 나오는 레이저 빛을 캡처합니다. 동시에 힘 센서는 밝은 필드 조명을 가능하게합니다. 회전 디스크 공초점 장치는 왼쪽 포트에 결합됩니다. 7개의 형광 흥분 레이저와 두 개의 백 조명 sCMOS 카메라를 제어하는 2개의 통합 레이저 엔진(ILE)이 장착되어 있어 Abb: TI, Transilluminator; FS, 필드 정지; AOD, 공수 광학 편향; HWP, 하프 웨이브 플레이트; 캠, 카메라 (G) 광학 트래핑 장비의 사진. 빨간색 원은 수동으로 광학 경로로 전환 할 수있는 버트 랜드 렌즈를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
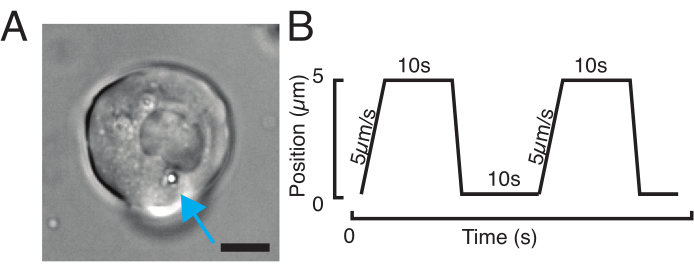
그림 3: 올바른 샘플 및 매개변수 선택. (A) 단일 마이크로스피어를 가진 분리된 제브라피시 전구 줄기세포의 대표적인 이미지가 핀들여쓰기 실험을 수행하기 위해 핵에 충분히 가깝게 배치된다. 스케일 바 = 10 μm. (B) 예시트랩 궤적; 들여쓰기 깊이 5 μm; 들여쓰기 속도 = 5 μm/s; 휴식 시간 10 s. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 개발 중 제브라피시 배아 내부의 미생물 국소화. 0.5 nL의 1 μm 적색 형광 구슬은 WT 배아에서 GPI-GFP mRNA(100 pg/embryo, 혈장 멤브레인)와 함께 주입되어 비드 국소화를 시각화합니다. (A-D) 0.75% 아가로즈에 장착된 배아 내부에 마이크로피어 5h 포스트 주입의 분포. (A) 브라이트필드 및 형광 이미지. 구슬은 공초점 현미경 표에서 볼 수 있듯이 배아 조직에 균질하게 분산됩니다. (B) 공초점 형광 z 스택의 최대 투영. 구슬은 이미지 스택의 z 위치에 따라 보라색에서 노란색으로 색상으로 구분됩니다. 보라색/마젠타는 가장 외부 구슬/세포(EVL; 상피 관종 층; 또는 EVL 표면에 가까운 선조 줄기 세포)에 해당하며, 노란색은 오른쪽 스케치에 나타난 바와 같이 내부 구슬(전구체 깊은 세포)에 해당한다. (C) 주황색 상자의 영역에 해당하는 (B)의 서브 스택의 절단 및 최대 투영: 깊은 세포의 큰 분수는 1-2 구슬을 포함한다. (D) 마젠타 상자에 대응하는 (B)의 서브 스택의 절단 및 최대 투영: 일부 EVL 세포에는 1-2 구슬이 포함되어 있습니다. (E) 브라이트필드 영상과 24hpf 배아의 z 스택의 최대 투영은 0.75% 아가로즈에 장착되고 트리카인으로 마취된다. 배아는 15 분 동안 트리카인으로 사전 배양되었습니다. 왼쪽에서 오른쪽으로: 마이크로스피어(직경 1μm), GPI-GFP 및 이미지가 겹칩니다. 구슬은 배아의 몸 전체에 분포. 각 패널에 표시된 스케일 바 치수입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
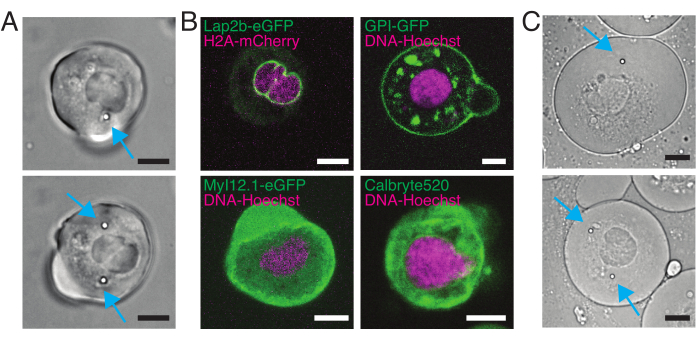
그림 5: 다른 라벨을 가진 분리된 제브라피시 전구 줄기 세포. (A) 1(상단) 또는 2(아래) 주입된 비드가 있는 서스펜션 셀의 전송 광 현미경 이미지. 시안 화살표는 구슬을 가리킵니다. (B) 다른 얼룩을 가진 현탁액 세포의 형광 공초점 이미지. 왼쪽 상단: Lap2b-eGFP (내부 핵막, 80 pg/배아) 및 H2A-mCherry. 오른쪽 상단: GPI-GFP (혈장 막, 100 pg/배아) 및 DNA-Hoechst (섹션 2에 설명된 대로 염색). 왼쪽 아래: MyI12.1-eGFP (형질전환선) 및 DNA-Hoechst. 오른쪽 아래: Calbryte488 및 DNA-Hoechst (섹션 2에 설명된 대로 염색). (C) 1(상단) 또는 2(아래) 주입된 비드가 있는 제한된 세포의 전송 광 현미경 이미지. 시안 화살표는 구슬을 가리킵니다. 스케일 바 = 10 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.
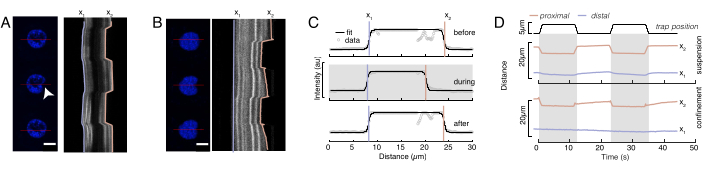
도 6: 방적 디스크 영화에서 핵 변형을 추정합니다. (A,B) 핵의 들여쓰기 실험의 시간 경과 (A) 일시 중단 된 세포 및 (B) 제한된 세포. 배율 막대 10 μm. Hoechst 표지된 핵의 대표적인 스냅샷은 광학적으로 갇힌 마이크로스피어(흰색 화살촉)를 들여 들여쓰기 전, 도중, 5s전에 5s를 나타내었다. 들여쓰기 세그먼트를 따라 키모그래프(빨간색 선, 오른쪽 패널). x1 및 x2는 강도 프로파일의 적합성에서 수학식 1에 추출된 들여쓰기 실험 동안 핵의 단부 및 근위(bead에 가까운) 경계이다. (C) 세 가지 다른 프레임(구들여 쓰기 전, 도중 및 후)에 대한 들여쓰기 세그먼트를 따라 강도 프로파일을 입력하고 핵 가장자리의 탈구, x1 및 근위, x2, 위치를 평가하기 위해 수학식 1에 장착됩니다. (D) 일시 중단 및 제한된 세포(10μm)의 들여쓰기 실험 중에 호박색으로 x1(t)의 대표적인 궤적을 호박색으로 한다. 그늘진 영역은 들여쓰기를 나타내며 x1과 x2 사이의 거리는 핵 직경을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
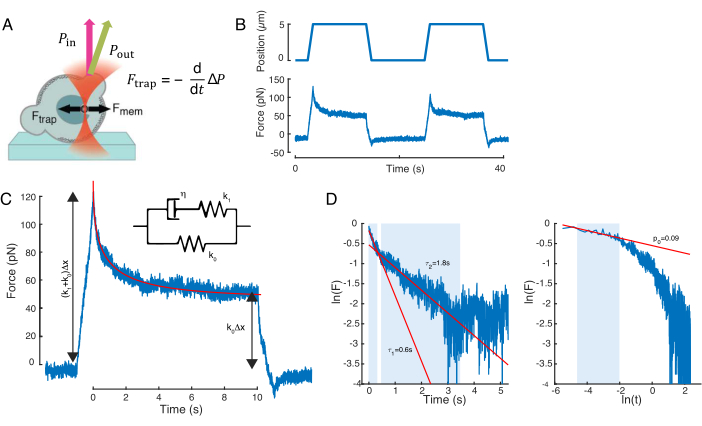
도 7: 힘 신호 처리. (A) 들여쓰기시 세포 핵을 변형하는 광학트랩 마이크로피어의 회로도. 핵막과 광학력은 검은 화살로 표시됩니다. 빔 모멘텀의 변화는 녹색 화살표 Pout로 표시됩니다. (B) 반복핵 들여쓰기 실험 동안 광학적으로 갇힌 마이크로스피어에 의해 경험된 트랩 궤적(위) 및 힘(bottom). (C) 최대 들여쓰기 깊이에서 힘 피크 후 강제 이완 붕괴. Inset은 여기서 현상학적 관측에 근해적인 역학을 가진 표준 선형 솔리드의 회로도를 보여줍니다. (D) 왼쪽: 정규화된 힘의 로가릿심대 시간. 그림자가 있는 영역은 이중 지수 붕괴(빨간색 선)에 맞추는 데 사용되는 데이터 부분을 나타냅니다. 오른쪽: 정규화된 힘의 로가릿심대 시간의 로가릿엄. 그림자 가분영역은 전력법에 맞는 데 사용되는 데이터 부분을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
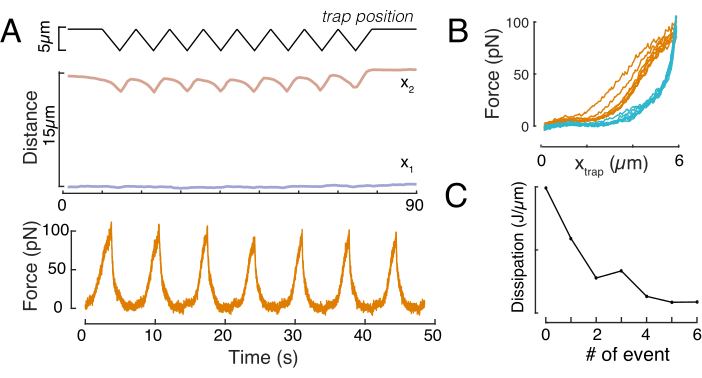
그림 8: 삼각형 트랩 변위를 가진 강제 들여쓰기 루틴. (A) 10 μm 감금 높이에서 셀에서 취한 삼각형 들여쓰기 실험 중 황색으로 파란색 및 x2(t)의 대표 궤적. 상단: 트랩 위치. 중간: 핵 형상 분석. x1과 x2 사이의 거리는 핵 직경을 나타냅니다. 아래쪽: 힘 신호. (B) 8회 연속 트랩 포지션을 포획한다. (C) F-d 곡선의 접근 및 철수 부분 사이의 히스테리시스로부터 유래된 소멸의 진화, 각 후속 들여쓰기 이벤트에 대한 핵의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9. 서스펜션 (접착제 표면)과 사다리꼴 루틴에서 감금 된 세포의 핵 특성. (A) 현탁액 및 10 μm 이하 의 세포로부터 핵의 투영 된 면적. 검정막대는 중앙값을 나타냅니다. (B) 현탁액 및 감금 하에 있는 세포의 핵 강성. 검정막대는 중앙값을 나타냅니다. MatLab을 사용하여 크루스칼- 월리스 테스트에서 파생된 P 값. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보조 표 1: 광학 핀셋 소프트웨어에 의해 정의된 사다리꼴 궤적. 첫 번째(두 번째) 행은 트랩이 선형으로 변위되는 x(y) 거리입니다. 세 번째 행에서는 지정된 단계의 지속 시간이 몇 초 만에 설정됩니다. 이 궤적은 7점으로 구성되며 도 7B에서 핵에 대해 두 번 적재된 사다리꼴에 해당한다. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보조 표 2: 광학 핀셋 소프트웨어에 의해 정의된 삼각형 궤적. 표 2와 마찬가지로 이 궤적은 16점으로 구성되어 있으며, 깊이 5μm의 8개 들여쓰기 이벤트와 2.5 μm/s의 속도로 구성되어 있습니다 .
보충 표 3: 그림 7의 데이터에 대한 매개 변수피팅. IG: 초기 추측. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보조 도면 S1: 광학 힘 센서 정렬 및 모멘텀 기준 보정. (A) 버트랜드 렌즈를 통해 보조 카메라(AUX, 도 2)에서 촬영한 필드 스톱. 접안렌즈를 통해 볼 수 없는 침수 오일에 기포가 나타납니다. (B) 광학 경로를 청소합니다. 정확한 정렬을 위해 필드 정지를 열고 NA = 1.2 라이트 콘과 일치하게 합니다. (C) 샘플 평면의 이미지입니다. 빨간색 사각형은 OT 작업 영역을 나타냅니다. 스케일 바: 20 μm.(D) 트랩 전력은 FoV를 가로질러 C에 표시된 흰색 이중 화살표를 따라 측정합니다. 수정이 적용되지 않는 경우 빨간색, 트랩 전원 변형. 파란색에서 트랩 전원이 전체 시야에서 수정되었습니다. (E) 동일한 범위를 따라 모멘텀 기준선의 X 구성 요소입니다. 수정되지 않은 빨간색의 추적입니다. 파란색에서 트랩 전원을 위해 추적이 수정되었습니다. 녹색에서 제조업체 소프트웨어에서 글로벌 오프셋 보정을 사용하여 모멘텀 기준을 수정했습니다. (F) Y 구성 요소에 대해 E와 동일합니다. 정상 작동 하에서, 그늘진 구성 요소는 역학 및 힘 측정에 사용됩니다,예를 들어, x 좌표를 따라 이동하는 동안 x 힘 구성 요소 와 y 축을 따라 이동하는 동안 y 힘 구성 요소. 모든 보정이 구현되면 <0.5 pN의 RMSD 노이즈가 얻어진다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 약한 함정으로 인해 실패한 루틴. (A) 실패한 루틴으로부터 핵 들여쓰기를 보여주는 Kymograph. 트랩에서 비드의 탈출으로 인해 짧고 일시적인 변형만 볼 수 있습니다. 중요한 것은, 트래핑 레이저는 여전히 미리 정의 된 궤적 (녹색 점선)을 완료하기 위해 비드없이 이동합니다. 스케일 바 = 10 μm. (B) 상단: 트랩 위치 대 시간. 중간: 들여쓰기 된 근위 및 단부 핵 가장자리의 가장자리 추적 결과. 점착성 기판에서 격리된 세포에 대해 일반적으로 관찰되는 대로 단면 가장자리는 들여쓰기 없이 움직이지 않습니다. 아래쪽: 열노이즈 감소와 0힘으로 급격히 떨어지는 것으로 표시된 마이크로피어의 손실을 나타내는 힘 대 시간. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 도서 S3: 주입된 태아의 생존. 프로토콜에 설명된 농도에서 1 μm 구슬과 100 pg/배아를 주입한 배아는 주입되지 않은 배아와 비교되었고 24시간 후 수정에 큰 차이를 보이지 않았다. N을 가진 3개의 독립적인 실험의 평균 및 표준 편차는 각 실험에 대한 조건당 21개의 배아를 >. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜에서, 우리는 살아있는 세포 안쪽에 세포 핵의 기계적 특성을 심문하는 유일한 방법을 기술합니다. 다른 힘 분광법 기술과는 달리, 비침습적 광학 포획은 세포막과 세포골격의 기여를 세포 핵 강성으로부터 분리할 수 있게 해 주었다. 중요한 것은, 광학 현미경 조작은 다중 모달 현미경 검사법과 호환됩니다, 이는 실험자가 세포 핵 메카노생물학에 관련있는 다른 프로세스를 공부할 수 있게 합니다. 대표적인 결과로, 우리는 수백 개의 피코뉴턴 의 질서의 힘에 의해 수행된 들여쓰기시 핵 변형을 측정하기 위해 DNA-Hoechst 염색을 사용했습니다.
이 프로토콜에 설명된 예제를 넘어 당사 방법의 잠재적 응용 프로그램
외부 의 동요없이 살아있는 세포 내부의 측정에서 정량적 기계적 정보를 추출 할 수있는 가능성은 탐구하기 시작한 전례없는 기회의 과다를 가능하게합니다. 따라서 광학 미세 조작 플랫폼의 제시된 프로토콜은 다재다능한 보다 복잡한 실험으로 확장될 수 있습니다. Acousto-optic 디플렉터(AOD)는 다양한 셀 위치에 걸쳐 동기력 측정을 위한 여러 광학 트랩을 생성할 수 있을 뿐만 아니라 넓은 주파수 범위에서 활성 미세화학에 사용될 수 있다51,61. 언급했듯이, 들여쓰기시 힘 반응은 최대 포획력을 극복할 수 있으며, 이는 광학 트랩에서 비드의 탈출으로 이어진다. 이 경우, 광학력을 클램프하기 위해 AOD로 힘 피드백을 구성할 수 있다. 모두 모두, 이러한 프로토콜에 기재된 응력 이완과 같은 다중 미세화학적 접근법은 또한 활성 미세화학 또는 크리프 컴플라이언스, 이 플랫폼을 통해 실험적으로 획득하고 새로운 소프트웨어 패키지61,62,63,64,65에 의해 철저히 분석될 수 있다. . 더욱이, 힘의 적용은 핵에 국한되지 않고, 손상되지 않은 혈관 내부에 흐르는 적혈구를 트래핑하거나 엽록소세포와 미토콘드리아68을 트래핑 및 변형시키기 위해 입증된 바와 같이 다양한 세포내 구조 및 복잡한 조직에서 측정하기 위해 원칙적으로 수행될 수 있다. . 광운동 보정은 갇힌 물체의 모양과 크기와 무관하므로 임의의 모양으로 임의의 힘 프로브에 대한 직접 력 측정을 가능하게 합니다38,39. 주입된 마이크로스피어를 사용하면 세포 구조의 직접 조작에 비해 레이저 전력이 상대적으로 낮은 핵에 높은 힘을 적용할 수 있었습니다69,70,71. 그러나 굴절률 차이가 충분히 높다는 점을 감안할 때, 외부적으로 적용된 힘 프로브는 필요하지 않으며 세포내 세포기관들은 주입된 비드(미공개 관측 및 참조70)없이 직접 조작할 수 있다.
응용 프로그램을 확장하는 방법의 잠재적 수정
마이크로비드의 크기는 실험에 따라 주입될 수 있지만 상대적 컨트롤은 수행해야 합니다. 예를 들어, 나중에 세포를 연구하기 위해 더 작은 구슬을 주입할 수 있다. 이렇게 하면 광학 트랩에 의해 가해질 수 있는 최대 힘이 줄어듭니다(예: 참조55에 도시됨). 더 큰 구슬은 더 높은 힘을 발휘하기 위하여 주입될 수 있습니다, 그러나 이들은 그들의 규모 또는 관심의 단계에 따라서 태아 발달에 영향을 미칠 수 있습니다. 미생물 분사가 옵션이 아닌 실험에서, 세포질에 비해 굴절성 지수 차이를 나타내는 다양한 세포기관은 여전히 광학적으로 조작될 수 있어 광모멘텀 변화로부터 측정가능한 광학력을 야기한다42. 위에서 언급했듯이, 이러한 방법은 Drosophila 배아70에서 세포 세포 접합을 변형시키기 위해 Bambardekar 외에 의해 사용되었습니다. 마찬가지로, 세포의 핵은 주변 매체44보다 굴절률이 낮으며, 이는 낮은 트래핑 강도에도 불구하고 구슬없는 들여쓰기(미공개 관측 및 참조72)를 허용합니다. 따라서 핵은 쉽게 포획될 수 없으며 함정을 탈출합니다.
스핀 코팅 PDMS 스페이서는 편리하고 빠른 방법을 통해 제작되지만 마이크로 /나노 제조 시설 이나 엔지니어링 실험실에 액세스하지 않고 실험실에 대한 손이 닿지 않을 수 있습니다. 따라서, 스페이서는 실험실 테이프 또는 파라필름(step 4)으로부터 쉽게 조립될 수 있다. 또한 이 프로토콜은 단일 세포의 전달을 미리 정의된 측정 우물또는 정의된 높이로 챔버로 자동화하는 미세유체 채널을 제조하여 동일한 시편 내에서 감금 효과를 추정할 수 있습니다. 그러나, 이러한 미세유체 장치는 현미경 목표와 광력 센서의 수집 렌즈 사이의 공간에 맞게 설계되어야 하며, 약 2mm(3단계 참조). 분산으로 인한 광학 수차가 광자 모멘텀 측정에 영향을 미치지 않도록 광학 력 센서를 적절한 높이에 배치해야 합니다.
다른 수정은 생물학적 기자의 변화를 포함 할 수있다. 우리는 Hoechst 형광이 GFP 채널로 관상적으로 출혈한다는 것을 것을을 발견하고 우리는 이렇게 두 개의 형광 채널에서 동시 측정을위한 핵 마커로 mCherry 태그 히스톤과의 조합을 선호합니다. 대안적으로, 핵 변형은 Lap2b-GFP와 같은 내부 핵막을 대상으로 하는 라벨로 쉽게 추적될 수 있다(도 2).
세포 핵에 들여쓰기는 2-3 미크론의 순서였으며, 회절 제한 방사 디스크 공초점 현미경 검사법의 이미지 분석에 의해 정확하게 측정할 수 있었습니다. 더 단단한 핵 또는 더 작은 힘의 경우, 들여쓰기는 이 접근을 사용하여 거의 측정할 수 없을 것입니다. 그러나, 절대힘 보정 광학 핀셋은 나노미터 정확도를 가진 BFP 간섭요법을 사용하여 시상에서 갇힌 비드의 위치 측정을 위해 보정될 수도 있다51. 이러한 접근법을 이용하여 전압 신호와 광학력 센서는 매개변수 β [nm/V]를 통해 트랩된 프로브의 위치로 변환될 수 있으며, 불변 매개변수는 [pN/V]α 전술한 광 모멘텀 보정을 통해 강제로 값을 산출합니다(자세한 내용은 아래 참조).
문제 해결
실험 중에 다음과 같은 문제가 발생할 수 있음을 발견했습니다.
안정된 트랩이 형성되지 않고 마이크로스피어가 쉽게 빠져나가지 않습니다.
현미경 목표 또는 잘못 정렬 된 보정 칼라에 어떤 먼지는 안정적인 함정의 실패로 이어질 수 있습니다. 즉각적인 솔루션을 찾을 수 없는 경우 목표 렌즈의 포인트 스프레드 기능을 측정합니다. 관심있는 표본이 광학적으로 조밀 한 조직 내부에 깊은 경우, 레이저 초점은 불안정한 트래핑으로 이어지는 심각한 광학 수차를 경험할 수 있습니다 (이 효과는 일반적으로 고립 된 세포에서 무시할 수 있지만 두꺼운 조직에서 더 분명해집니다). 높은 강성의 경우, 핵의 복원력은 마이크로피어가 손실되고 들여쓰기 루틴이 실패하도록 트랩의 탈출력을 초과할 수 있다. 처음에, 광학 트랩에 핵 막 가장자리 근위체는 거의 들여쓰기되지 않습니다 (그림 S2A). 이 경우 트래핑 레이저는 더 이상 힘 및 브라운 모션의 영향을 받지 않으며, 이는 힘 저하를 0으로 유도하고 신호 노이즈의 감소(도S2B). 이 경우 레이저 파워가 증가하여 더 강한 트랩을 가질 수 있고, 비드를 핵으로 밀어넣는 사다리꼴 궤적의 진폭이 감소될 수 있거나, 또는 갇힌 미생물의 초기 위치는 핵에서 더 멀리 설정될 수 있다.
세포가 자극 중에 움직이고 있습니다.
세포가 충분히 부착되지 않으면, 광학 그라데이션 트랩은 세포 내 들여쓰기 루틴을 수행하면서 세포를 이동하여 핵의 힘과 기본 역학이 관절이 될 수 있도록 합니다. 전체 세포의 변위를 방지하기 위해, 우리는 표면에 세포 접착 분자의 농도를 증가하는 것이 좋습니다, 예를 들어, ConA.
초기 모멘텀 보상
초기 모멘텀 보상 루틴이 OT 플랫폼(6.5단계)에서 사용할 수 없는 경우, 인위적이고 독립적인 기준 선신호가 수정되어야 합니다. 이는 구슬이 갇혀 있지 않더라도 힘 곡선의 경사로 볼 수 있습니다(그림 S1E). 보정을 수행하려면, 정확히 동일한 위치에서 셀의 외부, 구드없이 동일한 궤도를 수행 할 필요가있다. 이를 위해 스테이지 컨트롤을 사용하여 셀을 트랩에서 멀리 이동합니다. 참조로, 힘 오프셋은 우리 시스템의 200 mW에서 FOV에 걸쳐 5 pN을 변경합니다. 따라서, 그것은 짧은 궤적을 위해 무시할 된다. 대안적으로, 압착기 스캔 스테이지는 레이저 위치를 일정하게 남기고 시료상에서 세포를 이동하는 데 사용될 수 있다.
제시된 프로토콜의 중요한 단계
마이크로스피어는 배아에 대한 최대 분포를 보장하기 위해 오른쪽, 1세포 단계에서 주입되어야 한다. 구슬은 이미징에 사용되는 형광 채널로 빛이 누출되지 않도록 형광이 되어서는 안됩니다. 예를 들어, 일반적인 적색 형광 구슬조차도 휘도 (여기: 405 nm; 방출 : 445 nm)로 인해 Hoechst 염색 후 세포 핵을 이미징하는 데 사용되는 파란색 채널에서 명확하게 볼 수 있습니다. 기판에 셀의 안정적인 부착은 들여쓰기 루틴 동안 측면 변위를 방지하는 것이 중요합니다. 루틴 중에 셀이 이동하는 경우 힘이 과소 평가됩니다. 이러한 일이 자주 발생하면 첨부 프로토콜을 최적화합니다. 조직 배양 세포의 경우, 다른 세포 접착 단백질, 섬유넥틴, 콜라겐, 또는 폴리 L-리신과 같은 만족스러운 부착(미공개 관찰)이 발생합니다. 감금 하는 동안, 세포는 갑작스럽고 심각한 기계적 스트레스를 받게 됩니다. 이것은 세포에 손상을 일으키는 원인이 될 수 있고 절차가 신중하게 수행되지 않는 경우에 실험자가 파열한 세포를 자주 만날 것입니다. 또한 감금 높이가 너무 작으면 모든 세포가 핵 포위 파손 또는 돌이킬 수없는 손상으로 고통받을 수 있습니다. 이를 완화하기 위해 상부 커버슬립을 더 느리게 낮추고 커버슬립 사이의 간격을 늘립니다.
이를 극복하기 위한 기술과 제안의 한계
이 기술의 명확한 한계는 수차와 불안정한 트래핑으로 이어지는 조직의 깊은 부분으로 레이저 광을 침투시키는 것입니다. 따라서, 침투 깊이의 하한은 시료의 선명도, 사용될 수 있는 수차 보정에 따라 달라집니다73 및 적용된 레이저 전력. 더 높은 레이저 전력이 마이크로스피어 부근의 시료의 열 흥분으로 이어진다는 점을 고려해야 합니다. 그러나, 1064nm 파장 레이저 스팟에서 유래한 시료의 가열은 우리의 생물학적 샘플에 그럴듯한 열 관련 응을 피하기 위해 최소화된다74.
또 다른 제한사항은 측정할 수 있는 최대 힘입니다. 직접 광-모멘텀 검출은 광학 트랩40,41의 선형 응답 체제를 훨씬 뛰어넘는 힘 측정을 가능하게 하지만, 최대 적용 힘은 수백 picoNewtons의 순서입니다. 이는 일반적으로 0.1 또는 0.344보다 크지 않은 연생물학적 물질의 레이저 전력 및 결과적 손상 임계값 및 굴절률 차이에 의해 제한됩니다. 예를 들어 구조화 된 light75, 반사 방지 코팅 된 마이크로스피어76, 고굴성 지수 입자77 또는 고도로 도핑된 퀀텀닷78을 사용하여 힘 검출 한계를 높이기 위한 몇 가지 방법이 제안되었다.
OT는 BFP 간섭측정을 통해 나노미터 규모의 위치 측정에 사용될 수 있으며, 이러한 트랩 내의 비드의 위치는 Δx = β Sx이며, 여기서 Sx는 센서의 전압 신호이며, β [μm/V]는 서로 다른 프로토콜에 따라 즉석에서 교정될 수 있다35,54. 광학 력 센서의 경우, 전압-힘 불변 변환 계수 [pN/V]α 직접 β 및 트랩 강성, k [pN/μm], α =kβ 37을 통해 광학 이미징에서 검출하기에는 너무 작은 비드 변위를 실험하는 데 사용할 수 있으며, 이 전략은 작은 검출 위치로 힘 측정을 보완하는 데 사용될 수 있다. 예를 들어, 여기에 제시된 실험 루틴을 매우 뻣뻣한 핵에 적용하여 합리적인 레이저 힘(200-500 mW)에서 힘을 충분히 크게 들여쓰기 값을 유도하기에 충분하지 않다. 이 경우, 비드는 핵과 접촉하여 가져와야 하며 트래핑 강성은 측정 전에 교정되어야 한다(단계 8.6). 힘의 함수로서 핵의 들여쓰기 D는 간접적으로 다음과 같이 결정될 수 있다:
d = xtrap - F /k
여기서 xtrap은 트랩 위치입니다. [pN/V]α 불변광 모멘텀 계수와 는 달리, 입자 크기, 광학 트랩 스팟 크기 및 상대 굴절률과 같은 트래핑 역학을 결정하는 많은 로컬 변수에 따라 달라지므로 각 실험 전에 [μm/V]β 인자 β 보정해야 합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
MK는 계획 Nacional (PGC2018-097882-A-I00), FEDER (EQC2018-005048-P), R&D 우수 센터세베로 오초아 프로그램 (CEX2019-0009-S009.S009)을 통해 스페인 경제 및 경쟁력부의 재정 지원을 인정합니다. RYC-2016-21062), Fundació Privada 셀렉스, 펀다시오 미르 푸이그, 그리고 CERCA 및 연구 프로그램(2017 SGR 1012)을 통해 일반타트 드 카탈루냐에서 ERC(메카노시스템즈) 및 HFSP(CDA00023/2018)를 통한 자금 지원. V.R.은 스페인 과학 혁신부로부터 EMBL 파트너십, 센트로 드 엑셀렌시아 세베로 오초아, 마네코의 계획 나시오날(BFU2017-86296-P, PID2020-117011GB-I00) 및 일반 타말루냐(CERCACA)의 지원을 인정합니다. V.V.는 마리 스크와도우스카-퀴리 보조금 협정665884에 따라 유럽 연합의 호라이즌 2020 연구 및 혁신 프로그램에 의해 투자된 ICFOstepstone 박사 프로그램의 지원을 인정합니다. 우리는 원고의 비판적 독서에 대한 Arnau Farré 감사합니다; 마리아 마르살의 이미징 및 장착에 도움을 위한 24 hpf 배아; 센다 지메네즈-델가도는 제브라피시 미크로제스로 지원합니다.
자료
| Name | Company | Catalog Number | Comments |
| #1.5 22 mm cover glasses | Ted Pella | 260148 | |
| #1.5 22x60 mm Coverglasses | Ted Pella | 260152 | |
| #1.5H glass bottom dishes | Willco | GWST-5040 | |
| 10-um beads | Supelco | 72986 | |
| 1-mm glass capillaries | Harvard Apparatus | 30-0020 GC100F-15 | |
| 1-um polystyrene microbeads | Sigma | 89904 | |
| 1-um red-fluorescent beads | ThermoFisher | F8816 | |
| Agar | ThermoFisher | 16500500 | |
| Aqcuisition cameras sCMOS | Andor | Sona-4BV11-UNI | |
| Auxiliary camera (Figure 3, AUX) | Blackfly, FLIR | BFS-U3-200S6M-C | |
| Calbryte 520 | AAT Bioquest | 520 AM | |
| Centrifuge | Eppendorf | 5453000011 | |
| Concanavalin A | Sigma | C5275 | |
| DMEM | Sigma | D2906 | |
| DNA-Hoechst | ThermoFisher | 33342 | |
| Double scotch tape | Biesse Adesivi | ||
| E3 | 5 mM NaCl. 0.17 mM KCl. 0.33 mM CaCl2. 0.33 mM MgSO4 | ||
| Eclipse Ti2 | Nikon | ||
| Forceps | Fine Science Tools | 11252-20 | |
| GPI-GFP | |||
| H2A-mCh | |||
| Image acquisition software | Fusion-Andor | ||
| Immersion Oil | Cargille | Type B: 16484 | |
| IR protection googles | Thorlabs | LG1 | |
| Lap2b-eGFP | |||
| Micro loader pipette | Eppendorf | GELoader | |
| Microinjector | World Precision Instruments | SYS-PV820 | |
| MicroManager 2.0 | |||
| Micromiter slide | ID5243 GXMGRAT-5 5mm/100 divisions | ||
| Mineral oil | Sigma | M3616 | |
| Motorized stage | ASI | ||
| Needle puller | Sutter instrument Co. | Model P-97 | |
| Optical tweezers platform | Impetux Optics | Sensocell | |
| OTs software (LightAce) | Impetux Optics | ||
| PDMS | Sigma | Sylgard 184 | |
| PDMS Curing agent | Sigma | Sylgard 184 | |
| Post processing software (Matlab) | Mathworks | ||
| RNAse free water | Thermofisher | AM9937 | |
| Short-pass dichroic mirror (Figure 3, IR-F) | Semrock | FF01-950/SP-25 | |
| Spin-coater | Specialty Coating Systems | Spincoat G3P-8 | |
| Spinning-disk confocal microscope | Andor | DragonFly 502 | |
| Stereomicroscope | Leica M80 | ||
| Triangular microinjection mold | Adaptive Science Tools | TU1 | |
| Universal oven | Memmert | UNB 200 | |
| Water immersion objective | Nikon | MRD07602 |
참고문헌
- Chan, C. J., Heisenberg, C. P., Hiiragi, T. Coordination of Morphogenesis and Cell-Fate Specification in Development. Current Biology. 27 (18), 1024-1035 (2017).
- Heller, E., Fuchs, E. Tissue patterning and cellular mechanics. Journal of Cell Biology. 211 (2), 219-231 (2015).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Petridou, N. I., Spiró, Z., Heisenberg, C. P. Multiscale force sensing in development. Nature Cell Biology. 19 (6), 581-588 (2017).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. 160 (4), 673-685 (2015).
- Shellard, A., Mayor, R. Supracellular migration - Beyond collective cell migration. Journal of Cell Science. 132 (8), (2019).
- Mongera, A., et al. A fluid-to-solid jamming transition underlies vertebrate body axis elongation. Nature. 561 (7723), 401-405 (2018).
- Atia, L., et al. Geometric constraints during epithelial jamming. Nature Physics. 14 (6), 613-620 (2018).
- Turlier, H., Maître, J. -. L. Mechanics of tissue compaction. Seminars in Cell & Developmental Biology. 47-48, 110-117 (2015).
- Ladoux, B., Mège, R. M. Mechanobiology of collective cell behaviours. Nature Reviews Molecular Cell Biology. 18 (12), 743-757 (2017).
- Venturini, V., et al. The nucleus measures shape changes for cellular proprioception to control dynamic cell behavior. Science. 370 (6514), (2020).
- Charras, G., Sahai, E. Physical influences of the extracellular environment on cell migration. Nature Reviews Molecular Cell Biology. 15 (12), 813-824 (2014).
- Kirby, T. J., Lammerding, J. Emerging views of the nucleus as a cellular mechanosensor. Nature Cell Biology. 20 (4), 373-381 (2018).
- Lee, H. P., et al. The nuclear piston activates mechanosensitive ion channels to generate cell migration paths in confining microenvironments. Science Advances. 7 (2), (2021).
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Current Opinion in Cell Biology. 23 (1), 55-64 (2011).
- Versaevel, M., Riaz, M., Grevesse, T., Gabriele, S. Cell confinement: Putting the squeeze on the nucleus. Soft Matter. 9 (29), 6665-6676 (2013).
- Zuela-Sopilniak, N., et al. Measuring nucleus mechanics within a living multicellular organism: Physical decoupling and attenuated recovery rate are physiological protective mechanisms of the cell nucleus under high mechanical load. Molecular Biology of the Cell. 31 (17), 1943-1950 (2020).
- Kim, D. H., Wirtz, D. Cytoskeletal tension induces the polarized architecture of the nucleus. Biomaterials. 48, 161-172 (2015).
- Lomakin, A. J., et al. The nucleus acts as a ruler tailoring cell responses to spatial constraints. Science. 370 (6514), (2020).
- Hampoelz, B., et al. Microtubule-induced nuclear envelope fluctuations control chromatin dynamics in Drosophila embryos. Development. 138 (16), 3377-3386 (2011).
- Heo, S. J., et al. Differentiation alters stem cell nuclear architecture, mechanics, and mechano-sensitivity. eLife. 5, 1-21 (2016).
- Cosgrove, B. D., et al. Nuclear envelope wrinkling predicts mesenchymal progenitor cell mechano-response in 2D and 3D microenvironments. Biomaterials. 270, 120662 (2021).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nano. 8 (4), 3821-3828 (2014).
- Hobson, C. M., et al. Correlating nuclear morphology and external force with combined atomic force microscopy and light sheet imaging separates roles of chromatin and lamin A/C in nuclear mechanics. Molecular Biology of the Cell. 31 (16), 1788-1801 (2020).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Davidson, P. M., et al. High-throughput microfluidic micropipette aspiration device to probe time-scale dependent nuclear mechanics in intact cells. Lab on a Chip. 19 (21), 3652-3663 (2019).
- Lombardi, M., Zwerger, M., Lammerding, J. Biophysical assays to probe the mechanical properties of the interphase cell nucleus: Substrate strain application and microneedle manipulation. Journal of Visualized Experiments: JoVE. (55), (2011).
- Luo, T., Mohan, K., Iglesias, P. A., Robinson, D. N. Molecular mechanisms of cellular mechanosensing. Nature Materials. 12 (11), 1064-1071 (2013).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Bustamante, C. J., Wang, M. D. Optical tweezers in single-molecule biophysics. Nature Reviews Methods Primers. , 1-29 (2021).
- Svoboda, K., Block, S. M. Force and velocity measured for single kinesin molecules. Cell. 77 (5), 773-784 (1994).
- Berg-Sørensen, K., Flyvbjerg, H. Power spectrum analysis for optical tweezers. Review of Scientific Instruments. 75 (3), 594-612 (2004).
- Smith, S. B., Cui, Y., Bustamante, C. Optical-trap force transducer that operates by direct measurement of light momentum. Methods in Enzymology. 361 (1994), 134-162 (2003).
- Farré, A., Montes-Usategui, M. A force detection technique for single-beam optical traps based on direct measurement of light momentum changes. Optics Express. 18 (11), 11955 (2010).
- Català, F., Marsà, F., Montes-Usategui, M., Farré, A., Martín-Badosa, E. Extending calibration-free force measurements to optically-trapped rod-shaped samples. Scientific Reports. 7, 1-10 (2017).
- Bui, A. A. M., et al. Calibration of force detection for arbitrarily shaped particles in optical tweezers. Scientific Reports. 8 (1), 1-12 (2018).
- Farré, A., Marsà, F., Montes-Usategui, M. Beyond the hookean spring model: Direct measurement of optical forces through light momentum changes. Methods in Molecular Biology. 1486, (2017).
- Farré, A., Marsà, F., Montes-Usategui, M. Optimized back-focal-plane interferometry directly measures forces of optically trapped particles. Optics Express. 20 (11), 12270 (2012).
- Jun, Y., Tripathy, S. K., Narayanareddy, B. R. J., Mattson-Hoss, M. K., Gross, S. P. Calibration of optical tweezers for in vivo force measurements: How do different approaches compare. Biophysical Journal. 107 (6), 1474-1484 (2014).
- Mas, J., Farré, A., Sancho-Parramon, J., Martín-Badosa, E., Montes-Usategui, M. Force measurements with optical tweezers inside living cells. Optical Trapping and Optical Micromanipulation XI. 9164, (2014).
- Schürmann, M., Scholze, J., Müller, P., Guck, J., Chan, C. J. Cell nuclei have lower refractive index and mass density than cytoplasm. Journal of Biophotonics. 9 (10), 1068-1076 (2016).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments: JoVE. (25), (2009).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish. (Danio rerio), 5th Edition. , (2007).
- Schubert, R., et al. Assay for characterizing the recovery of vertebrate cells for adhesion measurements by single-cell force spectroscopy. FEBS Letters. 588 (19), 3639-3648 (2014).
- Koschwanez, J. H., Carlson, R. H., Meldrum, D. R. Thin PDMS films using long spin times or tert-butyl alcohol as a solvent. PLoS One. 4 (2), 2-6 (2009).
- Das, R., et al. Mechanical stretch inhibition sensitizes proprioceptors to compressive stresses. bioRxiv. , (2021).
- Chardès, C., Clement, R., Blanc, O., Lenne, P. F. Probing cell mechanics with bead-free optical tweezers in the drosophila embryo. Journal of Visualized Experiments: JoVE. (141), (2018).
- Staunton, J. R., Blehm, B., Devine, A., Tanner, K. In situ calibration of position detection in an optical trap for active microrheology in viscous materials. Optics Express. 25 (3), 1746 (2017).
- Bola, R., Treptow, D., Marzoa, A., Montes-Usategui, M., Martin-Badosa, E. Acousto-holographic optical tweezers. Optics Letters. 45 (10), 2938-2941 (2020).
- Thalhammer, G., Obmascher, L., Ritsch-Marte, M. Direct measurement of axial optical forces. Optics Express. 23 (5), 6112 (2015).
- Vermeulen, K. C., et al. Calibrating bead displacements in optical tweezers using acousto-optic deflectors. Review of Scientific Instruments. 77 (1), 1-6 (2006).
- Dzementsei, A., Barooji, Y. F., Ober, E. A., Oddershede, L. B. Foregut organ progenitors and their niche display distinct viscoelastic properties in vivo during early morphogenesis stages. bioRxiv. , 1-35 (2021).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. , (2018).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74 (3), 1564-1578 (1998).
- Khalilgharibi, N., et al. Stress relaxation in epithelial monolayers is controlled by the actomyosin cortex. Nature Physics. 15, (2019).
- Crick, S. L., Yin, F. C. Assessing micromechanical properties of cells with atomic force microscopy: importance of the contact point. Biomechanics and Modeling in Mechanobiology. 6 (3), 199-210 (2007).
- Hurst, S., Vos, B. E., Betz, T. Intracellular softening and fluidification reveals a mechanical switch of cytoskeletal material contributions during division. bioRxiv. , 425761 (2021).
- Kaplan, J. L., Bonfanti, A., Kabla, A. RHEOS.jl - A Julia package for rheology data analysis. arXiv. 4, 1-5 (2020).
- Bonfanti, A., Kaplan, J. L., Charras, G., Kabla, A. Fractional viscoelastic models for power-law materials. Soft Matter. 16 (26), 6002-6020 (2020).
- Rivas-Barbosa, R., Escobedo-Sánchez, M. A., Tassieri, M., Laurati, M. i-Rheo: determining the linear viscoelastic moduli of colloidal dispersions from step-stress measurements. Physical Chemistry Chemical Physics: PCCP. 22 (7), 3839-3848 (2020).
- Tassieri, M., et al. i-Rheo: Measuring the materials' linear viscoelastic properties "in a step". Journal of Rheology. 60 (4), 649-660 (2016).
- Zhong, M. C., Wei, X. B., Zhou, J. H., Wang, Z. Q., Li, Y. M. Trapping red blood cells in living animals using optical tweezers. Nature Communications. 4, 1767-1768 (2013).
- Harlepp, S., Thalmann, F., Follain, G., Goetz, J. G. Hemodynamic forces can be accurately measured in vivo with optical tweezers. Molecular Biology of the Cell. 28 (23), 3252-3260 (2017).
- Bayoudh, S., Mehta, M., Rubinsztein-Dunlop, H., Heckenberg, N. R., Critchley, C. Micromanipulation of chloroplasts using optical tweezers. Journal of Microscopy. 203 (2), 214-222 (2001).
- Favre-Bulle, I. A., Stilgoe, A. B., Rubinsztein-Dunlop, H., Scott, E. K. Optical trapping of otoliths drives vestibular behaviours in larval zebrafish. Nature Communications. 8 (1), 630 (2017).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. 112 (5), 1416-1421 (2015).
- Ferro, V., Chuai, M., McGloin, D., Weijer, C. J. Measurement of junctional tension in epithelial cells at the onset of primitive streak formation in the chick embryo via non-destructive optical manipulation. Development (Cambridge). 147 (3), (2020).
- Hörner, F., et al. Holographic optical tweezers-based in vivo manipulations in zebrafish embryos. Journal of Biophotonics. 10 (11), 1492-1501 (2017).
- Zhong, M. -. C., Wang, Z. -. Q., Li, Y. -. M. Aberration compensation for optical trapping of cells within living mice. Applied Optics. 56 (7), 1972 (2017).
- Català, F., Marsà, F., Montes-Usategui, M., Farré, A., Martín-Badosa, E. Influence of experimental parameters on the laser heating of an optical trap. Scientific Reports. 7 (1), 1-9 (2017).
- Taylor, M. A., Waleed, M., Stilgoe, A. B., Rubinsztein-Dunlop, H., Bowen, W. P. Enhanced optical trapping via structured scattering. Nature Photonics. 9 (10), 669-673 (2015).
- Bormuth, V., et al. Optical trapping of coated microspheres. Optics Express. 16 (18), 13831-13844 (2008).
- Sudhakar, S., et al. Germanium nanospheres for ultraresolution picotensiometry of kinesin motors. Science. 371 (6530), (2021).
- Shan, X., et al. Optical tweezers beyond refractive index mismatch using highly doped upconversion nanoparticles. Nature Nanotechnology. 16 (5), 531-537 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유