Method Article
황 색포도상구균 내산화 및 항균 화합물의 세포 내성 효능을 연구하는 향상된 효소 보호 분석
* 이 저자들은 동등하게 기여했습니다
Erratum Notice
요약
이 프로토콜은 황색포도상구 균 의 내재화의 범위와 인간 숙주 세포 내부에서 살아남을 수있는 능력뿐만 아니라 항균 화합물의 세포 내 효능을 연구하는 방법을 설명하는 것을 목표로합니다.
초록
황색포도상구균은 진핵세포로의 내화를 촉발하고 다른 세포체 구획 내부에서 살아남기 위해 독성 요인을 표현한다. 이 논문은 S. 아우레우스 내재화의 정도와 부착비 전문식 세포(NPPC)에서의 세포내 생존의 정도와 항균 화합물의 세포 내 효능을 연구하기 위한 효소 보호 분석서를 설명합니다. NPPC는 100% 합류에 도달할 때까지 멀티 웰 플레이트에서 재배됩니다. S. 아우레우스 배양은 세포 배양 배지에서 하룻밤 사이에 재배된다. 세균현탁액은 감염의 조절된 복합성에서 세포를 접종하기 위해 잘 당 세포의 수에 따라 희석된다. 접종된 세포는 NPPC에 의해 박테리아가 내면화될 수 있도록 2시간 동안 배양되며, 그 다음에리소스타핀이 세포외 박테리아를 선택적으로 죽이기 위해 배양 배지에 첨가된다. 리소스타핀은 나머지 실험을 위한 배양 배지에 존재한다.
이 시점에서, 감염된 세포는 S. 아우레우스에 대하여 그들의 세포내 활동을 평가하기 위하여 항균 화합물로 배양될 수 있었습니다. 다음으로, 세포는 약물을 제거하기 위해 세 번 세척되고, 세포 내 S. 아우레우스 하중은 다음 천판에 배양하여 정량화된다. 대안적으로, 세포 내 생존 및 세포 독성에 관여하는 포도상 구균 독성 인자를 연구하기 위해 리소스타핀은 세척 단계의 필요성을 제거하기 위해 단백질 효소 K로 비활성화 될 수 있습니다. 이 팁은 세포 내 세균 부하 정량화의 신뢰성을 향상, 세포가 세포 내 S. 아우레우스의 곱셈 때문에 심하게 감염 될 때 배양 판에서 분리하는 경향이 특히. 이러한 프로토콜은 거의 모든 유형의 응고형 NPPC및 오르가노이드와 같은 3D 세포 배양 모델과 함께 사용할 수 있습니다.
서문
황색포도상구균은 생명을 위협하는 병원체이자 피부의 막다른 박테리아와 전 세계 20억 명의 개인을 식민지화하는 점막입니다1. 인간에서, S. 아우레우스의 비강 운반체는 마차의 그들의 자신의 긴장으로 감염의 증가한 리스크가 있습니다; 그러나, S. 아우레우스 점막 마차의 다인적 결정요인은 아직도 불분명1,2. 급성 감염 이외에, 환자는 또한 치료하기 위하여 수시로 도전적인 만성 S. aureus 감염을 개발할 수 있습니다3. 식민지화 와 감염 도중 호스트 병원체 상호 작용의 더 나은 이해는 새로운 치료 전략을 개발하고 참을성 있는 관리를 향상을 위해 중요합니다.
시험관내에서, S. 아우레우스는 α5β1 integrin4를 발현하는 숙주 세포로 의 내화를 유발할 수 있다. 숙주 세포 표면에서 발현된 S. 아우레우스, fibronectin 및 β1 내테그린의 세포 벽에 고정된 황색엽 섬유네크틴 결합 단백질 간의 삼자 상호작용은 각질, 태아 세포 및 자궁 내세포와 같은 NPPC내세의 주요 경로로 잘 알려져 있다. 최근 연구에 따르면 S. 아우레우스는 비강 식민지 화 5,6 및 감염 시 인간 세포 내부에서 발견될 수 있습니다. 그러나, S. 아우레우스 감염의 병인에 있는 세포내 저수지의 역할은 불분명합니다. 숙주 세포는 면역 계통8 및 대부분의 항균 화합물 6,9모두에서 보호되는 S. 아우레우스를 위한 피난처로 작동할 수 있었습니다.
1980년대 초 프록터10 에 의해 기술된 리소스타핀 보호 분석법은 S. 아우레우스 분리의 내화에 관여하는 세균및 호스트 요인의 연구를 가능하게 합니다. 리소스타핀은 황색포도상구균 시뮬란에 의해 생성된 박테리아로, 항생제 내성 균주를 포함하여 거의 모든 S. 아우레우스 분리에 대한 강력한 활성을 나타낸다11. Lysostaphin만 실행 가능한 세포 내 박테리아의 계산을 가능하게 하기 위하여 세포외 세포 S. 아우레우스 를 파괴하는 데 사용되었습니다12. 이 기술은 널리 사용되었으며 S. 아우레우스의 여러 독성 요인의 발견에 기여했습니다. 겐타마이신은 단독으로 리소스타핀과 결합되어 세포내 박테리아를 연구하는 데도 널리 사용됩니다.
그러나, 최근 연구는 gentamycin 진핵 세포에 입력 하 고 시간 및 농도 의존 방식으로 내면화 된 박테리아에 도달 하는 것으로 나타났다13. 이 연구는 또한 리소스타핀이 진핵 세포를 입력하지 않는다는 것을 보여주었으며, 리소스타핀 기반 효소 보호 분석(EPA)이 culture13에 의한 세포내 S. 아우레우스 부하를 정량화하는 가장 정확한 분석임을 확인하였다. 세포 외 박테리아 (예 : 리소 스타핀 또는 젠타마이신)를 파괴하는 데 사용되는 화합물에 관계없이, 그것은 천 접시에 세포 내 S. 아우레우스를 도금하기 전에 세포를 세척하여 제거해야합니다. 연속된 세차는 세포의 분리 귀착될 수 있습니다, 특히 가난한 부착 세포 (예를 들면, 심하게 감염된 세포), 세포 내 S. 아우레우스 부하의 과소 평가로 이끌어 낼 것입니다. 이 논문은 EPA가 세포내 S. 아우레우스 부하를 정량화하고 체외 모델을 사용하여 항균 화합물의 세포 내 효능을 측정하는 데 어떻게 사용될 수 있는지 자세히 설명합니다. 특히, 집중적 세정제를 피함으로써 세포내 하중 정량화의 신뢰성을 향상시키는 간단한 방법이 제안되었다.
프로토콜
1. 인간 상피 세포의 문화
- 덜벡코의 수정된 이글 배지(DMEM) 높은 포도당과 페놀 레드, 항생제 없이 10% 태아소 혈청(FBS)으로 보충하여 완전한 배양 배지를 준비한다.
- 완전한 배양 배지에서 A549 상피 세포를 5% CO2에서 36± 1°C에서 성장시다. 적절한 크기의 배양 용기의 사용을 통해 후속 단계에 충분한 셀을 갖도록 하십시오(1.10단계 참조).
참고: 75cm2(T-75) 플라스크 1개는 24웰 플레이트 2개를 시드하고 세포를 하위 배양하기에 충분합니다. - 감염 이틀 전에, 하나의 24 웰 플레이트를 준비합니다.
- T-75 플라스크에서 소비된 배양 배지를 제거하고 버리고 덜벡코의 인산완충식염(DPBS)의 10mL로 세포를 한 번 씻는다.
- 트립신-EDTA 의 5 mL를 추가하고 5 % CO2에 36 ± 1 °C에서 5 분 동안 세포를 배양한다.
- 완전한 배양 배지 5mL를 추가하고 세포를 튜브로 옮킨다.
- 30 ×0 g에서 5 분 동안 세포를 원심 분리 합니다.
- 상체를 버리고 신선한 완전한 배양 배지의 10 mL에서 세포를 다시 중단합니다.
- 자동 셀 카운터(또는 카운팅 챔버)로 셀을 계산합니다.
- 완전한 배양 배지에서 세포를 희석하여 2.0 × 105 세포/mL의 농도로 세포 현탁액의 30mL를 준비한다.
- 24웰 플레이트의 각 웰에 셀 서스펜션 1mL을 추가하여, 이는 2cm²의 웰 영역에 대해 약 1.0 × 105 셀/cm²의 세포 밀도에 해당한다.
- 36에서 48h의 세포를 1°C에 5% CO2 로 ± 100% 결합할 때까지 배양합니다.
참고: 시험할 조건 이외에, 감염일에 셀 계산을 위해 3개의 우물을 예약해야 합니다(3.1.4단계 참조). 테스트할 조건의 수에 따라 최대 24웰 플레이트를 동시에 제조할 수 있습니다. 프로토콜에 표시된 볼륨을 그에 따라 늘려야 합니다.
2 . S. 아우레우스 균주의 문화
- 감염 이틀 전, 페놀 레드 없이 DMEM 높은 포도당으로 완전한 감염 배지를 준비하며 항생제 없이 10%의 FBS로 보충합니다.
- 용동 S. 오레우스 균주는 천 접시에서 테스트할 수 있습니다.
- 36 ± 1°C에서 18-24h의 한천 판을 배양한다.
- 접종 전날, 완전한 감염 배지의 10mL에서 시험될 S. 아우레우스 균주의 한 식민지를 접종한다.
- 160 rpm에서 흔들림으로 1 °C를 ± 36에서 18-24 h에 대한 박테리아를 배양하십시오. 박테리아침을 피하기 위해 45°에서 50mL 튜브를 사용하십시오.
참고: 새로운 균주로 시작하기 전에 추가 실험(미디어, 세균 부하, 리조스타핀 농도 및 잠복기)에 사용될 동일한 문화 조건에서 리소스타핀 감수성을 확인하는 것이 좋습니다. 또한 0.5의 OD600nm 에 대응하는 세균 부하를 결정하는 것도 중요합니다. 세균성 균주의 배양 조건은 실험적인 목표에 따라 적응될 수 있었습니다.
3. S. 아우레우스감염 분석
- 세포 밀도 및 생존 가능성 의 결정
- A549 셀을 세는 데 전념하는 세 개의 우물에서 소비된 배양 배지를 제거하고 폐기합니다.
- Hoechst 33342및 1 μg/mL의 5 μg/mL을 포함하는 완전한 감염 배지 1mL를 추가합니다.
참고: Hoechst 33342는 알려진 돌연변이원이며 주의하여 처리해야 합니다. 잠재적인 돌연변이원인 프로피듐 요오드(Propidium iodide)는 해당 규정에 따라 신중하게 처리되고 안전하게 폐기해야 합니다. - 36± 1°C에서 30분 동안 5%의 CO2로 세포를 배양한다.
- 세포 수를 계산하고 휘두른 필드 형광 현미경을 사용하여 세포 생존가능성을 계산합니다.
참고: 형광 현미경을 사용할 수 없는 경우 세포 계수 챔버를 사용하여 trypan blue 염색으로 세포 밀도 및 생존가능성을 계산할 수 있습니다.
- 세균 현탁액의 준비
- 튜브에 완전한 감염 배지의 25 mL을 분배하고 36 ± 1 °C에서 미리 따뜻하게합니다.
- 세포 밀도 계를 이용하여 완전한 감염 배지에서 0.5의 anOD600nm로 S. 아우레우스 현탁액을 조정한다.
- 완전한 감염 배지에서 0.5 OD600nm 를 희석하여 세포 접종을 위한 세균현탁액 20mL를 준비하여 우물당 세포 수에 따라 1의 감염(MOI)의 복합성을 달성한다.
참고: MOI는 각 우물에서 세포당 첨가된 박테리아의 수에 해당합니다. 예를 들어, 1.0× 106개의 세포를 잘 결합한 1의 MOI를 달성하기 위해, 106 CFU를 50μL의 부피로 추가할 수 있도록 2.0 × 106 CFU/mL에서 세균현탁액을 준비한다(단계 3.3.3 참조). MOI는 시험될 세포 모형 및 세균성 긴장에 따라 조정될 수 있습니다. - 자동 나선형 플래터를 사용하여 세포 접종 단계에 사용되는 희석된 세균 현탁액의 S. 아우레우스 부하를 결정합니다.
- 36 ± 1°C에서 18-24h의 한천 판을 배양한다.
- 다음 날, 콜로니 카운터가 있는 콜로니 수를 계산하여 테스트된 각 변형에 대한 정확한 MOI를 계산합니다.
참고: 자동 나선형 플래터를 사용할 수 없는 경우, 식기 판의 직렬 희석에 의해 세균 부하를 결정할 수 있습니다. 자세한 내용은 세균 분석 매뉴얼을 참조하십시오14.
- 세포 접종
- 세포가 건강하고 예상대로 성장하는지 확인하기 위해 낮은 배율 현미경 검사법에 의해 24 웰 플레이트의 모든 우물을 관찰하십시오.
- 24웰 플레이트에서 소비된 세포 배양 배지를 제거하고 폐기합니다.
- 100% 컨실루셀로 각 우물에 접종을 위해 세균 현탁액의 500 μL을 추가합니다.
- 36± 1°C 및 5% CO2에서 2h의 세포를 배양한다.
참고: 각 조건에 대해 3개의 우물을 사용하여 테스트(triplicate)를 사용하고 적어도 세 번의 독립적인 실험을 수행하는 것이 좋습니다. 인큐베이션의 지연은 실험적 목표에 따라 적응될 수 있다.
- 향상된 효소 보호 분석(iEPA)을 가진 세포내 박테리아의 정량화
- 멸균물에 2% 트리톤 X-100의 3.5mL와 트립신-EDTA 3.5mL로 4x 리시스 버퍼 7mL를 준비한다.
- 아세테이트 버퍼에서 10 mg/mL에서 리소스타핀 스톡 솔루션을 준비하고 25 μL을 극저온으로 준비합니다. -80°C에서 최대 6개월 간 보관하십시오.
- 리소스타핀 스톡 용액(10 mg/mL)의 25 μL과 0.1 M Tris-HCl의 225 μL을 혼합하여 1 mg/mL에서 신선한 리조스타핀 작업 용액의 250 μL을 준비하십시오. 최대 48시간 동안 4°C에 보관하십시오.
- 리소스타핀 작업 용액의 완전한 감염 배지 6mL~ 250 μL을 추가하여 리조스타핀으로 보충된 완전한 감염 배지의 6.25mL를 준비한다.
- 리조스타핀으로 보충된 완전한 감염 배지 250μL을 각 우물에 넣고 접시를 손으로 휘저어 부드럽게 접시를 교반합니다.
- 리소스타핀이 세포외 박테리아를 죽일 수 있도록 5% CO2 에서 36 ± 1°C에서 1시간 동안 세포를 배양한다.
- 인큐베이션 시간이 끝나면 리조스타핀을 비활성화하기 위해 각 웰에 20 mg/mL에 10 μL의 단백질아제 K를 첨가합니다.
- 실온에서 2 분 동안 세포를 배양하십시오.
- 4배 리시스 버퍼250 μL을 추가하여 삼투성 쇼크로 세포를 리즈합니다.
- 세포를 36± 1°C에서 10분 동안 배양한다.
- 셀이 완전히 lysed 및 균질화되도록 우물 의 바닥에 10 배 위아래로 파이펫하여 철저하게 섞는다.
- 자동 나선형 플래터를 사용하여 각 웰의 S. 아우레우스 부하를 결정합니다.
- 36 ± 1°C에서 18-24h의 한천 판을 배양한다.
- 다음 날, 식민지 카운터와 식민지의 수를 계산하여 각 우물의 세포 내 S. 아우레우스 부하를 계산합니다.
- 효소 보호 분석(EPA)을 통해 항균 화합물의 세포내 효능 측정
- 멸균수3.125mL의 1x 리시스 버퍼 25mL, 멸균수 6.25mL, 멸균수 15.625mL를 준비한다.
- 리소스타핀 스톡 용액(10 mg/mL)의 25 μL과 0.1 M Tris-HCl의 225 μL을 혼합하여 1 mg/mL에서 신선한 리조스타핀 작업 용액250 μL을 준비합니다.
- 리소스타핀 작업 용액의 250 μL에 완전한 감염 배지의 24.75 mL을 추가하여 리소스타핀으로 보충된 완전한 감염 배지 25mL을 준비한다.
- 시험할 각 항균 화합물에 대해, 연구될 농도에서 리소스타핀 및 항균 화합물로 보충된 완전한 감염 배지3.1mL을 준비한다.
- 24웰 플레이트에서 소비된 세포 배양 배지를 제거하고 폐기합니다.
- 리소스타핀으로 보충된 완전한 감염 배지 1mL를 추가합니다.
- 리소스타핀이 세포외 박테리아를 죽일 수 있도록 5% CO2 에서 36 ± 1°C에서 1시간 동안 세포를 배양한다.
- 24웰 플레이트에서 리소스타핀으로 보충된 매체를 제거하고 버립니다.
- 리소스타핀과 시험할 항균 화합물로 보충된 1mL의 배지로 3개의 우물을 채웁니다.
- 시험할 각 항균 화합물에 대해 3.5.9를 반복한다.
- 대조군 조건에 대 한, 어떤 항 균 화합물 없이 리소 스타 핀으로 보충 된 매체의 1 mL와 함께 3 개의 우물을 채우기.
- 5% CO2에서 36 ± 1°C에서 24시간 동안 세포를 배양한다.
- 인큐베이션 기간이 끝나면 소비된 매체를 제거하고 폐기하고 CaCl2 및 MgCl2로 멸균 DPBS로 각각 3회 부드럽게 세척합니다.
- 1mL의 1x 리시스 버퍼를 각 웰에 추가하여 삼투성 쇼크에 의해 세포를 분리하고 리세우합니다.
- 세포를 36± 1°C에서 10분 동안 배양한다.
- 셀이 완전히 lysed 및 균질화되도록 우물 전체에 걸쳐 10 배 위아래로 파이프하여 철저하게 섞는다.
- 자동 나선형 플래터를 사용하여 각 웰의 S. 아우레우스 부하를 결정합니다.
- 36 ± 1°C에서 18-24h의 한천 판을 배양한다.
- 다음 날, 식민지 카운터와 식민지의 수를 계산하여 각 우물의 세포 내 S. 아우레우스 부하를 계산합니다.
참고: 각 항균 화합물의 세포 내 활성은 대조군 상태의 세균 부하에 따라 계산되어야 합니다. 또한 모든 항균 화합물의 세포 독성을 확인하여 대조군과 화합물 사이에 관찰된 차이가 세포 사멸 때문이 아니라는 것을 증명하는 것이 중요합니다.
결과
A549 상피 세포에 의한 S. 아우레우스 내산화의 결과는 도 1A에 묘사된다. A549 세포는 2 시간 동안 1의 MOI에서 섬유네틴 결합 단백질 A 및 B가 부족한 S. 아우레우스 SF8300 WT 및 SF8300 ΔfnbA/B로 접종하였다. 세포외 S. 아우레우스를 파괴하기 위해 리소스타핀을 배양 배지에 첨가하고 세포가 1h로 배양하였다. 다음으로, 리소스타핀은 EPA용 세척에 의해 제거되거나 iEPA용 단백질제 K로 비활성화되었다. 이어서, 세포는 리시스 완충에서 중단되었고, 세균부하는 배양에 의해 정량화되었다. EPA를 사용하여, 평균 세포 내 하중은 각각 4.46 및 0.49 로그 CFU / mLSF8300 WT 및 SF8300 ΔfnbA / B, 각각이었다 (그림 1A, 녹색 막대). iEPA를 사용하여 평균 세포 내 하중은 각각 4.53 및 0.56 로그 CFU /mLSF8300 WT 및 SF8300 ΔfnbA/B(그림 1A, 빨간색 막대)였습니다. EPA와 iEPA 모두 유사한 결과를 보였으며, 이는 세포가 양호한 상태일 때 세설을 수행하는 용이성과 이러한 실험 설정에서 S. 아우레우스 유도 세포 독성이 매우 낮기 때문에 설명될 수 있습니다(데이터는 도시되지 않음).
S. 아우레우스에 대한 반코미신, 리팜피신 및 레보플로록사신의 세포내 활성의 결과는 도 1B에 묘사된다. 이러한 항생제의 세포 내 활성을 측정하기 위해 HaCaT 세포는 2 시간 동안 1의 MOI에서 S. 아우레우스 ATCC 29213으로 접종되었다. 세포는 24시간 동안 시험할 항균 화합물의 유무에 관계없이 리소스타핀으로 배양되었다. 다음으로, 리소스타핀과 항균 화합물은 세척에 의해 제거되었다. 세포는 리시스 완충에서 중단되었고, 세균 부하는 배양에 의해 정량화되었다. 평균 세포 내 하중은 4.57, 4.51, 3.03 및 2.91 로그 CFU/mL 제어용, 반코피신(50 μg/mL), 리팜피신(7 μg/mL), 및 레보플로록사신(10μg/mL), 각각(그림 1B)이었다.
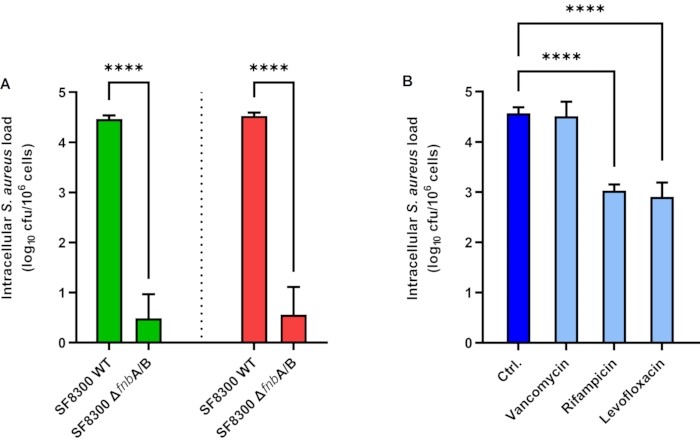
도 1: 상피 세포에 있는 세포내 황색포도상구균 소류 제. (A) 효소 보호 분석(녹색 막대) 및 S . 아우레우스 SF8300 WT및 ΔfnbA/B. (B) 세포내 항균 화합물의 세포내 활성에 감염된 A549 세포에서 효소 보호 분석(빨간 막대) 및 개선된 효소 보호 분석(red bar) . ATCC 29213. 막대는 삼중에서 수행된 세 가지 독립적인 실험의 평균 값을 나타냅니다. 오류 막대는 표준 편차를 나타냅니다. p < 0.0001. 약어: Ctrl = 제어; cfu = 식민지 형성 단위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 아스약은 NPPC에서 S. 아우레우스의 내재화 및 세포 내 생존의 정도뿐만 아니라 항균 화합물6,15,16의 세포 내 효능을 연구하는 데 유용합니다. 두 분석 프로토콜의 일부 단계는 중요할 수 있습니다. 건강 상태와 세포의 밀도는 독립적 인 실험 사이에 완벽하게 제어되고 일치해야합니다. 세균성 접종은 표적 이론적 MOI에 가까운 실제 MOI를 얻기 위해 신중하게 표준화되어야 합니다. 일반적으로, 파이펫을 하는 동안 셀을 분리하지 않도록주의해야 합니다. 리소스타핀과 항생제를 제거하는 세하는 것은 EPA에서 중요한 단계입니다. 단백질 AK의 사용은 항생제가 사용되지 않는 때이 단계를 개선하기 위해 발견되었습니다 (아래 참조). 마지막으로, 세포는 각각 의 우물에서 완전히 분리되어야하며 S. 아우레우스 내 세포 부하를 안정적으로 정량화하기 위해 용해 버퍼로 인큐베이션 후 완전히 균질화되어야합니다.
경우에 따라 문제가 발생할 수 있으며 여러 점을 먼저 확인해야 합니다. 재현성이 부족한 경우 , S. 아우레우스 가 덩어리를 형성하여 흡수력에 의한 정량화를 부정확하게 만들 수 있다는 점을 명심해야 합니다. 박테리아의 응집력은 배양 배지를 교체할 경우 원심분리 및 세척 단계에 의해 증가할 수 있다(예를 들어, 분비단백질을 제거하기 위한). 박테리아가 실온에서 계속 자라기 때문에 세균 현탁액을 신속하게 사용해야 합니다. 리소스타핀 효능은 잘못된 저장 조건, 배양 매체의 효소 활성에 대한 최적이 아닌 pH, 배치와 공급자 간의 효소 활성의 가변성, 특정 성장 조건에서 일부 균주의 리조스타핀 감도 부족으로 인해 감소할 수 있다. 페놀 레드는 박테리아 성장에 사용되는 전형적인 국물에 비해 배양 배지가 영양소가 상대적으로 좋지 않은 경우 약간의 박테리오정성 효과를 가질 수 있습니다. 따라서, 페놀 레드 없이 세포 배양 배지를 사용하는 것이 바람직하며, 이는 또한 배경 소음을 감소시킴으로써 형광 현미경 관찰을 향상시킨다.
이 방법은 다른 균주의 세포 내 운명을 연구하는 귀중한 도구이지만, 방법의 일부 한계를 고려해야한다. 매우 높은 MOI를 사용하면 NPPC에 의한 내재화 기능을 과부하시키고 테스트된 다양한 균주의 차이점을 평준화할 수 있습니다. 리소스타핀 (또는 항생제)이 손상된 세포에 의해 방출되는 S. 아우레우스 를 급속히 파괴하기 때문에 대부분의 세포 독성 균주의 내화의 정도는 과소 평가 될 수 있습니다. 따라서, 확장 된 기간 (즉, 항생제의 세포 내 생존 또는 세포 내 활성을 연구하기 위해)를 가진 실험은 낮은 세포 독성을 가진 긴장으로 설정하는 것이 더 쉽습니다. 따라서, 인큐베이션 시간 및 MOI는 스트레인 독성, 세포 유형 및 실험 목표에 따라 정확하게 조정되어야 한다.
리소스타핀을 사용하여 여기에 기재된 방법은 리소스타핀과 달리 젠타미신에 기초하여 보다 더 신뢰할 수 있기 때문에, 젠타미신은 숙주 세포에 의해 내면화되는 경향이 있다13. 다른 장점은 리소스타핀을 비활성화 할 수있는 가능성입니다. 리소스타핀 활성의 억제는 김 외 13 에 의해 아연 이온 또는 1,10-페난트로인을 chelate에 EDTA를 사용하여 보고하였다. 그러나, 집중적인 세정제는 박테리아의 도금 하기 전에 효소를 제거 하는 데 여전히 필요. 여기서, 단백질Ae K는 리소스타핀의 급속한 불활성화를 가능하게 합니다. 우리는 세포가 세포 내 S. 아우레우스의 곱셈 때문에 심하게 감염될 때 배양 판에서 분리하는 경향이 있다는 것을 관찰했습니다. 최종 세척 단계를 건너뛰면 iEPA 방법은 기술적 취급을 크게 단순화하고 느슨하게 부착된 또는 이미 분리된 세포에서 내화된 박테리아의 회수를 가능하게 했습니다.
iEPA에 사용되는 농축 시약 및 버퍼는 파이펫 팅 노력을 줄이고 셀 손실을 최소화하는 데 도움이 되었습니다. 또한 iEPA는 세포와 함께 현탁액뿐만 아니라 세척이 어려운 오르가노이드와 함께 사용할 수 있습니다. 결론적으로, 효소 보호 작용은 S. 아우레우스의 내재화 정도및 세포내 운명뿐만 아니라 체외 모델이 다른 항균제약물의 세포내 활성 에 대한 연구를 가능하게 한다. 개선은 더 나은 세포 내부 S. 아우레우스 에 도달 할 수있는 약물을 개발의 중요성을 이해하기 위해 내면화와 세포 독성 사이의 관계를 특성화하기 위해 이루어져야합니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
S. 아우레우스 균주 SF8300 WT 및 SF8300 ΔfnbA/B는 빈 디프 교수(미국 캘리포니아 대학)가 아낌없이 재능이 있었습니다. 이 작품은 리옹 대학 재단의 후원하에 FINOVI 협회 (#AO13 FINOVI)의 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 24-well plate | CORNING-FALCON | 353047 | |
| A549 cell line | ATCC | CCL-185 | |
| Acetate buffer solution pH 4.6 | Fluka | 31048 | Used to prepare lysostpahine stock solution at 10 mg/mL in 20 mM sodium acetate. |
| AMBICIN (Recombinant lysostaphin) | AMBI | LSPN-50 | Lyophilized recominant lysostaphin. Freeze at -80 °C for long-term storage. |
| COS - Colombia agar + 5% sheep blood | Biomerieux | 43049 | Any agar plate suitable for growing staphylococci can be used instead. |
| Densitometer WPA CO8000 | Biochrom Ltd. | 80-3000-45 | Cell density meter |
| Dulbecco’s Modified Eagle’s Medium, high glucose with phenol red | Sigma-Aldrich | D6429 | |
| Dulbecco’s Modified Eagle’s Medium, high glucose without phenol red | Sigma-Aldrich | D1145 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dulbecco′s Phosphate-buffered Saline with MgCl2 and CaCl2, sterile-filtered | Sigma-Aldrich | D8662 | |
| Dulbecco′s Phosphate-buffered Saline, sterile-filtered | Sigma-Aldrich | D8537 | |
| Easyspiral dilute | Interscience | 414000 | Automatic diluter and spiral plater |
| Fetal bovine serum | Gibco | 10270-106 | |
| HaCaT cell line | Cell lines service (CLS) | 300493 | |
| Hoechst 33342, Trihydrochloride, Trihydrate, 10 mg/mL Solution in Water | Fisher scientific | 11534886 | |
| Propidium iodide, 1.0 mg/mL solution in water | Invitrogen | P3566 | |
| Proteinase K, recombinant 20 mg/mL | Eurobio | GEXPRK01-B5 | > 30 U/mg, lot 901727 |
| Scan 4000 | Interscience | 438000 | Automatic colony counter |
| Sterile water | OTEC | 600500 | |
| T-75 culture flask | CORNING-FALCON | 353136 | |
| TC20 Automated cell counter | Biorad | 1450102 | Automatic cell counter |
| Tris 1 M pH 8.0 | Invitrogen | AM9855G | Used to prepare lysostaphine working solution at 1 mg/mL in 0.1 M Tris-HCl. |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin - EDTA solution | Sigma-Aldrich | T3924 | 0.05% porcine trypsin and 0.02% EDTA in Hanks′ Balanced Salt Solution with phenol red |
| Wide-field fluorescence microscope | Nikon | Ti2 |
참고문헌
- Verhoeven, P. O., et al. Detection and clinical relevance of Staphylococcus aureus nasal carriage: an update. Expert Review of Anti-Infective Therapy. 12 (1), 75-89 (2014).
- Gagnaire, J., et al. Epidemiology and clinical relevance of Staphylococcus aureus intestinal carriage: a systematic review and meta-analysis. Expert Review of Anti-Infective Therapy. 15 (8), 767-785 (2017).
- Tong, S. Y. C., Davis, J. S., Eichenberger, E., Holland, T. L., Fowler, V. G. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clinical Microbiology Reviews. 28 (3), 603-661 (2015).
- Josse, J., Laurent, F., Diot, A. Staphylococcal adhesion and host cell invasion: fibronectin-binding and other mechanisms. Frontiers in Microbiology. 8, 2433 (2017).
- Hanssen, A. -. M., et al. Localization of Staphylococcus aureus in tissue from the nasal vestibule in healthy carriers. BMC Microbiology. 17 (1), 89 (2017).
- Rigaill, J., et al. Evaluation of the intracellular efficacy of antimicrobial agents used for Staphylococcus aureus decolonization in a cell model mimicking nasal colonization. Journal of Antimicrobial Chemotherapy. 73 (11), 3044-3048 (2018).
- Yang, D., et al. Novel insights into Staphylococcus aureus deep bone infections: the Involvement of osteocytes. mBio. 9 (2), 00415-00418 (2018).
- Tuchscherr, L., et al. Staphylococcus aureus phenotype switching: an effective bacterial strategy to escape host immune response and establish a chronic infection. EMBO Molecular Medicine. 3 (3), 129-141 (2011).
- Valour, F., et al. Antimicrobial activity against intraosteoblastic Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 59 (4), 2029-2036 (2015).
- Proctor, R. A., Prendergast, E., Mosher, D. F. Fibronectin mediates attachment of Staphylococcus aureus to human neutrophils. Blood. 59 (4), 681-687 (1982).
- Climo, M. W., Ehlert, K., Archer, G. L. Mechanism and suppression of lysostaphin resistance in oxacillin-resistant Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 45 (5), 1431-1437 (2001).
- Bur, S., Preissner, K. T., Herrmann, M., Bischoff, M. The Staphylococcus aureus extracellular adherence protein promotes bacterial internalisation by keratinocytes independent of fibronectin-binding proteins. Journal of Investigative Dermatology. 133 (8), 2004-2012 (2013).
- Kim, J. -. H., Chaurasia, A. K., Batool, N., Ko, K. S., Kim, K. K. Alternative enzyme protection assay to overcome the drawbacks of the gentamicin protection assay for measuring entry and intracellular survival of Staphylococci. Infection and Immunity. 87 (5), 00119 (2019).
- Aerobic plate count. Bacteriological Analytical Manual., Edition 8, Revision A Available from: https://www.fda.gov/food/laboratory-methods-food/bam-chapter-3-aerobic-plate-count (2021)
- Kolenda, C., et al. Evaluation of the activity of a combination of three bacteriophages alone or in association with antibiotics on Staphylococcus aureus embedded in biofilm or internalized in Osteoblasts. Antimicrobial Agents and Chemotherapy. 64 (3), 02231 (2020).
- Abad, L., et al. Antibiofilm and intraosteoblastic activities of rifamycins against Staphylococcus aureus: promising in vitro profile of rifabutin. Journal of Antimicrobial Chemotherapy. 75 (6), 1466-1473 (2020).
Erratum
Formal Correction: Erratum: Improved Enzyme Protection Assay to Study Staphylococcus aureus Internalization and Intracellular Efficacy of Antimicrobial Compounds
Posted by JoVE Editors on 1/19/2022. Citeable Link.
An erratum was issued for: Improved Enzyme Protection Assay to Study Staphylococcus aureus Internalization and Intracellular Efficacy of Antimicrobial Compounds. One of the affiliations was updated.
The fifth affiliation was updated from:
Département de Bactériologie, Institut des Agents Infectieux, Hospices Civils de Lyon, Lyon, France
to:
Department of Bacteriology, Institute for Infectious Agents, Hospices Civils de Lyon, Lyon, France
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유