Method Article
미세 유체 장치에서 기능성 신경 근육 접합을 갖춘 인간 모터 유닛 생성
요약
당사는 인간 원발성 메소포스트 유래 근투와 인간 유도만능 줄기 세포 유래 모터 뉴런을 공동 배양하여 상업적으로 이용 가능한 미세유체 장치에서 인간 모터 유닛을 생성하는 방법을 설명하며, 이로 인해 기능적으로 활성 신경 근육 접합이 형성된다.
초록
신경 근육 접합부 (NMJs)는 하부 운동 뉴런의 축록스와 근육 수축의 참여를 촉진하는 근육 사이의 전문 시냅스입니다. 근위축성 측삭 경화증(ALS) 및 척추 근육 위축(SMA)과 같은 운동 신경 장애에서 NMJ는 퇴화하여 근육 위축과 점진적 마비를 초래합니다. NMJ 퇴화의 기본 메커니즘은 알 수 없습니다., 주로 번역 가능한 연구 모델의 부족으로 인해. 이 연구는 기능성 NMJ가 있는 인간 모터 유닛의 다재다능하고 재현 가능한 체외 모델을 만드는 것을 목표로 했습니다. 따라서 인간 유도만능 줄기세포(hiPSC)-유래 모터 뉴런 및 인간 1차 중혈관지블라스트(MAB)-유래 심포우투는 시판적으로 이용 가능한 미세유체 장치에서 공동 배양되었다. 유동적으로 분리된 마이크로 구획을 사용하면 세포별 마이크로환경을 유지관리하면서 마이크로그루브를 통해 세포간 접촉을 허용할 수 있습니다. 화학 및 체적 그라데이션을 적용함으로써, 심오튜브 상호 작용과 NMJs의 형성을 촉진하는 마이크로그루브를 통해 모터 뉴런 뉴라이트의 성장이 자극되었다. 이들 NMJs는 운동 뉴런 전시냅틱 마커 시냅토피신(SYP)과 포스트냅스 아세틸콜린 수용체(AChR) 마커 α-분가로톡신(Btx)의 공동 국소화를 통해 면역세포화학적으로 확인되었으며, 스캐닝 전자 현미경(SEM)을 이용한 형태학적 특성화. NMJs의 기능은 운동 뉴런의 탈극성 시 심오튜브에서 칼슘 반응을 측정하여 확인되었습니다. 표준 미세 유체 장치와 줄기 세포 기술을 사용하여 생성 된 모터 장치는 건강과 질병에 있는 NMJs에 초점을 맞춘 미래 연구를 도울 수 있습니다.
서문
NMJs는 신경 전달 물질의 방출을 통해 낮은 척추 운동 뉴런과 골격 근육 섬유 사이의 통신을 용이하게1. ALS 및 SMA 같이 운동 신경 무질서에서, NMJs는 근육과의 통신에 있는 중단을 일으키는 원인이 되는 퇴화2,3,4,5,6,7. 이것은 환자가 점차적으로 그들의 근육 기능을 분실귀착되는 결과, 그(것)들을 휠체어 에 묶는 원인이 되고 결국 다이어프램 같이 중요한 근육 단의 진보적인 위축 때문에 호흡 생활 지원에 의존하게 합니다. 이 무질서에 있는 NMJs의 이 심오한 손실에 책임 있는 정확한 근본적인 기계장치는 불명합니다. 많은 연구는 트랜스 제 동물 모델에 수행 되었습니다., NMJ 변성의 발병에 대 한 몇 가지 통찰력을 준 5,6,8,9,10,11. 그러나 병리학을 완전히 이해하고 기만에 대응하기 위해 완전한 접근성을 허용하는 인간 시스템을 갖는 것이 중요합니다.
여기서, 프로토콜은 시판되는 마이크로 유체 장치를 사용하여 hiPSC 유래 모터 뉴런 및 인간 1차 MAB 유래 근구의 공동 배양을 통해 인간 NMJ를 생성하는 비교적 간단한 방법을 설명합니다. 뉴런의 소마와 축축을 편광하고 유동적으로 분리하기 위해 미세 유체의 사용은 1970 년대 후반에 'Campenot'챔버12의 첫 번째 설명 부터 알려져있다. 그 이후로 상업적 옵션을 포함하여 더 많은 미세 유체 설계가 제작되었습니다. 이 프로토콜에 사용되는 장치에는 두 개의 구획이 포함되어 있으며 각 구획은 channel13과 연결된 두 개의 우물로 구성됩니다. 두 구획은 미러로 되어 여러 마이크로그루브로 연결됩니다. 이러한 마이크로그루브에는 모세관 유압 13,14를 통해 두 구획 간의 유체 절연을 유지하면서 중성기 성장을 용이하게 하는 크기가 있습니다. 이 시스템을 사용하여, 다른 하나의 구획및 근육 세포에 모터 뉴런을 배양 할 수 있습니다, 그들의 특정 배양 배지에 각각, 여전히 마이크로 그루브를 통과하고 근육 세포와 참여 중성염을 통해 물리적 연결을 촉진하면서. 이 모델은 ALS 및 SMA와 같은 질병의 초기 NMJ 병리학을 연구하는 데 사용할 수있는 인간 모터 장치의 완전히 접근 가능하고 적응 가능한 체외 시스템을 제공합니다.
프로토콜
iPSC 생성 및 MAB 수확을 위해 샘플을 제공한 모든 피험자로부터 서면 통보 동의를 얻었습니다. 절차는 대학 병원 루벤 (n ° S5732-ML11268)의 의료 윤리위원회와 StemBANCC 프로젝트의 일환으로 영국의 주요 연구 윤리위원회에 의해 승인되었습니다. 이 프로토콜에 사용되는 모든 시약 및 장비는 재료 표 에 나열되어 있으며 멸균을 사용해야 합니다. 미디어가 달리 지정되지 않는 한 사용하기 전에 RT(실온)로 가열해야 합니다. 공동 문화 프로토콜에 대한 개요는 그림 1을 참조하십시오.
1. iPSCs에서 운동 신경 선조의 차별화
- 이전 연구에서 적응된 운동 뉴런 분화 프로토콜15를 따라 10일 신경 전구(NPC) 상태에 도달할 때까지. 프로토콜의 기간에 따르면, 차별화는 월요일 (0 일)에 시작되며, 목요일에 10 NPC가 발생합니다.
- 냉동 보존 일 10 NPC는 유리병 당 2 x 106- 4 x 106 세포의 밀도에서 10 % 디메틸 설산화물 (DMSO)와 녹아웃 혈청 교체.
주의: DMSO는 독성이 있습니다: 개인 보호 장비가 있는 연기 후드에서 처리하십시오.
참고: 10개의 NPC는 해동 시 매우 중요할 것으로 예상되는 날의 약 50%가 될 것으로 예상됩니다. 이 '일 10 NPC' 상태에서 모터 뉴런 분화 프로토콜을 중지하고 NPC를 냉동보존하여 많은 수의 NPC를 생성하여 나중에 뱅크및 사용할 수 있으며, 공동 배양 프로토콜의 전체 타임라인의 길이를 총 28일에서 19일로 줄입니다.
2. 인간 MAB의 파생 및 유지 보수
참고: MABs는 58 세의 건강한 기증자로부터 얻은 생검에서 수확 된 용기 관련 중간 엽 줄기 세포입니다. 대체 상용 소스를 사용할 수 있습니다. MAB를 얻기 위한 프로토콜은 간략하게 설명됩니다. 자세한 내용은 자세한 프로토콜17을 참조하십시오. 모든 MAB 미디어는 사용하기 전에 37°C로 가열되어야 합니다.
- 생검 조직을 다진 콜라겐(송아지 피부에서)은 2주 동안 성장 배지(표 1)에서 6cm 의 요리를 코팅하였다. 4일마다 매체를 변경합니다.
- 콜라겐 코팅을 준비하려면 0.1 M 아세트산의 20mL에 콜라겐 100 mg을 녹입니다. 콜라겐은 용해하는 데 시간이 걸리므로 RT에서 밤새 흔들리는 플랫폼에 혼합물을 놓습니다. 다음 날, ddH2O의 80mL를 100mL의 최종 부피로 위로 올려다보며.
주의: 아세트산은 독성이 있습니다. 개인 보호 장비가있는 연기 후드에 손잡이.
참고: 송아지 가죽 코팅의 콜라겐은 최대 5배까지 재사용할 수 있습니다. 4 °C에 보관하십시오. - 접시의 전체 표면이나 플라스크를 콜라겐으로 코팅하고 라미나르 흐름 내부의 RT에서 20 분 동안 닫고 인큐베이션하십시오. 20분 후, 신선한 용기에 콜라겐을 회수하고 빈 접시/플라스크를 닫고 라미나르 흐름의 RT에서 10분 동안 둡니다.
- 접시/플라스크를 인큐베이터로 하룻밤(또는 최소 6시간) 인큐베이션(37°C, 5% CO2)에 옮기다. 세포를 도금하기 전에 칼슘이나 마그네슘(DPBS) 없이 덜벡코의 인산염 완충식식염으로 5배 세척합니다.
- 콜라겐 코팅을 준비하려면 0.1 M 아세트산의 20mL에 콜라겐 100 mg을 녹입니다. 콜라겐은 용해하는 데 시간이 걸리므로 RT에서 밤새 흔들리는 플랫폼에 혼합물을 놓습니다. 다음 날, ddH2O의 80mL를 100mL의 최종 부피로 위로 올려다보며.
- 14일 후, FACS(형광 활성 세포 선별)는 인간 알칼리성 인산염17 을 위해 MAB를 정렬한 다음 추가 확장이 뒤따릅니다. 콜라겐 코팅 T75 플라스크에 대한 MAB를 성장 배지에서 유지하고 2일마다 성장 배지를 변경합니다(플라스크당 10mL).
- 70%의 합류에 도달할 때 기기에서 냉동 보존, 통로 또는 종자 MAB를 종자.
참고: MABs는 세포 대 세포 접촉시 자발적인 융합으로 인해 근생 잠재력을 잃습니다. MAB를 확장할 때 70%의 합류를 초과하지 않도록 하십시오. 1개의 70% confluent T75 플라스크는 약 600,000-800,000개의 세포를 포함하고 있으며, 이는 유리병 당 100,000개의 세포에서 냉동 보존될 수 있습니다. 각 바이알은 나중에 해동하여 확장을 위해 T75 플라스크에 씨를 뿌린 다수 있습니다. - MAB를 통과하려면, 부드럽게 DPBS의 7 mL로 한 번 세척한 다음 세포를 해리하기 위해 5 % CO2 에서 3 7 분 동안 MAB 해리 용액7 mL로 배양합니다.
- 성장 배지의 7mL로 MAB 해리 용액을 중화시키고, 세포를 부드럽게 긁어내고, 세포 현탁액을 50mL 원심분리기 튜브로 이송한다. 잠재적으로 남은 MAB를 수집하기 위해 성장 매체의 5mL를 추가로 부드럽게 씻으십시오.
- 300 x g에서 3 분 동안 세포 현탁액을 원심 분리한 다음 확장을 위해 새로운 콜라겐 코팅 T75 플라스크로 직접 통과, 10 % DMSO로 녹아웃 혈청 교체에서 냉동 보존 또는 미세 유체 장치에서 씨앗에 계산.
참고: 구절은 최대 통과 수13까지 셀 확장을 위해 주당 1x-2배수행됩니다. 해리시, MABs는 현미경의 밑에 검토될 때 구형 및 큰 모양으로 나타납니다.
3. 사전 조립 된 미세 유체 장치의 준비 - 9 일
참고: 이 프로토콜은 미세 유체 장치 제조업체의 뉴런 장치 프로토콜에서 적용되었으며 사전 조립 및 실리콘 장치를 모두 사용하기 위해 조정되었습니다. 여기서, 사전 조립된 장치는 면역 세포 화학 (ICC) 및 살아있는 세포 칼슘 과도 기록에 사용되며 실리콘 장치는 SEM에 사용됩니다. 프로토콜의 타임라인은 모터 뉴런 분화 프로토콜에 대한 타임라인을 따릅니다.
- 코팅이 하룻밤 동안 배양해야하기 때문에 종자 세포가 종자하기 전날 미세 유체 장치를 준비하십시오. 모터 뉴런 프로토콜에 따르면, 이것은 수요일이 될 것입니다. 페트리 접시에 70%-100% 에탄올의 ~10mL를 넣습니다. 집게를 사용하여 선적 용기에서 페트리 접시로 장치를 전송하여 멸균합니다.
- 장치를 에탄올에 10초 동안 잠수하고 집게로 장치를 종이로 전송하여 -30분 동안 라미나르 흐름에서 공기 건조시합니다. 장치를 몇 번 뒤집어 양쪽이 건조할 수 있도록 합니다. 장치가 건조하면 집게를 사용하여 각 장치를 개별 10cm 페트리 접시로 이동하여 쉽게 취급할 수 있습니다.
주의: 에탄올은 독성이 있습니다. 개인 보호 장비가있는 연기 후드의 손잡이 - DPBS에서 폴리-L-오르니틴(PLO)(100 μg/mL)으로 장치를 코팅하고 37°C에서 인큐베이션, 3시간 동안 5% CO2 를 배양한다.
- P200 파이펫을 사용하여 DPBS 상단에 100 μL의 PLO를 추가하고 가능한 한 채널 개구부에 가깝고 채널을 통해 위쪽에서 잘 통과하는 유체를 잘 관찰합니다. 그 후 DPBS에 PLO 100 μL을 잘 넣습니다.
- 마이크로그루브의 반대편에서 반복하고 장치의 한쪽에 100 μL을 추가하여 마이크로그루브(예를 들어, 오른쪽 200 μL, 왼쪽 300 μL)를 코팅하는 장치의 두 미러 측 사이의 체적 그라데이션을 생성합니다. 3 시간 후, DPBS로 5 분 동안 장치를 3 배 세척하십시오. 필요한 경우 흡입 시스템을 사용합니다.
참고: 세포의 코팅 또는 배양 중에 채널의 기포 형성을 피하십시오. 작은 거품조차도 짧은 시간 동안 확장되어 코팅, 세포 파종 또는 채널 전체의 미디어 흐름을 억제합니다. 코팅 중에 유체가 채널에서 멈추면 PLO 용액을 양쪽에서 채널로 직접 재보선합니다. 기포가 여전히 존재하는 경우, DPBS의 200 μL을 사용하여 채널을 플러시하고 3.3.1-3.3.2 단계에서 위에서 언급한 대로 코팅 공정을 반복하십시오. 세포 파종 후 거품이 나타나면 채널을 플러싱하면 셀이 손상되기 때문에 장치를 복구하는 것은 불가능합니다.
- 신경물질 배지에 라미닌(20 μg/mL)으로 장치를 코팅하고 37°C, 5% CO2에서 하룻밤 동안 배양한다. 3.3.1-3.3.2 단계에서 PLO 코팅에 대한 동일한 지침을 따르십시오.
- 다음 날, P200 파이펫을 사용하고 우물에서 라미닌 코팅을 제거하기 위해 채널 개구부와 반대되는 우물에 팁을 배치한다. 모든 우물에 DPBS를 추가하고 셀 파싱을 위해 RT의 라미나르 흐름에 DPBS를 사용하여 장치를 둡니다.
참고: 이 시점부터는 기포 형성을 유발할 수 있으므로 채널에서 직접 액체(라미닌 코팅, DPBS, 미디어, 고정 용액 등)를 제거하지 않는 것이 중요합니다. 세포를 파종하기 전에 현미경으로 장치를 항상 검사하십시오.
4. 실리콘 미세 유체 장치의 준비 - 9 일
- 코팅이 하룻밤 동안 배양해야하므로 세포를 파종하기 전날 실리콘 미세 유체 장치를 준비하십시오. 모터 뉴런 프로토콜에 따르면, 이것은 수요일이 될 것입니다.
- 페트리 접시에 70%-100% 에탄올의 ~10mL를 넣습니다. 집게를 사용하여 선적 용기에서 페트리 접시로 장치를 전송하여 멸균합니다. 장치를 10초 동안 에탄올에 담그고 6웰 플레이트에서 잘 포셉으로 이송하여 라미나 유동에서 30분 동안 공기건조시다. 모든 면이 건조 할 수 있도록 측면에 장치를 배치합니다.
- SEM 시트를 장치의 크기로 줄입니다(양쪽에 몇 mm를 남겨 둡니다). 상기 4.1.1 단계에서 위에서 언급한 바와 같이 살균을 반복한다. 그런 다음, 10cm 페트리 접시에 집게로 전달하여 건조시다. 2-3 SEM 시트는 하나의 접시에 맞습니다.
- DPBS에서 PLO(100 μg/mL)로 장치 및 SEM 시트를 코팅하고 37°C에서 인큐베이션, 3h에 5% CO2 를 배양한다.
- 6웰 플레이트의 각 장치에 잘 DPBS에 1mL의 PLO를 추가합니다. 장치가 채널과 마이크로그루브 면이 액체를 아래로 향하여 PLO 용액 위에 떠 있는지 확인합니다. 10cm 페트리 접시당 DPBS에 10mL의 PLO를 추가하고 집게를 사용하여 SEM 시트를 액체로 밀어 넣습니다.
참고: SEM 시트는 일반적으로 코팅 용액 위에 떠 있습니다. 장치와 시트를 조립하기 전에 PLO와 접촉한 표면이 장치의 채널 및 마이크로그루브 표면에 접촉할 수 있도록 SEM 시트를 돌립니다. - 3 시간 후, DPBS로 5 분 동안 장치와 SEM 시트 2x를 세척한 다음 멸균 물로 5 분 동안 다시 씻습니다. 필요한 경우 흡입 시스템을 사용합니다. 각 SEM 시트를 개별 10cm 페트리 접시에 전달하여 손쉽게 취급할 수 있습니다.
참고: 장치와 SEM 시트 모두 조립 전에 완전히 건조해야 합니다. 멸균물로 최종 세척하면 DPBS에서 잠재적인 소금 결정을 제거하여 조립을 방해할 수 있습니다.
- 6웰 플레이트의 각 장치에 잘 DPBS에 1mL의 PLO를 추가합니다. 장치가 채널과 마이크로그루브 면이 액체를 아래로 향하여 PLO 용액 위에 떠 있는지 확인합니다. 10cm 페트리 접시당 DPBS에 10mL의 PLO를 추가하고 집게를 사용하여 SEM 시트를 액체로 밀어 넣습니다.
- 라미나르 흐름의 현미경으로 작업하십시오. 집게를 사용하여 채널과 마이크로그루브 면을 SEM 시트에 90° 각도로 아래로 장착하여 모든 면이 정렬되도록 합니다. 장치를 가볍게 눌러 외부 가장자리뿐만 아니라 우물, 채널 및 마이크로 홈 을 밀봉해야합니다.
참고: 본딩 영역은 회색으로 나타나고 아직 장착되지 않은 영역은 현미경으로 명확하게 나타납니다. 모든 영역이 기포 없이 잘 밀봉되어 있는지 확인하여 배양 중에 장치의 분리를 방지하십시오. 이물질이나 소금 결정이 장착을 차단하는 경우, SEM 시트와 장치를 멸균물로 재세척하고 장착 절차를 다시 시도하기 전에 건조시. 마이크로그루브가 장치에서 너무 세게 누르는 것으로 왜곡된 것처럼 보이면 SEM 시트에서 장치를 완전히 제거하고 마운팅을 다시 시도합니다. 장치가 장착되면 용지를 코팅하고 변경할 때주의하십시오. - 라미나르 흐름의 현미경으로 작업하십시오. 신경물질 배지에 라미닌(20 μg/mL)으로 장치를 코팅하고 37°C, 5% CO2에서 하룻밤 동안 배양한다.
참고: 하룻밤 잠복은 실리콘 장치를 강화하고 SEM 시트에 더 밀봉합니다.- P200 파이펫을 사용하여 상단에 라미닌 용액의 100 μL을 추가하고 가능한 한 채널 개구부에 가깝고 채널을 통해 위쪽에서 잘 통과하는 유체를 잘 관찰합니다. 우물과 채널 주위에 누출을 확인합니다.
- 그 후, 100 μL의 라미닌 용액을 바닥에 잘 넣고 누설을 확인합니다. 마이크로그루브의 반대편에서 반복하고 장치의 한쪽에 100 μL을 추가하여 마이크로그루브(예를 들어, 오른쪽 200 μL, 왼쪽 300 μL)를 코팅합니다.
참고: 누설시 라미닌 코팅을 제거하고 장치와 SEM 시트를 분해하고 멸균 수로 모두 세척하십시오. 4.3 단계에서 건조하고 반복하십시오. - 다음 날, 채널 개구부 맞은편에 팁을 배치하여 P200 파이펫으로 우물에서 코팅을 제거합니다. 모든 우물에 DPBS를 추가하고 셀 파싱을 위해 RT의 라미나르 흐름에 DPBS를 사용하여 장치를 둡니다.
참고: 이 시점부터는 기포 형성을 유발할 수 있으므로 채널에서 직접 액체(라미닌 코팅, DPBS, 미디어, 고정 용액 등)를 제거하지 마십시오. 세포를 파종하기 전에 현미경으로 장치를 항상 검사하십시오.
5. 미세 유체 장치에서 NPC도금 - 10 일
참고 : 모터 뉴런 분화 프로토콜15에 따르면, 일 10 NPC의 도금은 목요일에 발생합니다.
- 신선하게 해리된 날 10 NPc15를 사용하거나, 10mL당 뱅크된 NPC의 1-2 바이알을 10mL당 10mL(표 2 및 표 3)로 ROCK 억제제(10 μL/mL) 용액으로 사용하고, 세포 현탁액을 100 x g 에서 4분 동안 원심분리한다.
- ROCK 억제제(10 μL/mL) 용액을 사용하여 하루 10개의 모터 뉴런 배지의 500-1000 μL에서 세포 펠릿을 재보중단하고 선호하는 계수 방법을 사용하여 살아있는 세포를 계산한다.
참고: 아래에 명시된 바와 같이 최적의 시드 볼륨을 수용하기 위해 NPC를 올바른 양의 미디어로 다시 일시 중단해야 합니다. - P200 파이펫을 장착한 장치의 마이크로홈 의 한쪽에 있는 두 개의 우물에서 DPBS를 제거하고 10일 모터 뉴런 미디어의 60-100 μL에서 장치당 250,000NPC를 시드한다.
- 오른쪽 상단에있는 셀 서스펜션 (125,000 셀)의 시드 30-50 μL은 45 ° 각도로 채널 개구부에 가까운 파이펫 팁으로 우물의 중심을 향해 나머지 유체를 부드럽게 드래그합니다.
- 셀 서스펜션이 채널을 통해 흐를 수 있도록 몇 초 동안 일시 중지한 후 하부 우물(30-50 μL의 125,000세포)에서 이를 반복합니다. 펜을 사용하여 시드 측 "NPC" 또는 이에 상응하는 표시를 사용하여 현미경없이 장치의 쉬운 방향을 설정합니다.
- 장치를 37°C, 5% CO2 에서 5분 동안 배양하여 2종웰을 추가로 10일 모터 뉴런 배지(총 200 μL/well)로 토핑하기 전에 세포 부착을 허용하고 37°C, 5% CO2에서 다시 배양한다.
참고: 각 우물에는 우물과 채널 모두에서 200 μL. 시드 셀이 포함될 수 있으며, 이는 배지 변화 시 세포 분리의 위험을 낮춰 배양의 견고한 구조를 보장합니다. 단지 채널에서 적은 세포를 시드 할 수 있습니다. 그러나 이렇게 하면 각 중간 변경 중에 채널을 통해 볼륨 전류에 문화가 더 취약해집니다.
- P200 파이펫을 사용하여 갓 시드된 NPC 맞은편에 있는 두 개의 우물에서 DPBS를 제거합니다. 이어서, 배양 중 배지의 증발을 방지하기 위해 장치 주위에 10cm 접시당 DPBS 6mL을 추가한다.
참고: 필요한 경우 배양 기간 동안 장치 주위에 DPBS를 추가합니다. - 11일(금), 14일(월), 16일(수) (표 2 및 표 3)에 두 구획모두에서 전체 모터 뉴런 중간 변화를 수행한다. 중간 변화의 날에 신선한 미디어 보충제를 추가합니다.
참고: 이 시점부터 P200 파이펫으로 모든 중간 변경 사항을 수행합니다. 항상 파이펫 팁을 우물 가장자리의 채널에서 멀리 배치하고 채널에서 직접 액체를 제거하지 않습니다. 실리콘 장치를 분리하지 않도록주의하십시오. 매체를 제거하고 추가하려면 세포 분리를 방지하기 위해 천천히 수행해야 합니다.- 채널 열기 맞은편 웰 월의 하단 가장자리에 P200 파이펫 팁을 배치하여 NPC와 함께 두 우물의 모든 미디어를 신중하게 제거합니다. 채널 개구부 맞은편 웰 월의 상단 가장자리에 P200 파이펫 팁을 배치하여 신선한 모터 뉴런 배지의 50-100 μL을 천천히 상단에 배치합니다.
- 몇 초 동안 일시 중지하여 배지가 채널을 통해 흐를 수 있도록 한 후 모터 뉴런 배지의 50-100 μL을 바닥에 잘 추가합니다. 두 우물이 200 μL/웰을 포함할 때까지 이 과정을 신중하게 반복합니다. 셀없이 측면에 반복합니다.
6. 미세 유체 장치에서 MAB의 도금 - 17 일
- 약 7일 전에 미세유체 장치(운동 뉴런 분화의 10일째)에서 MAB를 해동하고 콜라겐으로 코팅된 T75 플라스크에서 성장 매체(표 1)에서 종자해하여 충분한 세포 확장을 가능하게 한다. 섹션 2를 참조하십시오.
- 17일 운동뉴런 분화(Thursday)의 날, 단계 2.4에서 설명된 바와 같이 MAB를 해리시키고, 성장 배지의 ~500 μL에서 세포 펠릿을 재보중단하고 임의의 바람직한 계수 방법을 사용하여 살아있는 세포를 계산한다.
참고: 아래에 명시된 바와 같이 최적의 시드 볼륨을 수용하기 위해 MAB를 올바른 양의 매체로 다시 일시 중단해야 합니다. - P200 파이펫을 가진 장치에서 마이크로그루브의 시드되지 않은 측의 모터 뉴런 배지를 제거하고 DPBS로 부드럽게 세척하고, 60-100 μL의 성장 배지에서 장치당 200,000 MABs를 시드한다.
- 오른쪽 상단에는 45° 각도로 채널 개구부에 가까운 셀 서스펜션(100,000셀)의 30-50 μL을 시드하고 파이펫 팁으로 우물 의 중심을 향해 나머지 유체를 부드럽게 드래그합니다. 낮은 우물에서 반복하기 전에 채널을 통해 세포의 흐름을 허용하기 위해 몇 초 동안 일시 중지 (30-50 μL에서 100,000 세포).
- 장치를 37°C, 5% CO2 에서 5분 동안 배양하여 2개의 갓 MAB 시드 우물을 추가 성장 배지(총 200 μL/well)로 토핑하기 전에 세포 부착을 허용합니다. 37°C, 5% CO2에서 다시 배양합니다.
참고: 장치의 모터 뉴런 측에서 17일째에는 중간 변화가 필요하지 않습니다. 17일째 이전에 발표된 모터 뉴런 분화 방법에 따른 중간 변화15 는 18일(금)에 수행된다.
7. MAB 구획을 향한 모터 뉴너리의 성장을 촉진하기 위해 체적 및 화학 적 그라데이션의 구현
- 18일째, 18일째 운동 뉴런 배지(200 μL/웰)를 통해 모터 뉴런 측에서 전체 중간 변화를 수행한다. 5.5.1-5.5.2 단계에서 언급된 중간 변경 사항에 대한 지침을 따르십시오. 장치의 MAB 구획에서 MAB 차별화를 시작합니다(표 2 및 표 4).
- 소열된 MAB 분화 매체(표 4)를 인간 아그린(200 μL/웰)으로 보충한 예열된 MAB 분화 매체(표 4)를 추가하기 전에 MAB 구획을 DPBS로 한 번 조심스럽게 세척합니다.
참고 : MABs는 1 주일의 시간 과정을 통해 융합 된 여러 개의 myotubes를 형성합니다.
- 소열된 MAB 분화 매체(표 4)를 인간 아그린(200 μL/웰)으로 보충한 예열된 MAB 분화 매체(표 4)를 추가하기 전에 MAB 구획을 DPBS로 한 번 조심스럽게 세척합니다.
- 21일, 운동 뉴런 분화 프로토콜(월요일)에 따르면, 화학및 체피그라데이션(표 2 및 표 3)을 개시한다.
- 뇌 유래 신경 영양인(BDNF), 신경세포선 유래 신경영양인자(GDNF) 및 실의 30 ng/mL로 모터 뉴런 기저형 배지 200μL/웰 추가 심뢰구획(이전에 MAB 구획으로 정의됨)에 대한 신경영양인자(CNTF), 인간 아그린(0.01 μg/mL), 라미닌(20 μg/mL). 운동 뉴런 컴파트먼트에 성장 인자 없이 운동 뉴런 기저형 배지(100 μL/well)를 추가합니다.
- 운동 뉴런 분화의 28일까지 2일마다 7.2단계를 반복한다. 주말에는 미디어 변경이 필요하지 않습니다.
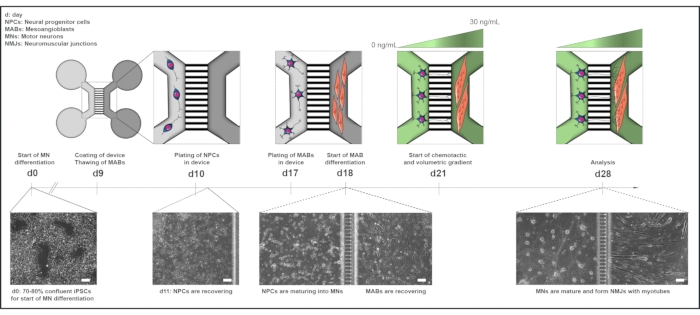
그림 1: 미세 유체 장치에서 모터 단위 프로토콜의 회로도 개요. 모터 뉴런 분화 프로토콜22의 타임라인에 따라 0일부터 28일까지의 분화 타임라인 및 공동 배양 개요. iPSC로부터의 운동 뉴런 분화는 0일째에 시작되어 다음 10일 15일에 대해 이전에 명시된 대로 수행된다. 9일째에 이 장치는 살균되어 PLO-laminin으로 코팅됩니다. MAB는 T75 플라스크에서 확장을 위해 해동됩니다. 10일째되는 날, 모터 뉴런-NPC는 우물과 장치의 하나의 구획(라이트 그레이)의 채널모두에서 도금되며, 여기서 모터 뉴런으로의 차별화가 일주일 동안 계속된다. MAB는 17일째에 우물과 반대 구획(다크 그레이)의 채널모두에서 도금됩니다. 18일째, MAB는 myotubes로 의차별화가 시작되었습니다. 21일, 장치의 마이크로그루브를 통해 운동 뉴런-중성염 편광을 촉진하기 위해 체피 및 화학적 그라데이션이 설치된다. 모터 뉴런 컴파트먼트는 성장 인자(밝은 녹색 구획)가 없는 모터 뉴런 기저 배지 100μL/웰을 받았으며, 심오튜브 컴파트먼트는 30ng/mL의 성장 인자(다크 그린 컴파트먼트)(표 2 및 표 3)를 갖춘 모터 뉴런 기저배지 200μL/웰을 받았다. 배양은 28일째분석전까지 7일 동안 체피 및 화학적 그라데이션으로 계속된다. 밝은 필드 이미지는 0일, 11일, 18일, 28일째에 사전 조립된 미세유체 장치에서 배양된 세포 형태를 보여줍니다. 스케일 바, 100 μm. 이 수치는 스토클룬드 디틀라우, K. 외.18에서 수정되었습니다. 셀 일러스트레이션은 스마트 서버 의료 Art22에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 고정 및 ICC
참고: 모든 단계는 신경 배양의 분리를 방지하기 위해 신중하게 수행해야합니다. 다음 단계에서채널에서 액체를 제거하지 마십시오.
- 연기 후드 또는 라미나르 흐름에 고정을 수행 : 신중하게 고정하기 전에 DPBS와 함께 한 번 장치의 모든 우물을 세척. 라미나르 흐름(100 μL/웰)에서 RT에서 15-20분 동안 DPBS에서 4% 파라포름데히드(PFA)를 사용하여 수정합니다.
주의 : PFA는 독성 : 개인 보호 장비와 연기 후드에 핸들.- 조심스럽게 장치의 상단 우물에 100 μL을 추가하고 고정 솔루션이 잘 바닥에 100 μL을 추가하기 전에 채널을 통해 흐를 수 있도록 몇 초 기다립니다. 다른 쪽에서 반복합니다. 인큐베이션 후 PFA 용액을 제거하고 DPBS로 5 분 동안 3 배 부드럽게 씻으십시오. 200 μL/well DPBS를 보관하고 ICC 실험전까지 4°C에 보관할 파라필름으로 10cm 페트리 접시를 밀봉하십시오.
참고: 저장 중에 장치가 건조되지 않도록 하십시오.
- 조심스럽게 장치의 상단 우물에 100 μL을 추가하고 고정 솔루션이 잘 바닥에 100 μL을 추가하기 전에 채널을 통해 흐를 수 있도록 몇 초 기다립니다. 다른 쪽에서 반복합니다. 인큐베이션 후 PFA 용액을 제거하고 DPBS로 5 분 동안 3 배 부드럽게 씻으십시오. 200 μL/well DPBS를 보관하고 ICC 실험전까지 4°C에 보관할 파라필름으로 10cm 페트리 접시를 밀봉하십시오.
- ICC 절차의 첫날 RT에서 20 분 동안 DPBS에서 0.1 % 트리톤 X-100의 투과 성액 (100 μL /well)으로 세포를 배양합니다. 투과성 용액을 제거하고 RT에서 30분 동안 0.1% 트리톤 X-100/DPBS 용액(100 μL/well)에 5% 일반 당나귀 세럼을 추가합니다.
- 5% 일반 당나귀 혈청 용액을 제거하고, 0.1% Triton X-100/DPBS 용액으로 2% 정상 당나귀 혈청에서 1차 항체(재료표)를 가진 장치를 배양하고 하룻밤 사이에 4°C에서 배양한다.
- 볼륨 그라데이션을 구현합니다. 마이크로그루브의 한쪽에 100 μL/웰의 항체 용액을 추가하고 다른 쪽에는 150 μL/잘 넣습니다(장치당 총 500μL).
참고: 마이크로홈의 양쪽에 상이한 항체를 사용할 수 있습니다. 이 경우, 구획 간의 유체 절연을 유지하기 위해 마이크로홈을 가로질러 1차 또는 이차 항체를 사용하여 체적 그라데이션을 구현하지 마십시오. 마이크로그루브의 중성염은 그라데이션 없이 염색되지 않습니다.
- 볼륨 그라데이션을 구현합니다. 마이크로그루브의 한쪽에 100 μL/웰의 항체 용액을 추가하고 다른 쪽에는 150 μL/잘 넣습니다(장치당 총 500μL).
- 다음 날(ICC 절차의 2일차)은 1차 항체를 제거하고 0.1% 트리톤 X-100/DPBS 용액으로 5분 동안 3배의 장치를 조심스럽게 세척한다.
참고: 쉽게 분리할 수 있는 문화권에서는 3x5분 동안 3배세탁을 30분 동안 1x로 교체할 수 있습니다. - 이차 항체 (재료의 표)가 빛에 민감하기 때문에 지금부터 어둠 속에서 작용하십시오. RT에서 1h에 대해 0.1% Triton X-100/DPBS 용액으로 2% 정상 당나귀 혈청에서 이차 항체를 가진 세포를 배양하여 8.3.1 단계에서 명시된 바와 같이 체적 그라데이션을 구현한다. 인큐베이션 후, 이차 항체를 제거하고 DPBS로 5 분 동안 3 배 세척하십시오.
- DPBS(100 μL/well)에서 DAPI로 핵 DNA를 라벨로 표시하여 RT에서 20분 동안 3x-4x의 5분 세척을 5분 동안 3x-4x로 팅톤 X-100/DPBS 용액으로 분류합니다. 모든 우물에서 0.1% 트리톤 X-100/DPBS 용액을 제거하고 각 웰에 형광 장착 미디어를 한 방울 추가하기 전에 배양이 몇 초 동안 건조하게 하십시오.
참고: 장착 미디어를 설정할 수 있도록 장치를 24시간 이상 수평으로 유지합니다. 24시간 후, 장치는 4°C에서 슬라이드 케이스에 저장될 수 있다. - 반전 된 현미경으로 z 스택의 이미지.
- NMJ를 이미지하려면 40배 의 목표를 사용하여 심튜브 항체(재료 표)로 표시된 심튜브를 찾고 z 스택 레코딩을 수행하여 신경 및 심피튜브 조직 이미징을 보장합니다. myotube가 너무 커서 단일 프레임에 들어갈 수 없을 때 여러 이미지를 가져 가라.
- NMJ 정량화의 경우, 각 z-스택을 통해 신경 전시냅스 마커와 AChR 마커 사이의 공동 국소화 수를 수동으로 계산합니다. z 스택에 존재하는 myotube의 수로 공동 지역화 수를 정규화합니다.
9. SEM용 장치의 고정 및 준비
참고: 액체를 변경할 때는 항상 소량의 양을 유지하여 세포 붕괴를 방지합니다. 이 프로토콜은 매우 독성이 강한 물질을 사용하며, 전체 과정에서 개인 보호 장비와 연기 후드로 작업해야 합니다.
- 고정 및 분해: 0.1M 나트륨 카코딜레이트 버퍼(pH 7.6)로 신선한 2.5% 글루타랄데히드(GA)를 준비하고, 0.2 μm 필터를 사용하는 필터를 넣고, 최대 37°C까지 가열한다.
주의: GA와 나트륨 cacodylate는 독성: 개인 보호 장비와 연기 후드에 핸들.- 조심스럽게 DPBS와 함께 장치를 한 번 세척하여 미디어 및 세포 이물질을 제거한 다음 RT에서 15 분 동안 GA 용액으로 접두사하십시오.
- 메스를 사용하여 SEM 시트를 장치 둘레로 조심스럽게 자르면서 장치를 집게로 안정시하십시오. 절단하는 동안 장치를 분리하지 않도록 하십시오. 3cm 페트리 접시에 집게의 도움으로 장치와 SEM 시트를 이동하고 쉽게 취급할 수 있도록 10cm 접시에 3cm 접시를 배치합니다.
- 접두사 후 15분 동안 집게를 사용하여 SEM 시트에서 장치를 조심스럽게 제거합니다. 장치를 한 쪽 구석에 분리하고 반대쪽 모서리를 향해 대각선 방향으로 천천히 제거합니다. 장치에서 분리된 셀을 관찰합니다.
- 추가 GA 용액을 추가하여 3cm 접시에 전체 SEM 시트를 덮고 RT 또는 4 °C에서 하룻밤 동안 총 2 시간 동안 고정을 계속합니다.
참고: 세포로 덮인 표면을 피하여 집게로 GA 솔루션 아래에 SEM 시트를 부드럽게 밀어 넣습니다.
- SEM에 대한 표준 프로토콜을 계속 합니다. 간단히 말해서, 오스뮴 테트옥사이드에서 배양한 다음 등급이 매겨진 일련의 에탄올로 탈수합니다. SEM 시트를 커버슬립 홀더에 삽입하여 중요한 점 건조를 위해 탄소 스티커 및 코팅을 위한 지지 스텁에 장착합니다. 스캐닝 전자 현미경을 사용하여 5 kV의 가속 전압과 7mm의 작동 거리를 이미지합니다.
10. 라이브 셀 칼슘 이미징을 사용하여 NMJ 기능 평가
- 장치 준비: BDNF, GDNF 및 CNTF의 30 ng/mL및 운동 뉴런 컴파트먼트가 있는 200 μL/well의 18일 모터 뉴런 기저 배지로 심오튜브 구획을 새로 고침하고 성장 인자 없이 200 μL/웰 모터 뉴런 기저 배지(표 2 및 표 3).
- 플루오-4 염료를 5μM의 최종 농도로 근튜브 컴파트먼트에 플루오-4 염료를 첨가하고 37°C, 25분 동안 5% CO2 에서 어두운 장치를 배양한다. 장치가 인큐베이션을 받고 있는 동안, 450 mMM의 최종 농도에서 성장 인자없이 운동 뉴런 기저 배지에서 염화칼륨을 희석시하십시오.
참고: 플루오-4 AM은 칼슘 변성에 대한 형광증가를 나타내는 칼슘 지표입니다. 염료가 빛에 민감하기 때문에 지금부터 어둠 속에서 작업하십시오. - 25분 후, BDNF, GDNF 및 CNTF의 30 ng/mL및 운동 뉴런 구획의 30 ng/mL로 200 μL/well의 18운동 뉴런 기저배지로 심튜브 구획을 새로 고치고, 성장 인자 없이 100μL/웰의 모터 뉴런 기저 배지를 사용하여 화학및 체피그라데이션을 재확립한다.
- NMJ를 차단하려면 AChR 경쟁 적대행위 튜부쿠라린 염산염 펜타하이드레이트의 19 μM으로 심우전지 구획 매체를 보완하십시오.
주의: 투부쿠라린 염산염 펜타하이드레이트독성: 개인 보호 장비가 있는 연기 후드에 손잡이.
- 플루오-4 염료를 5μM의 최종 농도로 근튜브 컴파트먼트에 플루오-4 염료를 첨가하고 37°C, 25분 동안 5% CO2 에서 어두운 장치를 배양한다. 장치가 인큐베이션을 받고 있는 동안, 450 mMM의 최종 농도에서 성장 인자없이 운동 뉴런 기저 배지에서 염화칼륨을 희석시하십시오.
- 37°C, 5% CO2로 조정된 인큐베이터를 장착한 반전된 공초점 현미경으로 레코딩을 수행합니다.
- 10배 의 목표를 통해 밝은 필드 채널을 사용하여 myotube 구획에서 myotube를 찾습니다. 488 채널의 레이저 전력, 게인 및 오프셋을 플루오-4 형광이 개별 심덩이를 표시하는 수준으로 조정합니다.
참고: 소프트웨어의 A1 설정에서 스크롤 막대를 레이저 전력 5%, 이득 60(HV) 및 0의 오프셋으로 조정하여 대표적인 결과를 얻었습니다.
- 10배 의 목표를 통해 밝은 필드 채널을 사용하여 myotube 구획에서 myotube를 찾습니다. 488 채널의 레이저 전력, 게인 및 오프셋을 플루오-4 형광이 개별 심덩이를 표시하는 수준으로 조정합니다.
- 1 간격으로 녹화 시간을 1분으로 설정합니다. 5-10s가 기준선을 가지고 있고, 염화칼륨 용액으로 모터 뉴런을 즉시 자극하는 기록을 기록합니다.
- 5-10s의 레코딩 후, 50mMM의 최종 농도에 도달하기 위해 모터 뉴런 컴파트먼트의 한 웰에 25 μL의 염화칼륨 용액을 천천히 추가합니다.
참고: 염화칼륨 용액을 너무 빨리 추가하지 마십시오.
- 5-10s의 레코딩 후, 50mMM의 최종 농도에 도달하기 위해 모터 뉴런 컴파트먼트의 한 웰에 25 μL의 염화칼륨 용액을 천천히 추가합니다.
- 운동 신경 자극이 2분 정지된 후, 운동 신경 탈극화와 무관하게 직접 심튜브 활동을 평가하기 위해 심오튜브 구획의 25 μL 칼륨 염화액을 직접 자극하여 운동 뉴런 자극으로 심오튜브 구획을 기록합니다.
- 정량화의 경우, 각 myotube를 기록 소프트웨어와 함께 수동으로 동그라미를 치고 1분 동안 형광강도를 분석한다. 칼슘 유입의 증가를 결정하기 위해 염화칼륨을 자극한 후 피크 값에서 평균 기준값(즉, 염화칼륨 자극 전 의 첫 10s에서 평균)을 빼낸다. 대표적인 결과는 소프트웨어의 시간 측정 도구를 사용하여 획득되었습니다.
결과
미세 유체 장치에서 NMJ의 생성
시판되는 마이크로유체 장치에서 기능성 NMJ를 이용한 인간 모터 유닛을 생성하기 위해 인간 iPSC 유래 모터 뉴런및 인간 MAB 유래 근구가 사용되었다. 시작 세포 물질의 품질이 중요하며, 특히 MABs의 융합 능력이 이 프로토콜의 성공적인 결과에 매우 중요합니다. MAB는 문화를 유지하기 쉽습니다. 그러나, 미세유체 장치에 적용하기 전에 각 배치의 융합 능력을 평가하는 것이 중요하다(보충 도 1A, B)18. 10일 분화 후 근관 형성을 표시하지 않는 모든 배치를 사용해서는 안 됩니다. 보충도 1B의 융합 지수는 심포지전서 내핵의 백분율을 영상당 총 핵수의 각 심오튜브 마커에 대해 양성으로 계산함으로써 결정되었다. 우리는 약 8 %의 융합 지수가 NMJ를 생성하는 공동 문화에 충분하다는 것을 발견했습니다.
iPSC의 순수한 문화와 모터 뉴런 차별화를 시작하는 것이 항상 중요합니다. 더 순수한 입력 - 더 순수한 결과. 모터 뉴런 분화 프로토콜은 운동 신경 배양, 일반적으로 85%-95% 운동 신경 마커에 대 한 긍정적인 생성 (보충 도 1C,D)18. 나머지 세포는 일반적으로 미분화 전구체 세포가 될 것이며, 어떤 경우에는 광범위한 증식을 겪고 이에 따라 배양의 품질에 부정적인 영향을 미칩니다. 이 프로토콜의 최상의 결과를 얻으려면 모터 뉴런 분화 효율을 평가해야 10 모터 뉴런-NPC를 장치에 적용해야 합니다. 또한, NPC 품질 검사는 NPC 마커 Olig2의 발현을 평가하기 위해 11일에 수행될 수 있다(보충 도 1E, F).
처음에, 모터 뉴런-NPC와 MABs는 10일째에 같은 시간에 도금되었다. 여기서 MAB 차별화는 11일에 시작되었습니다. 14일째에 구현된 볼륨 및 성장인자 그라데이션을 통해 21일째에 NMJ 형성을 평가하여 프로토콜을 1주일 단축할 수 있었습니다. 흥미롭게도, 우리는 ICC에 의해 특징적인 NMJ 형성을 관찰 할 수 (보충 그림 2A). 그러나, 우리는 운동 뉴런 분화에서 초기에 살아있는 세포 칼슘 기록을 통해 기능성 출력을 얻을 수 없었다 (데이터는 표시되지 않음). 우리는 NMJ 형태학이 유망한 보였음에도 불구하고 운동 뉴런이 아직 myotube와 기능적인 NMJ 연결을 형성할 만큼 성숙하지 못했다는 결론을 내렸습니다. 이것은 패치 클램프 전기 생리 분석을 통해 기록 된 모터 뉴런의 자발적인 작용 잠재력이 운동 뉴런 분화 15일째에만 발생한다는 이전 관찰과 일치합니다.
또한, 우리는 MAB를 도금하기 전에 2 주 (24 일) 장치에 있는 모터 뉴런을 성숙시킴으로써, 모터 뉴런 성숙뿐만 아니라 공동 배양 지속 가능성을 연장하려고 시도했습니다. 불행히도, 마이크로그루브를 통해 많은 양의 자발적인 운동 뉴런-뉴라이트 횡단이 관찰되어 MAB 부착(보충 도 2B)의 억제가 초래되었다. 채널에서 myotube 형성의 부족으로 인해, 우리는 36 일에 NMJ를 식별하는 데 실패하고 따라서 28 일 프로토콜을 적용 (그림 1).
시험관 내 NMJ의 식별, 정량화 및 형태학적 특성화
28일 프로토콜(그림 1)을 따라간 후, 완전 기능NMJ를 얻을 수 있었다. 생체 내 및 체외 에서, NMJs는 전시냅틱 마커 및 포스트냅틱 마커의 공동 국소화를 통해 면역히스토 또는 면역세포화학적으로 특징이다. 이 연구에서는, 신경필라멘트 중형 사슬(NEFH)과 SYP를 사전 시냅스 마커 조합으로서 사용하였고, 이는 가장 해반된 과정을 향한 운동 뉴런의 소마로부터 단일 뉴라이트의 다음을 허용하였다. 근육 측면에서, Btx널리 AChRs에 대 한 포스트 냅 스 마커로 사용, 그리고 마찬가지로이 연구에서 사용 되었다. 아그린과 라미닌의 보충은 sarcolemma19,20,21에서 AChRs의 클러스터링을 촉진하여 체외에서 AChRs를 쉽게 식별할 수 있게 하고 마찬가지로 현재 AChRs 및 NMJ의 수를 증가시킵니다18.
비편견방식으로 NMJ를 찾아 계산하기 위해, 각 myotube는 미오신 중형 체인(MyHC)-양성성을 통해 식별되고, 반전된 공초점 현미경을 사용하여 40배배율에서 z-스택으로 이미지된다. 매우 긴 myotubes에 대 한, 여러 z 스택 인수 했다. 이미지 분석을 위해, NEFH/SYP와 Btx 간의 공동 지역화 수는 각 z-스택을 통해 수동으로 계산되며, 공동 지역화의 수는 z 스택에 존재하는 myotube의 수로 정규화된다(도 2A-C)18. 모든 myotube는 NMJ를 가질 것입니다, 내부 된 myotube의 정량화에서 볼 수 있듯이 (그림 2D). 따라서 모든 myotube가 Btx 존재와 는 별개로 이미지되는 편견없는 녹음 접근 방식을 수행하는 것이 중요합니다.
이 시험관 내 시스템에서 두 가지 유형의 형태를 식별할 수 있습니다. NMJ는 단일 접점 NMJ로 표시되며, 여기서 중성염이 한 번의 상호 작용 지점에서 AChRs 클러스터를 터치하거나, 뉴라이트가 더 큰 표면을 통해 AChR 클러스터를 팬아웃하고 참여하는 다중 컨택포인트 NMJ로 나타납니다. 이들 두 가지 형태는 면역세포화학적(도 2A)18 및 SEM(도 2B)18을 모두 식별할 수 있으며, 마찬가지로 정량화될 수 있다(도 2C)18. 전반적으로, 다중 접점은 더 성숙한 NMJ 형성을 가리키는 큰 근육 임베드를 통해 더 넓은 연결을 용이하게합니다. 대조적으로, 단일 접점 NMJs는 문화의 초기 발달 상태 때문에 덜 성숙한 것으로 간주됩니다.
시험관 내 NMJ의 기능평가
NMJ의 기능을 평가하기 위해, 라이브 셀 칼슘 과도 레코딩이 사용되었다(그림 3)18. 미세유체 장치의 유동적으로 분리된 시스템을 활용하여, 운동 신경소종 측은 칼슘에 민감한 플루오-4 염료(그림 3A)로 로드된 심오튜브내 칼슘의 유입을 동시에 기록하는 동안 염화칼륨의 고농도(50mMMM)로 자극되었다. 거의 즉시 운동 뉴런 활성화 시, 우리는 모터 뉴런 -neurite 및 myotube (그림 3A-C)18을 통해 기능적 연결을 확인하는 특징적인 파도 형성을 통해 심포튜브의 칼슘 유입을 관찰 할 수 있었습니다. 염화칼륨과 직접 자극시 심오튜브 수축이 관찰되었지만 자발적인 칼슘 파또는 자발적인 심포지전 수축이 관찰되지 않았습니다. 연결의 특이성은 경쟁AChR 길항제, 튜부쿠라린 염산염 펜타하이드레이트(DTC)를 심오튜브 구획(도 3A)에 추가하여 추가로 확인되었으며, 이로 인해 칼슘 유입이 억제되었다(도 3C). 이 효과는 모터 뉴런과 근구 사이의 연결이 완전히 기능적인 NMJs를 초래한다는 것을 확인했습니다. NMJ 자극을 통해 활성 심포우의 수를 평가하기 위해, 심오튜브 구획은 이 구획에서 활성 심포우의 총 수를 확인하기 위해 염화칼륨으로 직접 자극되었다. 심포우의 약 70%는 염화칼륨(도 3D)18을 사용하여 운동 뉴런 자극 활성화를 통해 활성화되었다.
이러한 결과는 28일 프로토콜 동안 iPSC 유래 모터 뉴런 및 MAB 유래 근구의 공동 배양을 통해 최적의 NMJ 형성, 수, 형태 및 기능을 확인합니다.
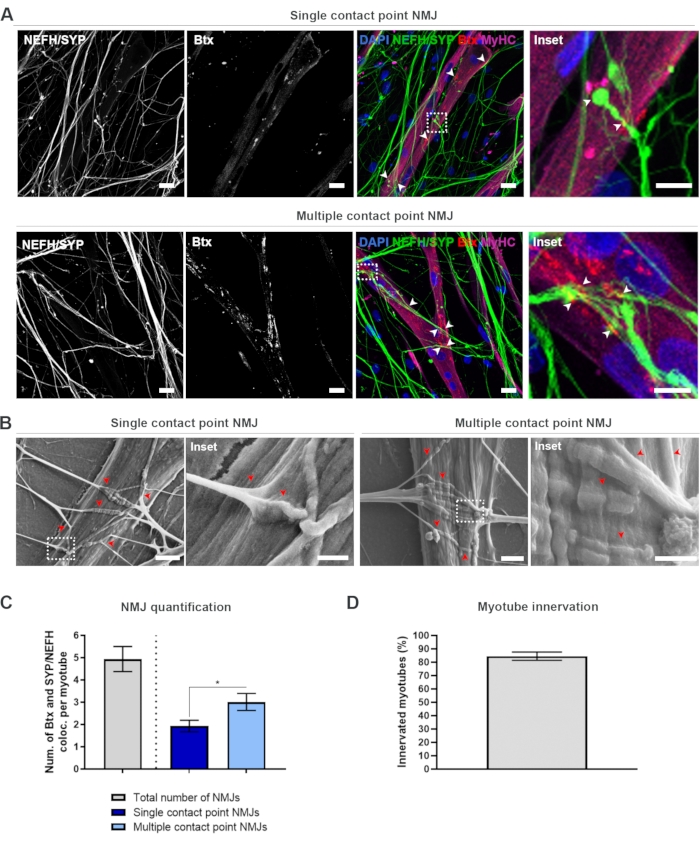
그림 2: 미세유체 장치의 NMJ 형성. (A) 28일째에 조립된 미세 유체 장치에서 NMJ 형성의 공초점 현미경 사진. NMJ는 MyHC 염색 심포우에 대한 사전 시냅스 마커(NEFH 및 SYP)와 포스트냅틱 AChR 마커(Btx)의 공동 국소화(arrowheads)를 통해 식별된다. NMJ는 중성염과 AChR 클러스터 사이의 단일 또는 다중 접점 형성을 통해 형태학적으로 식별됩니다. DAPI 라벨 핵. 스케일 바, 25 μm. 인셋은 NMJ의 배율을 보여줍니다. 28일째실리콘 미세유체 장치에서 NMJ 형태의 인셋 스케일 바, 10 μm. (B) SEM. 화살장은 근사튜브에 neurite 임베드를 묘사합니다. 스케일 바, 2 μm. 인셋은 NMJ의 배율을 보여줍니다. 인셋 스케일 바, 1 μm. (C) myotube 당 총 NMJ 수의 정량화뿐만 아니라 myotube 당 단일 및 다중 접점 NMJs의 수. 그래프는 4개의 생물학적 복제에서 평균의 표준 오차를 ± 평균으로 도시된다. 통계적 유의성은 0.05 *p< 0.05로 Mann-Whitney 테스트로 결정됩니다. (D) 내면의 심포튜브 의 백분율을 정량화합니다. 그래프는 4개의 생물학적 복제에서 평균의 표준 오차를 ± 평균으로 도시된다. 이 수치는 스토클룬드 디틀라우, K. 외.18에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
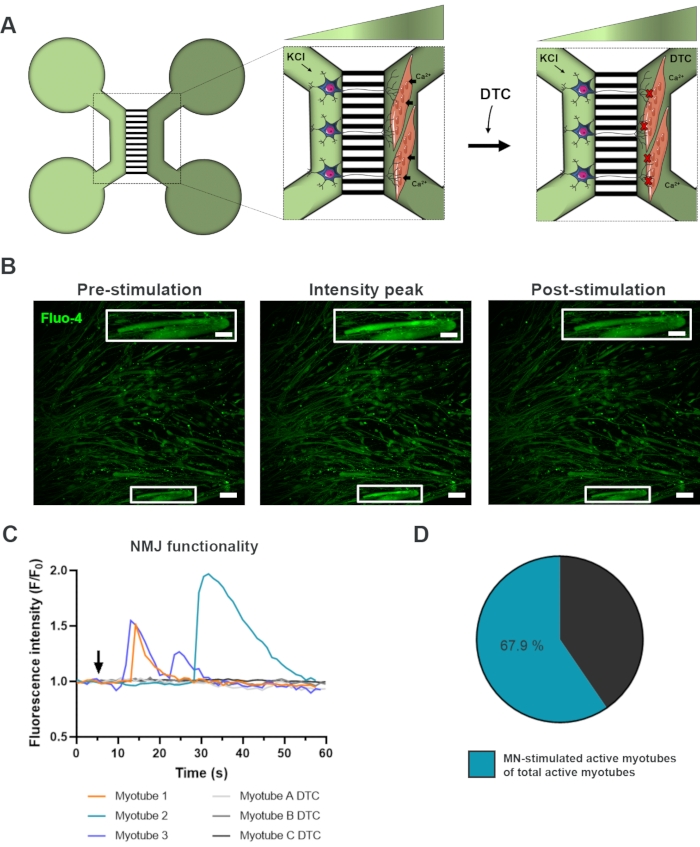
그림 3: NMJ 기능 확인. (A) 28일 전과 후 NMJ 차단(DTC)22전후에 사전 조립된 미세유체 장치에서 NMJ 기능의 실세포 과도 칼슘 레코딩의 회로도 일러스트레이션. 밝은 녹색 구획의 모터 뉴런은 염화염화(KCl)로 자극되어 중성염을 통해 세포내 운동 뉴런 반응을 일으킵니다. 이것은 칼슘에 민감한 플루오-4 염료 (어두운 녹색 구획)로 표시된 myotubes에서 칼슘 (Ca2+)의 유입을 불러 일으킵니다. (B) KCl. Inset을 통해 운동 신경 자극시 세포내 칼슘 증가의 물결을 묘사한 myotube의 자극 전, 강도 피크 및 후 자극의 플루오-4 형광 현미경 그래프는 내면의 활성 심코튜브의 배율을 나타낸다. 스케일 바, 100 μm. 인셋 스케일 바, 200 μm. (C) 대표적인 칼슘 유입 곡선은 KCl(화살표)을 통해 운동 신경 자극 후 근관에서 곡선을 나타내며 NMJ 기능을 확인한다. Myotube 1-3은 모터 뉴런-심코튜브 이너밴션을 통해 특징적인 칼슘 곡선을 보여주고, myotube A-C DTC는 NMJ가 DTC로 차단한 후 곡선을 묘사합니다. (D) 운동 뉴런 자극 활성 심포지의 비율은 활성 심포지의 총 수에. 이 수치는 스토클룬드 디틀라우, K. 외.18에서 수정되었습니다. 셀 일러스트레이션은 스마트 서버 의료 Art22에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보조 도 1: 모터 뉴런 검증, MAB 융합 지수 및 NPC 품질 관리. (A) 차별화 개시 후 10일 후에 MAB 유래 근구의 공초점 이미지. Myotube는 심오튜브 마커로 표시되어 있습니다: desmin, MyHC, myogenin (MyoG) 및 titin. 핵은 DAPI로 염색됩니다. 스케일 바, 100 μm. (B) MAB 융합 지수의 정량화 10일 후 분화. 기아 시, MABs는 심오튜브 마커 양성(AB+)을 위해 정량화된 다중 핵성 심포우로 융합합니다. 그래프는 세 가지 생물학적 복제에서 평균의 표준 오차가 ± 것을 의미합니다. (C) iPSC 유래 모터 뉴런의 공초점 이미지는 28일째에 모터 뉴런 마커 NEFH, 콜린 아세틸트랜스퍼라제(ChAT) 및 이슬레-1로 표시되어 팬뉴런 마커 βIII-tubulin(Tubulin)을 첨가하여 부착한다. 핵은 DAPI로 염색됩니다. 스케일 바, 75 μm. (D) 모터 뉴런 및 범신경 마커(AB+)에 양성인 세포 수의 정량화. 그래프는 세 가지 생물학적 복제에서 평균의 표준 오차가 ± 것을 의미합니다. (E) NPC 마커 올리그2와 팬뉴런 마커 βIII-tubulin (Tubulin)으로 표기되는 운동 뉴런 분화의 11일째에 iPSC 유래 NPC의 공초점 이미지. 핵은 DAPI로 염색됩니다. 스케일 바, 50 μm.(F) 올리그2 및 βIII-tubulin(AB+)에 대해 양성인 NPC 수의 정량화. 그래프는 세 가지 생물학적 복제에서 평균의 표준 오차가 ± 것을 의미합니다. 이 수치는 스토클룬드 디틀라우, K. 외.18에서 수정되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보조 도 2: 10일째에 MAB가 NPC와 동시에 시드되는 21일째운동 뉴런 분화일때 NMJ 형성의 공동배양 프로토콜(A) 공초점 이미지의 최적화. NMJ는 MyHC 염색 심포우에 대한 사전 시냅스 마커(NEFH 및 SYP)와 포스트냅틱 AChR 마커(Btx)의 공동 국소화(arrowheads)를 통해 식별된다. 스케일 바(왼쪽), 10 μm. 스케일 바(오른쪽), 5 μm. (B) MAB의 부착을 억제하는 자발적인 운동 뉴런 뉴라이트 횡단을 묘사한 24일 심오튜브 채널의 밝은 필드 이미지. 스케일 바, 100 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
| 시약 | 재고 농도 | 최종 농도 |
| IMDM | 1x | 80% |
| 태아 소 혈청 | 15% | |
| 페니실린/연쇄절제술 | 5000 U/mL | 0.5% |
| L-글루타민 | 50x | 1% |
| 피루바테 나트륨 | 100mM | 1% |
| 비필수 아미노산 | 100x | 1% |
| 인슐린 전달자 셀레늄 | 100x | 1% |
| bFGF (신선한 추가) | 50 μg/mL | 5 ng/mL |
표 1: MAB 성장 매체. 중간은 4 °C에서 2 주 동안 지속될 수 있습니다. bFGF는 사용 당일 신선하게 첨가됩니다.
| 시약 | 재고 농도 | 최종 농도 |
| DMEM/F12 | 50% | |
| 신경 물질 매체 | 50% | |
| 페니실린/연쇄절제술 | 5000 U/mL | 1% |
| L-글루타민 | 50x | 0.5 % |
| N-2 보충제 | 100x | 1% |
| 비타민 A 가 없는 B-27 | 50x | 2% |
| β 메카토에탄올 | 50mM | 0.1% |
| 아스코르브 산 | 200 μM | 0.5 μM |
표 2: 운동 뉴런 기저 배지. 중간은 4 °C에서 4 주 동안 지속될 수 있습니다.
| 하루 | 시약 | 재고 농도 | 최종 농도 | 컴파트먼트 |
| 10/11일차 | 부드러운 고뇌스트 | 10mM | 500 nM | 둘다 |
| 레티노산 | 1 mM | 0.1 μM | ||
| DAPT | 100mM | 10 μM | ||
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| 14일차 | DAPT | 100mM | 20 μM | 둘다 |
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| 16일차 | DAPT | 100mM | 20 μM | 둘다 |
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| CNTF | 0.1 mg/mL | 10 ng/mL | ||
| 18일차 | BDNF | 0.1 mg/mL | 10 ng/mL | 모터 뉴런 |
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| CNTF | 0.1 mg/mL | 10 ng/mL | ||
| 21일차 이상 | BDNF | 0.1 mg/mL | 30 ng/mL | 뮤튜브 |
| GDNF | 0.1 mg/mL | 30 ng/mL | ||
| CNTF | 0.1 mg/mL | 30 ng/mL | ||
| 아그린 (주) | 50 μg/mL | 0,01 μg/mL | ||
| 라미닌 () | 1 mg/mL | 20 μg/mL | ||
| 21일차 이상 | 보충제 없음 | 모터 뉴런 |
표 3: 모터 뉴런 중간 보조제. 보충 교재는 모터 뉴런 기저 배지에 사용 의 날에 신선한 추가 됩니다.
| 하루 | 시약 | 재고 농도 | 최종 농도 | 컴파트먼트 |
| 18일차 | DMEM/F12 | 97% | MAB | |
| 피루바테 나트륨 | 100mM | 1% | ||
| 말 세럼 | 2% | |||
| 아그린 (주) | 50 μg/mL | 0.01 μg/mL |
표 4: MAB 분화 매체. 중간은 4 °C에서 2 주 동안 지속될 수 있습니다. 아그린은 사용 당일 신선하게 첨가됩니다.
토론
이 프로토콜은 30일 이내에 시판되는 미세 유체 장치에서 기능성 NMJ를 사용하여 인간 모터 유닛을 생성하는 비교적 사용하기 쉬운 방법을 설명합니다. 그것은 NMJs가 ICC와 SEM과 같은 표준 기술을 통해 그리고 살아있는 세포 칼슘 기록을 통해 기능적으로 어떻게 형태적으로 평가될 수 있는지 설명됩니다.
이 프로토콜의 큰 장점은 줄기 세포 기술의 사용입니다. 이를 통해 NMJ가 기증자 프로필과 독립적으로 건강과 질병 모두에서 평가될 수 있는 완전한 적응성을 허용합니다. 이 모델은 ALS 연구에서 이미 성공적이고 유익한 것으로 입증되었으며, FUS gene18의 돌연변이로 인해 뉴라이트 아웃성장, 재성장 및 NMJ 번호의 장애를 새로운 표현형으로 확인했습니다. 이 모형을 사용하여, 산발적인 ALS 환자에서 iPSC를 사용하여, 병인이 알려지지 않은 ALS의 산발적인 양식을 포함하는 연구를 확장할 수 있습니다. 이것은 인간 질병을 다시 항복하기 위하여 돌연변이된 유전자의 형질 전환과 발현에 의존하는 전통적인 동물 모형에 비해 이점을 제공합니다23,24. 또한, 우리의 완전한 인간 시스템은 인간 특정 생리학 및 질병의 잠재적 인 회수를 허용합니다. 이전 연구는 설치류와 인간 NMJ 형태 사이의 차이점을 보여 주었다25, 이는 인간의 NMJ 병리학을 해결하기 위해 설치류를 사용할 때 주의구현해야한다는 것을 시사한다. 이 시스템은 생체 내 모델의 복잡성이 결여된 비교적 간단한 체외 설정이지만, 미세유체 장치에 표시되는 NMJ 형태가 인간 절단의 NMJ와 유사하다는 것을 입증할 수 있었다25. 더욱이, 이 모형은 NMJ 형성 및 성숙 도중 NMJ 평가를 허용합니다, 잠재적으로 초기 질병 표현형을 드러내는, 결석, 식별할 수 없는, 또는 인간 사후 견본에서 간과합니다.
MAB는 10일의 제한된 생존이 시스템의 단점이지만 myotube를 생성하는 유효한 옵션을 제공합니다. 근사 생존은 표면에 부착에 의존, 이는 가능성이 근섬유의 자발적인 수축에 의해 손상된다. 10일 이상 이후에 대부분의 myotube가 분리되어 NMJ 문화를 사용할 수 없게 됩니다. 이상적으로, myotube는 또한 iPSCs에서 생성될 것입니다. 그러나, 현재의 프로토콜은 융합 지수27,28,29,30의 변동성으로 인해 재현하기 어렵다는 것이 입증되었습니다.
시판되는 마이크로유체 장치를 사용하여 완전히 액세스할 수 있는 표준화된 시스템을 생성했습니다. 다른 NMJ 모델은 31,32,33,34,35,36,37,38,39,40,41,42가 존재한다. 그러나, 그(것)들은 일반적으로 세포 모형 사이 구획화 그리고 유동적인 격리가 결여된 단 하나 구획에 의지합니다, 또는 주문을 받아 만들어진 배양 용기에, 가용성을 낮추고 잠재적으로 또한 재현성을 낮춥니다. 이 프로토콜에 사용되는 미세 유체 장치는 다양한 길이의 마이크로 그루브로 구입할 수 있으며 축산 운송43,44 또는 axotomy18,45,46 조사와 같은 추가 분석을 가능하게합니다. 구획 사이의 유체 적 격리는 치료 개발에 유리할 수 있는 운동 뉴런 또는 근투의 구획화된 약물 치료를 더욱 가능하게 합니다. 마이크로 유체 학 전문 의 더 많은 회사가 등장했다, 이는 장치 디자인 및 기능의 큰 선택을 열어, 더 체외 연구에 대한 접근성을 촉진.
결론적으로, 우리는 기능적 NMJs와 인간 모터 단위를 배양하는 신뢰할 수있는, 다재 다능하고 쉬운 방법을 제공하는 프로토콜을 개발했다.
공개
L.V.D..B 샤르코트 마리 치아 질병(US-201327717-A1)에서 HDAC 억제제의 사용에 대한 특허를 보유하고 있으며, 어거스틴 테라피의 과학적인 공동 창립자이며 과학 자문위원회 의 원으로 활동하고 있습니다. 다른 저자는 경쟁 이익을 선언하지 않습니다.
감사의 말
저자는 리모네, 연구 그룹 분자 신경 생물학 (VIB-KU 루벤)에서 니키 코르투트와 세바스찬 멍크에게 라이브 셀 칼슘 과도 형광 기록에 대한 조언을 감사드립니다. 이 연구는 벨기에와 룩셈부르크에 풀 브라이트위원회에 의해 지원되었다, KU 루벤 (C1과 "미래를 여는" 기금), VIB, 과학 기술에 의해 혁신기구 (IWT; SBO-iPSCAF), "과학 연구 플랑드르 기금" (FWO-블라안데렌), 대상 ALS, ALS 리가 벨지에 (ALS에 대한 치료), 벨기에 정부 (벨기에 연방 과학 정책 사무소에 의해 시작 된 대학 명소 폴란드 프로그램 P7/16), 티에리 라트란 재단과 "협회 벨지 레 메네아 레 말라키". T.V. 및 J.B FWO-블라안데렌이 수여하는 박사 펠로우십의 지원을 받습니다.
자료
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
참고문헌
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유