Method Article
미세 유체 장치를 사용하여 siRNA로드 지질 나노 입자의 생산
요약
미세유체계 지질나노입자(LNP) 생산 방법은 RNA 전달을 포함한 약물 전달 시스템(DDSs)에서 주목받고 있다. 이 프로토콜은 iLiNP라는 이름의 당사의 원래 미세 유체 장치를 사용하여 제조, LNP(siRNA 로드 LNP) 생산 및 LNP 평가 프로세스를 설명합니다.
초록
기능성 지질 나노 입자 (LP)의 개발은 약물 전달 시스템 (DDS)의 분야에서 주요 과제 중 하나입니다. 최근에는 LNP 계 RNA 전달 시스템, 즉 RNA 로딩 LNPs가 RNA 치료에 관심을 모으고 있다. 특히, mRNA-로드 LNP 백신은 COVID-19를 방지하기 위해 승인되어 차세대 나노의약품의 개발을 향한 패러다임 전환을 초래했다. LNP 기반 나노 의약품의 경우 LNP 크기는 LNP 바이오 분배 및 LNP 성능을 제어하는 중요한 요소입니다. 따라서 LNP 생산 공정에 는 정확한 LNP 크기 제어 기술이 필수적입니다. 여기서는 iLiNP라는 미세 유체 장치를 사용하여 크기 제어 LNP 생산을 위한 프로토콜을 보고합니다. siRNA 로드 된 LP는 또한 iLiNP 장치를 사용하여 생성되고 시험관 내 실험에 의해 평가된다. 대표적인 결과는 SiRNA-로드LNP, Z-잠재력, siRNA 캡슐화 효율, 세포 독성 및 표적 유전자 침묵 활성을 포함하는 LNP 크기에 대해 도시된다.
서문
지질 나노 입자 (LNP)는 RNA 전달 시스템에 가장 널리 사용되는 나노 캐리어 중 하나입니다. 최근에는 mRNA-로드 LP가 COVID-191,2,3의 예방을 위한 백신으로 승인되었습니다. 일반적으로, LNP의 크기는 유전자 침묵 또는 단백질 발현을 포함하는 바이오 분배 및 약물 전달 시스템(DDS) 성능에 중요한 역할을 한다4,5,6. 따라서 LNP 생산 공정에 대해 정확한 LNP 크기 제어 방법이 필요합니다.
크기 제어 LP의 생산을 위해, 미세 유체 장치는 수년에 걸쳐 관심을 끌고있다7. 2018년, 최초의 식품의약국(FDA)이 승인한 siRNA-로드 LP(예를 들어, 온파트로)는 미세유체 장치를 사용하여 개발되었다8,9. 미세유체 계 LNP 생산 방법에서, 지질 용액 및 수성 용액은 마이크로 유체 장치로 별도로 도입된 다음 마이크로채널에 혼합된다. 혼합 효율을 향상시키기 위해 혼란스러운 믹서 장치는 LNP 생산10,11,12에 사용되었습니다. 혼란스러운 믹서 장치를 사용하면 특정 크기의 LP를 생성할 수 있습니다.
배플 구조를 갖춘 침습지질 나노입자 생성(iLiNP)이라는 간단한 미세유체 장치는 LNP 크기를 정밀하게 제어하기 위해 개발되었다13,14. 혼란스러운 믹서 장치에 비해 iLiNP 장치는 10 nm 간격으로 20~100nm 범위의 LNP 크기를 제어할 수 있었습니다. 또한, iLiNP 장치는 siRNA 로드 LNPs6, mRNA 로드 LNPs15, 리보뉴클레오프로틴 로드 LNPs16 및 엑소솜 같은 LNPs17을 생산했다. 이 논문의 목적은 iLiNP 장치의 제조 및 SiRNA 로드 LNP 생산 공정을 소개하고 iLiNP 장치에 의해 생성된 LNP 평가 프로세스를 설명하는 것입니다.
프로토콜
1. iLiNP 장치의 제조
참고: iLiNP 장치는 표준 소프트 리소그래피 방법을 사용하여 제조된다18. 상세한 제조 프로토콜은 이전에보고되었다10,13.
- SU-8 금형 제작
- SU-8 3050을 3인치 실리콘 웨이퍼에 붓습니다. 실리콘 웨이퍼를 스핀 코팅하여 100 μm 두께의 SU-8 층을 얻습니다.
- 실리콘 웨이퍼를 65°C에서 5분 동안, 95°C에서 45분간 구워줍니다.
- 베이킹 후 데스크탑 마스크리스 리소그래피 시스템의 무대에 실리콘 웨이퍼를 놓습니다.
- 실리콘 웨이퍼를 365 nm에서 UV 광에 노출하여 1.5s에 1.5s로 한 위치당 노출합니다.
참고: 이 실험에서 데스크톱 마스크리스 리소그래피 시스템이 사용되었습니다. 시스템은 마이크로채널의 분할조사 영역(한 위치)에서 UV 광을 자동으로 노출합니다. - UV 조사 후, 핫플레이트에 실리콘 웨이퍼를 1분 동안 65°C, 95°C에서 5분간 굽습니다.
- 실리콘 웨이퍼를 식힌 다음 SU-8 개발자에게 15분 간 담그고 노출되지 않은 SU-8을 제거합니다.
- 건조기와 진공 펌프를 사용하여 트리클로로(1H,1H,2H,2H-퍼플루오로옥틸)의 SU-8 금형을 시란으로 처리합니다.
- iLiNP 장치의 제조
- 실리콘 베이스와 폴리디메틸실록산(PDMS) 경화제를 10:1 비율로 혼합한다(w/w).
- 진공 펌프와 건조기로 혼합물을 탈가스합니다.
참고: PDMS는 실온에서 10분 동안 진공 펌프를 사용하여 탈유되었습니다. - 탈가스 PDMS를 SU-8 몰드에 최대 0.5~1cm 두께의 페트리 접시에 넣고 80°C에서 1시간 동안 오븐에서 굽는다.
- 금형을 식힌 다음 트위저를 사용하여 SU-8 금형에서 PDMS 기판을 벗깁니다.
- PDMS 기판에 3개의 구멍(0.5 mm)을 펀치합니다. iLiNP 장치를 구축하기 위해 산소 플라즈마 클리너를 사용하여 PDMS 기판 및 유리 슬라이드를 결합합니다( 그림 1)13을 참조하십시오.
- 3개의 PEEK 모세혈관(I.D. 0.3 mm, O.D. 0.5 mm)을 iLiNP 장치의 입구 및 콘센트에 연결하고 슈퍼 접착제로 치료합니다.
참고: PEEK 모세혈관의 길이는 조절이 가능하며 실험에 따라 다릅니다.
2. 지질 솔루션 준비
- 지질/에탄올 용액 준비: 13.4 mM 1-팔미토일-2-올레오일-센-글리케로-3-인포콜린(POPC), 10mMM 1,2-디스테로일-sn-글리케로-3-인포콜린(DSPC), 2 0 mM 1,2-디오틸록시-3-트리메틸람모늄 프로판(DOTAP), 5mM 1,2-디미리스토틸-락 글리세로-3-메톡시폴리에틸렌 글리콜-2000(DMG-PEG2k), 및 20mM 콜레스테롤. 실험 전에 재고 용액을 -20°C로 저장합니다.
- siRNA로드 LP를 생산하려면 DOTAP, DSPC, 콜레스테롤 및 DMG-PEG2k 용액을 50/10/38.5/1.5의 어금니 비율로 혼합하십시오. 총 지질 농도는 8mM로 조정된다.
3. 수성 솔루션 준비
- 수성 용액 준비: 154 mM NaCl (식염수), 25 mM 아세테이트 버퍼 pH 4.0 DNase/RNase 프리 증류수를 사용 하 여.
- 0.2 μm 크기의 멤브레인 필터 또는 주사기 필터를 통해 솔루션을 필터링합니다.
4. siRNA/버퍼 용액 의 준비
- siGL4 70 μg를 25m 아세테이트 버퍼(pH 4.0)의 1mL로 녹입니다.
참고: siGL4는 루시파아제 유전자의 녹다운에 사용됩니다.
5. iLiNP 장치 설정 및 LP 생산
참고: 회로도의 그림 1 을 참조하십시오.
- 지질 및 수성 솔루션(개별 주사기의 경우 3.1 및 4.1 단계)으로 1mL 유리 주사기를 각각 채웁니다.
참고: LNP 평가 실험에 필요한 양에 따라 지질 및 수성 용액 량을 조정합니다. - 유리 주사기를 주사기 커넥터를 사용하여 PEEK 모세혈관에 연결합니다.
- 지질 및 수성 솔루션의 유량을 설정합니다.
참고: 수성상에서 지질상까지의 유량 비율(FRR)은 3:1에서 9:1까지 다양합니다. - 주사기 펌프를 사용하여 iLiNP 장치에 지질 및 수성 용액을 별도로 도입합니다.
- iLiNP 장치의 콘센트에서 마이크로튜브에서 LNP 서스펜션을 수집합니다(그림 1).
6. LNP 서스펜션 및 LNP 크기 측정의 투석
- POPC LP 및 siRNA 로드 LP에 대한 식염수 또는 D-PBS에 대해 하룻밤 사이에 4°C에서 투석 막(12-14 kDa MW 컷오프)을 사용하여 LNP 서스펜션을 투석한다.
참고 : POPC는 식염수로 용해되지 않습니다 (2.1 참조하시기 바랍니다). POPC/에탄올 용액은 iLiNP 장치에서 식염수로 희석된다. - 마이크로튜브에서 투석된 LNP 서스펜션을 수집합니다.
- 마이크로 쿼츠 셀에 LNP 서스펜션의 파이펫 20-30 μL.
- 동적 광 산란(DLS)을 통해 LNP 크기, LNP 크기 분포 및 다분산지수를 측정합니다.
7. LNP의 Z 잠재력 측정
참고: Z-잠재력을 측정하기 위해 제조업체의 지시에 따라 입자 분석기( 재료 표 참조)가 사용되었습니다.
- 10mM HEPES 버퍼(pH 7.4)로 6.1, 35배에서 얻은 LNP 서스펜션을 희석시켰다.
- 파이펫 700 ~ 1000 μL의 희석된 LNP 현탁액은 모세관 세포로 한다.
- 제조업체의 지시에 따라 Z 가능성을 측정합니다.
8. 리보그린 분석에 의한 siRNA 캡슐화 효율
참고: 리보그린 분석은 LNPs19로 의 siRNA 캡슐화를 평가하기 위해 수행됩니다. 리보그린 분석은 계면활성제(예: TritonX-100)가 있는 LP 내부 및 외부의 RNA 양을 측정할 수 있습니다.
- 10m HEPES 버퍼(pH 7.4)에서 500 ng/mL siGL4 용액으로 2 mg/mL을 희석시합니다.
- 트리톤(+) 및 트리톤(-) 샘플에 대한 교정 곡선을 만들기 위해 siGL4 솔루션의 희석 계열(0, 12.5, 25, 50, 100, 200 ng/mL)을 준비한다.
- LNP 서스펜션을 10m HEPES 버퍼(pH 7.4)로 100회 희석합니다.
- 트리톤(+) 용액에 대해 다음을 혼합합니다: 10mHEPES(pH 7.4)의 980 μL, 10%의 μL w/v TritonX-100, 리보그린 1.25 μL 1.25 μL 96웰 마이크로플레이트의 10웰.
- 트리톤(-) 용액을 혼합합니다: 10mHEPES의 1000 μL(pH 7.4) 및 리보그린의 1.25 μL은 96웰 마이크로플레이트의 10개의 웰에 대해 이렇게 한다.
- 파이펫 100 μL 의 희석 계열의 siGL4 용액과 희석 LNP 서스펜션은 블랙 96웰 마이크로 플레이트의 우물에 들어갔다.
참고: siGL4 용액희석 시리즈와 희석 된 LNP 서스펜션은 조건당 4 개의 마이크로웰로 분배되었습니다. - 검출 용액(TritonX-100(+) 또는 트리톤(-)의 파이펫 100 μL이 우물안으로 들어갑니다.
참고: 검출 용액(TritonX-100(+)은 조건당 샘플당 2개의 우물로 분배되었고, TritonX-100(-) 용액은 샘플 조건당 나머지 두 개의 우물에 분배되었다. - 실온에서 5분 동안 마이크로플레이트를 배양합니다.
- 마이크로 플레이트 판독기를 사용하여 475 nm의 파장을 사용하여 형광 강도를 측정합니다.
- 다음 방정식19로부터 siRNA 캡슐화 효율을 계산한다.
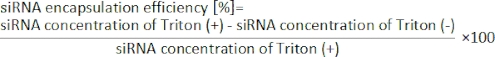
9. 세포 배양
- DMEM, 열 불활성 10% FBS, 100 U/mL 페니실린, 100 μg/mL 연쇄절제술, 400μg/mL G418을 포함하는 성장 매체를 준비한다.
- 배양 HeLa 세포는 5% CO2 인큐베이터에서 37°C에서 성장 배지를 함유하는 100mm TC 처리세포 배양식에서 반딧불및 레닐라 루시파라제(HeLa-dluc)를 안정적으로 표현한다.
10. 셀 생존 가능성 분석
- 종자 100 μL의 성장 배지에서 HeLa 세포의 현탁액(6 x 103 세포/웰) 96웰 마이크로 플레이트.
참고: 세포는 세포 카운터 플레이트와 현미경을 사용하여 계산되었습니다. - 마이크로 플레이트를 37°C에서 37°C에서 5% CO2 인큐베이터로 배양합니다.
- 10 및 100 nM siRNAs의 농도에서 DMEM (-)으로 siRNA로드 LN을 희석시 희석시.
- 희석된 siRNA 로드 LNP 서스펜션의 100 μL을 양호한 것으로 분배한다.
- 마이크로 플레이트를 37°C에서 37°C에서 5% CO2 인큐베이터로 배양합니다.
- LNP 서스펜션을 제거하고 DMEM(FBS(+)의 100 μL을 추가합니다.
- 마이크로 플레이트를 37°C에서 5% CO2 인큐베이터로 배양합니다.
- 제조업체의 프로토콜에 따라 시판되는 키트를 사용하여 셀 생존 가능성을 측정합니다.
참고: D-PBS(-)는 음수 제어로 사용되었다.
11. 루시파라제 유전자 녹다운 분석
- 종자 75 μL성장 배지에서 HeLa 세포의 현탁액(4.5 x 103 세포/웰) 96웰 마이크로 플레이트.
- 마이크로 플레이트를 37°C에서 37°C에서 5% CO2 인큐베이터로 배양합니다.
- 10 및 100 nM siRNAs의 농도에서 DMEM (-)으로 siRNA로드 LN을 희석시 희석시.
- 희석된 siRNA 로드 LNP 서스펜션의 75 μL을 1개당 잘 분배합니다.
- 마이크로 플레이트를 37°C에서 37°C에서 5% CO2 인큐베이터로 배양합니다.
- LNP 서스펜션을 제거하고 75 μL의 DMEM(FBS(+)을 추가합니다.
- 마이크로 플레이트를 37°C에서 5% CO2 인큐베이터로 배양합니다.
- 제조업체의 프로토콜에 따라 시판되는 키트를 사용하여 루시파라제 식을 측정합니다.
참고: D-PBS(-)를 음수 제어로 사용했습니다.
결과
도 2A, B 는 다른 유동 조건에서 생산된 POPC LNP 크기 분포를 나타낸다. 상기 미세유체계 LNP 제제 방법은 총 유량(TFR) 및 FRR과 같은 유량 조건에 의해 LP의 크기를 조절할 수 있다. iLiNP 장치는 혼돈믹서 장치 및 유동 초점 미세 유체 장치를 포함한 일반적인 미세 유체 장치와 비교하여 20~100nm(그림 2)에 이르는 정밀한 LNP 크기 제어를 가능하게 했습니다. 총 유량 조건에서 형성된 소형 LN. 또한, FRR에서 형성된 LNP 크기는 총 유량13에 관계없이 3의 FRR보다 작아졌다.
siRNA-로드 된 LP는 또한 iLiNP 장치를 사용하여 준비되었다 (도 3A). siRNA 로드 LNP 제제를 위해, 양이온 지질인 DOTAP는 SiRNA를 LN에 효과적으로 캡슐화하는 데 사용되었습니다. iLiNP 장치는 좁은 분포를 가진 90 nm 크기의 siRNA 로드 된 양이온 LP를 생산 (그림 3A, B). siRNA 캡슐화 효율은 양이온 지질과 음전하 siRNAs(도 3C)사이의 정전기 상호 작용으로 인해 95%였다.
90nm 크기의 siRNA-로드 LP의 세포독성 및 유전자 침묵 활성은 도 4 및 도 5에 도시된 바와 같이 평가되었다. siRNA 로드 LNP의 복용량에서 세포 독성을 보여주었다 10 그리고 100 nM siRNA. 또한 siRNA 농도에 따라 루시파라제의 발현 수준이 감소된 것을 확인했습니다. siRNA 로드 LNPs 억제 80% luciferase 발현의 복용량에서 100 nM siRNA. 유전자 침묵 활동에 LNP 크기의 효과는 이전에보고되었다6,13,17.
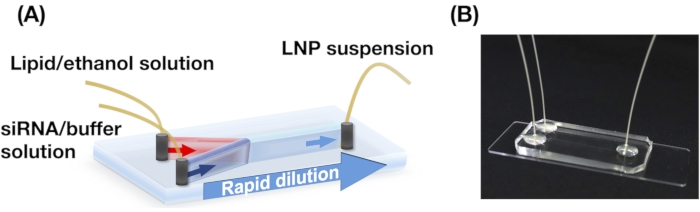
도 1: (A) iLiNP 장치의 회로도 일러스트레이션 및 (B) 사진. iLiNP 장치는 PDMS 및 유리 기판을 포함한다. iLiNP 장치는 슈퍼 접착제와 PEEK 모세 혈관에 연결되어 있습니다. 지질 및 siRNA/버퍼 솔루션은 주사기 펌프를 사용하여 iLiNP 장치에 별도로 도입됩니다. LNP 서스펜션은 마이크로튜브로 수집됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
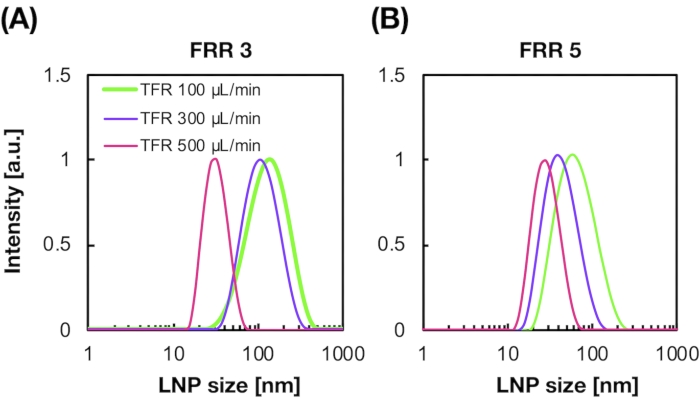
그림 2: iLiNP 장치에 의해 생성된 POPC LNP 크기 분포는 서로 다른 유량 비율(FRR)에서 생성된다. POPC LNP 크기는 동적 광 산란(DLS)에 의해 측정됩니다. POPC LP는 총 유량 및 FRR: (A) 3 FRR 및 (B) 5 FRR을 변경하여 제조됩니다. 소형 LP는 높은 총 유량 조건에서 형성됩니다. 또한, 5의 FRR에서 형성된 LNP 크기는 3의 FRR에 있는 것보다 작습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
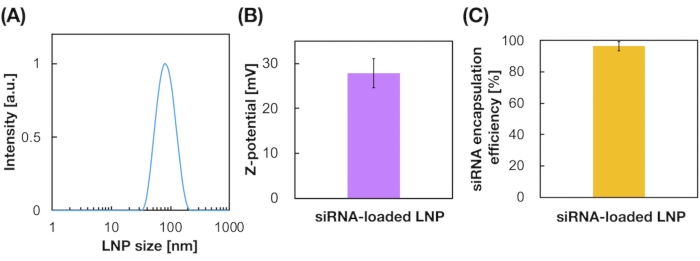
도 3: siRNA 로드 LNPs. (A) siRNA 로드 LNPs의 크기 분포의 특성화. siGL4(siGL4)는 양이온 지질(DOTAP) 및 음전하 시RNA 사이의 정전기 상호 작용에 의해 LP로 캡슐화된다. (B) siRNA 로드 LP의 Z-잠재력. LNP 서스펜션은 측정 전에 10m HEPES 버퍼(pH 7.4)로 희석하였다. 데이터는 sD(표준 편차)± 의미로 표시됩니다. n = 3. (C) DOTAP 기반 LP의 siRNA 캡슐화 효율. 캡슐화 효율은 RiboGreen 분석에 의해 결정되었습니다. 데이터는 SD. n = 3에 ± 의미로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
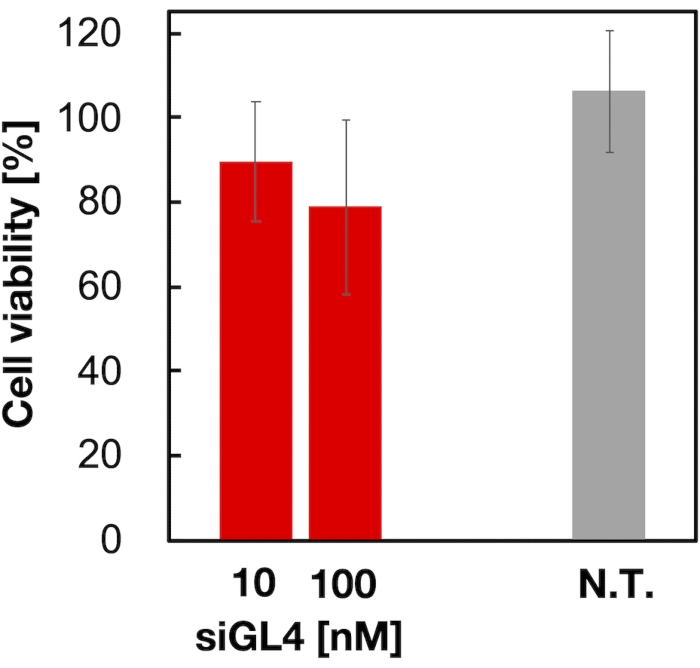
그림 4: siRNA 로드 LP의 세포 독성. siRNA-로드 된 LP는 DMEM (-)으로 희석되어 10 및 100 nM의 siGL4 농도를 얻었다. LNP 현탁액은 HeLa-dLuc 세포에 첨가되고 5% CO2 인큐베이터에서 37°C에서 4시간 동안 배양됩니다. N.T.: 비처리(D-PBS(-). 데이터는 SD. n = 3에 ± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
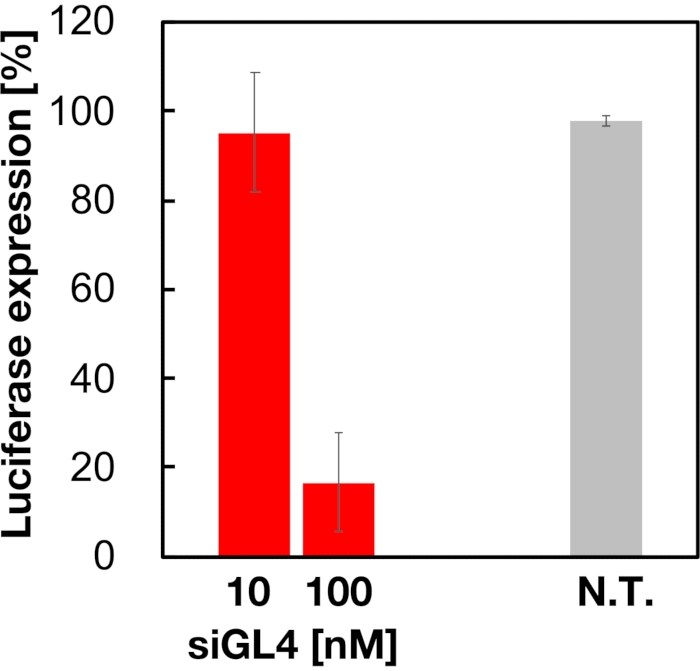
도 5: siRNA 로드 LNPs로 처리된 루시파라제 유전자 녹다운 활성. siRNA-로드 LNPs는 세포 생존 가능성 분석과 동일한 방식으로 제조된다. 루시파라제식 레벨은 듀얼 글로 루시파아제 분석 시스템을 사용하여 측정됩니다. N.T.: 비처리(D-PBS(-). 데이터는 평균 ± SD. n = 3으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
LNP 크기는 LNP 생체 분포, 항 종양 효과 및 유전자 침묵 성능에 영향을 미칩니다. 따라서, LNP 크기 제어 방법은 RNA 전달 시스템을 포함하는 DDS 나노 의약품을 제조하는 중요한 기술이다. 이 논문의 목적은 LP의 정확한 크기 튜닝을 위한 iLiNP 장치와 siRNA 로드 LNPs 생산에 응용 프로그램을 도입하는 것입니다. iLiNP 장치는 20nm(그림 2)13범위의 LNP 크기를 제어할 수 있었다. 총 유량 및 FRR과 같은 유동 조건이 LNP 크기를 제어하도록 변경되면, LNP 서스펜션은 약 5~10s 후에 수집하여 용액 흐름을 안정화시켜야 한다. iLiNP 장치의 콘센트에서 수집된 LNP 서스펜션은 완충액에 대해 즉시 투석되어 에탄올을 제거하고 LNP 응집을 방지했습니다.
LNP 크기 제어는 DDS 분야의 주요 과제 중 하나입니다. 일반적으로, 지질필름 수화 방법과 같은 기존의 LNP 생산 공정은 LNP 제작 후 크기 튜닝 공정이 필요하다20. 한편, 미세유체계 LNPs 생산 방법은 지질 및 수성 용액을 미세유체 장치에 도입하여 크기 조절 LP를 생성할 수 있다6,11,13. 투석 공정은 LNP 서스펜션에서 에탄올을 제거해야 하지만, 접선 유동 시스템과 결합된 미세유체 장치에 의한 지속적인 공정은 LNP 생산 공정의 자동화를 약속한다14. 문헌에 따르면, POPC LNP 크기는 50-60 nm와 30-60 nm, 유동-집중 미세 유체 장치21 및 혼돈믹서 장치에 대해 각각10이었다. 다른 미세 유체 장치에 비해 iLiNP 장치는 20nm에서 100 nm까지 넓은 범위에서 POPC LNP 크기 제어를 가능하게합니다.
iLiNP 장치의 제조 과정은 표준 소프트 리소그래피였습니다. 따라서 iLiNP 장치는 신속한 프로토타이핑 기술에 의해 대량 생산될 수 있으며 일회용 장치를 사용하여 용액의 교차 오염을 방지할 수 있다. iLiNP 장치는 POPC LNP 생산 방법과 동일한 방식으로 siRNA 로드 LP를 생성할 수 있다. iLiNP 장치를 사용하는 LNP 생산 방법의 경우 사용자는 복잡한 절차를 필요로 하지 않습니다. 이러한 이유로 iLiNP 장치를 포함한 미세 유체 기반 LNP 생산 방법은 표준 LNP 생산 방법으로 사용될 것으로 예상됩니다. 이 논문의 프로토콜은 LNP 생산을 위한 다른 미세 유체 장치에 적용될 수 있습니다. 또한, mRNA 로드 LP의 생산은 siRNA/버퍼 용액을 mRNA를 포함하는 완충액으로 변경하여 활성화된다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 JST, 크레스트 그랜트 번호 JPMJCR17H1, 일본, JST, PRESTO 보조금 번호 JPMJPR19K8, 일본, JST, 스코어, 일본, 교육, 문화, 스포츠, 과학 기술부, JSPS KAKENHI 보조금 번호 JP19KK0140, 그리고 Ikee과학에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
참고문헌
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유