Method Article
면역 펩티도믹스: 질량 분광분석 분석을 위한 마우스 및 인간 MHC 급 I-및 II 관련 펩타이드의 격리
요약
여기서, 우리는 고품질 면역 펩티도믹스 데이터를 제공하는 마우스 및 인간 세포주로부터 MHC 급 I 및 클래스 II 펩티드 복합체의 정화를 위한 프로토콜을 제시한다. 프로토콜은 시판되는 항체를 사용하여 샘플 준비에 중점을 둡니다.
초록
면역펩티도믹스는 백신 과 면역요법의 발달에 연료를 공급하고 인도하는 신흥 분야입니다. 보다 구체적으로, 대량 분광법(MS) 기술 플랫폼을 이용한 주요 조직적합성 복합체(MHC) 클래스 I 및 클래스 II 분자에 의해 제시된 펩티드의 조성을 조사하는 과학을 말한다. MS 기반 면역펩티도믹스 워크플로우의 모든 단계 중에서, 샘플 준비는 치료 관련성의 고품질 데이터를 캡처하는 데 매우 중요합니다. 여기서, 단계별 지침은 질 조절 샘플로부터의 면역화 정제에 의한 MHC 급 I 및 II 관련 펩티드를 분리하기 위해 기술되고, 마우스(EL4 및 A20), 인간(JY) 세포주에서보다 더 구체적으로 한다. 다양한 시약 및 특정 항체는 이러한 세포주로부터 MHC-관련 펩티드를 분리하기 위해 철저히 기술되며, 이는 비드로부터 MHC-펩타이드 복합체의 항체 결합 효율 및 용출 효율을 확인하는 단계를 포함한다. 이 프로토콜은 면역펩티도믹스 워크플로우를 설정하고 표준화하고 새로운 프로토콜을 벤치마킹하는 데 사용할 수 있습니다. 더욱이, 이 프로토콜은 면역펩티도믹스에서 시료 제제 절차의 실험실 내 및 실험실 간 재현성을 육성하는 것 외에도 모든 비전문가에게 좋은 출발점을 나타낸다.
서문
지난 10 년 동안 MHC 관련 펩타이드의 레퍼토리 조사에 대한 관심은 학계를 초과하여 생명 공학 및 제약 산업에 도달했습니다. 실제로, 암에서 실행 가능한 종양 특이적 신항제의 발견은 산업 분야에서 개인화된 종양학1,2,3로 이어지는 임상 면역 요법을 개발하는 데 중점을 두고 있습니다. 근본적으로, MHC 관련 펩타이드는 전신에 제시되고, 세포의 세포내 단계를 반영하며, 자가면역, 이식, 전염병, 염증, 암 및 알레르기와 같은 다양한 질병 조건에서 유의하다1,4. 따라서, 인간에서 MHC-관련 펩티드, 또는 인간 백혈구 항원(HLA) 리간드는 큰 의학적 관심사이며 집단적으로 면역펩티돔5라고 한다.
MS는 종양 특이적 신항제8,9,10,11의 발견을 포함하여 면역펩티돔6,7을 특성화하는 강력한 분석 접근법이다. 면역펩티도믹스 실험을 수행하는 전형적인 워크플로우에는 MHC 관련 펩티드의 분리를 위한 1) 샘플 준비, 2) MS에 의한 데이터 수집 및 3) 다양한 전산 소프트웨어 툴을 이용한 데이터 분석 의 세 가지 주요 단계가 포함된다. 이 시각화 된 프로토콜에 설명 된 고품질 샘플의 생성은 MS 기반 면역 펩티도믹스의 모든 프로젝트의 성공에 매우 중요합니다. 아래에 설명된 프로토콜은 고품질 면역펩티도믹스 데이터를 생성하는 데 적합한 잘 확립된 세포주로부터 MHC 급 I 및 II 관련 펩타이드를 분리하는 데 중점을 둡니다. 이러한 세포주에서 대표결과는 현재 프로토콜에 표시됩니다.
프로토콜
여기에 제공된 프로토콜은 확립된 프로토콜13,14,15,16,17,18,19,20에서 채택되었다. MHC 급 I 및 II 펩타이드의 면역affinity 정제(IP)에 대한 전반적인 절차는 도 1에 도시된다. 사용되는 세포주 및 항체에 대한 자세한 내용은 재료 표를 참조하십시오.
1. 항체와 결합된 구슬(1일차): 항체를 세파로즈 CNBr 활성화 구슬에 결합
참고: 각 새로운 실험에 대한 새로운 솔루션을 준비합니다. 시약 및 솔루션 레시피 목록은 재료 표 및 보조 표 1 을 참조하십시오. 모든 단계는 실온(RT)에서 수행됩니다. 새로운 항체를 사용하는 경우 키 알리쿼트(선택 사항 참조)를 수집하고 쿠마시 블루 염색 SDS-PAGE를 수행하여 결합 효율을 확인합니다(그림 2).
- 세파로즈 CNBr 구슬 활성화
- 시료당 80 mg의 세파로즈 CNBr 활성화 비드를 계량하여 15mL 원문 튜브로 옮겨냅니다.
- 먼저 말린 구슬의 재정지를 용이하게 하기 위해 먼저 1mM HCl 5mL의 5mL와 파이펫을 5회 위아래로 추가하십시오. 그런 다음 원문 튜브를 1mM HCl의 8.5mL를 추가로 채우십시오.
- 회전기 장치를 사용하여 RT에서 30 분 동안 20 rpm (분당 회전)에서 회전하십시오. RT에서 2 분 동안 200 x g 의 구슬을 원심 분리하고 포부로 상부를 제거하십시오.
- 500 μL의 커플링 버퍼를 구슬 펠릿에 넣고 새로운 2.0mL 원심분리기 튜브로 옮기고 1.2.2단계를 위해 따로 보관하십시오.
- CNBr 활성화 구슬에 항체의 결합
- 새로운 2.0 mL 마이크로센심심분리기 튜브에서 MHC 급 I 또는 II 펩타이드의 절연을 위해 선택된 항체를 준비한다(제조업체가 지정한 농도에 따라). 커플링 버퍼 솔루션으로 1mL로 볼륨을 완료하여 최종 농도2 mg/mL를 얻습니다.
- RT에서 2 분 동안 200 x g 에서 1.1.4 단계에서 구슬을 원심 분리한 다음 포부로 상퍼를 제거합니다.
- 활성 구슬을 포함하는 2.0 mL 마이크로센심분리기 튜브에 항체 용액을 추가합니다.
- (선택 사항) 18 μL(입력)의 알리쿼트(ALIquot)를 취하고, 4배 SDS-PAGE 버퍼의 6μL을 추가하고 즉시 동결합니다.
- 회전기 장치를 사용하여 120 분 동안 20 rpm에서 1.2.3 단계에서 마이크로 센트 심분리기 튜브를 회전하십시오. 구슬을 200 x g 에서 2분 동안 원심분리한 다음 상체를 제거합니다.
- (선택 사항) 상체(언바운드 항체)의 18μL의 알리쿼트(aliquot)를 취하고, 4배 SDS-PAGE 버퍼의 6μL을 추가하고 즉시 동결하십시오.
- 항체 결합 구슬의 차단 및 세척
- 1.2.5 단계에서 항체 결합 구슬을 함유하는 마이크로센심분리기 튜브에 0.2M 글리신 1mL을 첨가한다. 회전기 장치를 사용하여 RT에서 60 분 동안 20 rpm에서 회전하십시오.
- 2 분 동안 200 x g 의 구슬을 원심 분리 한 다음 상체를 제거합니다. PBS(인산염 완충식식염)의 1mL을 추가합니다.
- 2 분 동안 200 x g 의 구슬을 원심 분리 한 다음 상체를 제거합니다.
- (선택 사항) 상체의 18 μL (바운드되지 않은 항체, 마지막 세척)의 알리쿼트 (언바운드 항체, 마지막 세척)를 가져 와서 4 x SDS PAGE 버퍼6 μL을 추가하고 즉시 동결하십시오.
- 1.3.3 단계에서 비즈에 PBS 1mL을 추가합니다.
- (선택 사항) 18 μL의 구슬 혼합물(항체와 결합된 구슬)의 알리쿼트(항체와 결합된 구슬)를 넣고, 4x SDS-PAGE 버퍼의 6μL을 추가하고 즉시 동결하십시오.
- 같은 날 2.5단계에서 사용할 때까지 4°C로 유지하십시오.
참고: 비드는 면역 포획 전날 에 준비될 수 있지만 더 긴 저장은 테스트되지 않았습니다.
2. 항체 결합 구슬을 가진 세포 용해 및 면역 포획 (1 일)
참고: MHC 분자의 수준은 한 세포 유형에서 다른 세포 유형으로 다양하며 세포당 MHC/HLA 분자의 정량화가 제안됩니다21(도 4A). 각 IP에 대해 최소 1 x 108 셀을 권장합니다. 이 세포 수는 JY, EL4 및 A20 세포로부터 0.5% Chaps 버퍼로 용해된 단백질6-10 mg에 해당합니다. IP를 위한 세포 펠릿을 준비하기 위하여는, 세포는 PBS의 5 mL로 두 번 세척하고, 원심분리하고, 세척되어야 합니다. 이어서, 세포 펠릿은 IP의 시간까지 -80°C에서 1.5mL 마이크로센심심분리기 튜브 또는 15mL 원문관에 저장될 수 있다. IP는 신선한 수확 또는 냉동 셀 펠릿에서 수행 될 수 있습니다.
- MHC 급 I 또는 II 펩티드를 분리하려면 손바닥으로 튜브의 바닥을 따뜻하게하여 1 x 108 세포의 냉동 펠릿을 해동하십시오. 서스펜션이 균일해질 때까지 500μL의 PBS를 펠릿과 파이펫에 위아래로 추가합니다.
참고: 세포 유형에 따라 셀 펠릿 부피가 크게 달라질 수 있습니다. PBS의 500 μL이 셀 펠릿을 용해하기에 충분하지 않은 경우, 세포가 위아래로 파이펫을 하는 동안 쉽게 분해될 때까지 더 많은 PBS를 사용하십시오. - PBS에서 재중단된 펠릿의 총 부피를 측정하고 새로운 튜브 2 mL 마이크로센심분리기 튜브로 이송한다. 필요한 경우 더 많은 튜브로 분할합니다.
- 이전 단계에서 측정된 PBS에서 재연된 세포 펠릿의 부피와 동등한 세포 용해 버퍼(프로테아제 억제제가 함유된 PBS의 1% chaps 버퍼, 1펠릿/10mL 버퍼)를 추가합니다. 리시스 버퍼의 최종 농도는 0.5%입니다.
- 회전기 장치를 사용하여 4 °C에서 60 분 동안 10 rpm에서 회전하십시오. 원심분리기 는 4°C에서 20분 동안 18,000 x g 에서 최대 브레이크를 적용하고 새로운 2.0mL 마이크로센심분리기 튜브에서 슈퍼나탄트(MHC-펩티드 복합체 포함)를 이송한다.
- 항체 결합 구슬을 2분 동안 200 x g 에서 원심분리로 1.3.7 단계에서 회수하고 상체를 제거한다.
- 세포 용액 상체를 항체 결합 구슬에 2.4 단계로 옮기고 회전기 장치를 사용하여 4°C에서 14-18h(하룻밤)에 대한 회전(10 rpm)으로 배양한다.
3. MHC 펩티드의 용출 (2 일)
참고: 폴리프로필렌 컬럼은 비드를 컬럼으로 유지하면서 MHC-펩타이드 복합체를 용출할 수 있습니다. 1% TFA(트리플루오로아세트산)로 산성 용출 전후구구에 경계하는 MHC-펩타이드 복합체의 비율을 평가하기 위해 프로토콜 중 주요 단계에서 취한 알리쿼트와 함께 서부 블롯을 수행할 수 있다(선택 사항 표시 참조). 도 3 에 도시된 서양 블로팅은 1% TFA로 산성 용출에 따른 MHC-펩티드 복합체의 농축을 나타낸다. 이 분획에 신호가 없으면 용출 단계가 성공하지 않았음을 나타냅니다. 비드에 대한 언바운드 MHC-펩티드 복합체의 비율은 또한 3.1.6 단계에 기재된 알리쿼트를 사용하여 서양 블로팅에 의해 병렬로 평가될 수 있다.
- 항체 결합 구슬에서 MHC 펩티드 복합체의 용출
- 폴리프로필렌 컬럼의 아래쪽 뚜껑을 제거하고, 열을 폴리프로필렌 기둥 랙에 놓고, 아래에 빈 용기를 설치하여 흐름을 수집합니다.
참고: 샘플당 하나의 열이 필요합니다. - 10mL의 완충A로 폴리프로필렌 컬럼을 헹구고 중력에 의해 배수합니다. 액체 용출의 유속이 너무 느리면 폴리 프로필렌 컬럼의 바닥 끝을 더 잘라냅니다.
- 2.5단계에서 구슬-리자이혼합물(~2mL)을 측정하고 수집하여 폴리프로필렌 컬럼으로 옮기습니다.
- (선택 사항) 서쪽 블로팅을 위해 20 μL(또는 총 부피 중 1/100)의 알리쿼트(또는 총 부피 중 1/100)를 받아서 즉시 동결하십시오. 이 분획은 구슬로 배양된 총 MHC-펩타이드 복합체에 해당한다.
- 액체 혼합물을 중력에 의해 엘로트하자.
- (선택 사항) 흐름을 수집하고 측정하고 서쪽 블로팅을 위해 20 μL (또는 총 부피 중 1/100)의 알리쿼트 (또는 총 부피 중 1/100)를 받아 즉시 동결하십시오. 이 분획은 잔류 결합되지 않은 MHC-펩티드 복합체를 나타낸다.
- 구슬-리자테 혼합물을 가능한 한 많이 회수하려면, 3.1.3 단계에서 1mL의 완충A로 튜브를 헹구고 폴리프로필렌 컬럼으로 옮김한다.
- 버퍼 A의 10 mL을 추가하여 폴리 프로필렌 열에 유지 구슬을 세척합니다. 세탁 버퍼는 중력에 의해 엘루트하자.
- 완충 B 10mL, 완충A 10mL, 완충C 10mL로 세척 단계를 반복한다.
- 랙에서 폴리프로필렌 컬럼을 제거하고 새로운 2.0mL 마이크로센트심분리기 튜브 위에 놓습니다. 기둥과 튜브를 손으로 함께 잡습니다.
- 폴리프로필렌 컬럼에 1% TFA의 300 μL을 추가하고 5번 위아래로 파이프를 사용하여 구슬을 섞습니다.
참고: 비드는 폴리프로필렌 컬럼에 보관되며, MHC 바운드 펩타이드는 2.0mL 마이크로센트심분리기 튜브에서 엘루트됩니다. - 새로운 2.0 mL 마이크로센심분리기 튜브에서 용출을 전송합니다. 반복 단계 3.1.11 및 풀 2 용출 (MHC-펩티드 복합체를 포함하는 용출은 총 600 μL에 대응해야하며 단계 3.2.4에서 사용됩니다).
- (선택 사항) 서쪽 블로팅을 위해 6 μL(또는 총 부피의 1/100)의 알리쿼트(또는 총 부피의 1/100)를 수집하여 즉시 동결합니다. 이 분획은 구슬에서 출루된 MHC-펩티드 복합체에 해당한다.
- 폴리프로필렌 컬럼의 아래쪽 뚜껑을 제거하고, 열을 폴리프로필렌 기둥 랙에 놓고, 아래에 빈 용기를 설치하여 흐름을 수집합니다.
- MHC 펩타이드의 탈염 및 용출
참고: MHC 펩티드 단계의 탈염 및 용출은 2.0 mL 마이크로 센트리슈후지 튜브에 C18 컬럼을 설치하여 수행 될 수 있습니다. 더 잘 맞도록 C18 컬럼과 2.0 mL 마이크로센심분리기 튜브 사이에 제조업체에서 제공하는 절전 프로그램을 설치하십시오. 이 프로토콜에서 C18 컬럼은 5-200 μL(6-60 μg)의 부피 용량과 함께 사용됩니다. 모든 단계는 RT에서 수행됩니다.- C18 열 위에 메탄올 200 μL을 추가한 다음 원심분리기는 1546 x g 에서 3분 동안 추가합니다. 흐름을 삭제합니다.
- C18 열 위에 80%ACN(아세토닐릴)/0.1%TFA의 200 μL을 추가한 다음 원심분리기는 1546 x g 에서 3분 동안 추가합니다. 흐름을 삭제합니다.
- C18 열 위에 0.1%TFA의 200 μL을 추가한 다음 원심분리기는 1546 x g 에서 3분 동안 추가합니다. 흐름을 삭제합니다.
- C18 컬럼 위에 3.1.12 단계로부터 MHC-펩타이드 복합체의 200 μL을 적재한다. 원심분리기는 1546 x g 에서 3분 동안 흐르고 흐름을 버립니다.
- 전체 볼륨이 로드될 때까지 3.2.4 단계를 두 번 반복합니다. MHC 펩타이드는 C18 컬럼에 유지됩니다.
- C18 열에 0.1%TFA의 200 μL을 추가한 다음 원심분리기는 1546 x g 에서 3분 동안 추가합니다. 흐름을 삭제합니다.
- C18 컬럼을 새로운 2.0mL 마이크로센심분리기 튜브로 전송합니다. 28%ACN/0.1%TFA의 150 μL을 추가하여 C18 컬럼에서 엘루트 MHC 펩티드.
- 원심 분리기 1546 x g 에서 3 분 동안.
- 새로운 1.5 mL 마이크로 센심 분리기 튜브에서 흐름을 전달합니다. 흐름을 버리지 않도록 주의하십시오. 그것은 절연 된 MHC 클래스 I 또는 II 펩티드를 포함합니다.
- 총 부피 450 μL에 대해 3.2.7-3.2.9를 두 번 반복합니다.
- 샘플이 LC-MSMS에 의해 분석될 때까지 -20°C에서 용출액(정제 된 MHC 급 I 또는 II 펩타이드)의 450 μL을 동결한다.
- LC-MS/MS 분석에 앞서, 3.2.11 단계로부터 정제된 MHC 급 I 또는 II 펩타이드는 2h, 진공 레벨: 100 mTorr 및 진공 램프에 대한 45°C의 사전 셋을 사용하여 건조로 증발된다.
참고: 냉동 시료의 증발은 매우 효율적입니다. 말린 펩타이드는 분석될 때까지 재냉동할 수 있다.
4. LC-MS/MS에 의한 MHC 급 I 및 II 펩티드 식별
참고: 고성능 궤도랩및 고해상도 쿼드러폴 시간 질량 분광기6를 사용하여 MHC 급 I 및 II 면역펩티돔을 분석합니다. 다음 정보는 다양한 기존 탠덤 질량 분석 기체가 다른 운영 표준에 따라 작동한다는 점을 고려하여 표시로만 제공됩니다. 단계의 간략한 개요는 다음과 같습니다.
- 건조된 시료(3.2.12단계로부터)를 4%의 포믹산(FA)의 50μL에서 용해한다.
- 각 시료에 대해 16μL의 3개의 주사를 적재하고 집에서 만든 반전 상 열(150-μm i.d.by 250mm 길이, 목성 3 μm C18 300 Å)에 분리하고 5%-30% ACN-0.1% FA및 나노 UH-UH흐름에 600nL/min 유동률을 갖는다.
- 120000의 해상도로 각 전체 MS 스펙트럼을 획득, 최대 3s의 가장 풍부한 곱배음 전구체 이온에 탠덤-MS (MS-MS)를 사용하여 주입 시간 및 스펙트럼을 위한 자동 모드와 4 x 105 의 AGC.
참고: 탠덤-MS 실험은 충돌 에너지 30%, 해상도 30,000, AGC 1.5 x 105, 300ms의 주입 시간을 사용하여 고에너지 충돌 해리(HCD)를 사용하여 수행됩니다. - 마우스 및 인간 데이터베이스(UniProtKB/Swiss-Prot(2019_09)를 사용하여 프로테오믹스 LC-MS/MS 분석 소프트웨어(예: PEAKS X)를 사용하여 세 개의 주사/샘플에서 데이터 파일을 처리합니다.
- 효소 매개 변수에 대한 '불특정 효소 소화'를 선택하고, 전구체 및 단편 이온에 대한 질량 내성은 각각 10 ppm 및 0.01 Da를 선택합니다.
참고: 가변 수정은 탈아미디션(NQ) 및 산화(M)입니다. 다른 모든 검색 매개 변수는 기본 값입니다. 최종 펩티드 목록은 80%의 ALC를 사용하여 필터링되며, 프로테오믹스 LC-MS/MS 분석 소프트웨어를 사용하여 1%의 거짓 발견률(FDR)을 사용합니다.
5. 면역 펩티도믹스 데이터의 시각화
참고: MS에 의해 생성된 면역펩티도믹스 데이터의 품질은 최근에 설명된 바와 같이 여러 가지 방법으로 평가될 수 있다22,23. 데이터를 시각화하고 전반적인 품질, 구성 및 MHC 특이성을 평가하기 위해 MHcVizPipe(MVP) 소프트웨어 도구를 사용할 수 있습니다.
- 모든 지침 및 관련 문서를 따라 Caron Lab GitHub website24에서 사용할 수 있는 MVP 소프트웨어를 설치하고 실행하십시오.
참고: MVP는 샘플 품질, 구성 및 MHC 특이성에 대한 신속하고 통합된 보기를 제공합니다. MVP는 잘 확립된 면역펩티도믹스 알고리즘(NetMHCpan25, NetMHCIIpan26 및 GibbsCluster27)의 사용을 병렬화하고 HTML(하이퍼텍스트 마크업 언어) 형식으로 체계적이고 이해하기 쉬운 보고서를 생성합니다. 보고서는 완전히 휴대 가능하며 최신 웹 브라우저가있는 모든 컴퓨터에서 볼 수 있습니다. HTML 보고서의 예는 보충 데이터 1-4를 참조하십시오.
결과
MS에 의한 면역펩티돔 분석을 위한 MHC-펩티드 복합체를 분리하는 일반적인 워크플로우가 도 1에 도시된다. 항체의 구슬 결합 효율(도 2)(Y3 항-H2Kb 항체를 사용함) 및 구슬로부터 MHC-펩티드 복합체의 용출 효율(도 3)(W6/32 항HLA-ABC 항체를 사용하여)의 용출 효율을 검증하는 대표적인 결과가 나타난다. 플로트 사이토메트리 계 정량화 분석21은 또한 도 4A에 도시된 바와 같이 EL4 세포(H2Kb 및 H2Db) 및 JY 세포(HLA-ABC)당 MHC 클래스 I 분자의 절대 수를 측정하기 위해 적용되었다.
현재 프로토콜을 사용하는 결과의 개인 간 재현성은 도 4B-E에 도시된다. 대표적인 결과는 1 x 108 EL4 세포 및 1 x 108 JY 세포에서 확인된 MHC 급 I 펩티드에 대해 도시된다. 결과는 두 개의 서로 다른 랩 멤버(사용자 1 및 사용자 2)로부터 생성되었습니다. 사용자 1의 경우, EL4 및 JY 세포로부터 검출된 MHCI 특이적 펩티드의 평균 수는 각각 1341 및 6361이었다. 사용자 2, 1933 및 7238의 경우 각각(그림 4B,D). 3개의 상이한 생물학적 복제/실험에서 검출되는 펩티드의 수에 대한 변이(CV)의 평균 계수는 1.9%-11%에서 다릅니다(그림 4B,D). 3개의 상이한 실험에서 검출된 펩티드의 수에 대한 CV는 상대적으로 작지만, 펩타이드의 정체성은 상당히 다양하였다(도 4C, E). 실제로, 대표적인 벤 다이어그램은 3개의 생물학적 복제에 걸쳐 재현적으로 검출된 펩티드의 비율이 39%(사용자 2, EL4 세포)에서 63%(사용자 1, JY 세포)(도 4C, E 및 보충표 2)에 구역화되었다는 것을 보여줍니다.
MVP 소프트웨어 쇼에 의해 생성 된 히트맵은 NetMHCpan 제품군 도구를 사용하여 식별 된 펩타이드의 MHC 결합 강도를 예측25,26,28. '감독되지 않은 깁스클러스터'와 '알레레 특이적 깁스클러스터'라고 불리는 두 개의 깁스클러스터 루틴 옵션도 MVP가 MHC 펩티드 결합 모티브를 추출합니다. MVP에는 제한이 있습니다. 주요 목표는 골문 별 모티프를 추출하고 펩타이드에 대해 매우 정확한 방식으로 부음하는 것이 아니라 샘플의 전반적인 품질, 조성 및 MHC 특이성에 대한 조감도를 제공하는 것입니다.
EL4 세포에서 마우스 MHC 클래스 I(H2Db 및 H2Kb) 펩티드의 경우(도 5A; 상부 패널 및 보충 데이터 1), 대표 히트맵은 검출된 모든 8-12메르 펩타이드의 89%가 H2Db 또는 H2Db 또는 H2Kb 분자에 대해 강한 바인더(SB: NetMHCpan %랭크 <0.5) 또는 약한 바인더(WB: NetMHCpan %랭크 <2)로 예측된다는 것을 보여줍니다. 8-12-메르 펩티드로부터 생성된 서열 클러스터는 H2Db(P5의 아스파라진 및 P9의 류신)와 H2Kb(P5의 페닐알라닌 및 P8의 류신)에 대한 보고된 로고와 일치한다(그림 5)29. M1 항체(보충 데이터 1)를 이용하여 제3의 지배적 모티프(P7 및 P9의 류신에서의 히스티딘)와 추가적인 '관절' 모티프를 관찰할 수 있다는 점은 주목할 가치가 있다. 실제로, M1 항체는 비고전성 Qa2 분자와 교차 반응하는 것으로 알려져 있으며, 따라서 Qa2-관련 펩티드는 MS(보충 데이터 1)에 의해 검출된다. 여기서, 단순성, 도 5는 EL4 세포에서 발현된 두 개의 고전적인 H2b 알렐(즉, H2Db 또는 H2Kb)에 대한 잘 확립된 펩타이드 결합 모티브를 보여주는 데 중점을 둡니다.
인간 HLA 클래스 I (HLA-ABC) JY 세포 (그림 5A; 낮은 패널 및 보충 데이터 2)의 펩티드의 경우, 대표적인 히트맵은 모든 검출 된 8-12 메르 펩타이드의 97 %가 HLA-A * 0201, -B *0702 또는 -C *0702에 대한 SB 또는 WB로 예측된다는 것을 보여줍니다. 펩타이드는 HLA-A*0201 및 -B*0702용 펩타이드 결합 모티브를 시각화하기 위해 클러스터링되었다. HLA-C*0702용 바인딩 모티프는 C*0702 본선에 발현 수준이 상대적으로 낮기 때문에 도 5A에 표시되지 않습니다. 따라서 너무 적은 C*0702 펩티드는 분리되고 대표적인 C*0702 모티프를 생성하도록 식별되었다. C*0702 모티프는 다른 연구에서 시각화할 수 있습니다30,31,32 또는 NetMHCpan 4.1 모티프 뷰어 웹 사이트33에서.
JY 세포(그림 5B; 상부 패널 및 보충 데이터 S3)의 인간 HLA 클래스 II(HLA-DR) 펩타이드의 경우, 9-22메르 펩타이드모두 검출된 9-22메르 펩타이드의 70%가 HLA-DRB1*0404 및 -DRB1*1301의 경우 SB 또는 WB로 예측된다. 이 두 개의 진골에 대한 펩타이드 결합 모티프가 표시됩니다(도 5B). 여기에 표시된 펩타이드 결합 모티프는 HLA-DRB1*0404 및 -DRB1*130134에 대해 최근에 보고된 로고와 완전히 일치하지 않을 수 있습니다. 이러한 불일치는 MVP/NetMHCpan이 JY 세포에서 발현된 HLA-DRB1*0404 및 -DRB1*1301과 같이 특성이 떨어지는 HLA 클래스 II 송장에게 펩티드를 정확하게 송장하는 것이 현재의 무능력함을 강조합니다. 클래스 II 펩타이드 결합 모티프에 대한 추가 정보는 다른 연구에서 찾을 수 있습니다34,35 및 NetMHCIIpan 4.0 모티프 뷰어 웹 사이트에서 36.
마지막으로, A20 세포(그림 5B; 하부 패널 및 보충 데이터 4)에서 마우스 MHC 클래스 II(H2-IAd 및 H2-IEd) 펩타이드의 경우, 대표적인 히트맵은 검출된 모든 9-22메르 펩타이드의 87%가 H2-IAd 또는 H2-Ied에 대한 SB 또는 WB로 예측된다는 것을 보여줍니다. 이 두 개의 모두에 대한 펩타이드 바인딩 모티프는 보고된 로고s37과 일치합니다.
MVP 소프트웨어에서 생성된 완전한 HTML 보고서는 샘플의 전반적인 품질 및 MHC 특이성을 평가하기 위한 보충 데이터 1-4에서 확인할 수 있습니다.
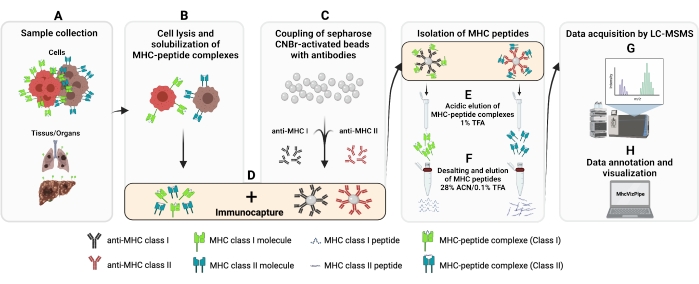
도 1: MHC 급 I 및 II 펩타이드의 분리를 위한 완전한 절차의 회로도. (A-B)1억 전지는 0.5% Chaps 버퍼로 펠릿과 용액처리됩니다. (C) 세포 용액은 원심분리되고, 상체는 CNBr-sepharose 구슬에 미리 원하는 항체에 결합되고 (D) 면역 포획 에 따라 4°C에서 14-18h를 배양하고, 비드는 폴리프로필렌 기둥으로 옮겨져 세척하고, MHC-펩티드를 1%로 결합하여 용액을 갖는다. (F) 펩타이드는 C18 컬럼을 사용하여 탈염및 용출된다. (G) 그 후, 펩타이드는 속도 진공 건조 건조및 탠덤 질량 분석법에 의해 분석된다. (H) 분리된 MHC 급 I 및 II 펩타이드의 품질은 자유롭게 이용 가능한 MhcVizPipe 소프트웨어를 사용하여 HLA 특수형을 기반으로 평가될 수 있다. BioRender.com(NT22ZL8QSL)로 만든 그림입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
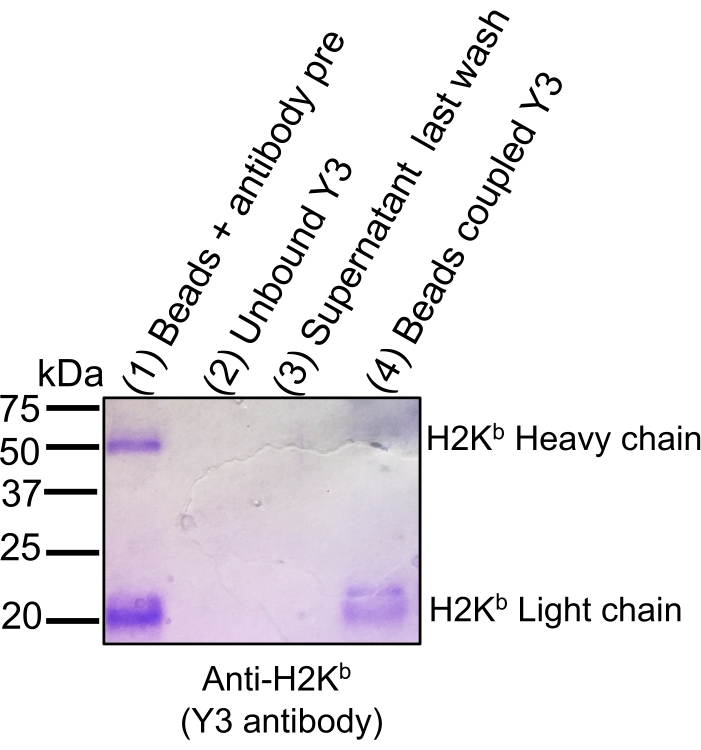
도 2: 쿠마시 젤 염색은 세파로즈 CNBr 활성화 구슬에 대한 항체 결합 효율을 추적한다. 동등한 양의 알리쿼트가 12% SDS-PAGE 젤에 적재되었고 쿠마시 블루 스테닝( 구슬 + 항체 프리 커플링(1), 결합 단계(2), 결합 후 마지막 세척(3), 항체(4)와 결합된 비드에 이어 무한한 항체가 결합되었다. 결합의 효율은 구슬이 결합 하기 전에 항체에 비해 CNBr 구슬에 공유 바인딩 (레인 4)인 경우 H2Kb의 빛과 무거운 체인의 신호 염색 강도의 현저한 감소에 의해 도시된다(레인 1). 이 수치는 bioRxiv38에서 재인쇄및 적용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 항체 결합 CNBr 활성화 구슬에서 산성 용출 다음 MHC-펩티드 복합체를 추적하기위한 서양 블로팅. 프로토콜에 표시된 단계(총 측정된 부피의 1/100)에서 가져온 알리쿼트(총 측정된 부피의 1/100)를 12% SDS-PAGE 젤에 적재하고 니트로셀룰로오스 막으로 옮겼습니다: 비드 + 면역 포획 및 마지막 세척(A); 구슬(C)으로부터 용출된 마지막 세척(B) 및 MHC-펩타이드 복합체의 상골. 항 HLA-ABC 중형 사슬 항체(Abcam, #ab 70328, 1:5000)를 이용한 MHC-펩티드 복합체의 강력한 검출 신호는 산성 용출 에 따른 MHC-펩티드 복합체의 분리를 확인하였다. 3.1.6단계에서 유동을 수집하여 항체 결합 구슬에 의해 포획되지 않은 MHC-펩티드 복합체의 비율을 평가할 수 있다. 알리쿼트는 서쪽 얼룩에 추가될 수 있습니다(이 젤에는 표시되지 않음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
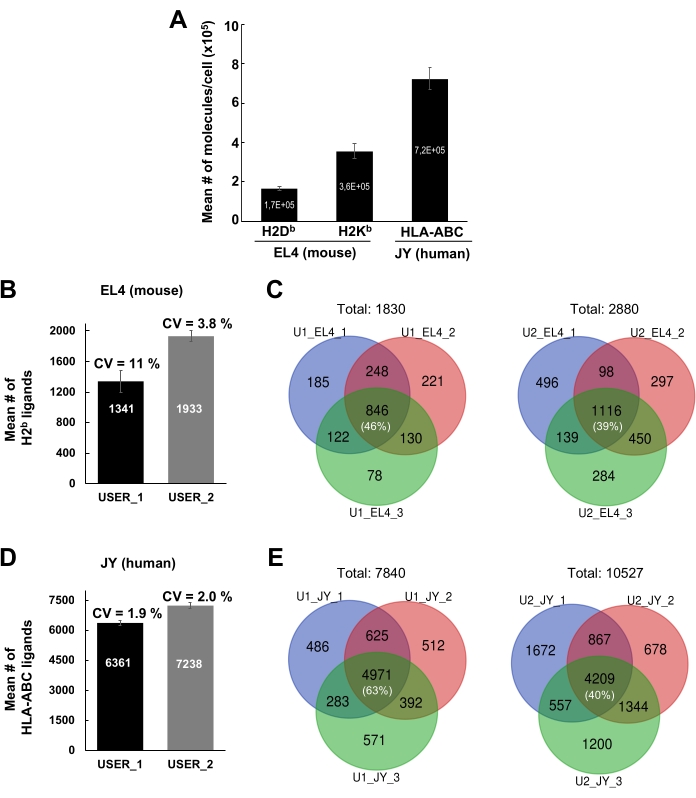
그림 4: JY 및 EL4 세포로부터 MHC 클래스 I 펩티드의 식별. (A) EL4 세포당 절대 수의 세포 표면 H2Db 및 H2Kb 분자와 JY 세포당 HLA-ABC 분자를 나타내는 히스토그램. 정량화는 유동 세포측정에 의해 수행되었다. 평균의 평균 및 표준 오차는 세 가지 생물학적 복제로부터 얻어졌다. (B, D) 히스토그램은 두 명의 독립적인 사용자(USER_1 [U1] 및 USER_2 [U2])에 의해 확인된 MHC 급 I 펩티드의 평균 수 및 표준 편차를 나타낸다. 마우스 EL4 세포(B) 및 인간 JY 세포(D)로부터 검출된 MHC 급 I 펩티드의 평균 수 및 표준 편차가 도시된다. 3개의 독립적인 생물학 복제에 걸쳐 변이계 (CV)가 표시됩니다. (C, E) 3개의 독립적인 생물학적 복제에 걸쳐 2명의 독립적인 사용자(U1 및 U2)에 의해 EL4(C) 및 JY 세포(E)에서 재현적으로 검출된 펩티드의 수를 보여주는 벤 다이어그램. 도 4A는 bioRxiv38에서 재인쇄 및 적응되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
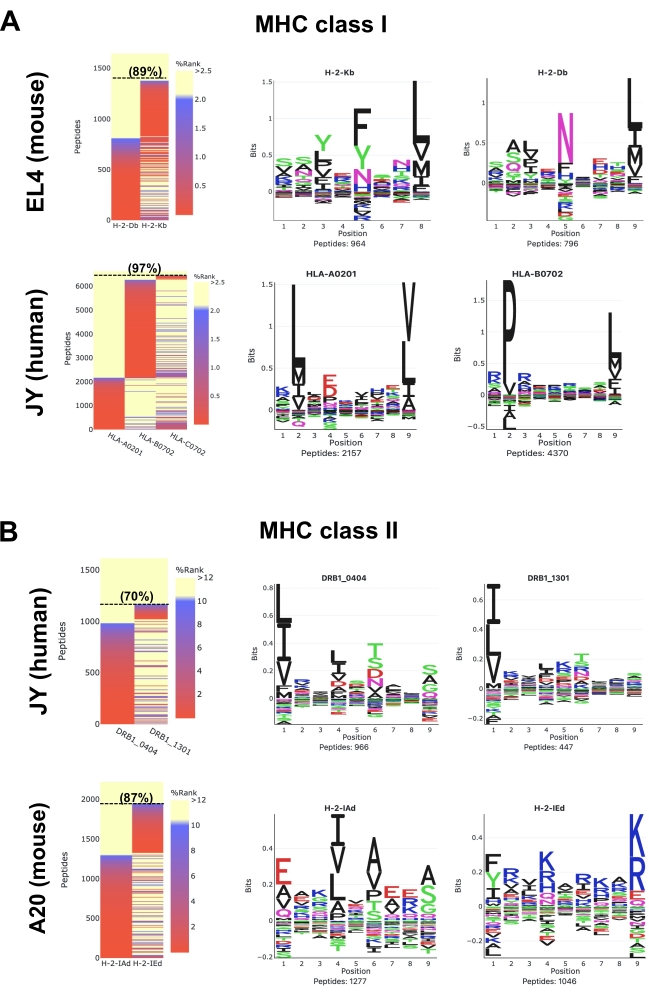
그림 5: MVP 소프트웨어 도구를 사용하여 면역펩티도믹스 데이터의 시각화. 마우스 및 인간(A) MHC 클래스 I 및 (B) MHC 급 II 펩타이드의 데이터 분석. 대표적인 결합 친화성 히트맵(왼쪽 패널) 및 펩타이드 결합 모티프(오른쪽 패널)가 표시됩니다. 히트맵 색상은 NetMHCpan 4.1(%랭크)에서 예측한 MHC 바인딩 선호도를 나타냅니다. 강한 바인더는 빨간색 (%랭크 <0.5), 약한 바인더는 파란색 (%랭크 <2)이며 비바인더는 노란색(%랭크 >2)입니다. SB 또는 WB인 8-12머 펩티드(A) 및 9-22mer 펩타이드(B)의 비율(%) 괄호안에 표시된다. 펩타이드 바인딩 모티프는 '알레레 전용 깁스클러스터' 옵션을 사용하여 MVP에 의해 생성되었습니다. 이러한 대표적인 결과는 1 x 108 세포로부터 수득되었고 다음 항체 및 세포주를 이용하여 마우스 MHC 급 I 펩티드에 대한 M1 항체 및 EL4 세포; 인간 MHC 급 I 펩티드를 위한 W6/32 항체 및 JY 세포; 마우스 MHC 급 II 펩티드를 위한 M5 항체 및 A20 세포; 인간 MHC 급 II 펩티드용 L243 항체 및 JY 세포. MVP 소프트웨어에서 생성된 전체 HTML 보고서에 액세스하려면 보충 데이터 1-4를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
추가 데이터 1-4: 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 데이터 1: M1 항체를 사용하여 1 x 108EL4 세포로부터 격리된 펩티드로부터 MVP 소프트웨어에 의해 생성된 HTML 보고서. 3개의 생물학 복제가 표시됩니다. 본 보고서는 도 4 및 도 5및 대표적인 펩타이드가 보충표 2에 기재되어 있다.
보조 데이터 2: W6/32 항체를 사용하여 1 x 108JY 세포로부터 격리된 펩티드로부터 MVP 소프트웨어에 의해 생성된 HTML 보고서. 3개의 생물학적 재플레이트가 표시됩니다. 본 보고서는 도 4 및 도 5와 관련이 있으며, 대표적인 펩타이드는 보충표 2에 기재되어 있다.
보충 데이터 3: L243 항체를 사용하여 1 x 108JY 세포로부터 격리된 펩티드로부터 MVP 소프트웨어에 의해 생성된 HTML 보고서. 본 보고서는 도 5와 관련이 있으며 대표 펩타이드는 보충표 2에 기재되어 있다.
보조 데이터 4: M5 항체를 사용하여 1 x 108A20 세포로부터 격리된 펩티드로부터 MVP 소프트웨어에 의해 생성된 HTML 보고서. 본 보고서는 도 5와 관련이 있으며 대표 펩타이드는 보충표 2에 기재되어 있다.
보충 표 1: 버퍼 목록입니다. 프로토콜에 사용되는 모든 버퍼에 대한 조리법이 설명되어 있습니다. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: H2Db/Kb, HLA-ABC, HLA-DR 및 H2-IAd/IEd와 관련된 펩타이드의 대표적인 목록. 이 표에는 마우스 EL4 및 A20 세포주로부터 분리된 대표적인 MHC 클래스 I 및 II 펩타이드 목록과 인간 JY 세포주로부터의 HLA 클래스 I 및 II목록이 포함되어 있다. 이러한 데이터는 ProteomeXchange(PXD028633)에 입금되었습니다. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
데이터 가용성:
이 원고에 사용된 데이터 집합은 ProteomeXchange(http://proteomecentral.proteomexchange.org/cgi/GetDataset): PXD028633에 기탁되었습니다.
토론
마우스 세포주 2개(EL4 및 A20), 인간 세포주 1개(JY), 5개의 시판 가능한 항체[M1(항-H2Db/Kb), Y3(항H2Kb), M5(항H2-2-2-IAd/IEd), W6/32(안티 HLA-ABC), 및 L243(안티 HLA-DR)]은 이 프로토콜의 맥락에서 테스트 및 검증되었으며 고품질 면역펩티도믹스 데이터를 제공합니다. 다른 항 HLA 항체는 유효합니다 (예를 들면, 반대로 HLA-A2 BB7.2) 그러나 여기에서 시험되지 않았습니다. W6/32 항체는 널리 사용되고 분야에서 가장 확립된 항체; 그것은 인간에 있는 모든 HLA-ABC 분자에 의해 제시된 펩티드의 격리를 가능하게 하고 이전에 신선하거나 동결된 조직8,39, 말초 혈액 단핵 세포 및 골수 단핵 세포40, 생검41, xenografts41, 부검4,42 및 혈장 견본과 같은 각종 생물학 근원에서 일하기 위하여 전문가 실험실에 의해 이전에 보고되었습니다.
프로토콜 전반에 걸쳐 사용되는 새로운 솔루션의 준비는 매우 중요합니다. 특히, 유리 병에 신선한 산성 용액을 사용하는 것은 MS에 의해 분석된 시료의 후속 오염을 피하기 위해 매우 중요합니다. 또한, 프로토콜이 처음으로 수행될 때 및/또는 새로운 항체로, 항체가 실제로 청색 쿠마시 젤을 사용하여 CNBr 세포로스 구슬에 결합되어 있음을 평가하는 것이 중요하다. MHC-펩타이드 복합체의 면역 포획 에 따른 항체 결합 구슬의 세척 단계는 비 MHC 펩타이드의 오염을 피하는 데에도 중요하다. 마지막으로, 1% TFA와 C18 컬럼으로부터펩티드의 용출을 1%로 한 후 용출을 폐기하지 않도록 특별한 주의가 요구된다.
문헌에서 제공되는 기존 프로토콜은 10-30 kDa filters13,47을 사용하여 서로 다른 방법에 의한 펩타이드 분획과 예를 들어, 절연 절차의 끝에 펩티드를 더욱 정화하는 추가 단계를 설명한다. 현재 프로토콜은 이러한 추가 단계에 대한 세부 정보를 제공하지 않으며 고품질 면역 펩티도믹스 데이터를 제공하기에 충분합니다. 그러나, 이러한 단계는 펩티드 절연 절차를 더욱 최적화하기 위해 비 전문가가 수정하고 문제를 해결하는 것으로 간주될 수 있다.
구슬의 종류와 구슬에서 MHC 복합체를 엘루트하는 데 사용되는 산성 용출 버퍼의 유형도 문제 해결을 위해 수정될 수 있습니다13,14,15,16,17,18,19. 이와 관련하여, 세파로즈 CNBr 활성화 구슬은 다양한 유형의 항체와 결합의 측면에서 유연성을 보여주는 것 이외에 상대적으로 저렴하기 때문에 일반적으로 좋은 출발점이다. 현재 프로토콜에서, 세파로즈 CNBr 활성화 구슬은 5개의 상이한 시판 가능한 항체(즉, M1, Y3, W6/32, L243 및 M5)를 사용하여 비교적 잘 수행되는 것으로 나타났다. 세파로즈 CNBr 활성화 구슬 외에, 단백질 A 또는 G 또는 A/G 세파로즈 4 패스트 플로우 구슬도 취급하기 쉽고, 상대적으로 더 비싸더라도 유사한 결과를 생성할 수 있습니다. 고려해야 할 또 다른 요인은 단백질 A 또는 G용 항체의 친화성이다. 또한, 세파로즈 자기 구슬도 사용하기 가 매우 쉽지만 상대적으로 비싸다. 비전문가에 의해 선택된 구슬의 종류와는 달리, 프로토콜의 중요한 단계에서 알리쿼를 수집하고 그림 2에 도시된 바와 같이, 구슬에 대한 항체의 결합 효율을 추적하기 위해 파란색 쿠마시 스테인드 SDS-PAGE 젤을 수행하는 것이 좋습니다.
MHC 펩티드 절연의 성공성에 영향을 미치는 또 다른 중요한 요소는 비드로부터 MHC-펩티드 복합체를 분리하는 데 사용되는 산성 용출 버퍼의 유형을 지칭한다. 0.1%, 1% 또는 10% TFA, 0.2% FA 및 10% 아세트산을 포함한 다양한 완충액이 보고되었습니다. 1% TFA는 시험된 모든 항체를 위해 일하는 용출 완충제였다. 이 단계는 또한 그림 3에 도시된 바와 같이 MHC 펩티드를 포착하는 데 사용되는 MHC 분자에 대하여 서쪽 블로팅에 의해 추적될 수 있었습니다.
아세토나이트(ACN) 및/또는 트리플루오로아세산(TFA)을 함유하는 모든 완충제는 공격적이며 플라스틱과 접촉하는 경우 가소제와 같은 작은 분자 및 중합물질로 시료의 오염으로 이어질 수 있다. 이러한 문제를 방지하기 위해 유기 용매 및/또는 TFA를 포함하는 모든 솔루션은 매일 신선하게 준비되고 사용이 끝날 때까지 유리 병에 보관됩니다. 단계의 대부분은 단백질 LoBind 플라스틱 튜브에서 수행됩니다. 이 튜브는 프로테오믹스용으로 특별히 설계되었으며 생체 제, 가소제 및 라텍스가 없는 최고 품질의 버진 폴리프로필렌으로 만들어집니다. 또한 미끄럼 방지 제고 없이 최적화된 고광택 금형으로 생산됩니다. 이러한 예방 조치는 고품질 면역 펩티도믹스 데이터의 생성을 가능하게 하는 것을 고려하는 것이 중요합니다.
항체는 MHC 결합 펩티드의 절연을 위한 중요한 한계입니다. W6/32 항체는 인간에서 모든 HLA-ABC 급 I 분자에 의해 제시된 펩티드의 분리를 가능하게 하고 분야에서 가장 널리 사용되고 확립된 항체이다. 특징이 없는 인간 세포주 또는 바이오시편의 고해상도 HLA 타이핑은 W6/32 항체를 적용할 때 필요한 것은 아니지만 데이터 해석을 용이하게 하기 위해 특정 응용 분야에 권장됩니다48. HLA/MHC 타이핑 정보는 또한 다중 세포주 및 마우스 모델에 대한 공공 자원에서 찾을 수 있습니다49. W6/32 항체 외에도 이 프로토콜의 맥락에서 테스트및 검증된 4개의 다른 항체(M1, M5, Y3 및 L243)는 모두 시판된다. 한편, 이전 면역펩티도믹스 연구에서 보고된 다른 많은 항체는 지역 사회에 의해 크게 채택되지 않았으며 상업적으로 이용 가능하지 않거나 혼종 세포주의 배양을 통해 사용할 수 있으며, 이는 상대적으로 비싸다.
MHC 결합 펩타이드의 분리에 대한 또 다른 중요한 제한은 필요한 시동 물질의 양이다. 필요한 양은 세포 표면상MHC 분자의 발현 수준에 반비례하며, 이는 혈류 세포측정에 의해 정량화될 수 있다(도 4A). MHC 분자의 높은 발현 수준을 보여주는 세포 (예를 들어, 수지상 세포 및 일반적으로 조혈 세포) 일반적으로 고품질 면역 펩티도믹스 데이터를 산출한다. 전문가 실험실은 5천만 개의 셀50에서 사용하지만 비 전문가에게는 1억에서 10억 개의 세포가 권장됩니다. 조직 생검 (<13 mg)41, xenograft42,43, 부검44, 및 혈장45,46 샘플의 사용도보고되었지만 비 전문가 실험실에 대한 도전남아있다. 또한, 예상되는 MHC-관련 펩타이드의 총 수는 확립된 세포주(여기, 세포주 및 항체에 따라 ~2000~10000펩타이드 사이)에 대해 잘 문서화되어 있지만, 기술에 의해 효율적으로 끌어당겨진 자연적으로 제시된 펩타이드의 절대양은 여전히 논의되고 있다. 실제로, 이전 연구는 격리 절차의 효율이 펩티드 의존적이며 0.5%-2%51로 낮을 수 있다고 추정했다. 면역펩티도믹스의 다른 한계는 보다 덜 특징적인 MHC 송계에 펩티드에 올바르게 송부하는 NetMHCpan 제품군 도구의 방법 및 무능력의 재현성이다. 이와 관련하여, 비교적 새로운 데이터 독립적 인수 MS 방법7,32,52뿐만 아니라 새로운 펩타이드 클러스터링 및 MHC 펩타이드 결합 예측 알고리즘31,34,53,54의 추가 개발 및 적용 면역펩티도믹스에서 펩타이드 음장의 재현성과 정확도를 향상시킬 것으로 기대된다. 면역펩티도믹스는 MHC 관련 펩타이드의 MS 획득 및 계산 분석에 관한 다른 한계에 직면하고 있으며 다른 곳에서 다루어지고 있다1,6,55.
W6/32 항체를 이용한 인간 샘플로부터 HLA-ABC-관련 펩티드의 분리는 많은 연구 군에 의해 잘 확립되고 널리 적용되며, 마우스 MHC 급 I-및 II-관련 펩티드의 분리는 상대적으로 덜 확립된다. 따라서 마우스 MHC 리간드의 분리를 위한 강력한 프로토콜이 필요합니다. 여기서, 우리는 각각 C57BL/6 및 BALB/c 기원의 2개의 마우스 세포주로부터 MHC 급 I 펩티드 및 MHC 급 II 펩티드의 분리에 최적화된 프로토콜을 제공한다. 구체적으로, 이 프로토콜은 M1 항체를 이용한 클래스 I H2Kb-및 H2Db-관련 펩타이드뿐만 아니라 M5 항체를 이용한 클래스 II H2-IAd 및 H2-IEd-관련 펩타이드의 분리를 가능하게 한다. 따라서, 현재 프로토콜의 보급 및 적용은 다양한 마우스 모델에서 기본 및 번역 면역펩티도믹스 연구를 용이하게 한다.
이 프로토콜은 면역펩티도믹스 워크플로우를 설정하고 표준화하고 새로운 프로토콜을 벤치마킹하는 데 사용할 수 있습니다. 예를 들어, 혈액/플라즈마에서 신선하거나 냉동된 조직에 이르는 다양한 생물학적 행렬에서 FFPE(포르말린 고정 파라핀-임베디드)에 이르는 다양한 생물학적 행렬에서 면역펩티도믹스 스크리닝을 수행하기 위해 적응하고 더욱 최적화될 수 있다. 더욱이, 이 프로토콜은 면역펩티도믹스에서 시료 제제 절차의 실험실 내 및 실험실 간 재현성을 육성하여 기초 및 임상 연구에서 폭넓은 적용을 찾을 것으로 기대된다.
공개
저자는 경쟁적인 재정적 이익이 없다고 선언합니다.
감사의 말
우리는 피에르 티보, 에릭 본닐, 조엘 라노이스, 캐롤라인 코트 (면역학 및 암 연구 연구소, 유니버시테 드 몬트리올) 및 앤서니 퍼셀 (모나시 대학)에게 통찰력있는 의견에 감사드립니다. 이 작품은 퐁드 드 레체슈 뒤 퀘벡 - 산테 (FRQS), 콜 재단, 추 상트 저스틴, 찰스 브루나우 재단, 캐나다 혁신 재단, 국립 과학 및 공학 연구 위원회 (NSERC) (#RGPIN-2020-05232) 및 캐나다 보건 연구 연구소 174924 (CIHR)의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| A20 cell line | ATCC | TIB-208 | mouse B lymphoblast |
| Acetonitrile, LC/MS Grade | FisherScientific | A955-4 | |
| anti-Human HLA A, B, C (W6/32) - MHC class I | BioXcell | BE0079 | |
| anti-Human/Monkey HLA-DR (L243) - MHC class II | BioXcell | BE0308 | |
| anti-Mouse H2 (M1/42.3.9.8) - MHC class I | BioXcell | BE0077 | |
| anti-Mouse H2-IAd/IEd (M5/114) - MHC class II | BioXcell | BE00108 | |
| anti-Mouse H2Kb (Y3) - MHC class I | BioXcell | BE0172 | |
| BupH Phosphate Buffered Saline Packs (PBS) | ThermoFisher | 28372 | Pouch contents dissolved in a final volume of 500 mL deionized water (FisherScientific, W64) |
| CHAPS (3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate) | EMDMilipore | 220201-10MG | |
| CNBr-activated Sepharose | Cytivia | # 17-0430-01 | |
| EL4 cell line | ATCC | TIB-39 | mouse T lymphoblast |
| epTIPS LoRetention Tips, 1000 µL/Eppendorf | FisherScientific | 02-717-352 | Better results with low retention material |
| epTIPS LoRetention Tips, 200 µL/Eppendorf | FisherScientific | 02-717-351 | Better results with low retention material |
| Formic Acid, LC/MS Grade | FisherScientific | A117-50 | |
| Glycine | FisherScientific | RDCG0250500 | |
| Hydrochloric acid solution | FisherScientific | 60-007-11 | |
| JY cell line | Sigma Aldrich | 94022533-1VL | EBV-immortalised B cell lymphoblastoid line |
| Methanol, LC/MS Grade | FisherScientific | A456-4 | |
| Poly prep chromatography columns (polypropylene column) | Bio-Rad | 731-1550 | referred as polypropylene column in the protocol |
| Proteases inhibitor | ThermoFisher | A32963 | 1 pellet per 10 mL of cell lysis buffer |
| Qifikit | Dako | K007811-8 | |
| Sodium Bicarbonate | Amresco | # 0865-1kg | |
| Sodium Chloride | FisherScientific | MSX04201 | |
| Solid phase extraction disk, ultramicrospin column C18 | The nest group | SEMSS18V | capacity of 6–60 µg, max volume of 200 µL |
| Trifluoroacetic Acid (TFA), LC-MS Grade | FisherScientific | PI85183 | |
| Tris | FisherScientific | T395-500 | |
| Tris-HCl | FisherScientific | #10812846001 | |
| Tube LoBind 1.5 mL/Eppendorf | FisherScientific | E925000090 | Better results with low retention material |
| Tube LoBind 2 mL/Eppendorf | FisherScientific | 13-698-795 | Better results with low retention material |
| Water, LC/MS Grade | FisherScientific | W64 |
참고문헌
- Vizcaíno, J. A., et al. The human immunopeptidome project: A roadmap to predict and treat immune diseases. Molecular & Cellular Proteomics. 19 (1), 31-49 (2019).
- Caron, E., Aebersold, R., Banaei-Esfahani, A., Chong, C., Bassani-Sternberg, M. A case for a human immuno-peptidome project consortium. Immunity. 47 (2), 203-208 (2017).
- Arnaud, M., Duchamp, M., Bobisse, S., Renaud, P., Coukos, G., Harari, A. Biotechnologies to tackle the challenge of neoantigen identification. Current Opinion in Biotechnology. 65, 52-59 (2020).
- Caron, E., et al. The MHC I immunopeptidome conveys to the cell surface an integrative view of cellular regulation. Molecular Systems Biology. 7 (1), 533(2011).
- Istrail, S., et al. Comparative immunopeptidomics of humans and their pathogens. Proceedings of the National Academy of Sciences of the United States of America. 101 (36), 13268-13272 (2004).
- Caron, E., Kowalewski, D. J., Koh, C. C., Sturm, T., Schuster, H., Aebersold, R. Analysis of major histocompatibility complex (MHC) immunopeptidomes using mass spectrometry. Molecular & Cellular Proteomics. 14 (12), 3105-3117 (2015).
- Caron, E., et al. An open-source computational and data resource to analyze digital maps of immunopeptidomes. eLife. 4, 07661(2015).
- Bassani-Sternberg, M., et al. Direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by mass spectrometry. Nature Communications. 7 (1), 13404(2016).
- Gubin, M. M., et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature. 515 (7528), 577(2014).
- Yadav, M., et al. Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature. 515 (7528), 572-576 (2015).
- Laumont, C. M., et al. Noncoding regions are the main source of targetable tumor-specific antigens. Science Translational Medicine. 10 (470), 5516(2018).
- Lill, J. R., et al. Minimal information about an immuno-peptidomics experiment (MIAIPE). Proteomics. 18 (12), 1800110(2018).
- Nelde, A., Kowalewski, D. J., Stevanović, S. Antigen processing, methods and protocols. Methods in molecular biology. 1988, Clifton, N.J. 123-136 (2019).
- Purcell, A. W., Ramarathinam, S. H., Ternette, N. Mass spectrometry-based identification of MHC-bound peptides for immunopeptidomics. Nature Protocols. 14 (6), 1687-1707 (2019).
- Ebrahimi-Nik, H., et al. Mass spectrometry driven exploration reveals nuances of neoepitope-driven tumor rejection. JCI Insight. 5 (14), 129152(2019).
- Schuster, H., et al. A tissue-based draft map of the murine MHC class I immunopeptidome. Scientific Data. 5, 180157(2018).
- Ritz, D., Gloger, A., Weide, B., Garbe, C., Neri, D., Fugmann, T. High-sensitivity HLA class I peptidome analysis enables a precise definition of peptide motifs and the identification of peptides from cell lines and patients sera. PROTEOMICS. 16 (10), 1570-1580 (2016).
- Bassani-Sternberg, M. Mass spectrometry based immunopeptidomics for the discovery of cancer neoantigens. Methods Mol Biol. 1719, 209-221 (2018).
- Lanoix, J., et al. Comparison of the MHC I Immunopeptidome Repertoire of B-Cell Lymphoblasts Using Two Isolation Methods. Proteomics. 18 (12), 1700251(2018).
- Kuznetsov, A., Voronina, A., Govorun, V., Arapidi, G. Critical review of existing MHC I immunopeptidome isolation methods. Molecules. 25 (22), 5409(2020).
- Urlaub, D., Watzl, C. Coated latex beads as artificial cells for quantitative investigations of receptor/ligand interactions. Current Protocols in Immunology. 131 (1), 111(2020).
- Ghosh, M., et al. Guidance document: Validation of a high-performance liquid chromatography-tandem mass spectrometry immunopeptidomics assay for the identification of HLA class I ligands suitable for pharmaceutical therapies*. Molecular & Cellular Proteomics. 19 (3), 432-443 (2020).
- Fritsche, J., et al. Pitfalls in HLA ligandomics - How to catch a li(e)gand. Molecular & Cellular Proteomics. 20, 100110(2021).
- Caron Lab. GitHub. , Available from: https://github.com/CaronLab/MhcVizPipe (2021).
- Jurtz, V., Paul, S., Andreatta, M., Marcatili, P., Peters, B., Nielsen, M. NetMHCpan-4.0: Improved peptide-MHC Class I interaction predictions integrating eluted ligand and peptide binding affinity data. The Journal of Immunology. 199 (9), 3360-3368 (2017).
- Reynisson, B., Alvarez, B., Paul, S., Peters, B., Nielsen, M. NetMHCpan-4.1 and NetMHCIIpan-4.0: improved predictions of MHC antigen presentation by concurrent motif deconvolution and integration of MS MHC eluted ligand data. Nucleic Acids Research. 48, 449-454 (2020).
- Andreatta, M., Alvarez, B., Nielsen, M. GibbsCluster: unsupervised clustering and alignment of peptide sequences. Nucleic Acids Research. 45 (1), 458-463 (2017).
- Nielsen, M., et al. NetMHCpan, a method for quantitative predictions of peptide binding to any HLA-A and -B Locus protein of known sequence. PLoS ONE. 2 (8), 796(2007).
- Fortier, M. -H., et al. The MHC class I peptide repertoire is molded by the transcriptome. The Journal of Experimental Medicine. 205 (3), 595-610 (2008).
- Marco, M. D., Schuster, H., Backert, L., Ghosh, M., Rammensee, H. -G., Stevanovic, S. Unveiling the peptide motifs of HLA-C and HLA-G from naturally presented peptides and generation of binding prediction matrices. The Journal of Immunology. 199 (8), 2639-2651 (2017).
- Sarkizova, S., et al. A large peptidome dataset improves HLA class I epitope prediction across most of the human population. Nature Biotechnology. 38 (2), 199-209 (2019).
- Pak, H., et al. Sensitive immunopeptidomics by leveraging available large-scale multi-HLA spectral libraries, data-independent acquisition and MS/MS prediction. 20, 100080(2021).
- Nielson, M. NetMHNetMHCpan 4.1 Motif Viewer. , Available from: http://www.cbs.dtu.dk/services/NetMHCpan/logos_ps.php (2021).
- Racle, J., et al. Robust prediction of HLA class II epitopes by deep motif deconvolution of immunopeptidomes. Nature Biotechnology. 37 (11), 1283-1286 (2019).
- Abelin, J. G., et al. Defining HLA-II ligand processing and binding rules with mass spectrometry enhances cancer epitope prediction. Immunity. 51 (4), 766-779 (2019).
- Nielson, M. NetMHCIIpan 4.0 Motif Viewer. , Available from: http://www.cbs.dtu.dk/services/NetMHCIIpan/logos.php (2021).
- Sofron, A., Ritz, D., Neri, D., Fugmann, T. High-resolution analysis of the murine MHC class II immunopeptidome. European Journal of Immunology. 46 (2), 319-328 (2015).
- Kovalchik, K. A., et al. Immunopeptidomics for Dummies: Detailed Experimental Protocols and Rapid, User-Friendly Visualization of MHC I and II Ligand Datasets with MhcVizPipe. bioRxiv. , (2020).
- Schuster, H., et al. The immunopeptidomic landscape of ovarian carcinomas. Proceedings of the National Academy of Sciences. 114 (46), 9942-9951 (2017).
- Berlin, C., et al. Mapping the HLA ligandome landscape of acute myeloid leukemia: a targeted approach toward peptide-based immunotherapy. Leukemia. 29 (3), 1-13 (2014).
- Rijensky, N. M., et al. Identification of tumor antigens in the HLA peptidome of patient-derived xenograft tumors in mouse. Molecular & Cellular Proteomics. 19 (8), 1360-1374 (2020).
- Heather, J. M., et al. Murine xenograft bioreactors for human immunopeptidome discovery. Scientific Reports. 9 (1), 18558(2019).
- Marcu, A., et al. HLA ligand atlas: A benign reference of HLA-presented peptides to improve T-cell-based cancer immunotherapy. Journal for Immunotherapy of Cancer. 9 (4), 002071(2021).
- Shraibman, B., et al. Identification of tumor antigens among the HLA peptidomes of glioblastoma tumors and plasma. Molecular & Cellular Proteomics. 18 (6), 1255-1268 (2019).
- Bassani-Sternberg, M., Barnea, E., Beer, I., Avivi, I., Katz, T., Admon, A. Soluble plasma HLA peptidome as a potential source for cancer biomarkers. Proceedings of the National Academy of Sciences. 107 (44), 18769-18776 (2010).
- Demmers, L. C., Heck, A. J. R., Wu, W. Pre-fractionation extends, but also creates a bias in the detectable HLA class Ι ligandome. Journal of Proteome Research. 18 (4), 1634-1643 (2019).
- Kowalewski, D. J., Stevanović, S. Antigen processing,. Methods and Protocols. 960, 145-157 (2013).
- Bentley, G., et al. High-resolution, high-throughput HLA genotyping by next-generation sequencing. Tissue Antigens. 74 (5), 393-403 (2009).
- Boegel, S., Löwer, M., Bukur, T., Sahin, U., Castle, J. C. A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines. OncoImmunology. 3 (8), 954893(2014).
- Klaeger, S., et al. Optimized liquid and gas phase fractionation increases HLA-peptidome coverage for primary cell and tissue samples. Molecular & Cellular Proteomics. 20, 100133(2021).
- Hassan, C., et al. Accurate quantitation of MHC-bound peptides by application of isotopically labeled peptide MHC complexes. Journal of Proteomics. 109, 240-244 (2014).
- Ritz, D., Kinzi, J., Neri, D., Fugmann, T. Data-independent acquisition of HLA Class I peptidomes on the Q exactive mass spectrometer platform. Proteomics. 17 (19), (2017).
- O'Donnell, T. J., Rubinsteyn, A., Laserson, U. MHCflurry 2.0: Improved pan-allele prediction of MHC Class I-presented peptides by incorporating antigen processing. Cell Systems. 11 (1), 42-48 (2020).
- O'Donnell, T. J., Rubinsteyn, A., Bonsack, M., Riemer, A. B., Laserson, U., Hammerbacher, J. MHCflurry: Open-source Class I MHC binding affinity prediction. Cell Systems. 7 (1), 129-132 (2018).
- Faridi, P., Purcell, A. W., Croft, N. P. In immunopeptidomics we need a sniper instead of a shotgun. Proteomics. 18 (12), 1700464(2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유