Method Article
Caenorhabditis elegans에서 자동 포함 계수를 사용하여 생체 내에서 단백질 응집 동역학 모니터링
요약
여기에서, 선충류 예쁜꼬마선충에서의 단백질 응집 동역학의 분석을 위한 방법이 제시 된다. 연령 동기화 된 집단의 동물은 서로 다른 시점에서 이미지화되고 CellProfiler에서 반자동 포함 계수가 수행되고 AmyloFit의 수학적 모델에 적합합니다.
초록
불용성 내포물로의 단백질 응집은 다양한 인간 질병의 특징이며, 그 중 많은 부분이 연령과 관련이 있습니다. 선충류 Caenorhabditis elegans 는 단백질 응집 및 독성을 연구하기 위해 현장에서 널리 사용 된 잘 정립 된 모델 유기체입니다. 그것의 광학적 투명도는 형광 현미경에 의한 단백질 응집의 직접적인 시각화를 가능하게 한다. 또한, 빠른 생식주기와 짧은 수명으로 인해 선충류는이 과정을 조절하는 유전자와 분자를 스크리닝하기에 적합한 모델입니다.
그러나, 살아있는 동물에서 응집체 부하의 정량화는 저조한 표준화되고, 전형적으로 단일 시점에서 형광 해부 현미경 하에서 수동 포접 계수에 의해 수행된다. 이 접근법은 관찰자 간의 높은 변동성을 초래할 수 있으며 집계 프로세스에 대한 이해를 제한합니다. 대조적으로, 시험관 내에서 아밀로이드-유사 단백질 응집은 고도로 정량적이고 시간-해결된 방식으로 티오플라빈 T 형광에 의해 일상적으로 모니터링된다.
여기에서, 살아있는 C. elegans에서 응집 동역학의 편향되지 않은 분석을 위해 맞춤형 이미지 분석 및 데이터 피팅과 결합 된 고처리량 공초점 현미경을 사용하여 유사한 방법이 제시됩니다. 이 방법의 적용 가능성은 체벽 근육 세포에서 형광 표지 폴리글루타민 (polyQ) 단백질의 포접 형성을 모니터링함으로써 입증됩니다. 이미지 분석 워크플로우를 통해 서로 다른 시점에서의 내포물 수를 결정할 수 있으며, 이는 개별 근육 세포의 독립적인 핵 형성 사건을 기반으로 한 수학적 모델에 적합합니다. 여기에 기재된 방법은 살아있는 동물에서 단백질 응집 질환에 대한 프로테오스타시스 인자 및 잠재적인 치료제의 효과를 강력하고 정량적인 방식으로 평가하는데 유용한 것으로 입증될 수 있다.
서문
미스폴딩 된 단백질이 불용성 침전물로 축적되는 것은 광범위한 질병에서 발생합니다. 잘 알려진 예는 알츠하이머 병에서 아밀로이드 β과 타우의 응집, 파킨슨 병의 α 시누클레인, 헌팅턴병 1,2에서 확장 된 polyQ를 가진 헌팅틴입니다. 이들 폴리펩티드를 아밀로이드 피브릴로 잘못 폴딩하는 것은 여전히 크게 불분명한 메카니즘에 의한 독성 및 세포 사멸과 관련된다. 아밀로이드 형성의 메커니즘을 밝히는 것은 현재 사용할 수없는 효과적인 치료법을 개발하는 데 중요합니다.
아밀로이드 형성에 대한 상세한 조사는 티오플라빈 T 형광 측정에 기초하여 시험관 내에서 수행되었으며, 응집 과정 및 억제 분자 3,4,5의 효과에 대한 기계론적 이해로 이어졌다. 그러나 살아있는 세포와 유기체의 복잡한 환경에서 동일한 응집 메커니즘이 사실인지 여부는 분명하지 않습니다. 선충류 Caenorhabditis elegans는 생체 내에서 단백질 응집을 연구하기에 적합한 모델 유기체입니다. 그것은 비교적 간단한 해부학을 가지고 있지만 근육, 장 및 신경계를 포함한 여러 조직으로 구성됩니다. 그것은 유전적으로 잘 특성화되어 있으며, 유전자 변형을위한 도구를 쉽게 사용할 수 있습니다. 또한 ~ 3 일의 짧은 생성 시간과 2-3 주간의 총 수명을 가지고 있습니다. 따라서, 단백질 응집은 실험적으로 편리한 시간 척도로 동물의 수명에 걸쳐 검사될 수 있다. 마지막으로, 선충류는 광학적으로 투명하여 살아있는 동물에서 형광 표지 단백질의 응집을 추적 할 수 있습니다.
C. elegans의 이러한 특징은 헌팅턴 및 다른 polyQ 확장 질환에 대한 모델로서 polyQ 단백질의 응집을 조사하기 위해 이전에 악용되었습니다. 35-40개의 글루타민 잔기의 병원성 역치 이상에서, 황색 형광 단백질(YFP)로 표지된 폴리Q 단백질은 근육 조직6,7, 뉴런8, 및 장 9,10에 불용성 내포물을 형성하는 것을 관찰할 수 있다. 이러한 특징들은 단백질 응집 및 독성의 유전자(11,12,13) 및 소분자 개질제(14)를 스크리닝하는데 널리 사용되어 왔다.
C. elegans는 단백질 응집에 대한 시험관내 연구와 마우스15와 같은보다 복잡한 질병 모델 사이의 격차를 해소하는 데 중요한 역할을 할 잠재력을 가지고 있습니다. C. 엘레간은 약물 스크리닝16에 순응할 수 있지만, 최근17에서 입증된 바와 같이 생체내에서 단백질 응집의 분자 메카니즘에 대한 근본적인 이해를 얻기 위해 또한 이용될 수 있다. 그러나, 두 가지 용도 모두에서, 단백질 응집의 정량적 및 재현 가능한 측정을 추출하는 것이 가장 중요하다. 여기서 이는 전용 이미지 분석 파이프라인과 결합된 고처리량 공초점 현미경을 사용하여 달성됩니다(그림 1).
프로토콜
1. C. elegans의 연령 동기화 된 인구의 성장
- C. 엘레간스 균주를 표준 절차18에 따라 에스케리치아 콜라이 OP50으로 시딩된 선충류 성장 배지(NGM) 플레이트 상에 20°C에서 유지한다.
- 백금 웜 픽이있는 6cm 시드 NGM 플레이트에 10 마리의 성인 선충류를 올려 놓음으로써 동기화 된 알을 낳습니다. 성인을 제거하기 전에 20 °C에서 ~ 2 시간 동안 알을 낳도록하십시오. 균주의 비옥도와 취할 시점의 수에 따라 균주 당 1-4 개의 플레이트를 준비하십시오.
- 계란이 있는 플레이트를 20°C의 인큐베이터에 놓는다. 성인이 될 때까지 동물의 발달을 모니터링하십시오.
참고 : 동물이 성인이되는 날은 여기에서 1 일째로 정의됩니다. 일반적으로 이것은 알을 낳은 지 사흘 후입니다. - 1 일째부터 매일 새로운 씨를 뿌린 NGM 플레이트로 동물을 옮겨 자손과 분리하십시오. 이송 중에 죽거나 유실된 동물을 보상하기 위해, 변형 당 ~40마리의 동물을 영상화할 점의 수만큼 옮기십시오(단계 2 참조). 동물들이 수정 된 알을 낳는 것을 멈출 때까지 진행하십시오 (~ 성인기의 6 일째).
참고 : 배깅이나 다른 발달 표현형이있는 동물은 제외하십시오. 배깅은 응집되기 쉬운 단백질을 발현하는 균주에서 일반적으로 관찰됩니다.
2. 멀티웰 플레이트에서 C. 엘레간스의 샘플 제조
참고 : 이미징 절차에는 결국 동물을 죽일 마취제가 필요하므로 동일한 동물을 후속 시간 지점에 재사용할 수 없습니다. 대신, 동일한 연령 동기화 배치의 다른 동물이 다른 날에 이미지화됩니다. 대부분의 균주는 1일째에 개재물이 거의 없을지라도 이 시점을 기준선으로 포함하는 것이 좋습니다.
- 필요한 수의 웰을 마취제로서 25 mM NaN3로 보충된 100 μL의 M9 완충액으로 채워서 384 -웰 플레이트를 제조하였다. 이미징 할 변형 당 하나의 웰을 채 웁니다.
참고 : 나트륨 아지드 (NaN3)는 독성이 있으므로 주의해서 다루어야합니다. - 각 균주에 대해 백금 웜 픽을 사용하여 20 마리의 동물을 하나의 우물로 옮깁니다.
참고 : 웜은 우물에 넣기 전에 박테리아 잔디밭 밖에 두어야합니다. 박테리아는 동물들이 웜 픽에 달라 붙게하여 방출을 막을 수 있으며 우물 내용물을 흐리게합니다. 일반적으로 20마리는 웜 간의 겹침을 방지하면서 빈 우물 공간의 불필요한 이미징을 제한하기 위해 웰당 최적의 동물 수입니다. - 증발을 방지하기 위해 플레이트를 뚜껑으로 덮고 준비 후 1 시간 이내에 플레이트를 이미지화하십시오.
- 포함 수의 꾸준한 고원에 도달하거나 대부분의 동물이 죽을 때까지 매일 2.1-2.3 단계를 반복하십시오. 매일 동시에 샘플 준비 및 이미징을 수행하여 24 시간의 간격을 보장합니다.
3. 고처리량 공초점 현미경에서의 이미지 수집
참고: 이 실험은 멀티웰 플레이트 홀더가 있는 일반 회전 디스크 공초점 현미경에도 설치할 수 있습니다. 시야각이 넓은 카메라는 우물 전체에 걸쳐 이미징하는 데 필요한 타일 수를 제한하는 데 유용합니다. 이 프로토콜에 사용되는 현미경 및 소프트웨어에 대한 자세한 내용은 재료 표를 참조하십시오.
- 계측기를 켜고 소프트웨어를 엽니다.
- 측정 설정 |로 이동하여 새 프로토콜 시작 새로운. 올바른 멀티웰 플레이트 유형을 선택하고 새 측정 설정 생성을 클릭합니다.
- Ch1로 이동하여 형광을 위한 채널을 설정합니다. 목표를 10x로 설정합니다. 광원으로 488nm를, 방출 필터로 BP525/25를 선택하여 YFP를 이미지화합니다. 파일 크기를 줄이기 위해 비닝을 2x2로 설정합니다.
- 채널 추가를 클릭하고 메서드로 밝은 필드를 선택합니다.
- z-스택 공초점 형광 이미지를 측정에 추가하려면 작업 목록에서 3D 형광 수집을 선택합니다. 선택으로 이동하여 Ch 1을 선택합니다. 파일 크기를 최소화하려면 전체 z-스택이 아닌 최대 프로젝션 이미지가 저장되도록 이미지 처리를 최대로 설정합니다.
- BF / Ph 취득 |를 클릭하십시오. | 선택 브라이트필드 채널용 Ch 2.
- 웰 플레이트 언로드 옆에 있는 재생 버튼(오른쪽을 가리키는 삼각형 기호 찾기)을 클릭하고 현미경에 384웰 플레이트를 놓습니다.
- 3D 형광 획득에서 테스트를 클릭하고 웜이 포함된 웰을 선택하여 웜이 올바르게 중앙에 위치하는 최적의 시프트 거리를 결정합니다. 오름차순 거리를 50μm로, 내림차순 거리를 -50μm로, 슬라이싱 간격을 2μm로 설정하여 z-스택에서 동물의 전체 두께를 캡처합니다.
- 포화를 피하면서 네 가지 균주 모두에 대해 좋은 신호 강도를 얻기 위해 노출 시간을 최적화하십시오. 모든 균주 및 시간대에 대해 동일한 노출 시간을 사용하십시오.
- 웰 플레이트 스캔 설정에서 이미지화할 웰을 선택합니다. 타일을 선택하고 전체 우물을 획득하십시오.
- 측정 설정을 저장하고 측정 시작을 클릭하여 실험을 시작합니다. 후속 시점의 경우 동일한 측정 설정을 열고 시프트 거리와 이미징할 웰을 조정합니다.
4. ImageJ에서 타일 이미지 스티칭
참고: 이 단계는 각 웰의 이미지를 여러 타일로 획득하는 4x보다 큰 목표를 사용하는 경우에만 필요합니다. 이 분석 워크플로우에서 타일의 스티칭은 자유 소프트웨어 FIJI/ImageJ19 를 사용하여 수행됩니다(그림 2). 단계 3에서 사용되는 기기에 따라 함께 제공되는 소프트웨어에서 직접 스티칭을 수행할 수도 있습니다.
- FIJI20을 다운로드하여 엽니 다.
- 플러그인으로 이동 | | 스티칭 그리드/컬렉션 스티칭21.
- 팝업 창인 그리드/컬렉션 스티칭에서 타일이 수집되는 유형 과 순서 를 선택합니다. 그리드: 행 단위 및 오른쪽 & 아래를 선택합니다.
- 다음 창에서 그리드 스티칭: 그리드: 행 단위, 오른쪽 & 아래쪽, x 및 y 방향으로 타일 수를 삽입합니다. 여기에 사용된 10x 목표의 경우 그리드 크기 x로 2를, 그리드 크기 y로 3을, 타일이 겹치면서 0을 선택합니다.
- 찾아보기를 클릭하고 스티치할 TIFF 이미지가 포함된 폴더를 선택합니다.
- 타일의 파일 이름 아래에 각 파일 이름의 타일 번호 위치에 {i}를 사용하여 공통 파일 이름을 삽입합니다.
- 아래의 모든 상자를 선택 해제하십시오.
- 플러그인을 실행합니다.
- 다음 단계에서 분석할 결과 이미지를 TIFF 파일로 저장합니다.
5. CellProfiler22를 사용한 자동 포함 계수
- 오픈 소스 이미지 분석 소프트웨어인 CellProfiler23을 다운로드하여 설치합니다. github.com/sinnigelab/aggregate-quantification 에서 InclusionCounting.cpproj 파이프라인을 다운로드합니다.
- CellProfiler를 열고 파이프라인을 여기에 파이프라인 파일 놓기 창으로 끕니다. 예를 클릭하여 프로젝트를 로드합니다.
- 이미지 입력 모듈을 클릭하고 스티치 된 이미지를 파일 및 폴더 드롭 창으로 드래그하십시오.
- 메타데이터 입력 모듈을 클릭합니다. 정규식을 조정하여 스티치된 이미지의 이름에 따라 파일 이름에서 추출합니다.
- NamesandTypes 입력 모듈을 클릭하고 파일 이름의 채널과 일치하도록 규칙 조건 선택을 조정합니다.
참고: 파이프라인의 기본 설정에서 BF 를 포함하는 파일 이름은 밝은 필드 이미지로 인식되고 이름은 웜입니다. YFP 를 포함하는 파일 이름은 형광 이미지로 인식되며 이름은 형광입니다. - 출력 설정보기를 클릭하여 CellProfiler에서 출력을 저장할 기본 폴더를 선택하십시오.
- 테스트 모드 시작을 클릭하여 첫 번째 이미징 데이터 세트를 사용하여 파이프라인의 설정을 확인합니다. 실행을 클릭하여 파이프라인의 모든 모듈을 실행하거나 단계를 클릭하여 파이프라인을 한 번에 하나의 모듈로 실행합니다. EditObjectsManually 모듈에서 웜 윤곽선을 조정하려면 도움말을 클릭하여 지침을 확인하고 완료를 클릭하여 파이프라인 실행을 계속합니다.
참고: 추출된 측정값은 테스트 모드에 있는 동안에는 내보내지지 않습니다. 웜 및 내포물을 검출하기 위한 임계 파라미터는 사용된 균주 및 배율에 따라 조정되어야 할 수도 있다. - 테스트 모드 종료를 클릭하고 이미지 분석을 클릭하십시오.
- 출력 폴더를 열어 출력 파일을 봅니다. 원본 파일 이름 다음에 윤곽선 이 있는 이미지를 열어 웜과 포함물이 올바르게 겹쳐졌는지 확인합니다.
참고: 웜당 포함 횟수는 ExpandedWormObjects라는 파일에서 찾을 수 있습니다. 입력 이미지에 대한 자세한 내용은 Image라는 파일에서 찾을 수 있습니다. 파이프라인의 ExportToSpreadsheet 모듈에서 추가 출력을 선택할 수 있습니다.
6. AmyloFit5를 사용한 포함 카운트 데이터의 글로벌 피팅
참고: 이 단계는 여러 단백질 농도에 대한 데이터를 사용할 수 있는 경우에만 수행할 수 있습니다. Q40-YFP의 경우, 체벽 근육 세포에서 과발현 수준이 다른 4 개의 균주 세트가 이전에17 번 생성되었습니다. 다른 경우에, 신규한 균주는 플라스미드 미세주입 및 게놈 통합(24)을 사용하여 생성되어야 한다.
- 집계 동역학 AmyloFit25를 위한 무료 온라인 피팅 플랫폼으로 이동하십시오. 기존 계정으로 등록하거나 로그인합니다.
참고: AmyloFit 사용 방법에 대한 광범위한 설명서에 액세스하여 추가 도움을 받을 수 있습니다. 자세한 내용은 웹 페이지의 왼쪽 상단(로그인 후)에 있는 링크를 참조하십시오. - AmyloFit 사용을 시작하려면 프로젝트 이름을 지정 하고 프로젝트 만들기를 클릭합니다. 열기 를 클릭하고 이름을 지정하고 Create & load 세션을 클릭하여 세션을 만들어 프로젝트를 엽니다.
- 데이터 추가를 클릭하고 왼쪽 패널에 표시된 데이터 형식 요구 사항에 따라 동물당 평균 포함 수를 포함하는 파일을 업로드합니다. 새 데이터 로드를 클릭합니다.
- 포함 카운트 데이터에 필요하지 않은 전처리 단계를 건너뜁니다. 제로 포인트 오프셋의 경우 점 수를 평균 이상으로 설정하고 고원의 경우 평균 이상인 점 수를 0으로 설정합니다. 제출을 클릭합니다. 각 단백질 농도 (즉, 업로드 된 파일의 각 열)에 대해이 단계를 반복하십시오.
- 모델 패널에서 사용자 지정 을 선택하고 수식 상자에 Ncells*(1-exp(- Kcell*m**(n)*(t-1))) 을 입력하고 모델 로드를 클릭합니다.
참고: AmyloFit은 원래 시험관내 분석에서 운동 데이터를 분석하기 위해 설계되었기 때문에 C. elegans 의 포함 카운트 데이터를 분석하기 위해 맞춤형 모델을 로드해야 합니다. 여기에 사용된 식에서, N 세포는 포접 형성이 일어나는 세포의 수이고, K세포는 핵형성 속도 상수이고, m은 세포내 단백질 농도, n은 핵형성의 반응 순서이다. - 매개 변수 유형을 N셀의 경우 전역 Const, K셀과 n에 대한 전역 적합, m에 대한 Const로 설정합니다. 체벽 근육 세포의 경우 N세포의 값을 95로 설정하고 K 세포에 대한 초기 추측과 n을 1로 설정합니다. 왼쪽 패널에 다른 변형선에 대한 m 값을 입력합니다.
참고: 초기 추측은 여기에 사용된 비교적 간단한 모델과는 관련이 없습니다. 더 복잡한 모델의 경우 예상 값의 추정치를 입력하여 계산 시간을 단축하는 것이 좋습니다. - 분지 홉 수를 변경하지 않고 피팅 패널에서 맞춤(Fit )을 클릭합니다.
- 데이터 다운로드 및 맞춤을 클릭하여 피팅을 추출합니다.
참고: 모델의 전역 맞춤으로 추출된 매개변수는 오른쪽 아래 모서리에 나열됩니다. 데이터 및 맞춤의 플롯이 오른쪽 상단 패널에 자동으로 생성됩니다. 이 플롯은 pdf 다운로드를 클릭하여 추출하고 플롯 옵션 표시로 이동하여 사용자 정의 할 수 있습니다. K세포는 분자 단위-n시간-1 세포-1을 갖는다. 상이한 n을 갖는 값들을 비교하기 위해, K세포는 Mn을 곱함으로써 주어진 단백질 농도에서 핵생성 속도로 전환될 수 있다.
결과
여기에 기재된 방법(도 1)은 YFP(Q40-YFP)에 융합된 40개의 글루타민을 포함하는 작제물의 응집 동역학을 분석하는데 사용되었다. 단백질은 unc-54 프로모터의 조절하에 발현되어, 체벽 근육 세포에서 발현을 유도한다. 이것들은 비교적 크고 시각화하기 쉽기 때문에 10x 목표의 사용은이 조직에서 Q40-YFP에 의해 형성된 내포물을 해결하기에 충분합니다. 네 개의 균주 (라인 A-D)는 생체내17에서 폴리Q 응집의 농도 의존성을 평가하기 위해 상이한 정도로 단백질을 발현하는 것으로 이전에 개발되었다.
A-D 라인의 연령 동기화 된 개체군은 2 시간 알을 낳은 다음 자손이 성인이되면 매일 이동했습니다. 성인기의 1일째부터 10일째까지, 4개의 균주 각각으로부터 20마리의 동물을 고처리량 공초점 현미경을 사용하여 384-웰 플레이트에서 이미지화하였다. 우물의 이미지는 ImageJ21 의 플러그인을 사용하여 함께 스티치된 6개의 타일로 획득되었습니다(그림 2). 이후 스티칭된 이미지를 맞춤형 CellProfiler22 파이프라인(그림 3)을 사용하여 분석하여 각 균주 및 시점에 대한 동물당 평균 포접 수를 정량화하였다.
그런 다음 데이터를 AmyloFit5의 수학적 모델에 적합하게 만들었습니다(그림 4). 상기 모델은 95개의 체벽 근육 세포 각각이 속도-제한 핵형성 이벤트에 의해 하나의 포함물을 독립적으로 획득하고, 이어서 빠른 응집체 성장(17)을 획득한다는 가정에 기초한다. 상기 적합은 1 mM의 세포내 단백질 농도에서 0.38 분자 d-1 세포-1에 상응하는 5 분자 M-2.1 d-1 세포-1 및 반응 차수 2.1의 핵 생성 속도 상수 9.9 × 105 분자 M-2.1 d-1 세포를 산출하였다. 두 개의 독립적인 생물학적 반복실험은 핵생성 속도 및 반응 순서에 대해 밀접하게 상응하는 값을 유도하였으며, 이는 유사한 프로토콜17을 사용한 이전 연구와 일치한다(표 1).
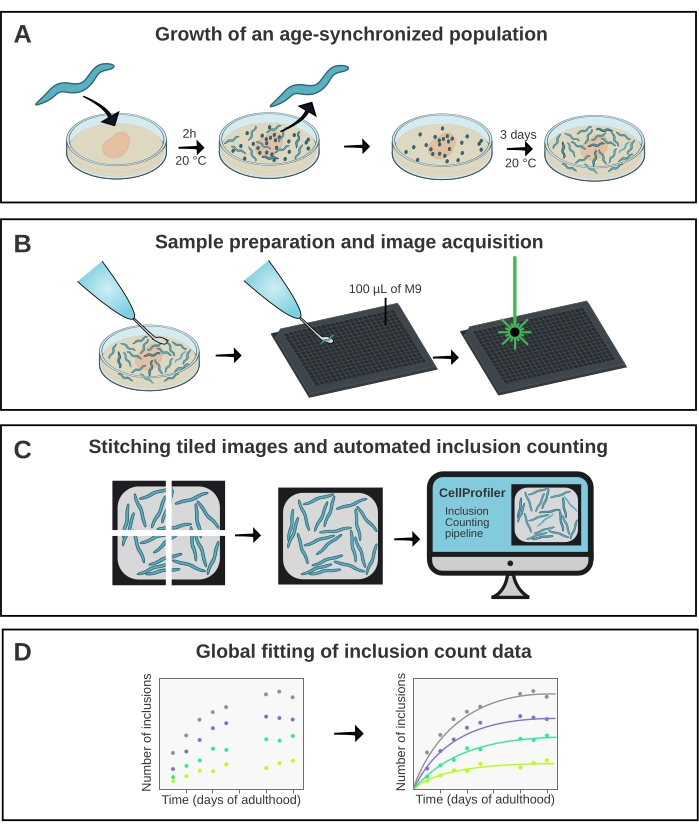
그림 1 : 방법의 개략적 개요. (A) 연령 동기화 된 C. elegans 개체군은 시간이있는 알에 의해 생성됩니다. (B) 동일한 집단의 동물들은 상이한 시점에서 384-웰 플레이트에서 이미지화된다. (C) 타일은 함께 꿰매어 전체 웰의 이미지를 형성하며, 이는 CellProfiler에서 분석되어 동물 당 포함 수를 정량화합니다. (D) 데이터는 AmyloFit을 사용하여 수학적 모델에 맞춰집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
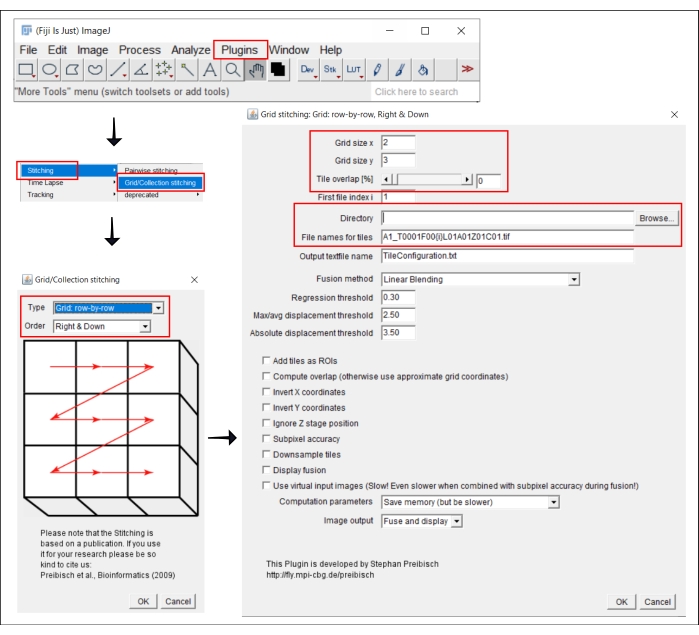
그림 2: 플러그인 그리드/컬렉션 스티칭을 사용하는 ImageJ의 스티칭 절차의 스크린샷21. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 내포물 수를 정량화하기 위한 CellProfiler 파이프라인의 회로도. (A-C) 브라이트필드 이미지(A)는 웜(B, C에서 클로즈업)을 식별하는 데 사용됩니다. (D-G) 형광 이미지(D, E에서의 클로즈업)는 내포물(F)을 확인하기 위해 사용된다. 웜 및 내포물은 웰(G) 내의 각 웜에 대한 개재물의 수를 제공하는 것과 관련된다. 표시된 이미지는 Q40 라인 A 성인기의 3 일째 동물입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
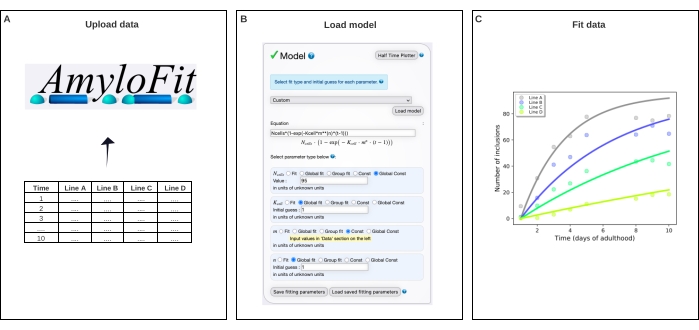
그림 4: AmyloFit의 수학적 모델에 데이터를 맞추기 . (A) 데이터가 AmyloFit에 업로드됩니다. (B) 각 세포에서 독립적인 핵형성 사건을 가정하여 포함 형성을 모델링하기 위해 사용자 정의 방정식이 입력된다. (c) Q40-YFP의 상이한 수준을 발현하는 C. elegans 라인 A-D에 대한 응집 동역학의 피팅. 데이터는 두 개의 독립적인 생물학적 반복실험으로 대표된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 데이터 집합 1 | 데이터 집합 2 | Sinnige et al.17 | |
| n | 2.1 | 1.9 | 1.6 |
| K 세포 (분자 M-nd-1 세포-1) | 9.9 엑스 105 | 1.4 x 105 | 3.1 x 104 |
| 1 mM에서의 핵 생성 속도 (분자 d-1 세포-1) | 0.38 | 0.21 | 0.35 |
표 1: Q40-YFP 응집의 핵형성 속도 및 반응 순서의 값. 프로토콜의 두 개의 독립적인 생물학적 반복실험에 대한 데이터 및 이전에 공개된 데이터와의 비교(17).
토론
본원에 제시된 방법은 모델 유기체 C. elegans에서 단백질 응집 동역학의 편향되지 않은 정량적 분석을 용이하게 한다. 그것은 네 가지 핵심 요소에 달려 있습니다 (그림 1) : 1) 선충류의 연령 동기화 된 개체군을 유지; 2) 멀티웰 플레이트에서의 형광 현미경 검사; 3) CellProfiler에서 자동 포함 계수; 4) AmyloFit의 데이터 피팅. 자유롭게 움직이는 동물 또는 저장된 이미지26에서 내포물의 수동 계산과 비교할 때, CellProfiler의 정량화는 더 빠르고 편향되지 않습니다. 프로토콜의 또 다른 주요 발전은 단일 시간점이 아닌 운동 데이터를 획득하는 것이며, 이는 데이터를 수학적 모델에 피팅 할 때 집계 메커니즘에 대한 양적 통찰력을 제공합니다.
프로토콜의 네 가지 요소는 응용 프로그램에 따라 수정할 수있는 독립적 인 모듈로 사용할 수 있습니다. 연령-동기화된 개체군은 또한 동물을 살균하기 위해 5-플루오로-2'-데옥시우리딘(FUDR)을 사용하여 유지될 수 있다. 이 화합물은 수명 및 프로테오스타시스24,25에 영향을 미치며 실험자에게 발암성이 매우 높습니다. 그러나 많은 수의 웜을 처리 할 때 노동 집약적 일 수있는 웜의 수동 전송을 배제합니다. 다른 대안은 자손(30)을 분리하기 위해 멸균 돌연변이체(29) 또는 여과 장치를 사용하는 것이다.
형광 현미경 검사 단계는 또한 예를 들어, 뉴런에서 단백질 응집을 모니터링하기 위해 더 높은 배율을 사용하여 조정될 수 있다. 와이드필드 현미경 검사는 조건 간의 상대적 차이가 절대 내포물의 수보다 더 중요할 때 근육 세포에서 polyQ 응집을 모니터링하기에 충분할 수 있다. 이러한 경우에도 CellProfiler 파이프라인을 계속 사용할 수 있지만 사용자가 웜 및 포함을 인식하는 설정을 조정해야 합니다. 이 기술의 처리량은 현재 384-웰 플레이트 내로 동물을 수동으로 채취해야 할 필요성에 의해 제한됩니다. 이것은 잠재적으로 미세유체 장치(16)의 사용에 의해 해결될 수 있다. 나트륨 아지드는 상대적으로 가혹한 마취제이며, 이는 하이드로겔 또는 비드28,29로 물리적 고정화로 대체될 수 있다.
여기에 제시된 AmyloFit의 분석은 개별 세포에서 독립적 인 핵 형성 사건으로 구성된 응집 메커니즘을 기반으로합니다. 이 모델이 적합하지 않은 경우, 사용자는 이전에 개발된17개의 협동 집계 모델과 같은 대안을 고려해야 한다. 이 접근법의 한계는 상이한 농도에서 관심있는 단백질을 발현하는 균주가 이용가능할 필요가 있지만, 이들은 일상적인 C. elegans 방법(24)을 사용하여 생성될 수 있다는 것이다.
전체적으로, 이 프로토콜은 생체내 모델 시스템에서 단백질 응집 동역학에 대한 고품질 데이터를 획득하는 수단을 제공하며, 응집 메커니즘(17)의 상세한 분석을 가능하게 한다. 이 방법이 C. elegans 근육 조직에서의 polyQ 응집에 대해 입증되었지만, 프로토콜의 향후 적용은 다른 단백질 및 조직 및 프로테오스타시스 인자 및 소분자의 효과를 포함할 수 있다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
우리는 C. elegans 균주에 대한 Morimoto 실험실과 높은 처리량의 공초점 현미경에 대한 도움을 주신 Esmeralda Bosman에게 감사드립니다. 이 작품은 위트레흐트 대학에서 T.S.에 대한 창업 보조금으로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 384-well plate | Greiner | 781091 | Black with flat clear bottom |
| AmyloFit | Knowles lab | v2.0 | Access at www.amylofit.ch.cam.ac.uk |
| C. elegans Q40 line A | Morimoto lab | AM1228 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line B | Morimoto lab | AM1229 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line C | Morimoto lab | AM1230 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line D | Morimoto lab | AM1231 | Genotype rmIs404[unc-54p::Q40::YFP] |
| CellProfiler | Broad Institute | 4.1.3 | Downloaded from https://cellprofiler.org |
| E. coli OP50 | Caenorhabditis Genetics Center (CGC) | OP50 | |
| FIJI | Open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| High-throughput confocal microscope | Yokogawa | CellVoyager CV7000S | |
| M9 buffer | Home-made | 3 g/L KH2PO4, 6 g/L Na2HPO4, 0.5 g/L NaCl, 1 mM MgSO4 | |
| NGM plates | Home-made | 17 g/L agar, 2.5 g/L bacto-peptone, 3 g/L NaCl, 25 mM KPO4 buffer pH 6.0, 1 mM MgSO4, 1 mM CaCl2, 5 mg/L cholesterol | |
| Pasteur pipette | WU Mainz | 250 | To make worm pick, 150 mm length |
| Platinum iridium wire | Alfa Aesar | 39383 | To make worm pick, 0.25 mm diameter |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Stereomicroscope | Leica | S9 |
참고문헌
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews. Molecular Cell Biology. 15 (6), 384-396 (2014).
- Chiti, F., Dobson, C. M. Protein misfolding, amyloid formation, and human disease: a summary of progress over the last decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., et al. An analytical solution to the kinetics of breakable filament assembly. Science. 326 (5959), 1533-1537 (2009).
- Cohen, S. I. A., et al. Proliferation of amyloid-β42 aggregates occurs through a secondary nucleation mechanism. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9758-9763 (2013).
- Meisl, G., et al. Molecular mechanisms of protein aggregation from global fitting of kinetic models. Nature Protocols. 11 (2), 252-272 (2016).
- Satyal, S. H., et al. Polyglutamine aggregates alter protein folding homeostasis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 5750-5755 (2000).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. Journal of Neuroscience. 26 (29), 7597-7606 (2006).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108 (34), 14204-14209 (2011).
- Nollen, E. A. A. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438 (2011).
- Brehme, M., et al. A chaperome subnetwork safeguards proteostasis in aging and neurodegenerative disease. Cell Reports. 9, 1-16 (2014).
- Calamini, B., et al. Small-molecule proteostasis regulators for protein conformational diseases. Nature Chemical Biology. 8 (2), 185-196 (2012).
- Sinnige, T., Stroobants, K., Dobson, C. M., Vendruscolo, M. Biophysical studies of protein misfolding and aggregation in in vivo models of Alzheimer's and Parkinson's diseases. Quarterly Reviews of Biophysics. 49, 22 (2020).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7, 13023 (2016).
- Sinnige, T., et al. Kinetic analysis reveals that independent nucleation events determine the progression of polyglutamine aggregation in C. elegans. Proceedings of the National Academy of Sciences of the United States of America. 118 (11), 202188118 (2021).
- Brenner, S. Caenorhabditis elegans. Methods. 77 (1), 71-94 (1974).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- . FIJI/ImageJ Available from: https://imagej.net/downloads (2012)
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. BioTechniques. 42 (1), 71-75 (2007).
- CellProfiler. Broad Institute Available from: https://cellprofiler.org/releases (2021)
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO Journal. 10 (12), 3959-3970 (1991).
- . Knowles group, University of Cambridge Available from: https://amylofit.com/amylofitmain/login/ (2021)
- Lazaro-Pena, M. I., Cornwell, A. B., Samuelson, A. V. Quantifying tissue-specific proteostatic decline in Caenorhabditis elegans. Journal of Visualized Experiments: JoVE. (175), (2021).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964 (2014).
- Brunquell, J., Bowers, P., Westerheide, S. D. Fluorodeoxyuridine enhances the heat shock response and decreases polyglutamine aggregation in an HSF-1-dependent manner in Caenorhabditis elegans. Mechanisms of Ageing and Development. 141-142, 1-4 (2014).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Hunter, S., Maulik, M., Scerbak, C., Vayndorf, E., Taylor, B. E. Caenorhabditis sieve: A low-tech instrument and methodology for sorting small multicellular organisms. Journal of Visualized Experiments: JoVE. (137), (2018).
- Burnett, K., Edsinger, E., Albrecht, D. R. Rapid and gentle hydrogel encapsulation of living organisms enables long-term microscopy over multiple hours. Communications Biology. 1, 73 (2018).
- Dong, L., et al. Reversible and long-term immobilization in a hydrogel-microbead matrix for high-resolution imaging of Caenorhabditis elegans and other small organisms. PLoS One. 13 (3), 0193989 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유