JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
색색세포 기반 분석법을 사용하여 AAV에 대한 항체 중화를 검출하는 단계별 방법
요약
포괄적인 실험실 프로토콜 및 분석 워크플로우는 AAV6에 대한 중화 요소를 감지하기 위해 신속하고 비용 효율적이며 간단한 색채 세포 기반 분석법을 위해 설명됩니다.
초록
재조합 아데노 관련 바이러스(rAAV)는 실험실과 클리닉 모두에서 다양한 건강 상태를 치료하기 위해 유전 물질을 옮기는 안전하고 성공적인 벡터로 입증되었습니다. 그러나, AAV capsids에 대하여 기존의 중화 항체 (NAbs)는 큰 동물 실험 모형 및 인간 인구 둘 다에 있는 유전자 치료의 성공적인 행정을 위한 지속적인 도전을 제기합니다. AAV에 대한 숙주 면역을 위한 예비 스크리닝은 연구 도구와 임상적으로 실행 가능한 치료제로서 AAV 기반 유전자 치료의 효능을 보장하기 위해 필요하다. 이 프로토콜은 AAV 혈청형 6(AAV6)에 대한 중화 요인을 감지하기 위해 체외 분석에서 착색을 설명합니다. 분석은 알칼리성 인산화(AP) 리포터 유전자와 그 기판 NBT/BCIP 사이의 반응을 활용하여 조합시 불용성 정량화 가능한 보라색 얼룩을 생성한다.
이 프로토콜에서 혈청 샘플은 AP를 표현하는 AAV와 결합되어 잠재적 중화 활동이 발생할 수 있도록 배양됩니다. 바이러스 혈청 혼합물은 이후에 중화되지 않은 모든 AAV의 바이러스 성 변환을 허용하기 위해 세포에 첨가됩니다. NBT/BCIP 기판이 첨가되고 바이러스 성 트랜스듀션 및 중화 활동에 대응하는 염색체 반응을 겪는다. 영역 색상의 비율은 자유 소프트웨어 도구를 사용하여 양으로 양화되어 중화 티터를 생성합니다. 이 분석은 착색과 바이러스 성 농도 사이의 강한 긍정적 인 상관 관계를 표시합니다. 재조합 AAV6의 투여 전후 양으로부터의 혈청 샘플의 평가는 중화 활성의 극적인 증가로 이어졌다 (125 받는 >10,000 배 증가). 분석은 >1:32,000 혈청 희석제에서 중화 활동을 감지하는 적절한 감도를 나타냈다. 이 분석법은 AAV에 대한 NAbs를 감지하는 간단하고 빠르며 비용 효율적인 방법을 제공합니다.
서문
아데노 관련 바이러스(AAV)는 심혈관, 폐, 순환, 안구 및 중추 신경계에 영향을 미치는 다양한 건강 상태에 대한 임상 시험 치료에 유전자 요법을 전달하기 위한 벡터로 점점 더 많이 사용되고 있다1,2,3,4,5. 선도적인 유전자 치료 플랫폼으로서 AAV 벡터의 인기는 양성 안전 성, 장기 간 질유전자 발현 및 광범위한 조직 별 트로피즘1,6에서 비롯됩니다. 동물 연구에서 성공적인 결과는 성공적으로 그들의 효험 끝점에 도달한 50 개 이상의 AAV 유전자 치료 임상 시험을 위한 도로를 포장했습니다7, 미국 식품 의약국에 의해 승인된 첫번째 상업적으로 유효한 AAV 유전자 치료 약의 방출8. 초기 성공에 이어, AAV는 선택의 벡터로서 기본 및 임상 연구 분야에서 견인력을 계속 얻고 있으며 현재 미국과 유럽에서 임상 사용을 위해 승인 된 유일한 생체 유전자 치료법입니다9. 그럼에도 불구하고, AAV 벡터 캡시드에 대한 기존의 중화 항체(NAbs)의 존재는 임상 전 연구와 임상 시험의 효능 모두에 방해가 되고 있다. NAbs는 순진한 인간과 동물 집단 모두에서 존재하며 AAV 벡터1의 생체 투여에 따른 유전자 전이를 억제한다. AAV 혈청화는 대부분의 유전자 치료 예심을 위한 제외 기준이고, 그러므로 호스트 면제를 위한 예비 검열은 실험실과 진료소 둘 다에서 중요합니다. AAV에 대한 NAbs의 존재를 감지할 수 있는 분석서를 확립하는 것은 모든 AAV 유전자 치료 기반 연구 프로젝트의 파이프라인에 필수적인 단계입니다. 이 보고서는 AAV6에 초점을 맞추고 있다 그 효율적이 고 선택적 변환 으로 인해 연구자에 게 관심 있다 (심장과 골격 근육)1,10,11,12. 유전자 치료는 침략적인 개방 심장 절차 없이 심혼을 구체적으로 표적으로 하기 어렵기 때문에 심혼을 표적으로 하기 위한 유망한 전략으로 여겨됩니다.
중화 활성은 일반적으로 세포 기반 의 체외 또는 생체 내 트랜스포션 억제 분석체를 사용하여 결정된다. 생체 내 NAb assays는 일반적으로 시험 대상자(예를 들어, 인간 또는 큰 동물)로부터 혈청을 마우스로 투여하고, 리포터 유전자를 가진 AAV가 그 뒤를 잇고, 이어서 리포터 유전자 또는 해당 항원의 발현을 위한 테스트를 포함한다. 시험관 내 실험은 리포터 유전자를 표현하는 재조합 AAV(rAAV)를 사용하여 인간 또는 대형 동물로부터 혈청 또는 플라즈마를 배양하여 NAb 티터를 결정합니다. 세포는 혈청/바이러스 혼합물에 감염되고, 리포터 유전자 발현이 억제되는 정도는 대조군과 비교하여 평가된다. 시험관 내 소는 상대적으로 낮은 비용, 테스트의 급속성 및 생체 내 에세이에 비해 표준화 및 유효성 검사에 대한 더 큰 용량으로 인해 NAb 스크리닝에 널리 사용됩니다. 생체 내 아세약은 종종 더 큰 감도가보고15,16, 하지만 같은 주장은 체외 애사14,17에 관한 만들어졌다.
현재까지, 시험관 내 NAb 아세약은 주로 발광(luciferase)을 중화를 검출하기 위해 기자 유전자로서 사용하였다. 빛 기반 방법은 많은 맥락에서 장점이 있지만, 색색/염색체 NAb 분석법은 어떤 상황에서도 유리할 수 있다. 중화를 평가하기 위한 색인 분석법에서는 인플루엔자 및 아데노바이러스18,19와 같은 다른 바이러스에 성공적으로 사용되었습니다. 그들의 매력은 단순함, 저렴한 비용 및 일상적인 실험실 장치 및 tools20에 대한 요구 사항에서 비롯됩니다. 발광 기반 리포터 유전자를 사용하는 NAb 분석은 분석21에 비용이 많이 드는 기판 키트, 광미계 및 해당 소프트웨어가 필요합니다. 이 색분석 분석은 가벼운 현미경과 매우 저렴한 기판을 필요로하는 장점이 있습니다. 색인과 발광 분석의 민감도에 대한 보고는 상충하는 결과를 낳았습니다. 한 연구는 발광 기반 ELISA 분석 이 더 큰 감도 및 색상 분석에 비교 재현성을 표시 제안 22, 다른 발견 된 색인식 기반 ELISA 분석 더 큰 감도23. 여기서, 알칼리인스파타제(AP) 리포터 유전자와 니트로 블루 테트라졸륨/5-브로모-4-클로로-3-인돌릴 인산염(NBT/BCIP) 기산염(NBT/BCIP) 기산염을 인코딩하는 AAV 사이의 염색체 반응을 활용하는 AAV에 대한 시험관 NAb 분석에 대한 상세한 프로토콜이 제공된다. 이러한 단계별 프로토콜은 AAV24에 대한 중화 활성을 검출하기 위해 hPLAP(인간 태반 알칼리인스파라스) 리포터 유전자(AAV6-hPLAP)를 활용한 이전 보고서에 기초하여 개발되었다. 이 분석법은 비용 효율적이고 시간 효율적이며 설치가 용이하며 최소한의 기술 기술, 실험실 장비 및 시약이 필요합니다. 더욱이, 이 분석의 단순성은 세포, 조직, 또는 바이러스성 혈청형의 다른 모형에 걸쳐 광범위한 응용에 최적화될 가능성을 제공합니다.
프로토콜
동물 관리 및 실험의 모든 측면은 신경 과학 및 정신 건강 지침의 플로리 연구소와 참조 25 다음 과학적 목적을 위한 동물의 관리 및 사용에 대 한 호주 코드에 따라 실시 되었다. 1.5-3세 메리노 에베가 연구에 사용되었습니다. 분석 프로토콜에 대한 회로도 개요는 그림 1에 제공됩니다.
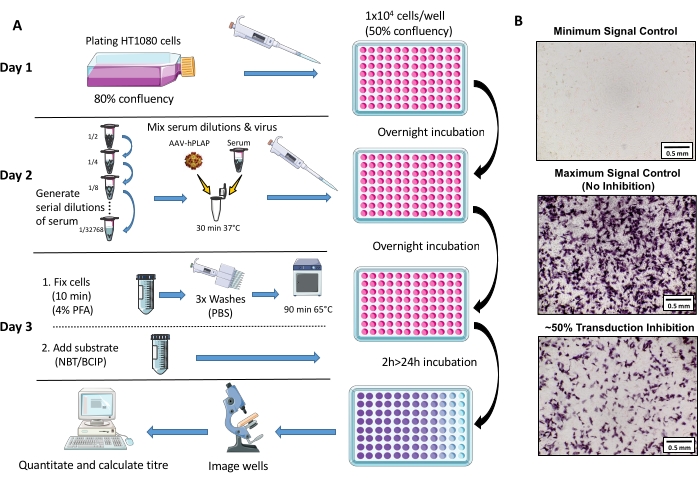
그림 1: NAb 분석 프로토콜의 회로도 도표. (A) 3일 프로토콜과 관련된 기본 단계를 설명하는 NAb 분석기의 시각적 표현. 간략하게, 세포는 하룻밤 성장하고 도금됩니다. 다음 날, 혈청의 연쇄 희석이 준비되고 AAV로 배양한 다음 하룻밤 동안 세포로 배양됩니다. 다음 날, 세포는 고정, 세척, 배양, 기판과 결합하고 다시 배양하고, 이미징 및 수량에 선행됩니다. (B) 최소 신호 제어(완전한 AAV 억제), 최대 신호 제어(억제 없음), 및 ~50% 신호 억제를 갖춘 오바인 혈청 샘플의 대표적인 이미지. 배율 막대 = 0.5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 초기 준비
- 양에서의 평가: 8mL 세럼 분리기 응고 활성제 튜브( 재료 표 참조)에서 혈액을 채취하고, 실온(RT)에서 20-30분 동안 혈액 샘플을 두고, 그 후 15분 동안 2,100x g 로 스핀다운합니다. 튜브 의 상단에 형성 명확한 상신은 혈청입니다. 미세 원심 분리기 튜브로 명확한 수성 단계를 알리쿼트하고 -80 °C에 저장합니다.
참고 : -80 °C의 혈청은 ~ 5 년 동안 안정적으로 유지됩니다. 혈액은 의식이 있는 동물로부터 16G 바늘(팁 컷오프)과 주사기를 사용하여 경동맥 정맥에서 채취하였다. - 열은 30 분 동안 56 °C의 수조에 배치하여 태아 소 혈청 (FBS)을 비활성화하고 간헐적으로 소용돌이. 정밀도를 위해, 동등한 양의 물을 포함하는 두 번째 병에 온도계를 놓고 FBS 병과 동시에 열 목욕에 추가하십시오. 온도계가 56°C에 도달하면 타이밍을 시작합니다.
- 세포 배양 후드26,27에서 수행되는 모든 후속 단계에 적합한 무균 기법과 세포 배양 실습을 채용한다. 사용하기 전에 모든 물체와 후드에 70% 에탄올을 뿌리고 완료 시 1% 하이포염소산 나트륨으로 청소하십시오.
- 고혈당(4.5g/L) DMEM(89%)과 열활성화 FBS(10%) 및 페니실린 연쇄절제술(1%)을 결합하여 DMEM의 수정이 본조 매체(DMEM)를 완성합니다. 멸균 진공 여과 시스템(0.22 μm 모공 크기, 폴레셔술폰 멤브레인)을 사용하여 결합하고 필터링합니다( 재료표 참조). 4 °C에서 호일에 싸여 전체 DMEM을 저장합니다.
- 참조28에 설명된 바와 같이 HT1080 셀(재료 표 참조) 및 75cm2 제곱 플라스크로 통로를 설정합니다. 셀의 여러 고정 된 주식을 만듭니다. 추가 패시징이 분석 결과에 영향을 줄 수 있기 때문에 20 개의 구절 후에 세포를 사용하지 마십시오.
2. 1 일 - 세포 도금
- 그들은 ~ 80 % 합류에 도달 할 때 통과 HT1080 세포.
- 사전 웜 완전 DMEM (단계 1.4에서 제조), 0.05% 트립신-EDTA, 1x 인산 완충식식염(PBS) ~ 37°C의 수조. 포부 시스템을 사용하여 통로 세포에서 성장 배지를 제거합니다.
참고: 이 프로토콜의 모든 포부는 멸균 5mL 세로지컬 파이펫에 튜브가 부착된 진공 시스템을 사용합니다. - 전침(37°C) 10mL로 세포를 세척하고 3-4분 동안 전동된 0.05% 트립신-EDTA의 4mL에서 3-4분 동안 세포를 플라이스크에서 분리한다.
- 사전 따뜻하게 된 완전한 DMEM의 6 mL을 추가하고 50 mL 튜브에 세포를 파이펫하여 트립신을 비활성화합니다. 혈변계 및 트라이판 블루 배제 방법을 사용하여 실행 가능한 세포의 수와 농도를 계산합니다29.
- 세포를 1 x 105 셀/mL의 농도로 희석하여 사전 따뜻하게 된 완전한 DMEM에서 희석합니다. 명확한 96 웰 평평한 바닥 플레이트 (잘 당 1 x 104 세포)로 셀 / 잘 의 씨앗 100 μL. 플레이트를 37°C, 16-22h에 대해 밤새 이산화탄소(CO2)를 5% 배양한다.
3. 2 일 - 세포 감염
- 인큐베이터에서 플레이트/s를 제거하고 가벼운 현미경을 사용하여 세포가 우물 내에 균등하게 분산되고 합류가 ~50%임을 확인합니다. 세포가 45%-55%의 수렴 범위 내에 있지 않으면 '1일' 프로토콜을 반복하고 이에 따라 초기 세포 농도를 조정합니다.
- 사전 따뜻하게 된 완전한 DMEM을 희석제로 사용하여 1.5 mL 마이크로 센심 분리기 튜브에 관심있는 혈청 샘플의 직렬 희석을 생성합니다. 표 1 은 트리탈리케이트 샘플에 대한 희석 캐스케이드의 생성을 보여 줍니다.
- 삼중에서 분석법을 수행하려면, 1x PBS에서 바이러스 스톡 솔루션을 희석하여 AAV6-hPLAP의 작동 용액의 7.5 x 106 벡터 게놈(vg)/μL을 준비한다.
- 7.5 x 106 vg/μL 바이러스 작동 솔루션의 66 μL을 혈청/미디어 희석 264 μL을 포함하는 각 튜브에 추가합니다(총 부피/희석의 330 μL, 표 1 참조).
참고: 완벽한 문화 조건이 필요하지 않은 강력한 분석입니다. 그러나, 각 분석실행이 신뢰할 수 있도록 정확하게 양과 확인하려면, 다음과 같은 다음을 포함할 필요가 있다: (1) 바이러스 및 미디어 전용 제어, (2) 미디어 전용 제어, (3) 동일한 실험 조건 하에서 모든 플레이트에 NAb 양성 제어 샘플. 설명된 부피(330 μL)는 혈청 및 바이러스 혼합물의 트리플리케이트 샘플 +10%를 차지합니다. 복제를 수행하는 것은 활동을 중화하는 정확한 결정에 매우 권장됩니다.
- 바이러스/혈청 희석제는 피펫팅에 의한 바이러스/혈청 희석제와 바이러스/혈청 혼합물을 함유한 튜브를 37°C에서 인큐베이터에 넣고, 30분 동안 5% CO2 를 배치하여 잠재적 중화가 발생할 수 있도록 한다.
- 96웰 플레이트에 각각 1 x 104 셀/웰을 함유한 바이러스/혈청 혼합물의 파이펫 100 μL...
참고: 이것은 각 우물에서 감염 (MOI)의 15k 바이러스/세포 복합성의 최종 바이러스 농도를 생성합니다. 표 2 는 1/512 희석시 샘플을 평가하기 위한 예제 96웰 샘플 플레이트 레이아웃을 제공합니다. - 세포, 혈청 및 AAV-hPLAP를 포함하는 96웰 플레이트를 호일에 싸서 37°C에서 인큐베이터에 넣고, 16-24h에 대해 16-24h의 5% CO2 를 세포로 입력할 수 있도록 한다.
| 희석 캐스케이드 라벨 | 희석 | 3 x 샘플 (240 μL) + 10 % 완충부 (24 μL) | 혈청 비율:미디어 |
| 희석 1 (D1) | 1/2 | 264 μL 혈청 264 μL 미디어 | 50:50 |
| 희석 2 (D2) | 1/4 | 264 μL D1 + 264 μL 미디어 | 25:75 |
| 희석 3 (D3) | 1/8 | 264 μL D2 +264μL 미디어 | 12.5:87.5 |
| 희석 4 (D4) | 1/16 | 264 μL D3 +264 μL 미디어 | 6.25:93.75 |
| 희석 5 (D5) | 1/32 | 264 μL D4 +264 μL 미디어 | 3.13:96.87 |
| 희석 6 (D6) | 1/64 | 264 μL D5 +264 μL 미디어 | 1.56:98.44 |
| 희석 7 (D7) | 1/128 | 264 μL D5 +264 μL 미디어 | 0.78:99.22 |
| 희석 8 (D8) | 1/256 | 264 μL D5 +264 μL 미디어 | 0.39:99.61 |
| 희석 9 (D9) | 1/512 | 264 μL D7 + 264 μL 미디어 | 0.2:99.8 |
| 희석 10 (D10) | 1/2048 | 132 μL D8 + 396 μL 미디어 | 0.05:99.95 |
| 희석 11 (D11) | 1/8192 | 132 μL D9 + 396 μL 미디어 | 0.01:99.99 |
| 희석 12 (D12) | 1/32768 | 132 μL D10 + 396 μL 미디어 | 0.003:99.997 |
표 1: 삼중음부에서 혈청의 직렬 희석을 생성하는 데 필요한 혈청 및 희석제의 볼륨.
| 세럼 샘플 #1 | 세럼 샘플 #2 | 세럼 샘플 #3 | 모노 AB(mAB), 컨트롤 및 추가 샘플 | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 ng MAb | 50 ng MAb | 50 ng MAb |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 ng MAb | 5 ng MAb | 5 ng MAb |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0.5 ng MAb | 0.5 ng MAb | 0.5 ng MAb |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 샘플 #1 1/512 | 샘플 #1 1/512 | 샘플 #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 샘플 #2 1/512 | 샘플 #2 1/512 | 샘플 #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 샘플 #3 1/512 | 샘플 #3 1/512 | 샘플 #3 1/512 |
표 2: 1/2에서 1/512에 이르는 희석제의 순진한 혈청 샘플을 평가하기 위한 예제 96웰 플레이트 레이아웃. AAV NAbs(투여 후 샘플)에 대해 양성으로 알려진 샘플을 평가하거나 더 높은 티터가 필요한 경우 더 높은 희석이 분석에 통합됩니다. MO(-C): 미디어 전용 제어. VO (+C): 바이러스 및 미디어만 제어합니다. mAb: AAV에 대한 단일 클론 항체 (NAb 양성 대조군).
4. 3 일 - 세포에 기판을 고정하고 추가하십시오.
- 37°C(~25mL/96웰 플레이트)로 1배 PBS의 알리쿼트를 미리 데우습니다. PBS (~25mL/96웰 플레이트)와 이중 증류 H2O(DDW, ~25mL/96웰 플레이트)의 4°C를 식히세요. 소용돌이에 의해 50 mL 원심 분리기 튜브에 DDW의 10 mL에 BCIP / NBT의 펠릿 ( 재료의 표 참조)를 용해 (10 mL은 2 x 96 웰 플레이트에 충분하다).
- 흡입 기반 포부 시스템 또는 연기 후드 진공에 부착 된 세로지학적 파이펫 또는 이와 유사한 것을 사용하여 96 웰 플레이트의 우물에서 미디어를 흡인. 세로지학적 파이펫 끝을 부드럽게 우물에 넣고 부착된 세포를 방해하지 않도록 주의를 기울이십시오.
- 파이펫을 사용하여 각 웰에 RT 4% PFA의 50 μL을 추가합니다. 호일에 접시를 감싸고 10 분 동안 RT에 두고 세포를 고정하십시오.
주의: Paraformaldehyde (PFA)는 가능한 발암 물질이며 피부 또는 눈 접촉 또는 흡입에서 독성이 있습니다. 적절한 개인 보호 장비와 얼굴 마스크로 연기 후드를 처리하십시오. PBS에서 4% PFA를 희석시 만듭니다(96웰 플레이트당 7mL).
- 파이펫을 사용하여 각 웰에 RT 4% PFA의 50 μL을 추가합니다. 호일에 접시를 감싸고 10 분 동안 RT에 두고 세포를 고정하십시오.
- RT 1x PBS의 200 μL로 세포를 세척하고 흡인합니다. 이 단계를 두 번 반복합니다.
참고: 멀티채널 파이펫은 파이펫팅 단계에 효율적인 옵션입니다. - 파이펫 200 μL 각각의 우물로 미리 따뜻워진 PBS, 호일로 플레이트를 감싸고 65°C에서 내성 알칼리성 인산포아아제 활성30을 90분 동안 배양한다.
- 흡입 우물과 세척 셀 200 μL의 감기 (4 °C) PBS. 다시 흡인, 차가운 DDW의 200 μl에 세척하고 다시 흡입.
- 각 우물에 용해 된 BCIP/NBT(4.1단계에서 준비)의 파이펫 50 μL.
- 접시를 호일로 감싸고 RT에서 2-24 h로 배양합니다.
참고: 실행 사이의 인큐베이션 시간과 일치하십시오. 시간 유연성을 통해 사용자는 3일째 또는 다음 날 우물을 촬영할 수 있습니다. - 가벼운 현미경 카메라를 사용하여 4배 의 객관적인 렌즈를 사용하여 각 우물의 사진을 찍어 동일한 노출, 흰색 밸런싱 및 조명 설정을 수행한 모든 곡에 일관되게 사용됩니다.
- 각각을 동일하게 배치하고 우물의 가장자리가 사진에 표시되지 않도록 합니다. 사진을 TIF 형식으로 저장하거나 이와 유사한 것으로 저장합니다.
참고: 특정 설정은 현미경마다 다르지만, 배경 조명이 우물 전체에서 높고 일관된 경우 수량이 가장 효과적입니다(그림 1B).
- 각각을 동일하게 배치하고 우물의 가장자리가 사진에 표시되지 않도록 합니다. 사진을 TIF 형식으로 저장하거나 이와 유사한 것으로 저장합니다.
5. ImageJ를 사용하여 중화 활동을 결정하는 수량
- 자유롭게 사용할 수 있는 소프트웨어 "ImageJ"를 다운로드하고 설치 합니다(자료표 참조).
- 파일 > 열기(그림 2)를 선택하여 ImageJ에서 분석할 이미지를 엽니다.
- 컬러 이미지를 사용하는 경우 이미지 > 유형 > 8비트를 선택하여 회색 으로 변환합니다.
- > 임계값을 조정하기 > 이미지를 클릭합니다. 모든 색깔영역이 빨간색으로 칠해지 않고 배경이 지정되지 않을 때까지 임계값을 조정합니다. NBT/BCIP를 추가하면, 유색 제품은 hPLAP를 표현하는 세포 주변 지역에 입금됩니다.
참고: 동일한 플레이트에서 캡처한 모든 이미지에 대해 동일한 임계값 설정을 사용하는 것이 좋습니다. - 측정 을 > 분석한 다음 영역을 체크하고 임계값으로 제한, 영역 분수 및 레이블 표시 확인란을 클릭하고 확인을 클릭합니다.
- 주어진 우물의 신호 판독값(색채 백분율)을 확인하려면 > 측정 분석분석을 클릭합니다. 팝업 창의 '% 영역' 열에는 신호 판독값이 표시됩니다.
- 모든 샘플 복제에 대해 수량을 수행합니다. 오염된 우물, 고르지 않은 세포 분포를 보여주는 우물 또는 세포 밀도 또는 조명에 따라 다양한 우물을 제외하십시오.
참고: 제외로 고려해야 할 우물의 예는 보충 그림 1 을 참조하십시오. 일반적으로 3-4 우물은 96웰 플레이트에서 제외해야 할 수 있습니다. 도 2 는 ImageJ를 사용하여 수량 프로세스의 시각적 표현을 제공합니다.
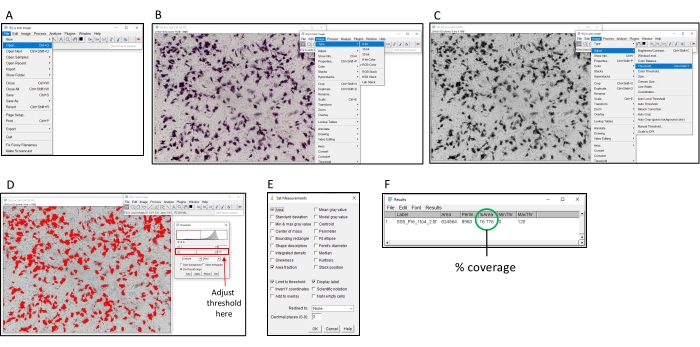
그림 2: ImageJ 소프트웨어를 사용하여 백분율 색을 결정하는 단계입니다. (A) ImageJ 소프트웨어로 분석할 이미지를 엽니다. (B) 이미지를 8비트 그레이스케일로 변환합니다. (C) 임계값 창을 엽니다. (D) 모든 색깔영역이 덮여 있도록 최대 임계값을 조정하지만 배경 영역은 그렇지 않습니다(이 임계값은 전체 플레이트에 걸쳐 일치해야 합니다). (E) '분석' 드롭박스를 선택하고'측정 설정', '영역', '영역 분수', '제한 임계값', '표시 레이블'을 클릭하고 'OK'를 클릭합니다. (F) '측정'을 클릭하여 덮여 영역을 측정합니다. % 영역은 색칠된 이미지의 비율을 나타냅니다. 그런 다음 제어 샘플과 함께 TI50 티터를 확인할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 트랜스듀션 억제(TI50) 타이터 의 결단
- 다음에 대해 복제(5단계에서 설명된 단계를 사용하여)에서 평균 판독값을 결정합니다. (2) 바이러스 + 미디어 만 제어 (최대 신호 판독). (3) 관심있는 바이러스 + 혈청 샘플.
- 다음 수식을 사용하여 억제비율을 계산합니다.
100 - [(테스트 샘플 신호 판독(바이러스 + 세럼 샘플 관심) - 기준신호 판독(미디어 전용 제어)) / (최대 신호 판독(미디어 및 바이러스만) - 기준신호 판독(미디어 및 바이러스만) x 100] = % 경전 억제13. - 6.2의 수식을 사용하여 모든 샘플에 대해 각 희석의 모든 복제에서 % 변환 억제를 계산합니다. 모든 샘플 및 컨트롤에 대한 각 희석에 대한 기술적 복제 사이의 평균 변환 억제를 결정합니다.
- hPLAP 활성의 50% 이상의 트랜스듀션 억제를 산출하는 시료의 가장 낮은 희석을 결정하여 관심 있는 시료의 50% 트랜스유도 억제 티터(TI50 titer)를 계산한다. 예를 들어, 시료의 1/8 희석이 6.2(및 1/4 희석하지 않음)에서 수행된 계산에 기초하여 50% 이상의 변환 억제를 가지는 경우 TI50 티터를 1/8로 보고합니다.
7. 중화 된 AAV 입자의 측정
- 다음 공식을 사용하여 지정된 샘플에 대한 μL 당 중화 된 AAV 입자수를 계산합니다.
((MOI x 셀 카운트/웰) / (TI50 티터의 혈청/희석계수)) / 2 = 중화 AAV 입자/혈청9의 μL.
참고: 중화 입자의 50%를 측정하는 TI50을 2로 나누면 됩니다. TI50 티터를 1/4(25% 혈청)의 시료의 경우, 75% 희석제) 분석이 1 x 104 세포에 도금된 15k의 80 μL 및 15k의 MOI를 사용한 경우, 다음과 같은 계산이 사용될 것이다: ((15000 x 10000) / (80/4)) / 2 = 3.75x106 중화 μL/μL 입자.
결과
플레이트 커버리지를 위한 최적의 바이러스 성 복용량을 확립 하는 Trans유도 분석
HT1080 세포, 잘 확립 된 섬유 육종 세포주, 이 분석에 대 한 선택 되었다. 1 x 104 HT1080 셀/웰의 농도는 96웰 플레이트의 각 웰에 ~50%의 세포 결합을 제공한다. 분석에 대한 최적의 바이러스 농도를 결정하기 위해, hPLAP(인간 태반 알칼리인포스파사제) 기자 유전자(AAV6-hPLAP)31은 세?...
토론
이 보고서는 체외 바이러스 성 트랜스듀션의 정도에 해당하는 염색체 반응을 평가하여 주어진 혈청 샘플에서 AAV 중화의 정도를 평가하는 색법 분석법을 설명합니다. 프로토콜의 개발은 면역 조직화학과 같은 응용 분야에서 단백질 표적의 검출을 위한 스테닝 도구로 널리 활용되고 있는 효소 알칼리인인포스파아제와 NBT/BCIP 사이의 공지된 염색체 반응에 기초하여, 바이러스 성 전도를 평가...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 JRM과 CJT (ID 1163732)에 대한 국가 보건 및 의료 연구 위원회 프로젝트 보조금에 의해 부분적으로 빅토리아 정부의 운영 인프라 지원 프로그램에 의해 지원되었습니다. SB는 공동 베이커 심장과 당뇨병 연구소 - 라 트로브 대학 박사 장학금에 의해 지원됩니다. KLW는 샤인 온 재단과 호주 국립 심장 재단 (ID 102539)의 미래 지도자 펠로우십에 의해 지원됩니다. JRM은 국민 건강 및 의학 연구 위원회 수석 연구 펠로우십 (ID 1078985)에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
참고문헌
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유