Method Article
축삭 수송의 생체 내 이미징을위한 툴킷 확장
요약
트랜스제닉 형광 마우스를 사용하여, 살아있는 동물에서 무손상 좌골 신경의 운동 및 감각 축삭 내 엔도솜 및 미토콘드리아의 신호전달의 생체내 축삭 수송을 평가하기 위해 상세한 프로토콜이 기술된다.
초록
축삭 수송은 다양한 소기관과 화물의 양방향 밀매를 가능하게 함으로써 뉴런 항상성을 유지한다. 축삭 수송의 중단은 개별 뉴런과 그 네트워크에 치명적인 결과를 초래하며 많은 신경 장애에 기여합니다. 이러한 조건의 대부분은 세포 자율 및 비 자율 메커니즘을 모두 포함하고 종종 신경 아류형에 걸쳐 병리학의 스펙트럼을 표시하기 때문에 신경 하위 집합을 정확하게 식별하고 분석하는 방법이 필수적입니다.
이 논문은 마취된 마우스의 좌골 신경에서 신호 엔도솜 및 미토콘드리아의 생체내 축삭 수송을 평가하기 위한 프로토콜을 상세히 기술한다. 1) 콜린성 운동 뉴런 내에서 형광 단백질을 선택적으로 발현하는 마우스를 이용하여 생체내, 계내, 및 생체외 감각 뉴런과 운동을 구별하기 위해 제공되는 단계적 지시사항; 및 2) 개별적으로 또는 동시에 신호전달 엔도솜 및 미토콘드리아의 생체내 축삭 수송을 평가한다. 이러한 상보적인 생체 내 접근법은 뚜렷한 말초 신경 축삭에서 서로 다른 화물의 동시 이미징을 촉진하여 건강과 질병에서 축삭 수송을 정량적으로 모니터링합니다.
서문
말초 신경계 (PNS)는 중추 신경계 (CNS)를 원위 표적에 연결하여 원심성 신호의 릴레이가 운동 제어 및 구심성 신호를 발휘하여 감각 피드백을 제공 할 수있게합니다. 마우스 유전학의 수많은 진보를 사용하여 과학자들은 PNS 1,2,3을 괴롭히는 많은 질병 / 증후군을 조사하기 위해 다양한 마우스 모델을 개발했습니다. 대부분의 신경 퇴행성 병리는 세포 자율 및 비 자율적 기여 4,5와 함께 다인자이기 때문에 세포 / 뉴런 특정 병리를 풀어내는 것은 질병 메커니즘에 대한 결정적이고 새로운 통찰력을 제공 할 수 있습니다.
이를 위해, 박테리아 인공 염색체 (BAC)-트랜스제닉 마우스6 의 개발은 뉴런의 표적화된 서브세트에서 형광 단백질의 선택적 내인성 발현을 가능하게 하였다. 예를 들어, BAC-트랜스제닉 마우스는 콜린성7 또는 글리시네르겐성 뉴런8, 또는 파브알부민 양성 뉴런9에서 변이체 적색 형광 단백질(tdTomato)을 발현하는 녹색 형광 단백질(GFP)을 이용할 수 있다. 대안적으로, 형광 단백질의 선택적 뉴런 발현은 Cre-loxP 기술(10)을 통해 달성될 수 있다. 예를 들어, 뉴런의 서브세트에서 Cre-재조합효소를 발현하는 마우스 균주 (예를 들어, 콜린 아세틸트랜스퍼라제 (ChAT)-Cre)는 loxP 부위11 에 의해 측면된 전사 리프레서의 제어 하에 구성적 유전자좌 (예를 들어, Gt(ROSA)26Sor)로부터 형광 단백질 (예를 들어, tdTomato 또는 GFP)을 발현하는 마우스와 함께 사육될 수 있다 (예를 들어, 콜린성 뉴런에서만 tdTomato를 발현하는 마우스를 생성함). 실제로, Cre-loxP 재조합을 사용하여, 하강 피질척수관(12)의 축삭돌기에서 황색 형광 단백질을 발현하는 트랜스제닉 마우스가 생성되었다.
또한, ORANGE와 같은 CRISPR/Cas9 유전자 편집의 최근 발전은 나노스케일 분해능13에서 달성할 수 있는 발현과 함께 다수의 내인성 뉴런 단백질의 형광 태깅을 가능하게 한다. 더욱이, Cre-발현 마우스 균주와 조합하여, ORANGE-CAKE는 개별 뉴런(13)에서 다수의 내인성 단백질을 태그하는데 사용될 수 있다. 대안적으로, 바이러스-매개 뉴런 추적은 또한 뉴런 서브세트의 표지를 허용하고, 바이러스 혈청형 및/또는 세포-특이적 프로모터14,15,16,17의 표적화된 조합으로 달성될 수 있다.
뉴런 표지 방법에 추가로, 마우스 라인은 또한 시안 형광 단백질 (Mito.CFP)18을 발현하는 미토콘드리아와 같은 특정 소기관을 표적화하는 리포터 단백질 또는 GFP (LC3.GFP)19를 발현하는 오토포고좀을 발현하도록 조작되었다. 더욱이, 마우스 라인은 뉴런 (예를 들어, Thy1.GCaMP)20,21에서 특이적으로 칼슘 역학을 평가하도록 조작되었다. 전체적으로 이러한 모델의 발전과 함께 새로운 실험 응용 프로그램을 통해 과학자들은 CNS와 PNS에 대해보다 정확한 생물학적 및 병리학 적 질문을 할 수 있습니다.
말초 운동 신경의 주요 역할은 전기 신호를 골격근으로 전송하여 움직임을 유도하는 것입니다. 또한, 더 긴 시간 스케일에 걸쳐 발생하며, 신경화학적 및 생리학적 메시지는 다양한 소기관(예를 들어, 미토콘드리아, 엔도리소좀, 신호전달 엔도솜)의 형태로 단방향 또는 양방향 방식으로 세포골격 네트워크를 횡단하여 뉴런 항상성을 유지하는 것을 돕는다(22,23,24). 축삭 수송의 손상은 신경 건강에 비참한 결과를 초래하며 많은 신경 발달 및 신경 퇴행성 질환과 관련이 있습니다25. 분자 수준에서, 축삭 수송의 손상은 축삭26,27 전체에 걸친 시냅스 신호 전달 및 가소성, 유전자 전사 및 국소 번역을 조절하는 생리적 사건을 방해 할 수 있습니다. 배양된 세포/뉴런(28,29)에서 이러한 사건들을 연구하기 위한 다수의 도구들이 있지만, 생체내에서 축삭 수송 역학 및 축삭-연결된 생물학적 사건들을 평가하는 것은 생리학적 및 병리학적 과정(30)에 대한 주요 통찰을 확인하기 위해 요구된다.
수년에 걸쳐, Schiavo 연구소는 축삭 수송 31,32,33,34,35,36에 대한 다양한 질문을하기 위해 프로토콜을 최적화했습니다. 이러한 실험은 파상풍 신경독소(HCT)의 형광 표지된 무독성 단편이 니도겐 및 폴리시알로강글리오사이드(37)와의 상호작용을 통해 골격근의 축삭 말단으로 내재화된다는 발견으로부터 확장되었다. 일단 내재화되면, HCT는 운동 및 감각 뉴런38,39,40,41의 세포체로 향하는 Rab7 양성, 뉴로트로핀 함유 신호전달 엔도솜으로 역행적으로 수송된다. 동시에, 이미징 기술의 발전은 살아있는 마취 마우스(30)에서 말초 신경 다발과 개별 축삭돌기의 실시간 분석을 가능하게 하였다. 병리학에서 생체 내 축삭 수송 역학을 평가하는 첫 번째 시도는 근위축성 측삭 경화증 (ALS)35의 SOD1G93A 마우스 모델에서 신호 엔도솜과 미토콘드리아의 수송에서 사전 증상 장애를 밝혀 냈습니다. 중요하게도, 이러한 결함은 케네디병(42)의 마우스 모델(42)과 ALS43의 이형접합체 돌연변이 FUS 모델에서 축삭 수송 섭동이 없을 때 운동 뉴런 손실이 발생할 수 있다는 발견을 고려할 때, 단순히 신경변성의 이차적인 결과를 나타내지 않을 것이다. 이러한 축삭 수송 결핍은 특정 키나제33 또는 성장 인자 수용체(34)의 억제제를 사용하여 ALS 마우스에서 해결될 수 있다. 더욱이, 뉴런을 특정 히스톤 탈아세틸라제 차단제로 치료하면 생체내 미토콘드리아 수송이 변화된다(36). 가장 최근에, 우리는 축삭 수송의 BDNF 의존성 조절이 ALS 마우스44에서 별개의 운동 뉴런 서브타입에서 조절되지 않는다는 것을 보고한다.
축삭 수송 역학28,29를 평가하기 위해 끊임없이 확장되는 툴킷을 사용함으로써, 이 비디오 프로토콜은 다양한 생물학적 및 병리학적 시나리오에 대한 추가 통찰력을 허용하는 몇 가지 애플리케이션을 간략하게 설명합니다. 첫째, 콜린성 뉴런 (즉, 운동 뉴런)에서 형광 단백질을 선택적으로 발현하는 트랜스제닉 마우스는 생체 내 및 생체 외 모두에서 운동 및 감각 축삭을 구별하는데 사용된다. 형광 표지된TH는 이어서 별개의 말초 뉴런에서 축삭 수송 역학을 분화시키기 위해 세 개의 트랜스제닉 라인에서 신호전달 엔도솜에 로딩된다. 다음 실험 프로토콜은 ChAT.tdTomato 마우스를 Mito-CFP 마우스와 함께 사육하여 운동 뉴런에서 미토콘드리아 수송을 구체적으로 평가하기 위한 멀티플렉스 형광 접근법을 자세히 설명합니다. 마지막으로, 생체내에서 동일한 축삭 내의 미토콘드리아와 엔도솜 신호전달을 동시에 영상화하는 방법에 대한 지침이 제공된다.
프로토콜
모든 마우스 취급 및 실험은 동물 (과학적 절차) 법 (1986)에 따라 수행되었으며 University College London - Queen Square Institute of Neurology Ethics Committee의 승인을 받았습니다.
1. 동물
- 모든 동물을 온도 및 습도가 조절 된 환경에서 개별적으로 환기 된 케이지에 보관하고 음식과 물에 대한 광고 리비툼 접근으로 12 시간 빛 / 어두운주기로 유지하십시오.
- 다음의 트랜스제닉 균주의 수컷 및 암컷 마우스를 모두 사용한다: 1) ChAT.eGFP 마우스로 지칭되는 이형접합성 Tg(Chat-EGFP) GH293Gsat/Mmucd 마우스; 2) 이형접합체 B6.Cg-Tg(Hlxb9-GFP)1Tmj/J, HB9로 지칭됨. GFP 마우스; 3) 이형접합성 B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J, Mito.CFP 마우스로 지칭됨.
- ChAT.Cre 마우스로 불리는 동형접합성 B6;129S6-Chat tm2(cre)Lowl/J를 교차시켜 ChAT.Cre 마우스로 지칭하고, 동형접합성 B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J를 통해 생성한다.
- ChAT.tdTomato::Mito.CFP 마우스를 이형접합성 Mito.CFP 마우스와 교차시켜 이형접합성 ChAT.tdTomato 마우스를 생성한다.
2. 형광 HCT의 근육내 주사
- 수술 전 준비
- 익스프레스 HCT(HCT441, 잔기 875-1315)는 45당 글루타티온-S-트랜스퍼라제 융합 단백질로서 박테리아에서 개선된 시스테인이 풍부한 태그에 융합된다. HCT를 AlexaFlour555C2 말레이미드31로 표지하고, 이를 빙냉투석 완충액 (10 mM HEPES-NaOH, 100 mM NaCl, pH 7.4)에서 투석하고, 이를 액체 질소에서 동결시키고, -80°C에서 저장한다. 생체내 실험을 수행하기 전에, 먼저 일차 뉴런에서의 성공적인 흡수 및 수송을 위해 시험관내 TH를 시험한다.
- 형광 H C T (예를들어, HCT-555)를 0.2 mL 튜브의 멸균 인산염 완충 식염수 (PBS)에서 2.5 내지 10 μg/μL 범위의 최종 및 실험적으로 일관된 농도로 희석한다. 이 단계에서, 필요한 경우 HCT 용액에 더 많은 화합물/인자를 첨가한다(예를 들어, 뇌 유래 신경영양 인자).
참고: 최종 볼륨은 관심 있는 근육의 크기에 적합해야 합니다. 예를 들어, 경골 전방 (TA) 근육에 대해 3-4 μL의 주입 부피를 제조하고 더 작은 발바닥 근육에 대해 ∼1 μL의 주입 부피를 준비한다. 최종 부피에 관계없이 HCT의 작동 농도를 2.5 ~ 10 μg / μL 사이로 유지하십시오. - 피펫 또는 볼텍스를사용하여 HC T용액을 혼합하고, 데스크탑 원심분리기를 사용하여 저속으로 간단히 스핀 다운하여 액체를 수집하고 큰 기포를 제거하십시오. HCT를 얼음 위에서 빛과 수송으로부터 보호하십시오.
- 당겨진 유리 마이크로 피펫을 사용하여 더 작은 근육 (예 : 발바닥)에 최적의 근육 주사를 사용하거나 좌골 내 신경 주사를 사용하십시오. 수술 전에 등급이 매겨진 유리 마이크로 피펫 ( 46 당)을 당깁니다.
참고: 피펫팅을 활성화하고 마이크로피펫 뒤쪽의 위아래로 흐르는 것을 제한하려면 해부 현미경 아래의 미세한 포셉을 사용하여 날카로운 팁에서 작은 조각을 조심스럽게 떼어냅니다. 부러진 끝을 적절한 쓰레기통에 버리십시오. - 사용하기 전에 모든 수술 도구를 멸균하고 청소하십시오.
- 수술 - 근육 주사
- 37°C로 설정된 히트 매트에 멸균 수술 드레이프를 고정하여 수술을 준비합니다. 작동 현미경을 배치하고 초점을 맞춥니다. 수술을 시작하려면 미리 멸균 된 수술 도구, 수술 테이프, 멸균 면봉, 물에 70 % (v / v) 에탄올, 멸균 식염수, 봉합사 및 해밀턴 바늘 또는 당겨진 유리 마이크로 피펫을 수술 드레이프에 포장하십시오.
- 마취 기계가 수술 절차 기간 동안 충분한 산소와 이소플루란을 가지고 있는지 확인하십시오. 마취의 흐름을 유도 챔버로 향하게하고 마취 기계를 켭니다.
- 시작하려면 1-2 L / min의 산소 유량과 5 % 이소플루란을 사용하십시오. 마우스를 유도 챔버에 두어 마취를 시작합니다. 우뢰 반사가 없으면 마취를 2-3 % 이소플루란으로 줄이고 마취의 흐름을 마우스 피스로 향하게하고 마우스를 수술 공간의 별도의 영역에있는 마우스 피스로 옮깁니다.
- 주사 할 근육을 덮고있는 모피 영역을 면도하기 전에 각막과 페달 금단 반사가 모두 없는지 확인하십시오. 완료되면 수술 테이프의 끈적 끈적한면을 사용하여 마우스에서 가능한 한 많은 면도 모피를 제거하고 마우스를 계량 저울에 올려 놓고 수술 전 체중을 기록하십시오.
- 면봉을 사용하여 눈 윤활제를 조심스럽게 바르고 마우스와 마우스 피스를 수술 부위로 옮깁니다.
참고 : 수술 부위로 옮겨지는 면도 모피의 양을 제한하십시오. 마우스가 빠져 나가는 것을 방지하기 위해 수술 테이프를 사용하여 마우스피스에 머리를 고정하십시오. 별도의 면봉을 사용하여 면도 부위에 에탄올을 바르면 모피 오염을 살균하고 줄입니다. - 주입 할 근육에 따라 몸을 배치하십시오. 예를 들어, TA의 경우 마우스를 뒤쪽에 놓고 뒷다리를 중간 선에서 ~ 10 ° 뻗어 내십시오. 또는 단독 주사의 경우 동물을 옆으로 놓고 뒷다리를 중간 선에서 ~ 45 °로 연장하십시오. 뒷다리가 올바른 위치에있을 때 수술 테이프를 사용하여 수술 중 원치 않는 움직임을 방지하십시오.
참고 : TA, 위장관 및 발바닥 근육에 대한 주사 절차는 이전에 자세히 설명되었습니다32. - 절개를하기 전에 페달 금단 반사를 테스트하여 마취가 충분한지 확인하십시오. 마취를 지속적으로 모니터링하고 호흡과 금단 반사에 대한 정기적 인 평가로 수술 과정 전반에 걸쳐 마취를 유지하십시오.
- 이 시점에서 작업 중인 HCT 용액을 해밀턴 주사기 또는 당긴 유리 마이크로피펫에 당깁니다.
- 모터 엔드 플레이트 영역(46,47,48)과 대응하는 영역(들)에서 관심있는 근육(들)을 약간 절개한다. 근육의 외부 근막을 관통하고 천천히 32에 따라 HCT를 주입하십시오. 천천히 철수하기 전에 주사기 / 마이크로 피펫을 5-10 초 동안 그대로 두십시오.
- 1-2 봉합사로 절개를 닫고 마우스를 격리 된 회복 케이지로 옮깁니다. 마우스 수술 후 최소 30 분 동안 모니터한 후 홈 케이지로 되돌려 놓습니다. 마우스가 성공적으로 회복되고 수술 후 모니터링이 완료되면 케이지를 정상 하우징 상태로 되돌립니다.
3. 생체 내 축삭 수송
- 좌골 신경의 노출
- 현미경 환경 챔버를 이미징 최소 1 시간 전에 37°C로 설정하십시오.
- 수술 부위 주위에 수술 커튼, 도구, 테이프, 멸균 면봉, 70% 에탄올 및 멸균 식염수를 배치하여 좌골 신경을 노출시킬 준비를 한다. 마취 기계가 마우스 당 최대 2 시간 동안 산소와 이소플루란을 충분히 저장하는지 확인하십시오. 각진 팁으로 좁은 직사각형 (예 : 더 큰 마우스의 경우 ~ 1cm 너비)으로 절단하여 파라 필름 또는 보이지 않는 테이프에서 쐐기를 만들고 노출 된 좌골 신경 아래에 배치하여 이미징 과정을 돕습니다. 유도 챔버를 열 매트 위에 놓고 체온으로 설정하십시오.
참고: 네 시간은 HCT가 흡수되어 주사 부위에서 좌골 신경으로 역행하여 운반되는 충분한 시간입니다. 따라서이 시간 후에 단일 마우스를 재마취 할 수 있습니다. - 마취의 흐름을 유도 챔버로 향하게하고, 1-2 L / min의 산소 유량과 3-4 % 이소플루란으로 마취 기계를 켜고 마우스를 유도 챔버에 두어 마취를 시작하십시오.
참고: 생체 내 축삭 수송 실험은 말단 절차이므로 눈에 윤활유를 바르지 않아도 됩니다. - 오른쪽 반사가 없을 때, 마취를 2-3 % 이소 플루란으로 줄이고, 마취의 흐름을 마우스 피스로 지시하고, 마우스를 마우스 피스로 옮깁니다. 수술 테이프를 사용하여 머리를 마우스 피스에 고정하고 중간 선에서 ~ 45 °로 대상 뒷다리를 연장 한 다음 발 위에 수술 테이프를 사용하여이 위치를 유지하십시오.
참고: 감소된 마취는 영상 과정 동안 호흡 아티팩트의 충격을 제한할 수 있기 때문에 이 시점에서 유리하다. - 각막 및 페달 금단 반사가 없는지 확인한 다음, 가위를 사용하여 좌골 신경(32 )(즉, 중앙 척수에서 중간 뒷다리까지 뻗어있는 넓은 영역)을 덮고 있는 피부를 잘라낸다. 위에 놓인 이두박근 대퇴골 근육뿐만 아니라 좌골 신경 근처에있는 다른 근육 및 결합 조직을 제거하십시오. 좌골 신경과 주변 혈관, 특히 슬개골 / 측방 위장관 머리의 근위 측면 근처에있는 혈관을 손상시키지 마십시오.
- 손상되지 않은 좌골 신경이 충분히 노출되면 좌골 신경 주변 부위에 미리 예열 된 멸균 식염수를 바르면 건조를 방지하십시오. 구부러진 포셉을 사용하여 깊숙이 누워있는 결합 조직을 파괴하고 미리 준비된 파라 필름 '쐐기'를 신경 아래에 놓습니다. 완료되면, 식염수에 담근 면모를 노출된 부위에 놓고 마우스를 열 매트(37°C로 설정)의 상부에 위치한 유도 챔버 내로 이동시키고, 이는 여전히O2의 이소플루란으로 채워져야 한다.
- In vivo 축삭 이미징
- 맞춤형 현미경 스테이지에 22 x 64mm 커버 글래스를 놓고 테이프로 위치를 고정하십시오. 침지 오일을 선택하여 목표에 적용한 다음 현미경 단계를 거꾸로 된 현미경에 연결하십시오. 오일과 커버 글라스 사이에 접촉이 이루어질 때까지 오일 침지 된 목표를 천천히 들어 올립니다.
참고: 40x, 1.3 수치 조리개 (NA) DIC Plan-Apochromat 또는 63x, 1.4 NA DIC Plan-Apochromat 오일 침지 목표를 사용하여 좌골 신경 의 생체 내 수송을 이미지화할 수 있습니다. - 마취 마우스 피스를 현미경 단계로 옮기고 마취 호스를 테이프로 고정하여 마취 방해를 방지하십시오. 좌골 신경에서 면봉을 제거하고 노출 된 신경이 커버 글라스를 향하게하면서 마우스를 유도 챔버에서 마우스 피스로 옮깁니다. 수술 테이프를 사용하여 마우스의 머리가 마우스 피스에 고정되고 가장 낮고 효과적인 마취 수준을 유지하십시오. 꼬리로 마우스를 부드럽게 들어 올리고 노출 된 좌골 신경 근처의 커버 슬립에 멸균 식염수를 첨가하여 건조를 제한하고 이미징을 돕습니다.
참고 : 환경 챔버의 모든 문을 닫아 해당 영역이 체온에 유지되도록하십시오. - 안구를 사용하여 좌골 신경을 찾고, 최적의 초점을 결정하고, 운동성 축삭 소기관을 포함하는 관심 영역을 선택하십시오.
참고: 이 프로세스에 대한 자세한 설명은 이전에 설명되었다(32). - 획득 버튼(또는 동급)을 클릭하여 컴퓨터 소프트웨어로 전환하고 관심 영역을 선택합니다. 디지털 줌을 사용하여 총 >80x 배율을 얻고 선택한 영역을 회전하여 축삭(예: 오른쪽에서 왼쪽으로 이동하는 역행 화물 및 왼쪽에서 오른쪽으로 움직이는 전방 화물)을 수평으로 시각화합니다.
참고: 방향성 매개 변수는 사용자에 따라 다르지만 실험 전체에서 일관성을 유지해야 합니다. - 레이저 강도(0.2 - 1%), 핀홀 조리개(1 AU - 최대), 이득(마스터)(700 - 1000), 디지털 오프셋(-50 - 0) 및 디지털 이득(1.0 - 4.0)과 같은 파라미터를 조정하여 신호 강도를 최적화합니다. 광독성의 잠재적 영향을 줄이려면 가능한 경우 레이저 강도를 ≤ 1 %로 유지하고 최대 레이저 강도는 2 %로 유지하십시오. 최적의 신호 감지를 위해 레이저 강도를 조정하기 전에 다른 모든 매개 변수를 변경하십시오.
- 영역 상자(또는 이에 상응하는 영역)를 클릭하고 관심 사각형 영역을 선택한 다음 획득 모드(또는 이에 상응하는 영역)에서 프레임 크기를 최소 1024 x 1024픽셀로 설정하고 100-1,000프레임의 타임랩스 획득을 시작합니다.
참고: 원하는 프레임 획득 속도는 사용자 의존적이며(예를 들어, 전송은 0.1 ~ 6초 사이의 프레임 속도로 평가될 수 있음), 관심 영역, 스캔 속도 시간, 획득 평균화 및 레이저 방향성과 같은 소프트웨어 파라미터로 조정될 수 있다. 예를 들어, 더 느린 프레임 속도를 얻으려면 관심 영역의 높이/너비를 늘리고, 더 느린 스캔 속도를 획득하고, 획득 평균화를 높이고, 더 빠른 프레임 속도를 위해 단일 레이저 방향성을 사용하고, 그 반대의 경우도 마찬가지입니다 . 프레임 획득 속도는 서로 다른 주파수에서의 이미징으로 인해 불일치가 발생할 수 있으므로 유사한 데이터 세트에서 일관성을 유지해야 합니다. 신호 엔도솜과 같은 빠른 화물은 느린 속도(예: 2.5-6초)를 사용하여 분석할 수 있는 미토콘드리아와 같은 느린 소기관과 비교하여 더 빠른 프레임 속도(예: 0.1-3초)를 필요로 합니다. - 마우스 당 최소 세 개의 축삭에서 최소 10 개의 운동성 화물을 포획하는 것을 목표로하십시오.
참고: 양면, 양면 검정력 계산(표준 검정력이 0.8(1-β)이고 유형 I 오류율이 5%(α)인 경우)를 기반으로 하여 6-8의 표본 크기는 야생형과 질병 모델35,43 간의 축삭 수송 차이를 식별하기에 충분합니다. - 일단 영상화가 완료되면, 마취 하에 있는 동안 즉시 마우스를 안락사시킨다(예를 들어, 자궁경부 탈구). 근육 및 좌골 신경과 같은 사후 사후 조직도 추가 분석을 위해 수확 될 수 있습니다.
- 맞춤형 현미경 스테이지에 22 x 64mm 커버 글래스를 놓고 테이프로 위치를 고정하십시오. 침지 오일을 선택하여 목표에 적용한 다음 현미경 단계를 거꾸로 된 현미경에 연결하십시오. 오일과 커버 글라스 사이에 접촉이 이루어질 때까지 오일 침지 된 목표를 천천히 들어 올립니다.
결과
이 논문은 설치류 모델 에서 생체 내 축삭 수송 툴킷을 확장하는 다목적 프로토콜을 자세히 설명합니다. 도 1 은 운동 뉴런 축색돌기가 트랜스제닉 마우스를 사용하여 감각 뉴런 축삭 및 슈완 세포 둘 다로부터 분화될 수 있음을 입증한다. 도 1A는 살고, 마취된 ChAT.eGFP 마우스로부터의 콜린성 운동 축색돌기에서의 eGFP 발현을 묘사한다. 도 1B 는 ChAT.tdTomato 마우스로부터 갓 적출된 신경(즉, 추가적인 조직 처리 없음)에서 tdTomato 발현을 달성하기 위한 대안적인 방법을 사용한다. 따라서, ChAT.eGFP, ChAT.tdTomato 또는 Hb9.GFP와 같은 트랜스제닉 균주를 사용하면 생체내에서 모터 축삭 특이적 표지가 가능하게 된다.
대안적으로, 축삭은 또한 추적기/마커(예를 들어, HC T31,32 또는 eGFP15를 코딩하는 바이러스)를 골격근에 주입함으로써 확인될 수 있다. 그림 2는 이러한 적용을 강조하며, HCT-555 양성 신호전달 엔도솜(흰색 화살표)을 포함하는 8개의 ChAT.eGFP 양성 축삭돌기를 견고하게 발현하는 것을 묘사하며, TA 근육으로의 프로브 주사 후 4시간 후이다. 이 실험 설계를 사용하여, 우리는 TA-innervating α-motor 뉴런을 확인할 수 있었는데, 이는 주로 빠르고-치명적일 수 있는44이다. 덜 강력한 eGFP 발현을 갖는 추가로 다섯 개의 ChAT.eGFP 축삭돌기(그림 2A, 오렌지색 별표)는 부분적으로 초점이 맞지 않았고 좌골 신경 내에 약간 더 깊이 위치할 가능성이 높다.
또한, 우리는 eGFP 음성 감각 축삭 (노란색 화살표)에서 HCT-555 양성 신호 엔도솜을 확인했습니다. 따라서, 이 실험적 패러다임을 사용하여, 운동 내의 신호 엔도솜의 축삭 수송과 생체 내의 감각 뉴런의 축삭 수송을 구체적으로 평가하고 비교할 수 있다. 실제로, 이 트랜스제닉 리포터 균주를 사용하여, 우리는 ChAT.eGFP 양성 운동 축삭에서 신호전달 엔도솜의 수송이 ChAT.eGFP 음성 감각 축삭보다 빠르다는 것을 발견하였으며, 이는 축삭 폭43을 사용하여 안정적으로 분화될 수 있다.
우리는 이전에 생체 내 ChAT.eGFP 마우스 43을 사용하여 운동 뉴런 축삭을 확인했다. 우리는 이제 HB9를보고합니다. GFP 마우스는 또한 생체내에서 운동 뉴런 축삭 동정을 달성하기 위해 사용될 수 있다. 실제로 그림 3은 HB9의 일련의 타임랩스 이미지를 보여줍니다. GFP 축색돌기는 역행적으로움직이는HFT-555-양성 신호전달 엔도솜을 함유한다. ChAT를 구동하는 식과 달리 GFP는 HB9에서 더 펑크/세부적인 패턴을 가지고 있습니다. GFP 축색돌기; 그 이유는 불분명하다.
우리는 이전에 미토콘드리아 표적화 염료, 테트라메틸로다민, 에틸 에스테르, 과염소산염 (TMRE)32,36의 좌골 신경내 주사를 통해 좌골 신경에서 생체 내 미토콘드리아 역학을 모니터링하는 방법을 기술하였다. 운동 대 감각 미토콘드리아를 확실하게 구별하기 위해, Thy1 프로모터18 하에서 CFP를 발현하는 Mito.CFP 마우스는 특정 뉴런 유형에서 형광 리포터 유전자를 발현하는 트랜스제닉 마우스와 교차될 수 있다. 실제로 Mito.CFP 마우스를 ChAT.tdTomato 마우스 (ChAT.tdTomato::Mito.CFP라고 함)로 번식시킴으로써 그림 4와 같이 모터 축삭에서 미토콘드리아를 구체적으로 시각화 할 수있었습니다. 이 라이브 멀티플렉스 예제에서 다섯 개의 ChAT.tdTomato 축삭을 시각화할 수 있으며, 그 중 네 개는 CFP 양성 미토콘드리아를 포함합니다. 또한, Ranvier의 노드 (패널 iii의 흰색 화살표)도 식별 될 수 있습니다. 또한 Ranvier의 노드는 ChAT.eGFP, HB9에서 명확하게 감지 할 수 있습니다. GFP 및 Mito.CFP 마우스 (도시되지 않음). 이러한 이중 트랜스제닉 균주는 마취된 생쥐의 시간경과 생체내 영상화를 가능하게 하여 운동 뉴런 특이적 미토콘드리아 함량 및 축삭 수송 역학을 모니터링한다.
마지막으로, 엔도솜과 미토콘드리아의 신호전달은 Mito.CFP 마우스의 근육에HFT를 주입함으로써 생체내에서 동일한 축삭 내에서 동시에 가시화될 수 있다(도 5). HCT-555의 근육내 주사는 영상화 전에 Mito.CFP 마우스에서 TA 근육에서 ∼4 h 동안 수행되었다. 미토콘드리아(i 패널) 및 신호전달 엔도솜(ii 패널) 둘 다 근육-특이적 축삭(즉, TA를 신경과민하는 축삭)에서 동시에 가시화되었다. 실제로, 전방 (노란색 삼각형)과 역행 적으로 (녹색 삼각형과 원) 움직이는 소기관과 정지 된 소기관 (주황색 삼각형과 원)을 관찰 할 수 있습니다. 이 실험 패러다임을 사용하여, 생체내에서 축삭 미토콘드리아와 엔도솜 신호전달 사이의 복잡한 기능적 상호작용을 평가할 수 있다. 전반적으로, 우리는 신호 엔도솜 및 / 또는 미토콘드리아, 특히 생체 내 콜린성 운동 뉴런에서 신호 전달의 축삭 수송을 평가하기위한 몇 가지 다른 실험 접근법을 보여줍니다.
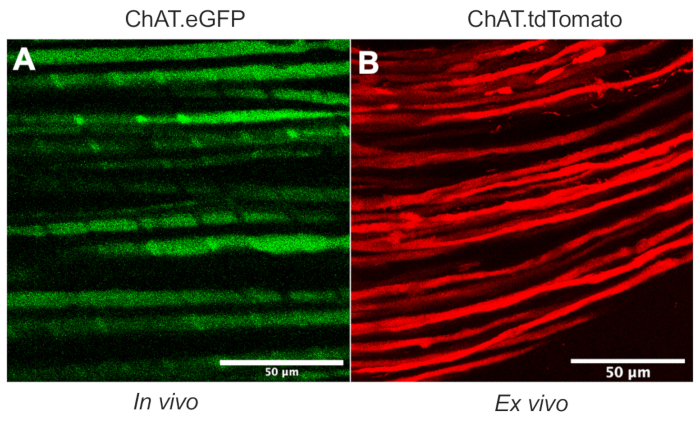
도 1: 좌골 신경 운동 축삭. (A) ChAT.eGFP 마우스로부터 생체내에서 얻어진 eGFP 양성 운동 축삭의 대표적인 단일 평면 이미지. (B) ChAT.tdTomato 마우스로부터 적출된 좌골 신경에서 tdTomato 양성 운동 축삭의 대표적인 단일 평면 이미지. 축삭 구경의 차이는 마우스 나이와 크기의 차이에서 비롯됩니다. 스케일 바 = 50 μm. 약어: eGFP = 강화된 녹색 형광 단백질; ChAT = 콜린 아세틸트랜스퍼라제. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: ChAT.eGFP 마우스의 살아있는 좌골 신경 운동 및 감각 뉴런에서의 신호전달 엔도솜의 생체내 축삭 수송. (A-C) eGFP (A)를 발현하고 H C T-555 양성 신호전달 엔도솜 (B)을 함유하는 콜린성 축색돌기의 대표적인 이미지(B) 및 병합(C). 흰색 화살표는 H C T-555 양성 신호 엔도솜을 포함하는 eGFP 양성 모터 축삭을 강조하고, 시안 화살표는 H C T-555 양성 신호 엔도솜이 결여된 모터 축색돌기를 식별하고, 노란색 화살표는 HCT-555 양성 신호 엔도솜을 운반하는eGFP 음성 감각 축색을 강조 표시합니다. 주황색 별표는 eGFP 발현이 약한 모터 축삭을 식별합니다. 스케일 바 = 25 μm. 약어: eGFP = 강화된 녹색 형광 단백질; ChAT = 콜린 아세틸트랜스퍼라제; CHCT-555 = 파상풍 독소-결합 도메인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
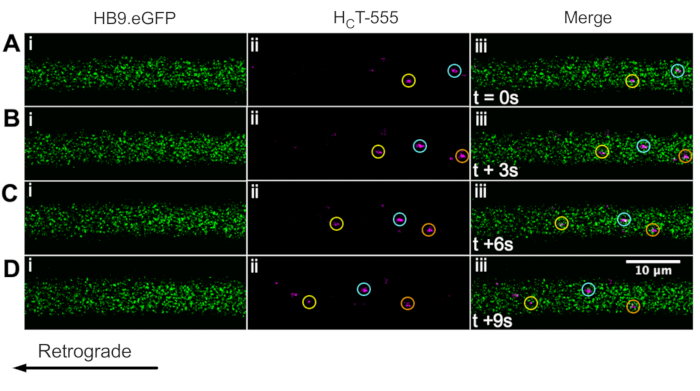
그림 3: HB9의 살아있는 운동 뉴런에서 신호전달 엔도솜의 생체내 축삭 수송을 나타내는 타임랩스 이미지 시리즈. GFP 마우스. (A-D) 시간-경과 이미지는 녹색 형광 단백질(i)을 발현하고HFT-555 양성 신호전달 엔도솜(ii)을 함유하고, 병합(iii)을 함유하는 운동 뉴런 축색돌기를 묘사하는 매 3초마다 촬영되었다. 동일한 색상의 각 원은 서로 다른 프레임에서 동일한 움직이는 엔도솜을 식별합니다. 역행 운동은 오른쪽에서 왼쪽으로 이동합니다. 스케일 바 = 10 μm. 약어: GFP = 녹색 형광 단백질; CHCT-555 = 파상풍 독소-결합 도메인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
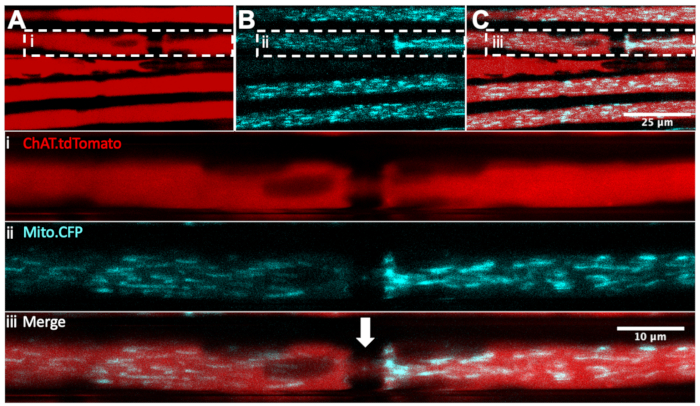
그림 4: ChAT.tdTomato:: Mito.CFP: mouse. ( A-C) CFP 양성 미토콘드리아(B)를 포함하는 tdTomato 양성 운동 축삭(A)의 대표적인 이미지. 삽입 이미지 i-iii은 각 패널에서 더 높은 배율을 포함합니다. 흰색 화살표는 Ranvier의 의심되는 노드를 나타냅니다. 스케일 바 = 25 (A-C) 및 10 μm (i-iii). 약어: ChAT = 콜린 아세틸트랜스퍼라제; CFP = 시안 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
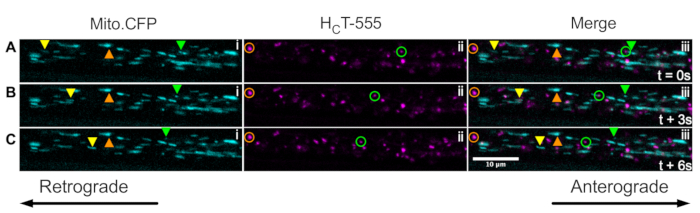
그림 5: Mito.CFP 마우스의 살아있는 좌골 신경 운동 뉴런에서 미토콘드리아의 생체 내 축삭 수송 및 신호 엔도솜의 동시 생체 내 축삭 수송을 나타내는 타임랩스 이미지 시리즈. (A-C) 동일한 좌골 신경 축삭 (iii) 내의 미토콘드리아(i)와 신호 엔도솜(ii) 모두의 축삭 수송을 묘사하는 3초마다 촬영된 타임랩스 이미지. 노란색 삼각형은 전방으로 움직이는 화물을 식별하고, 녹색 원/삼각형은 역행적으로 움직이는 화물을 식별하며, 주황색 원/삼각형은 고정된 화물을 식별합니다. Anterograde 운동은 왼쪽에서 오른쪽으로, 역행 운동은 반대 방향입니다. 스케일 바 = 10 μm. 약어:HCT-555 = 파상풍 독소-결합 도메인; CFP = 시안 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 마우스 좌골 신경의 무손상 축삭에서 신호전달 엔도솜 및 미토콘드리아의 생체내 축삭 수송을 평가하는 단계를 상세히 설명한다. 실제로, 사용자가 1) 운동 뉴런에서 선택적으로 발현되는 형광 리포터 단백질을 발현하는 마우스를 사용하여 생체내, 계내 및 생체외 감각 뉴런과 운동을 구별할 수 있도록 하는 실험 설정이 제공된다; 2) 세 개의 상이한 트랜스제닉 마우스를 사용하여 운동 뉴런 축색돌기에서 특이적으로 신호전달 엔도솜의 생체내 축삭 수송을 평가하는 단계; 3) 운동 뉴런 축색돌기에서 구체적으로 미토콘드리아의 생체내 축삭 수송을 조사하는 단계; 4) 동일한 축삭 내의 신호전달 엔도솜과 미토콘드리아의 생체내 수송 역학을 동시에 평가한다. 이 접근법은 기저 조건에서 축삭 수송을 조사 할 수있는 광대 한 잠재력을 가지고 있으며 말초 운동 및 감각 신경에 영향을 미치는 다양한 질병의 병리학 적 혼란을 평가하는 데 사용할 수 있습니다.
이전의 실험 패러다임을 기초31,32로 사용하여 트랜스제닉 리포터 마우스를 사용하여 운동 대 감각 뉴런에서 발생하는 축삭 수송을 구별하는 새롭고 강력한 방법을 자세히 설명했습니다. Mito.CFP 마우스를 사용하여, 이 접근법은 TMRE36의 좌골 내 신경 주사를 피함으로써 생체내 미토콘드리아 수송을 평가하기 위해 추가로 개발되었다. 이것은 프로브의 신경 내 주입으로 인한 축삭 수송의 가능한 신경 손상 및 교란을 우회합니다. 또한, 이 프로토콜은 뚜렷한 생리적 특성(예를 들어, 빠른 트위치 가늘어진 근육 대 느린 트위치 피로 저항성 근육)을 갖는 근육을 신경질하는 운동 축삭에서 다수의 소기관의 축삭 수송의 시각화를 허용한다. 이와 같이, 신호전달 엔도솜 및/또는 미토콘드리아 축삭 수송 역학은 α운동 뉴런(44)의 상이한 서브세트에서 평가될 수 있다. 더욱이, 병리학적 환경에서 이들 소기관의 축삭 수송은 또한 상이한 신경 퇴행성 질환 1,2,3의 마우스 모델과의 교배를 통해 평가될 수 있다.
축삭 수송 툴킷은 지속적으로 확장되고(28,29), 배양된 마우스 복부 뿔 외식편(49) 또는 적출된 마우스 신경-근육 제제(50)를 사용하여 수송 역학을 평가하기 위해 생체외 프로토콜이 개발되었다. 더욱이, 유도된 인간 다능성 줄기 세포(hiPSC) 유래 피질51 뉴런 또는 hiPSC 유래 척수 운동 뉴런(52)에서의 축삭 수송을 평가하기 위한 프로토콜의 개발은 질병 유발 돌연변이를 갖는 인간 뉴런의 조사를 가능하게 하였다. 마우스 조직 및 인간 세포에서의 이러한 최첨단 프로토콜은 신경 기능에 대한 중요한 통찰력을 제공하고, 신경 퇴행성 질환 모델에서 새로운 병리학적 발견을 촉진하며, 치료 분자 및 전략을 테스트하는데 사용될 수 있다.
이러한 기술을 성공적으로 구현하려면 몇 가지 중요한 단계를 수행해야 하며, 프로토콜 섹션에 몇 가지 중요한 참고 사항이 제공되었습니다. 생체 내 이미징의 주요 요구 사항은 맞춤형 스테이지 인서트가있는 반전 공초점 현미경과 마취 및 최적의 온도를 유지하는 장비입니다. 실제로, 1) 마취의 유도, 2) 해부 / 조직 처리 (즉, 좌골 신경의 노출), 3) 생체 내 영상 (이전에 31,32에서 설명 된대로) 동안 마취를 유지하기 위해 전문화 된 이동 마취 시스템이 필요합니다. 특히 더 높은 배율 목표 (예 : 40x 또는 63x)를 사용하는 경우 깊은 마취가 큰 '헐떡 거리는'호흡을 유도하여 초점이 자주 이동하기 때문에 마취의 깊이가 이미지 품질에 영향을 줄 수 있습니다. 이러한 큰 움직임은 의심 할 여지없이 이미징 후 전송 분석 (예 : 피지 플러그인 TrackMate53 또는 KymoAnalyzer54를 사용하여화물 추적)에 영향을 미치는데, 호흡 운동이 시간 경과 비디오에서 아티팩트를 생성하여 자동 추적에 부적합하거나 더 많은 시간이 소요되는 평가가 필요할 수 있습니다. 또한, 우리는 좌골 신경 내의 맥동 동맥으로 인한 이미징 아티팩트를 관찰했으며, 이는 다른 이미징 영역을 선택해야만 해결할 수 있습니다. 현미경에는 온도와 pH가 축삭 수송(55)에 영향을 미치기 때문에 일정한 체온을 유지할 수 있는 환경 챔버가 장착되어야 한다. 또한, 수술 후 진통제의 적용은 수송 역학(56)을 변경할 수 있기 때문에 피해야 한다. 실험 설계가 종방향 설계이고 반복적인 이미징(예: 57)이 필요한 경우, 해부 프로토콜은 최소 침습적이도록 적절하게 조정되어야 하며 추가적인 윤리적/면허 승인이 필요할 수 있습니다.
특정 실험 고려 사항을 염두에 두어야합니다. 첫째, 본원에 상술된 프로토콜의 대부분은 미토콘드리아 또는 운동 뉴런 축색돌기에서 형광 리포터 단백질을 소유하는 트랜스제닉 마우스의 사용을 포함한다. 이러한 각 마우스 라인은 반쪽/이형접합체로 사육되고 이미지화되어야 합니다. 그러나 예외는 ChAT.Cre 및 Rosa26.tdTomato 마우스 라인이 동형접합체로서 개별적으로 유지될 수 있으며, 생성된 반접합체 자손은 Cre-loxP 재조합 후 콜린성 뉴런에서 tdTomato 발현을 가능하게 한다. 트랜스제닉 헤미-/이형접합체 마우스(예를 들어, Mito.CFP)를 다른 트랜스제닉 헤미-/이형접합체 마우스(예를 들어, ChAT.eGFP)와 교차 사육할 때, 원하는 수의 이중 돌연변이 자손을 얻는 것이 시간이 많이 소요될 수 있기 때문에, 육종 전략을 신중하게 고려할 필요가 있다. 더욱이, 추가적인 트랜스제닉 균주(예를 들어, Mito.CFP)와 함께 ChAT.Cre 및 Rosa26.tdTomato 마우스(즉, ChAT.tdTomato)의 F1 세대를 번식시킬 때, 원하는 삼중 전이유전자를 운반하는 마우스가 훨씬 더 적을 것으로 예상해야 한다. 또한, 근처 파장 특성(예를 들어, Mito-CFP-여기: 435 nm, 방출: 485 nm, ChAT.eGFP로 사육된 여기: 488 nm, 방출: 510 nm)을 갖는 두 리포터 마우스를 사육할 때 잠재적인 형광단 중첩을 고려해야 하지만, 스펙트럼 혼합 해제58로 이러한 문제를 극복할 수 있을 수 있다.
이 기술에는 고려해야 할 몇 가지 제한 사항이 있습니다. 이 작업과 우리의 이전 프로토콜31,32에서, 우리는 생체 내에서 별개의 소기관을 표지하고 추적하기 위해 여러 유전적으로 인코딩 된 마커와 다른 염색 방법을 어떻게 사용할 수 있는지를 보여주었습니다. 그러나, 모든 프로브가 이러한 실험적 접근법에 적합한 것은 아니다. 우리는 콜레라 독소 베타 서브 유닛 (CTB)-488 (이미징 전에 0.5-1.5 μg / μL ~ 4 h)의 TA 또는 단독 근육으로의 주사를 평가했으며, 생체 내 역행 추적기 실험59,60에서 운동 뉴런 세포체를 표지하는 데 일상적으로 사용되는 프로브입니다. 그러나, 단독으로 주사하거나HC-555와 공동 주입했을 때, CTB-488 표지는 성공적인 역행 운동 뉴런 추적에 사용된 것과 유사한 농도를 사용함에도 불구하고 불량하였다. 따라서, 우리는 CTB가 뉴런 배양물(61)에서 엔도솜 신호전달의 우수한 시험관내 마커임에도 불구하고, HCT는 좌골 신경 축삭돌기에서 생체내 엔도솜 신호전달을 확인하기 위한 황금 표준 프로브로 남아 있다는 결론을 내린다.
우리는 또한 다른 경로를 사용하여 LysoTracker 녹색 DND-26과 같은 리소좀 표지에 일상적으로 사용되는 프로브와 카텝신 D62 의 경우 BODIPY-FL-pepstatin A, Cathepsin B의 경우 Magic Red와 같은 활성 리소좀 가수분해 효소의 마커를 테스트했지만 성공하지 못했습니다. 우리는 BODIPY-FL-펩스타틴 A (영상 촬영 전 TA ~ 4 시간 내로 2.5 μg)의 근육 내 전달뿐만 아니라 영상 촬영 30-60 분 전에 2 μL의 LysoTracker (10 μM), bodipy-fl-펩스타틴 A (10 μM) 또는 매직 레드 (1/10)의 좌골 내 주사를 시도했다. 신경을 강조하는 이러한 프로브에도 불구하고, 우리는 명확하게 라벨이 붙은 소기관을 찾을 수 없었습니다. 프로브는 축삭 주위에 축적되어 Schwann 세포에 의해 유지 될 가능성이 큽니다. 따라서, 리소좀의 실패한 표지는 뉴런으로의 프로브 전달 부족으로 인한 것일 수 있지만, 더 적합한 농도의 존재는 배제 될 수 없다. TMRE 표지가 유사한 조건 (즉, 좌골 내 신경 주사) 하에서 작동한다는 것을 감안할 때, 표지 강도는 염료 의존적 일 수 있으며 각 마커에 대해 독립적으로 테스트되어야합니다. 그러나, 우리는 이러한 프로브로 생체 내에서 리소좀을 표적화하는 것이 위에서 언급 한 농도에서 실현 가능하지 않다는 결론을 내립니다.
마취의 방법은 뚜렷한 생리학적 판독값을 변경할 수 있다(예를 들어, 달팽이관 기능(63) 및 피질 전기생리학(64); 그러나, 마취가 좌골 신경에서 생체 내 축삭 수송에 영향을 미치는지 여부는 현재 알려져 있지 않다. 이소플루란-유도된 마취 하에서의 감소된 신경근 활성을 감안할 때, 수송 동역학은 깨어있는 상태에 비해 다를 수 있다. 그러나, 이것을 직접 조사한 유일한 생체내 연구는 시상 피질 돌출부에서 조밀한 코어 소포의 수송이 마취된 마우스(65)와 깨어 있는 마우스(65) 사이에서 다르지 않다는 것을 밝혀냈다. 더욱이, 야생형 마우스와 질병 모델 마우스 사이의 수송에서의 구별은 마취35,43 하에서 검출될 수 있기 때문에, 이소플루란 노출이 엔도솜 신호전달 또는 미토콘드리아 밀매에서의 교란의 식별을 방해하지 않는다는 것이 명백하다.
이 프로토콜에는 아래에 설명 된 다른 잠재적 인 응용 프로그램이 있습니다. 이 프로토콜에 요약된 트랜스제닉 마우스(예를 들어, Mito.CFP, ChAT.eGFP)를 신경퇴행성 질환 마우스 모델 1,2,3으로 육종하는 것은 뉴런 아류형 및/또는 화물-특이적 조사를 가능하게 할 것이다. 더욱이, 최근에 개발된 마우스 Cre 라인(66)은 또한 뚜렷한 감각 축삭 집단에서 형광 리포터 단백질의 시각화를 허용할 것이다. 예를 들어, Rosa26.tdTomato 마우스는 뉴로펩티드 Y 수용체-2-발현 (Npy2r)과 교차될 수 있다. Cre 마우스는 수초화된 A-섬유 nociceptors67에서 tdTomato 형광을 가능하게 한다. 더욱이, 시간적 조절은 또한 유도성 Cre 시스템(예를 들어, 타목시펜)68을 사용하여 달성될 수 있다. 또 다른 잠재적 응용은 슈완 세포에서 형광 리포터 단백질을 발현하는 트랜스제닉 마우스의 가용성에 의존한다. 실제로, S100-GFP69 및 PLP-GFP70 마우스는 슈완 세포의 생체내 및/또는 현장 이미징을 가능하게 하며, 말초 신경 재생 동안 슈완 세포 이동에 관여하는 연구의 최전선에 서 있다.
이러한 응용에 더하여 Mito.CFP 마우스를 보완하는 것은 미토콘드리아 및 오토포고좀과 같은 별개의 소기관에서 형광 단백질을 발현하는 몇몇 트랜스제닉 마우스 라인의 이용가능성이다. 예를 들어, 생체내 미토콘드리아 수송을 조사하는 것은 mito::mKate2 마우스(71 ) 또는 광변환가능한 미토덴드라 마우스(57)로 가능할 수 있다. 더욱이, 생체내 미토파고좀 수송은 미토파지 분석을 위해 pH 민감성 미토케이마 마우스(72 ) 및 미토-QC 마우스(73 )를 사용하여 가능할 수 있다. 더욱이, 우리가 직면 한 리소좀 표지 어려움은 LAMP1-GFP를 발현하는 마우스를 사용하여 극복 될 수 있으며, LAMP1이 리소좀74와 구별되는 내분비 소기관에도 존재한다는 경고와 함께.
요약하면, 우리는 다양한 트랜스제닉 마우스로부터의 특정 말초 신경 축삭에서 몇몇 소기관의 생체내 축삭 수송을 평가하는 새로운 방법을 제공하였다. 다른 소기관의 동시 이미징은 미토콘드리아와 엔도솜75,76과 같은 소기관의 축삭 상호 작용 및 공동 밀매에 대한 최근의 발견을 감안할 때 특히 중요 할 것입니다. 우리는 제시된 방법이 생체 내에서 축삭의 기저 생리학에 대한 이해를 향상시키고 말초 신경의 신경 퇴행을 유발하는 중요한 병리 메커니즘을 푸는 데 유용 할 것이라고 믿습니다.
공개
저자는 이해 상충이 없습니다.
감사의 말
ChAT-eGFP, ChAT.Cre 및 Rosa26.tdTomato 마우스를 공유해 주신 Robert M. Brownstone(Queen Square Institute of Neurology, University College London)과 HB9를 공유해 주신 Pietro Fratta(Queen Square Institute of Neurology, University College London)에게 감사드립니다. GFP 마우스. 원고를 비판적으로 읽어 주신 Elena R. Rhymes, Charlotte J.P. Kremers, Qiuhan Lang (Queen Square Institute of Neurology, University College London)에게 감사드립니다. 이 연구는 Motor Neuron Disease Association (UK) (Tosolini / Oct20 / 973-799) (APT), Wellcome Trust Senior Investigator Awards (107116 / Z / 15 / Z 및 223022 / Z / 21 / Z) (GS), 영국 치매 연구소 재단 상 (GS)의 주니어 비 임상 펠로우십에 의해 지원되었습니다. 의학 연구위원회 경력 개발 상 (MR / S006990 / 1) (JNS).
자료
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tube | |||
| 70% (v/v) ethanol in distilled water | |||
| AlexaFlour555 C2 maleimide | ThermoFisher Scientific | A-20346 | Can also use AlexaFlour-488 or -647 Maleimide |
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J | Jackson Laboratory | 7909 | Rosa26.tdTomato mice |
| B6.Cg-Tg(Hlxb9-GFP)1Tmj/J mice | Jackson Laboratory | 5029 | HB9.GFP mice |
| B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J mice | Jackson Laboratory | 7967 | Mito.CFP mice |
| B6;129S6-Chattm2(cre)Lowl/J mice | Jackson Laboratory | 6410 | ChAT.Cre mice |
| Computer with microscope control and image acquisition software | Zeiss | Zen | |
| Cotton swab | |||
| Desktop centrifuge | |||
| Dissecting microscope | |||
| Eye lubricant | |||
| Fine curved forceps | Dumont | ||
| Fine straight forceps | Dumont | ||
| Glass coverslip (22 x 64 mm, thickness no. 1) | |||
| Graduated, glass micropipette with microliter markings and plunger | Drummond Scientific | 5-000-1001-X10 | |
| Hair clippers | |||
| Hamilton microliter syringe (701 N, volume 10 μL, needle size 26 s G, bevel tip, needle L 51 mm) | Merck | 20779 | |
| HcT-441 | N/A | N/A | See Restani et al., 2012 for more details |
| Heating pad | |||
| Immersion oil for fluorescent imaging at 37 °C | |||
| Inverted confocal microscope with environmental chamber | Zeiss | LSM 780 | Most inverted confocals should be adaptable |
| Isoflurane | |||
| Isoflurane vaporizer/anesthesia machine with induction cham-ber and mask stabilizer | |||
| Magic tape | invisible tape | ||
| Micropipette puller | |||
| Parafilm | Parafilm | ||
| Phosphate-buffered saline (PBS): 137 mM NaCl, 10 mM Na2HPO4, 2.7 mM KCl, 1.8 mM KH2PO4–HCl, pH 7.4 | |||
| Recombinant human brain-derived neurotrophic factor (BDNF) | Peprotech | 450-02 | BDNF that can be co-injected with HcT-555 |
| Saline | |||
| Scalpel blade | Dumont | ||
| Small spring scissors | Dumont | ||
| Surgery/operating microscope | |||
| Surgical drape | |||
| Surgical suture | |||
| Surgical tape | |||
| Tg(Chat-EGFP) GH293Gsat/Mmucd mice | MMRRC | 000296-UCD | ChAT.eGFP |
| Vortex mixer |
참고문헌
- Webster, R. G. Animal models of the neuromuscular junction, vitally informative for understanding function and the molecular mechanisms of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (5), 1326 (2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models & Mechanisms. 4 (4), 457-467 (2011).
- De Giorgio, F., Maduro, C., Fisher, E. M. C., Acevedo-Arozena, A. Transgenic and physiological mouse models give insights into different aspects of amyotrophic lateral sclerosis. Disease Models & Mechanisms. 12 (1), 037424 (2019).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. The Journal of Cell Biology. 187 (6), 761-772 (2009).
- Brown, R. H., Al-Chalabi, A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 377 (2), 162-172 (2017).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425 (6961), 917-925 (2003).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiological Genomics. 27 (3), 391-397 (2006).
- Zeilhofer, H. U., et al. Glycinergic neurons expressing enhanced green fluorescent protein in bacterial artificial chromosome transgenic mice. The Journal of Comparative Neurology. 482 (2), 123-141 (2005).
- Kaiser, T., Ting, J. T., Monteiro, P., Feng, G. Transgenic labeling of parvalbumin-expressing neurons with tdTomato. Neuroscience. 321, 236-245 (2016).
- Zheng, B., Sage, M., Sheppeard, E. A., Jurecic, V., Bradley, A. Engineering mouse chromosomes with Cre-loxP: range, efficiency, and somatic applications. Molecular and Cellular Biology. 20 (2), 648-655 (2000).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Bareyre, F. M., Kerschensteiner, M., Misgeld, T., Sanes, J. R. Transgenic labeling of the corticospinal tract for monitoring axonal responses to spinal cord injury. Nature Medicine. 11 (12), 1355-1360 (2005).
- Willems, J., et al. A CRISPR/Cas9-based genome editing toolbox for epitope tagging of endogenous proteins in neurons. PLoS Biology. 18 (4), 3000665 (2020).
- Huh, Y., Oh, M. S., Leblanc, P., Kim, K. -. S. Gene transfer in the nervous system and implications for transsynaptic neuronal tracing. Expert Opinion on Biological Therapy. 10 (5), 763-772 (2010).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: an approach to maximize uptake and transduction of spinal cord motor neurons. Scientific Reports. 6, 33058 (2016).
- Andrews, M. R. Gene therapy in the CNS-one size does not fit all. Gene Therapy. 28 (7-8), 393-395 (2021).
- Kügler, S. Tissue-specific promoters in the CNS. Methods in Molecular Biology. 1382, 81-91 (2016).
- Misgeld, T., Kerschensteiner, M., Bareyre, F. M., Burgess, R. W., Lichtman, J. W. Imaging axonal transport of mitochondria in vivo. Nature Methods. 4 (7), 559-561 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Molecular Biology of the Cell. 15 (3), 1101-1111 (2004).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), 108697 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Maday, S., Twelvetrees, A. E., Moughamian, A. J., Holzbaur, E. L. F. Axonal transport: cargo-specific mechanisms of motility and regulation. Neuron. 84 (2), 292-309 (2014).
- Terenzio, M., Schiavo, G., Fainzilber, M. Compartmentalized signaling in neurons: from cell biology to neuroscience. Neuron. 96 (3), 667-679 (2017).
- Abouward, R., Schiavo, G. Walking the line: mechanisms underlying directional mRNA transport and localisation in neurons and beyond. Cellular and Molecular Life Sciences. 78 (6), 2665-2681 (2021).
- Sleigh, J. N., Rossor, A. M., Fellows, A. D., Tosolini, A. P., Schiavo, G. Axonal transport and neurological disease. Nature Reviews. Neurology. 15 (12), 691-703 (2019).
- Bronfman, F. C., Moya-Alvarado, G. BDNF/TrkB signaling endosomes mediate long-distance dendritic growth by activating CREB/PI3K-mTOR-dependent translation in neuronal cell bodies. BioRxiv. , (2020).
- Nagano, S., Araki, T. Axonal Transport and Local Translation of mRNA in Neurodegenerative Diseases. Frontiers in Molecular Neuroscience. 14, 697973 (2021).
- Boecker, C. A., Olenick, M. A., Gallagher, E. R., Ward, M. E., Holzbaur, E. L. F. ToolBox: Live Imaging of intracellular organelle transport in induced pluripotent stem cell-derived neurons. Traffic. 21 (1), 138-155 (2020).
- Surana, S., et al. The evolution of the axonal transport toolkit. Traffic. 21 (1), 13-33 (2020).
- Sleigh, J. N., Vagnoni, A., Twelvetrees, A. E., Schiavo, G. Methodological advances in imaging intravital axonal transport. F1000Research. 6, 200 (2017).
- Gibbs, K. L., Kalmar, B., Sleigh, J. N., Greensmith, L., Schiavo, G. In vivo imaging of axonal transport in murine motor and sensory neurons. Journal of Neuroscience Methods. 257, 26-33 (2016).
- Sleigh, J. N., Tosolini, A. P., Schiavo, G. In vivo imaging of anterograde and retrograde axonal transport in rodent peripheral nerves. Methods in Molecular Biology. 2143, 271-292 (2020).
- Gibbs, K. L., et al. Inhibiting p38 MAPK alpha rescues axonal retrograde transport defects in a mouse model of ALS. Cell Death & Disease. 9 (6), 596 (2018).
- Fellows, A. D., Rhymes, E. R., Gibbs, K. L., Greensmith, L., Schiavo, G. IGF1R regulates retrograde axonal transport of signalling endosomes in motor neurons. EMBO Reports. 21 (3), 49129 (2020).
- Bilsland, L. G., Sahai, E., Kelly, G., Golding, M., Greensmith, L., Schiavo, G. Deficits in axonal transport precede ALS symptoms in vivo. Proceedings of the National Academy of Sciences of the United States of America. 107 (47), 20523-20528 (2010).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. The Journal of Cell Biology. 218 (6), 1871-1890 (2019).
- Bercsenyi, K., et al. Tetanus toxin entry. Nidogens are therapeutic targets for the prevention of tetanus. Science. 346 (6213), 1118-1123 (2014).
- Deinhardt, K., et al. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293-305 (2006).
- Debaisieux, S., Encheva, V., Chakravarty, P., Snijders, A. P., Schiavo, G. Analysis of signaling endosome composition and dynamics using SILAC in embryonic stem cell-derived neurons. Molecular & Cellular Proteomics. 15 (2), 542-557 (2016).
- Surana, S., et al. The travel diaries of tetanus and botulinum neurotoxins. Toxicon. 147, 58-67 (2018).
- Villarroel-Campos, D., Schiavo, G., Lazo, O. M. The many disguises of the signalling endosome. FEBS Letters. 592 (21), 3615-3632 (2018).
- Malik, B., et al. Absence of disturbed axonal transport in spinal and bulbar muscular atrophy. Human Molecular Genetics. 20 (9), 1776-1786 (2011).
- Sleigh, J. N., et al. Mice carrying ALS mutant TDP-43, but not mutant FUS, display in vivo defects in axonal transport of signaling endosomes. Cell Reports. 30 (11), 3655-3662 (2020).
- Tosolini, A. P., Sleigh, J. N., Surana, S., Rhymes, E. R., Cahalan, S. D., Schiavo, G. modulation of axonal transport is selectively impaired in ALS. BioRxiv. , (2021).
- Restani, L., et al. Botulinum neurotoxins A and E undergo retrograde axonal transport in primary motor neurons. PLoS Pathogens. 8 (12), 1003087 (2012).
- Mohan, R., Tosolini, A. P., Morris, R. Intramuscular injections along the motor end plates: a minimally invasive approach to shuttle tracers directly into motor neurons. Journal of Visualized Experiments: JoVE. (101), e52846 (2015).
- Tosolini, A. P., Mohan, R., Morris, R. Targeting the full length of the motor end plate regions in the mouse forelimb increases the uptake of fluoro-gold into corresponding spinal cord motor neurons. Frontiers in Neurology. 4, 58 (2013).
- Mohan, R., Tosolini, A. P., Morris, R. Targeting the motor end plates in the mouse hindlimb gives access to a greater number of spinal cord motor neurons: an approach to maximize retrograde transport. Neuroscience. 274, 318-330 (2014).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments: JoVE. (159), e60993 (2020).
- Boyer, N. P., Azcorra, M., Jung, P., Brown, A. Imaging and analysis of neurofilament transport in excised mouse tibial nerve. Journal of Visualized Experiments: JoVE. (162), e61264 (2020).
- Mou, Y., Mukte, S., Chai, E., Dein, J., Li, X. -. J. Analyzing mitochondrial transport and morphology in human induced pluripotent stem cell-derived neurons in hereditary spastic paraplegia. Journal of Visualized Experiments: JoVE. (156), e60548 (2020).
- Stoklund Dittlau, K., et al. Generation of human motor units with functional neuromuscular junctions in microfluidic devices. Journal of Visualized Experiments: JoVE. (175), e62959 (2021).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Bohnert, S., Schiavo, G. Tetanus toxin is transported in a novel neuronal compartment characterized by a specialized pH regulation. The Journal of Biological Chemistry. 280 (51), 42336-42344 (2005).
- Kanai, A., et al. Low-concentration lidocaine rapidly inhibits axonal transport in cultured mouse dorsal root ganglion neurons. Anesthesiology. 95 (3), 675-680 (2001).
- Bolea, I., Gan, W. -. B., Manfedi, G., Magrané, J. Imaging of mitochondrial dynamics in motor and sensory axons of living mice. Methods in Enzymology. , 97-110 (2014).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Multispectral live-cell imaging. Current Protocols in Cell Biology. 79 (1), 46 (2018).
- Blum, J. A., et al. Single-cell transcriptomic analysis of the adult mouse spinal cord reveals molecular diversity of autonomic and skeletal motor neurons. Nature Neuroscience. 24 (4), 572-583 (2021).
- Xu, J., et al. An approach to maximize retrograde transport based on the spatial distribution of motor endplates in mouse hindlimb muscles. Frontiers in Cellular Neuroscience. 15, 707982 (2021).
- Wang, T., et al. Flux of signalling endosomes undergoing axonal retrograde transport is encoded by presynaptic activity and TrkB. Nature Communications. 7, 12976 (2016).
- Chen, C. S., Chen, W. N., Zhou, M., Arttamangkul, S., Haugland, R. P. Probing the cathepsin D using a BODIPY FL-pepstatin A: applications in fluorescence polarization and microscopy. Journal of Biochemical and Biophysical Methods. 42 (3), 137-151 (2000).
- Cederholm, J. M. E., et al. Differential actions of isoflurane and ketamine-based anaesthetics on cochlear function in the mouse. Hearing Research. 292 (1-2), 71-79 (2012).
- Michelson, N. J., Kozai, T. D. Y. Isoflurane and ketamine differentially influence spontaneous and evoked laminar electrophysiology in mouse V1. Journal of Neurophysiology. 120 (5), 2232-2245 (2018).
- Knabbe, J., Nassal, J. P., Verhage, M., Kuner, T. Secretory vesicle trafficking in awake and anaesthetized mice: differential speeds in axons versus synapses. The Journal of Physiology. 596 (16), 3759-3773 (2018).
- Gong, S., et al. Targeting Cre recombinase to specific neuron populations with bacterial artificial chromosome constructs. The Journal of Neuroscience. 27 (37), 9817-9823 (2007).
- Arcourt, A., et al. Touch receptor-derived sensory information alleviates acute pain signaling and fine-tunes nociceptive reflex coordination. Neuron. 93 (1), 179-193 (2017).
- Valny, M., Honsa, P., Kirdajova, D., Kamenik, Z., Anderova, M. Tamoxifen in the mouse brain: implications for fate-mapping studies using the tamoxifen-inducible Cre-loxP system. Frontiers in Cellular Neuroscience. 10, 243 (2016).
- Hayashi, A., et al. A double-transgenic mouse used to track migrating Schwann cells and regenerating axons following engraftment of injured nerves. Experimental Neurology. 207 (1), 128-138 (2007).
- Chen, B., Chen, Q., Parkinson, D. B., Dun, X. -. P. Analysis of schwann cell migration and axon regeneration following nerve injury in the sciatic nerve bridge. Frontiers in Molecular Neuroscience. 12, 308 (2019).
- Barrasso, A. P., Tong, X., Poché, R. A. The mito::mKate2 mouse: A far-red fluorescent reporter mouse line for tracking mitochondrial dynamics in vivo. Genesis. 56 (2), (2018).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12 (8), 1576-1587 (2017).
- McWilliams, T. G., et al. mito-QC illuminates mitophagy and mitochondrial architecture in vivo. The Journal of Cell Biology. 214 (3), 333-345 (2016).
- Cheng, X. -. T., et al. Characterization of LAMP1-labeled nondegradative lysosomal and endocytic compartments in neurons. The Journal of Cell Biology. 217 (9), 3127-3139 (2018).
- Cioni, J. -. M., Lin, J. Q., et al. Late Endosomes Act as mRNA Translation Platforms and Sustain Mitochondria in Axons. Cell. 176 (12), 56 (2019).
- Liao, Y. -. C., Fernandopulle, M. S., et al. RNA Granules Hitchhike on Lysosomes for Long-Distance Transport, Using Annexin A11 as a Molecular Tether. Cell. 179 (1), (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유