Method Article
시아 노 박테리아 세포 밖 소포의 분리 및 특성 분석
* 이 저자들은 동등하게 기여했습니다
요약
본 프로토콜은 시아노박테리아 배양물로부터의 세포밖 소포의 분리, 농도 및 특성화에 대한 상세한 설명을 제공한다. 서로 다른 규모의 문화에서 소포를 정화하기위한 접근법, 방법론 간의 절충점 및 현장 샘플 작업을위한 고려 사항도 논의됩니다.
초록
시아노박테리아는 다양한 광합성, 그람 음성 박테리아 그룹으로, 지구 생태계에서 중요한 역할을 하고 필수적인 생명공학 모델로 작용합니다. 최근의 연구는 해양 및 담수 시아 노 박테리아가 미생물의 외부 표면에서 방출되는 작은 막 결합 구조 인 세포 밖 소포를 생산한다는 것을 입증했습니다. 소포는 다양한 생물학적 과정에 기여할 가능성이 있지만, 시아 노 박테리아 생물학에서 그들의 특정 기능적 역할은 크게 알려지지 않았습니다. 이 분야의 연구를 장려하고 발전시키기 위해 시아 노 박테리아 세포 밖 소포를 분리, 농축 및 정화하기위한 상세한 프로토콜이 제시됩니다. 현재의 연구는 Prochlorococcus, Synechococcus 및 Synechocystis의 대규모 문화에서 소포를 성공적으로 분리 한 방법론에 대해 논의 합니다. 이들 균주로부터의 소포 샘플을 정량화하고 특성화하는 방법이 제시된다. 수생장 샘플로부터 소포를 분리하기 위한 접근법이 또한 기술된다. 마지막으로, 시아 노 박테리아 소포 정화, 다양한 다운 스트림 응용 프로그램에 대한 방법 론적 고려 사항 및 접근법 간의 절충안과 함께 직면 한 전형적인 과제도 논의됩니다.
서문
세포밖 소포(EV)는 직경이 ~20-400 nm 사이인 구형 구조로, 거의 모든 유기체에 의해 주변 환경으로 방출된다 1,2,3. 소포는 지질 이중층에 의해 구분되며 스스로를 복제 할 수 없습니다. 그람 음성 박테리아에서, 이러한 구조는 주로 외막에서 작은 부분의 '블빙'에 의해 발생하는 것으로 생각됩니다. 그럼에도 불구하고 편모 운동, 세포 용해 및 내막 및 외막 물질의 분비를 포함한 다른 과정은 소포뿐만 아니라 4,5도 생성 할 수 있습니다. EVs는 지질, 가용성 및 막 단백질, 핵산 및 대사 산물을 포함한 다양한 생체 분자를 포함 할 수 있으며,이 물질을 세포 4,5,6 사이에서 운반 할 수 있습니다. 이러한 특징을 감안할 때, EV는 세포 통신, 생물막 형성, 수평 유전자 전달, 숙주 - 파지 역학 및 영양소 교환 4,6을 포함한 광범위한 생물학적 과정에서 가능한 역할을 이해하기 위해 연구되고 있습니다.
시아 노 박테리아는 단세포 및 필라멘트 생물을 포함한 그람 음성 박테리아의 크고 다양한 그룹입니다. 그들은 생리학과 다양성7,8,9,10에 봉사하는 중요한 생태계 기능 및 생명 공학 11,12에 대한 유용성을 이해하는 것을 포함하여 많은 관점에서 관심이 있습니다. 시아 노 박테리아는 해양, 담수 및 육상 환경의 자유 생물 또는 이끼류, 양치류, 식물 또는 지의류 및 해면체와의 공생 적 연관성13에서 다양한 서식지에서 발견됩니다. 그들은 수생 생태계에서 중요한 주요 생산자 역할을하며, 산소 광합성9,10을 통해 산소와 유기 탄소를 생산하며, 일부는 대기 질소를 고정 할 수 있습니다7. Prochlorococcus, Synechococcus 및 Synechocystis를 포함한 해양 및 담수 시아 노 박테리아는 실험실 조건 14,15,16에서 EV를 생산하고 시아 노 박테리아 소포는 자연 환경 14,17에서도 발견 될 수 있습니다. 시아 노 박테리아 소포의 생물학적 및 생태 학적 기능은 알려지지 않았지만이 분야의 추가 연구는 시아 노 박테리아 생리학, 분화, 의사 소통 전략, 진화 및 영양 상호 작용에 대한 질문에 대한 새로운 통찰력을 제공 할 가능성이 큽니다. 또한, 생체분자의 다양한 카테고리를 운반하는 시아노박테리아 EVs의 능력은 상업적 응용(18,19)을 가질 수 있다.
본 프로토콜은 시아노박테리아 배양물 및 현장 샘플로부터 소포를 분리하고 특성화하는 방법을 기술하여 시아노박테리아 세포밖 소포 생물학의 광범위한 검사를 가능하게 하고 장려한다. 여기에 설명된 워크플로우는 다른 박테리아로부터 EV를 분리하고 특성화하기 위한 프로토콜과 유사하지만, 시아노박테리아 배양물 및 현장 샘플은 전형적으로 숙주-관련 또는 병원성 모델 시스템(20,21,22)에서 일반적으로 관찰되는 것보다 더 낮은 세포 및 소포 농도를 함유한다. 따라서 시아 노 박테리아 EV에 대한 연구는 균주와 매체 배경에 따라 더 다양한 재배 및 소포 분리를위한 특별한 고려 사항과 최적화가 필요합니다. 단일 프로토콜이 모든 균주, 성장 조건 및 다운스트림 응용 분야에서 동등하게 잘 작동하지 않으므로 여러 옵션을 제공하고 관련된 절충안을 논의하여 연구자가 실험 질문을 해결하는 데 가장 적합한 접근 방식을 결정할 수 있도록합니다.
프로토콜
시아노박테리아 균주는 여러 배양 컬렉션으로부터 얻어진다(자세한 내용은 토론 참조).
1. 시아노박테리아 재배
- 아래 단계에 따라 해양 시아 노 박테리아 Prochlorococcus와 Synechococcus를 배양하십시오.
- Pro99 또는 SN과 같은 적절한 배지를 사용하여 폴리카보네이트 플라스크에서 Prochlorococcus 및 Synechococcus 균주를 배양하십시오 (표 참조). 자세한 내용은 이전에 출판된 참고 문헌23,24를 참조하십시오.
- 실험에 필요한 원하는 온도 및 조도 조건 하에서 2 ~ 세 번의 전송 (각 계대마다 신선한 배지로 배양물을 1:20 희석)으로 성장시켜 문화를 적응시킵니다.
참고: 일반적인 성장 조건23,25에는 8-150 μmol 광자 m-2 s-1 사이의 조도에서 15-30°C 사이의 온도가 포함되지만, 개별 변형 허용 오차 및 최적은26으로 매우 다양하며 관련 배양 수집 지침 또는 문헌의 지침에 따라 설정해야 합니다. 배양 형광 또는 유세포 분석기 카운트23을 사용하여 성장 속도를 모니터링하고, 실험을 시작하기 전에 배양물이 일관된 정상 상태 지수 속도로 성장하도록 보장한다. - 세포가 후기 지수 단계에 도달하면 더 작은 부피에서 더 큰 부피로 연속적인 점진적 전달 세트를 수행하십시오 (예 : 20 mL < 250 mL < 20 L < 10 L < 20 L).
참고: 대량 배양은 소량의 시작 배양물에서 직접 접종할 수 없습니다. 더 큰 배양물에서는 보충적인 중탄산나트륨과 함께 완충액(예: 1 mM HEPES, pH 7.5 또는 3.75 mM TAPS, pH 8)을 첨가하거나 멸균 공기(24)로 버블링해야 할 수 있습니다.
- 담수 시아 노 박테리움 Synechocystis sp. PCC 6803을 재배하십시오.
- BG11 배지27에서 1.0(지수 상)의 730 nm(OD7300)까지 최대 16시간 광(50 μmol m-2s-1의 광자 수)/8시간 어둠 정권 하에서 폭기(1 L/min에서 버블링 공기)로 배양함으로써 접종물로서 사용되는 Synechocystis sp. PCC 6803의 배양물을 준비한다.
- 이 배양액 30 mL를 BG11 배지 570 mL에 시 네코시스티스 sp. PCC 6803 30 mL를 1 L 유리 가스 세척 병에 0.05의 OD730에 접종한다.
- 세포를 폭기와 함께, 30°C에서, 16 h 광(50 μmol m-2s-1의 광자 수)/8 h 어두운 정권 하에서, 1.0-1.5의 최종 OD730까지 성장시킨다.
2. 작은 입자 (소포) 분획으로부터 시아 노 박테리아 바이오 매스의 분리
참고 : 첫째, 세포의 원심 펠릿을 통해 상층액으로부터 세포를 분리하는 것이 좋습니다. 그러나, 배양 부피가 너무 커서 이것이 실현 가능할 때, 원심분리를 건너뛰고 캡슐 여과를 사용하여 전체 배양물을 직접 여과하는 것을 진행할 수 있다(단계 2.4).
- 세포를 분리하기 위해 원심분리를 수행하십시오 (사용 가능한 원심분리 용량에 따라 ~ 4 L까지의 부피에 가장 적합합니다).
- Autoclave 또는 Type I 초순수 등급 물 ( 재료 표 참조)을 사용하여 원심 분리기 병을 철저히 세척하고 청소하여 잔류 비누 또는 기타 물질이 남아 있지 않도록하십시오.
- 배양 샘플을 적절한 수의 원심분리 병에 로딩하고 균형을 맞춥니다.
- >10,000 x g을 4°C에서 10분 동안 스핀 배양하였다. 상청액이 눈에 띄게 탁한 상태로 남아 있으면 원심분리 조건을 최대 속도로 20 분으로 늘리고 다시 시도하십시오.
- 조심스럽게 데칸트 또는 피펫 상청액을 깨끗한 용기에 넣고 단계 2.2-2.4에서 언급 한 다음 여과 옵션 중 하나를 진행하십시오.
- 옵션 1: 0.2μm 필터를 사용하여 주사기 여과를 수행합니다(최대 50mL의 시료 부피의 경우).
- 멸균된 50 mL 주사기를 크게 무세포 배양 배지로 채우고, 0.2 (또는 0.45) μm 폴리에테르술폰 (PES) 필터를 통해 여과 한다 (물자의 표 참조). 여과액을 깨끗하고 멸균 된 콘센트에 모으십시오.
- 필터가 막힐 때까지 이 단계를 반복한다(예를 들어, 주사기로 밀기가 어려워진다). 새 필터로 교체하고 샘플이 완전히 필터링될 때까지 진행합니다.
- 옵션 2: 0.2μm 진공 여과(최대 ~4L)를 수행합니다.
- Type I - 초순수 등급의 물을 사용하여 진공 장치를 철저히 세척하고 청소하여 진공 트랩 및 펌프에 연결 하십시오 (재료 표 참조).
- 적절한 직경의 0.2 μm 필터를 삽입하고 진공 장치를 클램프한다.
- 소량의 배양 샘플을 첨가하여 진공 압력이 <10 psi로 유지되도록 하십시오.
- 완료될 때까지 문화권을 작은 단위로 계속 필터링합니다. 여과 속도가 크게 느려지면 진공을 멈추고 필터를 교체하십시오.
- 소포를 함유하는 <0.2 μm 분획을 깨끗한 용기에 수집한다.
- 옵션 3: 0.2μm 캡슐 여과 수행(시료 부피 >~4L의 경우)
- 물과 순한 세제로 세척하여 적절한 크기의 유연한 튜브 및 수집 용기를 청소하십시오. 증류수와 탈이온수로 물질을 헹구십시오.
참고 : 사용하기 전에 재료를 유형 I - 초순수 등급의 물로 헹구어야합니다. - 여과될 배양물을 아래의 최종 수집 용기와 함께 안전하고 상승된 위치에 놓는다. 0.2μm 캡슐 필터( 재료 표 참조) 유출 포트를 튜브 한 조각에 연결하고 수집 용기에 넣습니다.
- 샘플에 다른 튜빙을 놓고, 주사기로 튜브 안으로 일부 샘플을 당겨서 중력 사이펀을 시작하고, 튜브를 캡슐 필터에 연결한다. 통풍구를 사용하여 과도한 공기를 방출하고 챔버를 상청액으로 채 웁니다.
- 샘플이 완전히 여과 될 때까지 재료가 캡슐을 통해 이동하도록하십시오. 유속이 너무 느려지면 (시작 유량의 < ~ 1/10번째 또는 지속적으로 흐르는 흐름과 달리 드롭 방향으로 나오는) 배압이 증가 할 때까지 연동 펌프로 기다리거나 부드러운 힘을 가하십시오. 또는 필터를 일시적으로 분리하여 유속을 부분적으로 복원하고, 유입 측에서 축적 된 바이오 매스를 물질이 더 이상 눈에 띄게 탁하지 않을 때까지 매우 깨끗한 물로 역세척 한 다음 여과 공정을 다시 시작하십시오.
- 물과 순한 세제로 세척하여 적절한 크기의 유연한 튜브 및 수집 용기를 청소하십시오. 증류수와 탈이온수로 물질을 헹구십시오.
3. 소포 샘플 집중
- 옵션 1: 소량(<500mL) 부피의 시료를 농축하기 위해 원심 한외여과를 수행합니다.
- 선택한 15-20 mL 한외여과 원심 농축기를 Type I - 초순수 등급 물로 헹구십시오.
- 농축기를 원심분리기에 적재하고 4°C에서 4,400 x g 에서 회전시킨다. 실행을 취소하고 이 단계를 적어도 두 번 더 반복합니다.
- 상청액 샘플을 물 헹굼 농축기에 넣고 동일한 조건에서 회전시킵니다. 실험 목표에 따라, 샘플 여액은 추가 농도 (공칭 분자량 한계가 3kDa인 농축기 사용) 및 분석을 위해 폐기되거나 수집될 수 있다.
- 샘플이 ∼15-30 mL의 최종 부피로 농축될 때까지 이 단계를 반복한다.
- 옵션 2: 큰 (>500mL) 부피의 시료를 농축하기 위한 접선 유동 여과(TFF)를 수행합니다.
- 제조업체의 지침에 따라 TFF 장치를 설정합니다( 재료 표 참조). 연동 펌프를 흡입 라인에 부착하고 고정 라인에 조정 가능한 클램프를 놓습니다. 제조업체의 권고에 따라 TFF를 살균 한 다음 1L의 Type I (초순수 등급의 물)로 장치를 플러시하십시오.
참고 : 흡기 및 유지 라인은 깨끗한 샘플 저장소 (유리 병)에 배치해야합니다. 여액 라인은 폐기물 용기 또는 싱크대에 보내야합니다. - <0.2 μm 여액을 샘플 저장소에 첨가하십시오. 유지 라인의 펌프 속도와 배압 수준을 천천히 증가시켜 여과 라인의 출력을 증가시킵니다.
- TFF를 계속 실행하고, 물질이 제거됨에 따라 저장고를 배양 상청액으로 다시 채운다. 공기 방울이 유입되지 않도록 처리 중에 흡기 라인이 샘플에서 나오지 않도록하십시오. 공급 압력이 ~10psi를 초과하지 않고 유지수가 TFF에서 일정한 속도로 저수지로 다시 흘러 들어가는지 확인하십시오.
- 저장고의 부피가 기포를 도입하지 않고 흡기 라인으로의 흐름을 유지하는 데 필요한 가능한 가장 낮은 양에 도달하면 시료 농축을 중단하십시오.
- 클램프로 유출 라인을 닫습니다. 잔류 라인의 배압을 제거하고 농축 된 상등액을 필터를 통해 ~ 10 분 동안 재순환시켜 재순환 속도를 20-40 mL / min으로 줄여 회복을 극대화하십시오.
- 잔류 라인을 깨끗한 용기로 옮기고, 샘플에서 흡입 라인을 제거하고, 농축 된 재료를 수집하십시오. 피펫을 사용하여 샘플 저장소에 남아 있는 물질을 회수합니다.
- 농축된 상청액을 0.2 μm 시린지 필터(단계 2.2)를 통해 여과하여 세포가 남아 있지 않도록 한다.
참고: 3.2.7단계는 선택 사항입니다. - 필요한 경우, 정제된 소포로 이동하기 전에 최종 농축액을 ∼3주 동안 4°C에서 보관한다(단계 4).
- 제조업체의 지침에 따라 TFF 장치를 설정합니다( 재료 표 참조). 연동 펌프를 흡입 라인에 부착하고 고정 라인에 조정 가능한 클램프를 놓습니다. 제조업체의 권고에 따라 TFF를 살균 한 다음 1L의 Type I (초순수 등급의 물)로 장치를 플러시하십시오.
4. 소포 분리 및 정화
- 아래 단계에 따라 초원심분리에 의해 직접 펠릿을 생성한다.
- 농축된 <0.2 μm 배양 샘플을 깨끗한 초원심분리 튜브에 넣는다. 튜브가 완전히 채워지도록 필요에 따라 깨끗한 매체 또는 버퍼를 추가하십시오.
참고: 최종 배양 샘플이 너무 커서 하나의 튜브에 들어갈 수 없는 경우, 세척 단계 전에 결합될 여러 튜브에 재료를 펠릿화하거나 동일한 튜브에서 연속적으로 펠릿으로 펠릿하십시오. - 필요한 경우 저울을 만들고 ~ 100,000 x g 에서 4 °C에서 3 시간 동안 회전하십시오.
- 피펫으로 상층액을 조심스럽게 제거하십시오. 시아 노 박테리아 소포 펠릿은 약간의 착색을 나타낼 수 있지만, 종종 보이지 않습니다.
- 신선한 배양 배지 또는 1x 인산완충식염수(PBS)와 같은 세척 완충액( 토론 참조)을 초원심분리 튜브에 첨가하여 펠렛화된 물질을 세척하고, 단계 4.1.2에서와 같이 부드럽게 피펫팅하여 혼합하고, 다시 스핀한다. 세척 과정을 두 번 반복하십시오.
- 최종 펠렛을 1 mL 피펫으로 튜브의 바닥 주위를 위아래로 부드럽게 피펫팅하면서 반복함으로써 신선한 배양물에 재현탁시킨다. 깨끗한 선박으로 이동하십시오.
- 농축된 <0.2 μm 배양 샘플을 깨끗한 초원심분리 튜브에 넣는다. 튜브가 완전히 채워지도록 필요에 따라 깨끗한 매체 또는 버퍼를 추가하십시오.
- 밀도 구배 초원심분리를 수행합니다.
- 요오드딕사놀 스톡을 준비하십시오 ( 재료 표 참조) 샘플에 원하는 버퍼 배경의 4x 농축 버전을 만듭니다 ( 토론 참조).
- 4x 버퍼의 한 부분을 60% 요오드딕사놀 스톡의 세 부분과 혼합하여 45% 요오드딕사놀 용액을 만듭니다.
- 45% 요오드딕사놀을 1x 완충액의 부피로 희석하여 40%, 35%, 30%, 25%, 20%, 15%, 10% 최종 요오드딕사놀 농도에서 구배 매질의 스톡을 생성한다.
참고: 필요한 총량은 초원심분리기 로터/튜브의 용량에 따라 달라집니다. - 동량의 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10%, 및 0% 이옥시디놀을 조심스럽게 겹쳐서 초원심분리기 밀도 구배를 초원심분리기 튜브에 겹쳐서 튜브의 전체 부피가 활용되도록 합니다.
참고: 정제할 세포밖 소포 샘플은 0% 요오드딕사놀 층의 일부로서 구배의 상부에 배치되어야 한다. 소포 샘플의 최종 부피가 0% 층의 크기를 초과하는 경우, 과량의 베시클 샘플을 충분한 45% 요오딕사놀 및/또는 완충액과 혼합하여 10% 이상의 농도 optiprep 스톡의 필요한 부피를 생성하고, 구배의 해당 위치에서 이들을 사용하십시오. - 구배를 4°C에서 ∼100,000 x g 에서 6시간 동안 회전시킨다.
- 조심스럽게 피펫팅하거나 분획 수집기를 사용하여 분획 (일반적으로 ~ 4.5 mL 구배에 대해 각각 0.5 mL)을 수집 하십시오 (재료 표 참조).
- 분석 저울과 교정된 피펫을 사용하여 각 분획의 밀도(g/mL)를 결정하여 알려진 샘플 부피의 중량을 측정합니다. 튜브에서 샘플을 제거하고 무게를 결정한 다음 샘플을 직접 반환합니다.
- 깨끗한 완충액으로 새로운 초원심분리 튜브에 개별 분획을 희석하고 단계 4.1.2-4.1.4에서 언급된 바와 같이 물질을 세척한다. 또는 투석 또는 한외여과 컬럼을 사용하여 입자를 회수하십시오.
참고: 시아노박테리아 세포밖 소포는 일반적으로 요오드딕사놀에서 ~1.14-1.19 g/mL의 부력 밀도로 이동한다.
- 소포가 1-3주 이내에 사용되어야 하는 경우에 4°C에서 보관한다. 소포가 그 기간보다 오래 사용되지 않으면 -20 °C 또는 -80 °C에서 동결하십시오.
5. 고립 된 소포의 특성 분석
- 네거티브 얼룩 투과 전자 현미경 검사 ( 재료 표 참조)를 수행합니다 (TEM; 입자 크기, 구조, 순도).
- 이미지 품질을 향상시키려면 제조업체의 지침에 따라 글로우 방전 시스템을 사용하여 이전에 코팅된 TEM 그리드의 표면을 글로우 방전 합니다(재료 표 참조).
- 조심스럽게 ~ 5 μL의 소포 샘플을 바르고 5 분 동안 그대로 두십시오.
참고: 소포 농도가 >109 mL-1인 샘플은 일반적으로 최상의 결과를 제공합니다. 더 희석 된 샘플은 이미지 당 소포가 거의 없습니다. - 그리드의 가장자리를 깨끗한 여과지 조각에 터치하여 샘플을 제거합니다.
- 2% 우라닐 아세테이트 20-50 μL 방울( 재료 표 참조)을 플라스틱 필름으로 덮인 평평한 표면 상에 피펫팅하고, 그 위에 떠 있는 그리드를 2분 동안 놓는다.
- 여과지를 사용하여 우라닐 아세테이트를 제거하고 초순수 한 방울에 잠깐 떠서 씻으십시오. 물 씻기를 두 번 반복하십시오.
참고: 최종 드라이 그리드는 5.1.5 단계 이후에 시각화할 준비가 되었습니다.
- TEM (입자 크기, 내부 구조)에 대한 초박형 섹션 염색을 수행하십시오.
- 단계 4.1.5로부터의 펠렛을 0.1 M 소듐 카코딜레이트 완충액 (pH 7) (표 7) 중의 2.5% 글루타르알데히드 1 mL와 함께 재현탁시키고(표 표 참조) 샘플을 4°C에서 2시간 동안 고정시켰다.
- 4°C에서 1시간 동안 ~100,000 x g 에서 회전시킨다.
- 펠렛을 0.1 M 소듐 카코딜레이트 완충액 (pH 7)으로 조심스럽게 세척하고, 이어서 4°C에서 1 h 동안 ∼100,000 x g 에서 스핀시킨다.
- 펠렛을 1 mL의 1% 오스뮴 테트록사이드 ( 물질 표 참조) (0.1 M 소듐 카코딜레이트 완충액으로 제조됨)로 1 h 동안 고정하고, 이어서 단계 5.2.3에서와 같이 세척한다.
- 샘플을 1 mL의 상승 계열 에탄올 (50%, 70%, 90%, 및 무수 에탄올에서 두 번)으로 4°C에서 각각 10분의 단계로 탈수시킨다.
- 펠렛에 무수 에탄올(1:1)과 혼합된 에폭시 수지 250 μL( 표 표 참조)를 첨가하고, 4°C에서 밤새 인큐베이션한다.
- 펠렛을 24시간 동안 500 μL의 순수 수지로 옮긴다. 이어서, 수지를 65°C에서 48시간 동안 인큐베이션한다.
참고: 수지는 이제 제조업체의 지침에 따라 울트라마이크로톰으로 단면화할 준비가 되었습니다( 재료 표 참조). - 2 % 우라닐 아세테이트 (50 % 에탄올 중)로 절편을 함유 한 격자를 5 분 동안 얼룩지게하십시오. 슬라이드를 실행 중인 탈이온수 하에서 각각 10-15초 동안 부드럽게 세척한다. 납 시트레이트 한 방울 ( 재료 표 참조)을 놓고 5 분 동안 얼룩을 남깁니다.
- 이전과 같이 씻고, 여과지에 그리드를 얼룩지게하여 물을 제거하고, 그리드를 공기 건조시킵니다. 제조업체의 지침에 따라 TEM으로 시각화 합니다(자료 표 참조).
- 나노입자 추적 분석(NTA)(입자 크기, 농도)을 수행합니다.
- 렌즈 용지를 사용하여 광학 플랫에서 먼지 나 눈에 보이는 물질을 조심스럽게 닦아냅니다. 모든 O-링 및 기타 씰이 깨끗하고 손상되지 않았는지 확인하십시오. 계측기를 켜고 소프트웨어를 시작합니다.
- 깨끗한 주사기를 사용하여 챔버를 초순수로 채 웁니다. 기포가 없는지 확인하십시오.
- 카메라 시작을 클릭하고 '지문'에 대한 챔버의 최적 영역을 시각화하십시오. 필요에 따라 현미경 스테이지를 수평 또는 수직으로 조정하여 신호 강도가 이미지화된 영역에 고르게 전달되도록 합니다. 지문을 기준으로 이미징 영역을 가로로(오른쪽, 세로선 방향으로) 이동하여 배경 신호가 낮은 근처의 영역을 찾습니다.
- 화면 게인 및 카메라 레벨 슬라이더를 최대로 밀고 가장 낮은 수준으로 줄여 가장 어두운 파티클을 확인합니다.
참고: 시아노박테리아 소포의 일반적인 설정은 화면 게인 7과 카메라 레벨 10-12를 사용합니다. - 필요에 따라 초점을 조정하여 입자가 시야각에서 거의 동일하게 표시되도록 합니다. 챔버가 깨끗하다는 것을 시각적으로 확인할 때까지 챔버를 통해 매우 깨끗한 물을 계속 밀어 넣으십시오.
- 다른 주사기를 사용하여 챔버에서 잔류 물을 제거하십시오.
- 시료가 들어있는 배지 / 버퍼의 샘플을 검사하여 깨끗한 1 mL 주사기를 사용하여 챔버에 미디어 / 버퍼를 채워 배경 입자 농도를 결정하십시오.
- SOP 드롭다운 상자에서 표준 측정을 선택합니다. 설정을 변경하여 각각 60초 비디오의 기술 반복실험이 세 개 이상 수집됩니다. 만들기 및 스크립트 실행을 누르고 프롬프트를 따릅니다. ~100 μL의 샘플을 반복실험 사이의 챔버 내로 밀어 넣는다.
- 획득이 완료되면, 주사기로 잔류 버퍼를 제거하고, 챔버를 통해 초순수 3-5 mL의 물을 플러시하고, 남아있는 물을 제거한다.
- 1 mL 주사기를 사용하여 챔버에 소포 샘플을 추가하고 획득 설정을 확인하십시오. 입자 수가 계측기의 선형 범위(일반적으로 20-80 입자/프레임 사이) 내에 있지 않으면 샘플을 희석하거나 농축해야 합니다. 데이터를 수집하기 전에 적어도 500μL의 샘플을 챔버 내로 밀어 넣습니다.
- 5.3.8 단계와 같이 비디오 데이터를 수집하여 서로 다른 샘플 사이의 초순수로 챔버를 청소하십시오.
- 데이터의 비교 가능성을 보장하기 위해 동일한 카메라 설정을 사용하여 동일한 유기체 / 실험에서 모든 후속 샘플을 수집합니다. 카메라 레벨 설정의 변경은 획득한 최종 값에 주목할 만한 영향을 미칠 수 있습니다.
- 소프트웨어의 분석 섹션을 사용하여 파티클 파라미터를 결정합니다. 실험 열기> 분석을 선택하고 샘플 파일을 로드합니다. 선택한 파일 처리를 선택하고 분석이 완료될 때까지 기다립니다. 동일한 실험의 모든 후속 샘플에 대해 동일한 검출 임계값 을 사용해야 합니다.
참고: 시아노박테리아 소포는 자주 희미하기 때문에 검출 임계값은 일반적으로 가장 민감한(가장 낮은) 값으로 조정해야 합니다.
- 동적 광산란(DLS)(입자 크기, 제타 전위)을 수행합니다.
- DLS로 들어가는 모든 샘플에 대해 0.2μm 기공 크기 필터를 통해 필터링하여 측정을 방해하는 큰 입자를 선별합니다.
- 깨끗한 큐벳에 1mL의 배지/버퍼를 넣어 배지에서 나오는 응집 또는 기타 나노입자를 검사합니다. 왼쪽의 서리가 내린 쪽이있는 큐벳을 마이크로 샘플러에 넣고 뚜껑을 닫습니다. 샘플을 적어도 5 분 동안 평형화시키십시오.
- 재료의 굴절률과 재료의 흡수율이 물의 기본값과 크게 다른 경우 입력하십시오.
참고 : 소포가 100nm보다 작 으면 재료 특성은 거의 영향을 미치지 않습니다. EVs의 표면 전위 (제타 전위)를 측정 할 때, 소포는 원래의 성장 매질에 재현탁되어야합니다. - 계기판 제어판을 클릭하여 판독 값을 확인하고 녹색 아이콘을 클릭하여 데이터 수집을 시작하십시오. 값이 양호해 보이고 미디어/버퍼에 집계 또는 다른 파티클이 포함되어 있지 않으면 이제 샘플을 측정할 준비가 된 것입니다.
- 1mL의 소포 샘플을 깨끗한 큐벳에 넣고 5.4.4단계에서 언급한 대로 데이터를 수집합니다. 각각 10분 동안 적어도 세 번의 기술 반복실험을 수집합니다.
- 리포폴리사카라이드(LPS) 분석을 수행하여 그람 음성 EV가 샘플에 존재하는지 확인합니다.
- 표준 1x Laemmli 샘플 버퍼에서 10분 동안 95°C에서 열 변성 소포 샘플( 표 참조).
- 스트렙토마이세스 그리세우스로부터의 0.2 U형 XIV 프로테아제(표 문헌 참조)와 함께 30분 동안 37°C에서 인큐베이션하여 오염된 당단백질을 제거하였다.
- 이전에 공개된 프로토콜 16에 따라 변성 16% (w/v) SDS-폴리아크릴아미드 겔에 대한 전기영동에 의해 처리된 샘플을 분리하였다.
- LPS를 검출하기 위해, 겔을 상업적으로 입수가능한 염색 키트 또는 변형된 은 염색 기술(28)로 염색한다. 이전에 발표된 참고문헌29,30에 따라 염색된 겔의 치밀측정법 분석에 의해 상대적인 LPS 풍부도를 정량화한다.
6. 소포 생산 속도 측정
- 단계 5.3에서와 같이 나노입자 추적 분석 또는 이와 동등한 기술을 사용하여, 실험을 위한 성장 배지 내의 입자 농도를 측정한다. 높은 입자 수가 발견되면 0.1 μm 공극 필터를 통해 여과하고 다시 확인하십시오.
참고: 오류를 최소화하려면 배지 배경 입자 농도가 가장 낮은 밀도의 배양물에서 발견되는 입자 농도의 10% 미만이어야 합니다. - 단계 1.1.2에서와 같이 실험을 위해 요망되는 배지 및 환경 조건 하에서 적어도 2개의 연속적인 연속 전달을 위해 세포를 성장시킴으로써 배양물을 적응시킨다. 문화는 여전히 기하 급수적 인 성장 단계에있는 동안 이전되어야합니다. 측정된 배양 성장률이 전사 전반에 걸쳐 일관되게 유지되도록 보장한다; 그렇지 않다면 성장률이 재현 될 때까지 문화를 계속 이전하십시오.
- 접종시 시간 코스 샘플을 수집하고 성장 곡선을 가로 질러 초기 고정 단계까지 정기적으로 시간 간격을 정합니다. 스태거 시점은 지수적 성장의 전체 범위에 걸쳐 수집된 최소 3-4개의 샘플을 가질 수 있다. 각 시점에서 샘플링하려면 다음 단계를 수행하십시오.
- 1 mL 이상의 배양물을 깨끗하고 멸균된 0.2 μm 시린지 필터를 통해 직접 여과하고 여액을 저장하여 단계 5.3에서와 같이 소포 농도를 측정하였다. 원하는 경우 시간 코스 샘플을 고정합니다. 상대 형광을 사용하여 배양 성장 역학을 따르십시오.
- 유기체에 적합한 방법을 사용하여 집단 크기를 결정하기 위해 전체 배양물의 샘플을 저장한다 (유세포 측정; 콜로니 플레이팅; 또는 기타).
- 각 시점에서 세포 및 소포 유사 입자 (mL 당)의 측정을 얻습니다.
- 지수 성장 단계에서 발생한 시점을 식별합니다. r을 계산하려면 세대당 세포당 생성되는 소포의 수, 지수 성장 중 두 점 사이(일반적으로 시간 코스의 시작과 끝)를 계산하려면 보충 파일 1에 제공된 방정식을 사용합니다.
참고: 이 방법은 정상 상태 성장 조건에서만 유효합니다. 계산의 기본 가정과 파생은 참조14에 자세히 설명되어 있습니다.
결과
도 1은 시아노박테리아 소포 분리 과정의 개요를 제시하며, 여기에 설명된 프로토콜의 주요 측면을 강조한다. 특히 주목할만한 것은 소포(vesicle) 분획으로부터 시아노박테리아 바이오매스를 분리하고, 소낭 샘플을 농축하고, 소낭을 분리 및 정제하는 단계(도 1, 단계 2 내지 4)이며, 이는 재현가능한 소포 제제를 수득하는데 매우 중요하다. 도 2는 시아노박테리움 시네코시스티스 sp. PCC 6803으로부터의 세포밖 소포의 분리 및 특성화로부터의 대표적인 결과를 제시한다. 이 시아노박테리움의 외막에는 카로티노이드(31)가 함유되어 있으며, 이는 초원심분리를 통해 직접 펠릿화하여 수집된 소포의 샘플에 특징적인 오렌지색 착색을 부여한다(도 2A). 일단 베시클 펠릿이 재현탁되면, 베시클은 우라닐 아세테이트로 샘플을 음으로 염색하거나(그림 2B) 초박형 절편을 관찰하여(도 2C) 투과 전자 현미경(TEM)으로 검사할 수 있다. 베시클 크기 분포 및 농도는 동적 광산란(DLS)(그림 2D) 및 나노입자 추적 분석(NTA)(그림 2E)을 사용하여 평가할 수 있습니다. 기술된 프로토콜에 의해, 전형적으로 mL 당 ∼3.5 ± 1.0 x 108 나노입자가 1.0의 OD730에서 시네코시스티스 sp. PCC 6803의 지수적으로 성장하는 배양물에서 수득되었다. 분리된 EV의 생화학적 분석은 분리된 소포의 물리적 특성화를 보완하기 위해 수행될 수 있다. 일례로서, 정제된 시네코시스티스 sp. PCC 6803 소포를 SDS-폴리아크릴아미드 겔 상에서 분리하고, 리포폴리사카라이드(LPS; 도 2F). LPS가 외막(32)에 특이적이기 때문에, LPS 검출은 막 결합된 소포의 존재를 검증할 수 있고, 동일한 균주(33)로부터의 제제들 사이의 상대적 소포 함량을 분석하기 위한 마커로서 기능할 수 있다. 저분자량 대 고분자량 LPS의 상대적 풍부도의 검사는 샘플34,35 사이의 소낭 조성의 변화를 나타낼 수 있다.
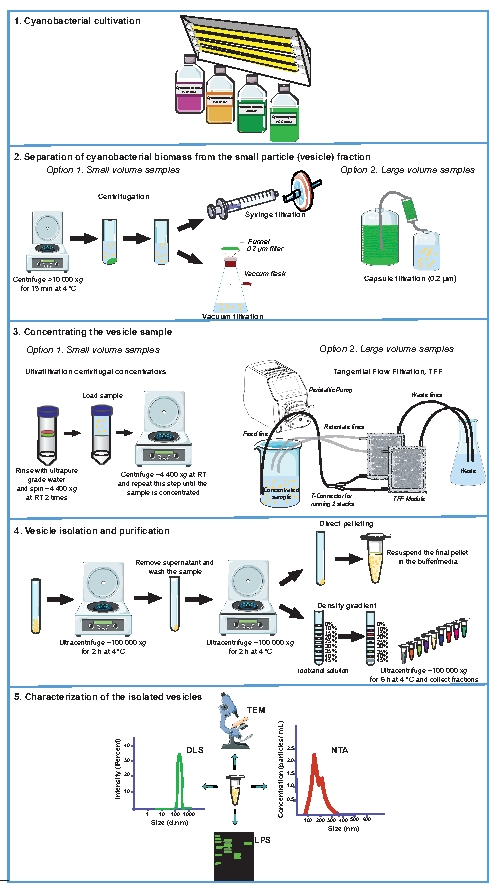
그림 1: 시아노박테리아 EV 분리 및 특성화에 사용되는 실험 절차. 성장 배양 (1) 및 성장 배지 (2)로부터 시아 노 박테리아 바이오 매스의 분리의 개략적 표현. 소포를 함유하는 무세포 샘플을 농축하고(3), EV를 분리하고 정제한다(4). 용도에 따라, 베시클 제제는 투과 전자 현미경 (TEM), 나노입자 추적 분석 (NTA), 동적 광산란 (DLS) 및 리포폴리사카라이드 (LPS) 프로파일 링 (5) 중 하나 또는 이들의 조합을 사용하여 특성화될 수 있다. RT, 실내 온도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 시아노박테리움 시네코시스티스 sp. PCC 6803에 대한 세포밖 소포 분리 및 특성화의 대표적인 결과. (a) 1.0-1.5의 OD730으로 성장한 600 mL Synechocystis sp. PCC 6803 배양물로부터 농축된 무세포 세포외 배지를 초원심분리한 후 수득한 세포밖 소포 펠릿(EVs pellet)의 사진. 외막에서 발견되는 카로티노이드로부터 유래된 소낭 펠릿의 전형적인 오렌지색 착색에 주목하라. (B,C) Synechocystis sp. PCC 6803 소낭 샘플의 음성 염색 (B) 및 초박형 섹션 (C)의 투과 전자 현미경 (TEM) 사진. 스케일 바: 각각 200nm 및 50nm. 샘플을 80 kV에서 작동되는 투과 전자 현미경 상에서 시각화하였다. (d) 소포 직경(nm)의 함수로서 소포 부피의 분포를 묘사하는 전형적인 동적 광산란(DLS) 플롯. 컬러 선은 동일한 샘플의 세 가지 기술적 복제 측정치의 데이터를 나타냅니다. (e) Synechocystis 세포밖 소포 크기 분포의 대표적인 나노입자 추적 분석(NTA) 데이터(nm에서). 검은 선은 세 번의 기술적 반복실험의 평균을 나타내고 빨간색 선은 평균의 표준 오차를 나타냅니다. (F) 리포폴리사카라이드(LPS) 프로파일은 16%(w/v) SDS-폴리아크릴아미드 겔 상에서 전기영동에 의해 소낭 제제를 분리하고 상용 LPS 염색 키트로 염색한 후 검출되었다. 각각 거친 LPS 및 평활 LPS 형태에 해당하는 저분자량 및 고분자량 LPS가 검출 가능합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1 : r을 계산하는 방정식. 지수 성장 동안 두 지점 (일반적으로 시간 코스의 시작과 끝) 사이의 생성 당 세포 당 생성 된 소포의 수는이 방정식을 사용하여 결정됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
일반적인 고려 사항
이 프로토콜(그림 1)은 시아노박테리아 세포밖 소포 작업을 위한 '1-size-fits-all' 방법이 없다는 것을 강조하기 위한 일련의 옵션으로 제시된다. 관심있는 연구원은 특정 모델 유기체, 실험 질문 / 목표 및 장비 가용성에 적합하고 호환되는이 프로토콜의 섹션을 활용할 수 있습니다. 모든 소포 분리 접근법은 절충안을 포함하며 불가피하게 어느 정도의 편향을 초래할 것입니다. 가능할 때마다 이것을 최소화하기 위해 노력해야하지만, 가장 중요한 고려 사항은 사용 된 상세한 방법론이 적절한 MISEV (세포 밖 소포 연구를위한 최소 정보) 지침36에 따라보고되도록하는 것입니다.
문화 성장
시아노박테리아 배양물은 전 세계적으로 이용가능한 많은 배양 컬렉션 중 하나로부터 용이하게 수득될 수 있다. 몇 가지 예는 Roscoff Culture Collection (Station Biologique de Roscoff, France), Pasteur Culture Collection (Institute Pasteur, Paris, France) 및 Provasoli-Guillard National Center for Marine Algae and Microbiota (NCMA, Maine, USA)입니다. 선택의 시아 노 박테리아 균주는 적절한 배지 및 환경 조건에서 재배되어야하며, 다른 균주들 사이에서 상당히 다양합니다. 시아 노 박테리아 재배에 일반적으로 사용되는 배지 목록은 배양 수집 웹 사이트 또는 기타 간행물 37,38,39에서 찾을 수 있습니다.
시아 노 박테리아 세포 밖 소포를 사용하는 것은 많은 전형적인 모델 실험실 종속 영양에 대해보고 된 방법론과 비교하여 몇 가지 독특한 도전을 제시합니다. 시아노박테리아 배양물은 에스케리치아 콜리14,16,40과 같은 다른 미생물에서 발견되는 것보다 훨씬 낮은 크기의 소낭 농도를 갖는다. 낮은 세포 밀도 및/또는 소포 생산 속도에서 비롯된 것으로 추정되는 이러한 차이는 벌크 분석을 위한 충분한 물질을 산출하기 위해 상대적으로 큰 배양물(~1-20 L 이상)이 필요할 수 있음을 의미한다. 따라서 연구자들은 소규모 문화권의 소포 수율을 테스트하여 원하는 최종 목표를 달성하는 데 필요한 물질의 양을 결정하는 것이 좋습니다. 실험에 사용 된 매체가 검출 가능한 미립자 배경을 가지고 있는지 여부를 확인하는 것의 중요성은 그 물질이 잠재적으로 소낭 집단 정량화를 혼동하거나, 소포 농도 / 크기 측정의 민감도를 감소시키거나, 최종 소포 제제를 오염시킬 수 있기 때문에 실험을 시작하기 전에 강조해야합니다.
이 분야의 또 다른 과제는 모든 시아 노 박테리아가 순수한 배양에서 잘 자라거나 전혀 자라지 않는다는 것입니다. 도끼로 렌더링 될 때까지, 물리적 소포 특성, 생산 속도 또는 내용에 대한 해석은 반드시 지역 사회의 어느 한 변형에 의해 생성 된 소포에 대한 명확한 결론을 이끌어 낼 수 없습니다. 연구자들은 또한 다른 유형의 입자가 존재할 수 있고 특정 나노 입자 분석 도구에 의해 소포와 잠재적으로 혼동 될 수있는 것을 고려하는 것이 좋습니다.이 도구는 반드시 다른 입자 유형을 구별 할 수는 없습니다. 예를 들어, 사용되는 균주가 게놈 시퀀싱, 유도 분석 또는 다른 수단을 통해 프로파지가 부족하거나 다른 유형의 미립자 물질을 방출하지 않는지 확인하는 것이 필수적일 수 있다. 우리의 경험에 비추어 볼 때, 대부분의 시아 노 박테리아 소포는 직경이 <0.2 μm이지만 새로운 균주 또는 성장 조건을 볼 때 0.45 μm 기공 크기 필터를 사용하여 정제 된 입자의 크기 분포를 변경하는지 확인해야합니다.
문화 조건의 많은 측면은 소포 생산과 그 내용물41,42에 영향을 줄 수 있습니다. 따라서, 배양 성장에 사용되는 물리적 및 화학적 조건(광조도, 온도 및 배지 조성 포함)은 결과의 재현성을 보장하기 위해 가능한 정도까지 문서화되고 제어되어야 한다. 소포 내용물에 대한 모든 화학 분석은 배경 조성을 설명해야하며, 특히 '-omics'스타일의 높은 처리량 분석을 수행 할 때 특히 그렇습니다. 이것은 천연 해수 배경을 기반으로하거나 효모 추출물 또는 트립톤으로 보충 된 것과 같이 정의되지 않은 배지를 사용할 때 특히 중요 할 수 있습니다. 정의된 성장 배지를 사용하는 것은 실험 목표에 따라 바람직할 수 있다.
연구원은 일정한 간격으로 배양 성장 역학을 신중하게 모니터링하여 임의의 시간 후에 샘플을 수집하는 것이 아니라 성장 단계에서 주어진 배치 배양이 어디에 있는지 알 수 있도록해야합니다. 소포 조성은 성장 단계에 따라, 특히 지수 및 정지 단계41,42 사이에서 다양 할 수 있습니다. 예를 들어, 정지기에서 샘플링된 소포의 적어도 일부 분획은 기하급수적 성장 동안 발생하지 않을 상이한 세포 메커니즘, 예컨대 세포 용해로부터 발생할 수 있다. 이것은 여전히 생물학적 관심이 클 수 있지만 샘플을 아는 것이 필수적입니다. 시아노박테리아 배양이 시료 농도로 직접 진행할 수 없는 시점에 원하는 성장 단계에 도달하는 경우, 즉시 <0.2 μm 분획으로부터 세포를 분리하고(원심분리 및/또는 직접 0.2 μm 여과 사용), 무세포 여액을 4°C에서 저장하는 것이 좋습니다. 이 물질은 소포의 농도 또는 크기 분포에 거의 또는 전혀 눈에 띄는 영향을 미치지 않고 며칠 동안 이러한 방식으로 보관할 수 있습니다.
소포 정화
상당한 부피의 배양물로부터 소포를 분리해야 하는 빈번한 필요성은 시아노박테리아 소포 분리 워크플로우에서 매우 중요하다. 더 많은 양의 재료로 작업 할 때, 소포는 다운 스트림 분리 워크 플로우 전에 집중되어야합니다. 공칭 분자량 한계가 100kDa인 농축기(접선 유동 필터 멤브레인 또는 원심 컬럼)는 일반적으로 농도 시간을 합리적으로 유지하면서 저분자량의 가용성 물질과의 분리를 허용하지만 30kDa 필터도 성공적으로 자주 사용됩니다. 소포를 정제하는 몇몇 비원심분리 기반 방법(예를 들어, 크기 배제 크로마토그래피, 미세유체-기반 시스템, 친화도-포획 기술, 및 침전-기반 접근법)이 세포밖 소포 분야에서 대중화되고 있지만, 우리의 경험에 따르면, 이러한 접근법은 수율 감소를 초래할 수 있고 전형적으로 필요한 배양 부피와 양립할 수 없다.
연구원은 요오딕사놀 배경의 조성과 소포 정화 중에 사용되는 세척 / 재현탁 버퍼를 고려하여 원하는 하류 응용 프로그램과 호환되는지 확인해야합니다. 많은 경우에, 최종 소포 샘플은 성장 배지 또는 성장 배지에 대한 조성에서 필적할만한 정의된 완충제 (예를 들어, 천연 대 인공 해수) 내에 재현탁될 수 있다. 그러나 해양 시아 노 박테리아 소포에서는 해수 수준과 유사한 높은 염 농도가 많은 효소 반응을 억제 할 수 있으므로 분석을 위해 추가 실험 조작이 필요할 수 있습니다. 이러한 경우, 0.2 μm 여과, 1x PBS와 같은 표준 실험실 버퍼는 일반적으로 해양 시아노박테리아 소포의 안정성을 유지하는 데 잘 작동하며 다운스트림 실험 프로세스와 더 잘 호환될 수 있습니다.
밀도 구배 정제는 실험 목표 및 배양 조성에 따라 선택적인 것으로 간주될 수 있지만, 보다 엄격하게 순수하고 재현 가능한 샘플을 생산하는 것이 좋습니다. EV 집단은 이질적이며 다양한 부력 밀도에 걸쳐 발견될 수 있으며, 이는 변형률, 성장 조건 및 기타 인자 4,5,6에 의해 더욱 다양하다. 위에 열거된 밀도는 시아노박테리아 배양물 및 요오딕사놀의 현장 샘플로부터의 소포에 대해 전형적으로 발견되는 것들을 나타내지만, 다른 균주의 결과는 다를 수 있다. 수크로오스 및 CsCl과 같은 다른 밀도 구배 물질은 소포에 활용 될 수 있지만, 이들은 이러한 배경에서 다른 부력 밀도로 이동한다. 상이한 구배 배지 배경은 지질-밀폐된 바이러스(43)의 회복을 편향시킬 수 있고, 잠재적으로 상이한 균주로부터의 소포의 회복에 영향을 미칠 수 있다.
소포는 여기에 설명된 소포 분리 및 구배 정제 과정을 통해 여러 지점에서 손실될 수 있으며, 수율을 감소시키고 다운스트림 적용을 위해 주어진 최종 소포 수율을 달성하는 데 필요한 출발 물질의 양을 증가시킨다. 초원심분리 후 소포 펠릿으로 작업 할 때 특별한주의를 기울여야합니다. 일부 시아노박테리아 소포는 소낭 샘플에 어느 정도의 색소침착을 빌려줄 수 있는 카로티노이드 또는 다른 화합물을 가질 수 있지만(도 2), 변형률 또는 물질의 양에 따라, 소낭 펠릿을 직접 시각화할 수 있을 것으로 반드시 기대되는 것은 아니다. 펠릿이 사용되는 원심 분리기 로터의 유형을 제공 할 것으로 예상되는 곳을 알고 있어야합니다. 가능한 경우, 정제된 소포 샘플은 회수된 최종 물질의 조성을 확인하기 위해 전자 현미경으로 검사하는 것이 제안된다.
보관 조건이 소포와 그 내용물에 미치는 영향은 여전히 열린 질문입니다. 비록 저장소가 시아노박테리아 소포의 크기 또는 농도(14)에 주목할 만한 효과를 갖지 않는다는 것이 밝혀지지만, 단리된 소포 제제의 기능은 시간(44)에 따라 변할 수 있다. 동결 / 해동 사이클은 가능할 때마다 피해야하지만, 동결 샘플이 전체 소포 수 및 크기에 미치는 영향은 최소화 된 것으로 보입니다. 하나는 소포-관련 핵산의 길이 또는 단백질의 안정성과 같은 소포 내용물의 조성에 영향을 미치는 동결-해동 사이클의 가능성을 인식해야 한다.
field samples의 소포
자연 수생 환경으로부터 세포밖 소포를 분리하기 위한 현재의 방법은 대용량 배양을 위해 여기에 기술된 것과 개념적으로 그리고 작동적으로 유사하다. 그럼에도 불구하고 더 많은 양의 재료가 필요할 수 있습니다. 이러한 현장 샘플은 분석을 위한 충분한 물질을 얻기 위해 수백 내지 수천 리터의 물을 수집, 여과 및 농축하는 것을 포함할 수 있다. 사용되는 샘플의 탁도에 따라, 0.2 μm 필터 전에 하나 이상의 사전 여과 단계의 혼입이 필요할 수 있다. 사용되는 특정 TFF 장치는 합리적인 시간 (이상적으로는 시간 순서로)과 샘플에 과도한 압력을 가하지 않고 이러한 대량으로 작업하는 데 적합해야합니다. 실제로, 이것은 종종 배양 기반 샘플에 적용될 수있는 것보다 훨씬 더 큰 총 표면적을 사용하는 것뿐만 아니라 증가 된 유속을 용이하게하기 위해 더 큰 직경의 튜브를 사용하는 것을 포함합니다. 이러한 증가된 필터 표면적은 더 작은 TFF 배열 및 더 큰 최종 농축 부피에 비해 입자 손실의 한계 증가로 이어질 가능성이 높습니다. 그러나 이러한 우려는 총 처리 시간을 고려한 것과 균형을 이루어야 합니다. 샘플링 후 며칠 동안 샘플이 실험실로 돌아 가지 않는 확장 된 해양 크루즈와 같은 상황에서는 현장에서 초기 0.2 μm 여과 및 TFF 단계를 수행하는 것이 좋습니다. 이 더 작은 부피의 농축 된 재료는 최종 처리를 위해 실험실로 반환 될 때까지 4 ° C 또는 -80 ° C (가용성 및 다운 스트림 분석 고려 사항에 따라 다름)에 저장 될 수 있습니다.
유기 및 무기물 인 다른 작은 입자로부터 세포 밖 소포를 분리하고 분리하는 것은 어려울 수 있으며 다른 입자를 분리하는 방법은 아직 완벽하지 않습니다. 예를 들어, 요오딕사놀 밀도 구배는 주어진 샘플에 존재하는 모든 부류의 소포 및 바이러스를 쉽게 분리하지 않을 수 있다. 혼란스러운 입자의 종류와 물리적 특성이 샘플링 부위마다 다르기 때문에 현재 모든 종류의 작은 수생 입자를 견고하게 분할하는 프로토콜을 제공하는 것은 불가능합니다. 시행 착오가 필수적이며, 분리를 최대화하기 위해 구배 및 초원심분리 조건에서 사용되는 요오드딕사놀 범위에 대한 실험이 필요할 것이다; 더 작은 부피, 더 미세하게 분해된 밀도 분수의 집합이 또한 요구될 수 있다. 문맥에 따라, 요오드딕사놀 대신에 CsCl 구배를 사용하는 것은 환경 입자(45)를 분리하는 데 도움이 될 수 있다. 그럼에도 불구하고, 삼투압 조건의 변화는 위에서 논의된 바와 같이 최종 회수된 제품에서 편향을 초래할 수 있다.
소포 특성화
나노입자 분석 장비는 아직 미생물학 실험실 환경에서 일상적으로 사용할 수 없지만 점점 더 많이 이용 가능해지고 있습니다. 모든 방법론에는 장단점이 있으며, 우리는 시아 노 박테리아 소포 작업에 대해 다른 모든 플랫폼보다 더 나은 플랫폼으로 한 플랫폼을 구체적으로 보증하지 않습니다. 실제로 모두 비용, 해상도, 사용 편의성, 탐지 한계, 다양한 성장 미디어 / 버퍼 배경과의 호환성 및 데이터 재현성과 관련하여 특별한 절충안을 가지고 있습니다. 위에서 설명한 나노입자 추적 분석에 기초한 계기 외에도, 나노플로우 세포측정법, 미세유체 저항 펄스 감지 및 조정 가능한 저항 펄스 감지를 포함한 다른 접근법도 적용될 수 있다(46,47). 사용자는 사용 가능한 계측기의 세부 정보를 배우고 해수 기반 미디어와 함께 일부 플랫폼을 사용할 때 어려움이 발생했기 때문에 시스템과 잘 작동하는지 확인해야합니다. 우리는 현장이 소포 크기, 농도 및 생산 속도의 양적 특성화로 나아갈 것을 권장합니다. 단백질 함량이나 다른 메트릭의 관점이 아닌 mL 당 기본 입자 기준으로 소포 농도를 측정하면 소포를보다 정량적 인 프레임 워크에 통합 할 수 있으며 균주와 조건 간의 상호 비교가 가능합니다. <100nm 입자에 대한 농도 측정을 교정하는 능력을 향상시키기위한 추가 노력이 필요합니다.
입자 손실을 최소화하기 위해 0.2 μm 여과된 배양 상청액으로부터 직접 소낭 생산 속도 측정이 수행된다는 사실은 위에서 설명된 다른 정제 단계와 연관될 것이다. 그러나, 이것은 접근법이 실제 세포밖 소포와 배양물에서 발견되는 다른 작은 입자들을 반드시 구별하지는 않는다는 것을 의미한다. 특정 크기 범위 (예를 들어, 직경 50-250 nm 내)의 입자만을 계수하는 것은 일부 특이치를 배제하는 데 도움이 될 수 있지만, 펠릿화 된 <0.2 μm 배양 내용물이 막 결합 된 소포 인 것처럼 보인다는 육안 확인은 (TEM 또는 다른 접근법에 의해) 소낭 유사 입자의 생산과 반대로 소포의 생산을 측정하고 있다고 구체적으로 주장 할 수 있어야합니다.
소낭 특성화의 필수 요소는 소낭 샘플이 나노입자 분석 장치의 적절한 선형 감도 범위에서 분석되고 있는지 확인하는 것입니다. 샘플이 너무 농축되면 깨끗한 버퍼로 해당 물질을 희석하고 다시 분석하는 것이 간단합니다. 반면에, 일부 시아노박테리아 배양물의 상대적으로 낮은 세포 및/또는 소포 밀도는 때때로 일부 기기의 검출 한계 미만인 소포 제제를 산출할 수 있다. 이것이 벌크 소포 정제와 함께 발생하는 경우, 더 큰 부피 배양물을 성장시키고, 최종 물질을 더 작은 부피로 재 펠릿화 및 재현탁하거나, 과도한 손실이 발생하고 완화 될 수있는 분리 과정에서 단계가 있는지 여부를 평가할 수 있습니다. 소포 생산 속도를 측정 할 때 수정이 반드시 그렇게 간단하지는 않습니다. 필요한 경우 샘플을 농축 할 수 있지만 첫 번째 샘플은 배지에 대한 조정이 더 높은 세포 밀도를 초래할 수 있는지 또는 농도가 더 높을 지수 단계 동안 나중 시점부터 충분히 농축 된 샘플을 얻을 수 있는지 여부를 확인해야합니다.
제한
다른 프로토콜과 마찬가지로 이러한 접근 방식을 사용하는 소포 분리에는 분명한 한계가 있습니다. 이러한 접근법은 완전히 순수한 소포 준비가 격리 될 것이라는 보장에 의존하지 않습니다. 배양물과 현장 샘플 모두 밀도 구배에서 소포와 유사하게 이동하는 다른 물질을 함유할 수 있다. 그럼에도 불구하고, 최소한 이러한 유형의 추가 정제 방법론은 소포 분석의 엄격함과 재현성을 보장하는 데 필수적입니다. 우리가 시아 노 박테리아의 맥락에서 소포 분리 접근법을 설명하는 동안, 다른 많은 미생물의 배양물은 또한 비교적 낮은 농도의 소포를 포함 할 것이며, 여기에 설명 된 절차는 일반적으로 적용 가능해야합니다. 이러한 방법은 영구적 인 프로토콜이 아니라 다양한 미생물의 세포 밖 소포 작업에 대한 미래의 발전을 촉진하기위한 출발점이 될 것으로 예상됩니다. 이러한 방법을 크기 배제 컬럼 또는 비대칭 필드 흐름 분별과 같은 다른 접근법과 병합하여 배양 및 환경 샘플에서 서로 다른 범주의 작은 입자의 차별 및 분리를 개선하기 위해 향후 노력이 필요합니다. 우리는 또한 이러한 기술이 소포 집단 내의 이질성, 내용 및 환경에서의 정확한 기능적 역할을 조사하는 능력을 향상시키기 위해 나노 입자 특성화 기술의 개선과 함께 계속 발전 할 수 있기를 희망합니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
저자들은 i3S 과학 플랫폼 "Biointerfaces and Nanotechnology"와 "Histology and Electron Microscopy", 국가 인프라 포르투갈 바이오 이미징 플랫폼 (PPBI-POCI-01-0145-FEDER-022122)의 지원을 인정합니다. 또한 TEM을 위한 초박형 섹션 염색 프로토콜을 최적화하는 데 도움을 준 J. A. Gonzalez-Reyes 교수(스페인 코르도바 대학)와 나노입자 추적 분석을 위해 Cecília Durães 박사와 Ana Rita Pinto 박사(포르투갈 포르토 대학)에게 감사드립니다.
이 작품은 미국 국립 과학 재단 (OCE-2049004 ~ SJB), Fundo Europeu de Desenvolvimento Regional (FEDER) 기금이 COMPETE 2020 경쟁력 및 국제화 프로그램 (POCI), 포르투갈, 2020 년 포르투갈 및 Fundação para a Ciência e a Tecnologia / Ministério da Ciência, Tecnologia e Ensino Superior 프로젝트 POCI-01-0145-FEDER-029540 (PTDC / BIA-OUT/29540 / 2017 to PO)을 통해 포르투갈 기금으로 자금을 지원했습니다. Fundação para a Ciência e a Tecnologia는 또한 PhD 펠로우십 SFRH / BD / 130478 / 2017 (SL) 및 FCT Investigator grant IF/00256/2015 (PO)로 크게 인정 받고 있습니다. M.C.M.-M. Horizon 2020 Framework Programme(H2020-MSCA-IF-2018-RI-844891) 내의 Marie Skłodowska-Curie Individual Fellowship(재통합 패널)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1x Phosphate buffered saline (PBS), pH 7.4 | Home-made buffer | --- | Standard wash/storage buffer which can be used with vesicles; can be made in lab or purchased commercially |
| 2% Uranyl acetate solution | Electron Microscopy Sciences | 22400-2 | Negative staining - TEM |
| 4x Laemmli Sample Buffer | Bio-Rad | 161-0747 | Denaturation of vesicle sample prior to proteolysis, required for lipopolysaccharides (LPS) staining |
| Amicon Ultra Centrifugal Filters (100 kDa) | Merck | UFC9100XX | Alternative option for centrifugal ultrafiltration |
| BG11 medium | Home-made medium | --- | Medium for cultivation of Synechocystis sp. PCC 6803 |
| Carbon Support Film 200 Mesh, copper. CF200-Cu | Electron Microscopy Sciences | 71150 | Transmission electron microscopy (TEM) grid |
| easiGlow Glow Discharge Cleaning System | Ted Pella | 91000 | Commercial TEM grid glow discharger |
| EMbed 812 epoxy resin | Electron Microscopy Sciences | 14120 | Ultra-thin sections - TEM |
| Filter holder for vacuum system | Thermo Fisher Scientific | 300-4000 | Reusable units with filter membrane support plates |
| Glutaraldehyde Grade I | Sigma-Aldrich | G5882-10X1ml | Ultra-thin sections - TEM |
| HEPES [N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid) sodium salt] | Sigma-Aldrich | H7006 | Buffering agent for cyanobacterial growth media |
| Lead Citrate, Trihydrate | Electron Microscopy Sciences | 17800 | Stain for use in electron microscopy |
| Macrosep Advance Centrifugal Devices with Omega Membrane 100K | Pall | MAP100C36 | For centrifugal ultrafiltration of small volume samples |
| Millipore Pellicon 3 TFF Module | EMD Millipore | XX42P0060 or XX42P0080 | Alternative TFF option for concentrating large volume samples |
| Milli-Q Reference Water Purification System | Merck | Z00QSV0WW | Water purification system for obtaining type I ultrapure grade water |
| NanoSight | Malvern Panalytical | LM14 or NS300 | Nanoparticle tracking analysis |
| Optima L80 XP Ultracentrifuge | Beckman Coulter | L80 XP | Ultracentrifuge (or similar model) |
| OptiPrep / Iodixanol | Sigma-Aldrich | D1556 | Density gradient media |
| Osmium Tetroxide Reagent Plus | Sigma-Aldrich | 201030 | Ultra-thin sections - TEM |
| Pall Centramate PE TFF holder | Pall Corporation | FS002K10 | TFF module good for concentrating 10s-100s of L of sample; requires additional 30 or 100 kDa filter modules to scale with your estimated volumes |
| Peristaltic pump Masterflex L/S | Cole-Parmer | 07559-07 | Pump for driving large-scale TFF modules |
| Piston Gradient Fractionator | Biocomp Instruments | 152-001 | Automated density gradient fractionation |
| Polycarbonate tubes for the 70 Ti rotor | Beckman Coulter | 355618 | Reusable ultracentrifuge polycarbonate aluminum tubes with cap assembly |
| Pro99 medium | Home-made medium | --- | Medium for cultivation of Prochlorococcus |
| Pro-Q Emerald LPS Gel Stain Kit | Thermo Fisher Scientific | P20495 | LPS staining |
| SN medium | Home-made medium | --- | Medium for cultivation of cyanobacterial marine strains such as Synechococcus |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250-100G | Buffering agent in the preparation of vesicles samples for TEM |
| SW32Ti swinging bucket rotor | Beckman Coulter | 369650 | Ultracentrifuge rotor, holds 6x ~40 mL tubes; good for pelleting of bulk material |
| SW60Ti swinging bucket rotor | Beckman Coulter | 335650 | Ultracentrifuge rotor, holds 6x ~4.5 mL tubes; good for gradient purifications and final vesicle washes |
| Syringe 1mL Luer | BD Plastipak | 303172 | For vesicle isolation and loading samples into nanparticle tracking analysis (NTA) equipment |
| Syringe filter 0.2 µm | Pall Corporation | 4602 | For vesicle isolation from cultures |
| TAPS [N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid] | Sigma-Aldrich | T5130 | Buffering agent for cyanobacterial growth media |
| Transmission electron microscope | JEOL | JEM-1400 | Or similar microscope |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | Ultracentrifuge rotor, holds 8x ~39 mL tubes; good for pelleting of bulk material |
| Type XIV protease from Streptomyces griseus | Sigma-Aldrich | P5147 | Enzyme for proteolysis of EVs proteins, required for LPS staining |
| UltraClear tubes for the SW32Ti rotor | Beckman Coulter | 344058 | Single use ultracentrifuge tubes |
| UltraClear tubes for the SW60Ti rotor | Beckman Coulter | 344062 | Single use ultracentrifuge tubes |
| Ultramicrotome PowerTome XL, PT-PC | RMC Products, Boeckeler Instruments | 75501 | Microtome for ultra-thin sections - TEM |
| Universal 320 R centrifuge | Hettich | Z654736 | This or any similar general-purpose benchtop/floor standing centrifuge can be used for pelleting cells |
| Vacuum apparatus | KNF Neuberger | N026.3 AT.18 | Or any similar vacuum pump and trap |
| Vivaflow 200 100,000 MWCO PES | Sartorius | VF20P4 | TFF module, good for 2-3L. You can connect different modules for higher volume (figure 1). |
| Whatman Polycap TC Capsule filter (0.2/0.2µm) | Cytiva | 6717-9502 | Capsule filter for filtering large volumes of liquid |
| Zetasizer | Malvern Panalytical | Zetasizer Nano ZS | Dynamic light scattering (DLS) instrument |
참고문헌
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Coelho, C., Casadevall, A. Answers to naysayers regarding microbial extracellular vesicles. Biochemical Society Transactions. 47 (4), 1005-1012 (2019).
- Schwechheimer, C., Kuehn, M. J. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions. Nature Reviews Microbiology. 13 (10), 605-619 (2015).
- Toyofuku, M., Nomura, N., Eberl, L. Types and origins of bacterial membrane vesicles. Nature Reviews Microbiology. 17 (1), 13-24 (2019).
- Kulp, A., Kuehn, M. J. Biological Functions and Biogenesis of Secreted Bacterial Outer Membrane Vesicles. Annual Review of Microbiology. 64 (1), 163-184 (2010).
- Berman-Frank, I., Lundgren, P., Falkowski, P. Nitrogen fixation and photosynthetic oxygen evolution in cyanobacteria. Research in Microbiology. 154 (3), 157-164 (2003).
- Flores, E., Herrero, A. Compartmentalized function through cell differentiation in filamentous cyanobacteria. Nature Reviews Microbiology. 8 (1), 39-50 (2010).
- Flombaum, P., et al. Present and future global distributions of the marine cyanobacteria Prochlorococcus and Synechococcus. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9824 (2013).
- Biller, S. J., Berube, P. M., Lindell, D., Chisholm, S. W. Prochlorococcus: the structure and function of collective diversity. Nature Reviews Microbiology. 13 (1), 13-27 (2015).
- Abed, R. M. M., Dobretsov, S., Sudesh, K. Applications of cyanobacteria in biotechnology. Journal of Applied Microbiology. 106 (1), 1-12 (2009).
- Lea-Smith, D. J., et al. Editorial: Exploring the growing role of cyanobacteria in industrial biotechnology and sustainability. Frontiers in Microbiology. 12, 1963 (2021).
- Garcia-Pichel, F., Zehr, J. P., Bhattacharya, D., Pakrasi, H. B. What's in a name? The case of cyanobacteria. Journal of Phycology. 56 (1), 1-5 (2020).
- Biller, S. J., et al. Bacterial vesicles in marine ecosystems. Science. 343 (6167), 183 (2014).
- Pardo, Y. A., Florez, C., Baker, K. M., Schertzer, J. W., Mahler, G. J. Detection of outer membrane vesicles in Synechocystis PCC 6803. FEMS Microbiology Letters. 362 (20), (2015).
- Oliveira, P., et al. The versatile TolC-like Slr1270 in the cyanobacterium Synechocystis sp. PCC 6803. Environmental Microbiology. 18 (2), 486-502 (2016).
- Biller, S. J., et al. Membrane vesicles in sea water: heterogeneous DNA content and implications for viral abundance estimates. The ISME Journal. 11 (2), 394-404 (2017).
- Yin, H., et al. Synechococcus elongatus PCC7942 secretes extracellular vesicles to accelerate cutaneous wound healing by promoting angiogenesis. Theranostics. 9 (9), 2678-2693 (2019).
- Lima, S., Matinha-Cardoso, J., Tamagnini, P., Oliveira, P. Extracellular vesicles: An overlooked secretion system in cyanobacteria. Life. 10 (8), 129 (2020).
- Gupta, S., Marcela Rodriguez, G. Isolation and characterization of extracellular vesicles produced by iron-limited mycobacteria. Journal of Visualized Experiments: JoVE. (152), e60359 (2019).
- Jung, A. L., et al. Legionella pneumophila outer membrane vesicles: Isolation and analysis of their pro-inflammatory potential on macrophages. Journal of Visualized Experiments: JoVE. (120), e55146 (2017).
- Fantappiè, L., et al. Antibody-mediated immunity induced by engineered Escherichia coli OMVs carrying heterologous antigens in their lumen. Journal of Extracellular Vesicles. 3 (1), (2014).
- Moore, L. R., et al. Culturing the marine cyanobacterium Prochlorococcus. Limnology and Oceanography: Methods. 5 (10), 353-362 (2007).
- Rippka, R., et al. Prochlorococcus marinus Chisholm et al. 1992 subs. Pastoris subs. nov. Strain PCC 9511, the first axenic chlorophyll a2/b2-containing cyanobacterium (Oxyphotobacteria). International Journal of Systematic and Evolutionary Microbiology. 50 (5), 1833 (2000).
- Moore, L. R., Chisholm, S. W. Photophysiology of the marine cyanobacterium Prochlorococcus: Ecotypic differences among cultured isolates. Limnology and Oceanography. 44 (3), 628 (1999).
- Partensky, F., Blanchot, J., Vaulot, D., Charpy, L., Larkum, A. W. D. . Bulletin de l'Institut Océanographique de Monaco, (n spécial 19). , 457-475 (1999).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Fomsgaard, A., Freudenberg, M. A., Galanos, C. Modification of the silver staining technique to detect lipopolysaccharide in polyacrylamide gels. Journal of Clinical Microbiology. 28 (12), 2627-2631 (1990).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Peterson, T. Densitometric analysis using NIH image. North American Vascular Biology Organization (NAVBO) eNewsletter. 16 (3), (2010).
- Jürgens, U. J., Weckesser, J. Carotenoid-containing outer membrane of Synechocystis sp. strain PCC6714. Journal of Bacteriology. 164 (1), 384-389 (1985).
- Whitfield, C., Trent, M. S. Biosynthesis and export of bacterial lipopolysaccharides. Annual Review of Biochemistry. 83 (1), 99-128 (2014).
- McBroom, A. J., Johnson, A. P., Vemulapalli, S., Kuehn, M. J. Outer membrane vesicle production by Escherichia coli is independent of membrane instability. Journal of Bacteriology. 188 (15), 5385-5392 (2006).
- Kadurugamuwa, J. L., Beveridge, T. J. Virulence factors are released from Pseudomonas aeruginosa in association with membrane vesicles during normal growth and exposure to gentamicin: a novel mechanism of enzyme secretion. Journal of Bacteriology. 177 (14), 3998-4008 (1995).
- Nguyen, T. T., Saxena, A., Beveridge, T. J. Effect of surface lipopolysaccharide on the nature of membrane vesicles liberated from the Gram-negative bacterium Pseudomonas aeruginosa. Journal of Electron Microscopy. 52 (5), 465-469 (2003).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Norena-Caro, D. A., Malone, T. M., Benton, M. G. Nitrogen sources and iron availability affect pigment biosynthesis and nutrient consumption in Anabaena sp. UTEX 2576. Microorganisms. 9 (2), 431 (2021).
- Rippka, R. Isolation and purification of cyanobacteria. Methods in Enzymology. , 3-27 (1988).
- Van Alphen, P., Abedini Najafabadi, H., Branco dos Santos, F., Hellingwerf, K. J. Increasing the photoautotrophic growth rate of Synechocystis sp. PCC 6803 by identifying the limitations of its cultivation. Biotechnology Journal. 13 (8), 1700764 (2018).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA. mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12 (383), (2021).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209 (2019).
- Soares, N. C., et al. Associating growth-phase-related changes in the proteome of Acinetobacter baumannii with increased resistance to oxidative stress. Journal of Proteome Research. 9 (4), 1951-1964 (2010).
- Thurber, R. V., Haynes, M., Breitbart, M., Wegley, L., Rohwer, F. Laboratory procedures to generate viral metagenomes. Nature Protocols. 4 (4), 470-483 (2009).
- Dell'Annunziata, F., et al. Outer membrane vesicles derived from Klebsiella pneumoniae are a driving force for horizontal gene transfer. International Journal of Molecular Sciences. 22 (16), 8732 (2021).
- Linney, M. D., Schvarcz, C. R., Steward, G. F., DeLong, E. F., Karl, D. M. A method for characterizing dissolved DNA and its application to the North Pacific Subtropical Gyre. Limnology and Oceanography: Methods. 19 (3), 210-221 (2021).
- Arab, T., et al. Characterization of extracellular vesicles and synthetic nanoparticles with four orthogonal single-particle analysis platforms. Journal of Extracellular Vesicles. 10 (6), 12079 (2021).
- Cimorelli, M., Nieuwland, R., Varga, Z., vander Pol, E. Standardized procedure to measure the size distribution of extracellular vesicles together with other particles in biofluids with microfluidic resistive pulse sensing. PLoS ONE. 16 (4), 0249603 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유