JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
살모넬라 티피뮤리움-유도된 마우스의 패혈성 복막염의 특징
요약
이 프로토콜은 마우스 모델 시스템에서 그람 음성 단세균 패혈증의 유도를 기술한다. 상기 모델은 패혈증 동안 염증성 및 치명적인 숙주 반응을 조사하는데 유용하다.
초록
패혈증은 미생물 침윤 또는 조직 손상에 대한 조절이 어려운 숙주 면역 반응으로, 감염 또는 손상으로부터 멀리 떨어진 부위에서 장기 손상을 유발한다. 현재, 패혈증의 널리 사용되는 마우스 모델은 리포폴리사카라이드 (LPS)-유도된 내독소혈증, 맹장 결찰 및 천자 (CLP), 및 단세균 감염 모델 시스템을 포함한다. 이 프로토콜은 마우스에서 살모넬라 티피뮤리움 감염-유도된 패혈성 복막염 동안 숙주 반응을 연구하는 방법을 기술한다. S. 그람 음성 세포 내 병원균 인 티피뮤리움은 생쥐에서 장티푸스와 같은 질병을 일으 킵니다.
이 프로토콜은 배양 준비, 복강 내 주사를 통한 마우스의 패혈성 복막염 유도 및 전신 숙주 반응을 연구하는 방법을 정교하게 설명합니다. 또한, 상이한 기관에서의 박테리아 부담의 평가 및 복막 세척에서 증가된 호중구 수의 유세포 분석이 제시된다. 살모넬라 균 마우스에서 티피뮤리움-유도된 패혈증은 전염증성 사이토카인의 증가와 복강 내의 호중구의 빠른 침윤을 유도하여, 생존율을 낮춘다.
이 프로토콜의 모든 단계가 최적화되어 패혈성 복막염의 발병기전을 재현 할 수 있습니다. 이 모델은 세균성 패혈증 동안 면역학적 반응, 질병 진행에서 상이한 유전자의 역할, 및 패혈증을 약화시키는 약물의 효과를 연구하는데 유용하다.
서문
패혈증은 미생물 침윤 또는 조직 손상에 대한 조절되지 않는 전신성 염증 및 면역 반응으로 정의되며, 감염 또는 손상 부위로부터 멀리 떨어진 장기 손상을 초래한다. 패혈성 쇼크는 부피 소생술 동안 지속되는 저혈압을 특징으로 하는 패혈증의 하위 집합으로, 사망 위험이 실질적으로 증가한다1. 일반 대중은 COVID-19 전염병 동안이 장애를 더 잘 알게되었습니다. 높은 관련 사망률에도 불구하고, 패혈증의 세계적 부담에 대한 포괄적 인 역학 데이터는 진단의 복잡성 때문에 부족합니다. 2017 년에는 전 세계적으로 48.9 백만 패혈증 발생률과 11 백만 명의 사망자가 있었으며 전 세계 사망자2의 19.7 %를 차지했습니다. 또한, 중환자실 환자에서 감염 및 관련 패혈증의 연장 유병률에 관한 연구에 따르면 환자로부터의 양성 격리물의 62%가 그람 음성 유기체3이었다.
처음에는 패혈증에 대한 조사가 미생물 병인을 묘사하는 데 중점을 두었습니다. 그러나 숙주가 자신과 비 자아를 구별하는 방법을 지시하는 "위험 가설"을 이해하면 침입하는 병원체에 대한 숙주 반응을 이해하는 방향으로 패혈증 연구의 균형이 기울어졌습니다. 패혈증의 널리 사용되는 마우스 모델은 리포폴리사카라이드(LPS)-유도된 내독소혈증 모델, 다미생물 패혈증 모델, 맹장 결찰 및 천자(CLP) 및 결장 상승 스텐트 복막염(CASP), 및 단세균 감염 모델4를 포함한다.
우리는 살모넬라 티피뮤리움을 사용하여 복막 패혈증을 유도하여 마우스 모델 시스템을 표준화했습니다. 이 모델은 살모넬라 티피뮤리움이 그람 음성 패혈증의 임상적으로 관련된 상태를 모방하는 세포 내 병원체이기 때문에 다른 모델보다 유리합니다. 이 모델에서 복막염 패혈증의 결과는 전신적이며, 감염 후 96 시간 이내에 100 % 사망률이 있습니다. 따라서이 모델은 염증 및 치명적인 숙주 반응을 연구하는 데 도움이됩니다. 이 모델에서, 패혈증은 살모넬라 티피뮤리움의 0.5백만 콜로니 형성 단위(CFU)를 8-10주령의 C57BL/6 마우스에 복강내 주입함으로써 유도된다. 전신 감염은 감염 후 ∼16 h 장기 박테리아 부담을 평가함으로써 확인할 수 있다. 이 기사는 마우스에서 살모넬라 티피뮤리움으로 인한 복막염 패혈증을 시연하고, 복막 세포 조성의 결과 변화를 특성화하고, 다른 장기에서 박테리아 부담을 정량화합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
살모넬라 티피뮤리움을 이용한 모든 실험은 바이오 안전 레벨 2(BSL-2) 시설에서 수행되었다. 적절한 개인 보호 장비 (PPE)를 사용하고 안전을 보장하며 표준 BSL-2 생물학적 위험 처리 방법을 따르기 위해주의를 기울여야합니다. 모든 마우스 실험은 IISc, Institutional Animal Ethics Committee에 의해 명시된 지침에 따라 수행되었다. 마우스는 인도 정부의 환경 및 산림부의 승인을 받은 IISc의 중앙 동물 시설(등록 번호: 48/1999/CPCSEA, 1999년 1월 3일자)에서 사육되고 유지되었다. 실험 프로토콜은 승인 된 허가 번호 CAF / Ethics / 797 / 2020으로 동물 실험의 목적 및 통제 및 감독위원회에 의해 승인되었습니다.
BSL2 정의 : BSL2 등급은 생물 유해 물질이 환경 및 실험실 직원에게 중간 정도의 위협을 제기한다는 것을 나타냅니다5.
1. 살모넬라 티피뮤리움의 문화 준비
- 살모넬라 티피뮤리움 NCTC 12023 글리세롤 스톡 100 μL를 루리아 베르타니(LB) 국물 3 mL에 첨가한다. 배양물을 37°C에서 160 rpm으로 밤새 인큐베이션한다.
- LB 배양액에서 밤새 성장한 배양물 50 μL를 살모넬라 시겔라(SS) 한천 플레이트 상에 줄무늬를 놓고 ∼12 h 동안 37°C에서 인큐베이션한다. 박테리아 콜로니와 함께 SS 한천 플레이트를 생체내 감염 실험 전에 며칠 동안 4°C에서 보관한다.
- 마이크로팁을 사용하여 줄무늬가 있는 SS 한천 플레이트에서 단일 콜로니를 선택하십시오. 마이크로팁을 LB 브로스 3 mL에 넣고 꺼내어 밤새 37°C에서 160 rpm으로 배양하였다.
- 박테리아 배양액 0.1 mL를 LB 배양액 50 mL에 첨가하고, 진탕기 배양기에서 37°C에서 3-4시간 동안 160 rpm으로 인큐베이션하여 대수 성장 단계에 도달한다. LB 국물을 사용하여 배양물을 2 배로 희석하십시오.
참고 : 대수 단계 동안, 박테리아 세포는 최상의 건강을 유지하고 적극적으로 분열하고 있습니다. - 분광광도계 또는 마이크로플레이트 판독기에서 600 nm 파장의 광에서 배양된 광의 광학 밀도(OD)를 측정한다. OD가 1.0에 도달하면, 1.5 mL 마이크로퍼지 튜브에서 배양물 1 mL의 두 분취량을 만든다.
- 튜브를 7,750 × g 에서 15분 동안 원심분리한다. 상청액을 버리고 펠렛을 1 mL의 1x PBS 2x로 세척한다. 튜브를 7,750 × g 에서 15분 동안 원심분리한다.
- 펠렛을 0.5 mL의 1x PBS에 재현탁시켜 두 개의 상이한 1.5 mL 마이크로퍼지 튜브에 재현탁시킨다. 두 튜브의 현탁액을 현재 ~2 ~ 2 × 10,8 콜로니 형성 단위 (CFU)/mL가 들어있는 하나의 1.5 mL 튜브에 결합하십시오.
- 이 원액을 희석하여 1 × 106 CFU/mL의 박테리아 세포 현탁액을 준비하십시오.
주의: 실험을 시작하기 전에 OD 1.0에 대한 CFU를 결정하기 위해 특정 실험실 조건에서 OD에 해당하는 CFU를 최적화하십시오.
2. 생쥐와 감염
- 8-10 주령의 수컷 C57BL / 6 마우스는 며칠 동안 동물 시설의 청정 공기 실에서 ~ 20g의 체중을 수용합니다.
- 감염 당일에는 한 손으로 마우스를 잡고 70 % 에탄올로 복부 피부를 닦은 다음 뒷다리를 펴서 복벽의 접근성을 향상시킵니다.
- 0.5 mL의 1 × 106 CFU/mL 박테리아 현탁액을 1 mL 주사기의 도움으로 복강내 주사하십시오. 따라서 각 마우스는 5 × 105 CFU를 수신합니다. 대조군, 감염되지 않은 마우스는 0.5 mL의 PBS 단독을 수용한다. 감염 후, 플레이트 배양물을 주입된 실제 CFU를 확인하기 위해, 이는 0.2-0.8 백만 CFU/0.5 mL에서 다양할 수 있다.
- 마우스를 배정 된대로 케이지에 다시 넣으십시오.
- 최상의 반응을 위해 감염 후 CO2 질식∼12-18 h를 사용하여 마우스를 희생시킨다. 일반적으로 감염된 모든 마우스는 96 시간 이내에 사망합니다. 일부 실험적 개입 하에서, 일부 마우스는 생존 할 수 있습니다. 96 시간 후에이 마우스를 안락사시킨다. 또한 체온이 33.2 °C 미만이고 96 h에서 급성 통증이있는 마우스를 인도적 인 종점으로 안락사시킵니다.
참고 :이 모델에서 일부 마우스는 살모넬라 균 주사 후 12 시간 후에 사망하기 시작할 수 있습니다. 따라서 여러 시점을 포함하는 실험을 적절하게 계획하십시오.
3. 장기의 CFU 평가
- CO2 질식에 의해 감염된 마우스를 희생시키고, 70% 에탄올에 담근 면화 조각으로 복부를 닦아낸다. 복부 피부를 엽니 다. 복막 세척액을 수집하는 방법에 대한 비디오 프로토콜에 대해서는 Ray and Dittel의 기사를 참조하십시오6. 복강을 자르고 미세 퍼지 튜브에 관심있는 기관을 수집하십시오. 또한, 패혈증이있는 마우스의 혈액이 빠르게 응고되고 양이 적기 때문에 희생 후 빨리 수집하십시오.
참고 :이 비디오는이 패혈증 모델에서 간이 광범위한 조직 병리학 적 손상을 겪을 때 간에서 장기 CFU의 열거를 보여줍니다. - 간장의 작은 조각을 자르고 미세 퍼지 튜브에 넣으십시오.
참고: 다음 단계로 진행하기 전에 최대 2-3시간 동안 얼음에 저장할 수 있습니다. - 무게를 측정하고 조각을 마이크로 원심분리 튜브로 옮깁니다. 바람직하게는, 적절한 균질화를 위해 ∼10-15 mg 무게의 조각을 절단한다. 장간막 림프절 (MLN) 또는 흉선과 같은 작은 장기의 경우 전체 장기를 사용하십시오.
- 0.5 mL의 1x PBS를 튜브에 첨가하고, 손 균질기를 사용하여 장기를 균질화한다. 장기가 완전히 균질화되어 있는지 확인하십시오. 0.5 mL의 1x PBS를 첨가하여 부피를 1 mL로 구성한다.
- 튜브를 200 × g 에서 4°C에서 5분 동안 원심분리한다.
- 상청액을 신선한 미세퍼지 튜브에 모으고 96웰 플레이트×서 10-1 및 10-2의 희석액을 준비합니다.
- 희석제 50 μL를 신선한 SS 한천 플레이트 상에 확산시키고, 플레이트를 37°C에서 12시간 동안 인큐베이션한다.
- 각 조건에 나타나는 콜로니의 수를 계산하고 방정식 (1)을 사용하여 장기 무게로 데이터를 정규화하십시오.
CFU/밀리그램 =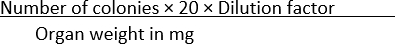 (1)
(1)
참고: 숫자 20은 플레이트당 콜로니를 CFU/mL로 변환하기 위해 수식에 사용됩니다. 이 숫자는 1 mL를 이 경우, 50 μL-플레이팅된 배양물의 주어진 부피의 양으로 나눔으로써 도달한다.
예를 들어, SS 한천 플레이트에서 100개의 콜로니가 발견되고, 여기서 10mg 무게의 균질화된 기관의 1× 10-1 희석액의 50 μL가 확산되는 경우,
CFU/mg =
4. 복막 삼출액의 다양한 면역 세포 집단의 유세포 분석
- Ray 및 Dittel6에 의해 이전에 기술된 바와 같이 복막 세포를 수집한다.
- 복막 세척액으로부터 세포 펠릿을 10% 소 태아 혈청(FBS)으로 보충된 RPMI 1 mL에 재현탁시킨다. 혈구세포계를 사용하여 복막 세척에서 총 세포 수를 열거한다. 모든 튜브가 0.2-0.5 백만 개의 셀을 받도록 셀 번호를 조정하십시오.
참고: 패혈증이 있는 마우스의 복막 세척에는 RBC가 포함될 수 있으며, 이는 출혈로 인해 나타날 수 있습니다. 복막 세포를 세는 동안 RBC를 제외하도록주의하십시오. 밝은 장 현미경에서 RBC는 면역 세포보다 훨씬 작게 나타납니다. 이들은 평평한 디스크 또는 도넛으로 나타나며 둥글고 중앙에 들여 쓰기가 있지만 비어 있지는 않습니다. RBC를 용해시키는 단계는7이 추가될 수 있다. - 세포를 200 × g 에서 4°C에서 10분 동안 스핀다운하고, 상청액을 버리고, 세포를 1x 차가운 PBS로 1x 세척한다. 세포를 200 × g 에서 4°C에서 10분 동안 원심분리한다.
- PBS 중의 5% FBS 및 0.02% 나트륨 아지드로 구성된 차단 완충액에서 제조된 FcR 차단제 (1:400 희석)를 사용하여 PECs 상의 Fc 수용체를 차단한다. 얼음 위에서 15 분 동안 배양하십시오.
- 세포를 200 × g 에서 4°C에서 10분 동안 원심분리한다. 상층액을 버리십시오. 블로킹 완충액에 관심있는 플루오로크롬-컨쥬게이션된 항체를 희석한다. 항-마우스 LY6G의 1:500 희석액을 사용하여 호중구를 염색한다.
참고: 다른 면역 세포 집단은 또한 예를 들어, B 세포에 대한 항-마우스 B220, T 세포에 대한 항-마우스 CD3, 및 대식세포에 대한 항-마우스 F4/80을 사용하여 검출될 수 있다. - 항체의 희석된 용액 200 μL에 ∼0.2백만 세포를 분리된 튜브에 인큐베이션한다. 음성 대조군으로서, 염색되지 않은 대조군을 위해 각각의 플루오로크롬 타입에 하나의 튜브를 따로 두어 항체없이 200 μL의 블로킹 완충액으로 세포를 인큐베이션한다.
- 샘플을 얼음 위에서 45분 동안 인큐베이션하고 15분마다 간헐적으로 두드리십시오.
- 세포를 4°C에서 10분 동안 200 × g 에서 원심분리한다. 상층액을 버리십시오. 며칠 동안 보관해야하는 경우 실온에서 ~ 15 분 동안 4 % 파라 포름 알데히드로 세포를 고정하십시오. 그러나 유세포 분석기에서 갓 염색 된 샘플로부터 데이터를 수집하는 것이 가장 좋습니다.
- 세포를 200 μL의 FACS 염색 완충액 (PBS 중 2% FBS)에 재현탁시켰다. 유세포 분석기에서 데이터를 수집합니다.
Access restricted. Please log in or start a trial to view this content.
결과
이러한 특정 모델을 이용한 숙주 면역 반응의 상세한 특성화는 이전 간행물 8,9에 제시되어 있다. 설명된 프로토콜의 몇 가지 대표적인 결과가 이 섹션에 설명되어 있습니다. 이 모델은 S의 전신 감염을 유도하는 것을 목표로 한다. 티피뮤륨은 박테리아 배양물을 복강내 주사하여 패혈증을 유도한다. 감염을 확인하기 위해, 패혈성 마우스로부터의...
Access restricted. Please log in or start a trial to view this content.
토론
이 글은 살모넬라 티피뮤리움의 복강내 주사에 의해 심각한 형태의 세균성 패혈증을 유도하는 방법을 설명한다. 이 모델은 살모넬라 티피뮤리움이 세포내 병원체이고, 따라서, 병원성이 높고, 그람 음성 패혈증의 임상적으로 관련된 상태를 모방하기 때문에 다른 모델보다 유리하다. 이 모델에서 복막염 패혈증의 결과는 전신적이며, 감염 후 96 시간 이내에 100 % 사망률이 있습니다. ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
우리는 연구를 위해 생쥐를 공급해 주신 중앙 동물 시설, IISc에 감사드립니다. 이 연구는 인도 정부의 생명 공학 및 과학 및 공학 연구위원회에서 DpN에 대한 보조금으로 자금을 지원했습니다. DBT-IISc 프로그램 및 DST-FIST 보조금의 인프라 지원은 크게 인정됩니다. DpN 연구소의 이전 및 현재 구성원 모두에게 도움을 주셔서 감사합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| 1 mL Sterile Syringe with 26 G needle | Beckton Dickinson, Singapore | 303060 | |
| 1.5 mL Microcentrifuge Tube | Tarsons, USA | 500010 | |
| 10 mL Sterile Syringe with 21 G needle | Beckton Dickinson, Spain | 307758 | |
| 50 mL Conical Flask | Tarsons, USA | 441150 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546041 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546021 | |
| Cell spreader | VWR, USA | VWRU60828-680 | |
| Dulbecco’s Phosphate Buffered Saline | HiMedia, Mumbai, India | TS1006 | |
| Ethanol | Merck | 100983 | |
| FcR blocker | BD Biosciences | 553142 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC Rat anti-mouse Ly6G (Clone 1A8) | BD Pharmingen | 551460 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Hand based Homogenizer | - | - | |
| Hemocytometer (Neubauer counting chamber) | Rohem, India | I.S. 10269 | |
| Luria Bertani Broth | HiMedia, Mumbai, India | M1245 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Petriplates | Tarsons, USA | 460091 | |
| RPMI | Himedia, Mumbai, India | AT060-10X1L | |
| Salmonella-Shigella Agar | HiMedia, Mumbai, India | M108 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Equipments | |||
| Centrifuge | Kubota | ||
| Flow cytometer | BD FACSverse | ||
| Incubator | N-biotek | ||
| Spectrophotometer | Shimadzu | ||
| Weighing machine | Sartorius |
참고문헌
- Hotchkiss, R. S., et al. Sepsis and septic shock. Nature Reviews Disease Primers. 2 (1), 1-21 (2016).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: Analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Vincent, J. L., et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 302 (21), 2323-2329 (2009).
- Lewis, A. J., Seymour, C. W., Rosengart, M. R. Current murine models of sepsis. Surgical Infections. 17 (4), 385-393 (2016).
- Ta, L., Gosa, L., Nathanson, D. A. Biosafety and biohazards: Understanding biosafety levels and meeting safety requirements of a biobank. Biobanking. 1897, 213-225 (2019).
- Ray, A., Dittel, D. N. Isolation of Mouse Peritoneal Cavity Cells. Journal of Visualized Experiments: JoVE. (35), e1488(2010).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-protocol. 5 (20), 1631(2015).
- Yadav, S., et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella Typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity. Free Radical Biology & Medicine. 116, 73-87 (2018).
- Verma, T., et al. Cell-free hemoglobin is a marker of systemic inflammation in mouse models of sepsis: A Raman spectroscopic study. Analyst. 146 (12), 4022-4032 (2021).
- Cassado, A. D. A., Lima, M. R. D., Bortoluci, K. R. Revisiting mouse peritoneal macrophages: Heterogeneity, development, and function. Frontiers in Immunology. 6, 225(2015).
- Yadav, S., Verma, T., Chattopadhyay, A., Nandi, D. Factors affecting the pathophysiology of sepsis, an inflammatory disorder: Key roles of oxidative and nitrosative stress. Indian Journal of Inflammation Research. 3 (1), 2(2019).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유