Method Article
폐렴의 해결을 평가하기 위한 실험모델
Erratum Notice
요약
이 원고는 생쥐에서 폐렴의 전염성 모델을 확립하고 손상 해결의 각각의 특성과 함께 박테리아 성장 및 기관 내 점안 방법을 설명합니다. 고차원 유세포 분석을 사용하여 면역 환경을 평가하는 새로운 접근 방식도 설명합니다.
초록
급성 호흡곤란 증후군(ARDS)은 급속한 폐포 손상과 심각한 저산소혈증을 특징으로 하는 급성 폐 손상을 일으킵니다. 이는 차례로 높은 이환율과 사망률로 이어집니다. 현재로서는 인간 ARDS의 복잡성을 요약하는 전임상 모델이 없습니다. 그러나 폐렴의 전염성 모델(PNA)은 ARDS의 주요 병태생리학적 특징을 복제할 수 있습니다. 여기에서는 C57BL6 마우스에서 살아있는 폐렴구균 및 폐렴균(Klebsiella pneumoniae )의 기관 내 점안에 의해 유도된 PNA 모델을 설명합니다. 모델을 평가하고 특성화하기 위해 부상을 유발한 후 체중과 폐 손상 마커를 측정하기 위한 기관지 폐포 세척(BAL)의 연속 측정을 수행했습니다. 또한 세포 수 및 감별, BAL 단백질 정량화, 시토스핀, 박테리아 콜로니 형성 단위 수 및 조직학을 위해 폐를 채취했습니다. 마지막으로, 고차원 유세포 분석을 수행했습니다. 우리는 이 모델을 폐 손상의 초기 및 후기 해결 단계에서 면역 환경을 이해하기 위한 도구로 제안합니다.
서문
급성 호흡곤란 증후군(ARDS)은 중환자실(ICU) 환자의 약 10%와 기계 환기를 받는 환자의 최대 23%에 영향을 미치는 흔한 치명적이고 무력한 증후군으로 병원 사망률이 35%-46%1에 이릅니다. 또한 최근의 COVID-19 전염병은 ARDS를 연구하는 것의 중요성을 다시 한 번 강조했습니다. COVID-19 양성 사례는 ARDS 사망률의 증가를 설명하며, 이는 약물 치료의 한계를 부각시키고 있다2.
인간의 경우, ARDS는 저산소혈증(PaO2/FiO2 < 300)의 급속한 발병과 과도한 폐포-모세혈관 투과성 및 폐포염으로 인한 비수압성 양측 폐부종의 증거를 특징으로 한다3. ARDS는 전통적으로 다양한 모욕에 이차적으로 발생하는 급성 폐 손상(ALI)의 패턴으로 설명되어 왔지만, 세균성 및 바이러스성 폐렴(PNA)은 여전히 가장 흔한 원인 중 하나입니다. 세 가지 주요 병태생리학적 단계, 즉 삼출기, 증식기, 섬유화 단계가 설명되었으며, ARDS의 두 가지 주요 특징은 조절 장애, 염증 조절 장애, 폐포 모세혈관 파괴4. 이러한 과정에서 염증성 사이토카인(예: 종양괴사인자[TNF-α], 인터루킨[IL-1β, IL-6, IL-8 등])의 방출, 호중구 및 염증성 대식세포의 유입, 단백질이 풍부한 액체의 범람에 의해 폐포 손상이 발생합니다. 궁극적으로 이러한 사건은 고르지 못하고 양측 폐포 손상으로 이어진다 5,6,7,8.
조기 폐 손상 및 염증에 대한 이해에 상당한 진전이 있었지만 PNA의 해결 기전은 덜 알려져 있으며 향후 기계론적 연구의 초점이 되어야 합니다. 이 방법 논문의 주요 목적은 연구자에게 ARDS의 주요 병태생리학적 특징을 복제할 수 있는 전염성 폐렴의 부상 해결 모델을 제공하는 것입니다. 우리는 이 모델이 폐 염증의 해결과 회복의 기저에 있는 생물학적 메커니즘을 더 잘 이해하는 데 도움이 될 것이라고 제안하며, 따라서 구조 치료를 위한 플랫폼 역할을 할 것입니다.
ARDS에서 발생하는 주요 생리병리학적 단계는 ALI의 전임상 동물 모델에서 재현될 수 있으며, 여기에는 염증 반응, 조직 손상, 생리적 기능 장애, 폐포염 및 폐포-모세혈관 장벽의 변화에 대한 조직학적 증거가 포함되어야 한다9. PNA 및 ALI를 유도하는 마우스 모델은 높은 재현성, 빠른 증식, 기계 및 분자 연구를 수행하기 위한 여러 도구의 가용성으로 인해 유리합니다. 인간 ARDS9의 모든 특징을 완전히 요약하는 단일 모델은 없다.
마우스의 PNA 모델은 인간에서 감염성 ARDS에 의해 생성되는 주요 병태생리학적 기전, 예를 들어 빠른 발병, 조직학에서의 조직 손상의 증거, 폐포-모세혈관 장벽 손상, 염증 반응의 증거 및 생리적 기능 장애와 같은 주요 병태생리학적 기전을 복제할 수 있으면서도 완만한 사망률을 생성한다10. 감염성 모델은 병원체의 국소 또는 전신 전달에 의해 유도될 수 있으며, 비강 내, 기관 내 및 정맥 투여가 가장 빈번한 투여 경로입니다. 기관 내 경로를 통해 감염원을 폐에 직접 접종할 수 있어 에어로졸화를 줄이고 전달을 최적화할 수 있습니다11,12.
여기에는 살아있는 연쇄상구균 폐렴균(Spn) 또는 폐렴구균( Kp )의 기관 내 점안에 의한 PNA의 전임상 쥐 모델에 대한 방법론이 설명되어 있습니다. 이 모델은 박테리아 PNA에 의해 생성된 ARDS의 우수한 대체물을 나타내며 다음과 같은 몇 가지 장점을 가지고 있습니다: 인간 PNA-ARDS의 일반적인 원인(커뮤니티 및 병원 획득); 높은 재현성; 사망률과 부상은 강력한 염증 반응을 나타내기 위해 쉽게 적정할 수 있으며(다양한 정도의 폐 염증 모델링) 폐포염 및 폐포 기능 장애로 이어질 수 있습니다. 폐 손상의 초기 및 후기 단계 평가 및 해결; PNA-ARDS의 여러 단계에서 치료 전략의 평가.
프로토콜
이 연구에 설명된 모든 동물 프로토콜은 동물 프로토콜 MO21M160에 대해 존스 홉킨스 대학교 의과대학의 ACUC(Institutional Animal Care and Use Committee)에서 승인되었습니다. 또한, 실험은 동물 연구에 대한 기관, 주 및 연방 규정에 따라 수행되었습니다.
주의: 아래에 설명된 모든 프로토콜의 복제는 생물안전 캐비닛 아래의 모든 기관 BSL-2 지침에 따라 생물안전 레벨 2(BSL-2) 캐비닛에서 수행해야 합니다.
1. 상업적인 반복에서 세균성 주식을 도금하기
참고: 이 프로토콜은 공급자로부터 얻은 컬티 루프부터 시작하여 Spn (ATCC 49619) 및 Kpn (ATCC 43816)에 대한 박테리아 스톡을 성장시키는 데 사용할 수 있습니다(자세한 내용은 재료 표 참조).
- 인큐베이터에서 37°C에서 15분 동안 5% 양혈 한천 플레이트를 데웁니다. 이를 위해 세포 인큐베이터를 사용할 수 있습니다.
- 후드 아래에서 박테리아 접종 루프에서 칼집을 제거하고 지그재그 패턴을 따라 한천 플레이트에 줄무늬를 그리며 조심스럽게 펼칩니다. 별도의 플레이트를 복제본으로 사용하여 이 단계를 반복합니다. 최대 5개의 플레이트에 동일한 루프로 줄무늬를 만들 수 있습니다.
- 최적의 박테리아 성장을 위해 37°C에서 밤새 플레이트를 배양합니다. 3 일 동안 매일 박테리아를 통과시킵니다. 37 ° C에서 15 분 동안 혈액 한천 플레이트를 따뜻하게하고, 일회용 접종 루프를 사용하여 첫 번째 한천 플레이트에서 15-20 콜로니를 취한 다음 새롭고 미리 따뜻해진 한천 플레이트에 펴 바릅니다. 플레이트에 적절하게 라벨을 붙입니다.
2. 향후 사용을 위한 박테리아 성장 및 보관
- 3일 후 줄무늬 고리가 있는 혈액 한천 플레이트에서 최대 30개의 콜로니를 선택하고 Todd Hewitt 육수(TH 육수)가 들어 있는 250mL 플라스크에 직접 넣습니다. 37 ° C에서 250 rpm에서 흔들어 약 4 시간 동안 5 % CO2 로 배양합니다.
- OD620nm 가 0.3에 도달할 때까지 15분마다 부분 표본을 채취하여 측정하며, 이는 mL당 약 3 x 108 콜로니 형성 단위(CFU)에 해당합니다.
- 새로운 박테리아 스톡 1mL를 즉시 2mL 극저온 바이알에 분취합니다. 갓 분양된 바이알을 액체 질소에 5분 동안 급속 얼립니다. 박테리아의 부분 표본을 -80 °C 냉동고에 보관하십시오(바이알은 효능을 잃기 전에 최대 6-8개월 동안 사용할 수 있음).
- 7일 동안 얼린 후 부분 표본은 동물 연구에 사용할 수 있습니다. 따라서 박테리아의 새로운 농도를 결정하십시오.
3. 기관 내 점안을 위한 박테리아 해동
- 셰이커에서 37°C에서 10분 동안 혈액 한천 플레이트를 데웁니다. 냉동실에서 새 스톡 바이알 중 하나를 꺼내 37°C 수조에서 약 2분 동안 부드럽게 교반하여 해동합니다. 따뜻한 물로 O-링이나 캡을 만지지 마십시오.
- 박테리아 군체를 수동으로 계산하기 위해 혈액 한천 플레이트에 플레이트를 만듭니다. 1 x 10-6 희석을 수행하고 마지막 희석에서 200 μL를 예열된 혈액 한천 플레이트에 플레이트합니다. 이 작업을 중복으로 수행하십시오.
- 박테리아의 최적 성장을 위해 37 °C에서 밤새 플레이트를 배양합니다. 다음 날, 다음 공식을 적용하여 새로운 박테리아 농도를 결정하십시오: CFU/mL = (콜로니 수 x 희석 계수) / 도금된 스톡의 부피
4. 살아있는 박테리아의 기관내 점안
참고: 이 프로토콜은 기관 내 50μL의 부피를 주입하도록 최적화되었습니다. 박테리아 스톡은 최대 6-9개월 동안 보관할 수 있습니다. 각 바이알에 박테리아 CFU가 있는지 확인하려면 각 실험 전에 플레이트하고 위에서 설명한 대로 박테리아 스톡 CFU를 계산한 다음 후속 희석을 위해 TH 육수를 사용해야 합니다.
주의: 생물 안전 캐비닛 아래에서 멸균 수술 기구를 사용하여 설치류 생존 절차를 수행하십시오.
- 케타민 100mg/kg과 아세틸프로마진 2.5mg/kg을 복강내 주사하여 마우스를 마취합니다. 한 번에 주입되는 마우스 수에 대해 반복합니다.
알림: 생쥐는 동물 취급을 용이하게 하기 위해 이소플루란에 노출될 수 있습니다. 그러나, 심각한 동물의 고통을 일으키지 않고 복강 내 마취제를 주입할 수 있는 숙련된 핸들러는 이소플루란 노출을 피할 수 있습니다. 주입할 마우스의 수는 외과 의사의 전문 지식에 따라 다릅니다. - 모든 쥐가 적절한 마취를 거친 후 꼬리 꼬집기로 마취를 확인합니다. 마취된 쥐를 깨끗하고 멸균된 표면에 놓고 앞니로 동물을 매달아 놓고 앞다리를 부드럽게 테이프로 붙입니다(그림 1A).
참고: 동물의 건강을 보장하려면 마취된 모든 동물에게 각막 윤활제를 제공하십시오. 카르복시메틸셀룰로오스 점안액을 사용할 수 있으며, 눈당 한 방울을 바를 수 있습니다. - 목 부위를 면도하고 클로르헥시딘과 70% 알코올로 해당 부위를 소독합니다. 수술용 가위를 사용하여 1cm의 표재성 정중선 목을 절개하여 기관을 시각화합니다(그림 1B). 한 번의 작은 절개로 충분하지만 지방 조직이 많이 보이면 지방 조직을 세로로 조심스럽게 절개하여 기관을 시각화합니다.
알림: 팁 전용 기술을 통해 멸균 장갑과 멸균 기구를 사용하십시오. 시술이 멸균 상태에서 수행되는 경우 감염 위험이 최소화됩니다. - 겸자를 사용하여 각 쥐를 삽관합니다. 혀를 바깥쪽으로 부드럽게 당기고 입을 통해 20G의 혈관 카테터를 도입하여 카테터를 기관 안으로 전진시킵니다. 삽관을 용이하게 하기 위해 기관에 부드러운 압력을 가합니다.
참고: 기관이 쥐 몸체 앞쪽에 있기 때문에 카테터 끝을 약간 구부리면 마우스를 성공적으로 삽관할 수 있는 각도를 얻는 데 도움이 됩니다. 목 절개는 주로 시각화 목적으로 수행됩니다. 또는 작업자가 맹목적으로 기관을 삽관할 수 있습니다. - 삽관 후 마우스를 인공호흡기에 연결하여 삽관을 확인합니다. 이 절차에 사용되는 일반 인공호흡기 매개변수는 200μL의 스트로크 부피와 분당 200스트로크입니다. 빠르고 쉽게 확인할 수 있도록 인공호흡기 속도를 잠시 높이거나 낮춥니다.
- 삽관을 확인한 후 인공호흡기에서 마우스를 분리하고 200μL 피펫 겔 로딩 팁을 사용하여 혈관 카테터를 통해 50μL의 세균 제제를 조심스럽게 주입합니다. 대조군 마우스의 경우 50μL의 멸균 TH 육수를 주입합니다.
- 세균성 병원체를 주입한 후 마우스를 호흡기에 다시 연결하여 호흡을 다시 시작하도록 돕습니다. 30-60초 동안 호흡보호구에 마우스를 올려 놓으십시오. 모든 쥐에게 주사한 후 호흡을 모니터링하십시오. 호흡 패턴이 느려지면 생쥐를 인공호흡기에 다시 연결합니다.
- 피부에 작은 접착제 한 방울을 떨어뜨려 절개 부위를 봉합합니다. 피부 주름을 모으고 접착제가 마를 때까지 부드러운 압력을 가합니다.
- 회복을 위해 쥐를 가열 패드에 놓고 충분한 의식을 회복할 때까지 면밀히 모니터링합니다. 완전히 회복되면 마우스를 케이지에 다시 넣으십시오. 수술 후 통증/고통 관리를 위해 마우스는 0.05-0.1mg/kg의 투여량으로 부프레노르핀으로 치료할 수 있습니다(SC).
참고: 체중 감소가 20% 이상이거나 시술 후 무기력, 물이나 음식에 접근할 수 없음, 호흡 곤란, 외부 자극에 대한 반응 장애 또는 정신 각성 저하와 같은 심각한 고통을 겪는 동물은 안락사시켜야 합니다.
5. 기관지 폐포 세척 및 폐 적출
- 쥐를 5% 이소플루란이 들어있는 밀폐된 용기에 넣어 안락사시킵니다. 쥐가 호흡을 멈춘 후 1분 동안 이소플루란에 계속 노출시킵니다. 안락사를 확인하기 위해 개흉술을 시행합니다.
참고: 육안 및 신체 검사로 안락사를 확정합니다. 심장 박동이 멈췄고 쥐가 숨을 쉬지 않았을 것입니다. 점막은 하얗거나 창백해야 합니다. - 깨끗한 수술 보드에 마우스를 누운 자세로 놓고 앞니에 매달아 놓습니다. 쥐 피부에 70% 에탄올을 뿌립니다. 수술용 가위를 사용하여 쥐의 기관을 시각화하기 위해 작은 표재성 정중선 목 절개를 만듭니다.
- 20G 카테터로 기관을 캐뉼레이션합니다. 1mL 주사기를 사용하여 1mL의 무칼슘 인산염 완충 식염수(PBS)를 기관 내에 조심스럽게 추가합니다. 폐가 완전히 확장되도록 한 다음 동일한 주사기를 사용하여 액체를 흡인합니다. 총 2mL에 대해 이 단계를 반복합니다.
- BAL을 2mL 부분 표본으로 옮깁니다. 최종 부피 2mL에 대해 이 단계를 두 번 수행합니다. 폐포 공간 붕괴의 위험이 높으므로 한 번에 1mL 이상으로 폐를 세척하지 마십시오.
- 흉강을 열고 가위와 집게를 사용하여 폐, 심장, 기관을 노출시킵니다. 횡격막을 조심스럽게 절개하고 흉곽을 제거합니다. 폐 조직이 끼지 않도록 주의하십시오.
- 복부 대동맥을 경절하여 출혈을 허용합니다. 가위를 사용하여 우심실을 약 2mm의 작은 절개로 폐 조직을 관류하고 20G 카테터를 사용하여 5mL의 차가운 PBS를 주입합니다. PBS는 폐에 관류해야 합니다. 적절한 관류가 수행되면 폐 조직이 하얗게 창백해지고 PBS는 복부 대동맥을 통해 혈관 내 구획을 떠납니다.
- 조심스럽게 폐를 추출하고 기관에서 절개하여 조직학 또는 단세포 현탁액에 대한 추가 처리를 수행합니다.
- 조직학을 위해 처리하는 경우 20G 카테터를 조심스럽게 삽입하여 포르말린 용액(중성 완충 10%)으로 폐를 최대 25cm H2O까지 팽창시킵니다. 폐가 막히면 기관 아래에 약 5cm 길이의 3.0 봉합 줄을 통과시키고 포르말린이 폐 조직에 머물도록 두 번 단단히 묶습니다. 나머지 조직에서 폐를 부드럽게 절개하고 10mL의 포르말린 용액이 들어 있는 15mL 원뿔형 튜브에 넣습니다.
6. 기관지폐포 세척 처리
- BAL을 4°C에서 500 x g 으로 5분 동안 원심분리합니다. 별도의 튜브에서 cell-free 상층액을 제거하고 -80 °C에서 보관합니다.
참고: 단백질 정량화(예: BCA 분석13) 또는 특정 바이오마커 또는 사이토카인 측정(ELISA 분석 및 MSD 및 Luminex와 같은 플랫폼을 사용한 다중 분석)을 포함하여 BAL 상층액에서 추가 분석을 수행할 수 있습니다. - 1분 동안 100μL의 용해 완충액을 추가하여 적혈구를 용해합니다. PBS 1mL를 첨가하여 용해 반응을 중화합니다. BAL을 4°C에서 500 x g 으로 5분 동안 원심분리하고 상층액을 제거합니다.
- PBS(100-300 μL, 세포 펠릿 크기 기준)에 세포를 재현탁시킵니다. 수동 또는 자동 세포 계수를 통해 0.4% 트리판 블루 염색으로 세포 계수를 수행합니다. 추가 테스트를 위해 유세포 분석 염색 및/또는 액체 질소에 동결 보존(동결 보존 용액에 재현탁)을 위해 나머지 펠릿을 사용하십시오.
7. 단세포 현탁액을 위한 폐 가공
- 나머지 조직에서 폐를 부드럽게 절개하고 5mL의 차가운 PBS가 들어 있는 15mL 원뿔형 튜브에 넣습니다. PBS에서 폐를 제거하고 종이 타월을 사용하여 말리십시오.
- DNase 1mg과 콜라겐 분해 효소 5mg을 저포도당 Dulbecco's modified Eagle's medium(DMEM) 1mL에 첨가하여 소화 칵테일을 준비합니다. 폐를 1mL의 분해 칵테일이 들어 있는 C-튜브로 옮깁니다.
- C-튜브를 조직 해리기로 옮기고 폐 조직 처리를 위한 표준화된 프로토콜을 따릅니다14.
- 10mL의 콜드 PBS를 C-튜브에 넣고 적절하게 혼합합니다. 50mL 코니컬 튜브 위에 70μm 셀 스트레이너를 사용하여 단일 셀 현탁액을 여과합니다. 필터링을 두 번 수행합니다.
- 현탁액을 4°C에서 500 x g 으로 5분 동안 원심분리합니다. 상층액을 조심스럽게 디캔팅하고 실온에서 1분 동안 용해 완충액 1mL를 추가합니다. 10mL의 차가운 PBS를 추가하여 용해 반응을 중지하고 상층액을 제거합니다.
- 현탁액을 4°C에서 500 x g 으로 5분 동안 원심분리합니다. 상층액을 조심스럽게 디캔팅하고 10mL의 콜드 PBS를 추가합니다.
- 수동 또는 자동 세포 계수를 통해 trypan blue 염색으로 세포 계수를 수행합니다. 유세포 분석 염색을 위해 세포 펠릿을 사용하거나 추가 테스트를 위해 액체 질소에서 동결 보존합니다.
결과
위에서 설명한 절차를 통해 마우스에서 세균성 폐렴 유발 폐 손상의 기저에 있는 병태생리학적 메커니즘을 모델링할 수 있었습니다. 모델링을 시작하기 위해 Jackson Laboratory에서 C57BL/6 야생형(WT) 마우스를 얻어 연구소의 동물 시설에서 사육했습니다. 생후 8주된 수컷 WT C57BL/6 마우스는 TH 육수(대조군), 3 x 106 CFU의 생 Spn 또는 200 CFU의 생 Kpn의 기관 내 접종을 받았습니다. 감염 후, 마우스는 각각 Spn 및 Kpn에 대해 6일 및 10일 동안 모니터링되었습니다. 감염된 그룹은 감염되지 않은 대조군에 비해 체중이 낮았지만, Spn 그룹은 체중을 기준선까지 회복한 반면, Kpn에 감염된 마우스는 감염 후 6일 후 느린 회복을 보였습니다(그림 2A). 연구 기간 동안 체중이 20% 이상이어서 안락사를 받아야 하는 쥐는 없었으며, 통증과 괴로움의 증거는 없었다.
우리는 서로 다른 간격에 걸쳐 폐 손상을 측정했다. BAL 단백질 농도와 BAL 및 폐의 총 세포 수는 감염된 그룹에서 현저하게 높았습니다(그림 2). 두 모델 모두에서 염증 과정을 보여주는 대표적인 조직학적 절편은 접종 후 2일, 4일, 6일째에 얻어졌으며(그림 3), Kpn에 감염된 마우스(그림 4)에서 10일째에도 지속적인 폐포 염증의 증거를 보여주었습니다. Kpn에 감염된 마우스는 10일째까지 손상이 계속된 반면(그림 2 및 그림 4), Spn에 감염된 마우스는 6일째까지 폐 염증이 해결되었습니다(그림 2 및 그림 3).
폐 단일 세포 현탁액은 형광 활성화 세포 분류(FACS)에서 18색 패널을 사용하여 Spn 모델에서 감염 후 6일차에 고차원 유세포 분석으로 면역 환경을 구별하는 데 사용되었습니다. t-SNE(t-distributed stochastic neighbor embedding)를 사용하면 면역 세포 구성의 전반적인 차이를 시각화할 수 있으며, 자연살해세포(CD45+, CD3+, NK1.1+)를 포함한 과립구(CD45+, CD11b+, CD24+), 간질성 대식세포(CD45+, CD11b+, MHC-II-, CD24-, CD64-), B세포(CD45+, CD19+) 및 T세포(CD45+, CD3+)의 수가 증가한 것으로 나타났습니다. 그림 5와 같습니다. 게이팅 전략은 그림 6에 나와 있습니다.
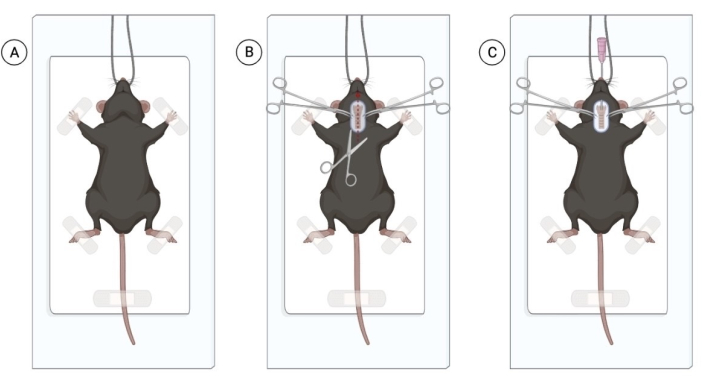
그림 1: 살아있는 박테리아의 기관 내 점안을 위한 수술 절차. (A) 앞니에 매달려 있는 멸균 수술 영역에서 마우스의 위치. (B) 절개 부위 및 기관 노출. (C) 20G 카테터를 삽입하는 삽관 과정. Biorender.com 로 만든 그림입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
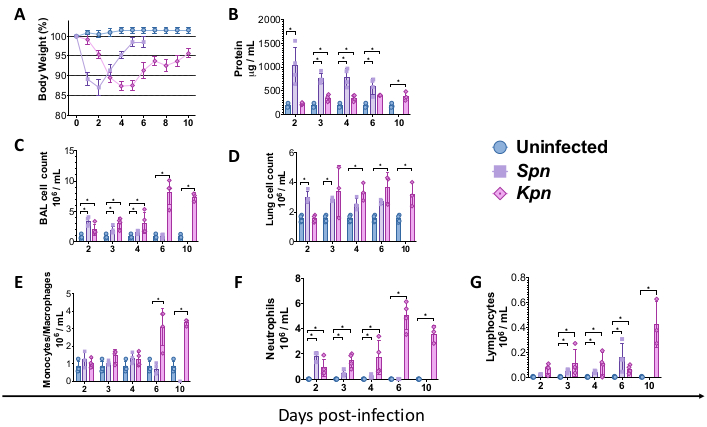
그림 2: 폐렴 모델 후 급성 폐 손상(ALI) 프로필. (A) 기준선 대비 시간 경과에 따른 체중, 대조군 대 Kpn 및 Spn(n = 4, 그룹당). (B) BCA 분석에 의한 BAL 총 단백질 정량화(n = 4, 그룹당). (C) 제어 (n = 3), Kpn (n = 4) 및 Spn (n = 3)의 BAL 총 셀 수. (D) 대조군의 폐 총 세포 수(n = 3), Kpn(n = 4) 및 Spn(n = 3). (E-G) 대조군(n = 3), Kpn(n = 4) 및 Spn(n = 3)에서 BAL cytospin의 수동 조직학 수에 의한 BAL 세포 차이. 통계적 검사는 개별 t-test로 수행되었으며, 감염되지 않은 대조군과 감염된 그룹을 비교했습니다. *p < 0.05. 데이터는 각 그림에 대해 표준 오차(SE)를 사용하여 표시됩니다. y축은 모든 패널의 감염 후 일수입니다. 약어: BAL = 기관지 폐포 세척; Spn = 폐렴 연쇄상 구균; Kpn = 폐렴균(Klebsiella pneumoniae). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
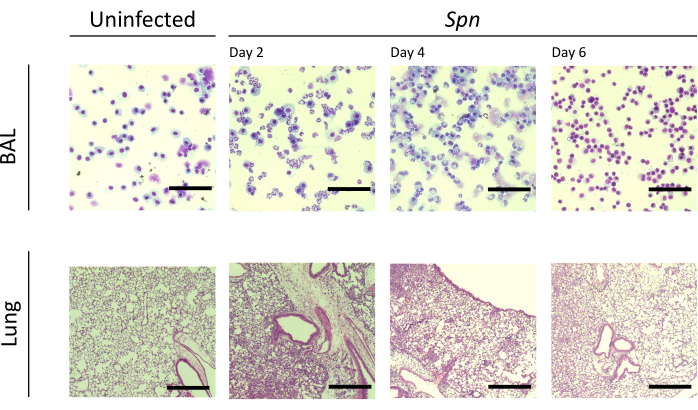
그림 3: Spn 감염 중 폐 조직병리학적 소견. Spn의 기관 내 감염 후 및 2일, 4일, 6일째에 대표적인 BAL 및 폐 절편의 조직학적 절편의 Hematoxylin 및 eosin(H&E) 염색. BAL 배율 = 100x; 폐 확대 = 10x. 약어: BAL = 기관지 폐포 세척; Spn = 폐렴 연쇄상 구균. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
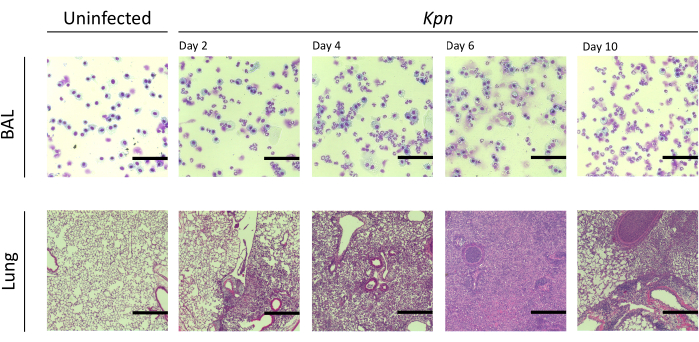
그림 4: Kpn 감염 중 폐 조직병리학적 소견. 2일, 4일, 6일, 10일에 Kpn 의 기관 내 감염 후 대표적인 BAL 및 폐 절편의 조직학적 절편의 Hematoxylin 및 eosin(H&E) 염색. 이미지는 고출력 배율(눈금 막대 = 50μm)을 보여줍니다. 약어: BAL = 기관지 폐포 세척; Kpn = 폐렴균(Klebsiella pneumoniae). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
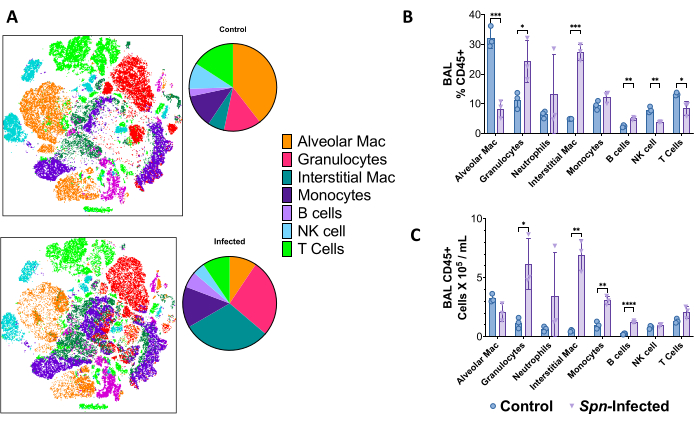
그림 5: Spn 감염 6일 후 multicolor 유세포 분석에 의한 면역 세포 풍경. (A) T-SNE(T-distributed stochastic neighbor embedding)를 사용하여 감염되지 않은 대조군과 감염된 그룹을 비교하여 폐의 면역 세포 집단(CD45+)을 시각화했습니다. (B) 폐에 있는 총 CD45+ 세포의 면역 세포 빈도 요약. (C) 각 개별 집단의 총 세포 수. 통계적 비교는 대조군과 감염자 간의 t-검정으로 수행되었습니다. *p < 0.05, **p < 0.01, ***p < 0,001. 데이터는 각 그림에 대해 표준 오차(SE)를 사용하여 표시됩니다. 약어: BAL = 기관지 폐포 세척; Spn = 폐렴 연쇄상 구균. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 기준선 시점과 폐렴 후 폐의 면역 세포 하위 집단을 식별하기 위한 게이팅 전략. BAL 및 폐 세포 현탁액은 multicolor 유세포 분석을 위해 염색을 거쳤습니다. 먼저 SSC-A 및 FSC-A를 사용하여 파편을 게이트아웃하고 단일 셀은 두 가지 전략(SSC-W 대 SSC-H 및 FSC-W 대 FSC-H)으로 게이트했습니다. 살아있는 세포는 SSC-A에 비해 살아있는/죽은 감별기를 사용하여 식별되었습니다. 후속적인 세포 집단은 이전에 확인된 마커 15에 의해 확인되었다. 약어: BAL = 기관지 폐포 세척. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
PNA의 실험적 쥐 모델은 ARDS의 손상 및 해결의 기저에 있는 세포 및 분자 메커니즘을 평가할 수 있는 플랫폼을 제공합니다. 평가할 수 있는 병태생리학적 요소에는 초기 염증 경로, 세균 제거, 동적 면역 환경 변화, 염증 해결, 섬유 증식, 상피 및 혈관 복구가 포함된다16. 그러나 이 폐렴 유발 폐 손상 모델을 복제할 계획을 세울 때는 연령, 성별, 마우스 변형률, 내인적 숙주 요인(예: 면역 저하 상태), 사용된 특정 병원체 및 박테리아 부하, 시술을 수행하는 직원의 경험 등 여러 측면을 고려해야 합니다.
PNA는 ARDS의 주요 원인 중 하나입니다. 우리는 각각 인간에서 지역사회 및 병원 획득 PNA의 흔한 원인인 라이브 Spn과 Kpn을 사용하기로 결정했습니다17. 연구자의 가설에 가장 적합한 원하는 사망률 및 부상 해결 프로필을 달성하기 위해 살아있는 박테리아의 투여량을 적정하여 PNA의 박테리아 모델을 최적화하는 것을 제안합니다. 당사는 폐포 염증, 폐포 혈관 장벽 파괴 및 장기 기능 장애를 유발하는 마우스에서 Spn에 대해 3 x 106 CFU 및 Kpn에 대해 200 CFU의 기관 내 박테리아 접종을 최적화했습니다(그림 2). 그러나 다른 출처 또는 중복 루프 내의 박테리아 배치는 동일한 균주와 CFU를 사용하는 경우에도 다른 정도의 염증 및 손상을 나타낼 수 있습니다.
따라서 이 원고에 제시된 결과를 복제하려면 연구원은 여기에 설명된 박테리아 농도부터 시작해야 합니다. 그러나 유사한 모델 프로필을 얻기 위해 용량을 늘리거나 줄여야 할 수도 있습니다. 따라서 사용되는 모든 새로운 박테리아 배치는 잠재적인 부상 해결 효과에 맞게 최적화되어야 합니다. 당사는 자가 해결(Spn)과 느리게/비해결(Kpn)이라는 두 가지 다른 해결 결과를 가진 강력한 PNA 모델을 제시하며, 이는 연구자가 면역학적 메커니즘을 평가하고 특히 최대 감염 시점 또는 그 이후(예: 감염 후 2일) 치료 개입을 테스트할 수 있는 플랫폼 역할을 할 수 있습니다.
연령, 성별, 긴장 및 유전적 요인이 부상 해결 패턴의 동역학에 영향을 미친다16. 예를 들어, 성별은 남성에 비해 여성의 해상도가 더 빠르다18. 따라서 세균 부하의 증가는 암컷에 비해 수컷의 사망률을 증가시키고 해결을 지연시킵니다. 노화는 사용된 박테리아의 CFU를 적정할 때 고려해야 할 또 다른 요소입니다. 노화 마우스는 지정된 Spn 용량을 사용했을 때 100 % 사망률을 나타 냈습니다 (여기에 표시되지 않음). 폐렴구균 PNA 모델(6주에서 14주 사이)에서 젊은 마우스가 가장 자주 사용되는 반면, 노화된 마우스(19-26개월)는 면역 반응이 변경되어 PNA11에서 노화의 역할을 조사하는 데 사용됩니다. 노화 동물의 생존을 달성하기 위해 CFU를 300%까지 줄여야 했습니다(여기에 표시되지 않음). 이 연구에는 수컷 C57BL/6마리 마우스(8-12주령)가 사용되었으며 감염 후 6-10일 동안 추적 관찰되었습니다. 감수성의 상당한 차이는 균주 간에서도 발견될 수 있습니다. BALB/C 및 C57BL6/J와 같은 근친 균주는 감염에 대해 서로 다른 반응을 보인다 11,19.
기관내로 세균을 직접 접종하면 접종물(최대 99%)을 폐로 보다 정밀하게 전달할 수있으며(최대 99%), 이는 독성이 낮은 혈청형에 대한 대안이 되고 세균의 에어로졸화를 감소시킨다11. 그러나 침습적 절차라고 주장할 수 있습니다. 삽관은 까다로울 수 있고, 전신 마취가 필요하며, 후속 기도 부종 및 발작을 동반한 기관 외상으로 이어질 수 있습니다. 생쥐는 무호흡증으로 이어지는 미주반사를 발달시킬 수 있으며, 이를 위해서는 필요할 때 추가적인 인공호흡기 지원을 제공하기 위해 작은 생쥐 인공호흡기가 필요합니다. 시술을 집도하는 외과의의 전문성은 성공적인 삽관을 보장하기 위한 중요한 요소이다11. 우리 연구에서는 적절한 통증 관리와 체중 감소가 20% 이하로 인해 안락사될 필요가 있는 쥐는 없었습니다. 무기력증, 물이나 음식에 손을 뻗을 수 없음, 호흡 곤란, 정신 각성 저하와 같은 통증과 괴로움의 징후는 보이지 않았다. 폐로 세균을 직접 전달하는 대체 방법은 구인두 흡인(oral aryngeal aspiration)이지만, 폐 손상의 해결이 더 빨리 이루어지는 것으로 보이며, 일부 세균은 위와 위장관에서 끝날 수 있다20.
PNA의 전임상 모델을 통해 연구자는 면역 환경을 평가할 수 있습니다. 기관지폐포 및 간질 구획은 면역 세포의 동적 변화를 평가할 수 있습니다16. 또한, 세포는 사이토카인(cytokine)과 케모카인(chemokine)의 특정 생산을 결정하기 위해 체외(ex vivo )에서 배양하고 자극할 수 있습니다. 여기에서는 multicolor 유세포 분석을 사용하여 폐와 BAL의 면역 세포 환경을 탐색하는 데 중점을 둡니다. 단일 세포 RNA 염기서열 분석은 손상 해결의 여러 단계에서 세포 특이적 전사체 서명을 이해하기 위해 수행할 수도 있습니다.
PNA-ARDS 모델은 질병이 진행되는 동안 체중을 측정하여 조기에 감지할 수 있는 전신 효과를 생성한다10. ARDS의 전신 영향을 직접 측정하지는 않지만, 화학 프로필의 혈액 측정과 조직학을 위해 비장, 신장 및 간과 같은 다양한 조직을 채취하여 장기 기능 장애를 평가할 수도 있습니다. 폐렴구균 PNA-ARDS의 전신 영향은 이전에 동일한 박테리아 균주를 사용하는 다른 그룹에 의해 설명되었다21.
여기에서는 인간 ARDS의 기저에 있는 주요 병태생리학적 발견 중 일부와 유사한 실험적 PNA 모델이 설명됩니다. 인간 ARDS9의 복잡성과 이질성을 완전히 요약할 수 있는 이상적인 모델은 없지만, 이러한 모델은 폐 손상 및 복구의 메커니즘을 연구하는 데 적절하고 재현 가능하며, 폐 염증의 해결을 가속화하고 폐 복구를 촉진하는 데 중점을 둔 새로운 잠재적 약리학적 표적을 식별하기 위한 플랫폼 역할도 합니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 NIH 보조금 R01 HL131812 및 R01HL163881의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1-200 µL Round 0.5 mm Thick Gel-Loading Pipet Tips | Corning | 4853 | |
| 2 mL Cryogenic vials | Corning Incorporated | 431420 | 2 mL self standing, round bottom, red cap, polypropylene |
| 2 mL Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Fisherscientific | 05-402-24C | Shape: Round, Length (Metric): 38mm, Diameter (Metric) Outer: 10mm, Capacity (Metric): 2mL |
| 70 µm Cell Strainer | Falcon | 352350 | White, Sterile, Individually Packaged |
| 96-well Clear Round Bottom | Falcon | 353077 | TC-treated Cell Culture Microplate, with Lid, Individually Wrapped, Sterile |
| Acepromizine Maleate Injection, USP 500 mg/50 mL (10mg/mL) | Phoenix | NDC 57319-604-04 | EACH mL CONTAINS: acepromazine maleate 10 mg, sodium citrate 0.36%, Citric acid 0.075%, benzyl alcohol 1% and water for injection. |
| Ammonium-Chloride-Potassium (ACK) Lysing Buffer | Quality Biological | 118-156-721 | 4 x 100mL |
| Anti-mouse I-A/I-E | Biolegend | 107628 | APC/Cyanine7 anti-mouse I-A/I-E [M5/114.15.2]; Isotype: Rat IgG2b |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| BD Trypticase Soy Agar | BD-Biosciences | 90001-276 | 5% Sheep Blood Prepared Media Stacker Plates, BD Diagnostics |
| Biotix Disposable Reagent Reservoirs | Biotix | 89511-194 | |
| Bovine Serum Albumin | Sigma-Aldrih | A4503 | |
| CD103 | Invitrogen | 509723 | Integrin alpha E) Armenian Hamster anti-Mouse, FITC, Clone: 2E7 |
| CD11b | Invitrogen | RM2817 | PE-Texas Red, Clone: M1/70.15, Invitrogen |
| CD11c | BD Biosciences | 565872 | Hamster anti-Mouse, APC-R700, Clone: N418, BD Horizon |
| CD19 | Biolegend | 152410 | APC anti-mouse CD19 [1D3/CD19]; Isotype: Rat IgG2a, κ |
| CD24 | BD Biosciences | 563450 | Rat anti-Mouse, Brilliant Violet 711, Clone: M1/69 |
| CD4 | BD Biosciences | 563790 | BUV395; Clone: GK1.5 |
| CD45 | Biolegend | 103157 | Brilliant Violet 750 anti-mouse CD45 [30-F11]; Isotype: Rat IgG2b, κ; |
| CD8a | BD Biosciences | 612759 | Rat anti-Murine, Brilliant Ultraviolet 737, Clone: 53-6.7 |
| Cell Counting Slides | Bio-rad | 1450017 | For TC20 Cell Counter |
| Cell strainer 70 µL Nylon | Falcon | 198718 | REF 352350 |
| Collagenase Type1 | Worthington Biochemical Corporation | LS004197 | |
| Culti-Loop Streptococcus pneumoniae | Thermo Scientific | R4609015 | ATCC 4961 |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrih | DN25 | |
| Disposable inoculation loops/needles | Fisherbrand | 22-363-603 | Color blue; Volume 1 µL |
| DMEM (Dulbecco’s Modified Eagle’s Medium) | Corning | 10-014-CV | |
| Fc Block | BD Biosciences | 553142 | CD16/CD32 Rat anti-Mouse, Unlabeled, Clone: 2.4G2 |
| Formalin solution | Sigma-Aldrih | HT501640 | Formalin solution, neutral buffered, 10% |
| Gauze Sponges, Covidien | Curity | 2146- | |
| gentleMACS C Tubes | MACS Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | MACS Miltenyi Biotec | 130-093-235 | SN: 4715 |
| Hema 3 Manual Staining System and Stat Pack | Thermo Scientific | 23123869 | |
| Isoflurane Liquid Inhalation | Henry Schein | 1182097 | |
| IV CATHETER JELCO 20GX1.25" | Hanna Pharmaceutical Supply Co., Inc | 405611 | |
| Ketamine HCl Injection | Henry Schein | 1049007 | Ketamine HCl Injection MDV 100mg/mL 10mL 10/Box |
| Klebsiella pneumoniae | ATCC | 43816 | subsp. pneumoniae (Schroeter) Trevisan |
| Loctite 409 | Electron Microscopy Sciences | 7257009 | |
| Ly-6C | Biolegend | 128036 | Brilliant Violet 605 anti-mouse Ly-6C [HK1.4]; Isotype: Rat IgG2c |
| Ly-6G | BD Biosciences | 740157 | Rat anti-Mouse, Brilliant Violet 510, Clone: 1A8, BD Optibuild |
| MiniVent Type 845 | Hugo Sachs Elektronik- Harvard Apparatus | 4694 | D-79232 March (Germany) |
| NK-1.1 | BD Biosciences | 553165 | Mouse anti-Mouse, PE, Clone: PK136, BD |
| Phase Hemacytometer | Hausser Scientific | 1475 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | 1X without calcium and magnesium, |
| Round Bottom | Sarstedt | 55.476.305 | |
| Round-Bottom Polystyrene Test Tubes | Falcon | 352235 | With Cell Strainer Snap Cap, 5mL |
| SealRite 1.5 mL Natural Microcentrifuge Tube | USA Scientific | 1615-5500 | Free of detectable Rnase, DNase, DNA and pyrogens. |
| Shandon EZ Single Cytofunnel | Epredia | A78710003 | |
| Siglec-F | BD Biosciences | 562681 | Anti-Mouse, Brilliant Violet 421, Clone: E50-2440 |
| Silk Black Braided 30"(75 cm) Sterile, nonabsorbable surgical suture U.S.P. | Ethicon | K-834 | 0 (3.5 metric) |
| Stainless-Steel Slide Clip | Epredia | 59910052 | |
| Sterile Single Use Vacuum Filter Units | Thermo Scientific | 1660045 | |
| Syringe sterile, single use, 1 mL | BD-Biosciences | 309628 | |
| TC20 Automatic Cell Counter | Bio-Rad | 508BR05740 | |
| TipOne 200 ul yellow pipet tip refill | USA Scientific | 1111-0706 | |
| TODD HEWITT BROTH | RPI | T47500 | |
| TPX Sample Chamber | Epredia | A78710018 | |
| TPX Single Sample Chamber, Caps and Filter Cards | Epredia | 5991022 | |
| Trypan Blue | Bio-rad | 1450022 | |
| U-100 Insulin Syringes | BD-Biosciences | 329461 | |
| Wet-Proof Multi-Heat Electric Heat Pad | Cullus | Model PR7791AB | 120 volst AC; 45 watts; Listed 562B/E26869 |
참고문헌
- Bellani, G., et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 315 (8), 788-800 (2016).
- Hariri, L., Hardin, C. C. Covid-19, angiogenesis, and ARDS endotypes. The New England Journal of Medicine. 383 (2), 182-183 (2020).
- Ferguson, N. D., et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Medicine. 38 (10), 1573-1582 (2012).
- Tomashefski Jr, J. F. Pulmonary pathology of the adult respiratory distress syndrome. Clinics in Chest Medicine. 11 (4), 593-619 (1990).
- Martin, T. R. Lung cytokines and ARDS: Roger S. Mitchell lecture. Chest. 116 (1 Suppl), 2S-8S (1999).
- Colletti, L. M., et al. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. The Journal of Clinical Investigation. 85 (6), 1936-1943 (1990).
- Donnelly, S. C., et al. The association between mortality rates and decreased concentrations of interleukin-10 and interleukin-1 receptor antagonist in the lung fluids of patients with the adult respiratory distress syndrome. Annals of Internal Medicine. 125 (3), 191-196 (1996).
- Miller, E. J., Cohen, A. B., Matthay, M. A. Increased interleukin-8 concentrations in the pulmonary edema fluid of patients with acute respiratory distress syndrome from sepsis. Critical Care Medicine. 24 (9), 1448-1454 (1996).
- Matute-Bello, G., et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals. American Journal of Respiratory Cell and Molecular Biology. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 66 (2), e1-e14 (2022).
- Borsa, N., Pasquale, M. D., Restrepo, M. I. Animal models of pneumococcal pneumonia. International Journal of Molecular Sciences. 20 (17), 4220(2019).
- Rubins, J. B., et al. Dual function of pneumolysin in the early pathogenesis of murine pneumococcal pneumonia. The Journal of Clinical Investigation. 95 (1), 142-150 (1995).
- Thermo Scientific, Pierce BCA Protein Assay Kit. , https://www.thermofisher.com/order/catalog/product/23225 Forthcoming.
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. Journal of Visualized Experiments. (29), e1266(2009).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 61 (2), 150-161 (2019).
- Aeffner, F., Bolon, B., Davis, I. C. Mouse models of acute respiratory distress syndrome: a review of analytical approaches, pathologic features, and common measurements. Toxicologic Pathology. 43 (8), 1074-1092 (2015).
- Torres, A., et al. Pneumonia. Nature Reviews Disease Primers. 7 (1), 25(2021).
- Xiong, Y., et al. Estradiol resolves pneumonia via ERβ in regulatory T cells. JCI Insight. 6 (3), e133251(2021).
- D'Alessio, F. R., et al. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming. American Journal of Physiology. Lung Cellular and Molecular Physiology. 310 (8), L733-L746 (2016).
- D'Alessio, F. R. Mouse models of acute lung injury and ARDS. Methods in Molecular Biology. 1809, 341-350 (2018).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology. Lung Cellular and Molecular Physiology. 317 (5), L717-L736 (2019).
Erratum
Formal Correction: Erratum: Experimental Model to Evaluate Resolution of Pneumonia
Posted by JoVE Editors on 6/13/2023. Citeable Link.
An erratum was issued for: Experimental Model to Evaluate Resolution of Pneumonia. A figure was updated.
Figure 2 was updated from:

to:

재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유