Method Article
지지된 지질 이중층에 대한 막으로 묶인 최소 액틴 피질의 재구성
요약
이 프로토콜은 형광 현미경을 사용하여 재구성된 막 연결 세포골격 네트워크의 역학을 연구하기 위해 지지된 지질 이중층의 형성과 세포골격 필라멘트 및 운동 단백질의 추가를 설명합니다.
초록
살아있는 세포의 표면은 원형질막과 기본 액틴 피질의 상호 작용에서 발생하는 수많은 세포 과정을위한 다목적 활성 플랫폼을 제공합니다. 지난 수십 년 동안 액틴 필라멘트 네트워크와 함께 지지된 지질 이중층을 기반으로 하는 재구성되고 최소한의 시스템은 막으로 묶인 액틴 네트워크의 기본 메커니즘과 결과를 밝히고 개별 막 관련 단백질의 기능을 연구하는 데 매우 중요한 것으로 입증되었습니다. 여기에서는 막 관련 액틴 결합 단백질을 통해 결합된 유체 지지 지질 이중층으로 구성된 체 외 활성 복합 시스템을 전체 내부 반사 형광 현미경을 통해 쉽게 관찰할 수 있는 동적 액틴 필라멘트 및 미오신 모터로 구성하는 방법을 설명합니다. 개방형 챔버 설계를 통해 시스템을 단계별로 조립하고 링커 단백질 농도, 액틴 농도, 액틴 필라멘트 길이, 액틴/미오신 비율 및 ATP 수준과 같은 많은 매개변수를 체계적으로 제어할 수 있습니다. 마지막으로 시스템의 품질을 제어하는 방법, 일반적으로 발생하는 문제를 감지하고 해결하는 방법, 살아있는 세포 표면과 비교하여 이 시스템의 몇 가지 제한 사항에 대해 설명합니다.
서문
살아있는 동물 세포의 원형질막은 인접한 액틴 세포 골격과 지속적으로 상호 작용하며, 함께 다양한 세포 기능을 수행하는 활성 복합 물질을 형성합니다 1,2. 이 지질막-액틴 계면에서의 공정을 연구하기 위해, 지원되는 지질 이중층(SLB) 위에 세포골격 네트워크를 재구성하는 것이 매우 유용한 것으로 입증되었습니다. 이 최소 시스템 접근 방식을 통해 세포 골격 네트워크 구성 요소와 지질 구성을 정밀하게 제어 할 수 있습니다. SLB의 평면 형상은 거대한 단층 소포의 독립형 지질막과 비교하여 초고해상도3,4, 전반사 형광(TIRF)5,6,7 또는 간섭계 산란8과 같은 최첨단 현미경 기술을 효율적으로 사용할 수 있습니다. 세포 골격 네트워크의 공간 조직과 역학을 연구합니다. TIRF는 배경 신호에 기여하는 용액에서 결합되지 않은 표지 된 분자의 신호가 최소화되기 때문에 형광 표지 된 성분에 대해 가장 높은 대비를 제공합니다.
여기에서는 활성 준 2D 네트워크 9,10,11의 물리학과 막 조직3,5,12,13,14,15,16에 미치는 영향을 연구하기 위해 현장에서 널리 사용되는 지지된 지질 이중층에 연결된 액토미오신 네트워크의 형성을 위한 기본 프로토콜을 설명합니다(그림 1 ). 이 접근법은 액틴 기반 네트워크에 국한되지 않고 미세 소관, 중간 필라멘트 또는 혼합 된 특성의 복합 네트워크를 탐색하고 표면 민감성 현미경 방법을 사용하여 지질 막 단백질과 세포 골격 구성 요소 간의 다양한 상호 작용을 연구하는 데 쉽게 적용 할 수 있습니다.
이 프로토콜에 초점을 맞추기 위해 액틴 및 미오신 단백질의 정제 및 표지에 대한 자세한 설명이나 액토미오신 네트워크의 수축성 및 조직을 조정하고 제어하는 방법에 대한 세부 정보를 제외했습니다. JoVE Method Collection, 생체 재료, 생물 물리학 및 활성 물질 연구를위한 세포 골격 네트워크의 체외 재구성17에서 이와 함께 출판 된 다른 프로토콜을 참조해야합니다.

그림 1: 시험관내 액틴-막 활성 복합 시스템의 개략도. 바이오렌더로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 시약 및 장비
- 표 1에 나열된 대로 새 버퍼를 준비합니다. 25°C에서 저항률이 18.2MΩ·cm인 초순수 탈이온수를 사용하십시오. 모든 완충액을 진공 상태에서 0.22μm 필터를 통과시켜 살균합니다. 컬럼 크로마토그래피에 사용되는 완충액을 탈기합니다.
- 앞서 설명한 바와 같이 골격근 액틴을 정제하십시오18,19. 최종 정제된 G-액틴 용액에 20% 글리세롤을 첨가하고 500μL(라벨링 또는 벌크 실험용) 및 10μL(개별 실험용) 부피의 분취량을 만듭니다. 튜브를 액체 질소에 30초 동안 담가 분취량을 급속 동결한 다음 최대 80개월 동안 -18°C에서 보관합니다.
참고: 또는 정제된 액틴 또는 아세톤 분말을 상업적으로 구입할 수 있습니다. - 정제된 골격근 G-액틴을 앞서 설명한 바와 같이 임의의 형광 말레이미드 염료로 라벨링한다5. 염료의 액틴(εactin = 26,600 M-1 cm-1) 및 Aλmax에 대해 보정된A 290nm를 사용하여 분광광도법으로 단백질의 농도 및 표지 정도를 결정하였다. 10 μL의 분취량을 만들고 튜브를 액체 질소에 30초 동안 담가 급속 동결하고 -80°C에서 최대 18개월 동안 보관합니다.
알림: 라이신 접합 NHS- 에스테르로 라벨링하면 비 기능성 액틴이 생성되므로 피해야합니다. - 골격근 미오신 II를 정제하여 프로토콜20에 따른다. 10% 폴리아크릴아미드 겔을 사용하여 SDS-PAGE를 실행한 후 쿠마시 염색하여 단백질21의 순도 수준을 결정하였다. 정제된 골격근 미오신 -II를 -20°C에서 액체 형태로 50% 글리세롤이 포함된 미오신 II 완충액에 보관하십시오.
알림: 저장된 미오신 II는 최대 2 년 동안 사용할 수 있습니다. - 정제된 미오신 II를 앞서 설명한 바와 같이 임의의 형광 말레이미드 염료로 표지5. 미오신 모터에 NHS 에스테르 염료를 표시하지 마십시오. 보정된A 280nm 의 미오신 II 및 염료의 Aλmax 를 사용하여 분광 광도법에 의해 표지의 농도 및 정도를 결정한다. 재활용된 미오신 II(다크 또는 라벨링)를 4°C에서 보관하고 6주 이내에 사용하십시오.
- 캡핑 단백질의 정제
- 이전 프로토콜22에 따라 쥐 캡핑 단백질을 얻습니다. 10% 폴리아크릴아미드 겔을 사용하여 SDS-PAGE를 실행한 후 쿠마시 염색을 실행하여 단백질의 순도 수준을 확인합니다. 캡핑 단백질280nm(εCP = 99,530 M-1 cm-1)를 사용하여 농도를 측정합니다.
- 단백질 용액에 20% 글리세롤을 첨가하고 200μL PCR 튜브에 5μL 분취액을 만듭니다. 튜브를 액체 질소에 담그고 최대 2 년 동안 -80 ° C에서 보관하십시오.
참고: 캡핑 단백질 활성은 다른 캡핑 단백질 양의 존재 하에 고정된 양의 형광 G-액틴을 중합하여 확인합니다. 그런 다음 필라멘트를 현미경으로 이미지화하고 길이 분포를 정량화합니다. 캡핑 단백질의 상대 농도가 높을수록 액틴 필라멘트 분포가 짧아집니다. Köster et al.5 참조.
- 형광막-액틴 링커 단백질을 발현시키고, 예를 들어, 이 프로토콜을 위해 10xHis-YFP-EzrinABD (HYE)를 사용하고, 이를 Bl21DE3* 대장균에서 발현시키고, 앞서 설명한 바와 같이 정제한다23. 분광 광도법으로 단백질의 농도를 결정하십시오.
- 단백질을 -80 ° C에서 20 % 글리세롤과 함께 겔 여과 크로마토 그래피 버퍼 (또는 다른 적절한 버퍼)에 작은 분취량으로 보관하십시오. 이러한 조건에서 단백질은 2 년 이상 안정적입니다.
참고: 액틴-막 링커 단백질과 형광 마커의 선택은 다루는 질문의 유형에 따라 다릅니다. 지난 몇 년 동안 히스티딘-태그된 단백질24, 비오틴-스트렙타비딘 25, 및 단일 가닥 DNA26을 포함하는 광범위한 지질-결합 전략이 개발되었다. - 다층 소포 (MLV)의 제조
참고: MLV에서 지원되는 지질 이중층까지의 워크플로는 그림 2에 나와 있습니다.- 5mL 유리 비커에 10-200개의 호박색 유리 바이알을 넣습니다. 유리 바이알이 잠길 만큼만 비커에 2% 세척액을 채웁니다. 최대 펄스 및 65 ° C에서 30 분 동안 수조에서 초음파 처리합니다.
- 용액에서 바이알을 꺼내 증류수로 완전히 헹굽니다. 바이알을 2 N NaOH가 들어있는 유리 비커에 넣고 20 분 동안 초음파 처리합니다. 이 단계에서는 가열이 필요하지 않습니다.
- NaOH 용액에서 바이알을 꺼내 증류수로 완전히 헹굽니다. 65°C로 설정된 뜨거운 공기 오븐 내부에서 바이알을 2시간 이상 건조시킵니다.
- 세척 된 바이알을 투명 필름으로 밀봉 된 깨끗한 비커에 최대 6 주 동안 보관하십시오.
주의: 화학 흄 후드 내부에서 다음 단계를 수행하십시오. 플라스틱에 의한 오염을 피하기 위해 기밀 Hamilton 유리 주사기로 클로로포름과 지질 용액을 처리하십시오. - 해밀턴 주사기와 호박색 유리 바이알 몇 개를 순수한 클로로포름으로 여러 번 헹굽니다. -20 °C 냉동고에서 유리 앰플에 저장된 지질 분말을 꺼내 적절한 양의 클로로포름을 첨가하여 지질 분말을 10-25 mg / mL의 농도로 용해시킵니다.
- 앰플에서 새로 세척 된 호박색 유리 바이알로 용액을 옮기고 적절하게 라벨을 붙입니다. 클로로포름의 증발을 줄이기 위해 얼음에서이 단계를 수행하십시오.
- 농도가 10-25 mg / mL이고 DGS-NTA-Ni2+ 농도가 1-10 mg / mL 인 DOPC 저장 용액을 만듭니다.
- 작동하는 지질 혼합물을 만들려면 깨끗한 유리 병을 가지고 클로로포름으로 2 x 헹굽니다. 바이알에 300μL의 순수 클로로포름을 추가하여 성분의 더 나은 혼합을 위한 베이스 역할을 합니다. 이것은 모든 클로로포름이 다음 단계에서 건조되기 때문에 지질의 최종 농도에 영향을 미치지 않습니다.
- 측정된 부피의 스톡 지질 용액을 바이알에 추가하여 원하는 작동 지질 혼합물을 만듭니다. 지질 재수화 완충액 중의 목표 지질 농도는 4 mM이다. 지질 혼합물을 실온에서 화학 후드 내부의N2 가스의 느린 흐름 하에서 건조시킨다. 이 단계는 각 바이알에 대해 최대 30분이 소요될 수 있습니다.
- 모든 용매가 건조된 후 지질 필름을 실온에서 >2시간 동안 진공 건조시켜 남아 있는 클로로포름의 흔적을 제거합니다. 건조된 지질 혼합물을 4mM의 최종 지질 농도를 위해 지질 재수화 완충액에 재현탁시킨다.
- 지질의 재수 화를 허용하기 위해 5-10 분 동안 배양하십시오. 지질 용액을 약 30초 동안 와동시켜 MLV를 형성합니다.
- 1.5mL 마이크로 원심분리 튜브에 MLV의 0.5-1mL 분취량을 만듭니다. 튜브를 액체 질소에 담그고 투명 필름으로 밀봉 한 다음 -20 ° C에서 보관하십시오 (최대 6 주 동안).
참고: 지질 스톡 농도는 Hamilton 주사기를 사용하여 신뢰할 수 있는 피펫팅이 가능하도록 충분히 많은 양을 허용하도록 선택됩니다. 스톡을 만드는 데 필요한 부피가 너무 커서 건조된 지질 분말을 용해할 수 없는 경우 다양한 지질의 재현 가능한 혼합을 보장하기 위해 스톡을 여러 번 희석합니다.
- 작은 단층 소포 (SUV)의 준비
- -20°C 저장소에서 MLV의 분취량을 꺼내 실온에서 해동합니다. 마이크로 원심분리 튜브를 액체 질소에 15-30초 동안 담가 소포를 급속 동결시키고 용액이 완전히 해동될 때까지(1-2분) 즉시 45°C로 설정된 수조에 넣습니다. 용액이 덜 탁해 보일 때까지 위의 동결-해동 주기를 10x-15x 반복합니다.
알림: 균일한 지질 혼합을 위해 해동되는 지질 혼합물의 전이 온도보다 수조의 온도를 높게 설정하십시오. - SUV 재수화 버퍼가 있는 80nm 기공 크기의 폴리카보네이트 필터 멤브레인이 장착된 주사기 기반 미니 압출기의 평형을 이룹니다. 시스템에 누출이나 기포가 없는지 확인하십시오. 압출 방법은 지질 손상을 최소화한 단분산 SUV를 생성하지만 음전하를 띤 지질 혼합물은 폴리카보네이트 막에 달라붙을 수 있습니다.
- 해동된 지질 용액을 미리 평형화된 압출기를 통해 한쪽에서 다른 쪽으로 부드럽게 통과시킨 다음 다시 통과시킵니다. 지질 용액이 눈에 띄게 투명해질 때까지 사이클을 5x-10x 반복하여 ~ 100nm 직경의 SUV 형성을 나타냅니다.
- 압출된 현탁액을 원심분리(또는 팁 초음파 처리, 아래 참고 참조)를 15,000 x g 에서 4°C에서 60분 동안 제거하여 지질 파편을 펠릿화합니다. 펠릿을 방해하지 않고 거품을 생성하지 않고 용액의 상위 80 %를 수집하십시오. SUV가 포함된 상청액을 새로운 미세 원심분리기 튜브로 옮기고 최대 6일 동안 얼음에 보관합니다.
알림: 원심 분리의 대안은 다음과 같이 수행되는 팁 초음파 처리입니다. 마이크로 팁 초음파 처리기를 켜고 진폭 = 최대 30 %, ON 시간 = 10 초, OFF 시간 = 60 초의 설정을 지정하십시오. 마이크로 초음파 처리기의 끝을 탈이온수로 청소한 다음 2 N NaOH, 클로로포름, 그리고 다시 탈이온수로 청소합니다. 이러한 각 용액에 초음파 처리기 팁을 담그고 위의 설정을 사용하여 1-2 사이클 동안 초음파 처리합니다. 동결 해동 된 소포 용액에 깨끗한 팁을 담그고 용액이 깨끗해질 때까지 얼음에서 3-6 사이클 동안 초음파 처리합니다. - 원심분리 후, 얇은 희끄무레 한 필름 및 / 또는 명확하게 보이는 펠릿의 형성으로 높은 지질 분해 또는 지질 압출 실패의 징후를 확인하십시오. 이러한 경우 진행하지 말고 SUV 준비 단계를 다시 반복하십시오.
알림: SUV의 유통 기한은 지질 혼합물에 따라 다를 수 있습니다. DOPC로 만든 SUV : DGS-NTA-Ni2+ 는이 실험의 목적을 위해 최대 6 일 동안 안정적입니다. 일반적인 문제를 해결하기 위한 팁은 표 2에서 찾을 수 있습니다.
- -20°C 저장소에서 MLV의 분취량을 꺼내 실온에서 해동합니다. 마이크로 원심분리 튜브를 액체 질소에 15-30초 동안 담가 소포를 급속 동결시키고 용액이 완전히 해동될 때까지(1-2분) 즉시 45°C로 설정된 수조에 넣습니다. 용액이 덜 탁해 보일 때까지 위의 동결-해동 주기를 10x-15x 반복합니다.
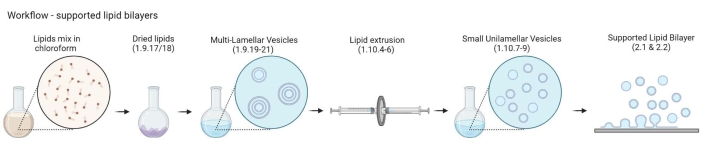
그림 2: 다층 소포 및 작은 단층 소포 준비에서 지지된 지질 이중층 형성까지의 워크플로를 보여주는 개략도. 바이오렌더로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 막 연결 액틴 네트워크의 재구성
- 시료 챔버 준비
- 3-5 개의 직사각형 유리 커버 슬립을 가져다가 Coplin 병 안에 넣으십시오. 목욕 초음파 처리기를 켜고 온도를 65 °C로 설정하십시오. Coplin 병에 2% 세척액을 채워 커버슬립을 완전히 담그고 최대 펄스 모드에서 30분 동안 초음파 처리기에 넣습니다.
- 무딘 PTFE 코팅 집게를 사용하여 항아리에서 커버 슬립을 하나씩 제거합니다. 증류수로 철저히 헹구고 2 N NaOH로 채워진 다른 코플린 병에 넣으십시오.
- 전체 펄스 모드에서 20분 동안 커버슬립을 초음파 처리합니다. 커버 슬립을 하나씩 제거하고 증류수로 철저히 헹구고 증류수가 채워진 다른 코플린 병에 넣으십시오.
알림: 선택적으로 커버 슬립을 증류수에서 20 분 동안 초음파 처리 한 다음 증류수로 다시 헹굽니다. - 실험을 시작하기 직전에 N2 가스 공급 장치가 장착 된 화학 후드에 커버 슬립이 들어있는 병을 가져 가십시오.
- 시행 착오를 통해 N2 가스 스트림의 공기 압력을 최적화하여 커버 슬립 표면에서 물을 파손시키지 않고 충분히 대체 할 수 있도록하십시오. N2 가스의 흐름을 커버 슬립 평면과 평행하게 정렬하여 커버 슬립이 파손될 가능성을 줄입니다.
- 장갑과 집게를 사용하여 항아리에서 커버 슬립을 하나씩 제거하여 N2 스트림 아래에서 건조시킵니다. 각 커버 슬립의 양면을 말리고 커버가있는 깨끗한 플라스틱 그리드에 놓습니다. 공기 중의 먼지 입자와 접촉하지 않도록 커버슬립이 있는 상자를 데시케이터에 넣습니다.
알림: N 2 건조 커버 슬립은 최대2 일 동안 친수성을 유지할 수있는 데시 케이터에 보관할 수 있습니다. 이 전략은 실험에 많은 이중층이 필요하거나 실험에 8시간 이상 걸리는 경우에 유용할 수 있습니다. - 오토클레이브 PCR 튜브를 가져다가 날카로운 수술용 칼날로 뚜껑과 원추형 반쪽을 잘라냅니다. 원통형 하프 컷 튜브를 하나씩 잡고 각 절단 튜브의 매끄러운 림에 UV 경화 접착제를 바르고 림이 커버 슬립에 평평하게 놓이도록 새로 청소 한 커버 슬립에 거꾸로 놓습니다.
- 접착제가 챔버의 중앙 공간으로 흘러 나오지 않도록 실린더가 커버 슬립에 위치하면 실린더를 옆으로 움직이지 마십시오. 직사각형 커버슬립은 최대 3개의 반응 챔버를 편안하게 수용할 수 있으며 둥근 커버슬립은 중앙에 하나만 수용할 수 있습니다(그림 1).
- 챔버 베어링 커버슬립을 O2 공급 및 진공 청소기가 있는 UV 오존 클리너 안에 넣습니다(또는 UV 조명기 사용). UV 광선을 켜고 접착제가 중합되도록 3-5분 동안 조명을 켭니다. 더 긴 조명(10-15분)을 수행하여 커버 유리의 친수성을 향상시켜 지질 이중층의 품질을 향상시킵니다.
- 건조한 UV 조명 샘플 챔버를 투명 필름으로 싸인 작은 플라스틱 상자(예: 빈 직사각형 커버슬립 상자) 안에 최대 8시간 동안 보관하여 공기 중 먼지 입자와의 접촉을 줄입니다.
알림: 자외선이 있는 상태에서O2 의 꾸준한 흐름은 덮개 슬립 표면에서 유기 불순물을 제거할 수 있는 오존 및 산소 라디칼을 형성합니다. 진공은 공정 중에 형성되는 독성 오존의 누출을 방지합니다. - 커버 슬립을 꺼내고 증류수로 채워 챔버의 누출 여부를 테스트하십시오. 각 챔버는 최대 ~ 150 μL의 샘플을 수용 할 수 있습니다. 새는 챔버는 폐기하십시오.
알림: 또 다른 훌륭하고 안전한 청소 옵션은 플라즈마 클리너입니다. 시간 및 전원 설정은 모델에 따라 다르지만 유리 슬라이드를 플라즈마로 과도하게 처리하면 지질 이동성이 감소하지 않도록 하십시오. 표면 처리는 세정 용액 (>45 분) 또는 NaOH (>30 분)로 장기간 처리 할 때 관찰 된 바와 같이 지질27의 이동성에 영향을 줄 수 있습니다.
- 지지된 지질 이중층의 제조
- SLB 형성 버퍼(또는 1x PBS)로 각 챔버를 세척하여 표면 오염 물질을 제거하고 끝에 100μL의 버퍼를 남깁니다. 영구 마커로 버퍼 레벨을 100μL로 표시하여 부피의 변화를 재현 가능하게 추적합니다.
- 2 μL의 0.1 MCaCl2 를 챔버에 첨가한다. 이것은 유리 표면에 대한 소포의 흡착을 개선하여 다음 단계에서 이중층 형성을 향상시킵니다. 8 μL의 SUV 용액 (단계 1.10에서)을 각 챔버에 첨가하고 25 °C에서 15 분 동안 배양한다.
참고 : 추가 할 SUV 믹스의 부피는 우물의 노출 된 친수성 영역을 두 개의 지질 층으로 완전히 덮는 데 필요한 총 지질 수 (평균 면적 0.72nm2)를 계산하여 추정 할 수 있습니다. - 결합되지 않은 소포를 액틴 운동성 완충액(1x KMEH)으로 씻어낸다. 먼저 50μL의 SLB 형성 버퍼를 제거하고 샘플 챔버에 50μL만 남깁니다. 둘째, 100μL의 1x KMEH를 챔버에 추가합니다. 부드럽게 혼합한 다음 바닥에 닿지 않고 완충액 100μL를 제거합니다.
알림: 세탁하는 동안 부드럽게 하는 것이 중요합니다. 피펫 팁이 챔버 바닥에 닿지 않도록하십시오. 직접적인 흐름이 이중층을 방해할 수 있으므로 버퍼의 흐름을 이중층이 아닌 챔버의 벽으로 향하도록 피펫을 기울인 상태로 유지하십시오. 피펫팅 중에 기포가 유입되지 않도록 주의해야 하는데, 공기가 지질 이중층에 도달하여 결함을 일으킬 수 있으므로 주의하십시오. - 1x KMEH 100μL를 추가하고 100μL를 제거하여 세척을 10회 반복합니다.
- 10μL의 1mg/mL β-카제인을 이중층에 넣고 부드럽게 혼합한 후 5-10분 동안 배양합니다. β-카제인은 이중층이 형성되지 않은 커버슬립 영역을 차단합니다. 3 단계에서 설명한대로 1x KMEH로 β- 카제인 2.2.3x를 씻어냅니다. 버퍼 레벨을 100 μL 마크로 되돌립니다.
- 막-액틴 링커 첨가
- β- 카제인 배양 (단계 2.2.5.) 동안, -80 °C에서 막 - 액틴 링커 단백질의 분취량을 꺼내어 37 °C에서 빠르게 해동 한 다음 얼음 위에 보관합니다. 분취량을 단백질 희석 완충액으로 1 μM의 농도로 희석한다.
- 링커 단백질을 정의된 최종 농도(일반적으로 5-20nM)로 추가하고 부드럽게 혼합합니다. 챔버에서 단백질의 빠른 평형화를 보장하려면 링커 단백질을 1x KMEH와 사전 혼합하여 20μL보다 큰 부피를 추가합니다.
- 실온에서 40분 동안 배양합니다. 1x KMEH 완충액으로 3x 세척하여 결합되지 않은 HSE 단백질을 제거한다(단계 2.2.3에서와 같이). 각 챔버의 버퍼 레벨을 100 μL 마크로 되돌립니다. 이제 샘플을 이미징할 준비가 되었습니다.
- 지질 이중층의 품질 평가
참고: 이 단계는 매번 수행할 필요가 없는 선택적 단계입니다. 이 평가는 냉동 MLV 재고로 새 SUV를 만들 때마다 수행하는 것이 좋습니다.- 현미경, 여기 레이저 및 감지 카메라를 켭니다. 레이저가 정렬되어 있고, 대물렌즈가 청소되었으며, 소프트웨어가 이미지를 획득할 준비가 되었는지 확인합니다.
- 100x 대물렌즈에 오일을 바르고 샘플을 현미경 스테이지에 장착한 다음 이중층에 대물렌즈의 초점을 맞춥니다. 레이저 위치가 샘플에 대한 전체 내부 반사를 받도록 하십시오. 488nm 여기 레이저를 사용하여 이중층 결합 10xHis-YFP-EzrinABD의 형광 강도 분포를 확인합니다.
참고: 좋은 품질의 이중층은 형광 강도의 대규모의 균일한 분포를 보여줍니다. 나쁜 이중층은 강렬하고 고르지 못한 형광 반점을 보여줍니다. - 이중층의 무결성을 결정하려면 FRAP 분석을 수행하십시오.
- 이중층에서 관심 영역을 선택하고 5:1 이상의 신호 대 잡음비를 제공하는 이미징 조건을 사용하여 시야의 몇 가지 이미지를 기록합니다. 기록을 일시 중지하고 TIRF 현미경의 필드 다이어프램을 닫아 이중층의 작은 원형 영역에 집중된 레이저 빔을 집중시켜 형광단을 국부적으로 표백합니다.
- 레이저를 최대 출력으로 켜서 작은 영역을 3-10초 동안 포토블리치한 다음 레이저를 끕니다. 필드 다이어프램을 원래 반경으로 다시 열고 이미징 조건을 (표백 전) 설정으로 다시 조정한 다음 즉시 다시 시작하여 시야에서 형광 신호의 복구를 기록합니다.
- 이중층이 유동적인지 확인하십시오. 정상적인 측면 확산을 가진 좋은 이중층은 빠르게 회복되는 반면, 나쁜 이중층은 천천히 회복되거나 전혀 회복되지 않습니다(그림 3). 이중층이 복구되지 않으면 문제 해결 섹션을 확인하고 다시 시작하십시오. 이미지를 16비트 TIFF 파일로 저장합니다. 확산 계수의 정량적 추정은 3단계를 확인하십시오. 아래.
- 형광 액틴의 중합
참고: 시간을 절약하려면 이중층에 결합하는 HSE 단백질의 배양 시간 (2.3 단계) 또는 이중층의 품질 평가 (2.4 단계) 중에 액틴 중합을 시작하십시오.- 표지되지 않은 G- 액틴과 형광 표지 된 G- 액틴을 10 : 1 몰비로 혼합하고 G- 액틴의 농도가 20 μM이되도록 G- 버퍼로 채 웁니다. 액틴이 최종적으로 중합되는 농도는이 값의 1/4입니다. 1x 용액에 대한 혼합물에 10x ME 버퍼의 1/10을 추가하고 2분 동안 배양합니다. 이 단계는 G- 액틴에 결합 된Ca2 + 이온을 Mg2+ 이온으로 대체합니다. 최종 부피가 10μL의 배수인지 확인합니다.
- 다음과 같이 원하는 양의 캡핑 단백질을 첨가하십시오. 캡핑 단백질 스톡이 담긴 바이알을 37°C에서 빠르게 해동한 다음 얼음 위에 보관합니다. 캡핑 단백질의 농도가 중합 혼합물에서 원하는 최종 농도의 두 배가 되도록 G-완충액으로 희석합니다. 동일한 부피의 희석된 캡핑 단백질 용액을 2.5.1단계의 액틴 혼합물에 첨가한다.
- 마지막으로, 동일한 부피의 새로운 2x 표적 버퍼를 반응 혼합물에 추가합니다. 용액의 최종 부피는 2.5.2 단계가 끝날 때 액틴 혼합물의 부피의 4 배가되어야합니다. KMEH의 최종 농도가 1x, ATP가 1mM, BSA가 1mg/mL, G-액틴이 5μM인지 확인합니다.
중합이 일어나도록 25 ° C의 어두운 곳에서 45-60 분 동안 배양하십시오.
참고: 이를 표적 완충액 전략이라고 하며, 한 부피의 Mg 2+ G-액틴(단계 2.5.1)을 한 부피의 캡핑 단백질 믹스(단계 2.5.2) 및 두 부피의2x 표적 완충액(단계 2.5.3)과 혼합합니다. 이를 통해 액틴의 양을 늘리거나 줄이고 캡핑 단백질 (또는 다른 액틴 조절제)의 상대 농도를 변경하는 것이 더 쉬워집니다. 그림 4).
- 형광 액틴 필라멘트 첨가
- 날카로운 칼날이나 가위로 200μL 팁 몇 개를 잘라 끝이 뭉툭하게 만듭니다. 뭉툭한 피펫 팁(액틴 필라멘트의 전단을 방지하기 위해)으로 필요한 부피의 5μM 중합된 액틴(2.5.3단계에서)을 부드럽게 피펫팅하고 깨끗한 오토클레이브 PCR 튜브에 추가합니다.
- 튜브에 1x KMEH를 추가하여 부피를 >20μL로 만들고 F-액틴의 전단을 피하기 위해 부드럽게 혼합합니다. 장착된 샘플 챔버에서 동일한 부피의 버퍼를 제거합니다.
- 중합된 액틴 용액을 챔버에 넣고 바닥의 이중층을 건드리지 않고 위아래로 부드럽게 피펫팅합니다. 이것은 액틴 필라멘트가 이중층에 균일하게 분포되도록합니다. 샘플을 TIRF 현미경에 장착합니다(2.4.1단계 및 2.4.2단계 참조).
- 하나는 이중층에 F- 액틴이 결합하는 과정을 기록 할 수 있습니다. 20-30 분 동안 배양하십시오. F-actin 첨가가 정상 상태에 도달한 후 다른 시야에서 몇 개의 이미지를 기록합니다. 액틴 조직 전(균질) 및 후의 10xHis-YFP-EzrinABD의 공간 조직의 변화를 관찰합니다.
참고: HYE는 액틴이 없는 상태에서 지질 이중층에 균일하게 분포되어 있습니다. 액틴 필라멘트를 첨가하면 HYE는 F- 액틴과 공동 국소화됩니다. 공동 국소화의 정도는 링커 단백질의 액틴 결합 친화도에 의존한다; 친화도가 강할수록 공동 국소화가 높아지고 링커 단백질의 측면 이동성이 느려집니다(그림 5).
- 미오신 II의 첨가
- 액틴 배양 30분 후 샘플을 현미경에 다시 장착합니다(장착되지 않은 경우). 링커 단백질과 F- 액틴 채널의 신호를 확인하십시오. 필요한 경우 이미징 조건을 조정합니다.
- 링커 단백질 신호가 균일하고 액틴 필라멘트가 균일하게 흩어져 있고 긴 타임 랩스 기록을 위해 인공물이 없는 양호한 영역을 선택합니다. 미오신 첨가 전에 0.1-0.2Hz에서 10-15 프레임을 기록하고 녹음을 일시 중지합니다. 뭉툭한 피펫 팁(미오신 필라멘트의 전단을 방지하기 위해)으로 스톡 바이알에서 필요한 양의 재활용 근육 미오신 -II를 피펫팅하고 깨끗한 오토클레이브 PCR 튜브에 추가합니다.
- 즉시 튜브에 1x KMEH를 추가하여 부피를 >20μL로 만들고 부드럽게 혼합합니다. ATP, ATP 재생 믹스, 광 안정화제 등을 추가 할 수도 있습니다. 이 단계 중. 장착된 시료 챔버에서 동일한 부피의 버퍼를 방해하지 않고 조심스럽게 제거합니다.
- 미오신 용액을 샘플 챔버에 부드럽게 추가합니다. 피펫팅은 표면에 묶인 필라멘트를 방해하므로 위아래로 피펫팅하지 마십시오. 즉시 타임 랩스 기록을 재개하고 시스템이 미오신 전 상태에서 ATP 연료 수축성 액토 미오신 흐름으로 진화하고 애 스터 형성이 ATP가 고갈 된 걸린 상태로 진화하는 것을 관찰하십시오 (대표 결과 참조).
- 버퍼 전용 샘플을 사용하여 모든 채널의 배경 이미지를 가져옵니다. 모든 이미지를 16비트 .tiff 파일로 저장합니다. 공통 문제점 해결을 위한 팁은 표 2 를 참조하십시오.

그림 3: 빠른 FRAP 분석을 통한 이중층의 품질 평가. DOPC 및 Ni-NTA 지질(98:2 mol%)로부터 제조된 지지된 지질 이중층(SLB)은 HYE(10xHis-YFP-태그된 막-액틴 링커)로 코팅된다. 결합되지 않은 단백질이 세척된 후, 형광 이중층을 TIRF 현미경으로 이미지화한다. 이중층의 작은 영역은 높은 레이저 출력으로 광표백되고 형광의 회복이 기록됩니다. (A) 양호한 이중층은 항상 빠르게 회복되며,이 경우 사용 된 지질 조성물에 대해 예상되는 확산 계수는 1-1.5 μm2 / s입니다. (B) 나쁜 이중층은 매우 느리게 회복되거나 전혀 회복되지 않습니다. (C) 나쁜 이중층의 대표적인 이미지: (C-i) 구멍이 있는 이중층, (C-ii) 크고 움직이지 않는 지질 패치가 있는 이중층, (C-iii) 작고 움직이지 않는 점이 있는 이중층. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
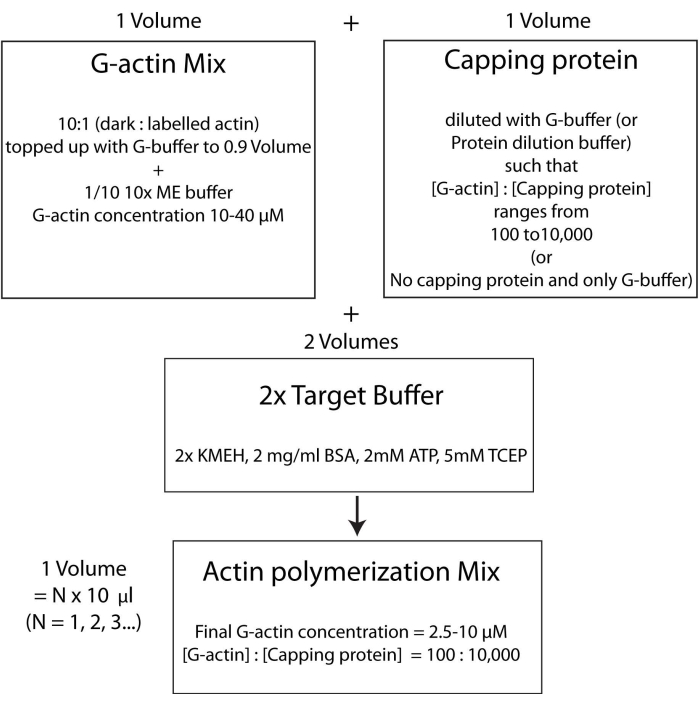
그림 4: 표적 완충 방법을 사용하여 액틴을 중합하는 방법을 보여주는 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: F-액틴에 결합할 때 HYE의 공간적 조직. 액틴 필라멘트 첨가 전후의 HYE의 공간 조직을 보여주는 TIRF 스냅샷(Atto-635 말레이미드로 표지됨). HYE 조직은 F- 액틴을 첨가하기 전에 균질하며 액틴 필라멘트를 따라 공동 국소화되고 공동 정렬됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 데이터 분석
- 피지 소프트웨어(https://imagej.net)를 사용하여, 링커 단백질 이미지로부터 배경을 뺀다(단계 2.4에서). 표백된 지점과 기준 영역에서 평균 강도 값을 측정합니다.
- 표백된 지점과 기준 영역에서 시간 추적을 각각의 사전 표백제 강도 값의 강도로 정규화합니다. 정규화된 표백 영역 값의 각 시점을 정규화된 참조 영역 시간 추적의 각 시점으로 나눕니다. 결과 정규화된 시간 추적을 배경 및 획득 중 강도의 체계적인 변동(전역 광퇴색, z-드리프트 등)에 대해 수정합니다.
- 피팅이 없는 수동 방법(28 )을 사용하여 이중층 테더링된 단백질의 확산 계수를 추정한다. 간단히 말해서, 복구 프로파일의 절반 시간 τ1/2은 정규화된 복구 프로파일이 정상 상태의 절반에 도달하는 시간을 살펴봄으로써 계산될 수 있다: Briefly, the half time of the recovery profile, τ1/2, the time of the normalized recovery profile to the half time to the half time of the normal state of the normal state and the half-the time of the normal state and the half, the time to the average the first when the same state:
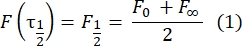
여기서, F0는 광퇴색 후 첫 번째 프레임에서 표백 영역에서의 평균 강도이고, F∞는 이중층의 장기 회복 정상 상태 값이다. - 유효 표백제 반경 re, 광표백 동안 확산을 보정하는 파라미터를 사후 표백제 스팟 프로파일(29)의 라인 스캔으로부터 추정한다. 표백제 스폿의 중심을 통과하는 이 라인-스캔의 절반 최소에서의 절반 너비 r1/2는 다음과 같이 re와 관련된다:
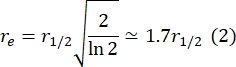
단계 2.8.3.에서 계산된 τ1/2, 단계 2.8.4.에서 계산된 re, 및 원래 설정된 표백제 반경 rn을 사용하여 다음 공식을 사용하여 확산 계수(D)를 계산하는 데 사용됩니다.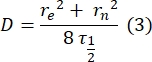
- 피팅이 없는 수동 방법(28 )을 사용하여 이중층 테더링된 단백질의 확산 계수를 추정한다. 간단히 말해서, 복구 프로파일의 절반 시간 τ1/2은 정규화된 복구 프로파일이 정상 상태의 절반에 도달하는 시간을 살펴봄으로써 계산될 수 있다: Briefly, the half time of the recovery profile, τ1/2, the time of the normalized recovery profile to the half time to the half time of the normal state of the normal state and the half-the time of the normal state and the half, the time to the average the first when the same state:
- 액토미오신 과꽃의 이미지 분석
- 피지를 사용하여 모든 채널의 모든 녹화 된 이미지에서 배경을 뺍니다. 플랫 필드 보정을 사용하여 균일하지 않은 조명 또는 간섭 패턴에 대해 이미지를 수정합니다.
알림: 이러한 보정을 수행하기에 좋은 평평한 샘플인 컬러 플라스틱 슬라이드를 사용할 수 있습니다. 평면 이중층의 링커 단백질 및 액틴 필라멘트의 경우 여러 개의 프리 미오신 이미지의 평균 투영을 사용하여 채널별 조명 보정 맵을 만들 수도 있습니다.- 여기에 표시된 HYE 채널의 경우 여러 HYE 이미지의 평균 강도 투영을 취합니다(미오신 첨가 전에 지질 이중층의 다른 영역에서 기록됨). 적절한 가우스 필터(σ = 50픽셀에서 80픽셀)를 평균 투영(미오신 이전 이미지 또는 표준 플랫 샘플)에 적용합니다.
- 필터링된 이미지를 32비트 이미지로 변환합니다. 모든 픽셀 값을 전체 이미지의 평균으로 나눕니다. 이렇게 하면 HYE 채널에 대한 정규화된 보정 맵이 제공됩니다. HYE 채널의 모든 이미지를 이 맵으로 분할하여 플랫 필드 보정을 수행합니다. 동일한 전략을 사용하여 다른 채널에 대한 수정 맵을 만듭니다.
- 피지에서 지수 또는 단순 비율 방법(강도 감쇠 프로파일에 따라 다름)을 사용하여 광퇴색에 대해 수정합니다.
- 시간적 x-y 정렬 불량(병진 이동)을 수정하려면 광표백제로 보정된 모든 채널을 단일 하이퍼스택으로 병합합니다. 피지에서 Hyperstack-Reg 플러그인을 사용하여 강체 또는 변환 변환을 적용합니다.
- 마지막으로 정렬된 하이퍼스택을 개별 채널로 분할하고 추가 분석을 위해 16비트 TIFF 스택으로 별도로 저장합니다.
- 피지를 사용하여 모든 채널의 모든 녹화 된 이미지에서 배경을 뺍니다. 플랫 필드 보정을 사용하여 균일하지 않은 조명 또는 간섭 패턴에 대해 이미지를 수정합니다.
결과
표현을 위해, 여기에 광퇴색 후 1번째 이미지( 도 3A에서 t=0초에서의 이미지)와 다음 기능(28 )에 대한 피팅( 그림 6A 참조)으로부터의 전형적인 표백제 프로파일이 도시된다:

이 곡선에 대한 피팅에 의해 계산된 re(23.94 μm)의 값은 2.8.4단계에서 계산된 re와 매우 유사하다. (23.24 μm). 여기서, K는 F0로부터 직접 추정될 수 있는 표백제 깊이 파라미터이다(단계 2.8.4.에서 설명됨). 유사하게, 도 6B는 다음의 기능(28)에 대한 회복 프로파일 및 그의 적합성을 도시한다: Figure 6b shows the recovery profile and its fit to the following function28:
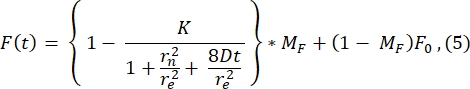
확산 계수의 적합치는 1.34μm2/s이며, 이는 2.8.4단계의 공식으로 계산된 1.39μm2/s 값과 거의 일치하는 값입니다. 여기서, MF는 다시 회복되는 표백된 개체군의 분율을 나타내는 지질 이중층의 이동 분율을 나타낸다. 지질 고정 분자의 이동성은 물론 지질 조성과 물리적 상태 (액체 또는 겔상)에 따라 달라집니다. DOPC 기반 지질 막을 사용한 실험의 경우 이동성은 >1μm2/s여야 하며 이동 분율은 0.9 이상이어야 양호한 지질 이중층을 나타냅니다. 이중층의 품질과 이동성을 빠르게 테스트하기 위해 수동 피팅 프리 방법을 사용하는 것이 좋습니다. 피팅 방법은 많은 FRAP 곡선에 대한 해석을 자동화하는 동안 유용할 수 있습니다. 또한 시스템의 확산을 체계적으로 특성화하기 위해 보다 정교한 FRAP 실험을 수행하려는 경우 독자는 Lorén et al.30의 이 리뷰를 참조하여 피팅 모델 및 실험 설계의 잠재적 함정에 대한 자세한 내용을 확인하는 것이 좋습니다.

그림 6: 지질 이중층의 확산 계수 정량화. (a) 광표백 후 첫 번째 영상의 라인 프로파일( 도 3A에서 t=0s)과 이의 수학식 4에 적합하여 유효 표백제 반경을 계산한다. (b) 표백 영역의 회복 프로파일 및 이의 적합성을 하기 수학식 5로 하여 확산계수 및 이동분율을 계산한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
TIRF 현미경에 의해 이미징된 지지된 지질 이중층 상에서 연결된 액토미오신 네트워크의 동적 조립 및 조직을 보여주는 전술한 실험의 전형적인 결과가 도 7 및 보충 비디오 S1에 묘사되어 있다.
도 7 은 링커 단백질, F-액틴, 및 미오신 II의 이미지 몽타주를 도시한다.
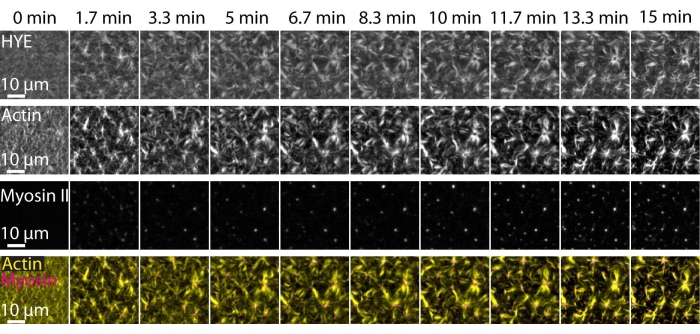
그림 7: 수축성 액토미오신 흐름은 막-액틴 링커 단백질 HYE의 국소 클러스터링을 유도합니다. HYE 및 F- 액틴을 포함하는 SLB에 미오신 II를 첨가했을 때 HYE (YFP 태그), 액틴 필라멘트 (Atto-635 말레이 미드로 표지) 및 미오신 II 필라멘트 (Atto-565 말레이 미드로 표지)의 TIRF 스냅 샷. 시간은 상단에 표시되어 있습니다 : 0 분은 TIRF 필드에 형광 근섬유가 나타나기 시작하기 직전입니다. HYE 및 F-액틴은 미오신 첨가 전에 지질 이중층에 걸쳐 균질하게 분포된다(0분). 미오신 활성은 수축성 액토미오신 흐름을 유도하여 정상 상태(15분)에서 과꽃과 같은 구조로 나타나 결합된 막 성분(HYE)의 국소 클러스터링을 유도합니다. 가장 낮은 행은 액틴(노란색)과 미오신 II(마젠타색) 이미지의 병합으로 서로 다른 시점에서 액틴과 미오신 조직을 보여줍니다. 이 몽타주를 만드는 데 사용 된 이미지는 배경 신호, 불균일 한 강도 패턴 및 병진 이동을 위해 피지에서 수정되었습니다. 스케일 바 = 10 μm. 자세한 내용은 보충 비디오 S1을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 버퍼 이름 | 구성 | |
| 지질 재수 화 완충액 | 50 mM 헤페스, 150 mM NaCl, 5% 자당, pH 7.5 | |
| SLB 형성 버퍼 | 50 mM 헤페스, 150 mM NaCl, pH 5-6 | |
| SLB 스토리지 버퍼 | 50 mM 헤페스, 150 mM NaCl, pH 7.2 | |
| 단백질 희석 완충액 | 20 mM hepes, 100 mM KCl, 1mM TCEP 또는 DTT, pH 7.2 | |
| 1X ME 또는 액틴 이온 교환 완충액 | 50 mM MgCl2, 0.2 mM EGTA, 10 mM hepes, pH 7.2 (4°C에서 보관) | |
| 1X KMEH 또는 액틴 중합 완충액 | 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 50 mM hepes, pH 7.2 | |
| 100 mM ATP 스톡 | 100 mM ATP 이 나트륨 염, 50 mM 트리스, 50 mM NaCl, 5 mM MgCl2, 2 mM EGTA, pH 7.5 (-20 ° C에서 보관) | |
| 2x 타겟 버퍼 | 2x KMEH, 2 밀리그램 / 밀리람베르트 BSA, 2mM ATP, 5밀리미터 TCEP (4°C에서 보관) | |
| G 버퍼 | 2 mM 트리스, 0.1 mM CaCl2, 0.2 mM ATP, 0.5 mM TCEP, 0.04% NaN3, pH 8 (4°C에서 보관) | |
| 미오신 II 완충액 | 500 mM KCl, 1 mM EDTA, 10-20 mM 헤페스, pH 7.0 | |
| 겔 여과 크로마토그래피 버퍼 | 50 mM 트리스-HCl, 150-300 mM NaCl, 5 mM TCEP, 0.1% 트윈-20, pH 7.5 | |
| 캡핑 단백질 저장 버퍼 | 10 mM 트리스· Cl, 50 mM NaCl, 1 mM TCEP, pH 7.5, 20% 글리세롤 | |
표 1: 이 프로토콜에 사용된 완충액 조성물 목록.
| 일반적인 문제 및 문제 해결 | 문제 | 원인 | 가능한 해결책 | ||||||
| 1 | 지질 이중층은 확산을 보이지 않습니다. | 이 문제의 가장 가능성있는 원인은 세척액이 노화되거나 목욕 초음파 처리 중에 가열이 발생하지 않았을 때 발생할 수있는 더러운 커버 글라스입니다. 이 이중층은 파열 된 소포가 커버 글라스에 달라 붙지 만 서로 융합되지 않기 때문에 '소포'모양을 갖습니다. 6 주 이상 된 MLV 또는 6 일 이상 된 SUV를 사용하거나 소량의 SUV를 추가하는 것도 소포 이중층 형성으로 이어질 수 있습니다. | 신선한 세척액을 사용하십시오. 히터가 켜져 있고 온도가 45-65°C 사이인지 확인하십시오. 신선한 지질 혼합물을 사용하십시오. (형광 지질 프로브와 형광 단백질 프로브를 사용하는 것은 때때로 다르게 나타날 수 있습니다. 예를 들어, 이중층에 하위 회절 결함이 있고 표면 패시베이션 단계를 건너 뛰는 경우 (또는 작동하지 않는 경우) 지질 프로브는 균일 한 강도 분포를 나타내지 만 형광 단백질 프로브는 밝은 형광 반점을 표시 할 수 있습니다.) | ||||||
| 2 | 지질 이중층에는 밝은 패치가 있습니다. | 이중층 형성을 위한 SUV의 긴 배양은 전체적으로 확산되지만 때때로 밝은 패치가 있는 지질 이중층을 생성할 수 있습니다. 이러한 패치는 다량의 형광 프로브를 유인할 수 있는 다층 이중층일 수 있습니다. | SUV로 15-20 분 배양하면 충분합니다. 프로브가 응집되지 않는지 확인하십시오: 링커 단백질(4°C에서 15분 동안 300 x g)의 빠른 하드 스핀으로 응집체를 제거할 수 있습니다. | ||||||
| 3 | 지질 이중층에는 어두운 구멍이 있습니다. | 이는 이중층이 오래된 SUV로 만들어지고 장시간 (형성 후 4 시간 >) 동안 이미징되거나 장기간의 이미징으로 인해 용액의 pH가 급격히 변하는 경우 (예 : 높은 ATP 상태 및 특정 산소 제거제가있는 경우) 또는 표면이 베타 카제인으로 과도하게 부동태화 된 경우 (10-15 분 이상 베타 카제인을 너무 많이 첨가하거나 씻어 내지 않을 때). | 신선한 지질을 사용하십시오. 이미징 프레임 속도 또는 유효 레이저 조명 시간을 줄입니다. 버퍼링 용량이 더 높은 버퍼를 사용합니다. | ||||||
| 4 | 지질 이중층은 느린 확산을 보여줍니다 | 콜레스테롤 비율이 높은 지질 이중층, 긴 포화 지질 또는 하전 된 지질은 느리게 확산됩니다. | 이러한 경우 고온에서 샘플을 준비하십시오. 또한 단순하고 시험된 지질 조성물을 복잡하고 시험되지 않은 지질 조성물과 함께 대조군으로 사용할 수 있다. 유리가 깨끗한 지 확인하십시오. | ||||||
| 5 | 액틴은 중합하지 않습니다 | 표적 완충액은 오래되었고, G-액틴 스톡은 너무 오래되었고, 오래된 G-액틴과 새로운 G-액틴은 공동 중합되었다. | 중합 전에 Ca2+가Mg2+로 대체되었는지 확인하십시오(ME 완충액 사용). 신선한 ATP-Mg2+ 스톡을 사용하십시오. 갓 재활용한 G-액틴을 사용하십시오. 이중층에 첨가 된 F- 액틴 (G- 액틴 기준)의 농도가 0.2 μM보다 높은지 확인하십시오. 농도가 낮 으면 팔로이딘 안정화 F- 액틴을 사용하십시오. | ||||||
| 6 | 액틴은 이중층에 결합하지 않습니다. | 막-액틴 링커는 첨가되거나 매우 낮은 농도로 첨가되지 않으며, 이는 링커 단백질의 형광을 형성한다고 추론할 수 있다. 형광이 적당하다면, 막 - 액틴 링커는 액틴 결합 능력을 상실한 것입니다. 또한 링커 단백질이 유리 표면에 비특이적으로 결합되어 있는 경우(이중층이 나쁜 경우) 액틴 필라멘트를 모집하지 않을 수 있습니다. | 이중층이 확산되고 있는지 확인하십시오. 신선한 링커 단백질 사용 | ||||||
| 7 | 형광 F- 액틴 신호가 약합니다. | 표지 된 액틴과 다크 액틴의 비율이 너무 낮습니다. 표지 된 액틴 또는 표지되지 않은 액틴은 너무 오래되어 서로 공중 합체되지 않습니다. | 액틴을 다시 재활용하고 새로 재활용된 액틴으로 계략화를 다시 시도하십시오. 광 손상은 F- 액틴을 파괴하거나 해중합시킬 수 있습니다. 가능하면 액틴 (및 미오신)에 적색 또는 원적색 염료를 사용하십시오. | ||||||
| 8 | 미오신은 수축성을 나타내지 않습니다. | 미오신 주입 시스템에 ATP를 첨가 한 후에는 액토 - 미오신의 수축성이 없음을 관찰 할 수 있습니다. | 미오신 농도 또는 순도 수준이 좋은지 확인하십시오. 새로 재활용 된 미오신 (재활용 후 6 주 이내에 사용)을 사용하십시오. 미오신 혼합물에 신선한 ATP를 추가하면 도움이 될 수 있습니다. 완충액 탈기 및 산소 제거제 사용 등 모터의 광 손상을 줄일 수 있습니다. 추가 정보는 동일한 방법 모음의 Plastino et al. 또는 Stam et al.의 프로토콜에서 찾을 수 있습니다. | ||||||
| 9 | 커버 글라스는 친수성이 아닙니다. | 커버 글라스가 제대로 청소되지 않았습니다. | 깨끗한 친수성 커버 글라스는 지질 이중층 형성에 중요합니다. 세척 프로토콜 후 커버 글라스의 친수성에 대한 유용하고 시각적 인 판독은 물에 의한 유리의 습윤을 관찰하는 것입니다. 평평한 커버 슬립에 소량의 물을 추가하십시오. 커버 슬립을 제대로 청소하지 않으면 물이 둥근 물방울 모양으로 유지됩니다. 그러나 동일한 양의 물이 퍼져 처리 된 친수성 커버 글라스 위에 얇은 층을 형성합니다. 커버 유리 표면에 있는 물의 이러한 습윤 거동은 세척액/NaOH를 사용한 세척 단계가 효과가 있는지 확인하는 데 사용할 수 있습니다. | ||||||
표 2: 일반적인 문제와 해당 해결 방법을 요약한 문제 해결 가이드입니다.
보충 비디오 S1: 수축성 액토미오신 흐름은 막-액틴 링커 단백질 HYE의 국소 클러스터링을 유도합니다. HYE 및 F-액틴을 포함하는 SLB에 미오신 II를 첨가할 때 HYE(YFP-태그), 액틴 필라멘트(Atto-635 말레이미드로 표지됨) 및 미오신 II 필라멘트(Atto-565 말레이미드로 표지됨)의 TIRF 타임랩스. 시간은 상단에 표시되어 있습니다 : 0 분은 TIRF 필드에 형광 근섬유가 나타나기 시작하기 직전입니다. 스케일 바 = 10 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 세포의 막-피질 인터페이스를 연구하기 위한 실험을 설계하기 위한 다목적 플랫폼과 출발점을 제공합니다. 중요한 단계는 깨끗한 유리 슬라이드를 준비하고, 효율적인 SUV 형성을 위해 신선한 지질을 사용하고(둘 다 SLB의 품질에 영향을 미침), 동적 액틴 필라멘트 재구성을 위해 새로 재활용된 미오신 II 단백질을 사용하는 것입니다. 장기간에 걸친 이미징 역학을 수행할 때 산소 제거제 시스템(예: 프로토카테추산 및 프로토카테추에이트 3 4-디옥시게나제 5,31)을 통합하는 것이 매우 중요합니다.
개방형 챔버 설계는 지질 흐름을 유도하지 않고 기존 시스템에 구성 요소를 순차적으로 추가할 수 있습니다. 이는 일반적으로 사용되는 폐쇄 챔버 접근법 또는 리포솜(36) 내에서 캡슐화된 단백질을 사용하는 작업에 비해 중요한 이점이 될 수 있다. 단백질 유도 막 변형과 같은 반대 효과는 유리 흡착 지질 이중층으로 연구 할 수 없습니다.
지질 이중층은 광범위한 지질 조성물로 형성될 수 있다. 그것은 친수성 유리 표면에 대한 지질 소포의 흡착으로 시작하여 표면-소포 및 직접 소포-소포 상호 작용으로 인한 자발적인 소포 파열 또는 흡착 된 소포가 임계 범위에 도달 한 후 소포의 작은 부분이 파열되어 활성 가장자리를 형성하여 결국 이중층 형성으로 이어진다32 . 유리 외에, 다양한 기판이 지지된 지질 이중층을 형성하는데 사용될 수 있으며, 예를 들어, 운모 (예를 들어, 원자력 현미경을 위해), 연질 기판 (예를 들어, 폴리-디메틸-실록산), 중합체 쿠션(33,34,35), 전자 현미경 그리드 (14)의 구멍 사이에 걸쳐있다. 액적 계면 이중층은 안정하고 독립된 지질 이중층(36)을 생성하는 또 다른 흥미로운 방법이다. 소포 또는 에멀젼 내로의 액토-미오신 네트워크의 포함은 세포-유사 기하학적 37, 38에서 이러한 최소 시스템을 연구하는 매우 강력한 방법이며, 이는 다른 곳(39)에서 상세히 기재되어 있다.
공개
저자는 선언 할 이해 상충이 없습니다.
감사의 말
이 연구는 AXA 연구 기금과 DVK의 경우 Warwick-Wellcome Quantitative Biomedicine Program (Wellcome ISSF, RMRCB0058), AB 및 ST의 경우 NCBS-TIFR, SM의 경우 Wellcome-DBT Margdarshi 펠로우십 (IA / M / 15 / 1 / 502018)의 지원을 받았습니다. DVK는 또한 가상 네트워킹 이벤트 "분자에서 중간 규모에 이르는 다중 성분 세포 골격 네트워크 이해의 과제"를 가능하게 한 생물 물리학 학회에 감사드립니다. 이 프로토콜 컬렉션의 생성에 기여했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
참고문헌
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671(2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948(2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615(2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116(2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695(2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123(2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350(2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30(2018).
- JoVE, JoVE. JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428(2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412(2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236(2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332(2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유